Окислители и восстановители Лекция 18 по курсу












18_Окислители и восстановители.ppt
- Количество слайдов: 15
 Окислители и восстановители Лекция 18 по курсу «Общая химия»
Окислители и восстановители Лекция 18 по курсу «Общая химия»
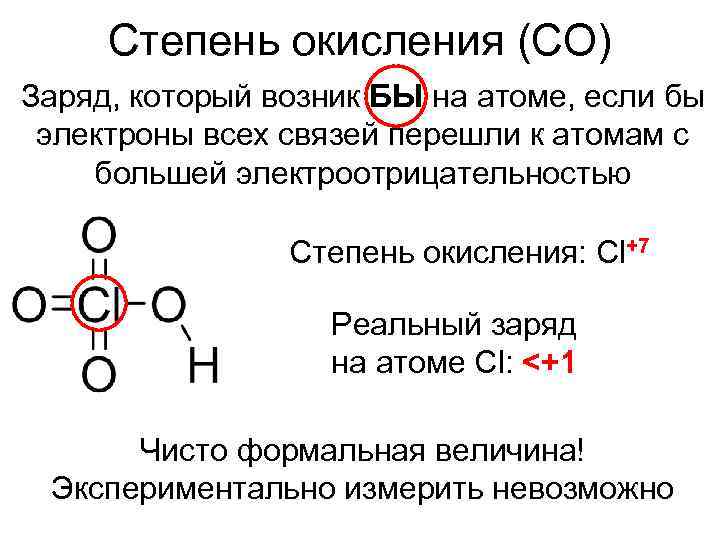
 Степень окисления (СО) Заряд, который возник БЫ на атоме, если бы электроны всех связей перешли к атомам с большей электроотрицательностью Степень окисления: Cl+7 Реальный заряд на атоме Cl: <+1 Чисто формальная величина! Экспериментально измерить невозможно
Степень окисления (СО) Заряд, который возник БЫ на атоме, если бы электроны всех связей перешли к атомам с большей электроотрицательностью Степень окисления: Cl+7 Реальный заряд на атоме Cl: <+1 Чисто формальная величина! Экспериментально измерить невозможно
 Определение СО по молекулярной формуле Ø Кислород – почти всегда – 2 (ИСКЛЮЧЕНИЯ: пероксиды (– 1), надперо- ксиды, озониды, фториды кислорода) Ø Водород – чаще всего +1 (ИСКЛЮЧЕНИЯ: гидриды металлов и бора) Ø Галогены – в основном – 1 (кроме кислородсодержащих кислот, их солей, интергалогенных соединений) Ø Металлы – только положительная или 0 В трудных случаях – по структурной формуле!
Определение СО по молекулярной формуле Ø Кислород – почти всегда – 2 (ИСКЛЮЧЕНИЯ: пероксиды (– 1), надперо- ксиды, озониды, фториды кислорода) Ø Водород – чаще всего +1 (ИСКЛЮЧЕНИЯ: гидриды металлов и бора) Ø Галогены – в основном – 1 (кроме кислородсодержащих кислот, их солей, интергалогенных соединений) Ø Металлы – только положительная или 0 В трудных случаях – по структурной формуле!
 Определение СО по структуре 1. Написать структурную формулу 2. Сравнить ЭО атомов 3. Каждая связь с >ЭО атомом: +1 4. Каждая связь с <ЭО атомом: – 1 5. Каждая связь с таким же атомом: 0 6. Если донорно-акцепторная: дополнительно +1 донору, – 1 акцептору +1 3. 50 -2 2. 20 -2 +4 -2 3. 50 +1 -2 2. 44 +50 O>S>H 2. 20 +1 -2 2. 44 3. 50
Определение СО по структуре 1. Написать структурную формулу 2. Сравнить ЭО атомов 3. Каждая связь с >ЭО атомом: +1 4. Каждая связь с <ЭО атомом: – 1 5. Каждая связь с таким же атомом: 0 6. Если донорно-акцепторная: дополнительно +1 донору, – 1 акцептору +1 3. 50 -2 2. 20 -2 +4 -2 3. 50 +1 -2 2. 44 +50 O>S>H 2. 20 +1 -2 2. 44 3. 50
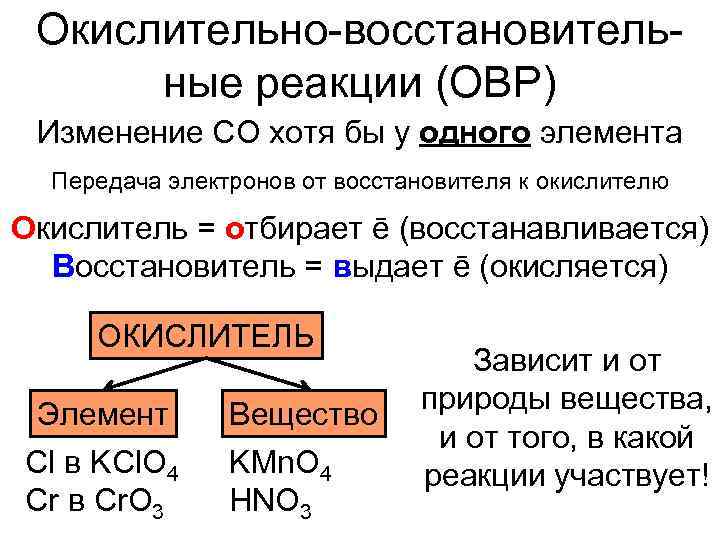
 Окислительно-восстановитель- ные реакции (ОВР) Изменение СО хотя бы у одного элемента Передача электронов от восстановителя к окислителю Окислитель = отбирает ē (восстанавливается) Восстановитель = выдает ē (окисляется) ОКИСЛИТЕЛЬ Зависит и от Элемент Вещество природы вещества, и от того, в какой Cl в KCl. O 4 KMn. O 4 реакции участвует! Cr в Cr. O 3 HNO 3
Окислительно-восстановитель- ные реакции (ОВР) Изменение СО хотя бы у одного элемента Передача электронов от восстановителя к окислителю Окислитель = отбирает ē (восстанавливается) Восстановитель = выдает ē (окисляется) ОКИСЛИТЕЛЬ Зависит и от Элемент Вещество природы вещества, и от того, в какой Cl в KCl. O 4 KMn. O 4 реакции участвует! Cr в Cr. O 3 HNO 3
 Окислители и восстановители Только Простые вещества-металлы (Li, Zn, Mg, Fe, Al…) восстановители Неметаллы в соединениях с H и металлами (S в H 2 S и (А) Na 2 S, P в Mg 3 P 2) Водород в гидридах (Li. H, B 2 H 6, Na. BH 4) Преимущественно H 2 (молекулярный) и H (атомарный) восстановители Металлы в низших степенях окисления (Cr(II), Mn(II), (Б) Fe(II), Ti(III)…) Простые вещества-неметаллы низкой ЭО (B, С, P…) Двойственные (В) Промежуточные степени окисления d-металлов и некоторых неметаллов (SO 2; NO, N 2 O, Cr(III), Fe(III), Mn(III, IV)…) Преимущественно Галогены и гипогалогениты (Cl 2, Br 2, KOCl, Ca(OCl)Cl) окислители (Г) Нитриты, HNO 2, NO 2; H 2 O 2 и пероксиды. Элементы в «почти высшей» степени окисления (Mn(VI), Cl(V)). Кислород O 2 Только окислители F 2, все элементы в высшей степени окисления (Д)
Окислители и восстановители Только Простые вещества-металлы (Li, Zn, Mg, Fe, Al…) восстановители Неметаллы в соединениях с H и металлами (S в H 2 S и (А) Na 2 S, P в Mg 3 P 2) Водород в гидридах (Li. H, B 2 H 6, Na. BH 4) Преимущественно H 2 (молекулярный) и H (атомарный) восстановители Металлы в низших степенях окисления (Cr(II), Mn(II), (Б) Fe(II), Ti(III)…) Простые вещества-неметаллы низкой ЭО (B, С, P…) Двойственные (В) Промежуточные степени окисления d-металлов и некоторых неметаллов (SO 2; NO, N 2 O, Cr(III), Fe(III), Mn(III, IV)…) Преимущественно Галогены и гипогалогениты (Cl 2, Br 2, KOCl, Ca(OCl)Cl) окислители (Г) Нитриты, HNO 2, NO 2; H 2 O 2 и пероксиды. Элементы в «почти высшей» степени окисления (Mn(VI), Cl(V)). Кислород O 2 Только окислители F 2, все элементы в высшей степени окисления (Д)
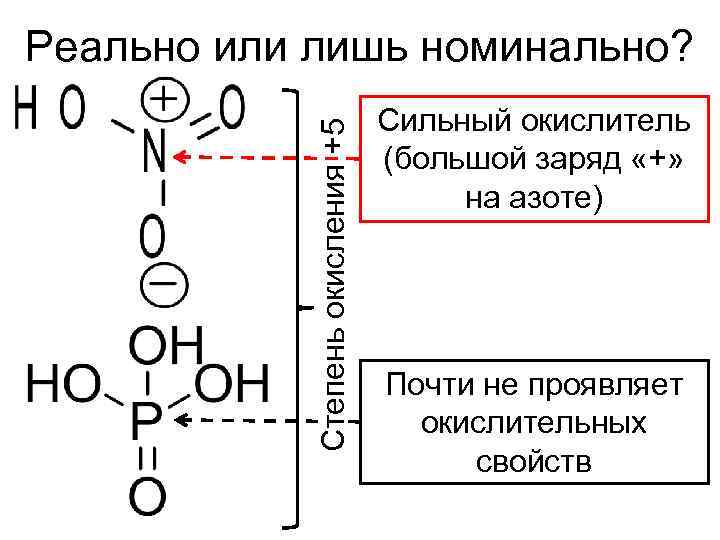
 Реально или лишь номинально? Сильный окислитель Степень окисления +5 (большой заряд «+» на азоте) Почти не проявляет окислительных свойств
Реально или лишь номинально? Сильный окислитель Степень окисления +5 (большой заряд «+» на азоте) Почти не проявляет окислительных свойств
 Классификация ОВР • «Межмолекулярные» (О. и В. в составе разных веществ): 2 KI + Br 2 = 2 KBr + I 2 (1) • «Внутримолекулярные» (О. и В. в составе одного и того же вещества): NH 4 NO 3 = N 2 O + 2 H 2 O (2) • Диспропорционирования (О. и В. – один и тот же элемент в одной и той же степени окисления в одном веществе: Cl–Cl + KOH = KCl– 1 + KOCl+1 (3) Пример (2) – не диспропорционирование!
Классификация ОВР • «Межмолекулярные» (О. и В. в составе разных веществ): 2 KI + Br 2 = 2 KBr + I 2 (1) • «Внутримолекулярные» (О. и В. в составе одного и того же вещества): NH 4 NO 3 = N 2 O + 2 H 2 O (2) • Диспропорционирования (О. и В. – один и тот же элемент в одной и той же степени окисления в одном веществе: Cl–Cl + KOH = KCl– 1 + KOCl+1 (3) Пример (2) – не диспропорционирование!
 Предсказание направления и результата ОВР На качественном уровне (количественно – см. следующую лекцию) • Принадлежность к группам А–Д (см. табл. ) • Устойчивость степеней окисления (ориентир – природные соединения) • Восстановление тем глубже, чем сильнее восстановитель, окисление – аналогично +1 +7 -2 +1 +4 -2 KMn. O 4 + K 2 SO 3 = ? Mn+7 – группа Д (только окислители) S+4 – группа В (двойственные)
Предсказание направления и результата ОВР На качественном уровне (количественно – см. следующую лекцию) • Принадлежность к группам А–Д (см. табл. ) • Устойчивость степеней окисления (ориентир – природные соединения) • Восстановление тем глубже, чем сильнее восстановитель, окисление – аналогично +1 +7 -2 +1 +4 -2 KMn. O 4 + K 2 SO 3 = ? Mn+7 – группа Д (только окислители) S+4 – группа В (двойственные)
 Метод электронного баланса 1) Степени окисления всех элементов 2) У кого меняется (О. и В. ) 3) Электронный баланс 4) Коэффициенты перед О. и В. 5) Уравнять прочие элементы (кроме Н, О) 6) Уравнять водород 7) Проверка по кислороду K+1 Mn+7 O 4– 2 + K 4 +1 S+42 SO 3+ HH 2 SO 4 2 KMn. O 2 + 5 K O 3– 2 + 3 2+1 S+6 O 4– 2 Mn+2 S+6 O 4– 2 + K 2+1 S 6 K 2 SO 4 + 2+1 O– 2 2 Mn. SO 4 + +6 O 4– 2 + H 3 H 2 O Mn+7 + 5 e = Mn 2+ 5 2 S+4 – 2 e = S+6 10 2 5
Метод электронного баланса 1) Степени окисления всех элементов 2) У кого меняется (О. и В. ) 3) Электронный баланс 4) Коэффициенты перед О. и В. 5) Уравнять прочие элементы (кроме Н, О) 6) Уравнять водород 7) Проверка по кислороду K+1 Mn+7 O 4– 2 + K 4 +1 S+42 SO 3+ HH 2 SO 4 2 KMn. O 2 + 5 K O 3– 2 + 3 2+1 S+6 O 4– 2 Mn+2 S+6 O 4– 2 + K 2+1 S 6 K 2 SO 4 + 2+1 O– 2 2 Mn. SO 4 + +6 O 4– 2 + H 3 H 2 O Mn+7 + 5 e = Mn 2+ 5 2 S+4 – 2 e = S+6 10 2 5
 Метод электронного баланса: проблемы • Требует использования формальной СО • Плохо пригоден для реакций, в которых СО меняется у нескольких элементов сразу (например, окисление органики) • Требует знания всех продуктов реакции, которые иногда трудно предсказать + H 2 O? + Fe(NOH)2 O? + H 2 SO 4 ? + 33 Fe. SO 4 + HNO 3 Fe 2(SO 4)3 + NO ? ? ?
Метод электронного баланса: проблемы • Требует использования формальной СО • Плохо пригоден для реакций, в которых СО меняется у нескольких элементов сразу (например, окисление органики) • Требует знания всех продуктов реакции, которые иногда трудно предсказать + H 2 O? + Fe(NOH)2 O? + H 2 SO 4 ? + 33 Fe. SO 4 + HNO 3 Fe 2(SO 4)3 + NO ? ? ?
 Метод полуреакций • Записываем исходные вещества и продукты; • Определяем окислитель и восстановитель; • Составляем в ионной форме схемы полуреакций: – восстановление окислителя; – окисление восстановителя; • Дальнейшие действия зависят от того, в какой среде идет процесс Fe. SO 4 + HNO 3 Fe 2(SO 4)3 + NO Fe 2+ Fe 3+ NO 3– NO
Метод полуреакций • Записываем исходные вещества и продукты; • Определяем окислитель и восстановитель; • Составляем в ионной форме схемы полуреакций: – восстановление окислителя; – окисление восстановителя; • Дальнейшие действия зависят от того, в какой среде идет процесс Fe. SO 4 + HNO 3 Fe 2(SO 4)3 + NO Fe 2+ Fe 3+ NO 3– NO
 Метод полуреакций (продолжение) А. Среда кислая • Уравниваем по атомам: дописываем в левой и правой части либо H+, либо H 2 O; • Уравниваем по заряду: дописываем нужное количество электронов; • Находим дополнительные множители; • Складываем полуреакции с учетом множителей Fe. SO 4 + HNO 3 Fe 2(SO 4)3 + NO Fe 2+ – 1 e Fe 3+ 1 3 3 NO 3– +4 H+ +3 e NO +2 H 2 O 3 1 3 Fe 2+ + NO 3– + 4 H+ 3 Fe 3+ + NO + 2 H 2 O
Метод полуреакций (продолжение) А. Среда кислая • Уравниваем по атомам: дописываем в левой и правой части либо H+, либо H 2 O; • Уравниваем по заряду: дописываем нужное количество электронов; • Находим дополнительные множители; • Складываем полуреакции с учетом множителей Fe. SO 4 + HNO 3 Fe 2(SO 4)3 + NO Fe 2+ – 1 e Fe 3+ 1 3 3 NO 3– +4 H+ +3 e NO +2 H 2 O 3 1 3 Fe 2+ + NO 3– + 4 H+ 3 Fe 3+ + NO + 2 H 2 O
 Метод полуреакций (окончание) • Превращаем сокращенное ионное уравнение в полное, дописывая ионы, не принимающие участие в реакции; • Превращаем ионное уравнение в “молекулярное”, объединив соответствующие ионы; • Для щелочной среды – то же самое, только дописывать можно OH– и H 2 O 3 Fe 2+ + NO 3– + 4 H+ +3 SO 42– +3 NO 3– 3 Fe 3+ + NO + 2 H 2 O +3 SO 42– +3 NO 3– 3 Fe. SO 4 + 4 HNO 3 = = Fe 2(SO 4)3 + Fe(NO 3)3 + NO + 2 H 2 O
Метод полуреакций (окончание) • Превращаем сокращенное ионное уравнение в полное, дописывая ионы, не принимающие участие в реакции; • Превращаем ионное уравнение в “молекулярное”, объединив соответствующие ионы; • Для щелочной среды – то же самое, только дописывать можно OH– и H 2 O 3 Fe 2+ + NO 3– + 4 H+ +3 SO 42– +3 NO 3– 3 Fe 3+ + NO + 2 H 2 O +3 SO 42– +3 NO 3– 3 Fe. SO 4 + 4 HNO 3 = = Fe 2(SO 4)3 + Fe(NO 3)3 + NO + 2 H 2 O
 Преимущества метода полуреакций • Можно записать уравнение, не зная всех продуктов; • Работает даже тогда, когда СО нельзя определить; • Количественная информация по ОВР (окислительно-восстановительные потенциалы) в справочниках сгруппирована именно по полуреакциям А подробнее – на следующей лекции!
Преимущества метода полуреакций • Можно записать уравнение, не зная всех продуктов; • Работает даже тогда, когда СО нельзя определить; • Количественная информация по ОВР (окислительно-восстановительные потенциалы) в справочниках сгруппирована именно по полуреакциям А подробнее – на следующей лекции!
