Нормативно-правовое регулирование обращения лекарственных средств в Российской Федерации


















































1_lekciya_norm_regulirovanie_obrascheniya_ls.pptx
- Размер: 1.3 Мб
- Автор:
- Количество слайдов: 51
Описание презентации Нормативно-правовое регулирование обращения лекарственных средств в Российской Федерации по слайдам
 Нормативно-правовое регулирование обращения лекарственных средств в Российской Федерации Лекция для студентов ФВСО
Нормативно-правовое регулирование обращения лекарственных средств в Российской Федерации Лекция для студентов ФВСО
 ПЕРЕЧЕНЬ ОСНОВНЫХ ЗАКОНОДАТЕЛЬНЫХ АКТОВ Федеральный закон от 21 ноября 2011 г. № 323 -ФЗ «Основы охраны здоровья граждан в Российской Федерации» . Федеральный закон от 12 апреля 2010 г. № 61 -ФЗ «Об обращении лекарственных средств» . Федеральный закон от 27 декабря 2002 г. № 184 -ФЗ (в актуальной редакции). Федеральный закон от 29 июня 2015 г. № 162 -ФЗ «О стандартизации в Российской Федерации» .
ПЕРЕЧЕНЬ ОСНОВНЫХ ЗАКОНОДАТЕЛЬНЫХ АКТОВ Федеральный закон от 21 ноября 2011 г. № 323 -ФЗ «Основы охраны здоровья граждан в Российской Федерации» . Федеральный закон от 12 апреля 2010 г. № 61 -ФЗ «Об обращении лекарственных средств» . Федеральный закон от 27 декабря 2002 г. № 184 -ФЗ (в актуальной редакции). Федеральный закон от 29 июня 2015 г. № 162 -ФЗ «О стандартизации в Российской Федерации» .
 ПЕРЕЧЕНЬ ОСНОВНЫХ ЗАКОНОДАТЕЛЬНЫХ АКТОВ Закон РФ от 07 февраля 1992 г. № 2300 -1 «О защите прав потребителей» (в актуальной редакции). Федеральный закон от 16 декабря 2008 г. № 294 -ФЗ «О защите прав юридических лиц и индивидуальных предпринимателей при осуществлении государственного контроля (надзора) и муниципального контроля» . Федеральный закон от 4 мая 2011 г. № 99 — ФЗ «О лицензировании отдельных видов деятельности» .
ПЕРЕЧЕНЬ ОСНОВНЫХ ЗАКОНОДАТЕЛЬНЫХ АКТОВ Закон РФ от 07 февраля 1992 г. № 2300 -1 «О защите прав потребителей» (в актуальной редакции). Федеральный закон от 16 декабря 2008 г. № 294 -ФЗ «О защите прав юридических лиц и индивидуальных предпринимателей при осуществлении государственного контроля (надзора) и муниципального контроля» . Федеральный закон от 4 мая 2011 г. № 99 — ФЗ «О лицензировании отдельных видов деятельности» .
 На территории России главную роль в процессе подготовки и издания нормативно-правовых актов, регламентирующих безопасное обращение лекарственных средств, играют: Министерство здравоохранения РФ (Минздрав); Росздравнадзор; Федеральная антимонопольная служба (ФАС); Министерство промышленности и торговли РФ. Основным регулятором в сфере обращения ЛС выступает Министерство здравоохранения РФ, в нем: Департамент государственного регулирования обращения лекарственных средств, Департамент лекарственного обеспечения и регулирования обращения медицинских изделий.
На территории России главную роль в процессе подготовки и издания нормативно-правовых актов, регламентирующих безопасное обращение лекарственных средств, играют: Министерство здравоохранения РФ (Минздрав); Росздравнадзор; Федеральная антимонопольная служба (ФАС); Министерство промышленности и торговли РФ. Основным регулятором в сфере обращения ЛС выступает Министерство здравоохранения РФ, в нем: Департамент государственного регулирования обращения лекарственных средств, Департамент лекарственного обеспечения и регулирования обращения медицинских изделий.
 БАЗОВЫЕ ВОПРОСЫ ЗАКОНОДАТЕЛЬСТВА ОБ ОБРАЩЕНИИ ЛС Сфера применения закона. Ключевые термины и понятия законодательства РФ о ЛС Обращение ЛС (как глобальный процесс). Фармацевтическая деятельность (как практическая деятельность аптечных, медицинских и др. организаций). Государственный контроль обращения ЛС и их качества Регистрация ЛС, клинические исследования , экспертиза ЛС. Вопросы допуска физических лиц к осуществлению ФД. Регулирование оптовой торговли ЛС. Регулирование розничной торговли ЛС. Государственное регулирование ценообразования на ЛС Мониторинг безопасности и фармаконадзор и другие.
БАЗОВЫЕ ВОПРОСЫ ЗАКОНОДАТЕЛЬСТВА ОБ ОБРАЩЕНИИ ЛС Сфера применения закона. Ключевые термины и понятия законодательства РФ о ЛС Обращение ЛС (как глобальный процесс). Фармацевтическая деятельность (как практическая деятельность аптечных, медицинских и др. организаций). Государственный контроль обращения ЛС и их качества Регистрация ЛС, клинические исследования , экспертиза ЛС. Вопросы допуска физических лиц к осуществлению ФД. Регулирование оптовой торговли ЛС. Регулирование розничной торговли ЛС. Государственное регулирование ценообразования на ЛС Мониторинг безопасности и фармаконадзор и другие.
 6 разработка ЛС, доклинические исследования, экспертиза, государственная регистрация, стандартизация и контроль качества ЛС, производство ЛП, изготовление, хранение, перевозка, ввоз в РФ и вывоз из РФ, реклама, отпуск, реализация , передача, применение, уничтожение ЛС оптовая торговля ЛС, хранение , перевозка и (или) розничная торговля ЛП, отпуск , хранение , перевозка , изготовление ЛПОбращение лекарственных средств Фармацевтическая деятельность
6 разработка ЛС, доклинические исследования, экспертиза, государственная регистрация, стандартизация и контроль качества ЛС, производство ЛП, изготовление, хранение, перевозка, ввоз в РФ и вывоз из РФ, реклама, отпуск, реализация , передача, применение, уничтожение ЛС оптовая торговля ЛС, хранение , перевозка и (или) розничная торговля ЛП, отпуск , хранение , перевозка , изготовление ЛПОбращение лекарственных средств Фармацевтическая деятельность
 КАКИЕ ПРИНЦИПИАЛЬНЫЕ ЗАДАЧИ РЕШАЕТ НОРМАТИВНО-ПРАВОВОЕ РЕГУЛИРОВАНИЕ ОБРАЩЕНИЯ ЛЕКАРСТВЕННЫХ СРЕДСТВ В НАСТОЯЩЕЕ ВРЕМЯ ? Проблема унификации терминологии и гармонизации российских правовых норм с международными стандартами, прежде всего, в направлении понятийного аппарата в сфере обращения лекарственных средств (ЕАЭС). Расширение полномочий государственных органов в сфере надзора и контроля деятельности участников фармацевтического рынка. Разработка новых и изменение существующих подзаконных актов, административных регламентов и инструкций , касающихся процедур государственной регистрации лекарственных средств.
КАКИЕ ПРИНЦИПИАЛЬНЫЕ ЗАДАЧИ РЕШАЕТ НОРМАТИВНО-ПРАВОВОЕ РЕГУЛИРОВАНИЕ ОБРАЩЕНИЯ ЛЕКАРСТВЕННЫХ СРЕДСТВ В НАСТОЯЩЕЕ ВРЕМЯ ? Проблема унификации терминологии и гармонизации российских правовых норм с международными стандартами, прежде всего, в направлении понятийного аппарата в сфере обращения лекарственных средств (ЕАЭС). Расширение полномочий государственных органов в сфере надзора и контроля деятельности участников фармацевтического рынка. Разработка новых и изменение существующих подзаконных актов, административных регламентов и инструкций , касающихся процедур государственной регистрации лекарственных средств.
 Организация проведения комплексной оценки (экспертизы) для включения лекарственных средств в ограничительные Перечни ЖНВЛП. Изменения механизма определения предельных цен на ЖНВЛП (с включением референтного ценообразования). Совершенствование существующей системы мониторинга безопасности лекарственных препаратов ( Фармаконадзор ). Адаптация международных систем надлежащих практик (GDP, GSP, GPP и др. ) с последующим внедрением их всеми субъектами, осуществляющими деятельность в сфере обращения ЛС в РФ и странах ЕАЭС. Разработка новых стандартов в сфере практической фармацевтической деятельности, в т. ч. Профессиональных стандартов специалистов.
Организация проведения комплексной оценки (экспертизы) для включения лекарственных средств в ограничительные Перечни ЖНВЛП. Изменения механизма определения предельных цен на ЖНВЛП (с включением референтного ценообразования). Совершенствование существующей системы мониторинга безопасности лекарственных препаратов ( Фармаконадзор ). Адаптация международных систем надлежащих практик (GDP, GSP, GPP и др. ) с последующим внедрением их всеми субъектами, осуществляющими деятельность в сфере обращения ЛС в РФ и странах ЕАЭС. Разработка новых стандартов в сфере практической фармацевтической деятельности, в т. ч. Профессиональных стандартов специалистов.
 НОВЫЕ ПОЛНОМОЧИЯ ФЕДЕРАЛЬНЫХ ОРГАНОВ ИСПОЛНИТЕЛЬНОЙ ВЛАСТИ В СФЕРЕ ОБРАЩЕНИЯ ЛС Утверждение правил надлежащих практик : лабораторной (GLP), клинической (GCP), производственной (GMP), дистрибьюторской GDP), аптечной (GPP), практики хранения и перевозки лекарственных препаратов (GSP), практики фармаконадзора. Определение порядка выбора торгового наименования ЛП. Утверждение перечня наименований лекарственных форм. Проведение комплексной оценки ЛП. Утверждение требований к инструкциям по медицинскому применению для ЛП и формирование реестра типовых инструкций для взаимозаменяемых лекарственных препаратов.
НОВЫЕ ПОЛНОМОЧИЯ ФЕДЕРАЛЬНЫХ ОРГАНОВ ИСПОЛНИТЕЛЬНОЙ ВЛАСТИ В СФЕРЕ ОБРАЩЕНИЯ ЛС Утверждение правил надлежащих практик : лабораторной (GLP), клинической (GCP), производственной (GMP), дистрибьюторской GDP), аптечной (GPP), практики хранения и перевозки лекарственных препаратов (GSP), практики фармаконадзора. Определение порядка выбора торгового наименования ЛП. Утверждение перечня наименований лекарственных форм. Проведение комплексной оценки ЛП. Утверждение требований к инструкциям по медицинскому применению для ЛП и формирование реестра типовых инструкций для взаимозаменяемых лекарственных препаратов.
 ПОЛНОМОЧИЯ ОРГАНОВ ИСПОЛНИТЕЛЬНОЙ ВЛАСТИ СУБЪЕКТОВ РОССИИ В СФЕРЕ ОБРАЩЕНИЯ ЛС разработка и проведение региональных программ с целью обеспечения населения регионов необходимыми препаратами; определение региональных предельных величин торговых надбавок к отпускным ценам производителя при оптовой или розничной торговле лекарствами из списка ЖНВЛП; контроль за ценами на ЛС из группы ЖНВЛП на региональном уровне.
ПОЛНОМОЧИЯ ОРГАНОВ ИСПОЛНИТЕЛЬНОЙ ВЛАСТИ СУБЪЕКТОВ РОССИИ В СФЕРЕ ОБРАЩЕНИЯ ЛС разработка и проведение региональных программ с целью обеспечения населения регионов необходимыми препаратами; определение региональных предельных величин торговых надбавок к отпускным ценам производителя при оптовой или розничной торговле лекарствами из списка ЖНВЛП; контроль за ценами на ЛС из группы ЖНВЛП на региональном уровне.
 Государственное регулирование обращения лекарственных средств должно постоянно совершенствоваться. Это связано с развитием фармацевтической науки и производства, с появлением инноваций в клинической медицине и здравоохранении в целом, с непрерывно изменяющимися условиями функционирования внутреннего и мирового фармацевтического рынка. Соответственно, изменений требуют ключевые системные компоненты законодательной базы об обращении лекарственных средств.
Государственное регулирование обращения лекарственных средств должно постоянно совершенствоваться. Это связано с развитием фармацевтической науки и производства, с появлением инноваций в клинической медицине и здравоохранении в целом, с непрерывно изменяющимися условиями функционирования внутреннего и мирового фармацевтического рынка. Соответственно, изменений требуют ключевые системные компоненты законодательной базы об обращении лекарственных средств.
 ОСНОВНЫЕ ПОНЯТИЯ В СФЕРЕ ЛЕКАРСТВЕННОГО ОБРАЩЕНИЯ СТАТЬЯ 4 ФЗ «ОБ ОБРАЩЕНИИ ЛЕКАРСТВЕННЫХ СРЕДСТВ» ОТ 12. 04. 2010 ГОДА № 61 -ФЗ (В РЕД. ОТ 13. 07. 2015 ГОДА)
ОСНОВНЫЕ ПОНЯТИЯ В СФЕРЕ ЛЕКАРСТВЕННОГО ОБРАЩЕНИЯ СТАТЬЯ 4 ФЗ «ОБ ОБРАЩЕНИИ ЛЕКАРСТВЕННЫХ СРЕДСТВ» ОТ 12. 04. 2010 ГОДА № 61 -ФЗ (В РЕД. ОТ 13. 07. 2015 ГОДА)
 СООТНОШЕНИЕ ПОНЯТИЙ «ЛС И ФАРМАЦЕВТИЧЕСКАЯ СУБСТАНЦИЯ» лекарственные средства — вещества или их комбинации, вступающие в контакт с организмом человека или животного, проникающие в органы , ткани организма человека или животного, применяемые для профилактики , диагностики (за исключением веществ или их комбинаций, не контактирующих с организмом человека или животного), лечения заболевания, реабилитации , для сохранения, предотвращения или прерывания беременности и полученные из крови, плазмы крови, из органов, тканей организма человека или животного, растений, минералов методами синтеза или с применением биологических технологий. К лекарственным средствам относятся фармацевтические субстанции и лекарственные препараты.
СООТНОШЕНИЕ ПОНЯТИЙ «ЛС И ФАРМАЦЕВТИЧЕСКАЯ СУБСТАНЦИЯ» лекарственные средства — вещества или их комбинации, вступающие в контакт с организмом человека или животного, проникающие в органы , ткани организма человека или животного, применяемые для профилактики , диагностики (за исключением веществ или их комбинаций, не контактирующих с организмом человека или животного), лечения заболевания, реабилитации , для сохранения, предотвращения или прерывания беременности и полученные из крови, плазмы крови, из органов, тканей организма человека или животного, растений, минералов методами синтеза или с применением биологических технологий. К лекарственным средствам относятся фармацевтические субстанции и лекарственные препараты.
 ФАРМАЦЕВТИЧЕСКАЯ СУБСТАНЦИЯ Фармацевтическая субстанция — лекарственное средство в виде одного или нескольких обладающих фармакологической активностью действующих веществ вне зависимости от природы происхождения, которое предназначено для производства, изготовления лекарственных препаратов и определяет их эффективность.
ФАРМАЦЕВТИЧЕСКАЯ СУБСТАНЦИЯ Фармацевтическая субстанция — лекарственное средство в виде одного или нескольких обладающих фармакологической активностью действующих веществ вне зависимости от природы происхождения, которое предназначено для производства, изготовления лекарственных препаратов и определяет их эффективность.
 СООТНОШЕНИЕ ПОНЯТИЙ ЛС, ЛП И ЛФ Пункт 4 ) лекарственные препараты — лекарственные средства в виде лекарственных форм, применяемые для профилактики, диагностики, лечения заболевания, реабилитации, для сохранения, предотвращения или прерывания беременности; Пункт 5) лекарственная форма — состояние лекарственного препарата, соответствующее способам его введения и применения и обеспечивающее достижение необходимого лечебного эффекта;
СООТНОШЕНИЕ ПОНЯТИЙ ЛС, ЛП И ЛФ Пункт 4 ) лекарственные препараты — лекарственные средства в виде лекарственных форм, применяемые для профилактики, диагностики, лечения заболевания, реабилитации, для сохранения, предотвращения или прерывания беременности; Пункт 5) лекарственная форма — состояние лекарственного препарата, соответствующее способам его введения и применения и обеспечивающее достижение необходимого лечебного эффекта;
 СООТНОШЕНИЕ ПОНЯТИЙ МНН И ТН 16) международное непатентованное наименование лекарственного средства — наименование действующего вещества фармацевтической субстанции , рекомендованное Всемирной организацией здравоохранения (ВОЗ); 17) торговое наименование лекарственного средства — наименование лекарственного средства, присвоенное его разработчиком , держателем или владельцем регистрационного удостоверения лекарственного препарата; 17. 1) группировочное наименование лекарственного препарата — наименование лекарственного препарата, не имеющего международного непатентованного наименования, или комбинации лекарственных препаратов, используемое в целях объединения их в группу под единым наименованием исходя из одинакового состава действующих веществ;
СООТНОШЕНИЕ ПОНЯТИЙ МНН И ТН 16) международное непатентованное наименование лекарственного средства — наименование действующего вещества фармацевтической субстанции , рекомендованное Всемирной организацией здравоохранения (ВОЗ); 17) торговое наименование лекарственного средства — наименование лекарственного средства, присвоенное его разработчиком , держателем или владельцем регистрационного удостоверения лекарственного препарата; 17. 1) группировочное наименование лекарственного препарата — наименование лекарственного препарата, не имеющего международного непатентованного наименования, или комбинации лекарственных препаратов, используемое в целях объединения их в группу под единым наименованием исходя из одинакового состава действующих веществ;
 НОВОЕ ПОНЯТИЕ В ФЗ № 61 26. 1) держатель или владелец регистрационного удостоверения лекарственного препарата — это разработчик лекарственного средства, производитель лекарственных средств или иное юридическое лицо , обладающее правом владения регистрационным удостоверением, которые несут ответственность за качество, эффективность и безопасность лекарственного препарата
НОВОЕ ПОНЯТИЕ В ФЗ № 61 26. 1) держатель или владелец регистрационного удостоверения лекарственного препарата — это разработчик лекарственного средства, производитель лекарственных средств или иное юридическое лицо , обладающее правом владения регистрационным удостоверением, которые несут ответственность за качество, эффективность и безопасность лекарственного препарата
 ГОМЕОПАТИЧЕСКОЕ ЛЕКАРСТВЕННОЕ СРЕДСТВО (ПРЕПАРАТ) Устаревшая редакция ФЗ № 61 15) гомеопатическое лекарственное средство — лекарственное средство, произведенное или изготовленное по специальной технологии Современная редакция ФЗ № 61 15) гомеопатический лекарственный препарат — лекарственный препарат, произведенный или изготовленный из фармацевтической субстанции или фармацевтических субстанций в соответствии с требованиями общих фармакопейных статей к гомеопатическим лекарственным препаратам или в соответствии с требованиями фармакопеи страны производителя такого лекарственного препарата
ГОМЕОПАТИЧЕСКОЕ ЛЕКАРСТВЕННОЕ СРЕДСТВО (ПРЕПАРАТ) Устаревшая редакция ФЗ № 61 15) гомеопатическое лекарственное средство — лекарственное средство, произведенное или изготовленное по специальной технологии Современная редакция ФЗ № 61 15) гомеопатический лекарственный препарат — лекарственный препарат, произведенный или изготовленный из фармацевтической субстанции или фармацевтических субстанций в соответствии с требованиями общих фармакопейных статей к гомеопатическим лекарственным препаратам или в соответствии с требованиями фармакопеи страны производителя такого лекарственного препарата
 ЖНВ ЛП ? перечень жизненно необходимых и важнейших лекарственных препаратов — ежегодно утверждаемый Правительством Российской Федерации перечень лекарственных препаратов для медицинского применения , обеспечивающих приоритетные потребности здравоохранения в целях профилактики и лечения заболеваний, в том числе преобладающих в структуре заболеваемости в Российской Федерации;
ЖНВ ЛП ? перечень жизненно необходимых и важнейших лекарственных препаратов — ежегодно утверждаемый Правительством Российской Федерации перечень лекарственных препаратов для медицинского применения , обеспечивающих приоритетные потребности здравоохранения в целях профилактики и лечения заболеваний, в том числе преобладающих в структуре заболеваемости в Российской Федерации;
 референтный лекарственный препарат — лекарственный препарат, который впервые зарегистрирован в России, качество , эффективность и безопасность которого доказаны на основании результатов доклинических исследований лекарственных средств и клинических исследований лекарственных препаратов, …. , и который используется для оценки биоэквивалентности или терапевтической эквивалентности, качества, эффективности и безопасности воспроизведенного или биоаналогового (биоподобного) лекарственного препарата 20 НОВЫЕ ПОНЯТИЯ В СТАТЬЕ 4 ФЗ № 61:
референтный лекарственный препарат — лекарственный препарат, который впервые зарегистрирован в России, качество , эффективность и безопасность которого доказаны на основании результатов доклинических исследований лекарственных средств и клинических исследований лекарственных препаратов, …. , и который используется для оценки биоэквивалентности или терапевтической эквивалентности, качества, эффективности и безопасности воспроизведенного или биоаналогового (биоподобного) лекарственного препарата 20 НОВЫЕ ПОНЯТИЯ В СТАТЬЕ 4 ФЗ № 61:
 пункт 46) исследование терапевтической эквивалентности лекарственных препаратов — вид клинического исследования лекарственных препаратов, проведение которого осуществляется для выявления одинаковых свойств лекарственных препаратов определенной лекарственной формы, а также наличия одинаковых показателей безопасности и эффективности лекарственных препаратов, одинаковых клинических эффектов при их применении
пункт 46) исследование терапевтической эквивалентности лекарственных препаратов — вид клинического исследования лекарственных препаратов, проведение которого осуществляется для выявления одинаковых свойств лекарственных препаратов определенной лекарственной формы, а также наличия одинаковых показателей безопасности и эффективности лекарственных препаратов, одинаковых клинических эффектов при их применении
 Пункт 45) исследование биоэквивалентности лекарственного препарата — вид клинического исследования лекарственного препарата, проведение которого осуществляется для определения скорости всасывания и выведения одного или нескольких обладающих фармакологической активностью действующих веществ , количества лекарственного препарата, достигающего системного кровотока , и результаты которого позволяют сделать вывод о биоэквивалентности воспроизведенного лекарственного препарата в определенных лекарственной форме и дозировке , соответствующих форме и дозировке референтного лекарственного препарата;
Пункт 45) исследование биоэквивалентности лекарственного препарата — вид клинического исследования лекарственного препарата, проведение которого осуществляется для определения скорости всасывания и выведения одного или нескольких обладающих фармакологической активностью действующих веществ , количества лекарственного препарата, достигающего системного кровотока , и результаты которого позволяют сделать вывод о биоэквивалентности воспроизведенного лекарственного препарата в определенных лекарственной форме и дозировке , соответствующих форме и дозировке референтного лекарственного препарата;
 23 лекарственный препарат, который имеет такой же качественный состав и количественный состав действующих веществ в такой же лекарственной форме , что и референтный лекарственный препарат, и биоэквивалентность или терапевтическая эквивалентность которого референтному лекарственному препарату подтверждена соответствующими исследованиями биологический лекарственный препарат, схожий по параметрам качества, эффективности и безопасности с референтным биологическим лекарственным препаратом в такой же лекарственной форме и имеющий идентичный способ введения. Воспроизведенный ЛП Биоаналоговый (биоподобный) лекарственный препарат (биоаналог)
23 лекарственный препарат, который имеет такой же качественный состав и количественный состав действующих веществ в такой же лекарственной форме , что и референтный лекарственный препарат, и биоэквивалентность или терапевтическая эквивалентность которого референтному лекарственному препарату подтверждена соответствующими исследованиями биологический лекарственный препарат, схожий по параметрам качества, эффективности и безопасности с референтным биологическим лекарственным препаратом в такой же лекарственной форме и имеющий идентичный способ введения. Воспроизведенный ЛП Биоаналоговый (биоподобный) лекарственный препарат (биоаналог)
 ВЗАИМОЗАМЕНЯЕМОСТЬ ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ Терапевтическая эквивалентность — достижение клинически сопоставимого терапевтического эффекта применении лекарственных препаратов для медицинского применения для одной и той же группы больных по одним и тем же показаниям к применению. 24 Согласно определению ВОЗ, взаимозаменяемый ЛП – это препарат, который является терапевтически эквивалентным препарату сравнения, т. е. таким, на который его можно заменить в клинической практике.
ВЗАИМОЗАМЕНЯЕМОСТЬ ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ Терапевтическая эквивалентность — достижение клинически сопоставимого терапевтического эффекта применении лекарственных препаратов для медицинского применения для одной и той же группы больных по одним и тем же показаниям к применению. 24 Согласно определению ВОЗ, взаимозаменяемый ЛП – это препарат, который является терапевтически эквивалентным препарату сравнения, т. е. таким, на который его можно заменить в клинической практике.
 ВЗАИМОЗАМЕНЯЕМОСТЬ И ЗАМЕЩАЕМОСТЬ ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ «Взаимозаменяемый лекарственный препарат» — лекарственный препарат с доказанной терапевтической эквивалентностью или биоэквивалентностью в отношении референтного лекарственного препарата , имеющий эквивалентные ему качественный состав и количественный состав действующих веществ, состав вспомогательных веществ, лекарственную форму и способ введения. 25 В зарубежных источниках « взаимозаменяемость » понимают как медицинскую или фармацевтическую практику перехода от одного ЛП к другому с тем же МНН и эквивалентному при одинаковых показаниях. При замене в аптеке одного взаимозаменяемого ЛП без консультации с врачом используется термин « замещаемость » .
ВЗАИМОЗАМЕНЯЕМОСТЬ И ЗАМЕЩАЕМОСТЬ ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ «Взаимозаменяемый лекарственный препарат» — лекарственный препарат с доказанной терапевтической эквивалентностью или биоэквивалентностью в отношении референтного лекарственного препарата , имеющий эквивалентные ему качественный состав и количественный состав действующих веществ, состав вспомогательных веществ, лекарственную форму и способ введения. 25 В зарубежных источниках « взаимозаменяемость » понимают как медицинскую или фармацевтическую практику перехода от одного ЛП к другому с тем же МНН и эквивалентному при одинаковых показаниях. При замене в аптеке одного взаимозаменяемого ЛП без консультации с врачом используется термин « замещаемость » .
 ВЗАИМОЗАМЕНЯЕМОСТЬ ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ Взаимозаменяемость будет проверяться в ходе государственной регистрации лекарственного препарата, а сведения о взаимозаменяемости будут включены в Государственный реестр лекарственных средств. Кроме того, держателям или владельцам регистрационного удостоверения предоставлена возможность обжалования заключения эксперта о взаимозаменяемости. Взаимозаменяемость уже зарегистрированных препаратов должна быть определена до 31 декабря 2017 года. Конкретный порядок определения взаимозаменяемости должен быть принят в форме постановления Правительства РФ, обсуждение проекта которого продолжается в настоящий момент.
ВЗАИМОЗАМЕНЯЕМОСТЬ ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ Взаимозаменяемость будет проверяться в ходе государственной регистрации лекарственного препарата, а сведения о взаимозаменяемости будут включены в Государственный реестр лекарственных средств. Кроме того, держателям или владельцам регистрационного удостоверения предоставлена возможность обжалования заключения эксперта о взаимозаменяемости. Взаимозаменяемость уже зарегистрированных препаратов должна быть определена до 31 декабря 2017 года. Конкретный порядок определения взаимозаменяемости должен быть принят в форме постановления Правительства РФ, обсуждение проекта которого продолжается в настоящий момент.
 ФЕДЕРАЛЬНЫЙ ЗАКОН «О КОНТРАКТНОЙ СИСТЕМЕ В СФЕРЕ ЗАКУПОК ТОВАРОВ, РАБОТ, УСЛУГ ДЛЯ ОБЕСПЕЧЕНИЯ ГОСУДАРСТВЕННЫХ И МУНИЦИПАЛЬНЫХ НУЖД» (С ИЗМЕНЕНИЯМИ И ДОПОЛНЕНИЯМИ) ОТ 5 АПРЕЛЯ 2013 Г. № 44 -ФЗ Идентичными товарами, работами, услугами (п. 13 ст. 22) признаются товары, работы, услуги, имеющие одинаковые характерные для них основные признаки. При определении идентичности товаров незначительные различия во внешнем виде таких товаров могут не учитываться. Однородными товарами (п. 14 ст. 22) признаются товары, которые, не являясь идентичными , имеют сходные характеристики и состоят из схожих компонентов, что позволяет им выполнять одни и те же функции и (или) быть коммерчески взаимозаменяемыми.
ФЕДЕРАЛЬНЫЙ ЗАКОН «О КОНТРАКТНОЙ СИСТЕМЕ В СФЕРЕ ЗАКУПОК ТОВАРОВ, РАБОТ, УСЛУГ ДЛЯ ОБЕСПЕЧЕНИЯ ГОСУДАРСТВЕННЫХ И МУНИЦИПАЛЬНЫХ НУЖД» (С ИЗМЕНЕНИЯМИ И ДОПОЛНЕНИЯМИ) ОТ 5 АПРЕЛЯ 2013 Г. № 44 -ФЗ Идентичными товарами, работами, услугами (п. 13 ст. 22) признаются товары, работы, услуги, имеющие одинаковые характерные для них основные признаки. При определении идентичности товаров незначительные различия во внешнем виде таких товаров могут не учитываться. Однородными товарами (п. 14 ст. 22) признаются товары, которые, не являясь идентичными , имеют сходные характеристики и состоят из схожих компонентов, что позволяет им выполнять одни и те же функции и (или) быть коммерчески взаимозаменяемыми.
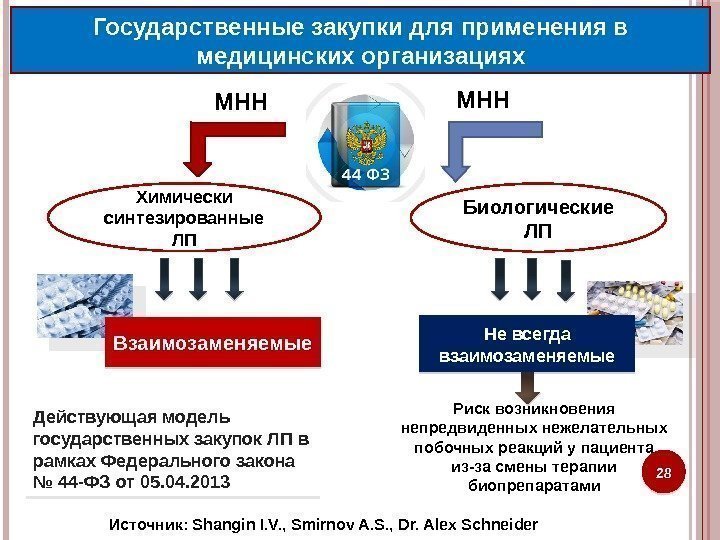
 28 Государственные закупки для применения в медицинских организациях Химически синтезированные ЛП Биологические ЛП Взаимозаменяемые Не всегда взаимозаменяемые. МНН Риск возникновения непредвиденных нежелательных побочных реакций у пациента из-за смены терапии биопрепаратами. Действующая модель государственных закупок ЛП в рамках Федерального закона № 44 -ФЗ от 05. 04. 2013 Источник: Shangin I. V. , Smirnov A. S. , Dr. Alex Schneider
28 Государственные закупки для применения в медицинских организациях Химически синтезированные ЛП Биологические ЛП Взаимозаменяемые Не всегда взаимозаменяемые. МНН Риск возникновения непредвиденных нежелательных побочных реакций у пациента из-за смены терапии биопрепаратами. Действующая модель государственных закупок ЛП в рамках Федерального закона № 44 -ФЗ от 05. 04. 2013 Источник: Shangin I. V. , Smirnov A. S. , Dr. Alex Schneider
 НОВЫЕ ВИДЫ ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ Орфанные лекарственные препараты — лекарственные препараты, предназначенные исключительно для диагностики или патогенетического лечения (лечения, направленного на механизм развития заболевания) редких (орфанных) заболеваний. Орфанные заболевания — жизнеугрожающие и хронические прогрессирующие редкие заболевания, приводящие к сокращению продолжительности жизни гражданина или инвалидности, которые имеют распространенность не более 10 случаев заболевания на 100 тысяч населения (ФЗ от 21. 11. 2011 г. № 323). Перечень редких (орфанных) заболеваний формируется Министерством здравоохранения РФ на основании статистических данных и размещается на его официальном сайте в сети «Интернет». Утверждается Правительством РФ.
НОВЫЕ ВИДЫ ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ Орфанные лекарственные препараты — лекарственные препараты, предназначенные исключительно для диагностики или патогенетического лечения (лечения, направленного на механизм развития заболевания) редких (орфанных) заболеваний. Орфанные заболевания — жизнеугрожающие и хронические прогрессирующие редкие заболевания, приводящие к сокращению продолжительности жизни гражданина или инвалидности, которые имеют распространенность не более 10 случаев заболевания на 100 тысяч населения (ФЗ от 21. 11. 2011 г. № 323). Перечень редких (орфанных) заболеваний формируется Министерством здравоохранения РФ на основании статистических данных и размещается на его официальном сайте в сети «Интернет». Утверждается Правительством РФ.
 ОРФАННЫЕ БОЛЕЗНИ И ОРФАННЫЕ ЛП Перечень лекарственных препаратов , предназначенных для обеспечения лиц, больных гемофилией, муковисцидозом, гипофизарным нанизмом, болезнью Гоше, злокачественными новообразованиями лимфоидной, кроветворной и родственных им тканей, рассеянным склерозом, лиц после трансплантации органов и (или) тканей, согласно приложению № 3 (Перечень ЖНВЛП на 2017 год, утвержденный распоряжением Правительства РФ от 26. 12. 2015 г. № 2724 -р ) включает 20 МНН.
ОРФАННЫЕ БОЛЕЗНИ И ОРФАННЫЕ ЛП Перечень лекарственных препаратов , предназначенных для обеспечения лиц, больных гемофилией, муковисцидозом, гипофизарным нанизмом, болезнью Гоше, злокачественными новообразованиями лимфоидной, кроветворной и родственных им тканей, рассеянным склерозом, лиц после трансплантации органов и (или) тканей, согласно приложению № 3 (Перечень ЖНВЛП на 2017 год, утвержденный распоряжением Правительства РФ от 26. 12. 2015 г. № 2724 -р ) включает 20 МНН.
 ГОСУДАРСТВЕННАЯ РЕГИСТРАЦИЯ ЛЕКАРСТВЕННЫХ СРЕДСТВ
ГОСУДАРСТВЕННАЯ РЕГИСТРАЦИЯ ЛЕКАРСТВЕННЫХ СРЕДСТВ
 ГОСУДАРСТВЕННАЯ РЕГИСТРАЦИЯ ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ (СТ. 13 ФЗ № 61) 1. В Российской Федерации допускаются производство, изготовление, хранение, перевозка, ввоз в Российскую Федерацию, вывоз из Российской Федерации, реклама, отпуск, реализация, передача, применение, уничтожение лекарственных препаратов, если они зарегистрированы соответствующим уполномоченным федеральным органом исполнительной власти. Форма регистрации – выдача регистрационного удостоверения.
ГОСУДАРСТВЕННАЯ РЕГИСТРАЦИЯ ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ (СТ. 13 ФЗ № 61) 1. В Российской Федерации допускаются производство, изготовление, хранение, перевозка, ввоз в Российскую Федерацию, вывоз из Российской Федерации, реклама, отпуск, реализация, передача, применение, уничтожение лекарственных препаратов, если они зарегистрированы соответствующим уполномоченным федеральным органом исполнительной власти. Форма регистрации – выдача регистрационного удостоверения.
 КАКИЕ ЛС ПОДЛЕЖАТ ГОСУДАРСТВЕННОЙ РЕГИСТРАЦИИ? Государственной регистрации подлежат: 1) все лекарственные препараты, впервые подлежащие вводу в обращение в Российской Федерации; 2) лекарственные препараты, зарегистрированные ранее, но произведенные в других лекарственных формах в соответствии с перечнем наименований лекарственных форм, в новой дозировке при доказательстве ее клинической значимости и эффективности; 3) новые комбинации зарегистрированных ранее лекарственных препаратов.
КАКИЕ ЛС ПОДЛЕЖАТ ГОСУДАРСТВЕННОЙ РЕГИСТРАЦИИ? Государственной регистрации подлежат: 1) все лекарственные препараты, впервые подлежащие вводу в обращение в Российской Федерации; 2) лекарственные препараты, зарегистрированные ранее, но произведенные в других лекарственных формах в соответствии с перечнем наименований лекарственных форм, в новой дозировке при доказательстве ее клинической значимости и эффективности; 3) новые комбинации зарегистрированных ранее лекарственных препаратов.
 КАКИМ ОБРАЗОМ ОСУЩЕСТВЛЯЕТСЯ ГОСУДАРСТВЕННАЯ РЕГИСТРАЦИЯ ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ? Государственная регистрация лекарственных препаратов осуществляется по результатам экспертизы лекарственных средств, а государственная регистрация орфанных лекарственных препаратов осуществляется по результатам экспертизы документов , представленных для определения возможности рассматривать лекарственный препарат для медицинского применения при осуществлении государственной регистрации в качестве орфанного лекарственного препарата, и по результатам экспертизы лекарственных средств.
КАКИМ ОБРАЗОМ ОСУЩЕСТВЛЯЕТСЯ ГОСУДАРСТВЕННАЯ РЕГИСТРАЦИЯ ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ? Государственная регистрация лекарственных препаратов осуществляется по результатам экспертизы лекарственных средств, а государственная регистрация орфанных лекарственных препаратов осуществляется по результатам экспертизы документов , представленных для определения возможности рассматривать лекарственный препарат для медицинского применения при осуществлении государственной регистрации в качестве орфанного лекарственного препарата, и по результатам экспертизы лекарственных средств.
 ОСОБЕННОСТИ ПРОЦЕДУРЫ РЕГИСТРАЦИИ ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ Расширен перечень ЛС, не подлежащих госрегистрации: фармацевтические субстанции; препараты, ввозимые в РФ для клинических исследований и(или) экспертизы; для оказания медицинской помощи по жизненным показаниям конкретного пациента. Расширены основания для отмены регистрации лекарственного препарата (например, отсутствие ЛП в обращении в РФ в течение 3 -х и более лет). Срок регистрации сокращен – с 210 до 160 рабочих дней. Этапы экспертизы ЛП при регистрации изменены. Получение разрешения на проведение клинических исследований выделено из процедуры регистрации ЛП. Возможность не проводить доклинические исследования в России, при условии, если они уже осуществлялись за пределами РФ согласно правилам GLP и GCP. Введена процедура научного консультирования.
ОСОБЕННОСТИ ПРОЦЕДУРЫ РЕГИСТРАЦИИ ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ Расширен перечень ЛС, не подлежащих госрегистрации: фармацевтические субстанции; препараты, ввозимые в РФ для клинических исследований и(или) экспертизы; для оказания медицинской помощи по жизненным показаниям конкретного пациента. Расширены основания для отмены регистрации лекарственного препарата (например, отсутствие ЛП в обращении в РФ в течение 3 -х и более лет). Срок регистрации сокращен – с 210 до 160 рабочих дней. Этапы экспертизы ЛП при регистрации изменены. Получение разрешения на проведение клинических исследований выделено из процедуры регистрации ЛП. Возможность не проводить доклинические исследования в России, при условии, если они уже осуществлялись за пределами РФ согласно правилам GLP и GCP. Введена процедура научного консультирования.
 КЛЮЧЕВЫЕ ПАРАМЕТРЫ ПОТРЕБИТЕЛЬСКОЙ ОЦЕНКИ ЛП 22) качество лекарственного средства — соответствие лекарственного средства требованиям фармакопейной статьи либо в случае ее отсутствия нормативной документации или нормативного документа; 23) безопасность лекарственного средства — характеристика лекарственного средства, основанная на сравнительном анализе его эффективности и риска причинения вреда здоровью; 24) эффективность лекарственного препарата — характеристика степени положительного влияния лекарственного препарата на течение, продолжительность заболевания или его предотвращение, реабилитацию, на сохранение, предотвращение или прерывание беременности;
КЛЮЧЕВЫЕ ПАРАМЕТРЫ ПОТРЕБИТЕЛЬСКОЙ ОЦЕНКИ ЛП 22) качество лекарственного средства — соответствие лекарственного средства требованиям фармакопейной статьи либо в случае ее отсутствия нормативной документации или нормативного документа; 23) безопасность лекарственного средства — характеристика лекарственного средства, основанная на сравнительном анализе его эффективности и риска причинения вреда здоровью; 24) эффективность лекарственного препарата — характеристика степени положительного влияния лекарственного препарата на течение, продолжительность заболевания или его предотвращение, реабилитацию, на сохранение, предотвращение или прерывание беременности;
 ДОКУМЕНТАЦИЯ В СФЕРЕ ФАРМДЕЯТЕЛЬНОСТИ 53) рецепт на лекарственный препарат — письменное назначение лекарственного препарата по установленной форме, выданное медицинским или ветеринарным работником, имеющим на это право, в целях отпуска лекарственного препарата или его изготовления и отпуска; 54) требование медицинской организации , ветеринарной организации — документ установленной формы, который выписан медицинским или ветеринарным работником, имеющим на это право, и содержит в письменной форме указание аптечной организации об отпуске лекарственного препарата или о его изготовлении и об отпуске для обеспечения лечебного процесса в медицинской организации, ветеринарной организации;
ДОКУМЕНТАЦИЯ В СФЕРЕ ФАРМДЕЯТЕЛЬНОСТИ 53) рецепт на лекарственный препарат — письменное назначение лекарственного препарата по установленной форме, выданное медицинским или ветеринарным работником, имеющим на это право, в целях отпуска лекарственного препарата или его изготовления и отпуска; 54) требование медицинской организации , ветеринарной организации — документ установленной формы, который выписан медицинским или ветеринарным работником, имеющим на это право, и содержит в письменной форме указание аптечной организации об отпуске лекарственного препарата или о его изготовлении и об отпуске для обеспечения лечебного процесса в медицинской организации, ветеринарной организации;
 КОМПЛЕКСНАЯ ОЦЕНКА ЛП 55 ) комплексная оценка лекарственного препарата — оценка зарегистрированного лекарственного препарата, включающая в себя анализ информации о сравнительной клинической эффективности и безопасности лекарственного препарата, оценку экономических последствий его применения , изучение дополнительных последствий применения лекарственного препарата в целях принятия решений о возможности включения лекарственного препарата в перечень жизненно необходимых и важнейших лекарственных препаратов , нормативные правовые акты и иные документы, определяющие порядок оказания медицинской помощи, или исключения его из указанных перечня, актов и документов. (п. 55 введен Федеральным законом от 22. 12. 2014 N 429 -ФЗ)
КОМПЛЕКСНАЯ ОЦЕНКА ЛП 55 ) комплексная оценка лекарственного препарата — оценка зарегистрированного лекарственного препарата, включающая в себя анализ информации о сравнительной клинической эффективности и безопасности лекарственного препарата, оценку экономических последствий его применения , изучение дополнительных последствий применения лекарственного препарата в целях принятия решений о возможности включения лекарственного препарата в перечень жизненно необходимых и важнейших лекарственных препаратов , нормативные правовые акты и иные документы, определяющие порядок оказания медицинской помощи, или исключения его из указанных перечня, актов и документов. (п. 55 введен Федеральным законом от 22. 12. 2014 N 429 -ФЗ)
 НОВЫЕ ПРАВИЛА ОБРАЩЕНИЯ ИММУНОБИОЛОГИЧЕСК ИХ ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ
НОВЫЕ ПРАВИЛА ОБРАЩЕНИЯ ИММУНОБИОЛОГИЧЕСК ИХ ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ
 ФЕДЕРАЛЬНЫЙ ЗАКОН ОТ 17. 09. 1998 № 157 -ФЗ «ОБ ИММУНОПРОФИЛАКТИКЕ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ» иммунопрофилактика инфекционных болезней — система мероприятий, осуществляемых в целях предупреждения, ограничения распространения и ликвидации инфекционных болезней путем проведения профилактических прививок ; иммунобиологические лекарственные препараты для иммунопрофилактики — вакцины , анатоксины , иммуноглобулины и прочие лекарственные средства , предназначенные для создания специфической невосприимчивости к инфекционным болезням (в ред. Федерального закона от 25. 11. 2013 № 317 -ФЗ).
ФЕДЕРАЛЬНЫЙ ЗАКОН ОТ 17. 09. 1998 № 157 -ФЗ «ОБ ИММУНОПРОФИЛАКТИКЕ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ» иммунопрофилактика инфекционных болезней — система мероприятий, осуществляемых в целях предупреждения, ограничения распространения и ликвидации инфекционных болезней путем проведения профилактических прививок ; иммунобиологические лекарственные препараты для иммунопрофилактики — вакцины , анатоксины , иммуноглобулины и прочие лекарственные средства , предназначенные для создания специфической невосприимчивости к инфекционным болезням (в ред. Федерального закона от 25. 11. 2013 № 317 -ФЗ).
 ОБРАЩЕНИЕ ИММУНОБИОЛОГИЧЕСКИХ ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ 6. 2) биологические лекарственные препараты — лекарственные препараты, действующее вещество которых произведено или выделено из биологического источника и для определения свойств и качества которых необходима комбинация биологических и физико-химических методов. К биологическим лекарственным препаратам относятся иммунобиологические лекарственные препараты , лекарственные препараты, полученные из крови, плазмы крови человека и животных (за исключением цельной крови), биотехнологические лекарственные препараты, генотерапевтические лекарственные препараты; (ФЗ «Об обращении лекарственных средств» от 12. 04. 2010 г. п. 6. 2 введен Федеральным законом от 22. 12. 2014 № 429 -ФЗ )
ОБРАЩЕНИЕ ИММУНОБИОЛОГИЧЕСКИХ ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ 6. 2) биологические лекарственные препараты — лекарственные препараты, действующее вещество которых произведено или выделено из биологического источника и для определения свойств и качества которых необходима комбинация биологических и физико-химических методов. К биологическим лекарственным препаратам относятся иммунобиологические лекарственные препараты , лекарственные препараты, полученные из крови, плазмы крови человека и животных (за исключением цельной крови), биотехнологические лекарственные препараты, генотерапевтические лекарственные препараты; (ФЗ «Об обращении лекарственных средств» от 12. 04. 2010 г. п. 6. 2 введен Федеральным законом от 22. 12. 2014 № 429 -ФЗ )
 МИБП ИЛИ ИБП ? Устаревшая редакция ФЗ «Об обращении лекарственных средств» от 12. 04. 2010 № 61 -ФЗ: п. 7) иммунобиологические лекарственные препараты — лекарственные препараты биологического происхождения, предназначенные для иммунологических диагностики , профилактики и лечения заболеваний
МИБП ИЛИ ИБП ? Устаревшая редакция ФЗ «Об обращении лекарственных средств» от 12. 04. 2010 № 61 -ФЗ: п. 7) иммунобиологические лекарственные препараты — лекарственные препараты биологического происхождения, предназначенные для иммунологических диагностики , профилактики и лечения заболеваний
 ГОСУДАРСТВЕННЫЙ РЕЕСТР ЛЕКАРСТВЕННЫХ СРЕДСТВ ПО СОСТОЯНИЮ НА 24. 12. 2016 Г. Актинолизат Ботокс Бронхо-Ваксом® взрослый Бронхо-Ваксом® детский Бронхо-мунал® ИРС 19 Исмиген Ксеомин Лантокс Мабтера® Авонекс® Бетаферон Виферон Гриппферон Интерферон альфа-2 b человеческий рекомбинантный Пегасис® Пирогенал Ребиф Роферон®-А И др. к МИБП отнесены : к Цитокинам отнесены:
ГОСУДАРСТВЕННЫЙ РЕЕСТР ЛЕКАРСТВЕННЫХ СРЕДСТВ ПО СОСТОЯНИЮ НА 24. 12. 2016 Г. Актинолизат Ботокс Бронхо-Ваксом® взрослый Бронхо-Ваксом® детский Бронхо-мунал® ИРС 19 Исмиген Ксеомин Лантокс Мабтера® Авонекс® Бетаферон Виферон Гриппферон Интерферон альфа-2 b человеческий рекомбинантный Пегасис® Пирогенал Ребиф Роферон®-А И др. к МИБП отнесены : к Цитокинам отнесены:
 МИБП ИЛИ ИБП ? Современная редакция ФЗ «Об обращении лекарственных средств» : п. 7) иммунобиологические лекарственные препараты (ИБП) — лекарственные препараты, предназначенные для формирования активного или пассивного иммунитета либо диагностики наличия иммунитета или диагностики специфического приобретенного изменения иммунологического ответа на аллергизирующие вещества. К иммунобиологическим лекарственным препаратам относятся вакцины, анатоксины, сыворотки, иммуноглобулины и аллергены.
МИБП ИЛИ ИБП ? Современная редакция ФЗ «Об обращении лекарственных средств» : п. 7) иммунобиологические лекарственные препараты (ИБП) — лекарственные препараты, предназначенные для формирования активного или пассивного иммунитета либо диагностики наличия иммунитета или диагностики специфического приобретенного изменения иммунологического ответа на аллергизирующие вещества. К иммунобиологическим лекарственным препаратам относятся вакцины, анатоксины, сыворотки, иммуноглобулины и аллергены.
 ИММУНОБИОЛОГИЧЕСКИЕ ЛЕКАРСТВЕННЫЕ ПРЕПАРАТЫ 45 Старая редакция 7) иммунобиологические лекарственные препараты — лекарственные препараты биологического происхождения, предназначенные для иммунологических диагностики, профилактики и лечения заболеваний ; ** до 1 сентября 2010 г. было принято использовать термин «Медицинские иммунобиологические препараты» (МИБП). Новая редакция 7) иммунобиологические лекарственные препараты — лекарственные препараты, предназначенные для формирования активного или пассивного иммунитета либо диагностики наличия иммунитета или диагностики специфического приобретенного изменения иммунологического ответа на аллергизирующие вещества. К иммунобиологическим лекарственным препаратам относятся вакцины, анатоксины, сыворотки, иммуноглобулины и аллергены; (п. 7 в ред. Федерального закона от 22. 12. 2014 N 429 -ФЗ) Особые технологии производства Особое действие на организм Особый надзор за качеством и применением.
ИММУНОБИОЛОГИЧЕСКИЕ ЛЕКАРСТВЕННЫЕ ПРЕПАРАТЫ 45 Старая редакция 7) иммунобиологические лекарственные препараты — лекарственные препараты биологического происхождения, предназначенные для иммунологических диагностики, профилактики и лечения заболеваний ; ** до 1 сентября 2010 г. было принято использовать термин «Медицинские иммунобиологические препараты» (МИБП). Новая редакция 7) иммунобиологические лекарственные препараты — лекарственные препараты, предназначенные для формирования активного или пассивного иммунитета либо диагностики наличия иммунитета или диагностики специфического приобретенного изменения иммунологического ответа на аллергизирующие вещества. К иммунобиологическим лекарственным препаратам относятся вакцины, анатоксины, сыворотки, иммуноглобулины и аллергены; (п. 7 в ред. Федерального закона от 22. 12. 2014 N 429 -ФЗ) Особые технологии производства Особое действие на организм Особый надзор за качеством и применением.
 ФАРМАКОНАДЗОР — ВИД ДЕЯТЕЛЬНОСТИ ПО МОНИТОРИНГУ ЭФФЕКТИВНОСТИ И БЕЗОПАСНОСТИ ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ, НАПРАВЛЕННЫЙ НА ВЫЯВЛЕНИЕ, ОЦЕНКУ И ПРЕДОТВРАЩЕНИЕ НЕЖЕЛАТЕЛЬНЫХ ПОСЛЕДСТВИЙ ПРИМЕНЕНИЯ ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ Представление информации об индивидуальной непереносимости, отсутствии эффективности лекарственных препаратов, иных обстоятельствах, представляющих угрозу жизни или здоровью человека; Проводится на любом этапе обращения ЛС , а не только в ходе применения ЛС и клинических исследований; Ответственность за непредставление информации несут держатели (владельцы) регистрационных удостоверений ЛП, юридические лица, на имя которых выданы разрешения на проведение клинических исследований в РФ, должностные лица, которым эта информация стала известна по роду их профессиональной деятельности.
ФАРМАКОНАДЗОР — ВИД ДЕЯТЕЛЬНОСТИ ПО МОНИТОРИНГУ ЭФФЕКТИВНОСТИ И БЕЗОПАСНОСТИ ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ, НАПРАВЛЕННЫЙ НА ВЫЯВЛЕНИЕ, ОЦЕНКУ И ПРЕДОТВРАЩЕНИЕ НЕЖЕЛАТЕЛЬНЫХ ПОСЛЕДСТВИЙ ПРИМЕНЕНИЯ ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ Представление информации об индивидуальной непереносимости, отсутствии эффективности лекарственных препаратов, иных обстоятельствах, представляющих угрозу жизни или здоровью человека; Проводится на любом этапе обращения ЛС , а не только в ходе применения ЛС и клинических исследований; Ответственность за непредставление информации несут держатели (владельцы) регистрационных удостоверений ЛП, юридические лица, на имя которых выданы разрешения на проведение клинических исследований в РФ, должностные лица, которым эта информация стала известна по роду их профессиональной деятельности.
 МЕХАНИЗМ ГОСУДАРСТВЕННОГО РЕГУЛИРОВАНИЯ ЦЕН НА ЖНВЛП Правительству РФ предоставлены полномочия по установлению особенностей государственного регулирования предельных отпускных цен в зависимости от экономических и(или) социальных критериев, в том числе на основе механизма референтного ценообразования, изменений порядка оказания медицинской помощи, и иные изменения) (действует с 16 марта 2015 г. ).
МЕХАНИЗМ ГОСУДАРСТВЕННОГО РЕГУЛИРОВАНИЯ ЦЕН НА ЖНВЛП Правительству РФ предоставлены полномочия по установлению особенностей государственного регулирования предельных отпускных цен в зависимости от экономических и(или) социальных критериев, в том числе на основе механизма референтного ценообразования, изменений порядка оказания медицинской помощи, и иные изменения) (действует с 16 марта 2015 г. ).
 ПОСТАНОВЛЕНИЕ ПРАВИТЕЛЬСТВА РФ ОТ 06. 05. 2015 № 434 «О региональном государственном контроле за применением цен на лекарственные препараты, включенные в перечень жизненно необходимых и важнейших лекарственных препаратов» 48 Постановление Правительства РФ от 28. 08. 2014 № 871 « Правила формирования перечней лекарственных препаратов для медицинского применения и минимального ассортимента лекарственных препаратов, необходимых для оказания медицинской помощи»
ПОСТАНОВЛЕНИЕ ПРАВИТЕЛЬСТВА РФ ОТ 06. 05. 2015 № 434 «О региональном государственном контроле за применением цен на лекарственные препараты, включенные в перечень жизненно необходимых и важнейших лекарственных препаратов» 48 Постановление Правительства РФ от 28. 08. 2014 № 871 « Правила формирования перечней лекарственных препаратов для медицинского применения и минимального ассортимента лекарственных препаратов, необходимых для оказания медицинской помощи»
 «Соглашение о единых принципах и правилах обращения лекарственных средств в рамках Евразийского экономического союза» (Заключено в г. Москве 23. 12. 2014)
«Соглашение о единых принципах и правилах обращения лекарственных средств в рамках Евразийского экономического союза» (Заключено в г. Москве 23. 12. 2014)
 Таким образом, государственное регулирование обращения лекарственных средств – процесс, который требует участия разнообразных квалифицированных специалистов, принятия разносторонних мер и значительных финансовых вложений. Однако цель в данном случае однозначно оправдывает средства.
Таким образом, государственное регулирование обращения лекарственных средств – процесс, который требует участия разнообразных квалифицированных специалистов, принятия разносторонних мер и значительных финансовых вложений. Однако цель в данном случае однозначно оправдывает средства.
 БЛАГОДАРЮ ЗА ВНИМАНИЕ!
БЛАГОДАРЮ ЗА ВНИМАНИЕ!
