Неметаллы Неметаллы План лекции 1. Общая характеристика







lekciya_6_n-h.pptx
- Размер: 329.2 Кб
- Автор:
- Количество слайдов: 11
Описание презентации Неметаллы Неметаллы План лекции 1. Общая характеристика по слайдам
 Неметаллы
Неметаллы
 Неметаллы План лекции 1. Общая характеристика неметаллов 2. Элементы VII группы ПСХЭ 3. Элементы VI группы ПСХЭ 4. Элементы V группы ПСХЭ 5. Элементы IV группы ПСХЭ
Неметаллы План лекции 1. Общая характеристика неметаллов 2. Элементы VII группы ПСХЭ 3. Элементы VI группы ПСХЭ 4. Элементы V группы ПСХЭ 5. Элементы IV группы ПСХЭ
 Общая характеристика неметаллов Неметаллы в ПС в основном располагаются в конце малых и больших периодов. Количество электронов на последнем энергоуровне равно номеру группы. Для завершения внешних энергоуровней неметаллы присоединяют электроны, следовательно, являются окислителями. При взаимодействии с металлами образуют соединения с ионной связью. С водородом образуют летучие соединения. С кислородом образуют кислотные оксиды.
Общая характеристика неметаллов Неметаллы в ПС в основном располагаются в конце малых и больших периодов. Количество электронов на последнем энергоуровне равно номеру группы. Для завершения внешних энергоуровней неметаллы присоединяют электроны, следовательно, являются окислителями. При взаимодействии с металлами образуют соединения с ионной связью. С водородом образуют летучие соединения. С кислородом образуют кислотные оксиды.
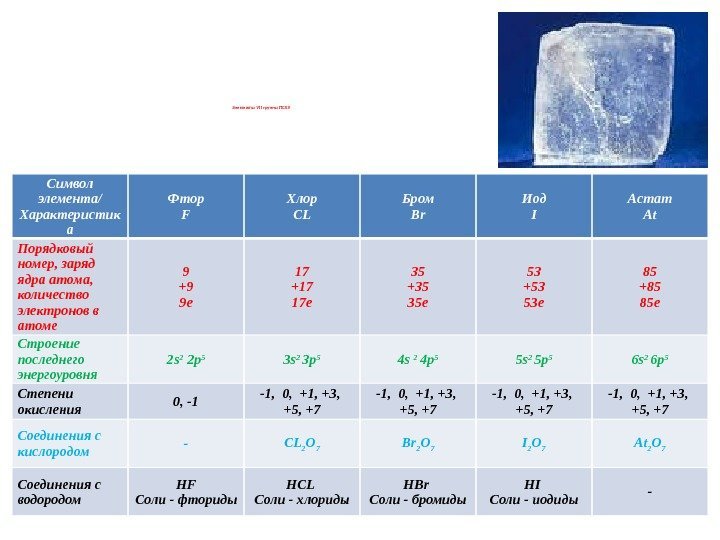
 Элементы VII группы ПСХЭ Символ элемента/ Характеристик а Фтор F Хлор CL Бром Br Иод I Астат At Порядковый номер, заряд ядра атома, количество электронов в атоме 9 +9 9 е 17 +17 17 е 35 +35 35 е 53 +53 53 е 85 +85 85 е Строение последнего энергоуровня 2 s 2 2 p 5 3 s 2 3 p 5 4 s 2 4 p 5 5 s 2 5 p 5 6 s 2 6 p 5 Степени окисления 0, -1 -1, 0, +1, +3, +5, +7 Соединения с кислородом — CL 2 O 7 Br 2 O 7 I 2 O 7 At 2 O 7 Соединения с водородом HF Соли — фториды HCL Соли — хлориды HBr Соли — бромиды HI Соли — иодиды —
Элементы VII группы ПСХЭ Символ элемента/ Характеристик а Фтор F Хлор CL Бром Br Иод I Астат At Порядковый номер, заряд ядра атома, количество электронов в атоме 9 +9 9 е 17 +17 17 е 35 +35 35 е 53 +53 53 е 85 +85 85 е Строение последнего энергоуровня 2 s 2 2 p 5 3 s 2 3 p 5 4 s 2 4 p 5 5 s 2 5 p 5 6 s 2 6 p 5 Степени окисления 0, -1 -1, 0, +1, +3, +5, +7 Соединения с кислородом — CL 2 O 7 Br 2 O 7 I 2 O 7 At 2 O 7 Соединения с водородом HF Соли — фториды HCL Соли — хлориды HBr Соли — бромиды HI Соли — иодиды —
 Элементы VII группы ПСХЭ отдельные представители HCLO – кислота хлорноватистая, соли – гипохлориты, слабая кислота HCLO 2 – кислота хлористая, соли – хлориты, слабый электролит HCLO 3 – хлорноватая кислота, соли — хлораты HCLO 4 – хлорная кислота, соли – перхлораты, сильная кислота
Элементы VII группы ПСХЭ отдельные представители HCLO – кислота хлорноватистая, соли – гипохлориты, слабая кислота HCLO 2 – кислота хлористая, соли – хлориты, слабый электролит HCLO 3 – хлорноватая кислота, соли — хлораты HCLO 4 – хлорная кислота, соли – перхлораты, сильная кислота
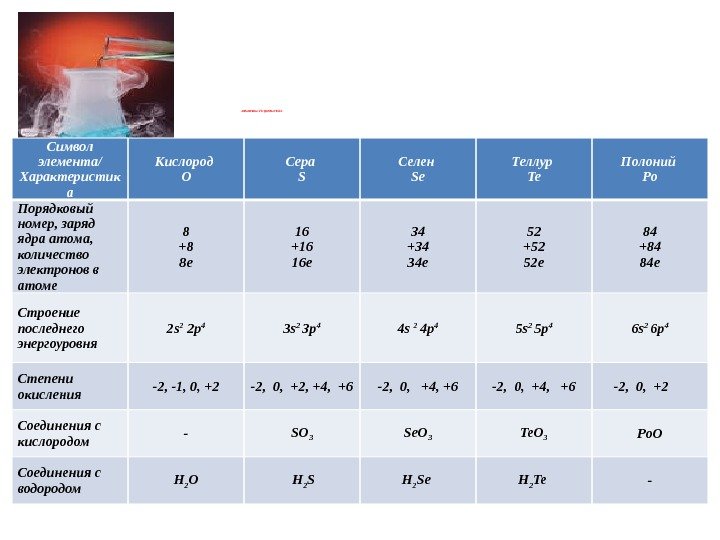
 Элементы VI группы ПСХЭ Символ элемента/ Характеристик а Кислород O Сера S Селен Se Теллур Te Полоний Po Порядковый номер, заряд ядра атома, количество электронов в атоме 8 +8 8 е 16 +16 16 е 34 +34 34 е 52 +52 52 е 84 +84 84 е Строение последнего энергоуровня 2 s 2 2 p 4 3 s 2 3 p 4 4 s 2 4 p 4 5 s 2 5 p 4 6 s 2 6 p 4 Степени окисления -2, -1, 0, +2 -2, 0, +2, +4, +6 -2, 0, +2 Соединения с кислородом — SO 3 Se. O 3 Te. O 3 Po. O Соединения с водородом H 2 O H 2 Se H 2 Te —
Элементы VI группы ПСХЭ Символ элемента/ Характеристик а Кислород O Сера S Селен Se Теллур Te Полоний Po Порядковый номер, заряд ядра атома, количество электронов в атоме 8 +8 8 е 16 +16 16 е 34 +34 34 е 52 +52 52 е 84 +84 84 е Строение последнего энергоуровня 2 s 2 2 p 4 3 s 2 3 p 4 4 s 2 4 p 4 5 s 2 5 p 4 6 s 2 6 p 4 Степени окисления -2, -1, 0, +2 -2, 0, +2, +4, +6 -2, 0, +2 Соединения с кислородом — SO 3 Se. O 3 Te. O 3 Po. O Соединения с водородом H 2 O H 2 Se H 2 Te —
 Элементы VI группы ПСХЭ отдельные представители H 2 S – сероводородная кислота, соли сульфиды, гидросульфиды H 2 SO 3 — сернистая кислота, соли – сульфиты, гидросульфиты H 2 SO 4 — серная кислота, соли – сульфаты, гидросульфаты
Элементы VI группы ПСХЭ отдельные представители H 2 S – сероводородная кислота, соли сульфиды, гидросульфиды H 2 SO 3 — сернистая кислота, соли – сульфиты, гидросульфиты H 2 SO 4 — серная кислота, соли – сульфаты, гидросульфаты
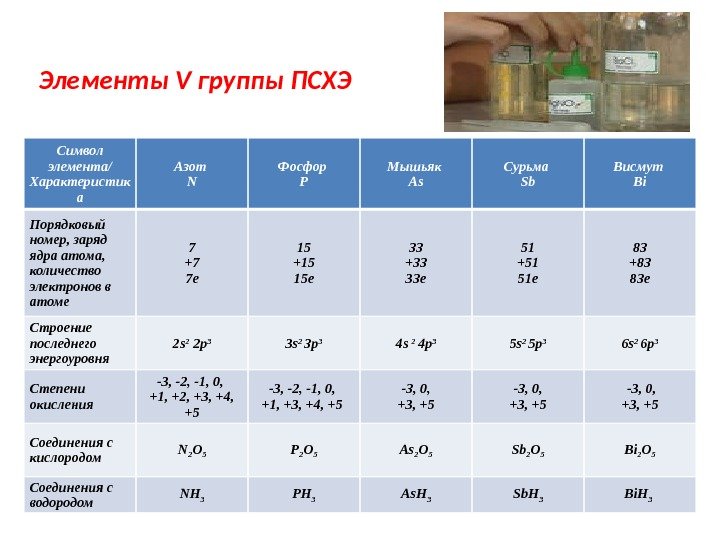
 Элементы V группы ПСХЭ Символ элемента/ Характеристик а Азот N Фосфор P Мышьяк As Сурьма Sb Висмут Bi Порядковый номер, заряд ядра атома, количество электронов в атоме 7 +7 7 е 15 +15 15 е 33 +33 33 е 51 +51 51 е 83 +83 83 е Строение последнего энергоуровня 2 s 2 2 p 3 3 s 2 3 p 3 4 s 2 4 p 3 5 s 2 5 p 3 6 s 2 6 p 3 Степени окисления -3, -2, -1, 0, +1, +2, +3, +4, +5 -3, -2, -1, 0, +1, +3, +4, +5 -3, 0, +3, +5 Соединения с кислородом N 2 O 5 P 2 O 5 As 2 O 5 Sb 2 O 5 Bi 2 O 5 Соединения с водородом NH 3 PH 3 As. H 3 Sb. H 3 Bi. H
Элементы V группы ПСХЭ Символ элемента/ Характеристик а Азот N Фосфор P Мышьяк As Сурьма Sb Висмут Bi Порядковый номер, заряд ядра атома, количество электронов в атоме 7 +7 7 е 15 +15 15 е 33 +33 33 е 51 +51 51 е 83 +83 83 е Строение последнего энергоуровня 2 s 2 2 p 3 3 s 2 3 p 3 4 s 2 4 p 3 5 s 2 5 p 3 6 s 2 6 p 3 Степени окисления -3, -2, -1, 0, +1, +2, +3, +4, +5 -3, -2, -1, 0, +1, +3, +4, +5 -3, 0, +3, +5 Соединения с кислородом N 2 O 5 P 2 O 5 As 2 O 5 Sb 2 O 5 Bi 2 O 5 Соединения с водородом NH 3 PH 3 As. H 3 Sb. H 3 Bi. H
 Элементы V группы ПСХЭ отдельные представители NH 3 – аммиак, водный раствор – NH 4 OH – нашатырный спирт, гидроксид аммония HNO 2 – азотистая кислота, соли – нитриты HNO 3 – азотная кислота, соли – нитраты Н 3 PO 4 – фосфорная кислота, соли – фосфаты, гидрофосфаты, дигидрофосфаты
Элементы V группы ПСХЭ отдельные представители NH 3 – аммиак, водный раствор – NH 4 OH – нашатырный спирт, гидроксид аммония HNO 2 – азотистая кислота, соли – нитриты HNO 3 – азотная кислота, соли – нитраты Н 3 PO 4 – фосфорная кислота, соли – фосфаты, гидрофосфаты, дигидрофосфаты
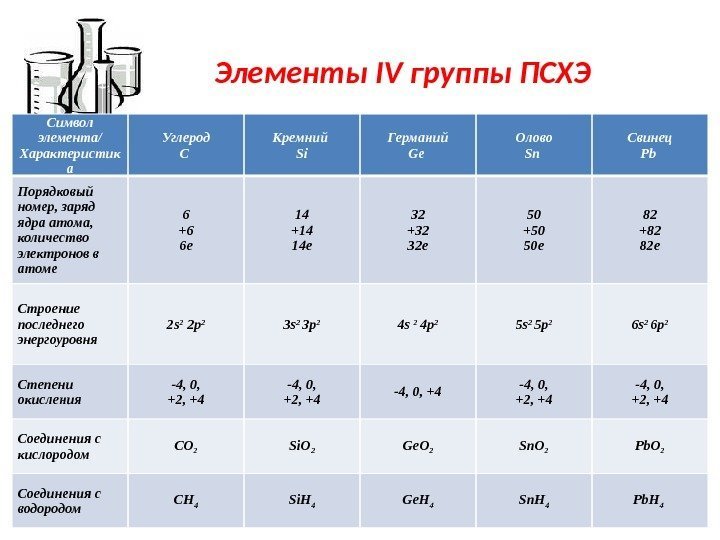
 Элементы IV группы ПСХЭ Символ элемента/ Характеристик а Углерод C Кремний Si Германий Ge Олово Sn Свинец Pb Порядковый номер, заряд ядра атома, количество электронов в атоме 6 +6 6 е 14 +14 14 е 32 +32 32 е 50 +50 50 е 82 +82 82 е Строение последнего энергоуровня 2 s 2 2 p 2 3 s 2 3 p 2 4 s 2 4 p 2 5 s 2 5 p 2 6 s 2 6 p 2 Степени окисления -4, 0, +2, +4 -4, 0, +2, +4 Соединения с кислородом CO 2 Si. O 2 Ge. O 2 Sn. O 2 Pb. O 2 Соединения с водородом CH 4 Si. H 4 Ge. H 4 Sn. H 4 Pb. H
Элементы IV группы ПСХЭ Символ элемента/ Характеристик а Углерод C Кремний Si Германий Ge Олово Sn Свинец Pb Порядковый номер, заряд ядра атома, количество электронов в атоме 6 +6 6 е 14 +14 14 е 32 +32 32 е 50 +50 50 е 82 +82 82 е Строение последнего энергоуровня 2 s 2 2 p 2 3 s 2 3 p 2 4 s 2 4 p 2 5 s 2 5 p 2 6 s 2 6 p 2 Степени окисления -4, 0, +2, +4 -4, 0, +2, +4 Соединения с кислородом CO 2 Si. O 2 Ge. O 2 Sn. O 2 Pb. O 2 Соединения с водородом CH 4 Si. H 4 Ge. H 4 Sn. H 4 Pb. H
 Элементы IV группы ПСХЭ отдельные представители CO – угарный газ CO 2 — углекислый газ H 2 CO 3 – угольная кислота, соли – карбонаты, гидрокарбонаты H 2 Si. O 3 – кремниевая кислота, соли – силикаты, гидросиликаты
Элементы IV группы ПСХЭ отдельные представители CO – угарный газ CO 2 — углекислый газ H 2 CO 3 – угольная кислота, соли – карбонаты, гидрокарбонаты H 2 Si. O 3 – кремниевая кислота, соли – силикаты, гидросиликаты
