Б-ОХ-М-Я НЕРВОВОп СИСТЕМИ ч.--.ppt
- Количество слайдов: 64
 Нейрохімія. Ч. ІІ Основи синаптичної передачі. Дія нейротропних сполук.
Нейрохімія. Ч. ІІ Основи синаптичної передачі. Дія нейротропних сполук.
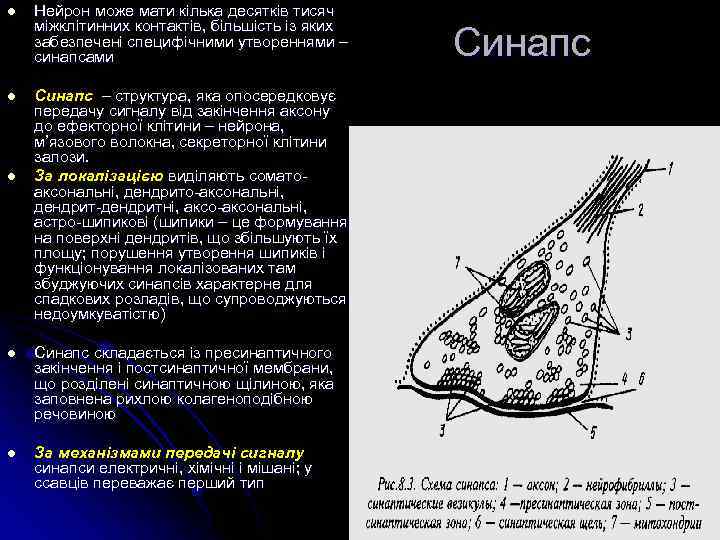 l l l Нейрон може мати кілька десятків тисяч міжклітинних контактів, більшість із яких забезпечені специфічними утвореннями – синапсами Синапс – структура, яка опосередковує передачу сигналу від закінчення аксону до ефекторної клітини – нейрона, м’язового волокна, секреторної клітини залози. За локалізацією виділяють соматоаксональні, дендрито-аксональні, дендрит-дендритні, аксо-аксональні, астро-шипикові (шипики – це формування на поверхні дендритів, що збільшують їх площу; порушення утворення шипиків і функціонування локалізованих там збуджуючих синапсів характерне для спадкових розладів, що супроводжуються недоумкуватістю) l Синапс складається із пресинаптичного закінчення і постсинаптичної мембрани, що розділені синаптичною щілиною, яка заповнена рихлою колагеноподібною речовиною l За механізмами передачі сигналу синапси електричні, хімічні і мішані; у ссавців переважає перший тип Синапс
l l l Нейрон може мати кілька десятків тисяч міжклітинних контактів, більшість із яких забезпечені специфічними утвореннями – синапсами Синапс – структура, яка опосередковує передачу сигналу від закінчення аксону до ефекторної клітини – нейрона, м’язового волокна, секреторної клітини залози. За локалізацією виділяють соматоаксональні, дендрито-аксональні, дендрит-дендритні, аксо-аксональні, астро-шипикові (шипики – це формування на поверхні дендритів, що збільшують їх площу; порушення утворення шипиків і функціонування локалізованих там збуджуючих синапсів характерне для спадкових розладів, що супроводжуються недоумкуватістю) l Синапс складається із пресинаптичного закінчення і постсинаптичної мембрани, що розділені синаптичною щілиною, яка заповнена рихлою колагеноподібною речовиною l За механізмами передачі сигналу синапси електричні, хімічні і мішані; у ссавців переважає перший тип Синапс
 Електричний синапс l В електричних синапсах потенціал дії пресинаптичного закінчення забезпечує струм, що деполяризує постсинаптичну мембрану. l Морфологічною основою для цього є дуже вузька синаптична щілина Морфологічною основою для цього є (щілинний контакт, 2 нм), що спричиняє міцне прилягання пре- і постсинаптичних мембран одна до одної. l Електричні синапси спостерігаються між нервовими клітинами, однотиповими за структурою і функціями l Функціональна роль електричних синапсів – здійснення миттєвої передачі сигналів (без синаптичної затримки), що забезпечує синхронізацію електричної активності групи нейронів; напр. , групи мотонейронів під час стрибка жаби або плавальних рухів риби 1) 2) 3) 4) Критерії електричної синаптичної передачі: Відсутність синаптичної затримки; Проведення збудження в обох напрямках; Незалежність від потенціалу пресинаптичної мембрани; Стійкість до змін концентрації іонів Са, Mg у середовищі, до асфіксії, низьких температур, деяких фармакологічних впливів
Електричний синапс l В електричних синапсах потенціал дії пресинаптичного закінчення забезпечує струм, що деполяризує постсинаптичну мембрану. l Морфологічною основою для цього є дуже вузька синаптична щілина Морфологічною основою для цього є (щілинний контакт, 2 нм), що спричиняє міцне прилягання пре- і постсинаптичних мембран одна до одної. l Електричні синапси спостерігаються між нервовими клітинами, однотиповими за структурою і функціями l Функціональна роль електричних синапсів – здійснення миттєвої передачі сигналів (без синаптичної затримки), що забезпечує синхронізацію електричної активності групи нейронів; напр. , групи мотонейронів під час стрибка жаби або плавальних рухів риби 1) 2) 3) 4) Критерії електричної синаптичної передачі: Відсутність синаптичної затримки; Проведення збудження в обох напрямках; Незалежність від потенціалу пресинаптичної мембрани; Стійкість до змін концентрації іонів Са, Mg у середовищі, до асфіксії, низьких температур, деяких фармакологічних впливів
 Хімічний синапс l В хімічному синапсі нервовий імпульс спричиняє звільнення із пресинаптичних закінчень хімічного посередника – нейромедіатора, який дифундує через синаптичну щілину (10 – 50 нм) і вступає у взаємодію із білками-рецепторами на постсинаптичній мембрані, в результаті чого відбувається генерація постсинаптичного потенціалу l Хімічні синапси є більш ефективними щодо односпрямованості проведення сигналу, його посилення, конвергенції багатьох сигналів на одній постсинаптичній клітині, пластичності передачі сигналів. l Пресинаптична мембрана в хімічному синапсі має специфічну потовщену ділянку – активну зону, яка розташована напроти рецепторів постсинаптичної мембрани. Лише в активних зонах мембрани здійснюється екзоцитоз нейромедіатора l Пресинаптична мембрана також містить потенціалзалежні Са-канали, причетні до екзоцитозу нейромедіатора, та рецептори до нейромедіатора, що виділяєтья для пригнічення секреції нових квантів за зворотним зв’язком l Хімічні синапси передають 2 типи сигналів – збуджуючі й гальмівні. l В збуджуючих синапсах нейромедіатор спричиняє у постсинаптичній мембрані В розвиток збуджуючого постсинаптичного потенціалу – локальну деполяризацію потенціалу – l В гальмівних синапсах розвивається гальмівний постсинаптичний потенціал – В локальна гіперполяризація
Хімічний синапс l В хімічному синапсі нервовий імпульс спричиняє звільнення із пресинаптичних закінчень хімічного посередника – нейромедіатора, який дифундує через синаптичну щілину (10 – 50 нм) і вступає у взаємодію із білками-рецепторами на постсинаптичній мембрані, в результаті чого відбувається генерація постсинаптичного потенціалу l Хімічні синапси є більш ефективними щодо односпрямованості проведення сигналу, його посилення, конвергенції багатьох сигналів на одній постсинаптичній клітині, пластичності передачі сигналів. l Пресинаптична мембрана в хімічному синапсі має специфічну потовщену ділянку – активну зону, яка розташована напроти рецепторів постсинаптичної мембрани. Лише в активних зонах мембрани здійснюється екзоцитоз нейромедіатора l Пресинаптична мембрана також містить потенціалзалежні Са-канали, причетні до екзоцитозу нейромедіатора, та рецептори до нейромедіатора, що виділяєтья для пригнічення секреції нових квантів за зворотним зв’язком l Хімічні синапси передають 2 типи сигналів – збуджуючі й гальмівні. l В збуджуючих синапсах нейромедіатор спричиняє у постсинаптичній мембрані В розвиток збуджуючого постсинаптичного потенціалу – локальну деполяризацію потенціалу – l В гальмівних синапсах розвивається гальмівний постсинаптичний потенціал – В локальна гіперполяризація
 Принципи вивільнення нейромедіатора l Процес звільнення нейромедіатора складається із окремих елементарних реакцій, кожна з яких є виходом одного кванту (порції) нейромедіатора реакцій, кожна з яких (кілька тисяч молекул нейромедіатора) l Коли до пресинаптичного закінчення не надходять нервові імпульси, кванти нейромедіатора також звільнюються, але з низькою швидкістю, відповіддю на що в постсинаптичній мембрані є виникнення мініатюрних потенціалів мембрані є виникнення кінцевої пластинки l Деполяризація пресинаптичної мембрани під час нервового імпульсу веде до практично синхронного вивільнення кількох сотен квантів нейромедіатора, в результаті чого виникає потенціал кінцевої пластинки, , в результаті чого виникає який при досягненні порогової амплітуди спричиняє генерацію який потенціалу дії в постсинаптичній клітині. l У синхронності вивільнення квантів нейромедіатора при цьому передбачають посиленний вхід іонів Са у клітину через потенціалзалежні Са-канали та NMDA-рецептори. l Квантовий вихід нейромедіатора зумовлений тим, що нейромедіатор у пресинаптичному волокні зберігається у синаптичних пухирцях діаметром волокні зберігається у 40 – 200 нм і оточених мембраною 4 -5 нм. Синаптичні пухирці розташовані біля пресинаптичної мембрани в ділянці “активної зони”. Там же розташовані потенціалзалежні Са-канали.
Принципи вивільнення нейромедіатора l Процес звільнення нейромедіатора складається із окремих елементарних реакцій, кожна з яких є виходом одного кванту (порції) нейромедіатора реакцій, кожна з яких (кілька тисяч молекул нейромедіатора) l Коли до пресинаптичного закінчення не надходять нервові імпульси, кванти нейромедіатора також звільнюються, але з низькою швидкістю, відповіддю на що в постсинаптичній мембрані є виникнення мініатюрних потенціалів мембрані є виникнення кінцевої пластинки l Деполяризація пресинаптичної мембрани під час нервового імпульсу веде до практично синхронного вивільнення кількох сотен квантів нейромедіатора, в результаті чого виникає потенціал кінцевої пластинки, , в результаті чого виникає який при досягненні порогової амплітуди спричиняє генерацію який потенціалу дії в постсинаптичній клітині. l У синхронності вивільнення квантів нейромедіатора при цьому передбачають посиленний вхід іонів Са у клітину через потенціалзалежні Са-канали та NMDA-рецептори. l Квантовий вихід нейромедіатора зумовлений тим, що нейромедіатор у пресинаптичному волокні зберігається у синаптичних пухирцях діаметром волокні зберігається у 40 – 200 нм і оточених мембраною 4 -5 нм. Синаптичні пухирці розташовані біля пресинаптичної мембрани в ділянці “активної зони”. Там же розташовані потенціалзалежні Са-канали.
 Схема життя синаптичних пухирців l Мембранні їх утворення формуються в апараті Гольджі тіла нейрону у вигляді порожніх пухирців; l Надалі порожні пухирці спрямовуються до пресинаптичної ділянки аксональним транспортом (є участь іонів Са); l У пресинаптичних ділянках за участю АТФ-залежних помп пухирці заповнюються нейромедіатором (ці помпи входять да складу мембрани пухирців). В цій же мембрані є Са-АТФаза, яка забезпечує поглинання пухирцями іонів Са. Окрім нейромедіатора пухирці містять АТФ та низку катіонів. р. Н внутрішнього середовища пухирця кисле (5, 5) і створюється протонною АТФазою. l В нервовому закінченні пухирці зв’язані із цитоскелетом і ролміщуються поблизу пресинаптичної мембрани. l При деполяризації ПМ (або без деполяризації – дуже повільно) шляхом екзоцитозу вміст пухирця виштовхується у синаптичну щілину, а мембранна складова шляхом ендоцитозу повертається у пресинаптичну ділянку, де відновлюється її структура і пухирець знову заповнюється нейромедіатором. Процеси ендо- і екзоцитозу повторюються. l Роль Са: коли нервовий імпульс досягає пресинаптичної мембрани, відкриваються потенціалзалежні Са-канали; кальцій накопичується у активній зоні (біля 100 мкмоль/л), що підвищує ймовірність злиття пухирців із ПМ і виходу нейромедіатору у синаптичну щілину. Білок мембрани пухирця синаптотагмін є “сенсором”, що реагує на підвищення вмісту кальцію
Схема життя синаптичних пухирців l Мембранні їх утворення формуються в апараті Гольджі тіла нейрону у вигляді порожніх пухирців; l Надалі порожні пухирці спрямовуються до пресинаптичної ділянки аксональним транспортом (є участь іонів Са); l У пресинаптичних ділянках за участю АТФ-залежних помп пухирці заповнюються нейромедіатором (ці помпи входять да складу мембрани пухирців). В цій же мембрані є Са-АТФаза, яка забезпечує поглинання пухирцями іонів Са. Окрім нейромедіатора пухирці містять АТФ та низку катіонів. р. Н внутрішнього середовища пухирця кисле (5, 5) і створюється протонною АТФазою. l В нервовому закінченні пухирці зв’язані із цитоскелетом і ролміщуються поблизу пресинаптичної мембрани. l При деполяризації ПМ (або без деполяризації – дуже повільно) шляхом екзоцитозу вміст пухирця виштовхується у синаптичну щілину, а мембранна складова шляхом ендоцитозу повертається у пресинаптичну ділянку, де відновлюється її структура і пухирець знову заповнюється нейромедіатором. Процеси ендо- і екзоцитозу повторюються. l Роль Са: коли нервовий імпульс досягає пресинаптичної мембрани, відкриваються потенціалзалежні Са-канали; кальцій накопичується у активній зоні (біля 100 мкмоль/л), що підвищує ймовірність злиття пухирців із ПМ і виходу нейромедіатору у синаптичну щілину. Білок мембрани пухирця синаптотагмін є “сенсором”, що реагує на підвищення вмісту кальцію
 Критерії нейромедиаторів l l l Пресинаптичні нервові волокна містять ферменти, необхідні для синтезу цієї речовини При подразненні нервів (деполяризації ПМ) ця речовина повинна виділятися, реагувати зі специфічним рецептором на постсинаптичній клітині і викликати біологічну реакцію Є механізми, які швидко припиняють дію цієї біологічної речовини Є дві основні групи нейромедіаторів: • Класичні нейромедіатори • Нейропептиди-нейромедіатори l l l Окрім нейромедіаторів, є група речовин-нейромодуляторів, які регулюють рівень синаптичної передачі. Пресинаптичні модулятори впливають на збудливість нервових закінчень, біосинтез нейромедіаторів, вхід Са в нервове закінчення та на ін етапи екзоцитозу Постсинаптичні модулятори змінюють афінність рецепторів або внутрішньоклітинні шляхи передачі сигналів від цих рецепторів.
Критерії нейромедиаторів l l l Пресинаптичні нервові волокна містять ферменти, необхідні для синтезу цієї речовини При подразненні нервів (деполяризації ПМ) ця речовина повинна виділятися, реагувати зі специфічним рецептором на постсинаптичній клітині і викликати біологічну реакцію Є механізми, які швидко припиняють дію цієї біологічної речовини Є дві основні групи нейромедіаторів: • Класичні нейромедіатори • Нейропептиди-нейромедіатори l l l Окрім нейромедіаторів, є група речовин-нейромодуляторів, які регулюють рівень синаптичної передачі. Пресинаптичні модулятори впливають на збудливість нервових закінчень, біосинтез нейромедіаторів, вхід Са в нервове закінчення та на ін етапи екзоцитозу Постсинаптичні модулятори змінюють афінність рецепторів або внутрішньоклітинні шляхи передачі сигналів від цих рецепторів.
 Нейропептиди l Мають у своєму складі від трьох до кількох десятків амінокислотних залишків. Функціонують лише у вищих відділах НС. l Всі нейропептиди за механізмом їх дії можна поділити на нейропептиди-нейромедіатори (речовина Р, вазоактивний інтестинальний пептид (ВІП), нейропептид Y, люліберин, опіоїдні пептиди, соматостатин) і нейропептиди) і нейромодулятори (АКТГ і його фрагменти, кортиколіберин, тиреоліберин, окситоцин, вазопресин, холецистокінін, бомбезин, галанін, нейротензин, ангіотензин, брадикінін, нейропептиди безхребетних, тощо)
Нейропептиди l Мають у своєму складі від трьох до кількох десятків амінокислотних залишків. Функціонують лише у вищих відділах НС. l Всі нейропептиди за механізмом їх дії можна поділити на нейропептиди-нейромедіатори (речовина Р, вазоактивний інтестинальний пептид (ВІП), нейропептид Y, люліберин, опіоїдні пептиди, соматостатин) і нейропептиди) і нейромодулятори (АКТГ і його фрагменти, кортиколіберин, тиреоліберин, окситоцин, вазопресин, холецистокінін, бомбезин, галанін, нейротензин, ангіотензин, брадикінін, нейропептиди безхребетних, тощо)
 Нейропептиди 1. Нейрогіпофізарні гормони (вазопресин, ліберини, статіни). Ці сполуки одночасно і гормони, і медіатори; 2. Гастроінтестинальні пептиди (гастрин, холецистокінін, речовина Р). 2. Гастрин спричиняє відчуття голоду, холецистокінін - відчуття насичення, а також стимулює скорочення жовчного міхура і функцію підшлункової залози. Речовина Р – збуджуючий нейромедіатор; крім того, може бути нейромодулятором 3. опіоїдні пептиди (або пептиди знеболення) – утворюються шляхом реакцій 3. обмеженого протеолізу білка-попередника проопіомеланокортину (ПОМК). Взаємодіють з тими ж рецепторами, що й опіати (напр. , морфін), завдяки чому імітують їх дію. Легко руйнуються протеїназами, тому їх фармакологічний ефект незначний; є гальмівними медіаторами. Це енкефаліни (метіонін-енкефалін та ; є лейцин-енкефалін) та ендорфіни (бета-ендорфін, динорфін та бетанеодинорфін). Вони беруть участь в індукції і модуляції процесів пам яті, сну, страху, ін. , у патогенезі шизофренії. Інактивуються протеолізом 4. пептиди сну. Їх молекулярна природа не встановлена. Лише відомо, що їх 4. введення тваринам спричиняє сон; 5. пептиди пам’яті (скотофобін). Накопичується у мозку щурів при тренуванні на 5. избегание темряви 6. пептиди - компоненти ренін-ангиотензинової системи. Показано, що 6. введення ангіотензину-II у центр спраги головного мозку спричиняє появу цього відчуття і стимулює секрецію антидіуретичного гормону.
Нейропептиди 1. Нейрогіпофізарні гормони (вазопресин, ліберини, статіни). Ці сполуки одночасно і гормони, і медіатори; 2. Гастроінтестинальні пептиди (гастрин, холецистокінін, речовина Р). 2. Гастрин спричиняє відчуття голоду, холецистокінін - відчуття насичення, а також стимулює скорочення жовчного міхура і функцію підшлункової залози. Речовина Р – збуджуючий нейромедіатор; крім того, може бути нейромодулятором 3. опіоїдні пептиди (або пептиди знеболення) – утворюються шляхом реакцій 3. обмеженого протеолізу білка-попередника проопіомеланокортину (ПОМК). Взаємодіють з тими ж рецепторами, що й опіати (напр. , морфін), завдяки чому імітують їх дію. Легко руйнуються протеїназами, тому їх фармакологічний ефект незначний; є гальмівними медіаторами. Це енкефаліни (метіонін-енкефалін та ; є лейцин-енкефалін) та ендорфіни (бета-ендорфін, динорфін та бетанеодинорфін). Вони беруть участь в індукції і модуляції процесів пам яті, сну, страху, ін. , у патогенезі шизофренії. Інактивуються протеолізом 4. пептиди сну. Їх молекулярна природа не встановлена. Лише відомо, що їх 4. введення тваринам спричиняє сон; 5. пептиди пам’яті (скотофобін). Накопичується у мозку щурів при тренуванні на 5. избегание темряви 6. пептиди - компоненти ренін-ангиотензинової системи. Показано, що 6. введення ангіотензину-II у центр спраги головного мозку спричиняє появу цього відчуття і стимулює секрецію антидіуретичного гормону.
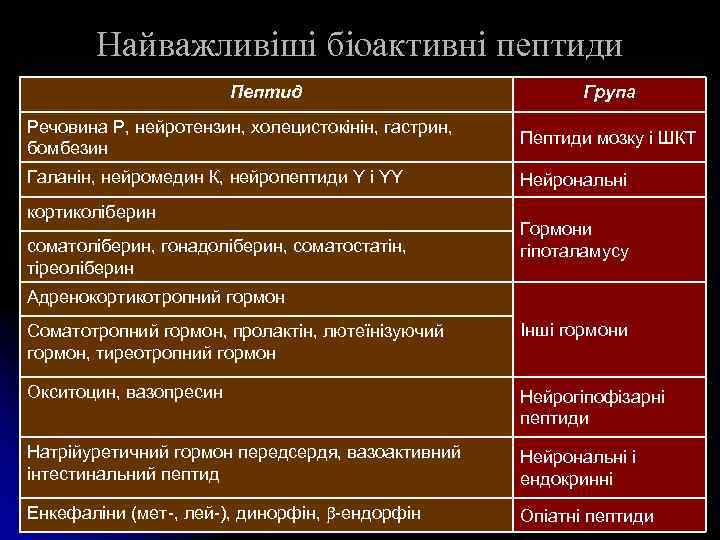 Найважливіші біоактивні пептиди Пептид Група Речовина Р, нейротензин, холецистокінін, гастрин, бомбезин Пептиди мозку і ШКТ Галанін, нейромедин К, нейропептиди Y і YY Нейрональні кортиколіберин соматоліберин, гонадоліберин, соматостатін, тіреоліберин Гормони гіпоталамусу Адренокортикотропний гормон Соматотропний гормон, пролактін, лютеїнізуючий гормон, тиреотропний гормон Інші гормони Окситоцин, вазопресин Нейрогіпофізарні пептиди Натрійуретичний гормон передсердя, вазоактивний інтестинальний пептид Нейрональні і ендокринні Енкефаліни (мет-, лей-), динорфін, -ендорфін Опіатні пептиди
Найважливіші біоактивні пептиди Пептид Група Речовина Р, нейротензин, холецистокінін, гастрин, бомбезин Пептиди мозку і ШКТ Галанін, нейромедин К, нейропептиди Y і YY Нейрональні кортиколіберин соматоліберин, гонадоліберин, соматостатін, тіреоліберин Гормони гіпоталамусу Адренокортикотропний гормон Соматотропний гормон, пролактін, лютеїнізуючий гормон, тиреотропний гормон Інші гормони Окситоцин, вазопресин Нейрогіпофізарні пептиди Натрійуретичний гормон передсердя, вазоактивний інтестинальний пептид Нейрональні і ендокринні Енкефаліни (мет-, лей-), динорфін, -ендорфін Опіатні пептиди
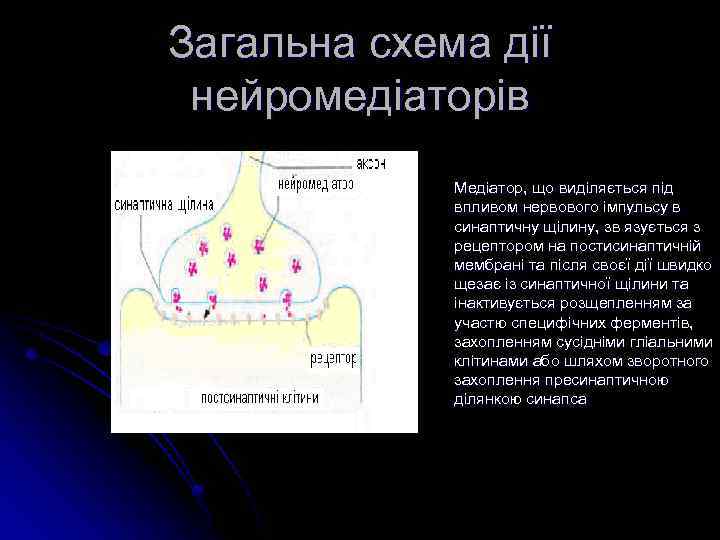 Загальна схема дії нейромедіаторів Медіатор, що виділяється під впливом нервового імпульсу в синаптичну щілину, зв язується з рецептором на постисинаптичній мембрані та після своєї дії швидко щезає із синаптичної щілини та інактивується розщепленням за участю специфічних ферментів, захопленням сусідніми гліальними клітинами або шляхом зворотного захоплення пресинаптичною ділянкою синапса
Загальна схема дії нейромедіаторів Медіатор, що виділяється під впливом нервового імпульсу в синаптичну щілину, зв язується з рецептором на постисинаптичній мембрані та після своєї дії швидко щезає із синаптичної щілини та інактивується розщепленням за участю специфічних ферментів, захопленням сусідніми гліальними клітинами або шляхом зворотного захоплення пресинаптичною ділянкою синапса
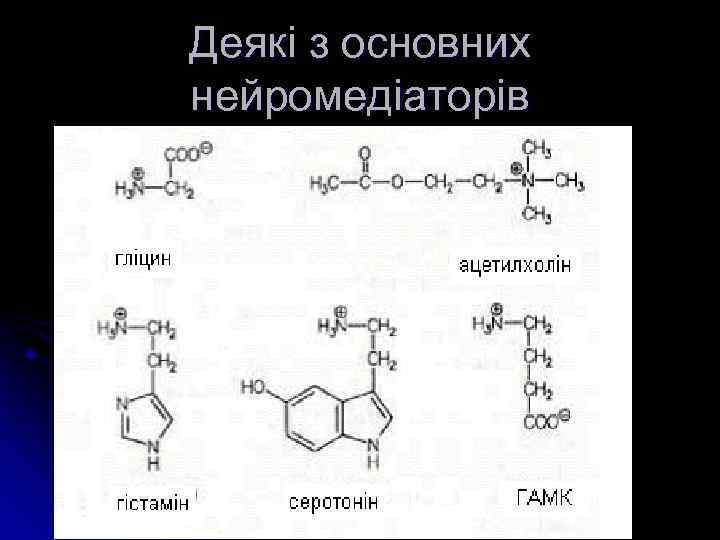
 Основні нейромедіатори Система Холінергічна Амінокислотоергічна Моноамінергічна • Катехоламіни • Індоламіни • інші Пуринергічна Медіатор АХ ГАМК, аспарагінова й глутамінова к-ти, гліцин, гомоцистеїн дофамін, норепінефрин (НА), епінефрин (адреналін) триптамін, серотонін гістамін, таурин аденозин, АДФ, АМФ, АТФ
Основні нейромедіатори Система Холінергічна Амінокислотоергічна Моноамінергічна • Катехоламіни • Індоламіни • інші Пуринергічна Медіатор АХ ГАМК, аспарагінова й глутамінова к-ти, гліцин, гомоцистеїн дофамін, норепінефрин (НА), епінефрин (адреналін) триптамін, серотонін гістамін, таурин аденозин, АДФ, АМФ, АТФ
 Деякі з основних нейромедіаторів
Деякі з основних нейромедіаторів
 Найважливіші нейромедіатори - характеристика l Ацетилхолін найбільше присутній у корі головного мозку, таламусі, передніх буграх чотиригорб’я, в мосту; м. б. як збуджуючим, так і гальмівним нейромедіатором. Токсин ботулізму гальмує пресинаптичне вивільнення АХ, зв язуючись із гангліозидами мембран. Після дисоціації із комплексу з рецептором АХ інактивується при дії АХ-естерази; холін, який при цьому утворюється, поглинається пресинаптичною мембраною і служить для ресинтезу АХ. Фосфорорганічні речовини (хлорофос, дихлофос, метафос, карбофос) ковалентно зв язуються із гідроксилом серину активного центру, що зумовлює незворотнє гальмування АХ-естерази; аналогічно діє низка інших інсектицидів, пестицидів та нервово-паралітичних отрут (зарин, табун). Інші інгібітори ферменту - прозерин, фізоостигмін, галантамін - утворюють проміжний карбамоїл-ферментний комплекс, який дуже повільно гідролізується, та зворотно інактивують фермент. Ці сполуки застосовують для посилення чи збільшення тривалості дії АХ l Глутамінова кислота, як і інша - аспарагінова к-та - збуджуючий нейромедіатор. Видалення глутамату із синаптичної щілини відбувається за участю гліальних клітин, фермент яких – глутаміназа – перетворює його на глутамін. l Вміст гліцину - гальмівного нейромедіатору - у спинному та довгастому мозку у - 3 -5 разів вищий, ніж у інших відділах. Токсин правцю пригнічує вивільнення гліцину . із нервового закінчення у синаптичну щілину і зумовлює різке посилення процесів збудження в ЦНС, зокрема, мотонейронів, що проявляється судомами.
Найважливіші нейромедіатори - характеристика l Ацетилхолін найбільше присутній у корі головного мозку, таламусі, передніх буграх чотиригорб’я, в мосту; м. б. як збуджуючим, так і гальмівним нейромедіатором. Токсин ботулізму гальмує пресинаптичне вивільнення АХ, зв язуючись із гангліозидами мембран. Після дисоціації із комплексу з рецептором АХ інактивується при дії АХ-естерази; холін, який при цьому утворюється, поглинається пресинаптичною мембраною і служить для ресинтезу АХ. Фосфорорганічні речовини (хлорофос, дихлофос, метафос, карбофос) ковалентно зв язуються із гідроксилом серину активного центру, що зумовлює незворотнє гальмування АХ-естерази; аналогічно діє низка інших інсектицидів, пестицидів та нервово-паралітичних отрут (зарин, табун). Інші інгібітори ферменту - прозерин, фізоостигмін, галантамін - утворюють проміжний карбамоїл-ферментний комплекс, який дуже повільно гідролізується, та зворотно інактивують фермент. Ці сполуки застосовують для посилення чи збільшення тривалості дії АХ l Глутамінова кислота, як і інша - аспарагінова к-та - збуджуючий нейромедіатор. Видалення глутамату із синаптичної щілини відбувається за участю гліальних клітин, фермент яких – глутаміназа – перетворює його на глутамін. l Вміст гліцину - гальмівного нейромедіатору - у спинному та довгастому мозку у - 3 -5 разів вищий, ніж у інших відділах. Токсин правцю пригнічує вивільнення гліцину . із нервового закінчення у синаптичну щілину і зумовлює різке посилення процесів збудження в ЦНС, зокрема, мотонейронів, що проявляється судомами.
 Найважливіші нейромедіатори - характеристика (продовження) l l l Найменший вміст норадреналіну – у корі головного мозку; в 2 -4 рази більше його у базальних ядрах, середньому та довгастому мозку і мості; в 5 -10 разів більше – у гіпоталамусі та ряді ядер проміжного мозку. Він м. б. як збуджуючим, так і гальмівним м. б. медіатором. Трициклічні антидепресанти блокують видалення НА із синаптичної щілини медіатором. - це застосовується при лікуванні депресивних станів. Аналогічне значення мають інгібітори моноаміноксидази - фермента, який інактивує НА. Гіпотензивні лікарські засоби (напр. , альфа-метилдофа) під впливом ферментів нейрону перетворюються на сполуки, подібні до норадреналіну за своєю будовою. Ці “несправжні” медіатори накопичуються й виділяються разом із справжніми та знижують їх ефект. Резерпін - інший засіб для зниження артеріального тиску, який застосовують при лікуванні гіпертонії - специфічно гальмує процес переносу катехоламінів у гранули нейронів, через що вони стають доступними для інактивації моноаміноксидазою На серотонін багаті довгастий мозок, міст, середній мозок, таламус та гіпоталамус; бідні – базальні ядра, кора на півкуль та мозочок. Він регулює такі психомоторні реакції, як тривога, агресивність, імпульсивні потяги, контроль фізіологічного сну - це т. зв. “нейромедіатор гарного самопочуття”. Дефіцит серотоніну в ГМ виявляють у хворих із важкими депресіями, що здійснювали самогубства, у людей, схильних до алкоголізму. наркоманії. Інгібітори видалення серотоніну і його інактивації - аналогічно до НА ГАМК - гальмівний медіатор ЦНС; інактивується ГАМК-амінотрансферазою або - зворотнім поглинанням нейромедіатора пресинаптичною мембраною
Найважливіші нейромедіатори - характеристика (продовження) l l l Найменший вміст норадреналіну – у корі головного мозку; в 2 -4 рази більше його у базальних ядрах, середньому та довгастому мозку і мості; в 5 -10 разів більше – у гіпоталамусі та ряді ядер проміжного мозку. Він м. б. як збуджуючим, так і гальмівним м. б. медіатором. Трициклічні антидепресанти блокують видалення НА із синаптичної щілини медіатором. - це застосовується при лікуванні депресивних станів. Аналогічне значення мають інгібітори моноаміноксидази - фермента, який інактивує НА. Гіпотензивні лікарські засоби (напр. , альфа-метилдофа) під впливом ферментів нейрону перетворюються на сполуки, подібні до норадреналіну за своєю будовою. Ці “несправжні” медіатори накопичуються й виділяються разом із справжніми та знижують їх ефект. Резерпін - інший засіб для зниження артеріального тиску, який застосовують при лікуванні гіпертонії - специфічно гальмує процес переносу катехоламінів у гранули нейронів, через що вони стають доступними для інактивації моноаміноксидазою На серотонін багаті довгастий мозок, міст, середній мозок, таламус та гіпоталамус; бідні – базальні ядра, кора на півкуль та мозочок. Він регулює такі психомоторні реакції, як тривога, агресивність, імпульсивні потяги, контроль фізіологічного сну - це т. зв. “нейромедіатор гарного самопочуття”. Дефіцит серотоніну в ГМ виявляють у хворих із важкими депресіями, що здійснювали самогубства, у людей, схильних до алкоголізму. наркоманії. Інгібітори видалення серотоніну і його інактивації - аналогічно до НА ГАМК - гальмівний медіатор ЦНС; інактивується ГАМК-амінотрансферазою або - зворотнім поглинанням нейромедіатора пресинаптичною мембраною
 Найважливіші нейромедіатори - характеристика (продовження) l Дофамін в незначній кількості містять всі ділянки мозку; високий його вміст характерний для хвостатого ядра, чорної субстанції, шкарлупи. Він також м. б. як збуджуючим, так і гальмівним медіатором. При деяких формах шизофренії виявляють гіперактивацію дофамінового апарату хвостатих ядер, яка спричиняє т. зв. синдром стереотипної поведінки. Інші форми цього захворювання, пов язані з гіперактивацією мезолімбічного дофамінового апарату, є основою психозоподібних станів. Для лікування цих станів застосовують нейролептики, напр. , галоперидол, який блокує дофамінові рецептори. При недостатності дофамінового апарату у хвостатих ядрах виникає паркінсонічний синдром. Він м. б. наслідком ушкодження джерела дофаміну - нейронів чорної субстанції, або виникати вторинно - як наслідок лікування галоперидолом шизофренії. Останніми роками доведено роль в розвитку хв. Паркінсона загибелі нейронів чорної субстанції шляхом апоптозу l В низці нейронів роль медіатора виконують таурин і бета-аланін (гальм. ), і аденозин, гістамін, оксид азоту тощо. Таурин – синтезується із цистеїну, це , . незвична амінокислота, в якій замість карбоксильної групи присутній залишок сірчаної кислоти. Залучений у проведення нервового імпульсу під час зорового сприйняття
Найважливіші нейромедіатори - характеристика (продовження) l Дофамін в незначній кількості містять всі ділянки мозку; високий його вміст характерний для хвостатого ядра, чорної субстанції, шкарлупи. Він також м. б. як збуджуючим, так і гальмівним медіатором. При деяких формах шизофренії виявляють гіперактивацію дофамінового апарату хвостатих ядер, яка спричиняє т. зв. синдром стереотипної поведінки. Інші форми цього захворювання, пов язані з гіперактивацією мезолімбічного дофамінового апарату, є основою психозоподібних станів. Для лікування цих станів застосовують нейролептики, напр. , галоперидол, який блокує дофамінові рецептори. При недостатності дофамінового апарату у хвостатих ядрах виникає паркінсонічний синдром. Він м. б. наслідком ушкодження джерела дофаміну - нейронів чорної субстанції, або виникати вторинно - як наслідок лікування галоперидолом шизофренії. Останніми роками доведено роль в розвитку хв. Паркінсона загибелі нейронів чорної субстанції шляхом апоптозу l В низці нейронів роль медіатора виконують таурин і бета-аланін (гальм. ), і аденозин, гістамін, оксид азоту тощо. Таурин – синтезується із цистеїну, це , . незвична амінокислота, в якій замість карбоксильної групи присутній залишок сірчаної кислоти. Залучений у проведення нервового імпульсу під час зорового сприйняття
 Пуринові нейромедіатори: аденозин l l l Аденозин як інгібуючий нейромодулятор ЦНС: пресинаптично аденозин інгібує звільнення різних трансміттерів, включаючи глутамат і ГАМК, тоді як постсинаптично його інгібуючі дії опосередковані аденілатциклазою Шляхи позаклітинного утворення аденозину в ЦНС: Катаболізм позаклітинних АТФ й АДФ за послідовною участю ектоферментів ектонуклеозидтрифосфат-дифосфогідролази 1 (гідролізує АТФ й АДФ до АМФ) й екто-5′-нуклеотидази (дефосфорилює АМФ до аденозину). Внутрішньоклітинний аденозин, транспортований Na+-залежним транспортером нуклеотидів. Утворення аденозину в клітині: l Дві розчинні 5’-нуклеотидази: IMФ-чутлива (субстрат – ІМФ) і АМФ-чутлива (основний субстрат – АМФ, що утворюється при дефосфорилюванні АДФ і АТФ). l Гідроліз S-аденозилгомоцистеїну відповідною гідролазою Внутрішньоклітинний аденозин бере участь в різних метаболічних реакціях, або перетворюється на інозин, гіпоксантин, ксантин й сечову кислоту Звільнення аденозину пресинаптичною мембраною l Аденозин може звільнюватися у відповідь на такі стимули, як висока концентрація іонів К, електрична стимуляція, агоністи глутаматних рецепторів, гіпоксія, гіпоглікемія та ішемія. l Внутрішньоклітинні ефекти аденозину опосередковані 4 -ма підтипами пуринових рецепторів, поєднаними з G-білками (A 1, A 2 A, A 2 B, A 3).
Пуринові нейромедіатори: аденозин l l l Аденозин як інгібуючий нейромодулятор ЦНС: пресинаптично аденозин інгібує звільнення різних трансміттерів, включаючи глутамат і ГАМК, тоді як постсинаптично його інгібуючі дії опосередковані аденілатциклазою Шляхи позаклітинного утворення аденозину в ЦНС: Катаболізм позаклітинних АТФ й АДФ за послідовною участю ектоферментів ектонуклеозидтрифосфат-дифосфогідролази 1 (гідролізує АТФ й АДФ до АМФ) й екто-5′-нуклеотидази (дефосфорилює АМФ до аденозину). Внутрішньоклітинний аденозин, транспортований Na+-залежним транспортером нуклеотидів. Утворення аденозину в клітині: l Дві розчинні 5’-нуклеотидази: IMФ-чутлива (субстрат – ІМФ) і АМФ-чутлива (основний субстрат – АМФ, що утворюється при дефосфорилюванні АДФ і АТФ). l Гідроліз S-аденозилгомоцистеїну відповідною гідролазою Внутрішньоклітинний аденозин бере участь в різних метаболічних реакціях, або перетворюється на інозин, гіпоксантин, ксантин й сечову кислоту Звільнення аденозину пресинаптичною мембраною l Аденозин може звільнюватися у відповідь на такі стимули, як висока концентрація іонів К, електрична стимуляція, агоністи глутаматних рецепторів, гіпоксія, гіпоглікемія та ішемія. l Внутрішньоклітинні ефекти аденозину опосередковані 4 -ма підтипами пуринових рецепторів, поєднаними з G-білками (A 1, A 2 A, A 2 B, A 3).
 Шляхи інактивації позаклітинного аденозину l Поглинання аденозину постсинаптичним нейроном або сусідніми клітинами з наступним фосфорилюванням до АМФ аденозинкіназою (АК) або до АМФ дезамінуванням до інозину аденозиндезаміназою (ADA). Інозин надалі підлягає перетворенню на гіпоксантин, який або трансформується у сечову кислоту – кінцевий продукт пуринового обміну (фермент ксантиноксидаза), або використовується для синтезу мононуклеотидів (фермент гіпоксантин-гуанін фосфорибозилтрансфераза) У 1980 р було охарактеризовано два відмінні типи нуклеотидних транспортерів: - рівноважні (equilibrative) нуклеотидні транспортери, що переносять - як пуринові, так і піримідинові нуклеотиди через мембрани в будь-якому напрямку за їх концентраційним градієнтом (полегшена дифузія); - концентруючі (concentrative) нуклеотидні транспортери, що - опосередковують котранспорт нуклеотидів із іонами натрію за градієнтом останніх (вторинно-активний транспорт) В ЦНС домінантним є перший тип транспортерів. l l Зворотня реакція, що каталізується SAH-гідролазою з утворенням Sаденозилгомоцистеїну із аденозину й l-гомоцистеїну. Вміст останньої сполуки лімітує цей шлях і, оскільки її рівні в мозку є дуже низькими, цей шлях є мінорним у метаболізмі аденозину в тканинах мозку за фізіологічних умов
Шляхи інактивації позаклітинного аденозину l Поглинання аденозину постсинаптичним нейроном або сусідніми клітинами з наступним фосфорилюванням до АМФ аденозинкіназою (АК) або до АМФ дезамінуванням до інозину аденозиндезаміназою (ADA). Інозин надалі підлягає перетворенню на гіпоксантин, який або трансформується у сечову кислоту – кінцевий продукт пуринового обміну (фермент ксантиноксидаза), або використовується для синтезу мононуклеотидів (фермент гіпоксантин-гуанін фосфорибозилтрансфераза) У 1980 р було охарактеризовано два відмінні типи нуклеотидних транспортерів: - рівноважні (equilibrative) нуклеотидні транспортери, що переносять - як пуринові, так і піримідинові нуклеотиди через мембрани в будь-якому напрямку за їх концентраційним градієнтом (полегшена дифузія); - концентруючі (concentrative) нуклеотидні транспортери, що - опосередковують котранспорт нуклеотидів із іонами натрію за градієнтом останніх (вторинно-активний транспорт) В ЦНС домінантним є перший тип транспортерів. l l Зворотня реакція, що каталізується SAH-гідролазою з утворенням Sаденозилгомоцистеїну із аденозину й l-гомоцистеїну. Вміст останньої сполуки лімітує цей шлях і, оскільки її рівні в мозку є дуже низькими, цей шлях є мінорним у метаболізмі аденозину в тканинах мозку за фізіологічних умов
 Пуринові нейромедіатори: АТФ l Перші дані про те, що ATФ може бути нейромедіатором, з’явилися ще в 1954 р, завдяки даним Holton. Підтвердженням цього є : l Синтез і накопичення ATP у нервових закінченнях; l звільнення ATP при нервовій стимуляції; l Імітування відповіді на нервову стимуляцію введенням АТФ; l Існування механізмів позаклітинного руйнування ATP (екто-АТФази); l ATФ може звільнюватися нейронами як нейротрансмітер або як як котрансмітер, генеруючи збуджуючу відповідь в різних ділянках ЦНС через вплив на специфічні нуклеотидні рецептори (P 2 -рецептори)). на l В багатьох системах АТФ також проявляє інгібіторні ефекти на синаптичні функції, що зумовлено активацією аденозинових рецепторів; АТФ може як безпосередньо взаємодіяти з останніми, так і після того, як перетвориться на аденозин в процесі метаболізму l Якщо нейрон має і аденозинові рецептори, і рецептори до АТФ, АТФ буде давати швидке, але нетривале збудження із наступним тривалим інгібуванням.
Пуринові нейромедіатори: АТФ l Перші дані про те, що ATФ може бути нейромедіатором, з’явилися ще в 1954 р, завдяки даним Holton. Підтвердженням цього є : l Синтез і накопичення ATP у нервових закінченнях; l звільнення ATP при нервовій стимуляції; l Імітування відповіді на нервову стимуляцію введенням АТФ; l Існування механізмів позаклітинного руйнування ATP (екто-АТФази); l ATФ може звільнюватися нейронами як нейротрансмітер або як як котрансмітер, генеруючи збуджуючу відповідь в різних ділянках ЦНС через вплив на специфічні нуклеотидні рецептори (P 2 -рецептори)). на l В багатьох системах АТФ також проявляє інгібіторні ефекти на синаптичні функції, що зумовлено активацією аденозинових рецепторів; АТФ може як безпосередньо взаємодіяти з останніми, так і після того, як перетвориться на аденозин в процесі метаболізму l Якщо нейрон має і аденозинові рецептори, і рецептори до АТФ, АТФ буде давати швидке, але нетривале збудження із наступним тривалим інгібуванням.
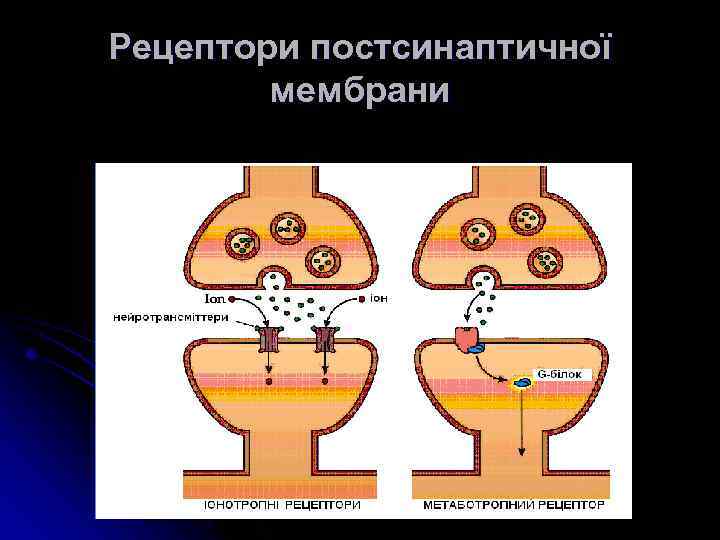 Рецептори постсинаптичної мембрани
Рецептори постсинаптичної мембрани
 Іоно- і метаботропні рецептори l Основою всіх іонотропних рецепторів є великий білок, що складається із 5 -ти Основою всіх (рідше – 4 -х) с/о, М. м. кожної с/о 40 -70 к. Да. Субодиниці рецептора пронизують мембрану, створюючи канал для іонів. Первинна структура всіх іонотропних рецепторів має велику ступінь гомології (20 -60%), що вказує на загальне еволюційне походження. Деякі іонотропні рецептори мають кілька підтипів через різне поєднання с/о l Метаботропні рецептори представлені великими поліпептидами, амінокислотні ланцюги яких 7 разів перетинають ПМ. При зв’язуванні ліганду вони змінюють свою конформацію, щр спричиняє відповідні зміни у конформації сполученого з рецептором G-білка, які, в свою чергу, ведуть до активації чи інгібування ферменту, функцією якого є синтез молекул вторинного месенджера.
Іоно- і метаботропні рецептори l Основою всіх іонотропних рецепторів є великий білок, що складається із 5 -ти Основою всіх (рідше – 4 -х) с/о, М. м. кожної с/о 40 -70 к. Да. Субодиниці рецептора пронизують мембрану, створюючи канал для іонів. Первинна структура всіх іонотропних рецепторів має велику ступінь гомології (20 -60%), що вказує на загальне еволюційне походження. Деякі іонотропні рецептори мають кілька підтипів через різне поєднання с/о l Метаботропні рецептори представлені великими поліпептидами, амінокислотні ланцюги яких 7 разів перетинають ПМ. При зв’язуванні ліганду вони змінюють свою конформацію, щр спричиняє відповідні зміни у конформації сполученого з рецептором G-білка, які, в свою чергу, ведуть до активації чи інгібування ферменту, функцією якого є синтез молекул вторинного месенджера.

 Агоніст, антагоніст, інвертивний агоніст, збуджуючі і гальмівні синапси l Агоніст – ініціює нормальні ефекти рецептора l Антагоніст – блокує рецептор від активації іншими лігандами l Інвертивний агоніст – ініціює ефекти, які є протилежними нормальним функціям рецептору l Міжнейрональні хімічні синапси поділяються на збуджуючі (сприяють поділяються на генерації нових імпульсів) і гальмівні (приводять до зняття ефектів генерації нових імпульсів) і сигналів, які надійшли). Цей поділ значною мірою визначається природою рецепторів: часто 1 Цей поділ значною мірою визначається природою рецепторів: і той же нейромедіатор може бути і збуджуючим, і гальмівним, залежно від природи рецептора (АХ в різних типах мускаринового рецептору, аденозин – в різних типах аденозинового) l
Агоніст, антагоніст, інвертивний агоніст, збуджуючі і гальмівні синапси l Агоніст – ініціює нормальні ефекти рецептора l Антагоніст – блокує рецептор від активації іншими лігандами l Інвертивний агоніст – ініціює ефекти, які є протилежними нормальним функціям рецептору l Міжнейрональні хімічні синапси поділяються на збуджуючі (сприяють поділяються на генерації нових імпульсів) і гальмівні (приводять до зняття ефектів генерації нових імпульсів) і сигналів, які надійшли). Цей поділ значною мірою визначається природою рецепторів: часто 1 Цей поділ значною мірою визначається природою рецепторів: і той же нейромедіатор може бути і збуджуючим, і гальмівним, залежно від природи рецептора (АХ в різних типах мускаринового рецептору, аденозин – в різних типах аденозинового) l
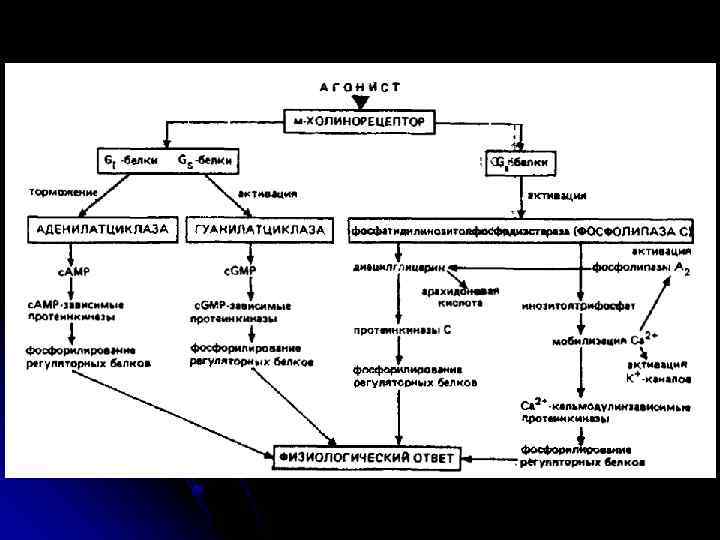
 Рецептори постсинаптичної мембрани Зв’язування медіатора з рецептором викликає ряд складних реакцій, наслідком яких є деполяризація або гіперполяризація мембрани нервової клітини. l Рецептори до АХ - 2 типи: нікотиновий (ефект медіатора імітується нікотином) і : мускариновий (мускарином). н-ХР – іонотропний (пропускає іони Na і К у (мускарином). – співвідношенні 100: 85), збуджуючий; найважливіша роль – у м язах. Отрута кураре і , роль – у м язах. нейротоксини змій зв язують н-ХР і конкурентно блокують дію АХ із одночасним розвитком паралічу і опосередковують швидкі і нетривалі ефекти; м-ХР – метаботропні, ; – можуть буди як збуджуючими, так і гальмівними (є М 1 і М 2 рецептори, які сполучені з буди різними G-білками), специфічно блокуються атропіном і скополаміном – при цьому і порушується пізнавальна здатність; вони реагують більш повільно і тривало. При міастенії гравіс - аутоімунному захворюванні - в організмі виробляються антитіла до холінорецептору м язового волокна; реакція антитіл з рецепторами прискорює розпад молекул останніх протеолітичними ферментами, що викликає зменшення числа рецепторів на постсинаптичній мембрані більш ніж на 70% l Рецептори до катехоламінів - це α-1 -, α-2 -, β-1 - і β-2 -адренорецептори. Вони поєднані з регуляторним G-білком (Gi , Gs або Gq). Бета-1 - і бета-2). i , адренорецептори активують аденілатциклазу, альфа-2 -адренорецептори інгібують , її. Альфа-1 -адренорецептори діють не через ц. АМФ, а через фосфоліпазу С, І-1, 4, 5її. трифосфат, змінюючи концентрацію в клітині Са, і ДАГ. Агоністи катехоламінів застосовують для лікування астми. Антагоністи використовують для лікування гіпертензії, стенокардії, інфаркту міокарда
Рецептори постсинаптичної мембрани Зв’язування медіатора з рецептором викликає ряд складних реакцій, наслідком яких є деполяризація або гіперполяризація мембрани нервової клітини. l Рецептори до АХ - 2 типи: нікотиновий (ефект медіатора імітується нікотином) і : мускариновий (мускарином). н-ХР – іонотропний (пропускає іони Na і К у (мускарином). – співвідношенні 100: 85), збуджуючий; найважливіша роль – у м язах. Отрута кураре і , роль – у м язах. нейротоксини змій зв язують н-ХР і конкурентно блокують дію АХ із одночасним розвитком паралічу і опосередковують швидкі і нетривалі ефекти; м-ХР – метаботропні, ; – можуть буди як збуджуючими, так і гальмівними (є М 1 і М 2 рецептори, які сполучені з буди різними G-білками), специфічно блокуються атропіном і скополаміном – при цьому і порушується пізнавальна здатність; вони реагують більш повільно і тривало. При міастенії гравіс - аутоімунному захворюванні - в організмі виробляються антитіла до холінорецептору м язового волокна; реакція антитіл з рецепторами прискорює розпад молекул останніх протеолітичними ферментами, що викликає зменшення числа рецепторів на постсинаптичній мембрані більш ніж на 70% l Рецептори до катехоламінів - це α-1 -, α-2 -, β-1 - і β-2 -адренорецептори. Вони поєднані з регуляторним G-білком (Gi , Gs або Gq). Бета-1 - і бета-2). i , адренорецептори активують аденілатциклазу, альфа-2 -адренорецептори інгібують , її. Альфа-1 -адренорецептори діють не через ц. АМФ, а через фосфоліпазу С, І-1, 4, 5її. трифосфат, змінюючи концентрацію в клітині Са, і ДАГ. Агоністи катехоламінів застосовують для лікування астми. Антагоністи використовують для лікування гіпертензії, стенокардії, інфаркту міокарда
 М 2 рецептори М 1 рецептори
М 2 рецептори М 1 рецептори
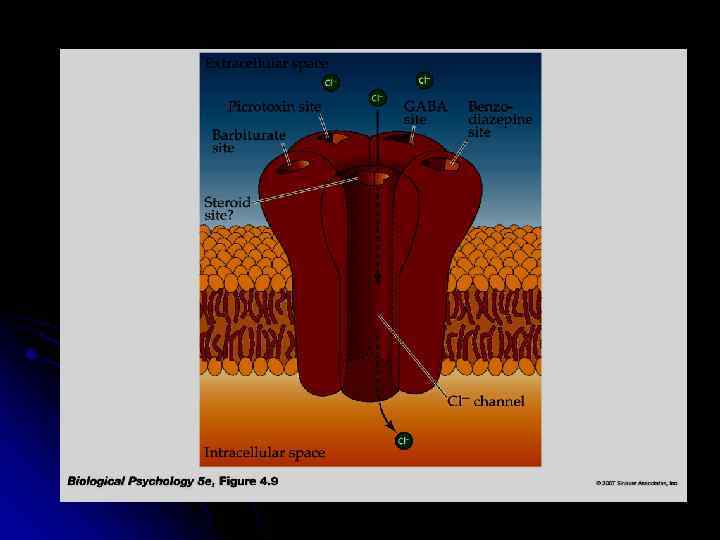
 Рецептори постсинаптичної мембрани (продовження) l Дофамінові рецептори - D 1 - D 5, метаботропні. Перший активує аденілатциклазу, інші - блокують. Блокатори D 2 -рецепторів проявляють нейролептичну дію і ефективні для . лікування шизофренії (фенотіазіни, бутирофенони). У хворих на цю хворобу спостерігається підвищений вміст D 2 -рецепторів l Серотонінові рецептори - НТ 1 - НТ 4 (в основному метаботропні, зв’язані за білками Gi , Gs або Gq. Вони зв язують галюциногенну речовину діетиламін лізергінової кислоти (ЛСД), яка блокує зв язування медіатора і гальмує синтез серотоніну l ГАМК-рецептори - ГАМК-А і ГАМК-В. Перші є іонотропними (канал для іонів Сl-) і є відповідають за стабілізацію потенціалу спокою, здійснюючи гальмівний ефект ГАМК. Заспокійливі ліки - бензодіазепіни, барбітурати - посилюють гальмівну дію ГАМК; - антагоністи ГАМК-А-рецептора взаємодіють із центром зв язування медіатора на рецепторі (бікукулін) або із Сl- каналом (пікротоксин) і викликають конвульсії. ГАМК-Арецептори також мають місця для зв’язування бензодіазепінів та ендогенних ендозепінів – та виявлено, що ці сполуки зв’язуються із рецептором в одному і тому ж місці. Бензодіазепіни збільшують тривалість існування каналу у відкритому стані, не впливаючи на кількість каналів та на швидкість транспорту іонів хлору. Ендозепіни мають протилежний ефект, спричиняючи тривожність, збудженість через пригнічення відкриття хлорного каналу під впливом ГАМК. Таким чином, екзогенні бензодіазепіни є блокаторами зв’язування ендогенних ендозепінів. ГАМК-В – погано досліджений, спряжений із каналом для К.
Рецептори постсинаптичної мембрани (продовження) l Дофамінові рецептори - D 1 - D 5, метаботропні. Перший активує аденілатциклазу, інші - блокують. Блокатори D 2 -рецепторів проявляють нейролептичну дію і ефективні для . лікування шизофренії (фенотіазіни, бутирофенони). У хворих на цю хворобу спостерігається підвищений вміст D 2 -рецепторів l Серотонінові рецептори - НТ 1 - НТ 4 (в основному метаботропні, зв’язані за білками Gi , Gs або Gq. Вони зв язують галюциногенну речовину діетиламін лізергінової кислоти (ЛСД), яка блокує зв язування медіатора і гальмує синтез серотоніну l ГАМК-рецептори - ГАМК-А і ГАМК-В. Перші є іонотропними (канал для іонів Сl-) і є відповідають за стабілізацію потенціалу спокою, здійснюючи гальмівний ефект ГАМК. Заспокійливі ліки - бензодіазепіни, барбітурати - посилюють гальмівну дію ГАМК; - антагоністи ГАМК-А-рецептора взаємодіють із центром зв язування медіатора на рецепторі (бікукулін) або із Сl- каналом (пікротоксин) і викликають конвульсії. ГАМК-Арецептори також мають місця для зв’язування бензодіазепінів та ендогенних ендозепінів – та виявлено, що ці сполуки зв’язуються із рецептором в одному і тому ж місці. Бензодіазепіни збільшують тривалість існування каналу у відкритому стані, не впливаючи на кількість каналів та на швидкість транспорту іонів хлору. Ендозепіни мають протилежний ефект, спричиняючи тривожність, збудженість через пригнічення відкриття хлорного каналу під впливом ГАМК. Таким чином, екзогенні бензодіазепіни є блокаторами зв’язування ендогенних ендозепінів. ГАМК-В – погано досліджений, спряжений із каналом для К.
 Рецептори постсинаптичної мембрани (продовження) l Гліциновий рецептор - теж іонотропний (Сl-канал), а деякі ділянки гліцинового і ГАМК-А рецепторів є гомологічними. Алкалоїд стріхнін зв язується із Сlканалом і припиняє постсинаптичне гальмування гліцином l Опіатні рецептори - μ- і δ (для енкефалінів) та κ (для динорфіну). Вони існують у 2 -х формах, які переходять одна в одну через конформаційні зміни. Одна форма приєднує нейропептиди, інша - їх антагоністи (налорфін, налоксон). ( Останні вживаються для терапії отруєнь опійними препаратами
Рецептори постсинаптичної мембрани (продовження) l Гліциновий рецептор - теж іонотропний (Сl-канал), а деякі ділянки гліцинового і ГАМК-А рецепторів є гомологічними. Алкалоїд стріхнін зв язується із Сlканалом і припиняє постсинаптичне гальмування гліцином l Опіатні рецептори - μ- і δ (для енкефалінів) та κ (для динорфіну). Вони існують у 2 -х формах, які переходять одна в одну через конформаційні зміни. Одна форма приєднує нейропептиди, інша - їх антагоністи (налорфін, налоксон). ( Останні вживаються для терапії отруєнь опійними препаратами
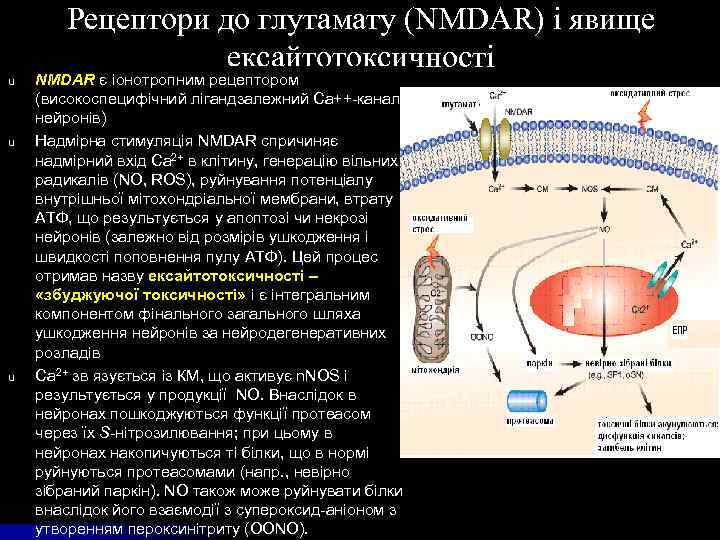 u u u Рецептори до глутамату (NMDAR) і явище ексайтотоксичності NMDAR є іонотропним рецептором (високоспецифічний лігандзалежний Са++-канал нейронів) Надмірна стимуляція NMDAR спричиняє надмірний вхід Ca 2+ в клітину, генерацію вільних радикалів (NO, ROS), руйнування потенціалу внутрішньої мітохондріальної мембрани, втрату ATФ, що результується у апоптозі чи некрозі нейронів (залежно від розмірів ушкодження і швидкості поповнення пулу АТФ). Цей процес отримав назву ексайтотоксичності – «збуджуючої токсичності» і є інтегральним компонентом фінального загального шляха ушкодження нейронів за нейродегенеративних розладів Ca 2+ зв язується із КМ, що активує n. NOS і результується у продукції NO. Внаслідок в нейронах пошкоджуються функції протеасом через їх S-нітрозилювання; при цьому в нейронах накопичуються ті білки, що в нормі руйнуються протеасомами (напр. , невірно зібраний паркін). NO також може руйнувати білки внаслідок його взаємодії з супероксид-аніоном з утворенням пероксинітриту (OONO).
u u u Рецептори до глутамату (NMDAR) і явище ексайтотоксичності NMDAR є іонотропним рецептором (високоспецифічний лігандзалежний Са++-канал нейронів) Надмірна стимуляція NMDAR спричиняє надмірний вхід Ca 2+ в клітину, генерацію вільних радикалів (NO, ROS), руйнування потенціалу внутрішньої мітохондріальної мембрани, втрату ATФ, що результується у апоптозі чи некрозі нейронів (залежно від розмірів ушкодження і швидкості поповнення пулу АТФ). Цей процес отримав назву ексайтотоксичності – «збуджуючої токсичності» і є інтегральним компонентом фінального загального шляха ушкодження нейронів за нейродегенеративних розладів Ca 2+ зв язується із КМ, що активує n. NOS і результується у продукції NO. Внаслідок в нейронах пошкоджуються функції протеасом через їх S-нітрозилювання; при цьому в нейронах накопичуються ті білки, що в нормі руйнуються протеасомами (напр. , невірно зібраний паркін). NO також може руйнувати білки внаслідок його взаємодії з супероксид-аніоном з утворенням пероксинітриту (OONO).
 Пуринові рецептори: рецептори до аденозину l l P 1 -пуринорецептори (=аденозинові рецептори) є більш чутливими до аденозину і АМФ, ніж до АТФ і АДФ; зв’язування ліганду з цими рецепторами інгібує або активує аденілатциклазну систему. Антагоністи - низькі нонцентрації - метилксантинів – кофеїн, теофілін. Внутрішньоклітинні ефекти аденозину опосередковані 4 -ма підтипами метаботропних пуринових рецепторів (A 1, A 2 A, A 2 B, A 3), які різняться ступенем ( експресії на клітинах різного типу і типом зв’язаного із ним G-білка (Gi, Gs). l Головний ефект аденозин-рецепторної взаємодії – активація чи пригнічення – аденілатциклази з відповідним зростанням чи зниженням синтезу ц. АМФ. - Активація А 1 - й А 3 -рецепторів спричиняє зниження рівнів ц. АМФ, що результується в гальмуючих впливах на діяльність НС в - Активація А 2 а- й А 2 b-рецепторів веде до зростання вмісту ц. АМФ і до процессів збудження в НС. l A 1 - і A 3 -рецептори також діють через фосфоліпазу C й Ca 2+: активуючи фосфоінозитидний каскад, вони спричиняють зростання вмісту Са в клітині, що активує Са-залежні ПК, фосфоліпазу А 2, Са-залежні К-канали, NOS. l Стимулювання А 2 а-рецепторів веде до інгібування функціональної активності D 2 -дофамінових рецепторів, що має важливе значення для розвитку неврологічних й психічних захворювань. l Активація рецептора A 1 також може змінювати активність протеїнкінази С, фосфатидилінозитол-3 фосфаткінази й MAP-кіназ, блокувати деякі Са-канали. A 2 A-рецептори окрім системи аденілатциклаза–ц. АМФ активують транскрипційні фактори CREB.
Пуринові рецептори: рецептори до аденозину l l P 1 -пуринорецептори (=аденозинові рецептори) є більш чутливими до аденозину і АМФ, ніж до АТФ і АДФ; зв’язування ліганду з цими рецепторами інгібує або активує аденілатциклазну систему. Антагоністи - низькі нонцентрації - метилксантинів – кофеїн, теофілін. Внутрішньоклітинні ефекти аденозину опосередковані 4 -ма підтипами метаботропних пуринових рецепторів (A 1, A 2 A, A 2 B, A 3), які різняться ступенем ( експресії на клітинах різного типу і типом зв’язаного із ним G-білка (Gi, Gs). l Головний ефект аденозин-рецепторної взаємодії – активація чи пригнічення – аденілатциклази з відповідним зростанням чи зниженням синтезу ц. АМФ. - Активація А 1 - й А 3 -рецепторів спричиняє зниження рівнів ц. АМФ, що результується в гальмуючих впливах на діяльність НС в - Активація А 2 а- й А 2 b-рецепторів веде до зростання вмісту ц. АМФ і до процессів збудження в НС. l A 1 - і A 3 -рецептори також діють через фосфоліпазу C й Ca 2+: активуючи фосфоінозитидний каскад, вони спричиняють зростання вмісту Са в клітині, що активує Са-залежні ПК, фосфоліпазу А 2, Са-залежні К-канали, NOS. l Стимулювання А 2 а-рецепторів веде до інгібування функціональної активності D 2 -дофамінових рецепторів, що має важливе значення для розвитку неврологічних й психічних захворювань. l Активація рецептора A 1 також може змінювати активність протеїнкінази С, фосфатидилінозитол-3 фосфаткінази й MAP-кіназ, блокувати деякі Са-канали. A 2 A-рецептори окрім системи аденілатциклаза–ц. АМФ активують транскрипційні фактори CREB.
 Пуринові рецептори: рецептори до АТФ l P 2 -пуринорецептори є більш чутливими до ATФ і AДФ; агоністи - сурамін, піридоксальфосфат-6 -азофеніл-2’-4’-дисульфатна кислота (pyridoxalphosphate-6 -azophenyl-2'-4'-disulphuric acid, PPADS). Перша класифікація Р 2 -пуринорецепторів передбачала наступні підкласи Р 2 -пуринорецепторів: - P 2 X і P 2 Y (опосередковують, відповідно, скорочення й послаблення гладеньких м’язів, включаючи вазодиляцію через P 2 Y-рецептори ендотеліальних клітин у відповідь на звільнення NO; - P 2 T-пуринорецептори (АДФ-чутливі рецептори тромбоцитів); - P 2 Z-пуринорецептори (відкривають неселективні пори в жирових клітинах, макрофагах і лімфоцитах імунної системи); - P 2 U-пуринорецептори (рівноспецифічні до UTP і ATP); - P 2 D-пуринорецептори (чутливі до діаденозину поліфосфату). l 1994 - Abbracchio and Burnstock – нова класифікація. Всі P 2 -пуринорецептори за нею поділяються на 2 великі підродини: - підродина P 2 X-пуринорецепторів (має як мінімум 7 субкласів), що - опосередковують швидкі відповіді через ліганд-залежні іонні канали – тобто є іонотропними рецепторами). Р 2 Х-рецептори при взаємодії з лігандом відкривають низькоселективний канал для моновалентних іонів (К, Na, Сs), через який таож вільно проходять іони Са, причому зростання Са у цитоплазмі може блокувати рух по каналу інших іонів. l - підродина P 2 Y-пуринорецепторів (8 підкласів у ссавців), що опосередковують повільні відповіді через G-білки (метаботропні). (
Пуринові рецептори: рецептори до АТФ l P 2 -пуринорецептори є більш чутливими до ATФ і AДФ; агоністи - сурамін, піридоксальфосфат-6 -азофеніл-2’-4’-дисульфатна кислота (pyridoxalphosphate-6 -azophenyl-2'-4'-disulphuric acid, PPADS). Перша класифікація Р 2 -пуринорецепторів передбачала наступні підкласи Р 2 -пуринорецепторів: - P 2 X і P 2 Y (опосередковують, відповідно, скорочення й послаблення гладеньких м’язів, включаючи вазодиляцію через P 2 Y-рецептори ендотеліальних клітин у відповідь на звільнення NO; - P 2 T-пуринорецептори (АДФ-чутливі рецептори тромбоцитів); - P 2 Z-пуринорецептори (відкривають неселективні пори в жирових клітинах, макрофагах і лімфоцитах імунної системи); - P 2 U-пуринорецептори (рівноспецифічні до UTP і ATP); - P 2 D-пуринорецептори (чутливі до діаденозину поліфосфату). l 1994 - Abbracchio and Burnstock – нова класифікація. Всі P 2 -пуринорецептори за нею поділяються на 2 великі підродини: - підродина P 2 X-пуринорецепторів (має як мінімум 7 субкласів), що - опосередковують швидкі відповіді через ліганд-залежні іонні канали – тобто є іонотропними рецепторами). Р 2 Х-рецептори при взаємодії з лігандом відкривають низькоселективний канал для моновалентних іонів (К, Na, Сs), через який таож вільно проходять іони Са, причому зростання Са у цитоплазмі може блокувати рух по каналу інших іонів. l - підродина P 2 Y-пуринорецепторів (8 підкласів у ссавців), що опосередковують повільні відповіді через G-білки (метаботропні). (
 Типи рецепторів Система АХ-ргічна Тип Нікотиновий рецептор до АХ Мускариновий рецептор до АХ Моноамінергічна 1 -адренорецептор 2 -адренорецептор Дофаміновий рецептор Серотоніновий рецептор Амінокислотоергічна ГАМК-рецептор Глутаматний іонотропний рецептор Глутаматний метаботропний рецептор Гліциновий рецептор Гістаміновий рецептор Пептидергічна Опіоїдні рецептори Рецептори до ін. пептидів Пуринергічна Рецептори до аденозину (P 1 -пурінорецептори) P 2 -пурінорецептори
Типи рецепторів Система АХ-ргічна Тип Нікотиновий рецептор до АХ Мускариновий рецептор до АХ Моноамінергічна 1 -адренорецептор 2 -адренорецептор Дофаміновий рецептор Серотоніновий рецептор Амінокислотоергічна ГАМК-рецептор Глутаматний іонотропний рецептор Глутаматний метаботропний рецептор Гліциновий рецептор Гістаміновий рецептор Пептидергічна Опіоїдні рецептори Рецептори до ін. пептидів Пуринергічна Рецептори до аденозину (P 1 -пурінорецептори) P 2 -пурінорецептори
 Підтипи рецепторів до норадреналіну Рецептори 1 -адренорецептори Підтип Сигнальна система Стр-ра (а/к/TMдомени) І-1, 4, 5 -Ф/ДАГ 466/7 Gq/11 І-1, 4, 5 -Ф/ДАГ 519/7 1 D Gq/11 І-1, 4, 5 -Ф/ДАГ 572/7 2 A Gi/o ц. АМФ 450/7 2 B Gi/o ц. АМФ 450/7 2 C Gi/o ц. АМФ 461/7 2 D - адренорецептори Gq/11 1 B 2 - адренорецептори 1 A Gi/o ц. АМФ 450/7 1 Gs ц. АМФ 477/7 2 Gs ц. АМФ 413/7 3 Gs, Gi/o ц. АМФ 408/7
Підтипи рецепторів до норадреналіну Рецептори 1 -адренорецептори Підтип Сигнальна система Стр-ра (а/к/TMдомени) І-1, 4, 5 -Ф/ДАГ 466/7 Gq/11 І-1, 4, 5 -Ф/ДАГ 519/7 1 D Gq/11 І-1, 4, 5 -Ф/ДАГ 572/7 2 A Gi/o ц. АМФ 450/7 2 B Gi/o ц. АМФ 450/7 2 C Gi/o ц. АМФ 461/7 2 D - адренорецептори Gq/11 1 B 2 - адренорецептори 1 A Gi/o ц. АМФ 450/7 1 Gs ц. АМФ 477/7 2 Gs ц. АМФ 413/7 3 Gs, Gi/o ц. АМФ 408/7
 Підтипи дофамінових рецепторів Рецептори дофаміновий Підтип Сигнальна система Стр-ра (aa/TM) D 1 Gs ц. АМФ 446/7 D 2 Gi Gq/11 ц. АМФ І-1, 4, 5 -Ф/ДАГ, K+, Ca 2+ 443/7 D 3 Gi ц. АМФ 400/7 D 4 Gi ц. АМФ, K+ 386/7 D 5 Gs ц. АМФ 477/7
Підтипи дофамінових рецепторів Рецептори дофаміновий Підтип Сигнальна система Стр-ра (aa/TM) D 1 Gs ц. АМФ 446/7 D 2 Gi Gq/11 ц. АМФ І-1, 4, 5 -Ф/ДАГ, K+, Ca 2+ 443/7 D 3 Gi ц. АМФ 400/7 D 4 Gi ц. АМФ, K+ 386/7 D 5 Gs ц. АМФ 477/7
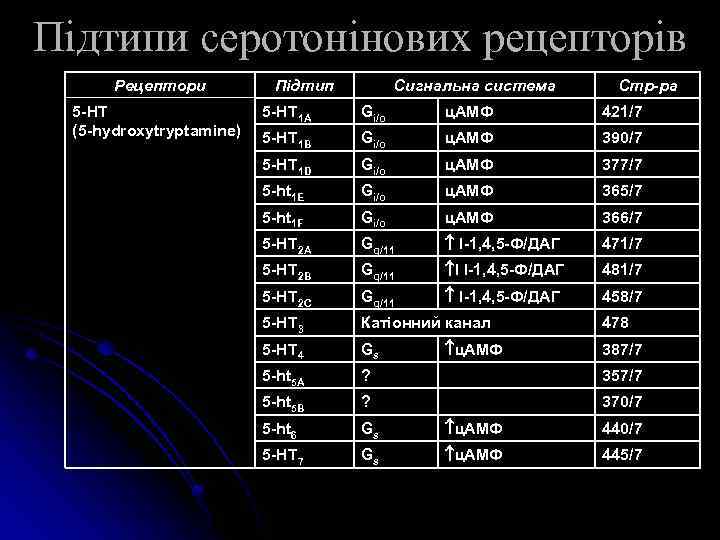 Підтипи серотонінових рецепторів Рецептори 5 -HT (5 -hydroxytryptamine) Підтип Сигнальна система Стр-ра 5 -HT 1 A Gi/o ц. АМФ 421/7 5 -HT 1 B Gi/o ц. АМФ 390/7 5 -HT 1 D Gi/o ц. АМФ 377/7 5 -ht 1 E Gi/o ц. АМФ 365/7 5 -ht 1 F Gi/o ц. АМФ 366/7 5 -HT 2 A Gq/11 І-1, 4, 5 -Ф/ДАГ 471/7 5 -HT 2 B Gq/11 I І-1, 4, 5 -Ф/ДАГ 481/7 5 -HT 2 C Gq/11 І-1, 4, 5 -Ф/ДАГ 458/7 5 -HT 3 Катіонний канал 5 -HT 4 Gs 5 -ht 5 A ? 357/7 5 -ht 5 B ? 370/7 5 -ht 6 Gs ц. АМФ 440/7 5 -HT 7 Gs ц. АМФ 445/7 ц. АМФ 478 387/7
Підтипи серотонінових рецепторів Рецептори 5 -HT (5 -hydroxytryptamine) Підтип Сигнальна система Стр-ра 5 -HT 1 A Gi/o ц. АМФ 421/7 5 -HT 1 B Gi/o ц. АМФ 390/7 5 -HT 1 D Gi/o ц. АМФ 377/7 5 -ht 1 E Gi/o ц. АМФ 365/7 5 -ht 1 F Gi/o ц. АМФ 366/7 5 -HT 2 A Gq/11 І-1, 4, 5 -Ф/ДАГ 471/7 5 -HT 2 B Gq/11 I І-1, 4, 5 -Ф/ДАГ 481/7 5 -HT 2 C Gq/11 І-1, 4, 5 -Ф/ДАГ 458/7 5 -HT 3 Катіонний канал 5 -HT 4 Gs 5 -ht 5 A ? 357/7 5 -ht 5 B ? 370/7 5 -ht 6 Gs ц. АМФ 440/7 5 -HT 7 Gs ц. АМФ 445/7 ц. АМФ 478 387/7
 Потенційні мішені психотропних препаратів Психотропні засоби - фармакологічні препарати, що застосовуються за порушень психічної діяльності людини 1. Синтез і збереження нейромедіатора 2. Звільнення нейромедіатора 3. Взаємодія із рецептором (блокування рецептора) 4. Катаболізм нейромедіатора 5. Поглинання нейромедіатора 6. Елементи трансдукції (G-білки) 7. Ефекторні системи
Потенційні мішені психотропних препаратів Психотропні засоби - фармакологічні препарати, що застосовуються за порушень психічної діяльності людини 1. Синтез і збереження нейромедіатора 2. Звільнення нейромедіатора 3. Взаємодія із рецептором (блокування рецептора) 4. Катаболізм нейромедіатора 5. Поглинання нейромедіатора 6. Елементи трансдукції (G-білки) 7. Ефекторні системи
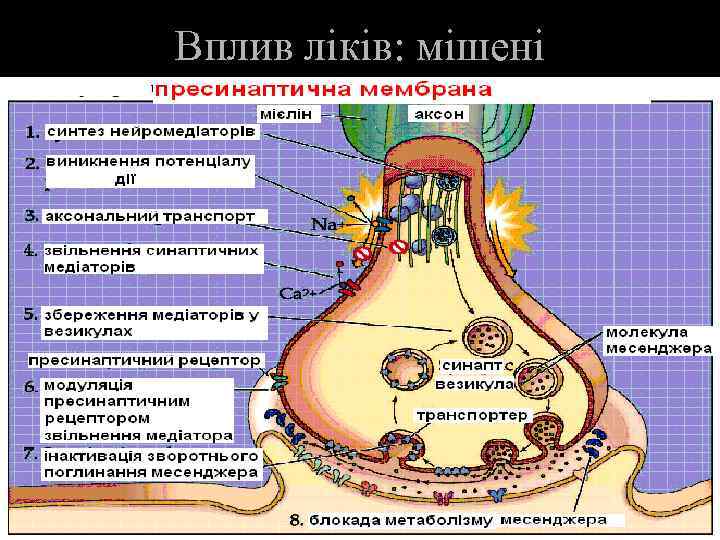 Вплив ліків: мішені
Вплив ліків: мішені
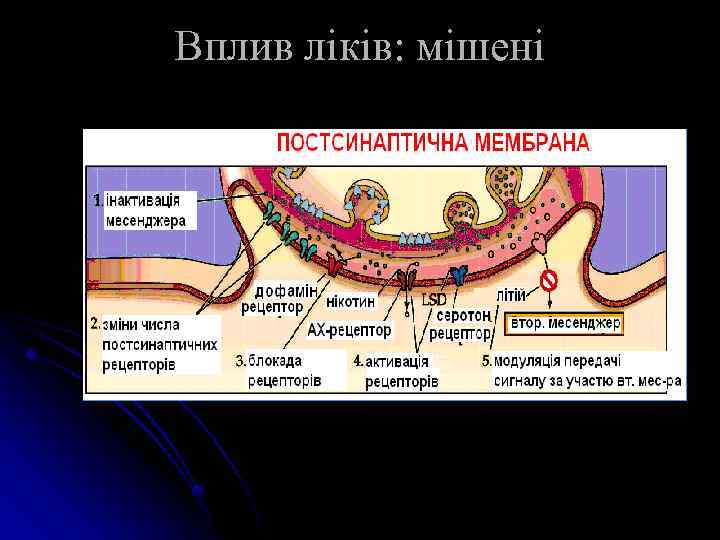 Вплив ліків: мішені
Вплив ліків: мішені
 Мішені психотропних ліків у ЦНС Виникнення ПД Синтез месенджера метаболізм збереження звільнення поглинання деградація рецепція Іонна пронкність, G-білок залежні каскади
Мішені психотропних ліків у ЦНС Виникнення ПД Синтез месенджера метаболізм збереження звільнення поглинання деградація рецепція Іонна пронкність, G-білок залежні каскади
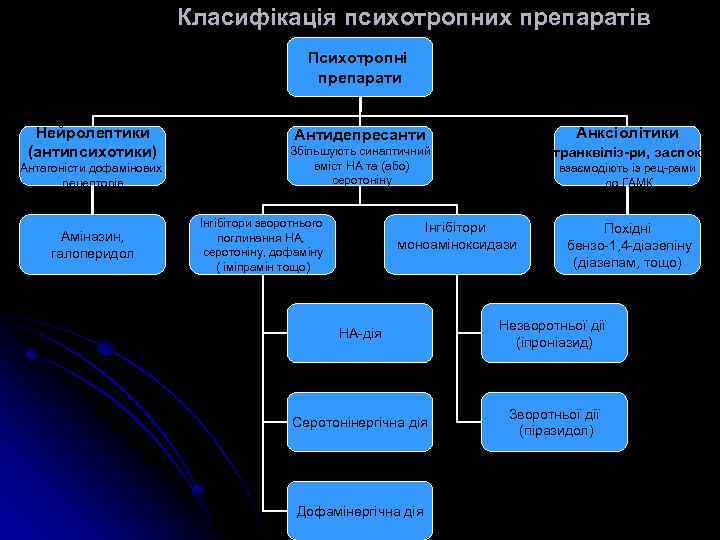 Класифікація психотропних препаратів Психотропні препарати Нейролептики (антипсихотики) Антагоністи дофамінових рецепторів Аміназин, галоперидол Анксіолітики (транквіліз-ри, заспок) Антидепресанти Збільшують синаптичний вміст НА та (або) серотоніну Інгібітори зворотнього поглинання НА, серотоніну, дофаміну ( іміпрамін тощо) взаємодіють із рец-рами до ГАМК Інгібітори моноаміноксидази Похідні бензо-1, 4 -діазепіну (діазепам, тощо) НА-дія Незворотньої дії (іпроніазид) Серотонінергічна дія Зворотньої дії (піразидол) Дофамінергічна дія
Класифікація психотропних препаратів Психотропні препарати Нейролептики (антипсихотики) Антагоністи дофамінових рецепторів Аміназин, галоперидол Анксіолітики (транквіліз-ри, заспок) Антидепресанти Збільшують синаптичний вміст НА та (або) серотоніну Інгібітори зворотнього поглинання НА, серотоніну, дофаміну ( іміпрамін тощо) взаємодіють із рец-рами до ГАМК Інгібітори моноаміноксидази Похідні бензо-1, 4 -діазепіну (діазепам, тощо) НА-дія Незворотньої дії (іпроніазид) Серотонінергічна дія Зворотньої дії (піразидол) Дофамінергічна дія
 Нейролептики (=антипсихотики) l l l використовуються для лікування шизофренії Класичні нейролептики (галоперидол (1958), хлорпромазин (1950), флюфеназін (1962)) Атипові антипсихотики (антипсихотики 2 -го покоління, або серотонін-дофамінові антагоністи) – додається (5 HT 2 A)активність: клозапін (1990 р), рісперідон (1994), сульпірід, аріпіпразол (2003)
Нейролептики (=антипсихотики) l l l використовуються для лікування шизофренії Класичні нейролептики (галоперидол (1958), хлорпромазин (1950), флюфеназін (1962)) Атипові антипсихотики (антипсихотики 2 -го покоління, або серотонін-дофамінові антагоністи) – додається (5 HT 2 A)активність: клозапін (1990 р), рісперідон (1994), сульпірід, аріпіпразол (2003)
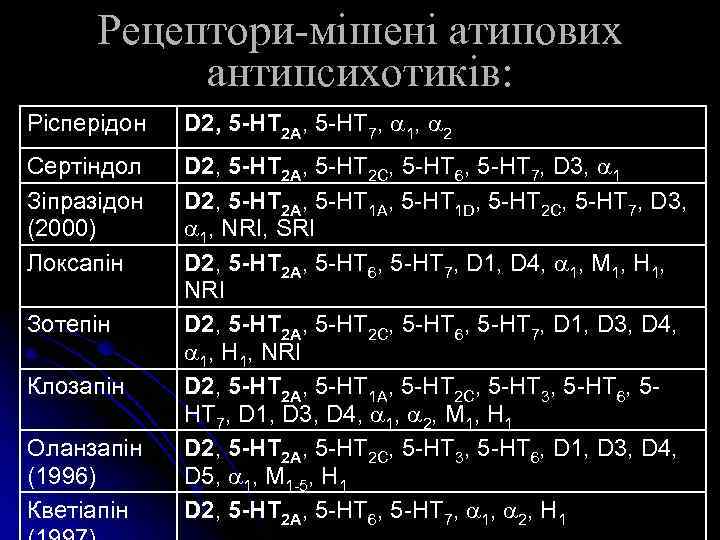 Рецептори-мішені атипових антипсихотиків: Рісперідон D 2, 5 -HT 2 A, 5 -HT 7, 1, 2 Сертіндол Зіпразідон (2000) Локсапін D 2, 5 -HT 2 A, 5 -HT 2 C, 5 -HT 6, 5 -HT 7, D 3, 1 D 2, 5 -HT 2 A, 5 -HT 1 D, 5 -HT 2 C, 5 -HT 7, D 3, 1, NRI, SRI D 2, 5 -HT 2 A, 5 -HT 6, 5 -HT 7, D 1, D 4, 1, M 1, H 1, NRI D 2, 5 -HT 2 A, 5 -HT 2 C, 5 -HT 6, 5 -HT 7, D 1, D 3, D 4, 1, H 1, NRI D 2, 5 -HT 2 A, 5 -HT 1 A, 5 -HT 2 C, 5 -HT 3, 5 -HT 6, 5 HT 7, D 1, D 3, D 4, 1, 2, M 1, H 1 D 2, 5 -HT 2 A, 5 -HT 2 C, 5 -HT 3, 5 -HT 6, D 1, D 3, D 4, D 5, 1, M 1 -5, H 1 D 2, 5 -HT 2 A, 5 -HT 6, 5 -HT 7, 1, 2, H 1 Зотепін Клозапін Оланзапін (1996) Кветіапін
Рецептори-мішені атипових антипсихотиків: Рісперідон D 2, 5 -HT 2 A, 5 -HT 7, 1, 2 Сертіндол Зіпразідон (2000) Локсапін D 2, 5 -HT 2 A, 5 -HT 2 C, 5 -HT 6, 5 -HT 7, D 3, 1 D 2, 5 -HT 2 A, 5 -HT 1 D, 5 -HT 2 C, 5 -HT 7, D 3, 1, NRI, SRI D 2, 5 -HT 2 A, 5 -HT 6, 5 -HT 7, D 1, D 4, 1, M 1, H 1, NRI D 2, 5 -HT 2 A, 5 -HT 2 C, 5 -HT 6, 5 -HT 7, D 1, D 3, D 4, 1, H 1, NRI D 2, 5 -HT 2 A, 5 -HT 1 A, 5 -HT 2 C, 5 -HT 3, 5 -HT 6, 5 HT 7, D 1, D 3, D 4, 1, 2, M 1, H 1 D 2, 5 -HT 2 A, 5 -HT 2 C, 5 -HT 3, 5 -HT 6, D 1, D 3, D 4, D 5, 1, M 1 -5, H 1 D 2, 5 -HT 2 A, 5 -HT 6, 5 -HT 7, 1, 2, H 1 Зотепін Клозапін Оланзапін (1996) Кветіапін
 Антидепресанти u u u Інгібітори МАО – запобігають розщепленню моноамінів у синаптичній щілині (тирамін (1960 -ті), транілципромін, фенелзін); в той же час практично не застосовувалися через майже одночасне відкриття менш токсичних трициклічних антидепресантів Трициклічні антидепресанти – підвищують вміст серотоніну і нормадреналіну в синаптичній щілині, блокуючи їх поглинання пресинаптичним закінченням (амітриптілін, іміпрамін (1958)); з 1990 -х рр майже не застосовуються Селективні інгібітори поглинання серотоніну (SSRIs) – прозак (1988), паксил, лювокс (1992 -1993), селекса, золофт (1998), флюоксетин (=модифікований прозак, 2001), лексапро (=модифікована селекса, 2002); акумулюють серотонін у синаптичній щілині, запобігаючи його поглинанню пресинаптичним закінченням Іони літію (маніакально-депресивні розлади) (1949) – дуже висока токсичність; зараз для лікування цих розладів застосовують ламотрігін (1993) та ін Атипові антидепресанти (2 -го покоління) – дезірел (1981), велбутрін (1989), ефексор (1993), серзон (1994), ремерон (1996), дулоксетін (2006)
Антидепресанти u u u Інгібітори МАО – запобігають розщепленню моноамінів у синаптичній щілині (тирамін (1960 -ті), транілципромін, фенелзін); в той же час практично не застосовувалися через майже одночасне відкриття менш токсичних трициклічних антидепресантів Трициклічні антидепресанти – підвищують вміст серотоніну і нормадреналіну в синаптичній щілині, блокуючи їх поглинання пресинаптичним закінченням (амітриптілін, іміпрамін (1958)); з 1990 -х рр майже не застосовуються Селективні інгібітори поглинання серотоніну (SSRIs) – прозак (1988), паксил, лювокс (1992 -1993), селекса, золофт (1998), флюоксетин (=модифікований прозак, 2001), лексапро (=модифікована селекса, 2002); акумулюють серотонін у синаптичній щілині, запобігаючи його поглинанню пресинаптичним закінченням Іони літію (маніакально-депресивні розлади) (1949) – дуже висока токсичність; зараз для лікування цих розладів застосовують ламотрігін (1993) та ін Атипові антидепресанти (2 -го покоління) – дезірел (1981), велбутрін (1989), ефексор (1993), серзон (1994), ремерон (1996), дулоксетін (2006)
 Анксіолітики (транквілізатори, гіпнотики) l Від “Anxiety” – зрушення, що характеризуються панічними нападами (тривога, фобії) l Бензодіазепіни: лібріум (=хлордіазепоксид, 1957), діазепам, (1970), клоназепам, лоразепам; зв”язуються із ГАМК-рецептором і підвищують його афінність до ГАМК; під впливом ГАМК у рецепторі відкривається С 1 - канал, і іони С 1 - входять у клітину і спричиняють гіперполяризацію, внаслідок якої інгібується можливість розвитку потенціалу дії Небензодіазепінові анксіолітики, серед яких одні із найважливіших - барбітурати одні із найважливіших - (фенобарбітал, тощо) – впливають на транспорт К+ і Na+ через мембрану Анксіолітики нового покоління – амбеїн (1992), золпідем (=модифікований амбеїн, 2006) l l
Анксіолітики (транквілізатори, гіпнотики) l Від “Anxiety” – зрушення, що характеризуються панічними нападами (тривога, фобії) l Бензодіазепіни: лібріум (=хлордіазепоксид, 1957), діазепам, (1970), клоназепам, лоразепам; зв”язуються із ГАМК-рецептором і підвищують його афінність до ГАМК; під впливом ГАМК у рецепторі відкривається С 1 - канал, і іони С 1 - входять у клітину і спричиняють гіперполяризацію, внаслідок якої інгібується можливість розвитку потенціалу дії Небензодіазепінові анксіолітики, серед яких одні із найважливіших - барбітурати одні із найважливіших - (фенобарбітал, тощо) – впливають на транспорт К+ і Na+ через мембрану Анксіолітики нового покоління – амбеїн (1992), золпідем (=модифікований амбеїн, 2006) l l
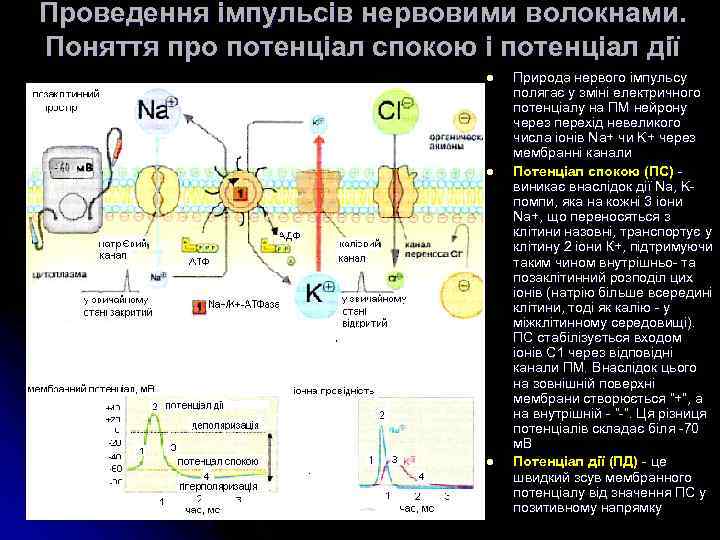 Проведення імпульсів нервовими волокнами. Поняття про потенціал спокою і потенціал дії l l l Природа нервого імпульсу полягає у зміні електричного потенціалу на ПМ нейрону через перехід невеликого числа іонів Na+ чи K+ через мембранні канали Потенціал спокою (ПС) - виникає внаслідок дії Na, Kпомпи, яка на кожні 3 іони Na+, що переносяться з клітини назовні, транспортує у клітину 2 іони К+, підтримуючи таким чином внутрішньо- та позаклітинний розподіл цих іонів (натрію більше всередині клітини, тоді як калію - у міжклітинному середовищі). ПС стабілізується входом іонів С 1 через відповідні канали ПМ. Внаслідок цього на зовнішній поверхні мембрани створюється “+”, а на внутрішній - “-”. Ця різниця потенціалів складає біля -70 м. В Потенціал дії (ПД) - це швидкий зсув мембранного потенціалу від значення ПС у позитивному напрямку
Проведення імпульсів нервовими волокнами. Поняття про потенціал спокою і потенціал дії l l l Природа нервого імпульсу полягає у зміні електричного потенціалу на ПМ нейрону через перехід невеликого числа іонів Na+ чи K+ через мембранні канали Потенціал спокою (ПС) - виникає внаслідок дії Na, Kпомпи, яка на кожні 3 іони Na+, що переносяться з клітини назовні, транспортує у клітину 2 іони К+, підтримуючи таким чином внутрішньо- та позаклітинний розподіл цих іонів (натрію більше всередині клітини, тоді як калію - у міжклітинному середовищі). ПС стабілізується входом іонів С 1 через відповідні канали ПМ. Внаслідок цього на зовнішній поверхні мембрани створюється “+”, а на внутрішній - “-”. Ця різниця потенціалів складає біля -70 м. В Потенціал дії (ПД) - це швидкий зсув мембранного потенціалу від значення ПС у позитивному напрямку
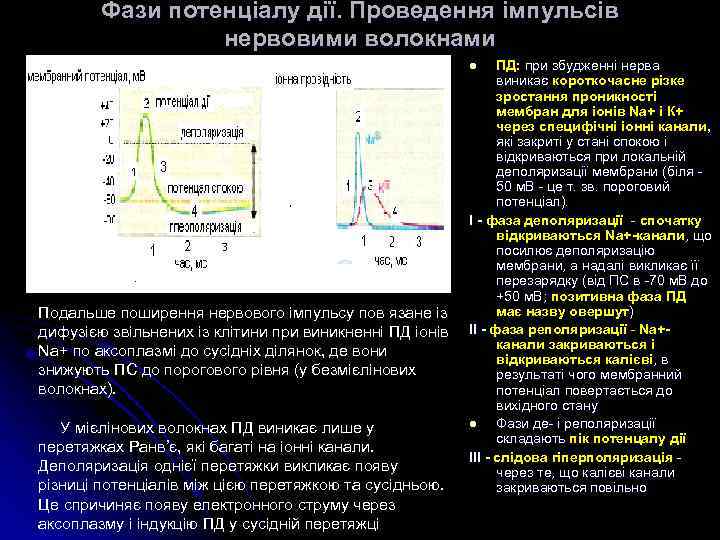 Фази потенціалу дії. Проведення імпульсів нервовими волокнами ПД: при збудженні нерва виникає короткочасне різке зростання проникності мембран для іонів Na+ і К+ через специфічні іонні канали, які закриті у стані спокою і відкриваються при локальній деполяризації мембрани (біля 50 м. В - це т. зв. пороговий потенціал). І - фаза деполяризації - спочатку І - відкриваються Na+-канали, що посилює деполяризацію мембрани, а надалі викликає її перезарядку (від ПС в -70 м. В до +50 м. В; позитивна фаза ПД +50 м. В; має назву овершут) ІІ - фаза реполяризації - Na+ІІ - канали закриваються і відкриваються калієві, в результаті чого мембранний потенціал повертається до вихідного стану l Фази де- і реполяризації складають пік потенцалу дії ІІІ - слідова гіперполяризація - ІІІ - через те, що калієві канали закриваються повільно l Подальше поширення нервового імпульсу пов язане із дифузією звільнених із клітини при виникненні ПД іонів Na+ по аксоплазмі до сусідніх ділянок, де вони знижують ПС до порогового рівня (у безмієлінових волокнах). У мієлінових волокнах ПД виникає лише у перетяжках Ранв’є, які багаті на іонні канали. Деполяризація однієї перетяжки викликає появу різниці потенціалів між цією перетяжкою та сусідньою. Це спричиняє появу електронного струму через аксоплазму і індукцію ПД у сусідній перетяжці
Фази потенціалу дії. Проведення імпульсів нервовими волокнами ПД: при збудженні нерва виникає короткочасне різке зростання проникності мембран для іонів Na+ і К+ через специфічні іонні канали, які закриті у стані спокою і відкриваються при локальній деполяризації мембрани (біля 50 м. В - це т. зв. пороговий потенціал). І - фаза деполяризації - спочатку І - відкриваються Na+-канали, що посилює деполяризацію мембрани, а надалі викликає її перезарядку (від ПС в -70 м. В до +50 м. В; позитивна фаза ПД +50 м. В; має назву овершут) ІІ - фаза реполяризації - Na+ІІ - канали закриваються і відкриваються калієві, в результаті чого мембранний потенціал повертається до вихідного стану l Фази де- і реполяризації складають пік потенцалу дії ІІІ - слідова гіперполяризація - ІІІ - через те, що калієві канали закриваються повільно l Подальше поширення нервового імпульсу пов язане із дифузією звільнених із клітини при виникненні ПД іонів Na+ по аксоплазмі до сусідніх ділянок, де вони знижують ПС до порогового рівня (у безмієлінових волокнах). У мієлінових волокнах ПД виникає лише у перетяжках Ранв’є, які багаті на іонні канали. Деполяризація однієї перетяжки викликає появу різниці потенціалів між цією перетяжкою та сусідньою. Це спричиняє появу електронного струму через аксоплазму і індукцію ПД у сусідній перетяжці
 Сполуки, що порушують проведення імпульсів нервовими волокнами l Інгібітори Na, K-помпи - напр. , серцеві глікозиди (уабаїн) l Нейротоксини впливають на полегшену дифузію іонів натрію через канали в мембранах аксонів: блокують транспорт (тетродоксин, сакситоцин), викликають стійку активацію каналів чи пригнічують їх інактивацію (батрахотоксин, токсини морської анемони та отрути скорпіона)
Сполуки, що порушують проведення імпульсів нервовими волокнами l Інгібітори Na, K-помпи - напр. , серцеві глікозиди (уабаїн) l Нейротоксини впливають на полегшену дифузію іонів натрію через канали в мембранах аксонів: блокують транспорт (тетродоксин, сакситоцин), викликають стійку активацію каналів чи пригнічують їх інактивацію (батрахотоксин, токсини морської анемони та отрути скорпіона)
 Вплив на стан нервової системи та на синаптичну передачу деяких нейротропних сполук
Вплив на стан нервової системи та на синаптичну передачу деяких нейротропних сполук
 Вплив алкоголю Алкогольний ефект – біфазний: – початкова фаза стимуляції; за нею - депресорна Алкоголь активує ГАМКA рецептори і Алкоголь посилює інгібуючий ефект ГАМК (подібно бензодіазепінам) - це є контрибутом втрати рухової координації Алкоголь також стимулює Алкоголь також дофамінові шляхи, спричиняючи ефект ейфорії Зловживання алкоголем пошкоджує нейрони, особливо в frontal lobe (лобна доля ГМ), cerebellum (мозочок) & hippocampus (гіпокамп) Синдром Корсакофа – одночасний дефіцит вітаміну В 1 (тіаміну) Алкогольний синдром новонароджених - результат зловживання алкоголем вагітними (алкоголь ушкоджує плод) Спадковість алкоголізму : l 20 -50% синів і 8 -10% дочок мають прояви хвороби
Вплив алкоголю Алкогольний ефект – біфазний: – початкова фаза стимуляції; за нею - депресорна Алкоголь активує ГАМКA рецептори і Алкоголь посилює інгібуючий ефект ГАМК (подібно бензодіазепінам) - це є контрибутом втрати рухової координації Алкоголь також стимулює Алкоголь також дофамінові шляхи, спричиняючи ефект ейфорії Зловживання алкоголем пошкоджує нейрони, особливо в frontal lobe (лобна доля ГМ), cerebellum (мозочок) & hippocampus (гіпокамп) Синдром Корсакофа – одночасний дефіцит вітаміну В 1 (тіаміну) Алкогольний синдром новонароджених - результат зловживання алкоголем вагітними (алкоголь ушкоджує плод) Спадковість алкоголізму : l 20 -50% синів і 8 -10% дочок мають прояви хвороби
 u Інші біологічні ефекти: – Низькі концентрації: t Посилює збуджуючий ефект N-АХ і 5 HT 3 (серотонінові) рецепторів => збудження – Високі концентрації: t Інгібування звільнення медіаторів шляхом блокування Na+ і Ca 2+ каналів t Інгібування функцій NMDAрецептору Периферійні ефекти t вазодиляція t Зростання потовиділення і шлункової секреції (=> почуття голоду) t Зростання вивільнення глюкокортикоїдів t Інгібування секреції антидіуретичного гормону => діурез t Інгібування звільнення окситоцину
u Інші біологічні ефекти: – Низькі концентрації: t Посилює збуджуючий ефект N-АХ і 5 HT 3 (серотонінові) рецепторів => збудження – Високі концентрації: t Інгібування звільнення медіаторів шляхом блокування Na+ і Ca 2+ каналів t Інгібування функцій NMDAрецептору Периферійні ефекти t вазодиляція t Зростання потовиділення і шлункової секреції (=> почуття голоду) t Зростання вивільнення глюкокортикоїдів t Інгібування секреції антидіуретичного гормону => діурез t Інгібування звільнення окситоцину
 Опіум містить морфін, ефективний анальгетик Морфін і героїн – обидва є наркотичними сполуками Ці опіати зв”язуються із опіоїдними рецепторами у мозку Ендогенні опіати – пептиди, що зв”язують опіоїдні рецептори (μ, κ, δ) і вгамовують біль, також є наркотичними сполуками: - енкефаліни - ендорфіни - динорфіни
Опіум містить морфін, ефективний анальгетик Морфін і героїн – обидва є наркотичними сполуками Ці опіати зв”язуються із опіоїдними рецепторами у мозку Ендогенні опіати – пептиди, що зв”язують опіоїдні рецептори (μ, κ, δ) і вгамовують біль, також є наркотичними сполуками: - енкефаліни - ендорфіни - динорфіни
 Маріхуана Активний інгредієнт - Δ 9 тетрагідроканнабінол (tetrahydrocannabinol, THC) l Ефекти - релаксація, зміни настрою, стимуляція, галюцинації, паранойя Тривале вживання може привести до звикання l Мозок містить орфанові каннабіоїдні рецептори, що опосередковують ефекти THC та ін сполук l Препарати, що містять синтетичний ТГК (марінол та його аналоги), вкористовують у США, Канаді й Західній Європі для купірування сторонніх ефектів хіміотерапії при раку й для боротьбы з синдромом втрати ваги за СНІДу. Даний препарат також може бути эфективним при глаукомі, фантомних болях, нейропатичному болю й деяких інших захворюваннях, які не піддаються лікуванню за допомогою інших лікарських засобів Рафаэль Мешулам, відкривач психоактивної сполуки транс -Δ 9 -тетрагідроканнабінолу, із конопель (Cannabis sativa L. ) (1964) й Люмир Хануш, відкривач ендогенного ліганду — анадаміду, із мозку (1992 )
Маріхуана Активний інгредієнт - Δ 9 тетрагідроканнабінол (tetrahydrocannabinol, THC) l Ефекти - релаксація, зміни настрою, стимуляція, галюцинації, паранойя Тривале вживання може привести до звикання l Мозок містить орфанові каннабіоїдні рецептори, що опосередковують ефекти THC та ін сполук l Препарати, що містять синтетичний ТГК (марінол та його аналоги), вкористовують у США, Канаді й Західній Європі для купірування сторонніх ефектів хіміотерапії при раку й для боротьбы з синдромом втрати ваги за СНІДу. Даний препарат також може бути эфективним при глаукомі, фантомних болях, нейропатичному болю й деяких інших захворюваннях, які не піддаються лікуванню за допомогою інших лікарських засобів Рафаэль Мешулам, відкривач психоактивної сполуки транс -Δ 9 -тетрагідроканнабінолу, із конопель (Cannabis sativa L. ) (1964) й Люмир Хануш, відкривач ендогенного ліганду — анадаміду, із мозку (1992 )
 Ендоканнабіоїди (напр. , анандамід) - це гомологи маріхуани, що продукуються у мозку - окрім дії через канабіоїдні рецептори мозку, можуть - впливати на звільнення нейромедіаторів із пресинаптичного нейрону Анандамід має такі ефекти: l Змінює процеси, що забезпечують запам”ятовування l Стимулюють апетит l Знижують чутливість до болю l Захищають від ексайтотоксичного пошкодження мозку l Інші ендоканнабіоїди: 2 -арахідоніл-гліцерол (2 -AG), олеамід
Ендоканнабіоїди (напр. , анандамід) - це гомологи маріхуани, що продукуються у мозку - окрім дії через канабіоїдні рецептори мозку, можуть - впливати на звільнення нейромедіаторів із пресинаптичного нейрону Анандамід має такі ефекти: l Змінює процеси, що забезпечують запам”ятовування l Стимулюють апетит l Знижують чутливість до болю l Захищають від ексайтотоксичного пошкодження мозку l Інші ендоканнабіоїди: 2 -арахідоніл-гліцерол (2 -AG), олеамід
 Нікотин Никоти н — алкалоїд, що міститься в рослинах родини пасльонових (Solanaceae), головним чином у табаці і, у менших кількостях, в томатах, картоплі, баклажанах, зелених болгарських перцях. Нікотинові алкалоїди також присутні в листі коки. Нікотин складає від 0, 3 до 5 % маси табака в сухому вигляді, біосинтез нікотину відбувається в коріннях, накопичення нікотину — в листі. Нікотин — сильнодіючий нейротоксин, який особливо діє на комах, завдяки чому нікотин раніше широко використовували як інсектицид, а в наш час з цією ж метою продовжують використовувати похідні нікотину Назва «нікотин» походить від лат. назви табака Nicotiana tabacum, який, в свою чергу, названо на честь Жана Ніко (J. Nicot), посла Франції при португальскому дворі, який у 1560 р відправив порцію табака королеві Єкатерині Медічі, відрекомендувавши його як засіб від мігрені Нікотин – це стимулянт, що активує ЦНС. В низьких концентраціях нікотин активує нікотиновий АХ-рецептор, а також посилює секрецію адреналіну. Викид адреналіну веде до прискорення сердцебиття, посилює силу і частоту серцевих скорочень, кров”яний тиск, моторику кишечника, прискорює дихання, а також підвищує рівень глюкози в крові. l Функціонально подібний до наркотичних сполук
Нікотин Никоти н — алкалоїд, що міститься в рослинах родини пасльонових (Solanaceae), головним чином у табаці і, у менших кількостях, в томатах, картоплі, баклажанах, зелених болгарських перцях. Нікотинові алкалоїди також присутні в листі коки. Нікотин складає від 0, 3 до 5 % маси табака в сухому вигляді, біосинтез нікотину відбувається в коріннях, накопичення нікотину — в листі. Нікотин — сильнодіючий нейротоксин, який особливо діє на комах, завдяки чому нікотин раніше широко використовували як інсектицид, а в наш час з цією ж метою продовжують використовувати похідні нікотину Назва «нікотин» походить від лат. назви табака Nicotiana tabacum, який, в свою чергу, названо на честь Жана Ніко (J. Nicot), посла Франції при португальскому дворі, який у 1560 р відправив порцію табака королеві Єкатерині Медічі, відрекомендувавши його як засіб від мігрені Нікотин – це стимулянт, що активує ЦНС. В низьких концентраціях нікотин активує нікотиновий АХ-рецептор, а також посилює секрецію адреналіну. Викид адреналіну веде до прискорення сердцебиття, посилює силу і частоту серцевих скорочень, кров”яний тиск, моторику кишечника, прискорює дихання, а також підвищує рівень глюкози в крові. l Функціонально подібний до наркотичних сполук
 Кокаїн Поряд з іншими алкалоїдами міститься в рослинах роду Ерітроксилум (Erythroxylum), зокрема: кокаїновий кущ (Erythroxylum coca), Erythroxylum laetevirens, Erythroxylum novogranatense, Erythroxylum recurrens, Erythroxylum steyermarkii тощо, які розповсюджені в тропічній зоні Південної Америки. Як психостимулятор кокаїн вживався індейцями Південної Америки з III ст до нашої ери. Крек (англ. Crack) — більш дешева версія кокаїну для куріння. Є вільною основою кокаїну (англ. free base, має непротоновану аміногрупу), яку отримують шляхом лужного екстрагування розчинниками. Назву крек отримав через характерне клацання, що супроводжує його куріння, цей звук виникає при термічному руйнуванні кристалів вільної основи кокаїну. Температура плавлення крека складає 98 °C, через що він легко випаровується при курінні без втрати наркотичного ефекту. Спідбол (англ. Speedball) — суміш креку й героїну, найнебезпечніша форма кокаїну. Значна небезпека для здоров’я зумовлена перехресною взаємодією опіоїдного наркотика героїну й психостимулятора кокаїну. Така суміш може спричинити серйозні ускладнення в функціонуванні серцево-судинної системи, в перспективі — перехресну фізичну залежність Кокаїн: l Використовується для локальної анестезії l Блокує транспортери моноамінів, особливо – дофаміну, що спричиняє повільне поглинання медіаторів, посилюючи їх ефект l Посилює катехоламінову стимуляцію (посилює звільнення, блокує поглинання із синапт. щілини) l Високонаркотична сполука
Кокаїн Поряд з іншими алкалоїдами міститься в рослинах роду Ерітроксилум (Erythroxylum), зокрема: кокаїновий кущ (Erythroxylum coca), Erythroxylum laetevirens, Erythroxylum novogranatense, Erythroxylum recurrens, Erythroxylum steyermarkii тощо, які розповсюджені в тропічній зоні Південної Америки. Як психостимулятор кокаїн вживався індейцями Південної Америки з III ст до нашої ери. Крек (англ. Crack) — більш дешева версія кокаїну для куріння. Є вільною основою кокаїну (англ. free base, має непротоновану аміногрупу), яку отримують шляхом лужного екстрагування розчинниками. Назву крек отримав через характерне клацання, що супроводжує його куріння, цей звук виникає при термічному руйнуванні кристалів вільної основи кокаїну. Температура плавлення крека складає 98 °C, через що він легко випаровується при курінні без втрати наркотичного ефекту. Спідбол (англ. Speedball) — суміш креку й героїну, найнебезпечніша форма кокаїну. Значна небезпека для здоров’я зумовлена перехресною взаємодією опіоїдного наркотика героїну й психостимулятора кокаїну. Така суміш може спричинити серйозні ускладнення в функціонуванні серцево-судинної системи, в перспективі — перехресну фізичну залежність Кокаїн: l Використовується для локальної анестезії l Блокує транспортери моноамінів, особливо – дофаміну, що спричиняє повільне поглинання медіаторів, посилюючи їх ефект l Посилює катехоламінову стимуляцію (посилює звільнення, блокує поглинання із синапт. щілини) l Високонаркотична сполука
 Біохімічні механізми впливу кокаїну Кокаїн впливає на : дофамінову, норадреналінову, серотонінову системи. l В нормі викид катехоламінів здійснюється шляхом екзоцитозу везикул, що містять нейромедіатор. В подальшому відбувається зворотнє поглинання нейромедіатора (англ. Reuptake) із синаптичної щілини в цитоплазму нейрона із залученням мембранного транспортеру катехоламінів. Із цитоплазми нейромедіатор проникає зворотньо у везикули через роботу везикулярного транспортера моноамінів (VMAT). l Зв’язуючи транспортери моноамінів, кокаїн порушує зворотнє поглинання нейромедіаторів пресинаптичною мембраною. - нейромедіатор залишається в синаптичній щілині; - з кожним проходженням нервового імпульсу концентрація його зростає; - вплив на відповідні рецептори постсинаптичної мембрани посилюється; - спустошується запас нейромедіатора в депо пресинаптичної мембрани; - з кожним нервовим імпульсом виділяється все менше нейромедіаторів і компенсаторно зростає щільність відповідних рецепторів на постсинаптичній мембрані, що особливо характерно для дофамінових рецепторів. l Ейфорія й психічна залежність, які виникають при вживанні кокаїну, пов’ язані головним чином з блокуванням дофамінового транспортера (англ. Dopamine transporter, DAT) в ЦНС. l Порушення обміну норадреналіну проявляється головним чином в симпатичній НС, впливаючи на органи, де кількість норадреналінових рецепторів найбільша. l Вплив кокаїну на систему серотонінового обміну при одноразовому введенні веде до зростання концентрації серотоніну в синаптичній щілині і, як наслідок, — до розвитку центральных ефектів, характерних для кокаїну l Через поступове наростання тяжкості порушення обміну дофаміну при вживанні кокаїну можуть розвиватися специфічні психози, які за клінічним перебігом нагадують шизофренію. l Місцевоанестезуюча дія кокаїну зумовлена блокуванням потенціалзалежних Naканалів перифкрійної НС. Для прояву цього ефекту в ЦНС необхідна велика доза препарату, що є близькою до летальної l
Біохімічні механізми впливу кокаїну Кокаїн впливає на : дофамінову, норадреналінову, серотонінову системи. l В нормі викид катехоламінів здійснюється шляхом екзоцитозу везикул, що містять нейромедіатор. В подальшому відбувається зворотнє поглинання нейромедіатора (англ. Reuptake) із синаптичної щілини в цитоплазму нейрона із залученням мембранного транспортеру катехоламінів. Із цитоплазми нейромедіатор проникає зворотньо у везикули через роботу везикулярного транспортера моноамінів (VMAT). l Зв’язуючи транспортери моноамінів, кокаїн порушує зворотнє поглинання нейромедіаторів пресинаптичною мембраною. - нейромедіатор залишається в синаптичній щілині; - з кожним проходженням нервового імпульсу концентрація його зростає; - вплив на відповідні рецептори постсинаптичної мембрани посилюється; - спустошується запас нейромедіатора в депо пресинаптичної мембрани; - з кожним нервовим імпульсом виділяється все менше нейромедіаторів і компенсаторно зростає щільність відповідних рецепторів на постсинаптичній мембрані, що особливо характерно для дофамінових рецепторів. l Ейфорія й психічна залежність, які виникають при вживанні кокаїну, пов’ язані головним чином з блокуванням дофамінового транспортера (англ. Dopamine transporter, DAT) в ЦНС. l Порушення обміну норадреналіну проявляється головним чином в симпатичній НС, впливаючи на органи, де кількість норадреналінових рецепторів найбільша. l Вплив кокаїну на систему серотонінового обміну при одноразовому введенні веде до зростання концентрації серотоніну в синаптичній щілині і, як наслідок, — до розвитку центральных ефектів, характерних для кокаїну l Через поступове наростання тяжкості порушення обміну дофаміну при вживанні кокаїну можуть розвиватися специфічні психози, які за клінічним перебігом нагадують шизофренію. l Місцевоанестезуюча дія кокаїну зумовлена блокуванням потенціалзалежних Naканалів перифкрійної НС. Для прояву цього ефекту в ЦНС необхідна велика доза препарату, що є близькою до летальної l
 Амфетаміни — клас сполук, що включає власне амфетамін та його похідні, більшість із яких є розповсюдженими наркотиками. l Прикладами похідних амфетаміну є метамфетамін, ефедрин, катінон, меткатінон, 3, 4 метилендиоксиамфетамін (MDA), 3, 4 метилендіоксиметамфетамін (MDMA, «Экстазі» ), 2, 5 -діметокси-4 -бромоамфетамін (DOB). l Амфетаміни і метамфетаміни – синтетичні стимулятори, що подібні за структурою до катехоламінів. Вони стимулюють звільнення катехоламінів навіть у відсутності потенціалу дії, також блокують моноаміносксидазу Короткочасні ефекти – позбавлення страху, ейфорія Тривале використання спричиняє безсоння, втрату ваги, шизофренічні симптоми. l Клінічне використання – зрідка, внаслідок побічних ефектів (напр. , при нарколепсії) l Адреналін Норадреналін Дофамін D-амфетамін
Амфетаміни — клас сполук, що включає власне амфетамін та його похідні, більшість із яких є розповсюдженими наркотиками. l Прикладами похідних амфетаміну є метамфетамін, ефедрин, катінон, меткатінон, 3, 4 метилендиоксиамфетамін (MDA), 3, 4 метилендіоксиметамфетамін (MDMA, «Экстазі» ), 2, 5 -діметокси-4 -бромоамфетамін (DOB). l Амфетаміни і метамфетаміни – синтетичні стимулятори, що подібні за структурою до катехоламінів. Вони стимулюють звільнення катехоламінів навіть у відсутності потенціалу дії, також блокують моноаміносксидазу Короткочасні ефекти – позбавлення страху, ейфорія Тривале використання спричиняє безсоння, втрату ваги, шизофренічні симптоми. l Клінічне використання – зрідка, внаслідок побічних ефектів (напр. , при нарколепсії) l Адреналін Норадреналін Дофамін D-амфетамін
 l l При малих концентраціях амфетаміни впливають на роботу лише мембранних транспортерів катехоламінів, спричиняючи інверсію напрямку транспорту нейромедіатора (із цитоплазми в синаптичну щілину). Такий вплив частково зумовлений тим, що амфетаміни, молекулярна структура яких близька до структури ендогенних катехоламінів, через мембранні транспортери проникають у цитоплазму нейрону, що спричиняє обмінну дифузію нейромедіатора в зворотньому напрямку. При середніх концентраціях додається ще один механізм: амфетаміни, що проникли в цитоплазму нейрона, взаємодіють з везикулярним транспортером моноамінів (VMAT). Амфетаміни спричиняють зворотнє переміщення нейромедіатора із везикули в цитоплазму, через що концентрація нейромедіатора в цитоплазмі значно зростає, і через вищенаведений механізм він потрапляє у синаптичну щілину. Механізм взаємодії амфетамінів з VMAT аналогічний механізму їх взаємодії з мембранними транспортерами. Механізм стимулюючої дії амфетаміну і його аналогів. • Ліворуч — нормальний режим роботи дофамінергічного терміналу • Праворуч — в присутності амфетаміну: везикули зпустошуються, везикулярний викид дофаміну зменшується, вміст везикул викидається у цитоплазму і далі в синаптичну щілину. VMAT — везикулярний транспортер моноамінів.
l l При малих концентраціях амфетаміни впливають на роботу лише мембранних транспортерів катехоламінів, спричиняючи інверсію напрямку транспорту нейромедіатора (із цитоплазми в синаптичну щілину). Такий вплив частково зумовлений тим, що амфетаміни, молекулярна структура яких близька до структури ендогенних катехоламінів, через мембранні транспортери проникають у цитоплазму нейрону, що спричиняє обмінну дифузію нейромедіатора в зворотньому напрямку. При середніх концентраціях додається ще один механізм: амфетаміни, що проникли в цитоплазму нейрона, взаємодіють з везикулярним транспортером моноамінів (VMAT). Амфетаміни спричиняють зворотнє переміщення нейромедіатора із везикули в цитоплазму, через що концентрація нейромедіатора в цитоплазмі значно зростає, і через вищенаведений механізм він потрапляє у синаптичну щілину. Механізм взаємодії амфетамінів з VMAT аналогічний механізму їх взаємодії з мембранними транспортерами. Механізм стимулюючої дії амфетаміну і його аналогів. • Ліворуч — нормальний режим роботи дофамінергічного терміналу • Праворуч — в присутності амфетаміну: везикули зпустошуються, везикулярний викид дофаміну зменшується, вміст везикул викидається у цитоплазму і далі в синаптичну щілину. VMAT — везикулярний транспортер моноамінів.
 Екстазі l MDMA (Екстазі) – галюциногенне похідне амфетаміну l Його основна дія виражена у зростанні рівнів рецепторів до серотоніну (5 Його основна дія виражена HT 2 R) і у зміні рівнів дофаміну і пролактіну l Хронічне вживання екстазі спричиняє хронічні ефекти і загибель серотонінпродукуючих нейронів
Екстазі l MDMA (Екстазі) – галюциногенне похідне амфетаміну l Його основна дія виражена у зростанні рівнів рецепторів до серотоніну (5 Його основна дія виражена HT 2 R) і у зміні рівнів дофаміну і пролактіну l Хронічне вживання екстазі спричиняє хронічні ефекти і загибель серотонінпродукуючих нейронів
 Галюциногени змінюють сенсорне сприйняття Галюциногени мають різні дії на НС, зокрема, на адренергічну, серотонінергічну і АХ- ергічну системи LSD , мескалін (речовина із мексиканського кактуса) і псілосибін (галюциногенні гриби) - візуальні ефекти LSD-25 вперше отримав у 1938 р швейцарський хімік Альберт Хофман, але психотропні властивості цієї сполуки були виявлені випадково LSD нагадує за структурою серотонін і діє як агоніст 5 -HT рецепторів. Щодо клінічних використань – даних немає Оскільки всі галюциногени діють на серотонінові рецептори, їх ефекти досить схожі. Однак ці наркотики сильно різняться за ефективністю, тривалістю дії тощо. Найпотужнішим наркотиком цього класу є LSD. Ефективність псилоцибіну складає біля 1% ефективності LSD. Мескалін приблизно в 3000 разів слабкіший за LSD Albert Hofmann: винахідник LSD
Галюциногени змінюють сенсорне сприйняття Галюциногени мають різні дії на НС, зокрема, на адренергічну, серотонінергічну і АХ- ергічну системи LSD , мескалін (речовина із мексиканського кактуса) і псілосибін (галюциногенні гриби) - візуальні ефекти LSD-25 вперше отримав у 1938 р швейцарський хімік Альберт Хофман, але психотропні властивості цієї сполуки були виявлені випадково LSD нагадує за структурою серотонін і діє як агоніст 5 -HT рецепторів. Щодо клінічних використань – даних немає Оскільки всі галюциногени діють на серотонінові рецептори, їх ефекти досить схожі. Однак ці наркотики сильно різняться за ефективністю, тривалістю дії тощо. Найпотужнішим наркотиком цього класу є LSD. Ефективність псилоцибіну складає біля 1% ефективності LSD. Мескалін приблизно в 3000 разів слабкіший за LSD Albert Hofmann: винахідник LSD
 Біохімічні механізми дії ЛСД l l l Біохімічний механізм дії ЛСД є складним і на даний час ще не досліджений до кінця. Діетиламід лізергінової кислоти є структурним аналогом серотоніну. ЛСД впливає на велику кількість G-білкових рецепторів: всі підвиди дофамінових рецепторів, всі підвиди адренорецепторів, а також на низку інших. ЛСД зв’язується практично зі всіма серотоніновими рецепторами, окрім 5 HT 3 й 5 -HT 4. Однак слід враховувати, що для більшості цих рецепторів ЛСД не спричиняє їх активації через невеликі концентрації в синапсах для типових доз. Рекреаційні дози можуть впливати на 5 -HT 1 A, 5 -HT 2 C, 5 -HT 5 A, 5 -HT 5 B й 5 -HT 6 рецептори.
Біохімічні механізми дії ЛСД l l l Біохімічний механізм дії ЛСД є складним і на даний час ще не досліджений до кінця. Діетиламід лізергінової кислоти є структурним аналогом серотоніну. ЛСД впливає на велику кількість G-білкових рецепторів: всі підвиди дофамінових рецепторів, всі підвиди адренорецепторів, а також на низку інших. ЛСД зв’язується практично зі всіма серотоніновими рецепторами, окрім 5 HT 3 й 5 -HT 4. Однак слід враховувати, що для більшості цих рецепторів ЛСД не спричиняє їх активації через невеликі концентрації в синапсах для типових доз. Рекреаційні дози можуть впливати на 5 -HT 1 A, 5 -HT 2 C, 5 -HT 5 A, 5 -HT 5 B й 5 -HT 6 рецептори.
 Фенциклідин l Фенциклідин (повна назва – феніл-циклогексил-піперидин, сокращённое англ. PCP; “ангельський пил”. l Роз”єднувальні ліки, що продукують відчуття деперсоналізації і відриву від дійсності) — синтетичний препарат для внутрішньовенного наркозу. Був синтезований у другій половині 1950 -х рр у США й під назвою SERNYL впроваджений у медичну практику, оскільки, на відміну від опіатів, він не пригнічує серцево-судинну систему і дихання. Однак в процесі клінічного застосування були виявлені токсичні сторонні ефекти, які включають постопераційні галюцінації, збудження, ментальні розлади й депресивні стани, і, незважаючи на позитивні терапевтичні властивості, препарат був виключений із клінічної практики. PCP - антагоніст NMDA-рецептору, також непрямо стимулює вивільнення дофаміну. Так, дію фенциклідину й близьких до нього сполук пов’язують з впливом на NMDA-peцептори, які локалізуються в гіпокампі, лобній корі, стріатумі й мигдалині, тобто в структурах дофамінової й серотонінової систем мозку; крім того, фенциклідин, як і інші наркотики, здатний блокувати зворотнє захоплення багатьох нейротрансміттерів; Також є дані про вплив на серотонінергічну систему через взаємодію з різними підтипами серотонінових рецепторів. Сторонні ефекти – агресивінсть і кататонія (ступор) PCP використовують як хімічну модель шизофренії l
Фенциклідин l Фенциклідин (повна назва – феніл-циклогексил-піперидин, сокращённое англ. PCP; “ангельський пил”. l Роз”єднувальні ліки, що продукують відчуття деперсоналізації і відриву від дійсності) — синтетичний препарат для внутрішньовенного наркозу. Був синтезований у другій половині 1950 -х рр у США й під назвою SERNYL впроваджений у медичну практику, оскільки, на відміну від опіатів, він не пригнічує серцево-судинну систему і дихання. Однак в процесі клінічного застосування були виявлені токсичні сторонні ефекти, які включають постопераційні галюцінації, збудження, ментальні розлади й депресивні стани, і, незважаючи на позитивні терапевтичні властивості, препарат був виключений із клінічної практики. PCP - антагоніст NMDA-рецептору, також непрямо стимулює вивільнення дофаміну. Так, дію фенциклідину й близьких до нього сполук пов’язують з впливом на NMDA-peцептори, які локалізуються в гіпокампі, лобній корі, стріатумі й мигдалині, тобто в структурах дофамінової й серотонінової систем мозку; крім того, фенциклідин, як і інші наркотики, здатний блокувати зворотнє захоплення багатьох нейротрансміттерів; Також є дані про вплив на серотонінергічну систему через взаємодію з різними підтипами серотонінових рецепторів. Сторонні ефекти – агресивінсть і кататонія (ступор) PCP використовують як хімічну модель шизофренії l
 Метилксантини (кофеїн, теофілін) l l l Інгібітори фосфодіестерази. Конкурентні антагоністи аденозину Метилксантини застосовують при лікуванні бронхіальної астми: інгібування : фосфодіестерази сприяє накопиченню в м’язових клітинах ц. АМФ, який гальмує поєднання міозину з актином й веде до послаблення гладеньких м’язів бронхів й усунення бронхоспазму. Застосовуються також в лікуванні хронічної астми й хронічних обструктивних захворювань легень, апное новонароджених, для зниження втомлюваності діафрагми та як діуретики Напрямки дії: l Зростає [Ca++] всередині клітини l Зростає вміст ц. AMФ, ц. ГMФ l Блокуються аденозинові рецептори Кофеїн l Летальна доза - 10 г (~100 чашок) l Негативні симптоми з”являються у людей, що випивають понад 6 чашок (600 mг/день) Кофеїн Теофілін
Метилксантини (кофеїн, теофілін) l l l Інгібітори фосфодіестерази. Конкурентні антагоністи аденозину Метилксантини застосовують при лікуванні бронхіальної астми: інгібування : фосфодіестерази сприяє накопиченню в м’язових клітинах ц. АМФ, який гальмує поєднання міозину з актином й веде до послаблення гладеньких м’язів бронхів й усунення бронхоспазму. Застосовуються також в лікуванні хронічної астми й хронічних обструктивних захворювань легень, апное новонароджених, для зниження втомлюваності діафрагми та як діуретики Напрямки дії: l Зростає [Ca++] всередині клітини l Зростає вміст ц. AMФ, ц. ГMФ l Блокуються аденозинові рецептори Кофеїн l Летальна доза - 10 г (~100 чашок) l Негативні симптоми з”являються у людей, що випивають понад 6 чашок (600 mг/день) Кофеїн Теофілін
 Кетамін l Клінічне використання: Анестетік Дія: l Інгібітор поглинання дофаміну, серотоніну, норадреналіну l NMDA-антагонист, за високої концентрації також зв’язує опіоїдні μ- й σ-рецептори l Препарат також може діяти як ефективний антидепресант, хоча через його виражені галюциногенні властивості кетамін навряд чи коли-небудь буде використовуватися для боротьби з депресією l l Психологічні ефекти: l Дисоціативна поведінка, кома
Кетамін l Клінічне використання: Анестетік Дія: l Інгібітор поглинання дофаміну, серотоніну, норадреналіну l NMDA-антагонист, за високої концентрації також зв’язує опіоїдні μ- й σ-рецептори l Препарат також може діяти як ефективний антидепресант, хоча через його виражені галюциногенні властивості кетамін навряд чи коли-небудь буде використовуватися для боротьби з депресією l l Психологічні ефекти: l Дисоціативна поведінка, кома
