Московская государственная академия тонкой химической технологии им.

















7b_group.ppt
- Размер: 593 Кб
- Количество слайдов: 32
Описание презентации Московская государственная академия тонкой химической технологии им. по слайдам
 Московская государственная академия тонкой химической технологии им. М. В. Ломоносова ВСПОМОГАТЕЛЬНЫЕ СХЕМЫ ПО НЕОРГАНИЧЕСКОЙ ХИМИИ Сорокина О. В. Утверждено библиотечным Советом МИТХТ им. М. В. Ломоносова Московская Государственная академия тонкой химической технологии им. М. В. Ломоносова (МИТХТ), 2006 г. VIIB ГРУППА
Московская государственная академия тонкой химической технологии им. М. В. Ломоносова ВСПОМОГАТЕЛЬНЫЕ СХЕМЫ ПО НЕОРГАНИЧЕСКОЙ ХИМИИ Сорокина О. В. Утверждено библиотечным Советом МИТХТ им. М. В. Ломоносова Московская Государственная академия тонкой химической технологии им. М. В. Ломоносова (МИТХТ), 2006 г. VIIB ГРУППА
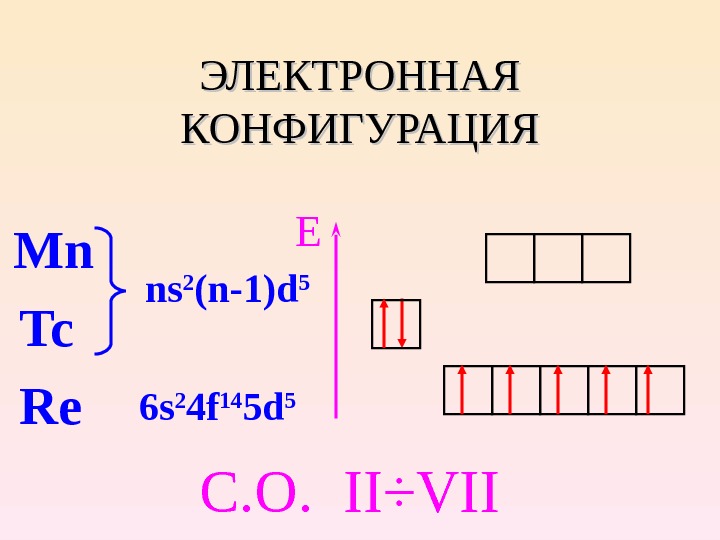
 ЭЛЕКТРОННАЯ КОНФИГУРАЦИЯ Mn Tc Re ns 2 (n-1)d 5 6 s 2 4 f 14 5 d 5 E C. О. II÷VII
ЭЛЕКТРОННАЯ КОНФИГУРАЦИЯ Mn Tc Re ns 2 (n-1)d 5 6 s 2 4 f 14 5 d 5 E C. О. II÷VII
 ПРОСТЫЕ ВЕЩЕСТВА Mn Tc Re I эв. 7. 4 7. 2 7. 9 потенц иал ионизац ии
ПРОСТЫЕ ВЕЩЕСТВА Mn Tc Re I эв. 7. 4 7. 2 7. 9 потенц иал ионизац ии
 ОБЩИЕ СВОЙСТВА к. ч. 4, 6 (Mn) Mn : катионы, анионы Tc , Re – только анионы [Mn(H 2 O) 6 ] 2+ , Mn. O 4 — Тс, Re не образ. аквакатионов, только оксокомплексы MO 4 n —
ОБЩИЕ СВОЙСТВА к. ч. 4, 6 (Mn) Mn : катионы, анионы Tc , Re – только анионы [Mn(H 2 O) 6 ] 2+ , Mn. O 4 — Тс, Re не образ. аквакатионов, только оксокомплексы MO 4 n —
 В ПРИРОДЕ 14. Mn – 0. 09% Tc 81. Re – 1. 10 — 7 % Руды : пиролюзит Mn. O 2 гаусманит Mn 3 O 4 ( Mn 2 O 3. Mn. O ) Руды Cu, Mo своих минералов нет (рассеянный эл-т)
В ПРИРОДЕ 14. Mn – 0. 09% Tc 81. Re – 1. 10 — 7 % Руды : пиролюзит Mn. O 2 гаусманит Mn 3 O 4 ( Mn 2 O 3. Mn. O ) Руды Cu, Mo своих минералов нет (рассеянный эл-т)
 ПРИМЕНЕНИЕ Тс – радиоактивный элемент Тс 99 43 τ 1/2 =2, 12. 10 5 лет Получают из радиоактивны х отход ов атомной энергетики. Сейчас Tc (искусств. ) больше, чем Re Mn – в сталях, электрохимии Тс – медицина Re – катализатор (нефтяная промышл. )
ПРИМЕНЕНИЕ Тс – радиоактивный элемент Тс 99 43 τ 1/2 =2, 12. 10 5 лет Получают из радиоактивны х отход ов атомной энергетики. Сейчас Tc (искусств. ) больше, чем Re Mn – в сталях, электрохимии Тс – медицина Re – катализатор (нефтяная промышл. )
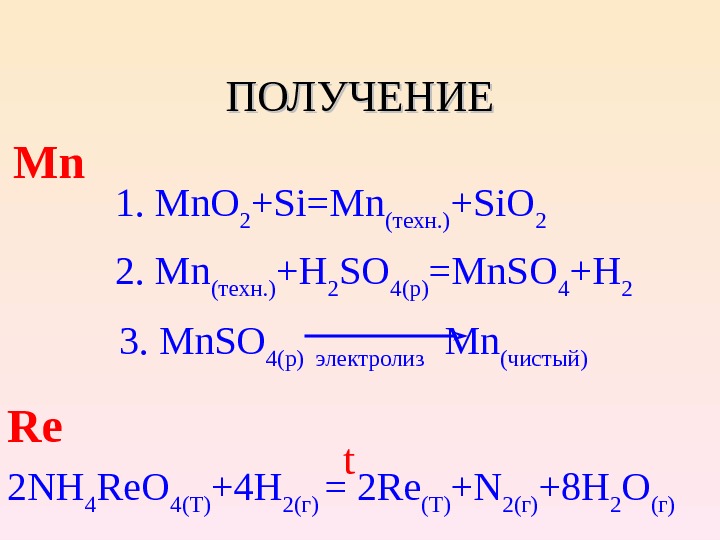
 ПОЛУЧЕНИЕ Mn 1. Mn. O 2 +Si=Mn ( техн. ) +Si. O 2 2. Mn ( техн. ) +H 2 SO 4(p) =Mn. SO 4 +H 2 3. Mn. SO 4( p ) электролиз Mn (чистый) Re 2 NH 4 Re. O 4(T) +4 H 2( г ) = 2 Re (T) +N 2( г ) +8 H 2 O ( г) t
ПОЛУЧЕНИЕ Mn 1. Mn. O 2 +Si=Mn ( техн. ) +Si. O 2 2. Mn ( техн. ) +H 2 SO 4(p) =Mn. SO 4 +H 2 3. Mn. SO 4( p ) электролиз Mn (чистый) Re 2 NH 4 Re. O 4(T) +4 H 2( г ) = 2 Re (T) +N 2( г ) +8 H 2 O ( г) t
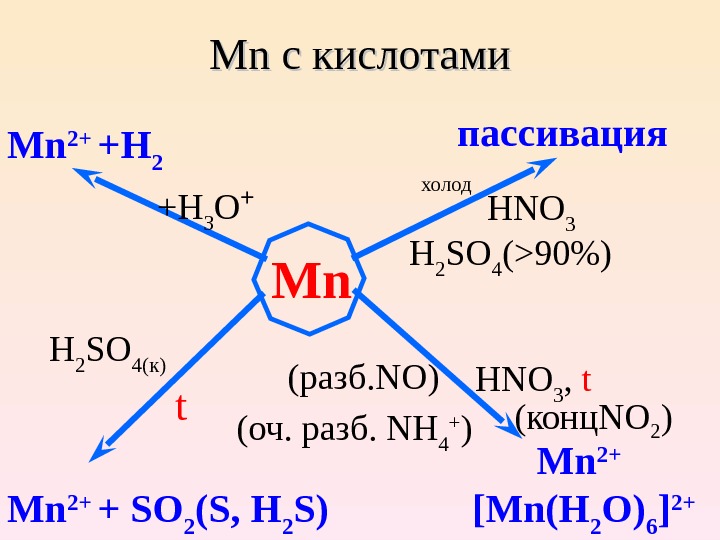
 Mn Mn с кислотами Mn. Mn 2+ + H 2 +H 3 O + холод пассивация HNO 3 H 2 SO 4 (>90%) H 2 SO 4( к) t Mn 2+ + SO 2 (S, H 2 S) (конц NO 2 )HNO 3 , t (разб. NO ) (оч. разб. NH 4 + ) Mn 2+ [Mn(H 2 O) 6 ] 2+
Mn Mn с кислотами Mn. Mn 2+ + H 2 +H 3 O + холод пассивация HNO 3 H 2 SO 4 (>90%) H 2 SO 4( к) t Mn 2+ + SO 2 (S, H 2 S) (конц NO 2 )HNO 3 , t (разб. NO ) (оч. разб. NH 4 + ) Mn 2+ [Mn(H 2 O) 6 ] 2+
 Re Re с кислотами 3 Re+ 7 HNO 3 = 3 HRe. O 4 +7 NO+2 H 2 O средней концентр. 30% Re+HNO 3( конц. ) ≠ 2 Re+7 H 2 O 2 = 2 HRe. O 4 +6 H 2 O
Re Re с кислотами 3 Re+ 7 HNO 3 = 3 HRe. O 4 +7 NO+2 H 2 O средней концентр. 30% Re+HNO 3( конц. ) ≠ 2 Re+7 H 2 O 2 = 2 HRe. O 4 +6 H 2 O
 взаимодействие с MOHMOH Mn , Tc , Re – не взм. с растворами МОН Mn , Tc , Re – взм. с расплавами МОН !!! 2 Mn +4 KOH +3 О 2 = 2 K 2 Mn. O 4 +2 H 2 O (г) KRe. O 4 2 Re+2 KOH+7 KNO 3 = 2 KRe. O 4 +7 KNO 2 +H 2 O ( г ) K 2 Mn. O 4 Тс расплав t Тс t
взаимодействие с MOHMOH Mn , Tc , Re – не взм. с растворами МОН Mn , Tc , Re – взм. с расплавами МОН !!! 2 Mn +4 KOH +3 О 2 = 2 K 2 Mn. O 4 +2 H 2 O (г) KRe. O 4 2 Re+2 KOH+7 KNO 3 = 2 KRe. O 4 +7 KNO 2 +H 2 O ( г ) K 2 Mn. O 4 Тс расплав t Тс t
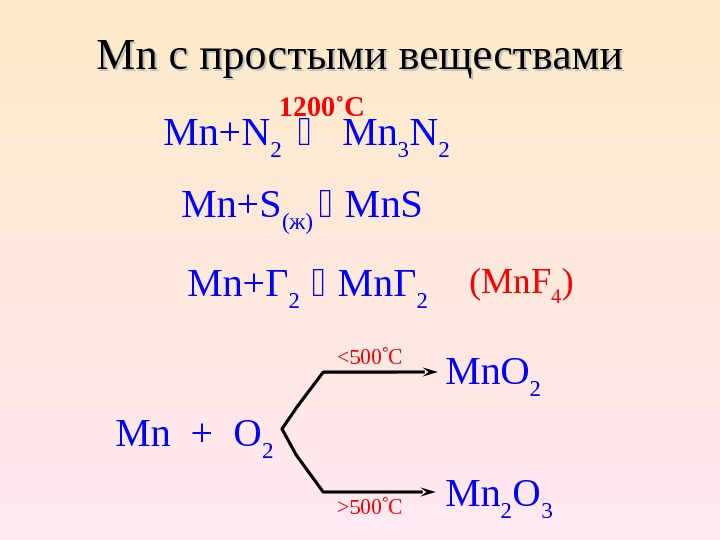
 Mn Mn с простыми веществами Mn+N 2 Mn 3 N 2 1200˚C Mn+S ( ж ) Mn. S Mn+ Г 2 Mn Г 2 (Mn. F 4 ) Mn + O 2 Mn 2 O 3
Mn Mn с простыми веществами Mn+N 2 Mn 3 N 2 1200˚C Mn+S ( ж ) Mn. S Mn+ Г 2 Mn Г 2 (Mn. F 4 ) Mn + O 2 Mn 2 O 3
 Re Re с простыми веществами Re + Tc F 2 Cl 2 I 2 Re +VI F 6 Re 3 +III Cl 9 (Re +II I 2 ) n Re+O 2 Re 2 +VII O 7 Re+S Re +IV S 2 Г 2 t >
Re Re с простыми веществами Re + Tc F 2 Cl 2 I 2 Re +VI F 6 Re 3 +III Cl 9 (Re +II I 2 ) n Re+O 2 Re 2 +VII O 7 Re+S Re +IV S 2 Г 2 t >
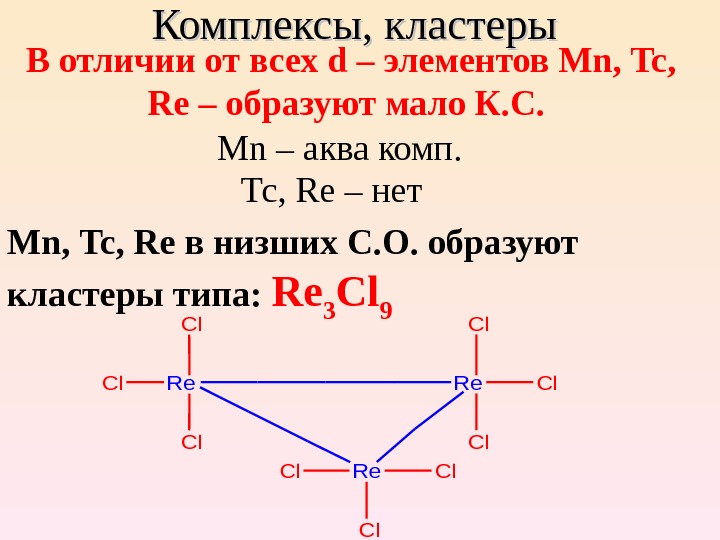
 Комплексы, кластеры В отличии от всех d – элементов Mn , Tc , Re – образуют мало К. С. Mn – аква комп. Тс, Re – нет Mn , Tc , Re в низших С. О. образуют кластеры типа: Re 3 Cl 9 Re. Re Re Cl Cl Cl
Комплексы, кластеры В отличии от всех d – элементов Mn , Tc , Re – образуют мало К. С. Mn – аква комп. Тс, Re – нет Mn , Tc , Re в низших С. О. образуют кластеры типа: Re 3 Cl 9 Re. Re Re Cl Cl Cl
![Степень Окисления « 0 » [(CO) 5 Mn – Mn(CO) 5 ] 0 Степень Окисления « 0 » [(CO) 5 Mn – Mn(CO) 5 ] 0](/docs//7b_group_images/7b_group_13.jpg) Степень Окисления « 0 » [(CO) 5 Mn – Mn(CO) 5 ] 0 H 2 , P, t H[Mn(CO) 5 ] Cl 2 [Mn +I (CO) 5 Cl] 0 хлоропентакарбонил- марганец( I )
Степень Окисления « 0 » [(CO) 5 Mn – Mn(CO) 5 ] 0 H 2 , P, t H[Mn(CO) 5 ] Cl 2 [Mn +I (CO) 5 Cl] 0 хлоропентакарбонил- марганец( I )
 Кислородные соединения Mn. Mn С. О. Mn II Mn. O 1÷ 1. 13 серозел. , полупроводн. Mn(OH) 2 III (Mn II Mn 2 III )O 4 амфот. , преобл. Mn 2 O 3 -основн. Mn. O ( OH ) IV Mn. O 2 – амфот. V Mn. O 4 3 — c иний VI Mn. O 4 2 — зелен. VII Mn 2 O 7 –кисл. неуст. HMn. O 4 (20%) сильн. кислота
Кислородные соединения Mn. Mn С. О. Mn II Mn. O 1÷ 1. 13 серозел. , полупроводн. Mn(OH) 2 III (Mn II Mn 2 III )O 4 амфот. , преобл. Mn 2 O 3 -основн. Mn. O ( OH ) IV Mn. O 2 – амфот. V Mn. O 4 3 — c иний VI Mn. O 4 2 — зелен. VII Mn 2 O 7 –кисл. неуст. HMn. O 4 (20%) сильн. кислота
 Tc, Re с. о. Tc, Re III IV MO 2 M(OH) 4 V VI MO 3 VII M 2 O 7 – уст. HMO 4 (40%) слаб. кислота амфот.
Tc, Re с. о. Tc, Re III IV MO 2 M(OH) 4 V VI MO 3 VII M 2 O 7 – уст. HMO 4 (40%) слаб. кислота амфот.
 Особенности химии Mn. Mn 1. Mn – активный металл (φ 0 =-1, 19 В) 2. Устойчивые СО: + II и + IV 3. Mn подобен Mg : не амфотерн ый гидроксид растворяется NH 4 + ( p )+ II 4. C увеличением СО усиливаются кислотные свойства 5. С увеличением СО усиливаются окислительные свойства.
Особенности химии Mn. Mn 1. Mn – активный металл (φ 0 =-1, 19 В) 2. Устойчивые СО: + II и + IV 3. Mn подобен Mg : не амфотерн ый гидроксид растворяется NH 4 + ( p )+ II 4. C увеличением СО усиливаются кислотные свойства 5. С увеличением СО усиливаются окислительные свойства.
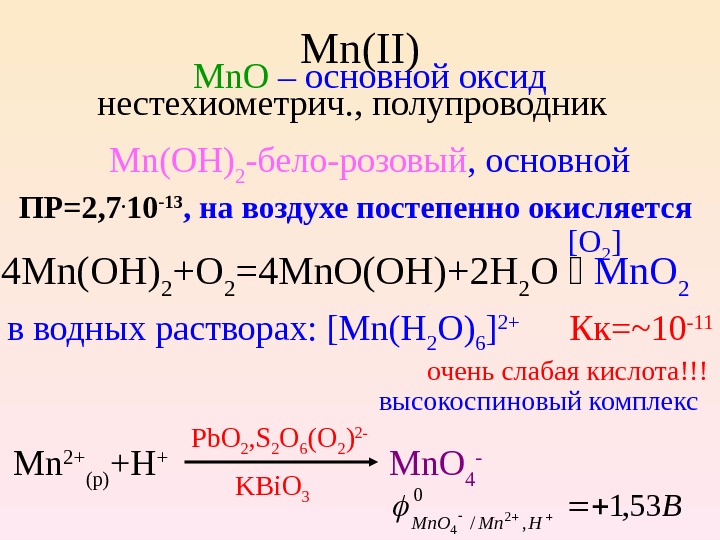
 Mn ( II ) Mn. O – основной оксид н естехиом етрич. , полупровод ник Mn ( OH ) 2 -бело-розовый , основной ПР=2, 7. 10 -13 , на воздухе постепенно окисляется 4 Mn(OH) 2 +O 2 =4 Mn. O(OH)+2 H 2 O Mn. O 2 в водных растворах: [ Mn ( H 2 O ) 6 ] 2+ очень слабая кислота! !! высокоспиновый комплекс Mn 2+ (p) +H + Mn. O 4 — KBi. O 3 [O 2 ] Кк=~10 -11 Pb. O 2 , S 2 O 6 (O 2 ) 2 — B HMn. O 53, 10 , /
Mn ( II ) Mn. O – основной оксид н естехиом етрич. , полупровод ник Mn ( OH ) 2 -бело-розовый , основной ПР=2, 7. 10 -13 , на воздухе постепенно окисляется 4 Mn(OH) 2 +O 2 =4 Mn. O(OH)+2 H 2 O Mn. O 2 в водных растворах: [ Mn ( H 2 O ) 6 ] 2+ очень слабая кислота! !! высокоспиновый комплекс Mn 2+ (p) +H + Mn. O 4 — KBi. O 3 [O 2 ] Кк=~10 -11 Pb. O 2 , S 2 O 6 (O 2 ) 2 — B HMn. O 53, 10 , /
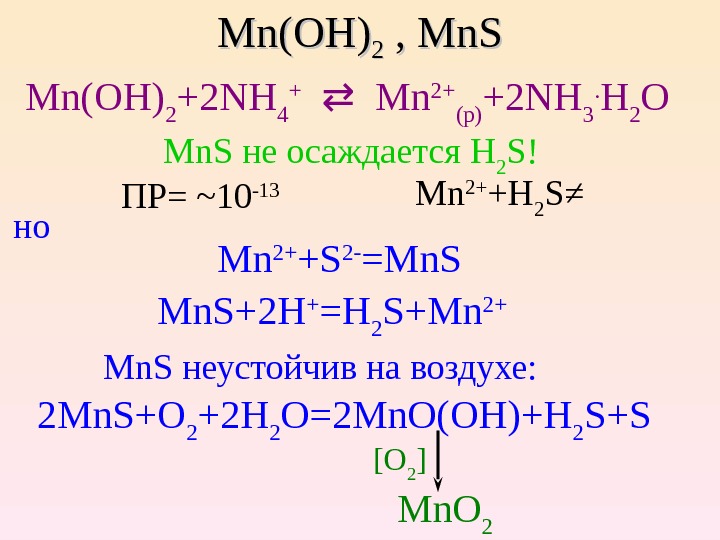
 Mn(OH) 22 , Mn. S Mn(OH) 2 +2 NH 4 + Mn 2+ (p) +2 NH 3. H 2 O Mn. S не осаждается H 2 S ! ПР= ~10 -13 Mn 2+ + H 2 S ≠ но Mn 2+ +S 2 — =Mn. S Mn. S+2 H + =H 2 S+Mn 2+ Mn. S неустойчив на воздухе: 2 Mn. S+O 2 +2 H 2 O=2 Mn. O(OH)+H 2 S+S [O 2 ] Mn. O
Mn(OH) 22 , Mn. S Mn(OH) 2 +2 NH 4 + Mn 2+ (p) +2 NH 3. H 2 O Mn. S не осаждается H 2 S ! ПР= ~10 -13 Mn 2+ + H 2 S ≠ но Mn 2+ +S 2 — =Mn. S Mn. S+2 H + =H 2 S+Mn 2+ Mn. S неустойчив на воздухе: 2 Mn. S+O 2 +2 H 2 O=2 Mn. O(OH)+H 2 S+S [O 2 ] Mn. O
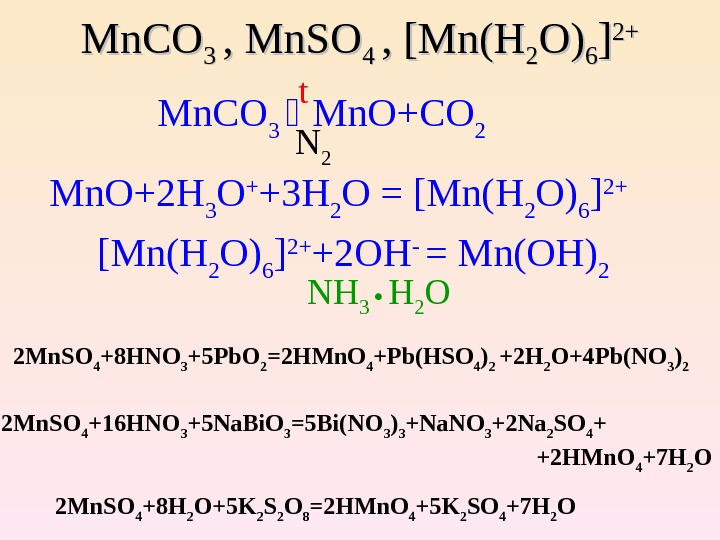
 Mn. CO 3 3 , Mn. SO 4 4 , [Mn(H 22 O)O) 66 ]] 2+2+ Mn. CO 3 Mn. O+CO 2 N 2 Mn. O+2 H 3 O + +3 H 2 O = [Mn(H 2 O) 6 ] 2+ +2 OH — = Mn(OH) 2 NH 3 H 2 O 2 Mn. SO 4 +8 HNO 3 +5 Pb. O 2 =2 HMn. O 4 +Pb(HSO 4 ) 2 +2 H 2 O+4 Pb(NO 3 ) 2 2 Mn. SO 4 +16 HNO 3 +5 Na. Bi. O 3 =5 Bi(NO 3 ) 3 +Na. NO 3 +2 Na 2 SO 4 + +2 HMn. O 4 +7 H 2 O 2 Mn. SO 4 +8 H 2 O+5 K 2 S 2 O 8 =2 HMn. O 4 +5 K 2 SO 4 +7 H 2 O t
Mn. CO 3 3 , Mn. SO 4 4 , [Mn(H 22 O)O) 66 ]] 2+2+ Mn. CO 3 Mn. O+CO 2 N 2 Mn. O+2 H 3 O + +3 H 2 O = [Mn(H 2 O) 6 ] 2+ +2 OH — = Mn(OH) 2 NH 3 H 2 O 2 Mn. SO 4 +8 HNO 3 +5 Pb. O 2 =2 HMn. O 4 +Pb(HSO 4 ) 2 +2 H 2 O+4 Pb(NO 3 ) 2 2 Mn. SO 4 +16 HNO 3 +5 Na. Bi. O 3 =5 Bi(NO 3 ) 3 +Na. NO 3 +2 Na 2 SO 4 + +2 HMn. O 4 +7 H 2 O 2 Mn. SO 4 +8 H 2 O+5 K 2 S 2 O 8 =2 HMn. O 4 +5 K 2 SO 4 +7 H 2 O t
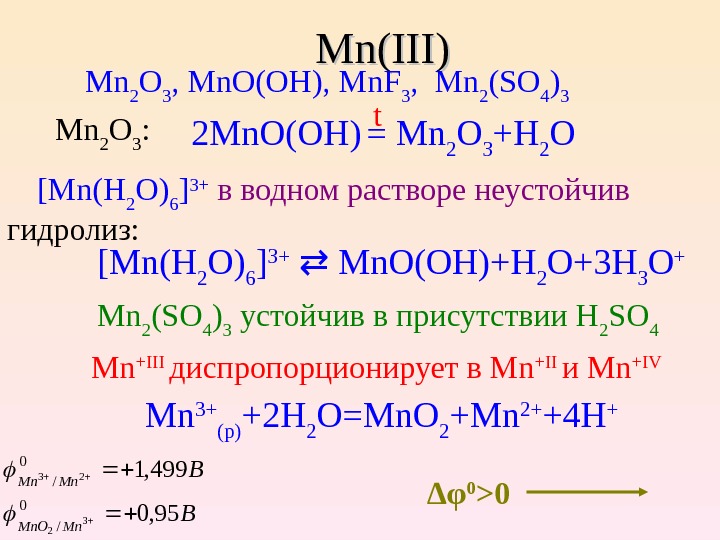
 2 Mn. O(OH) = Mn 2 O 3 +H 2 O Mn. Mn (( IIIIII )) Mn 2 O 3 , Mn. O(OH), Mn. F 3 , Mn 2 (SO 4 ) 3 Mn 2 O 3 : [ Mn ( H 2 O ) 6 ] 3+ в водном растворе неустойчив гидролиз: [ Mn ( H 2 O ) 6 ] 3+ Mn. O ( OH )+ H 2 O +3 H 3 O + Mn 2 ( SO 4 ) 3 устойчив в присутствии Н 2 SO 4 Mn + III диспропорционирует в Mn + II и Mn + IV Mn 3+ (p) +2 H 2 O=Mn. O 2 +Mn 2+ +4 H + ∆ φ 0 >0 t B B Mn. O Mn. Mn 95, 0 499, 1 0 /0 /
2 Mn. O(OH) = Mn 2 O 3 +H 2 O Mn. Mn (( IIIIII )) Mn 2 O 3 , Mn. O(OH), Mn. F 3 , Mn 2 (SO 4 ) 3 Mn 2 O 3 : [ Mn ( H 2 O ) 6 ] 3+ в водном растворе неустойчив гидролиз: [ Mn ( H 2 O ) 6 ] 3+ Mn. O ( OH )+ H 2 O +3 H 3 O + Mn 2 ( SO 4 ) 3 устойчив в присутствии Н 2 SO 4 Mn + III диспропорционирует в Mn + II и Mn + IV Mn 3+ (p) +2 H 2 O=Mn. O 2 +Mn 2+ +4 H + ∆ φ 0 >0 t B B Mn. O Mn. Mn 95, 0 499, 1 0 /0 /
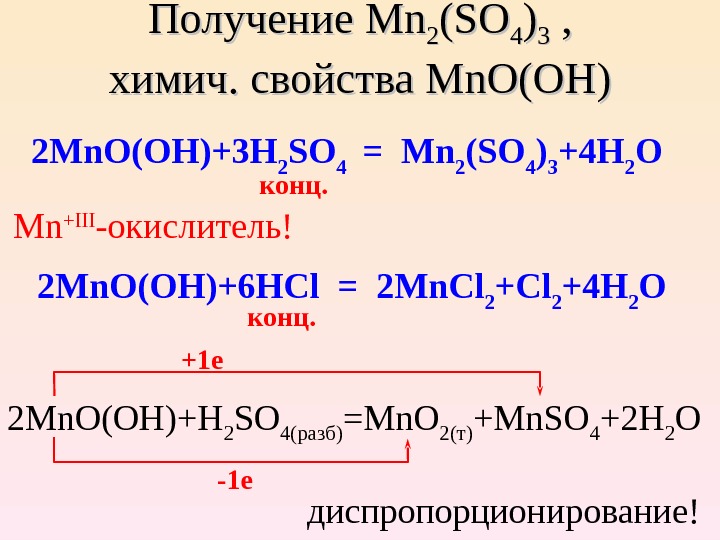
 Получение Mn. Mn 22 (SO(SO 44 )) 33 , , химич. cc войства Mn. O(OH) 2 Mn. O(OH)+3 H 2 SO 4 = Mn 2 (SO 4 ) 3 +4 H 2 O Mn + III -окислитель! 2 Mn. O ( OH )+6 HCl = 2 Mn. Cl 2 +4 H 2 O 2 Mn. O(OH)+H 2 SO 4( разб ) =Mn. O 2( т ) +Mn. SO 4 +2 H 2 O -1 e диспропорционирование! конц. +1 e
Получение Mn. Mn 22 (SO(SO 44 )) 33 , , химич. cc войства Mn. O(OH) 2 Mn. O(OH)+3 H 2 SO 4 = Mn 2 (SO 4 ) 3 +4 H 2 O Mn + III -окислитель! 2 Mn. O ( OH )+6 HCl = 2 Mn. Cl 2 +4 H 2 O 2 Mn. O(OH)+H 2 SO 4( разб ) =Mn. O 2( т ) +Mn. SO 4 +2 H 2 O -1 e диспропорционирование! конц. +1 e
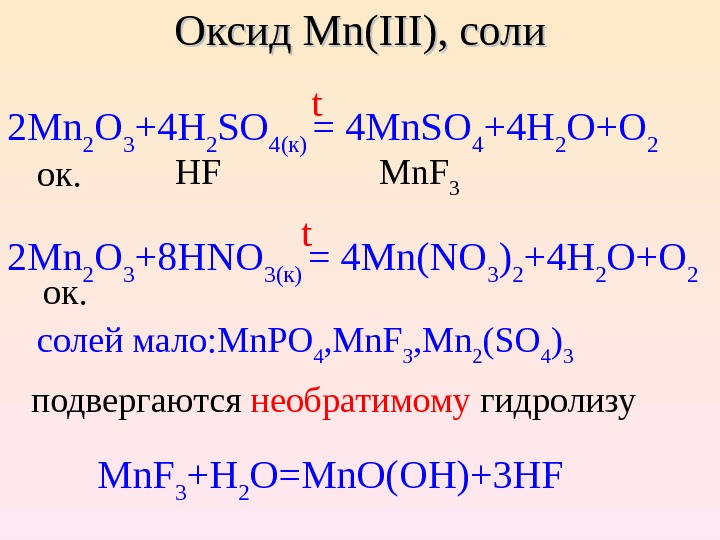
 Оксид Mn. Mn (( IIIIII )) , , соли 2 Mn 2 O 3 + 4 H 2 SO 4( к ) = 4 Mn. SO 4 + 4 H 2 O+O 2 ок. HF Mn. F 3 2 Mn 2 O 3 + 8 HNO 3( к ) = 4 Mn(NO 3 ) 2 + 4 H 2 O+O 2 солей мало: Mn. PO 4 , Mn. F 3 , Mn 2 (SO 4 ) 3 подверг аются н еобр атимому гидролизу Mn. F 3 +H 2 O=Mn. O(OH)+3 HF t t ок.
Оксид Mn. Mn (( IIIIII )) , , соли 2 Mn 2 O 3 + 4 H 2 SO 4( к ) = 4 Mn. SO 4 + 4 H 2 O+O 2 ок. HF Mn. F 3 2 Mn 2 O 3 + 8 HNO 3( к ) = 4 Mn(NO 3 ) 2 + 4 H 2 O+O 2 солей мало: Mn. PO 4 , Mn. F 3 , Mn 2 (SO 4 ) 3 подверг аются н еобр атимому гидролизу Mn. F 3 +H 2 O=Mn. O(OH)+3 HF t t ок.
 Mn. Mn (( IVIV )) , , Mn. O 2 1. Очень устойчив, не реагируе т с Н 3 O + , OH — ∆ G 0 298 =-465 к. Дж/моль 2. окислитель: 0 = +1, 24 В 3. слабый в-тель: 0 = +0, 65 В 4. катализатор Mn. O 2 / Mn 2+ (Н + ) Mn. O 4 2 — / Mn. O 2 (О H — )
Mn. Mn (( IVIV )) , , Mn. O 2 1. Очень устойчив, не реагируе т с Н 3 O + , OH — ∆ G 0 298 =-465 к. Дж/моль 2. окислитель: 0 = +1, 24 В 3. слабый в-тель: 0 = +0, 65 В 4. катализатор Mn. O 2 / Mn 2+ (Н + ) Mn. O 4 2 — / Mn. O 2 (О H — )
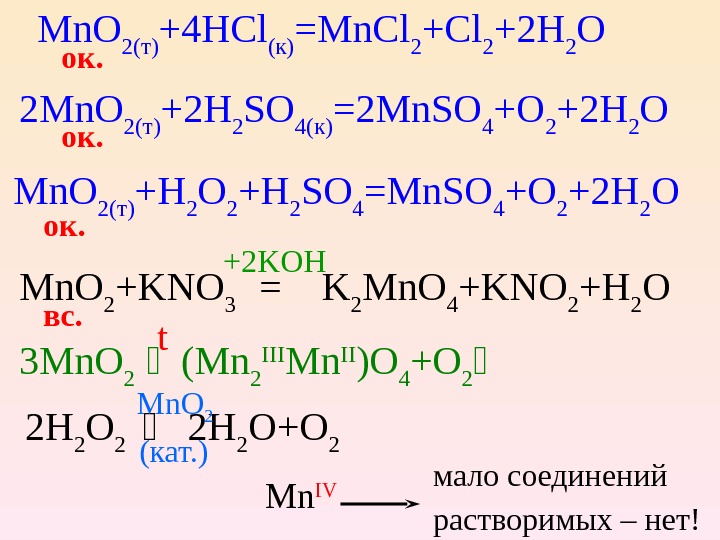
 Mn. O 2( т ) +4 HCl ( к ) =Mn. Cl 2 +2 H 2 O ок. 2 Mn. O 2( т ) +2 H 2 SO 4( к ) =2 Mn. SO 4 +O 2 +2 H 2 O Mn. O 2( т ) +H 2 O 2 +H 2 SO 4 =Mn. SO 4 +O 2 +2 H 2 O Mn. O 2 +KNO 3 = K 2 Mn. O 4 +KNO 2 +H 2 O вс. 3 Mn. O 2 (Mn 2 III Mn II )O 4 +O 2 ок. +2 KOH t 2 H 2 O 2 2 H 2 O+O 2 Mn. O 2 (кат. ) Mn IV мало соединений растворимых – нет!
Mn. O 2( т ) +4 HCl ( к ) =Mn. Cl 2 +2 H 2 O ок. 2 Mn. O 2( т ) +2 H 2 SO 4( к ) =2 Mn. SO 4 +O 2 +2 H 2 O Mn. O 2( т ) +H 2 O 2 +H 2 SO 4 =Mn. SO 4 +O 2 +2 H 2 O Mn. O 2 +KNO 3 = K 2 Mn. O 4 +KNO 2 +H 2 O вс. 3 Mn. O 2 (Mn 2 III Mn II )O 4 +O 2 ок. +2 KOH t 2 H 2 O 2 2 H 2 O+O 2 Mn. O 2 (кат. ) Mn IV мало соединений растворимых – нет!
 Mn ( VI ) 1. Соединений очень мало 2. Устойч. тв. K 2 Mn. O 4 3. В р-ре – устойчив в сильнощелочной среде при подкислении — диспропорционирует p. H =7 – медленно p. H <7 – быстро 3 K 2 Mn. O 4 +4 CO 2 +2 H 2 O=Mn. O 2 +2 KMn. O 4 +4 KHCO 3 Mn. O 4 2 — +2 H 2 O+2 e=Mn. O 2 +4 OH — Mn. O 4 2 — -e=Mn. O 4 — 1 2 BB B HMn. OMn. O OHMn. O 26, 2558, 0 65, 0 0 , /0 /0 , /
Mn ( VI ) 1. Соединений очень мало 2. Устойч. тв. K 2 Mn. O 4 3. В р-ре – устойчив в сильнощелочной среде при подкислении — диспропорционирует p. H =7 – медленно p. H <7 – быстро 3 K 2 Mn. O 4 +4 CO 2 +2 H 2 O=Mn. O 2 +2 KMn. O 4 +4 KHCO 3 Mn. O 4 2 — +2 H 2 O+2 e=Mn. O 2 +4 OH — Mn. O 4 2 — -e=Mn. O 4 — 1 2 BB B HMn. OMn. O OHMn. O 26, 2558, 0 65, 0 0 , /0 /0 , /
 4. Восстановительные св-ва: 2 Mn. O 4 2 — +Cl 2 =2 Mn. O 4 — +2 Cl — 5. Окислительные св-ва H 2 O+Mn. O 4 2 — +C 2 H 5 OH = Mn. O 2 + +CH 3 CHO+2 H 2 O+2 OH — Mn. O 4 2 — +2 H 2 O+2 e=Mn. O 2 +4 OH — C 2 H 5 OH-2 e = CH 3 CHO+2 H +
4. Восстановительные св-ва: 2 Mn. O 4 2 — +Cl 2 =2 Mn. O 4 — +2 Cl — 5. Окислительные св-ва H 2 O+Mn. O 4 2 — +C 2 H 5 OH = Mn. O 2 + +CH 3 CHO+2 H 2 O+2 OH — Mn. O 4 2 — +2 H 2 O+2 e=Mn. O 2 +4 OH — C 2 H 5 OH-2 e = CH 3 CHO+2 H +
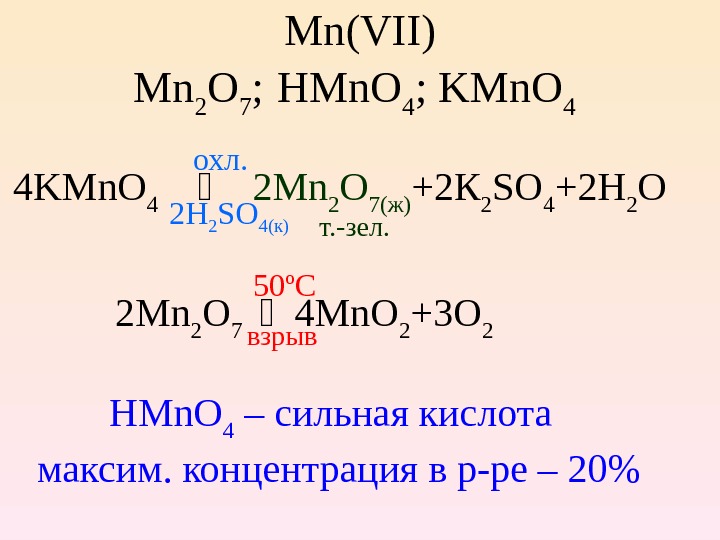
 Mn(VII) Mn 2 O 7 ; HMn. O 4 ; KMn. O 4 4 KMn. O 4 2 Mn 2 O 7( ж ) +2 К 2 SO 4 +2 H 2 O 2 H 2 SO 4( к ) т. -зел. 2 Mn 2 O 7 4 Mn. O 2 +3 O 2 взрыв HMn. O 4 – сильная кислота максим. концентрация в р-ре – 20% охл. 50º
Mn(VII) Mn 2 O 7 ; HMn. O 4 ; KMn. O 4 4 KMn. O 4 2 Mn 2 O 7( ж ) +2 К 2 SO 4 +2 H 2 O 2 H 2 SO 4( к ) т. -зел. 2 Mn 2 O 7 4 Mn. O 2 +3 O 2 взрыв HMn. O 4 – сильная кислота максим. концентрация в р-ре – 20% охл. 50º
 KMn. O 4 устойчив в кислотной среде KMn. O 4 +H 2 O Mn. O 2(T) +KOH+O 2 KMn. O 4 +OH — ( изб. ) K 2 Mn. O 4 +O 2 Mn. O 4 — p. H7 Mn. O 4 — +e= Mn. O 4 2 — φ 0 =+0. 56 B p. H≈7 Mn. O 4 — +3 e+2 H 2 O=Mn. O 2 +4 OH — (OH — ) φ 0 =+0. 59 B (H + ) φ 0 =+1.
KMn. O 4 устойчив в кислотной среде KMn. O 4 +H 2 O Mn. O 2(T) +KOH+O 2 KMn. O 4 +OH — ( изб. ) K 2 Mn. O 4 +O 2 Mn. O 4 — p. H7 Mn. O 4 — +e= Mn. O 4 2 — φ 0 =+0. 56 B p. H≈7 Mn. O 4 — +3 e+2 H 2 O=Mn. O 2 +4 OH — (OH — ) φ 0 =+0. 59 B (H + ) φ 0 =+1.
 Степени Окисления Mn Tc, Re — I , 0, + I в произв. карбонильных комплексов + III наиб. уст. + IV уст. неуст. + V неуст. + VI неуст. + VIII сильн. окисл. уст. у в е л и ч и в а е т с я к о в а л е н т н ы й х а р а к т е р х и м. с в я з е й
Степени Окисления Mn Tc, Re — I , 0, + I в произв. карбонильных комплексов + III наиб. уст. + IV уст. неуст. + V неуст. + VI неуст. + VIII сильн. окисл. уст. у в е л и ч и в а е т с я к о в а л е н т н ы й х а р а к т е р х и м. с в я з е й
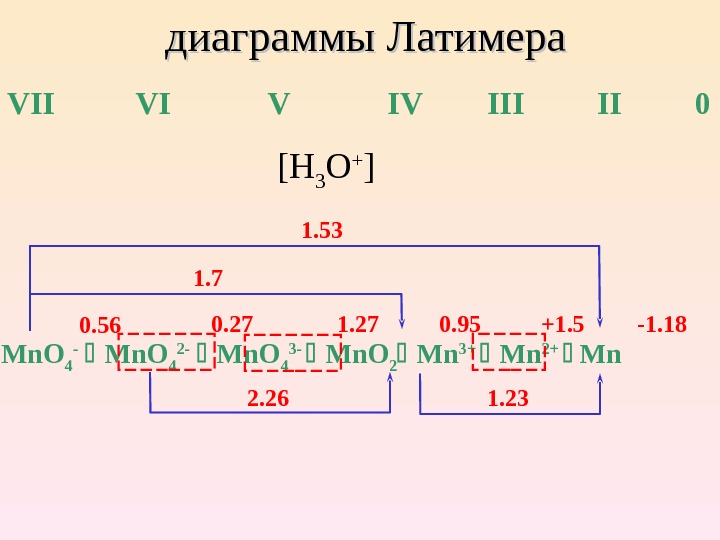
 диаграммы Латимера VII VI V III 0 Mn. O 4 — Mn. O 4 2 — Mn. O 4 3 — Mn. O 2 Mn 3+ Mn 2+ Mn [H 3 O + ] 1. 53 1. 7 2. 26 1. 2 3 0. 5 6 0. 27 1. 27 0. 95 + 1. 5 — 1.
диаграммы Латимера VII VI V III 0 Mn. O 4 — Mn. O 4 2 — Mn. O 4 3 — Mn. O 2 Mn 3+ Mn 2+ Mn [H 3 O + ] 1. 53 1. 7 2. 26 1. 2 3 0. 5 6 0. 27 1. 27 0. 95 + 1. 5 — 1.
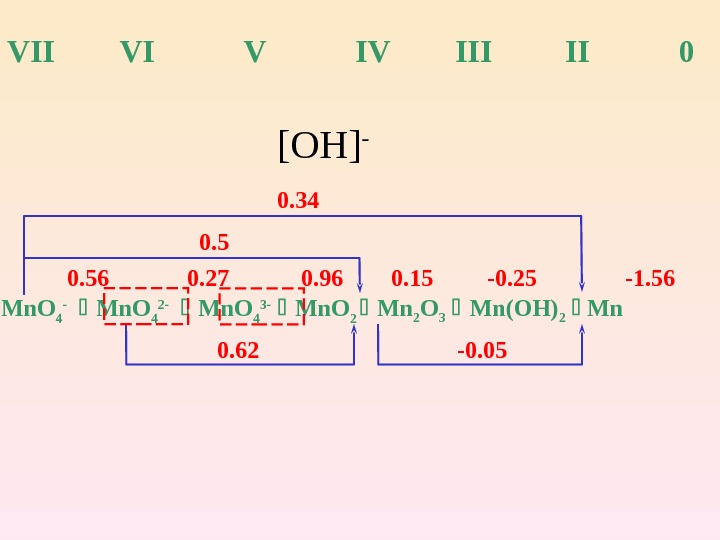
 VII V IV III 0 Mn. O 4 — Mn. O 4 2 — Mn. O 4 3 — Mn. O 2 Mn 2 O 3 Mn(OH) 2 Mn [OH] — 0. 34 0. 56 0. 27 0. 96 0. 15 -0. 25 -1. 56 0. 62 -0.
VII V IV III 0 Mn. O 4 — Mn. O 4 2 — Mn. O 4 3 — Mn. O 2 Mn 2 O 3 Mn(OH) 2 Mn [OH] — 0. 34 0. 56 0. 27 0. 96 0. 15 -0. 25 -1. 56 0. 62 -0.
