Московская государственная академия тонкой химической технологии им. М.







![ГИДРИДЫ: - ионные крист. (щ.м., щ.-з.м.) - полимеры [(Be, Mg)H2]n LiH + H2O = ГИДРИДЫ: - ионные крист. (щ.м., щ.-з.м.) - полимеры [(Be, Mg)H2]n LiH + H2O =](https://present5.com/customparser/29454780_155921657 --- s_elem.ppt/slide_10.jpg)

![КАРБИДЫ (АЦЕТИЛЕНИДЫ) [–C≡C–]2- Li(Ca)(т) + С(т) = Li2C2(CaC2)(т) tº CaC2(т) + 2H2O(ж) = Сa(OH)2(т) КАРБИДЫ (АЦЕТИЛЕНИДЫ) [–C≡C–]2- Li(Ca)(т) + С(т) = Li2C2(CaC2)(т) tº CaC2(т) + 2H2O(ж) = Сa(OH)2(т)](https://present5.com/customparser/29454780_155921657 --- s_elem.ppt/slide_13.jpg)



![АМФОТЕРНОСТЬ БЕРИЛЛИЯ Be + 2H3O+ + 2H2O = [Be(H2O)4]2+(p) + H2 Be + 2OH- АМФОТЕРНОСТЬ БЕРИЛЛИЯ Be + 2H3O+ + 2H2O = [Be(H2O)4]2+(p) + H2 Be + 2OH-](https://present5.com/customparser/29454780_155921657 --- s_elem.ppt/slide_19.jpg)






![СОЛИ МАЛОРАСТВОРИМЫ: LiF, Li3PO4, Li2CO3, Cs3Bi2I9, Na[Sb(OH)6], K3[Co(NO2)6], Ca, Sr, Ba – карбонаты, сульфаты, СОЛИ МАЛОРАСТВОРИМЫ: LiF, Li3PO4, Li2CO3, Cs3Bi2I9, Na[Sb(OH)6], K3[Co(NO2)6], Ca, Sr, Ba – карбонаты, сульфаты,](https://present5.com/customparser/29454780_155921657 --- s_elem.ppt/slide_31.jpg)






s_elem.ppt
- Количество слайдов: 42
 Московская государственная академия тонкой химической технологии им. М.В. Ломоносова ВСПОМОГАТЕЛЬНЫЕ СХЕМЫ ПО НЕОРГАНИЧЕСКОЙ ХИМИИ Сорокина О.В. Утверждено библиотечным Советом МИТХТ им. М.В. Ломоносова Московская Государственная академия тонкой химической технологии им. М.В. Ломоносова (МИТХТ), 2006 г. IА И IIА ГРУППЫ
Московская государственная академия тонкой химической технологии им. М.В. Ломоносова ВСПОМОГАТЕЛЬНЫЕ СХЕМЫ ПО НЕОРГАНИЧЕСКОЙ ХИМИИ Сорокина О.В. Утверждено библиотечным Советом МИТХТ им. М.В. Ломоносова Московская Государственная академия тонкой химической технологии им. М.В. Ломоносова (МИТХТ), 2006 г. IА И IIА ГРУППЫ
 ПРИСТУПАЯ К ИЗУЧЕНИЮ СВОЙСТВ ЭЛЕМЕНТОВ КАКОЙ ЛИБО ГРУППЫ СЛЕДУЕТ РАССМОТРЕТЬ: 1. положение этих элементов в Периодической системе 2. электронное строение 3. величину и характер изменения размеров изолированных атомов 4. энергетические характеристики отдельных атомов: - энергии ионизации - сродство к электрону - электроотрицательность
ПРИСТУПАЯ К ИЗУЧЕНИЮ СВОЙСТВ ЭЛЕМЕНТОВ КАКОЙ ЛИБО ГРУППЫ СЛЕДУЕТ РАССМОТРЕТЬ: 1. положение этих элементов в Периодической системе 2. электронное строение 3. величину и характер изменения размеров изолированных атомов 4. энергетические характеристики отдельных атомов: - энергии ионизации - сродство к электрону - электроотрицательность
 4*. степени окисления 5. простые вещества, характер химической связи в них 6. свойства простых веществ: - агрегатное состояние, энергетические характеристики плавления и испарения - температуры плавления, кипения, плотность и другие физические характеристики 7. химические свойства простых веществ: - окислительно-восстановительные свойства - взм. с простыми веществами - взм. с Н2О - взм. с кислотами и основаниями 7*. получение простых веществ
4*. степени окисления 5. простые вещества, характер химической связи в них 6. свойства простых веществ: - агрегатное состояние, энергетические характеристики плавления и испарения - температуры плавления, кипения, плотность и другие физические характеристики 7. химические свойства простых веществ: - окислительно-восстановительные свойства - взм. с простыми веществами - взм. с Н2О - взм. с кислотами и основаниями 7*. получение простых веществ
 8. свойства важнейших соединений 8*. синтезы 9. нахождение в природе: - кларки - минералы 10. практическое значение соединений данной группы элементов, основные технологии 11. токсичность
8. свойства важнейших соединений 8*. синтезы 9. нахождение в природе: - кларки - минералы 10. практическое значение соединений данной группы элементов, основные технологии 11. токсичность
 ЭЛЕКТРОННАЯ ФОРМУЛА
ЭЛЕКТРОННАЯ ФОРМУЛА
 ПРОСТЫЕ ВЕЩЕСТВА Кроме Ве – все активные металлы A) реагируют как восстановители с простыми и сложными веществами: M – ne = Mn+ (n = 1,2) Б) в ЭХРН – самые левые:
ПРОСТЫЕ ВЕЩЕСТВА Кроме Ве – все активные металлы A) реагируют как восстановители с простыми и сложными веществами: M – ne = Mn+ (n = 1,2) Б) в ЭХРН – самые левые:
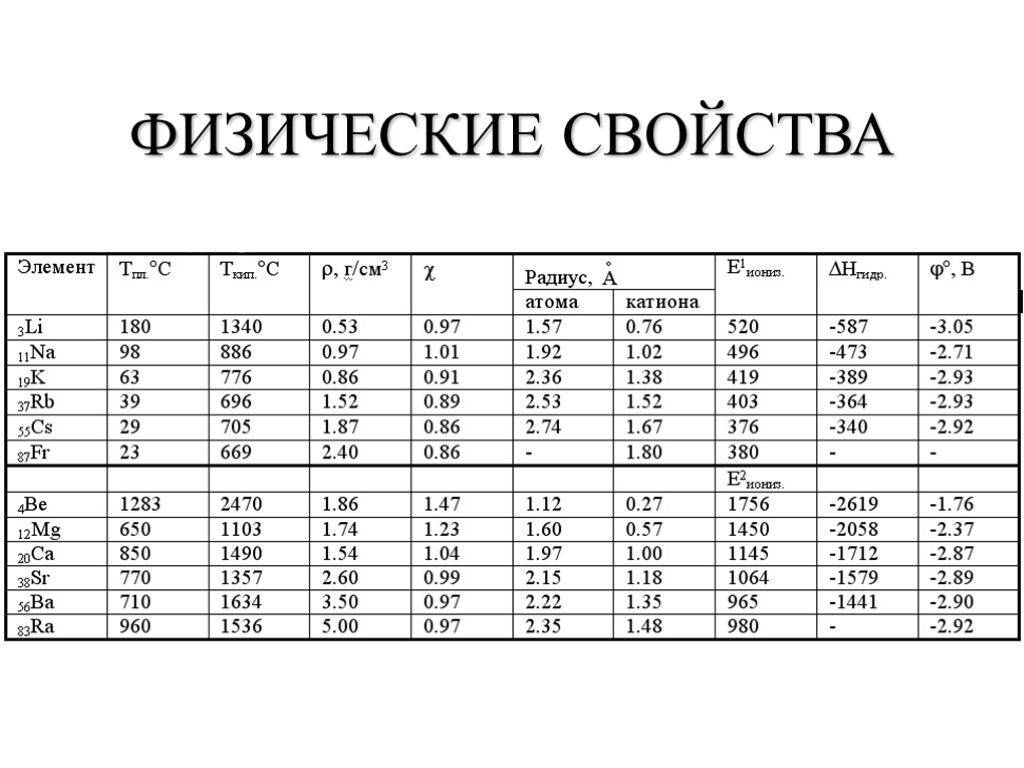
 ФИЗИЧЕСКИЕ СВОЙСТВА
ФИЗИЧЕСКИЕ СВОЙСТВА
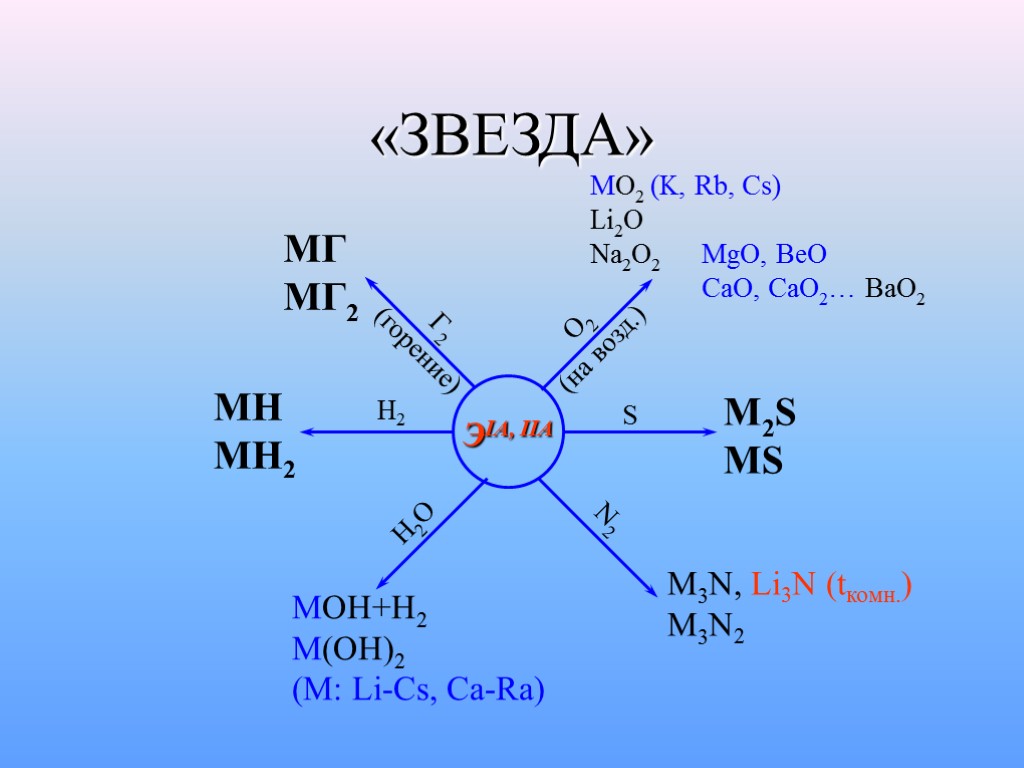
 «ЗВЕЗДА» ЭIA, IIA МГ МГ2 Г2 (горение) O2 (на возд.) MO2 (K, Rb, Cs) Li2O Na2O2 MgO, BeO CaO, CaO2… BaO2 S M2S MS N2 M3N, Li3N (tкомн.) M3N2 H2O MOH+H2 M(OH)2 (M: Li-Cs, Ca-Ra) H2 MH MH2
«ЗВЕЗДА» ЭIA, IIA МГ МГ2 Г2 (горение) O2 (на возд.) MO2 (K, Rb, Cs) Li2O Na2O2 MgO, BeO CaO, CaO2… BaO2 S M2S MS N2 M3N, Li3N (tкомн.) M3N2 H2O MOH+H2 M(OH)2 (M: Li-Cs, Ca-Ra) H2 MH MH2
 ГОРЕНИЕ МАГНИЯ В ВОДЕ © МИТХТ
ГОРЕНИЕ МАГНИЯ В ВОДЕ © МИТХТ
![>ГИДРИДЫ: - ионные крист. (щ.м., щ.-з.м.) - полимеры [(Be, Mg)H2]n LiH + H2O = >ГИДРИДЫ: - ионные крист. (щ.м., щ.-з.м.) - полимеры [(Be, Mg)H2]n LiH + H2O =](https://present5.com/customparser/29454780_155921657 --- s_elem.ppt/slide_10.jpg) ГИДРИДЫ: - ионные крист. (щ.м., щ.-з.м.) - полимеры [(Be, Mg)H2]n LiH + H2O = LiOH + H2 НИТРИДЫ: Mg3N2 + 8H2O = 3Mg(OH)2 + 2NH3 . H2O t t NH3 H2O
ГИДРИДЫ: - ионные крист. (щ.м., щ.-з.м.) - полимеры [(Be, Mg)H2]n LiH + H2O = LiOH + H2 НИТРИДЫ: Mg3N2 + 8H2O = 3Mg(OH)2 + 2NH3 . H2O t t NH3 H2O
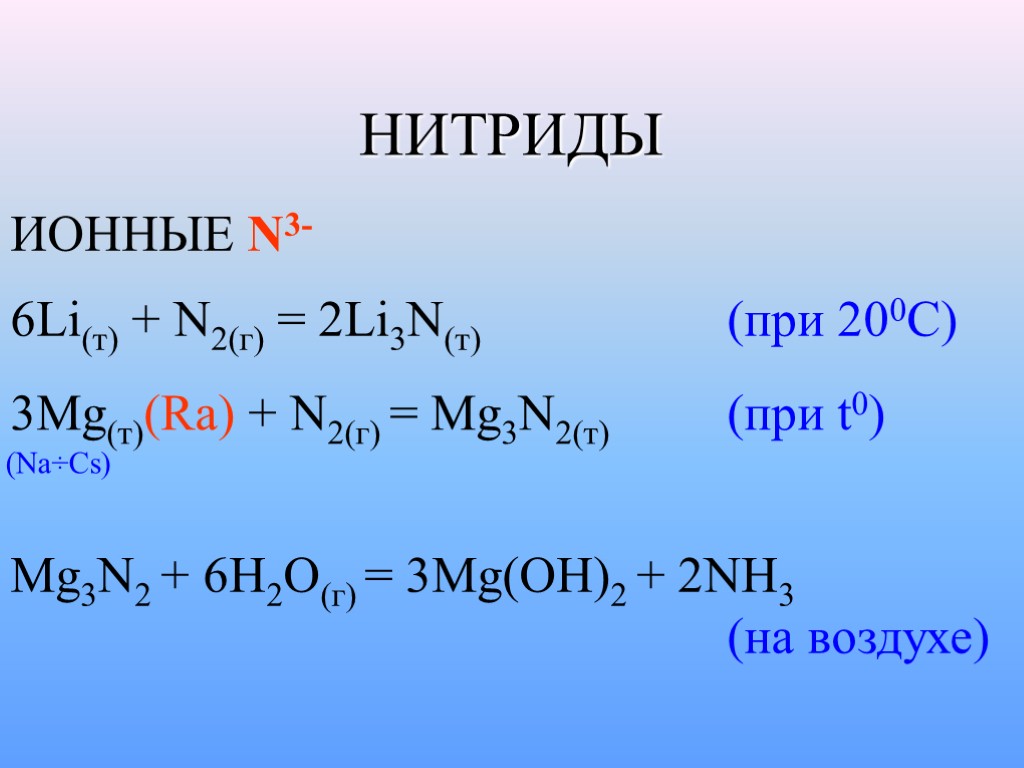
 НИТРИДЫ ИОННЫЕ N3- 6Li(т) + N2(г) = 2Li3N(т) (при 200С) 3Mg(т)(Ra) + N2(г) = Mg3N2(т) (при t0) (Na÷Cs) Mg3N2 + 6H2O(г) = 3Mg(OH)2 + 2NH3 (на воздухе)
НИТРИДЫ ИОННЫЕ N3- 6Li(т) + N2(г) = 2Li3N(т) (при 200С) 3Mg(т)(Ra) + N2(г) = Mg3N2(т) (при t0) (Na÷Cs) Mg3N2 + 6H2O(г) = 3Mg(OH)2 + 2NH3 (на воздухе)
 ГИДРИДЫ ИОННЫЕ H- LiH ÷ CsH (t) и CaH2 ÷ RaH2 (t) (Be, Mg) CaH2(т) + 2H2O(ж) = Ca(OH)2(т) + 2H2(г)
ГИДРИДЫ ИОННЫЕ H- LiH ÷ CsH (t) и CaH2 ÷ RaH2 (t) (Be, Mg) CaH2(т) + 2H2O(ж) = Ca(OH)2(т) + 2H2(г)
![>КАРБИДЫ (АЦЕТИЛЕНИДЫ) [–C≡C–]2- Li(Ca)(т) + С(т) = Li2C2(CaC2)(т) tº CaC2(т) + 2H2O(ж) = Сa(OH)2(т) >КАРБИДЫ (АЦЕТИЛЕНИДЫ) [–C≡C–]2- Li(Ca)(т) + С(т) = Li2C2(CaC2)(т) tº CaC2(т) + 2H2O(ж) = Сa(OH)2(т)](https://present5.com/customparser/29454780_155921657 --- s_elem.ppt/slide_13.jpg) КАРБИДЫ (АЦЕТИЛЕНИДЫ) [–C≡C–]2- Li(Ca)(т) + С(т) = Li2C2(CaC2)(т) tº CaC2(т) + 2H2O(ж) = Сa(OH)2(т) + C2H2(г)
КАРБИДЫ (АЦЕТИЛЕНИДЫ) [–C≡C–]2- Li(Ca)(т) + С(т) = Li2C2(CaC2)(т) tº CaC2(т) + 2H2O(ж) = Сa(OH)2(т) + C2H2(г)
 КАРБИДЫ (МЕТАНИДЫ) ПОЛУЧЕНИЕ: 4Al + 3C(графит) = Al4C3 1500 - 1700C Al4C3(т) + 12H2O(ж) = 4Al(OH)3(т) + 3CH4(г) 4Li + C(графит) = Li4C (Be2C) tC
КАРБИДЫ (МЕТАНИДЫ) ПОЛУЧЕНИЕ: 4Al + 3C(графит) = Al4C3 1500 - 1700C Al4C3(т) + 12H2O(ж) = 4Al(OH)3(т) + 3CH4(г) 4Li + C(графит) = Li4C (Be2C) tC
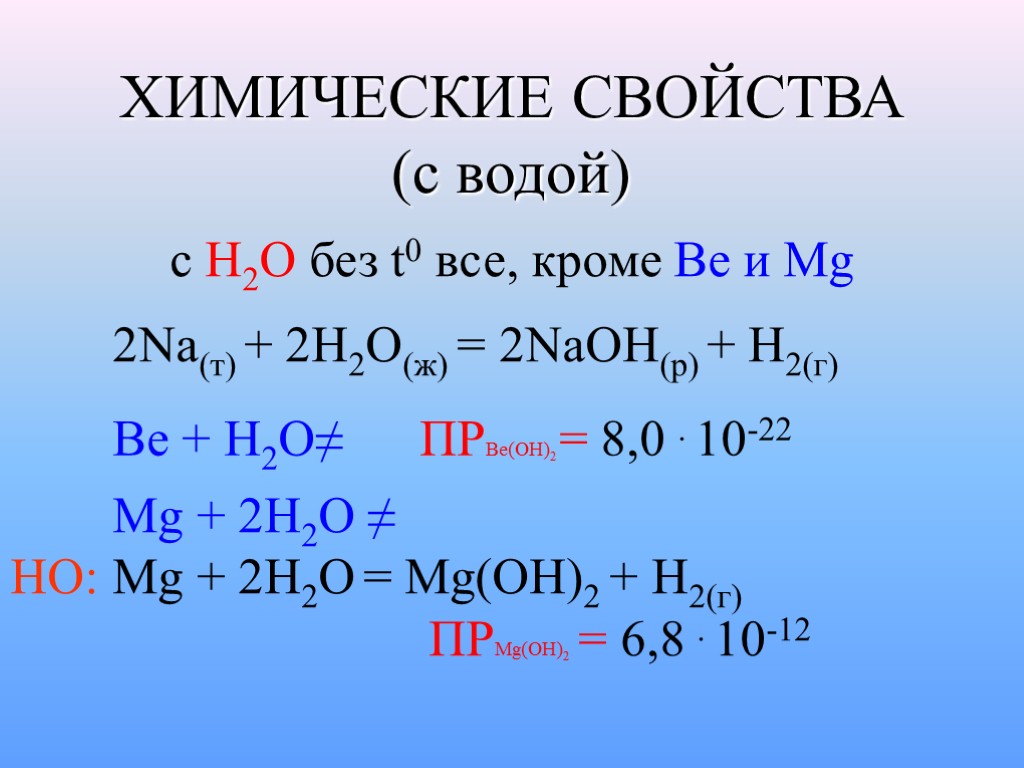
 ХИМИЧЕСКИЕ СВОЙСТВА (с водой) c H2O без t0 все, кроме Be и Mg 2Na(т) + 2H2O(ж) = 2NaOH(p) + H2(г) Be + Н2О≠ ПРВе(ОН)2 = 8,0 . 10-22 Mg + 2H2O ≠ НО: Mg + 2H2O = Mg(OH)2 + H2(г) ПРMg(ОН)2 = 6,8 . 10-12
ХИМИЧЕСКИЕ СВОЙСТВА (с водой) c H2O без t0 все, кроме Be и Mg 2Na(т) + 2H2O(ж) = 2NaOH(p) + H2(г) Be + Н2О≠ ПРВе(ОН)2 = 8,0 . 10-22 Mg + 2H2O ≠ НО: Mg + 2H2O = Mg(OH)2 + H2(г) ПРMg(ОН)2 = 6,8 . 10-12
 ХИМИЧЕСКИЕ СВОЙСТВА (с кислотами-неокислителями) Mg + 2H3O+ = 2Mg2+ + H2 + 2H2O только в случае образования растворимой соли
ХИМИЧЕСКИЕ СВОЙСТВА (с кислотами-неокислителями) Mg + 2H3O+ = 2Mg2+ + H2 + 2H2O только в случае образования растворимой соли
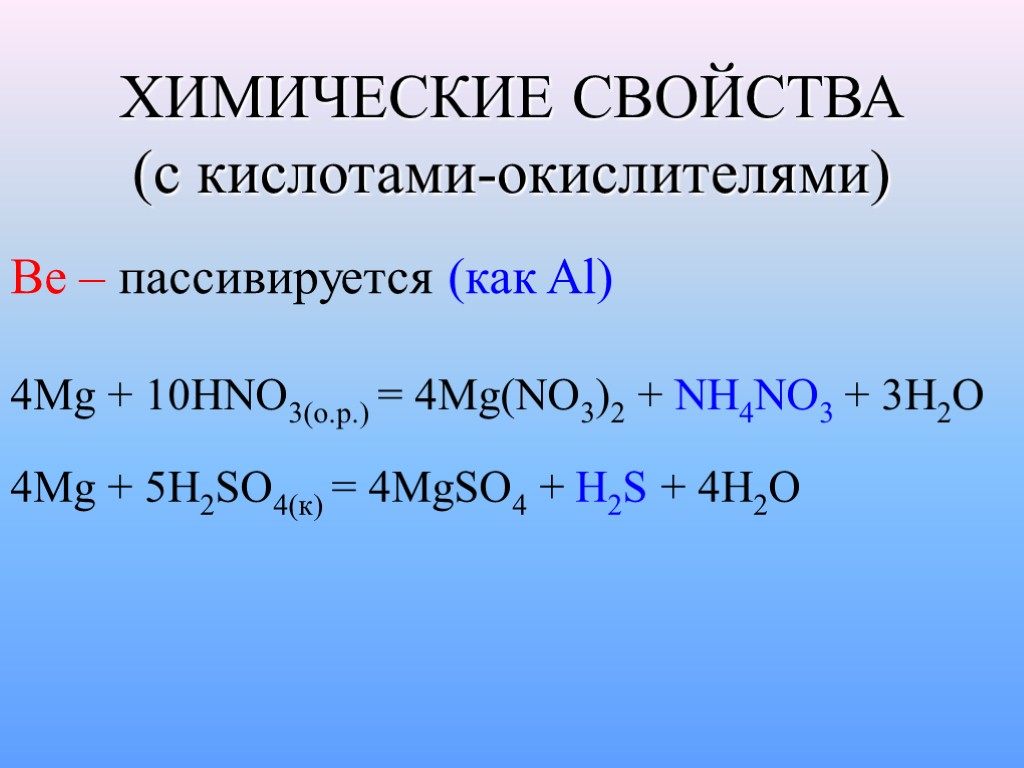
 ХИМИЧЕСКИЕ СВОЙСТВА (с кислотами-окислителями) Be – пассивируется (как Al) 4Mg + 10HNO3(o.p.) = 4Mg(NO3)2 + NH4NO3 + 3H2O 4Mg + 5H2SO4(к) = 4MgSO4 + H2S + 4H2O
ХИМИЧЕСКИЕ СВОЙСТВА (с кислотами-окислителями) Be – пассивируется (как Al) 4Mg + 10HNO3(o.p.) = 4Mg(NO3)2 + NH4NO3 + 3H2O 4Mg + 5H2SO4(к) = 4MgSO4 + H2S + 4H2O
 ХИМИЧЕСКИЕ СВОЙСТВА (с основаниями) с основаниями – только Be Be(т) + 2NaOH(p) + 2H2O = Na2[Be(OH)4](p) + H2(г)
ХИМИЧЕСКИЕ СВОЙСТВА (с основаниями) с основаниями – только Be Be(т) + 2NaOH(p) + 2H2O = Na2[Be(OH)4](p) + H2(г)
![>АМФОТЕРНОСТЬ БЕРИЛЛИЯ Be + 2H3O+ + 2H2O = [Be(H2O)4]2+(p) + H2 Be + 2OH- >АМФОТЕРНОСТЬ БЕРИЛЛИЯ Be + 2H3O+ + 2H2O = [Be(H2O)4]2+(p) + H2 Be + 2OH-](https://present5.com/customparser/29454780_155921657 --- s_elem.ppt/slide_19.jpg) АМФОТЕРНОСТЬ БЕРИЛЛИЯ Be + 2H3O+ + 2H2O = [Be(H2O)4]2+(p) + H2 Be + 2OH- + 2H2O = [Be(OH)4]2-(p) + H2
АМФОТЕРНОСТЬ БЕРИЛЛИЯ Be + 2H3O+ + 2H2O = [Be(H2O)4]2+(p) + H2 Be + 2OH- + 2H2O = [Be(OH)4]2-(p) + H2
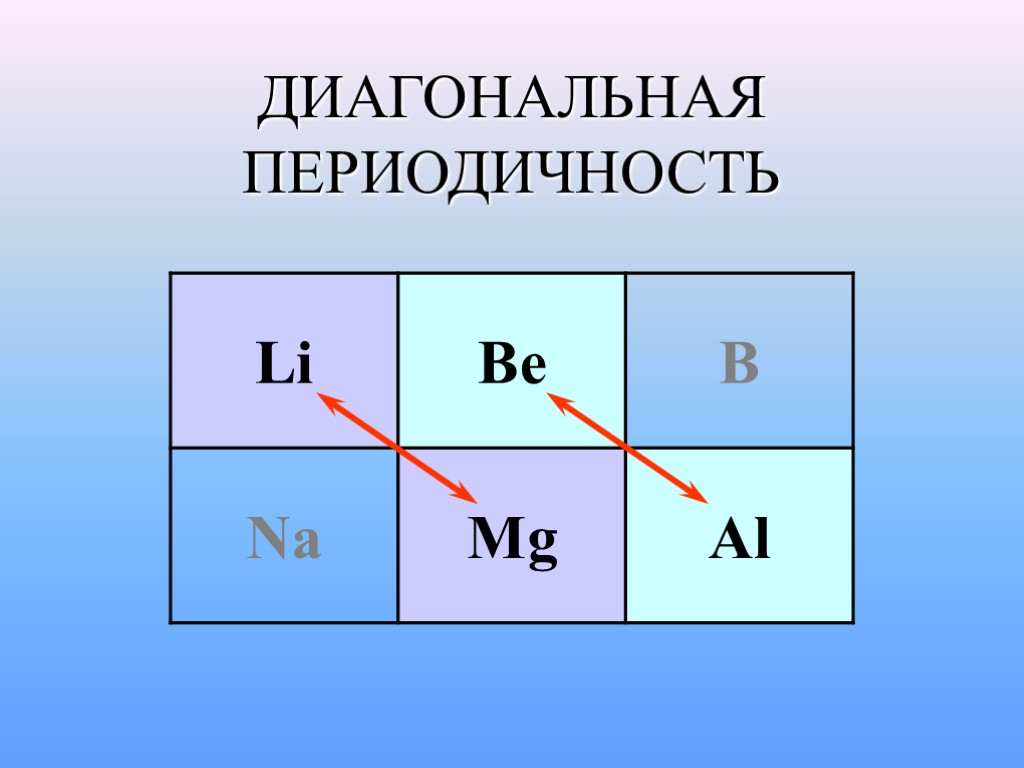
 ДИАГОНАЛЬНАЯ ПЕРИОДИЧНОСТЬ
ДИАГОНАЛЬНАЯ ПЕРИОДИЧНОСТЬ
 КИСЛОРОДНЫЕ СОЕДИНЕНИЯ IA ОКСИД O2- ПЕРОКСИД O22- НАДПЕРОКСИД O2- 4Li(т) + O2(г) = 2Li2O(т) 2Na(т) + О2(г) = Na2О2(т) K(Rb, Cs)(т) + О2(г) = KО2(т) t t t
КИСЛОРОДНЫЕ СОЕДИНЕНИЯ IA ОКСИД O2- ПЕРОКСИД O22- НАДПЕРОКСИД O2- 4Li(т) + O2(г) = 2Li2O(т) 2Na(т) + О2(г) = Na2О2(т) K(Rb, Cs)(т) + О2(г) = KО2(т) t t t
 КИСЛОРОДНЫЕ СОЕДИНЕНИЯ IIA ОКСИД ПЕРОКСИД 2Be(Sr)(т) + О2(г) = ВеО(SrO)(т) Ba(т) + O2(г) = BaO2(т) Сa(OH)2(т) + H2O2(конц.) = CaO2(т) + 2H2O(ж)
КИСЛОРОДНЫЕ СОЕДИНЕНИЯ IIA ОКСИД ПЕРОКСИД 2Be(Sr)(т) + О2(г) = ВеО(SrO)(т) Ba(т) + O2(г) = BaO2(т) Сa(OH)2(т) + H2O2(конц.) = CaO2(т) + 2H2O(ж)
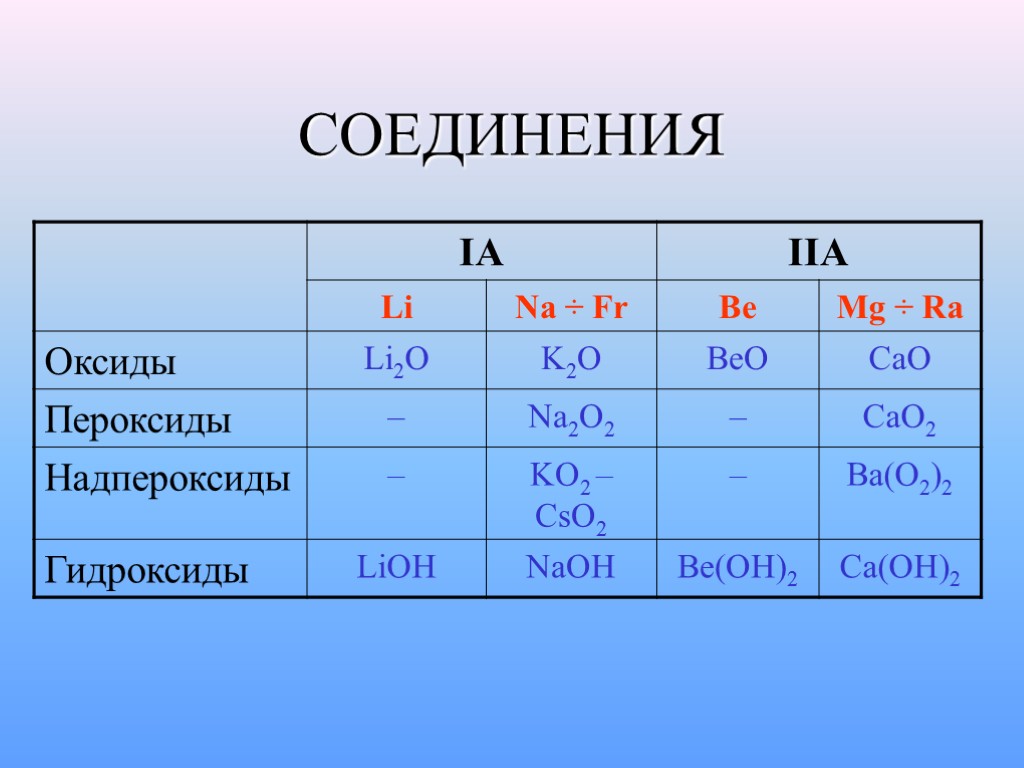
 СОЕДИНЕНИЯ
СОЕДИНЕНИЯ
 ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ СВОЙСТВА ПЕРОКСИДОВ Na2O2 + 2H2O + 2e = 2Na+ + 4OH- = 1,2B Na2O2 - 2e = 2Na+ + O2 = -0,56B 3Na2O2 + 2KCr(SO4)2 + 4KOH = 2K2CrO4 + K2SO4 + 3Na2SO4 + 2H2O ОБЛАДАЮТ ДВОЙСТВЕННЫМИ ОВ СВОЙСТВАМИ +IV +VI
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ СВОЙСТВА ПЕРОКСИДОВ Na2O2 + 2H2O + 2e = 2Na+ + 4OH- = 1,2B Na2O2 - 2e = 2Na+ + O2 = -0,56B 3Na2O2 + 2KCr(SO4)2 + 4KOH = 2K2CrO4 + K2SO4 + 3Na2SO4 + 2H2O ОБЛАДАЮТ ДВОЙСТВЕННЫМИ ОВ СВОЙСТВАМИ +IV +VI
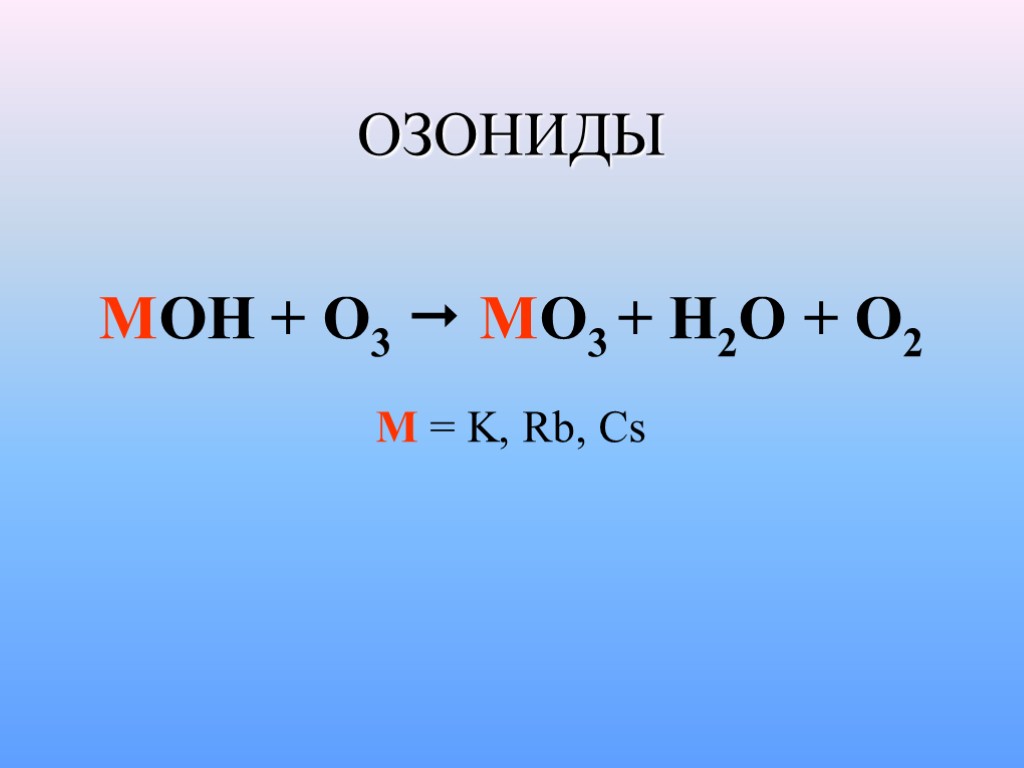
 ОЗОНИДЫ MOH + O3 MO3 + H2O + O2 M = K, Rb, Cs
ОЗОНИДЫ MOH + O3 MO3 + H2O + O2 M = K, Rb, Cs
 ГИДРОКСИД МАГНИЯ Mg + 2H2O ≠ Mg + 2H2O = Mg(OH)2 + H2(г) НО: t И ВОЗМОЖНО: Mg + NH4Cl + 2H2O Mg(OH)2(T) + NH4Cl + H2(г)
ГИДРОКСИД МАГНИЯ Mg + 2H2O ≠ Mg + 2H2O = Mg(OH)2 + H2(г) НО: t И ВОЗМОЖНО: Mg + NH4Cl + 2H2O Mg(OH)2(T) + NH4Cl + H2(г)
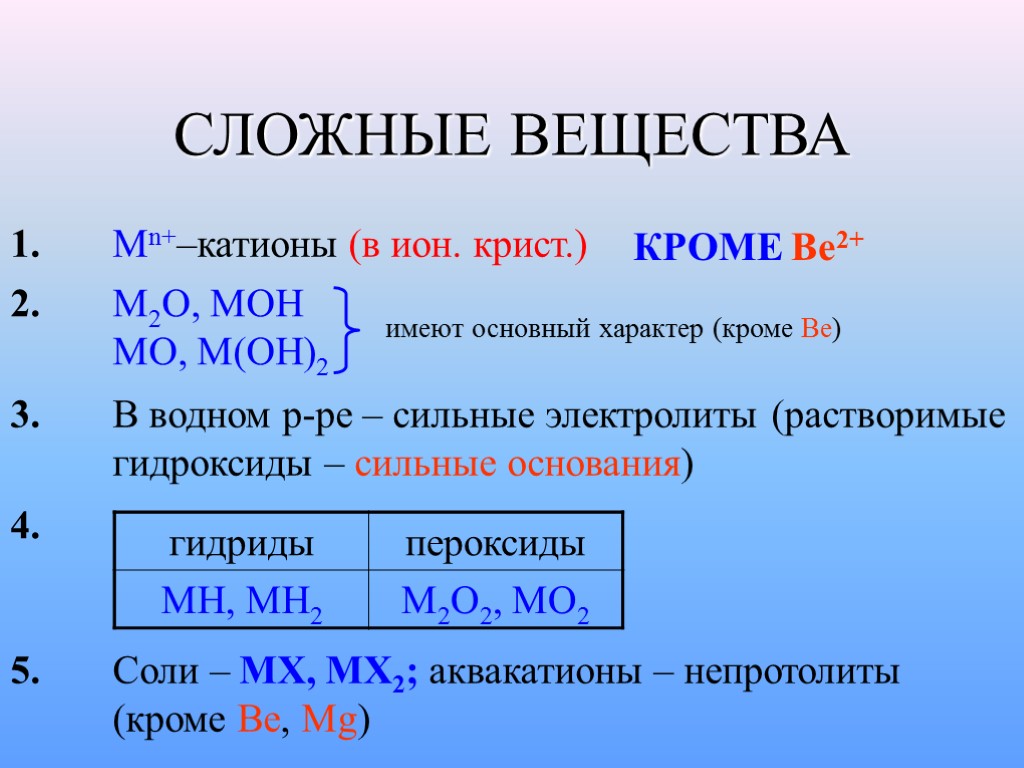
 СЛОЖНЫЕ ВЕЩЕСТВА 1. Mn+–катионы (в ион. крист.) КРОМЕ Be2+ 2. M2O, MOH MO, M(OH)2 имеют основный характер (кроме Be) 3. В водном р-ре – сильные электролиты (растворимые гидроксиды – сильные основания) 4. 5. Соли – MX, MX2; аквакатионы – непротолиты (кроме Be, Mg)
СЛОЖНЫЕ ВЕЩЕСТВА 1. Mn+–катионы (в ион. крист.) КРОМЕ Be2+ 2. M2O, MOH MO, M(OH)2 имеют основный характер (кроме Be) 3. В водном р-ре – сильные электролиты (растворимые гидроксиды – сильные основания) 4. 5. Соли – MX, MX2; аквакатионы – непротолиты (кроме Be, Mg)
 ПЕРОКСИДЫ С ВОДОЙ Na2O2 + H2O NaHO2 + NaOH
ПЕРОКСИДЫ С ВОДОЙ Na2O2 + H2O NaHO2 + NaOH
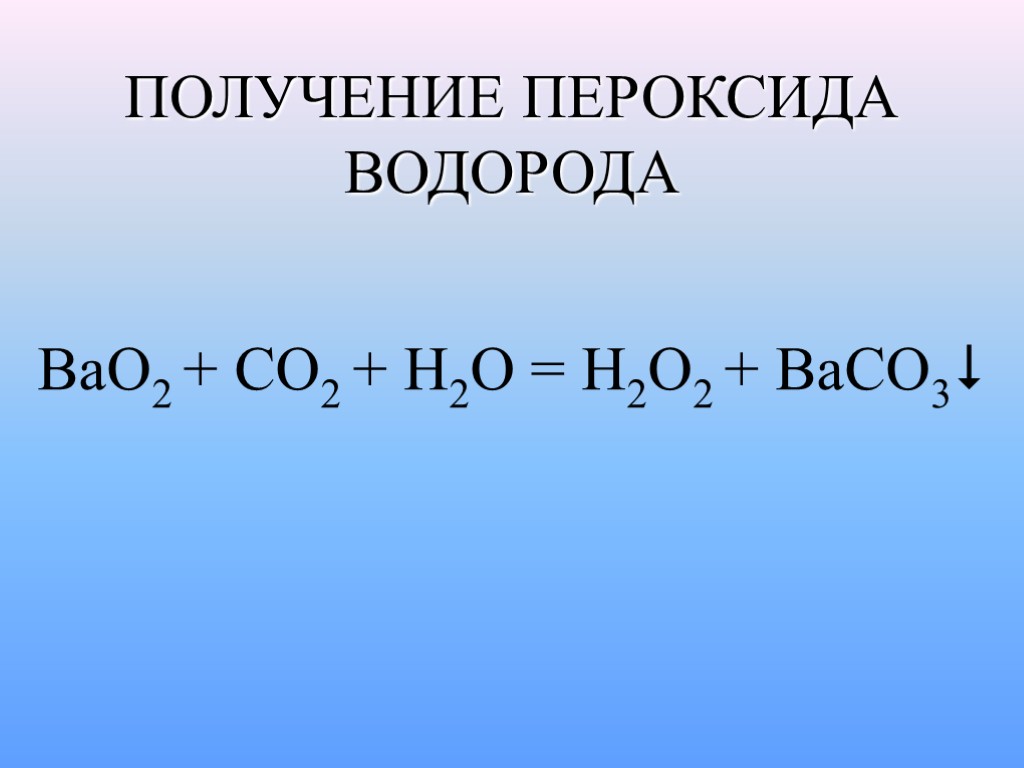
 ПОЛУЧЕНИЕ ПЕРОКСИДА ВОДОРОДА BaO2 + CO2 + H2O = H2O2 + BaCO3
ПОЛУЧЕНИЕ ПЕРОКСИДА ВОДОРОДА BaO2 + CO2 + H2O = H2O2 + BaCO3
 ПРИМЕНЕНИЕ Na2O2 + CO2 = Na2CO3 + 1/2O2 2NaO2 + CO = Na2CO3 + O2 Na2O2 + CO = Na2CO3
ПРИМЕНЕНИЕ Na2O2 + CO2 = Na2CO3 + 1/2O2 2NaO2 + CO = Na2CO3 + O2 Na2O2 + CO = Na2CO3
![>СОЛИ МАЛОРАСТВОРИМЫ: LiF, Li3PO4, Li2CO3, Cs3Bi2I9, Na[Sb(OH)6], K3[Co(NO2)6], Ca, Sr, Ba – карбонаты, сульфаты, >СОЛИ МАЛОРАСТВОРИМЫ: LiF, Li3PO4, Li2CO3, Cs3Bi2I9, Na[Sb(OH)6], K3[Co(NO2)6], Ca, Sr, Ba – карбонаты, сульфаты,](https://present5.com/customparser/29454780_155921657 --- s_elem.ppt/slide_31.jpg) СОЛИ МАЛОРАСТВОРИМЫ: LiF, Li3PO4, Li2CO3, Cs3Bi2I9, Na[Sb(OH)6], K3[Co(NO2)6], Ca, Sr, Ba – карбонаты, сульфаты, хроматы…
СОЛИ МАЛОРАСТВОРИМЫ: LiF, Li3PO4, Li2CO3, Cs3Bi2I9, Na[Sb(OH)6], K3[Co(NO2)6], Ca, Sr, Ba – карбонаты, сульфаты, хроматы…
 РАСТВОРИМОСТЬ
РАСТВОРИМОСТЬ
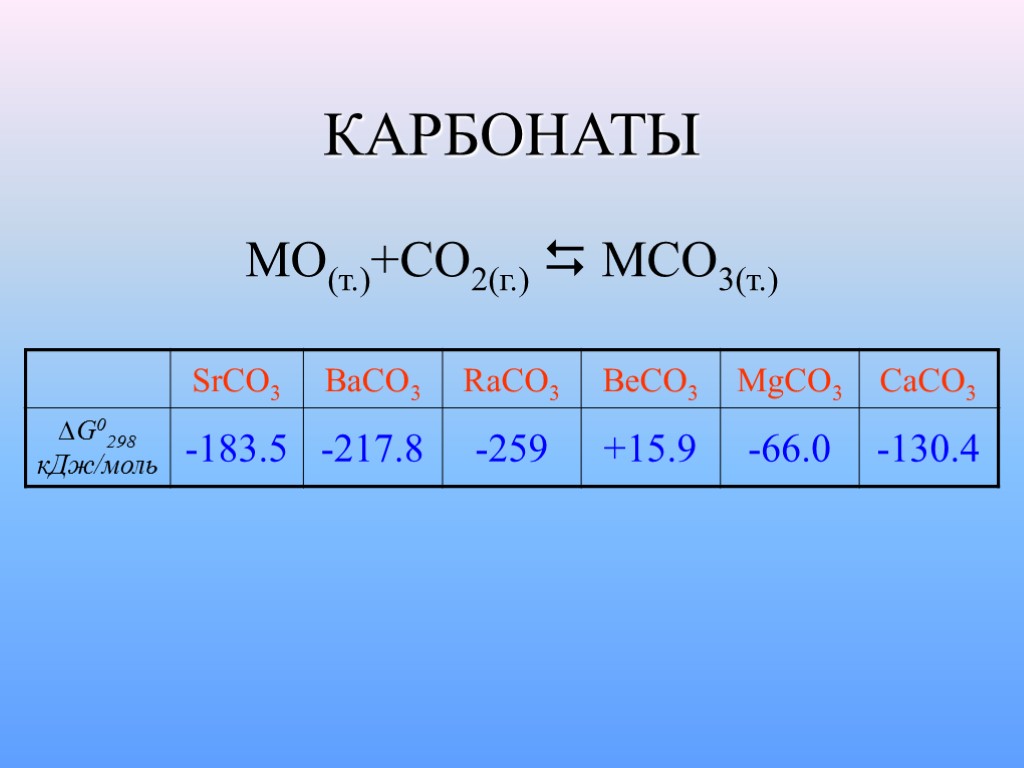
 КАРБОНАТЫ MO(т.)+CO2(г.) MCO3(т.)
КАРБОНАТЫ MO(т.)+CO2(г.) MCO3(т.)
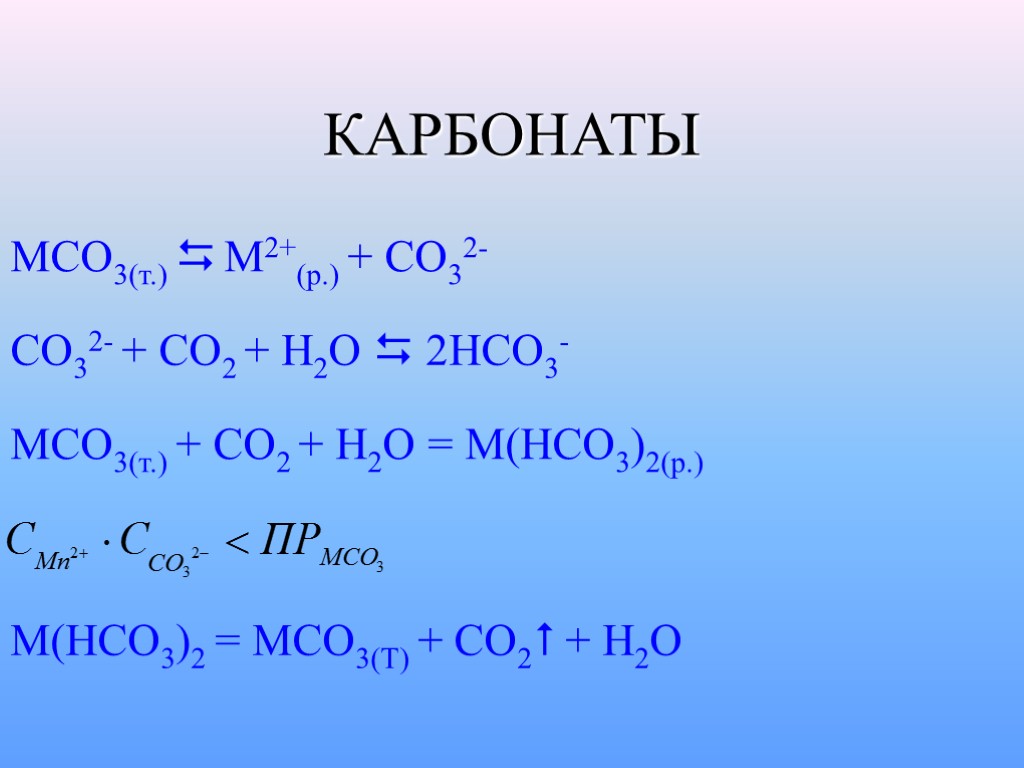
 КАРБОНАТЫ MCO3(т.) M2+(p.) + CO32- CO32- + CO2 + H2O 2HCO3- MCO3(т.) + CO2 + H2O = M(HCO3)2(p.) M(HCO3)2 = MCO3(T) + CO2 + H2O
КАРБОНАТЫ MCO3(т.) M2+(p.) + CO32- CO32- + CO2 + H2O 2HCO3- MCO3(т.) + CO2 + H2O = M(HCO3)2(p.) M(HCO3)2 = MCO3(T) + CO2 + H2O
 РАСТВОРИМОСТЬ Гидрокарбонаты ЩЗМ – хорошо растворимы. ЖЕСТКОСТЬ ВОДЫ ПЕРЕНОС КАРБОНАТОВ В ПРИРОДЕ
РАСТВОРИМОСТЬ Гидрокарбонаты ЩЗМ – хорошо растворимы. ЖЕСТКОСТЬ ВОДЫ ПЕРЕНОС КАРБОНАТОВ В ПРИРОДЕ
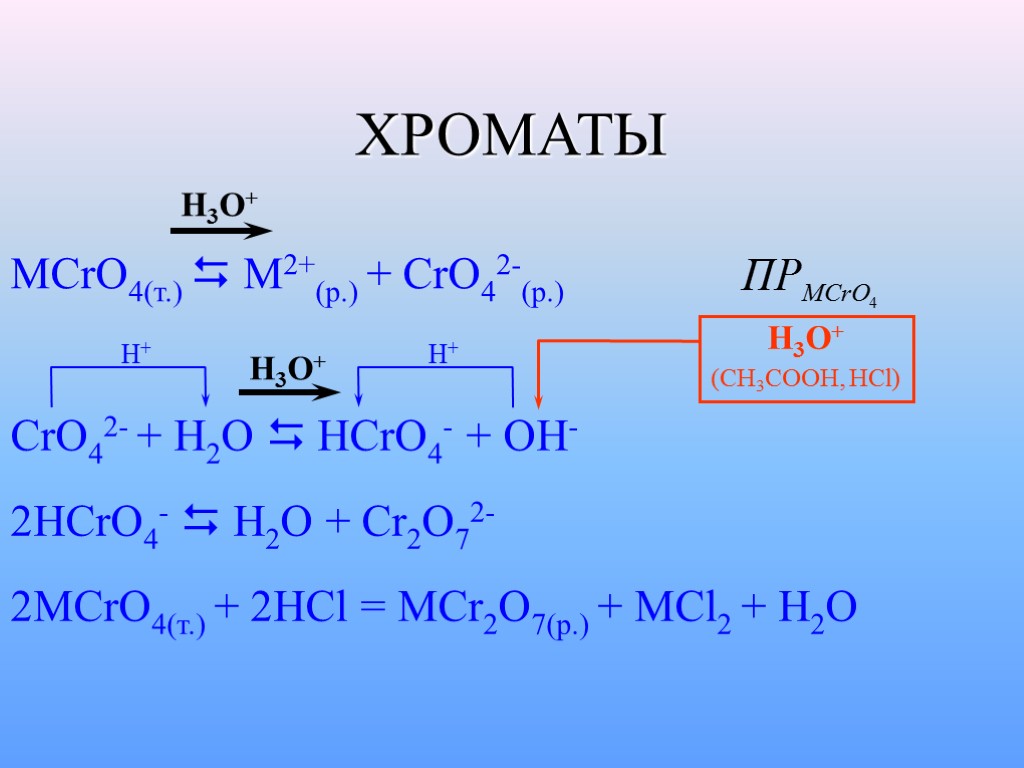
 ХРОМАТЫ MСrO4(т.) M2+(p.) + CrO42-(p.) CrO42- + H2O HCrO4- + OH- 2HCrO4- H2O + Cr2O72- 2MСrO4(т.) + 2HCl = MCr2O7(p.) + MCl2 + H2O H+ H+ H3O+ H3O+ H3O+ (CH3COOH, HCl)
ХРОМАТЫ MСrO4(т.) M2+(p.) + CrO42-(p.) CrO42- + H2O HCrO4- + OH- 2HCrO4- H2O + Cr2O72- 2MСrO4(т.) + 2HCl = MCr2O7(p.) + MCl2 + H2O H+ H+ H3O+ H3O+ H3O+ (CH3COOH, HCl)
 ХРОМАТЫ (продолжение) CaCrO4 – растворим (13,2 г. в 100 гр. Н2О)
ХРОМАТЫ (продолжение) CaCrO4 – растворим (13,2 г. в 100 гр. Н2О)
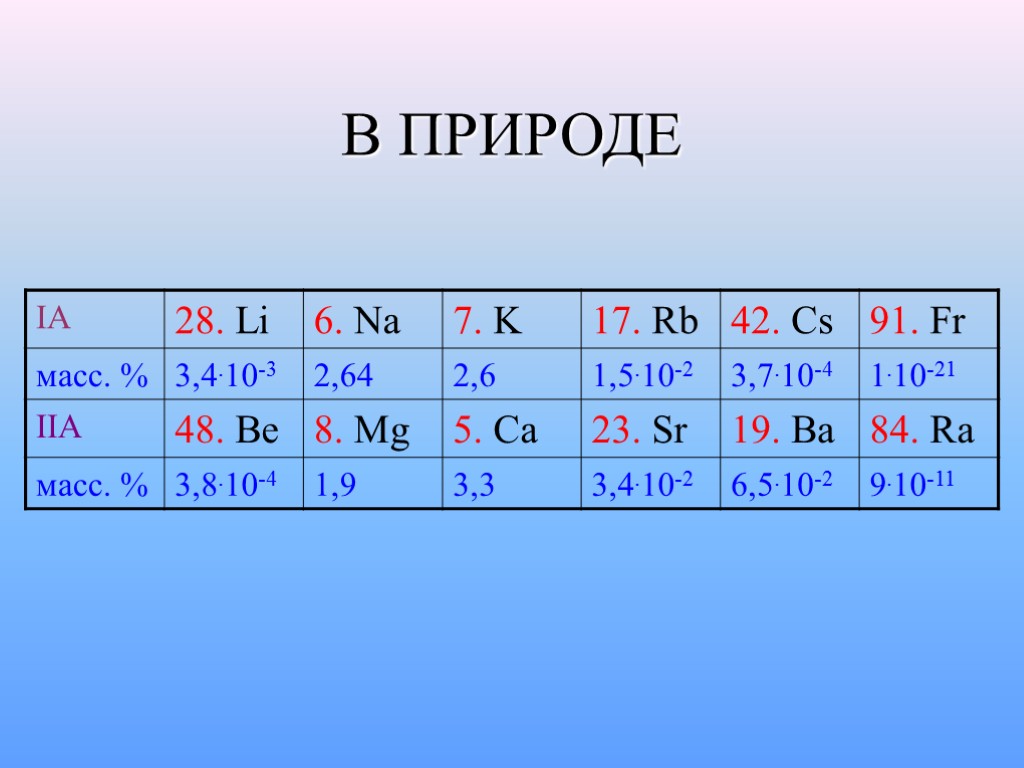
 РАСПРОСТРАНЕННОСТЬ Кларк – среднее относительное содержание химического элемента в земной коре (в масс. долях, %). 2 - 4% ОСТАЛЬНЫЕ: от 5 . 10-12% Ва до 10-21% Fr – редкие и рассеянные Минералы – природные химические соединения, образовавшиеся в результате геохимических процессов. NaCl - галит; KCl - сильвин KCl . MgCl2 . 6H2O - карналит CaCO3 - кальцит; CaSO4 . 2H2O – гипс Руда – минерал промышленного использования.
РАСПРОСТРАНЕННОСТЬ Кларк – среднее относительное содержание химического элемента в земной коре (в масс. долях, %). 2 - 4% ОСТАЛЬНЫЕ: от 5 . 10-12% Ва до 10-21% Fr – редкие и рассеянные Минералы – природные химические соединения, образовавшиеся в результате геохимических процессов. NaCl - галит; KCl - сильвин KCl . MgCl2 . 6H2O - карналит CaCO3 - кальцит; CaSO4 . 2H2O – гипс Руда – минерал промышленного использования.
 В ПРИРОДЕ
В ПРИРОДЕ
 МИНЕРАЛЫ Li – алюмосиликаты (сподумен) Na - галит NaCl; мирабилит Na2SO4.10H2O K - сильвин KCl; сильвинит KCl.NaCl Mg - карналлит KCl.MgCl2 ; доломитMgCO3.CaCO3 Ca - гипс CaSO4.2H2O; ангидрит CaSO4 флюоритCaF2 ; кальцитCaCO3 Sr - стронцианит SrCO3; целестин SrSO4 Ba - барит BaSO4
МИНЕРАЛЫ Li – алюмосиликаты (сподумен) Na - галит NaCl; мирабилит Na2SO4.10H2O K - сильвин KCl; сильвинит KCl.NaCl Mg - карналлит KCl.MgCl2 ; доломитMgCO3.CaCO3 Ca - гипс CaSO4.2H2O; ангидрит CaSO4 флюоритCaF2 ; кальцитCaCO3 Sr - стронцианит SrCO3; целестин SrSO4 Ba - барит BaSO4
 ПОЛУЧЕНИЕ электролиз расплавов солей
ПОЛУЧЕНИЕ электролиз расплавов солей
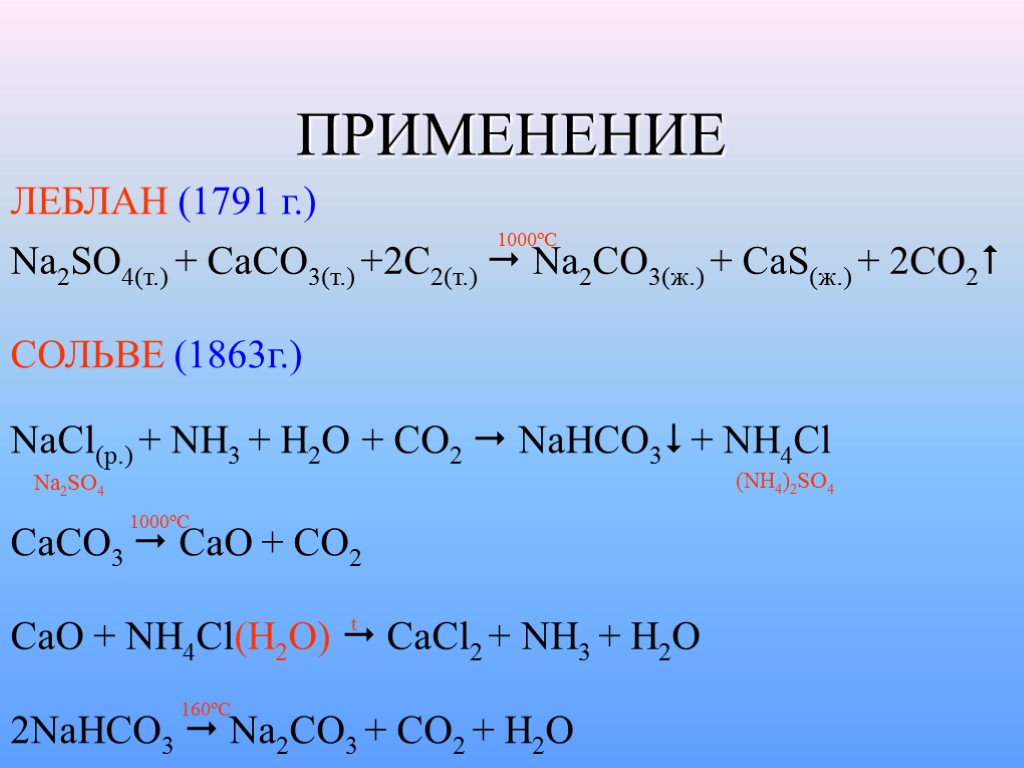
 ПРИМЕНЕНИЕ ЛЕБЛАН (1791 г.) Na2SO4(т.) + CaCO3(т.) +2C2(т.) Na2CO3(ж.) + CaS(ж.) + 2CO2 1000ºC СОЛЬВЕ (1863г.) NaCl(p.) + NH3 + H2O + CO2 NaHCO3 + NH4Cl Na2SO4 (NH4)2SO4 CaCO3 CaO + CO2 1000ºC CaO + NH4Cl(H2O) CaCl2 + NH3 + H2O t 2NaHCO3 Na2CO3 + CO2 + H2O 160ºC
ПРИМЕНЕНИЕ ЛЕБЛАН (1791 г.) Na2SO4(т.) + CaCO3(т.) +2C2(т.) Na2CO3(ж.) + CaS(ж.) + 2CO2 1000ºC СОЛЬВЕ (1863г.) NaCl(p.) + NH3 + H2O + CO2 NaHCO3 + NH4Cl Na2SO4 (NH4)2SO4 CaCO3 CaO + CO2 1000ºC CaO + NH4Cl(H2O) CaCl2 + NH3 + H2O t 2NaHCO3 Na2CO3 + CO2 + H2O 160ºC
