Московская государственная академия тонкой химической технологии им. М.В.





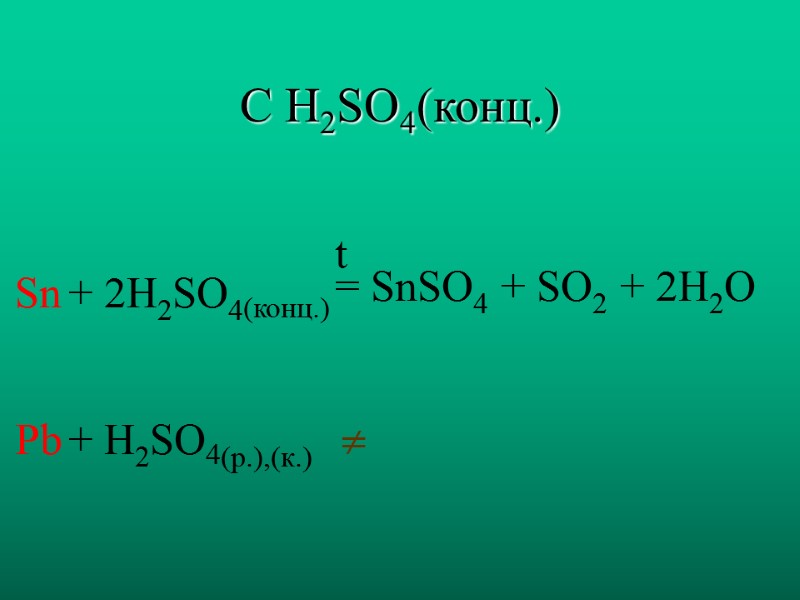

![С ОСНОВАНИЯМИ K[Sn(OH)3] Sn (Pb) + 4KOH(р.) + 2H2O = С ОСНОВАНИЯМИ K[Sn(OH)3] Sn (Pb) + 4KOH(р.) + 2H2O =](https://present5.com/presentacii-2/20171208\5628-sn_pb.ppt\5628-sn_pb_11.jpg)






![ГАЛОГЕНИДЫ SnCl2 + HCl H[SnCl3] SnCl4(ж.) + 2HCl(к.) H2[SnCl6] SnCl4(ж.) ГАЛОГЕНИДЫ SnCl2 + HCl H[SnCl3] SnCl4(ж.) + 2HCl(к.) H2[SnCl6] SnCl4(ж.)](https://present5.com/presentacii-2/20171208\5628-sn_pb.ppt\5628-sn_pb_24.jpg)

 ОКСИДЫ СВИНЦА (PbO2 и (Pb2Pb)O4) PbO2(т.) + 2KOH + 2H2O = K2[Pb(OH)6](р.)](https://present5.com/presentacii-2/20171208\5628-sn_pb.ppt\5628-sn_pb_26.jpg)



5628-sn_pb.ppt
- Количество слайдов: 31
 Московская государственная академия тонкой химической технологии им. М.В. Ломоносова ВСПОМОГАТЕЛЬНЫЕ СХЕМЫ ПО НЕОРГАНИЧЕСКОЙ ХИМИИ Сорокина О.В. Утверждено библиотечным Советом МИТХТ им. М.В. Ломоносова Московская Государственная академия тонкой химической технологии им. М.В. Ломоносова (МИТХТ), 2006 г. ОЛОВО. СВИНЕЦ
Московская государственная академия тонкой химической технологии им. М.В. Ломоносова ВСПОМОГАТЕЛЬНЫЕ СХЕМЫ ПО НЕОРГАНИЧЕСКОЙ ХИМИИ Сорокина О.В. Утверждено библиотечным Советом МИТХТ им. М.В. Ломоносова Московская Государственная академия тонкой химической технологии им. М.В. Ломоносова (МИТХТ), 2006 г. ОЛОВО. СВИНЕЦ
 ФИЗИЧЕСКИЕ СВОЙСТВА Sn -Sn -Sn -Sn Sn(ж.) Sn = 7,3 г/см3 Pb tпл. = 327oC Pb = 11,3 г/см3
ФИЗИЧЕСКИЕ СВОЙСТВА Sn -Sn -Sn -Sn Sn(ж.) Sn = 7,3 г/см3 Pb tпл. = 327oC Pb = 11,3 г/см3
 ОКИСЛИТЕЛЬНО – ВОССТАНОВИТЕЛЬНЫЙ ПОТЕНЦИАЛ
ОКИСЛИТЕЛЬНО – ВОССТАНОВИТЕЛЬНЫЙ ПОТЕНЦИАЛ
 ХИМИЧЕСКИЕ СВОЙСТВА (С ВОДОЙ) Sn (Pb) + H2O
ХИМИЧЕСКИЕ СВОЙСТВА (С ВОДОЙ) Sn (Pb) + H2O
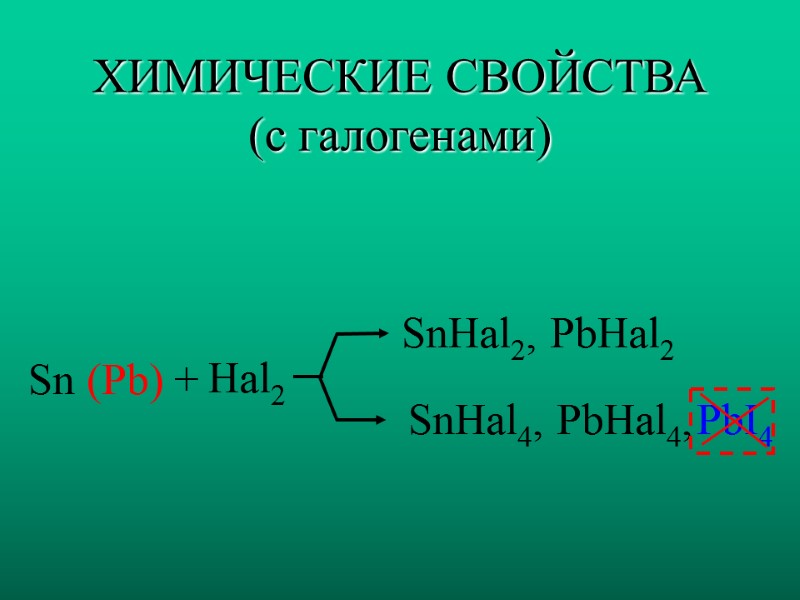
 ХИМИЧЕСКИЕ СВОЙСТВА (с галогенами) Sn (Pb) + Hal2 SnHal2, PbHal2 SnHal4, PbHal4, PbI4
ХИМИЧЕСКИЕ СВОЙСТВА (с галогенами) Sn (Pb) + Hal2 SnHal2, PbHal2 SnHal4, PbHal4, PbI4
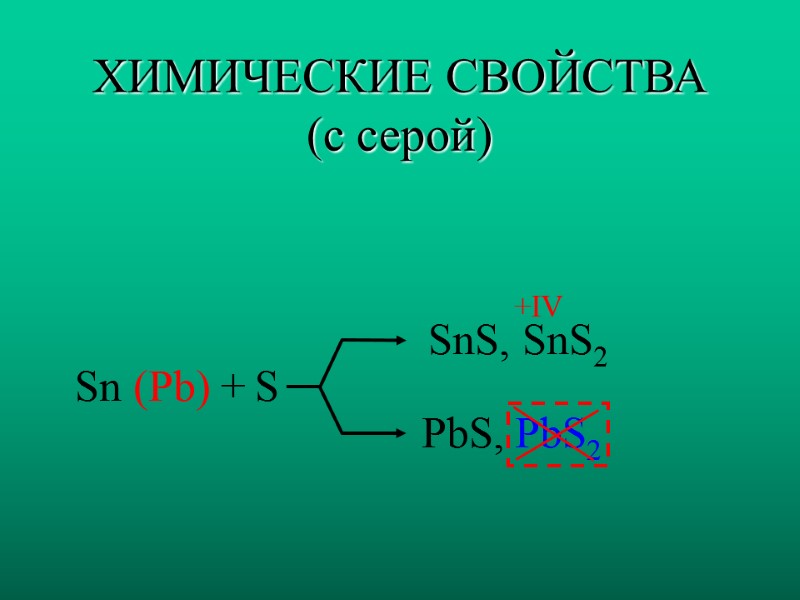
 ХИМИЧЕСКИЕ СВОЙСТВА (с серой) Sn (Pb) + S SnS, SnS2 +IV PbS, PbS2
ХИМИЧЕСКИЕ СВОЙСТВА (с серой) Sn (Pb) + S SnS, SnS2 +IV PbS, PbS2
 ХИМИЧЕСКИЕ СВОЙСТВА (с кислотами) Sn (Pb) + H3O+ Sn2+(Pb2+) + H2 Для Pb: мало хорошо растворимых солей, Pb реагирует не с любой кислотой
ХИМИЧЕСКИЕ СВОЙСТВА (с кислотами) Sn (Pb) + H3O+ Sn2+(Pb2+) + H2 Для Pb: мало хорошо растворимых солей, Pb реагирует не с любой кислотой
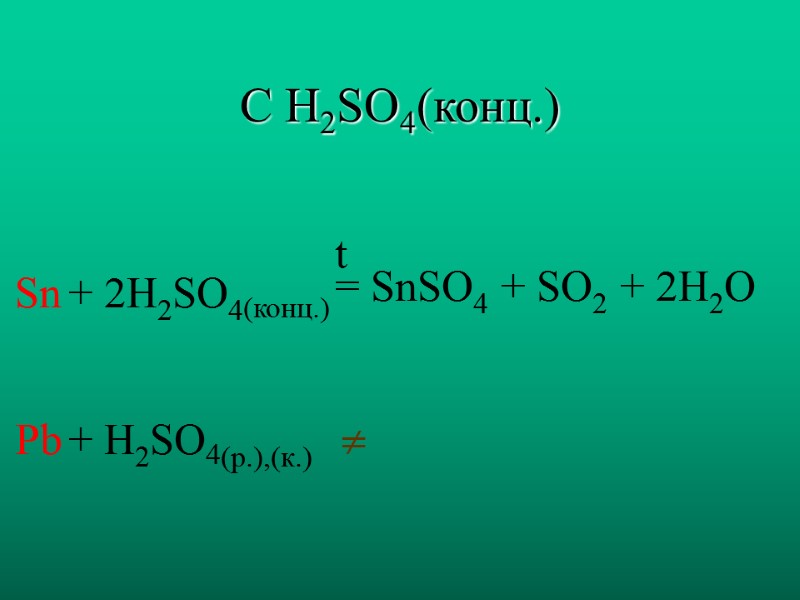 С H2SO4(конц.) Sn Pb + 2H2SO4(конц.) + H2SO4(р.),(к.) = SnSO4 + SO2 + 2H2O t
С H2SO4(конц.) Sn Pb + 2H2SO4(конц.) + H2SO4(р.),(к.) = SnSO4 + SO2 + 2H2O t
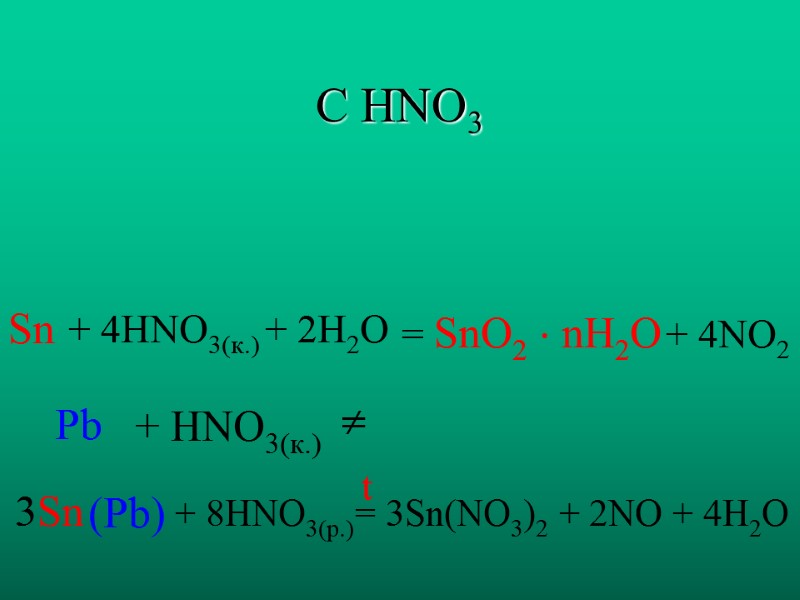
 С HNO3 Sn Pb + 4HNO3(к.) + 2H2O + HNO3(к.) = SnO2 nH2O + 4NO2 3Sn (Pb) + 8HNO3(р.) = 3Sn(NO3)2 + 2NO + 4H2O t
С HNO3 Sn Pb + 4HNO3(к.) + 2H2O + HNO3(к.) = SnO2 nH2O + 4NO2 3Sn (Pb) + 8HNO3(р.) = 3Sn(NO3)2 + 2NO + 4H2O t
 СО СЛАБЫМИ КИСЛОТАМИ СО СЛАБЫМИ КИСЛОТАМИ РЕАГИРУЮТ И Sn И Pb. Древний Рим: Pb + CO2 + H2O = PbCO3(тв.) + H2 +O2 (H2O) PbCO3(тв.) = Pb(HCO3)2(р). ОЧЕНЬ МЕДЛЕННО И ОТРАВЛЕНИЯ!!! + CO2 + H2O
СО СЛАБЫМИ КИСЛОТАМИ СО СЛАБЫМИ КИСЛОТАМИ РЕАГИРУЮТ И Sn И Pb. Древний Рим: Pb + CO2 + H2O = PbCO3(тв.) + H2 +O2 (H2O) PbCO3(тв.) = Pb(HCO3)2(р). ОЧЕНЬ МЕДЛЕННО И ОТРАВЛЕНИЯ!!! + CO2 + H2O
![>С ОСНОВАНИЯМИ K[Sn(OH)3] Sn (Pb) + 4KOH(р.) + 2H2O = >С ОСНОВАНИЯМИ K[Sn(OH)3] Sn (Pb) + 4KOH(р.) + 2H2O =](https://present5.com/presentacii-2/20171208\5628-sn_pb.ppt\5628-sn_pb_11.jpg) С ОСНОВАНИЯМИ K[Sn(OH)3] Sn (Pb) + 4KOH(р.) + 2H2O = K4[Sn(OH)6] + H2 Т. Е. Sn И Pb – АМФОТЕРНЫ
С ОСНОВАНИЯМИ K[Sn(OH)3] Sn (Pb) + 4KOH(р.) + 2H2O = K4[Sn(OH)6] + H2 Т. Е. Sn И Pb – АМФОТЕРНЫ
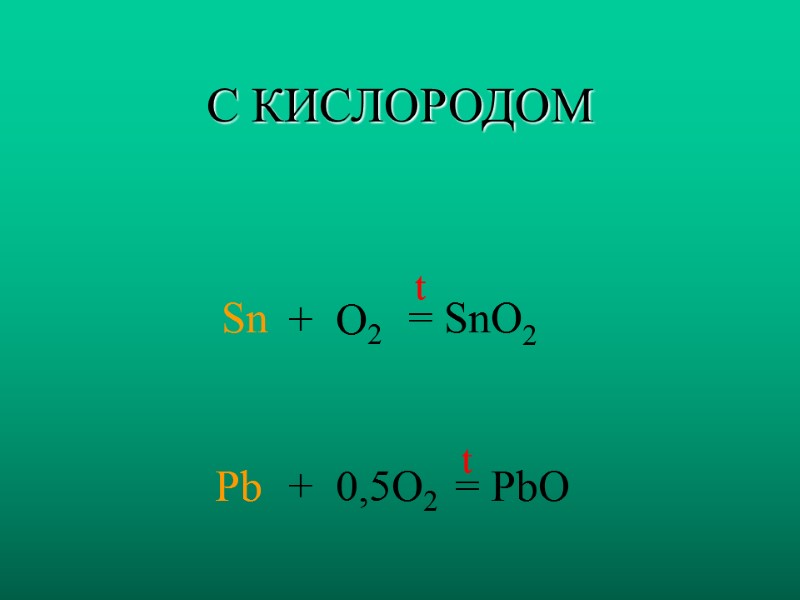
 С КИСЛОРОДОМ Sn Pb + O2 + 0,5O2 = SnO2 = PbO t t
С КИСЛОРОДОМ Sn Pb + O2 + 0,5O2 = SnO2 = PbO t t
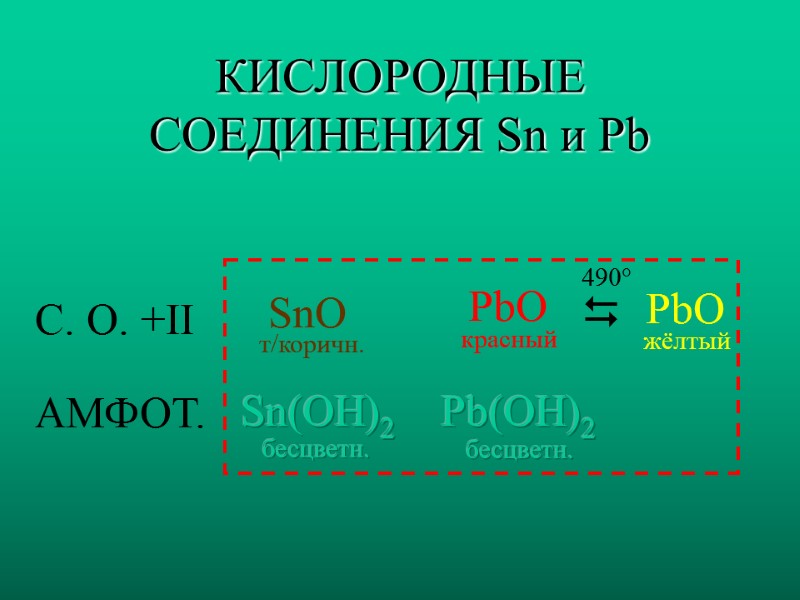
 КИСЛОРОДНЫЕ СОЕДИНЕНИЯ Sn и Pb С. О. +II АМФОТ. SnO Sn(OH)2 PbO PbO Pb(OH)2 т/коричн. красный жёлтый бесцветн. бесцветн. 490°
КИСЛОРОДНЫЕ СОЕДИНЕНИЯ Sn и Pb С. О. +II АМФОТ. SnO Sn(OH)2 PbO PbO Pb(OH)2 т/коричн. красный жёлтый бесцветн. бесцветн. 490°
 ПРОИЗВЕДЕНИЯ РАСТВОРИМОСТИ Sn(OH)2 Pb(OH)2 ПР = 5,5 10-27 ПР = 5,5 10-16 Sn2+ Sn(OH)2 [Sn(OH)6]4- Pb [Sn(OH)3]- [Pb(OH)4]2- H3O+ OH-
ПРОИЗВЕДЕНИЯ РАСТВОРИМОСТИ Sn(OH)2 Pb(OH)2 ПР = 5,5 10-27 ПР = 5,5 10-16 Sn2+ Sn(OH)2 [Sn(OH)6]4- Pb [Sn(OH)3]- [Pb(OH)4]2- H3O+ OH-
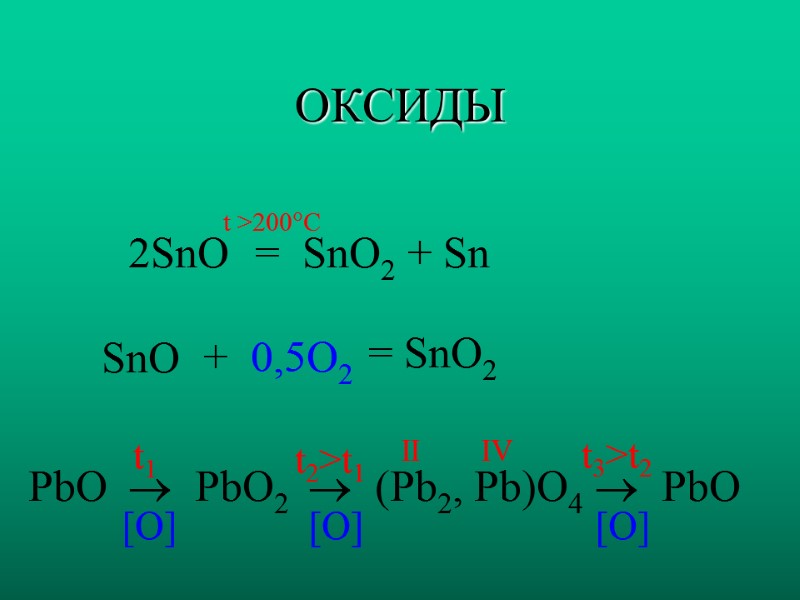
 ОКСИДЫ 2SnO SnO = SnO2 + Sn + 0,5O2 = SnO2 t >200C PbO PbO2 (Pb2, Pb)O4 PbO [O] IV [O] [O] II t1 t2>t1 t3>t2
ОКСИДЫ 2SnO SnO = SnO2 + Sn + 0,5O2 = SnO2 t >200C PbO PbO2 (Pb2, Pb)O4 PbO [O] IV [O] [O] II t1 t2>t1 t3>t2
 СВОЙСТВА ОКСИДОВ (II) PbO и SnO – амфотерны SnO SnO(тв.) PbO(тв.) + KOH(разб.) + H2O + 4KOH(к.) + H2O = K[Sn(OH)3] = K4[Sn(OH)6] – аналогично
СВОЙСТВА ОКСИДОВ (II) PbO и SnO – амфотерны SnO SnO(тв.) PbO(тв.) + KOH(разб.) + H2O + 4KOH(к.) + H2O = K[Sn(OH)3] = K4[Sn(OH)6] – аналогично
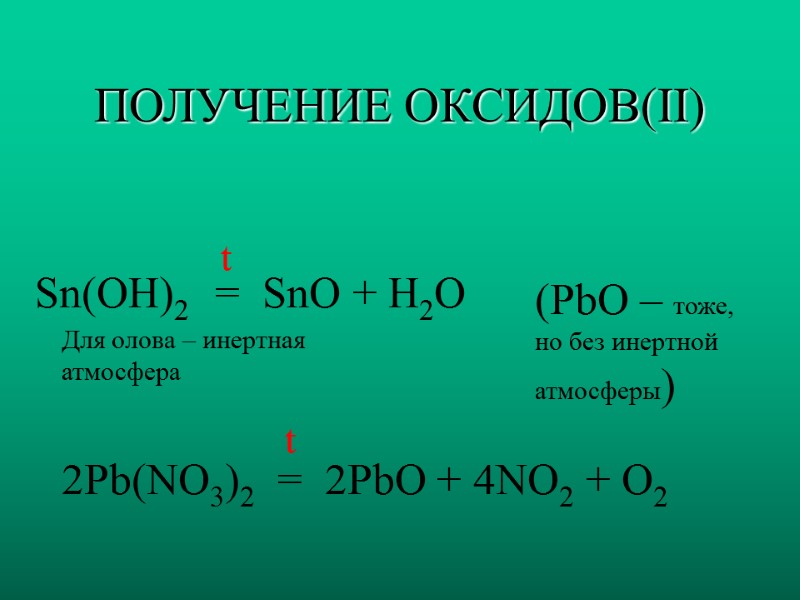
 ПОЛУЧЕНИЕ ОКСИДОВ(II) Sn(OH)2 t = SnO + H2O (PbO – тоже, но без инертной атмосферы) 2Pb(NO3)2 = 2PbO + 4NO2 + O2 t Для олова – инертная атмосфера
ПОЛУЧЕНИЕ ОКСИДОВ(II) Sn(OH)2 t = SnO + H2O (PbO – тоже, но без инертной атмосферы) 2Pb(NO3)2 = 2PbO + 4NO2 + O2 t Для олова – инертная атмосфера
 ГИДРОКСОКОМПЛЕКСЫ (М+II)
ГИДРОКСОКОМПЛЕКСЫ (М+II)
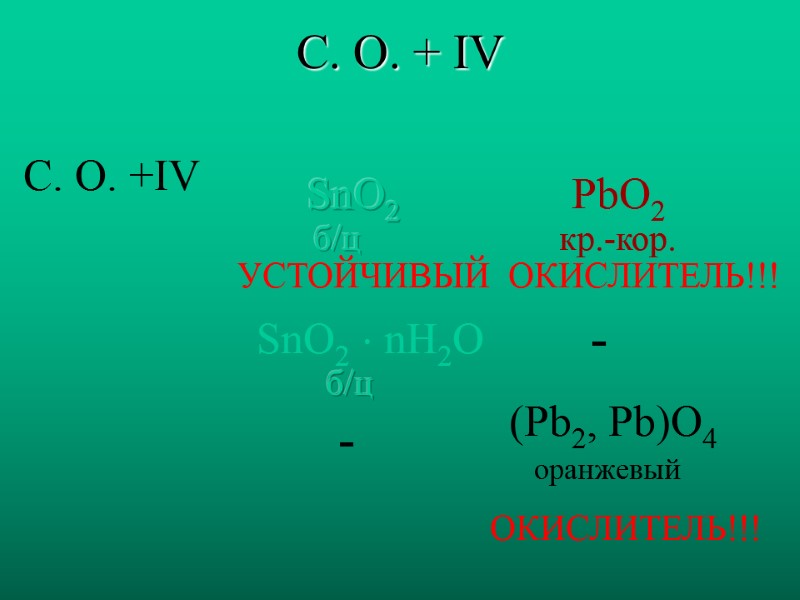
 С. О. + IV С. О. +IV SnO2 PbO2 SnO2 nH2O - (Pb2, Pb)O4 б/ц кр.-кор. ОКИСЛИТЕЛЬ!!! ОКИСЛИТЕЛЬ!!! УСТОЙЧИВЫЙ - б/ц оранжевый
С. О. + IV С. О. +IV SnO2 PbO2 SnO2 nH2O - (Pb2, Pb)O4 б/ц кр.-кор. ОКИСЛИТЕЛЬ!!! ОКИСЛИТЕЛЬ!!! УСТОЙЧИВЫЙ - б/ц оранжевый
 ПОЛУЧЕНИЕ ОКСИДОВ(IV) Sn + O2 = SnO2 t SnO2 • nH2O = SnO2 + nH2O PbO + CaCl2O CaCl(ClO) = PbO2 + CaCl2
ПОЛУЧЕНИЕ ОКСИДОВ(IV) Sn + O2 = SnO2 t SnO2 • nH2O = SnO2 + nH2O PbO + CaCl2O CaCl(ClO) = PbO2 + CaCl2
 СВОЙСТВА ОСИДОВ (IV) SnO2 PbO2 – инертен – окислитель!!! SnO2 + 2KOH(ж.) t спл. +IV 3H2O = K2SnO3 K2[Sn(OH)6] SnO2 nH2O H3O+
СВОЙСТВА ОСИДОВ (IV) SnO2 PbO2 – инертен – окислитель!!! SnO2 + 2KOH(ж.) t спл. +IV 3H2O = K2SnO3 K2[Sn(OH)6] SnO2 nH2O H3O+
 ХИМИЯ ВОДНЫХ РАСТВОРОВ(Sn) Sn SnCl2 = Sn2+ + 2Cl- [Sn3(OH)4]2+ [Sn2(OH)2]2+ Sn2+ H2O + H2O SnOH+ + H3O+ KK ~ 8 10-3 ОЧЕНЬ БЫСТРО ПОЛИМЕРИЗ. И ВЫПАДАЕТ ОСАДОК
ХИМИЯ ВОДНЫХ РАСТВОРОВ(Sn) Sn SnCl2 = Sn2+ + 2Cl- [Sn3(OH)4]2+ [Sn2(OH)2]2+ Sn2+ H2O + H2O SnOH+ + H3O+ KK ~ 8 10-3 ОЧЕНЬ БЫСТРО ПОЛИМЕРИЗ. И ВЫПАДАЕТ ОСАДОК
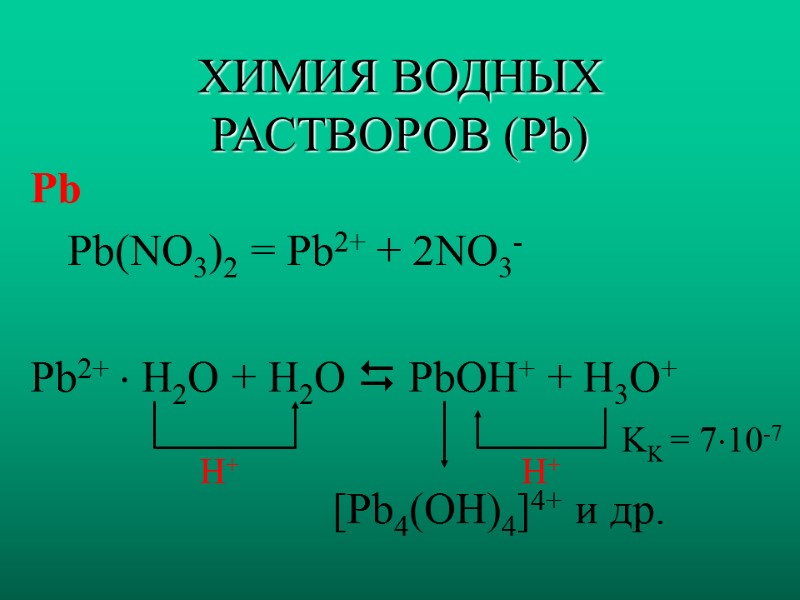
 ХИМИЯ ВОДНЫХ РАСТВОРОВ (Pb) Pb Pb(NO3)2 = Pb2+ + 2NO3- Pb2+ H2O + H2O PbOH+ + H3O+ KK = 710-7 H+ [Pb4(OH)4]4+ и др. H+
ХИМИЯ ВОДНЫХ РАСТВОРОВ (Pb) Pb Pb(NO3)2 = Pb2+ + 2NO3- Pb2+ H2O + H2O PbOH+ + H3O+ KK = 710-7 H+ [Pb4(OH)4]4+ и др. H+
![>ГАЛОГЕНИДЫ SnCl2 + HCl H[SnCl3] SnCl4(ж.) + 2HCl(к.) H2[SnCl6] SnCl4(ж.) >ГАЛОГЕНИДЫ SnCl2 + HCl H[SnCl3] SnCl4(ж.) + 2HCl(к.) H2[SnCl6] SnCl4(ж.)](https://present5.com/presentacii-2/20171208\5628-sn_pb.ppt\5628-sn_pb_24.jpg) ГАЛОГЕНИДЫ SnCl2 + HCl H[SnCl3] SnCl4(ж.) + 2HCl(к.) H2[SnCl6] SnCl4(ж.) + 2H2O = SnO2(т.) + 4HCl PbCl4 PbCl2 + Cl2 (ОВР) PbO2(т.) + 4HCl = PbCl2 + Cl2 + 2H2O H2O
ГАЛОГЕНИДЫ SnCl2 + HCl H[SnCl3] SnCl4(ж.) + 2HCl(к.) H2[SnCl6] SnCl4(ж.) + 2H2O = SnO2(т.) + 4HCl PbCl4 PbCl2 + Cl2 (ОВР) PbO2(т.) + 4HCl = PbCl2 + Cl2 + 2H2O H2O
 ОКИСЛИТЕЛЬНО – ВОССТАНОВИТЕЛЬНЫЕ ПОТЕНЦИАЛЫ (PbO2) pH < 7 pH > 7 PbO2(т.) + 4H+ + 2e = Pb2+ + 2H2O PbO2(т.) + 2H2O + 2OH- + 2e = [Pb(OH)6]4- +1,45В +0,3В
ОКИСЛИТЕЛЬНО – ВОССТАНОВИТЕЛЬНЫЕ ПОТЕНЦИАЛЫ (PbO2) pH < 7 pH > 7 PbO2(т.) + 4H+ + 2e = Pb2+ + 2H2O PbO2(т.) + 2H2O + 2OH- + 2e = [Pb(OH)6]4- +1,45В +0,3В
 >ОКСИДЫ СВИНЦА (PbO2 и (Pb2Pb)O4) PbO2(т.) + 2KOH + 2H2O = K2[Pb(OH)6](р.)](https://present5.com/presentacii-2/20171208\5628-sn_pb.ppt\5628-sn_pb_26.jpg) ОКСИДЫ СВИНЦА (PbO2 и (Pb2Pb)O4) PbO2(т.) + 2KOH + 2H2O = K2[Pb(OH)6](р.) Pb3O4 (Pb2Pb)O4 – окислитель (Pb2Pb)O4 + 4HNO3 + Mn(NO3)2 + HNO3 + 8H+ + 2e = 2Pb(NO3)2 + PbO2 + =HMnO4 + (не ОВР) … = 3Pb2+ + 4H2O o = 2,09В (Pb2Pb)O4 (Pb2Pb)O4 …
ОКСИДЫ СВИНЦА (PbO2 и (Pb2Pb)O4) PbO2(т.) + 2KOH + 2H2O = K2[Pb(OH)6](р.) Pb3O4 (Pb2Pb)O4 – окислитель (Pb2Pb)O4 + 4HNO3 + Mn(NO3)2 + HNO3 + 8H+ + 2e = 2Pb(NO3)2 + PbO2 + =HMnO4 + (не ОВР) … = 3Pb2+ + 4H2O o = 2,09В (Pb2Pb)O4 (Pb2Pb)O4 …
 ВОССТАНОВИТЕЛЬНЫЕ СВОЙСТВА Sn(II) и Pb(II) Pb(II) – устойчив Sn(II) – восстановитель H[SnCl3] + Br2 + 3HCl H2[SnCl6] + 2HBr pH < 7 [SnCl3]- + 3Cl- - 2e = H2[SnCl6] o = + 0,14В K4[Sn(OH)6] + HgCl2 = K2[Sn(OH)6] + Hg + 2KCl pH > 7 o = - 0,96В (типичный восстановитель!!!) K[Sn(OH)3] +HgCl2 +3KOH = K2[Sn(OH)6] + Hg + 2KCl
ВОССТАНОВИТЕЛЬНЫЕ СВОЙСТВА Sn(II) и Pb(II) Pb(II) – устойчив Sn(II) – восстановитель H[SnCl3] + Br2 + 3HCl H2[SnCl6] + 2HBr pH < 7 [SnCl3]- + 3Cl- - 2e = H2[SnCl6] o = + 0,14В K4[Sn(OH)6] + HgCl2 = K2[Sn(OH)6] + Hg + 2KCl pH > 7 o = - 0,96В (типичный восстановитель!!!) K[Sn(OH)3] +HgCl2 +3KOH = K2[Sn(OH)6] + Hg + 2KCl
 ПРОИЗВЕДЕНИЯ РАСТВОРИМОСТИ Sn(OH)2 Pb(OH)2 ПР = 5,5 10-27 ПР = 5,5 10-16 Sn2+ Sn(OH)2 [Sn(OH)6]4- Pb [Sn(OH)3]- [Pb(OH)4]2- H3O+ OH-
ПРОИЗВЕДЕНИЯ РАСТВОРИМОСТИ Sn(OH)2 Pb(OH)2 ПР = 5,5 10-27 ПР = 5,5 10-16 Sn2+ Sn(OH)2 [Sn(OH)6]4- Pb [Sn(OH)3]- [Pb(OH)4]2- H3O+ OH-
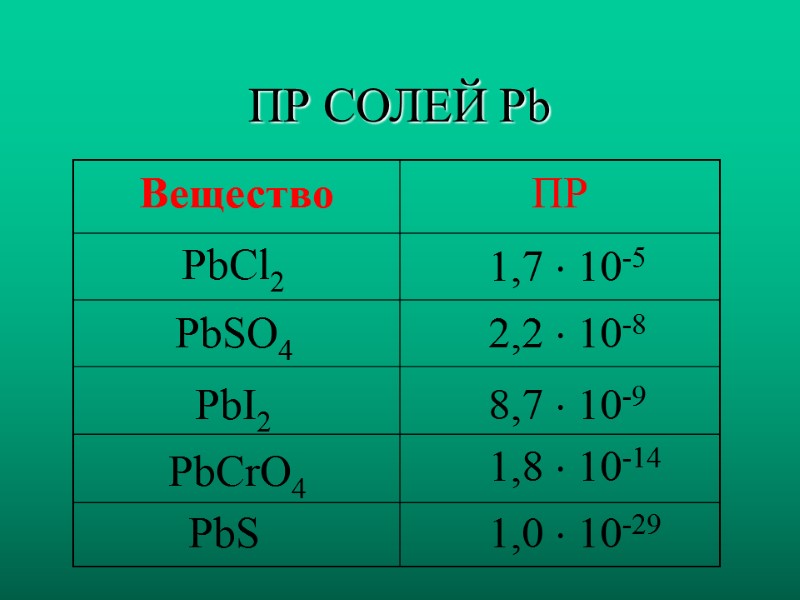
 ПР СОЛЕЙ Pb PbCl2 PbSO4 PbI2 PbCrO4 PbS 1,7 10-5 2,2 10-8 8,7 10-9 1,8 10-14 1,0 10-29
ПР СОЛЕЙ Pb PbCl2 PbSO4 PbI2 PbCrO4 PbS 1,7 10-5 2,2 10-8 8,7 10-9 1,8 10-14 1,0 10-29
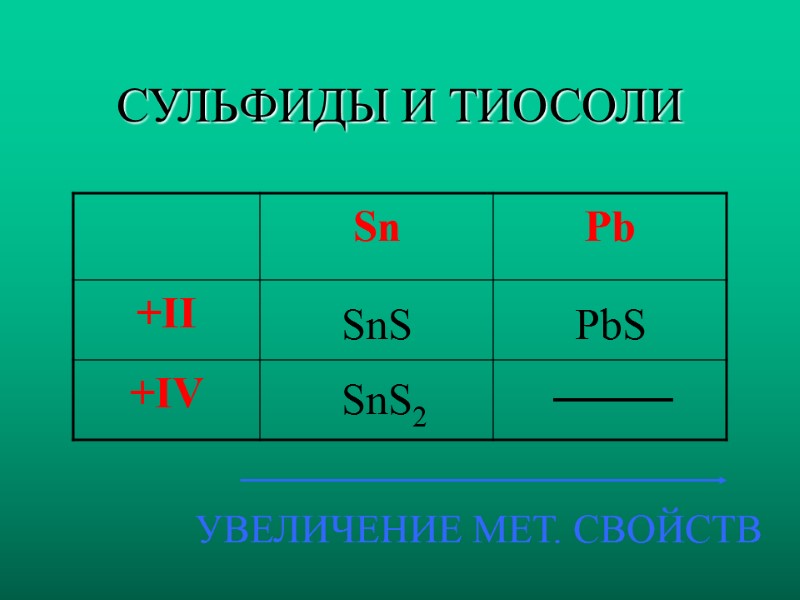
 СУЛЬФИДЫ И ТИОСОЛИ SnS PbS SnS2 УВЕЛИЧЕНИЕ МЕТ. СВОЙСТВ
СУЛЬФИДЫ И ТИОСОЛИ SnS PbS SnS2 УВЕЛИЧЕНИЕ МЕТ. СВОЙСТВ
 ХИМИЧЕСКИЕ СВОЙСТВА СУЛЬФИДОВ И ТИОСОЛЕЙ SnS (PbS) + Na2S SnS2(тв.) + Na2S Na2[SnS3](р.) SnS + Na2S2 = Na2[SnS3] Sn+II – 2e = Sn+IV 2S-I + 2e = 2S-II Na2[SnS3] + 2HCl = 2NaCl + SnS2(т.) + H2S PbS + Na2S2 +II -I +IV -II
ХИМИЧЕСКИЕ СВОЙСТВА СУЛЬФИДОВ И ТИОСОЛЕЙ SnS (PbS) + Na2S SnS2(тв.) + Na2S Na2[SnS3](р.) SnS + Na2S2 = Na2[SnS3] Sn+II – 2e = Sn+IV 2S-I + 2e = 2S-II Na2[SnS3] + 2HCl = 2NaCl + SnS2(т.) + H2S PbS + Na2S2 +II -I +IV -II
