Основные понятия.Периодическая система.PPT
- Количество слайдов: 21
 Московская государственная академия тонкой химической технологии им. М. В. Ломоносова Сорокина О. В. ВСПОМОГАТЕЛЬНЫЕ СХЕМЫ ПО НЕОРГАНИЧЕСКОЙ ХИМИИ ОСНОВНЫЕ ПОНЯТИЯ. ПЕРИОДИЧЕСКАЯ СИСТЕМА Утверждено библиотечным Советом МИТХТ им. М. В. Ломоносова Московская Государственная академия тонкой химической технологии им. М. В. Ломоносова (МИТХТ), 2006 г.
Московская государственная академия тонкой химической технологии им. М. В. Ломоносова Сорокина О. В. ВСПОМОГАТЕЛЬНЫЕ СХЕМЫ ПО НЕОРГАНИЧЕСКОЙ ХИМИИ ОСНОВНЫЕ ПОНЯТИЯ. ПЕРИОДИЧЕСКАЯ СИСТЕМА Утверждено библиотечным Советом МИТХТ им. М. В. Ломоносова Московская Государственная академия тонкой химической технологии им. М. В. Ломоносова (МИТХТ), 2006 г.
 Этапы развития химических учений 1) Алхимический 2) Классический 3) Количественный 4) Современный (с открытия Д. И. Менделеевым ПЗ, 1869 г. ) – появилась возможность предсказания, физические методы активно использовались в химии и т. д. (до ~ 1869 г. – XVIII века) (до конца до открытия (до первой половины XVI Периодического закона) – сформулированы – накопление – измерения… важнейшие понятия и экспериментальных фактов Химия стала одной из создан всем понятный о веществах и их свойствах. естественных наук. язык. (Бойль, Лемери, Ломоносов, Лавуазье, Пруст)
Этапы развития химических учений 1) Алхимический 2) Классический 3) Количественный 4) Современный (с открытия Д. И. Менделеевым ПЗ, 1869 г. ) – появилась возможность предсказания, физические методы активно использовались в химии и т. д. (до ~ 1869 г. – XVIII века) (до конца до открытия (до первой половины XVI Периодического закона) – сформулированы – накопление – измерения… важнейшие понятия и экспериментальных фактов Химия стала одной из создан всем понятный о веществах и их свойствах. естественных наук. язык. (Бойль, Лемери, Ломоносов, Лавуазье, Пруст)
 Этапы развития химических учений База современной химии: 4 учения • учение о Периодическом законе • учение о химическом равновесии • учение о растворах • учение о строении вещества
Этапы развития химических учений База современной химии: 4 учения • учение о Периодическом законе • учение о химическом равновесии • учение о растворах • учение о строении вещества
 Химические частицы Названи е заряд q Ne 1(н/э) Примеры атом =0 ≥ 0 Н(1 e 1), Ca(2 e 1), Ar(0 e 1) молекул а =0 =0 Сl 2, H 2 O, N 2 O 4 катион >0 =0 K+, Al 3+, Zn 2+ анион <0 =0 Cl-, SO 42 -, OH- радикал =0 >0 . OH, . NO катионрадикал >0 >0 анионрадикал <0 >0 . Cu 2+, Mn 2+ . SO 3 2
Химические частицы Названи е заряд q Ne 1(н/э) Примеры атом =0 ≥ 0 Н(1 e 1), Ca(2 e 1), Ar(0 e 1) молекул а =0 =0 Сl 2, H 2 O, N 2 O 4 катион >0 =0 K+, Al 3+, Zn 2+ анион <0 =0 Cl-, SO 42 -, OH- радикал =0 >0 . OH, . NO катионрадикал >0 >0 анионрадикал <0 >0 . Cu 2+, Mn 2+ . SO 3 2
 Химические частицы Вещество – ансамбль любых химических частиц или их совокупностей. 1 частица – формульная единица, имеет состав, изображаемый формулой. Ar – в-во «аргон» (атомы) H 2 O – в-во вода (молекулы) H+. H 2 O(H 3 O+) – в-во катион оксония (катионы) NO 2 - - в-во нитрит-ионы (анионы) KNO 3(K+)(NO 3 -) – в-во нитрат калия Cu. SO 4 – в-во сульфат меди Cu. SO 4 • 5 H 2 O – в-во пентагидрат сульфата меди (медный купорос)
Химические частицы Вещество – ансамбль любых химических частиц или их совокупностей. 1 частица – формульная единица, имеет состав, изображаемый формулой. Ar – в-во «аргон» (атомы) H 2 O – в-во вода (молекулы) H+. H 2 O(H 3 O+) – в-во катион оксония (катионы) NO 2 - - в-во нитрит-ионы (анионы) KNO 3(K+)(NO 3 -) – в-во нитрат калия Cu. SO 4 – в-во сульфат меди Cu. SO 4 • 5 H 2 O – в-во пентагидрат сульфата меди (медный купорос)
 Классификация Химических веществ Неорганические вещества Сложные Вещества Простые вещества • Металлы • Неметаллы • Амфотерные • Благородные газы
Классификация Химических веществ Неорганические вещества Сложные Вещества Простые вещества • Металлы • Неметаллы • Амфотерные • Благородные газы
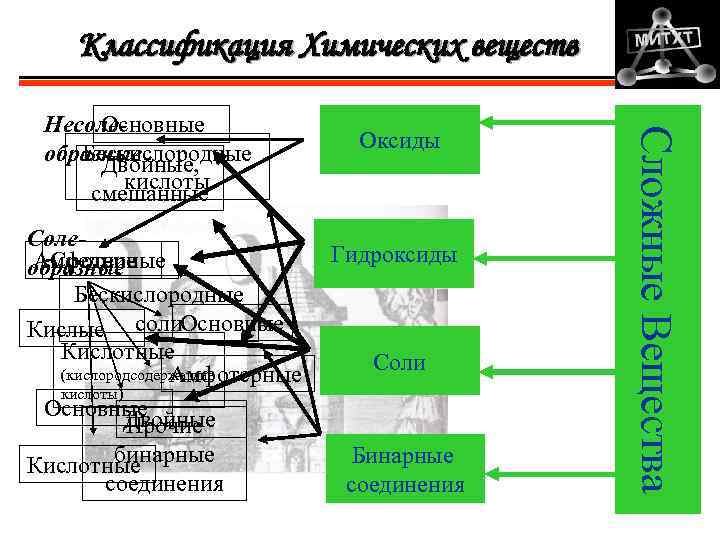 Классификация Химических веществ Соле. Амфотерные Средние образные Бескислородные Кислые соли. Основные Кислотные (кислородсодержащие Амфотерные кислоты) Основные Двойные Прочие бинарные Кислотные соединения Оксиды Гидроксиды Соли Бинарные соединения Сложные Вещества Несоле. Основные Бескислородные образные Двойные, кислоты смешанные
Классификация Химических веществ Соле. Амфотерные Средние образные Бескислородные Кислые соли. Основные Кислотные (кислородсодержащие Амфотерные кислоты) Основные Двойные Прочие бинарные Кислотные соединения Оксиды Гидроксиды Соли Бинарные соединения Сложные Вещества Несоле. Основные Бескислородные образные Двойные, кислоты смешанные
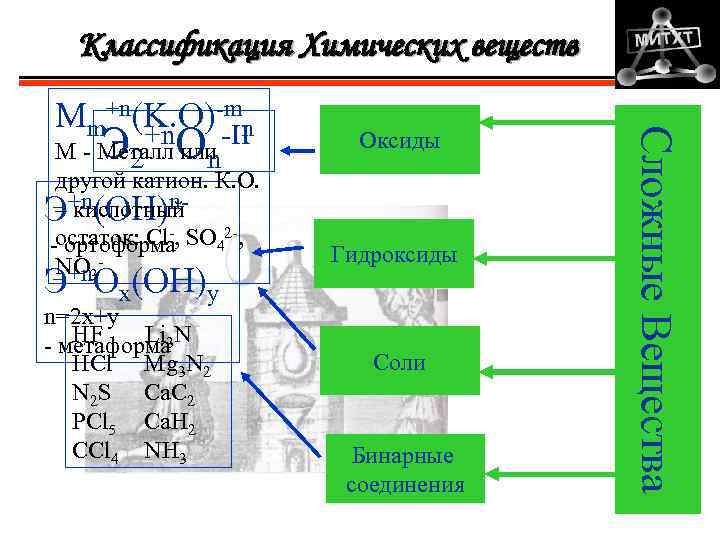 Классификация Химических веществ Э О М - Металл или 2 n другой катион. К. О. – кислотный Э+n(ОН)-n- 2 -остаток: Cl , SO 4 , ортоформа NO 3 Э+n. Ox(OH)y n=2 x+y HF Li - метаформа 3 N HCl Mg 3 N 2 N 2 S Ca. C 2 PCl 5 Ca. H 2 CCl 4 NH 3 Оксиды Гидроксиды Соли Бинарные соединения Сложные Вещества Mm+n(K. O)-mn +n -II
Классификация Химических веществ Э О М - Металл или 2 n другой катион. К. О. – кислотный Э+n(ОН)-n- 2 -остаток: Cl , SO 4 , ортоформа NO 3 Э+n. Ox(OH)y n=2 x+y HF Li - метаформа 3 N HCl Mg 3 N 2 N 2 S Ca. C 2 PCl 5 Ca. H 2 CCl 4 NH 3 Оксиды Гидроксиды Соли Бинарные соединения Сложные Вещества Mm+n(K. O)-mn +n -II
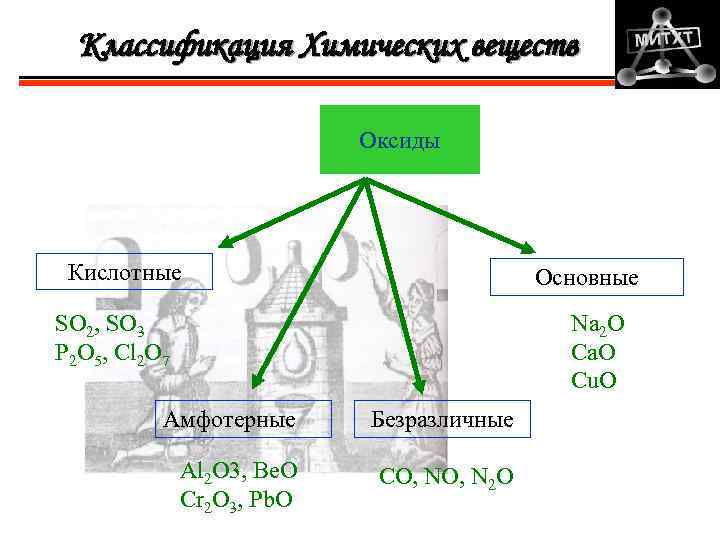 Классификация Химических веществ Оксиды Кислотные Основные Na 2 O Ca. O Cu. O SO 2, SO 3 P 2 O 5, Cl 2 O 7 Амфотерные Безразличные Al 2 O 3, Be. O Cr 2 O 3, Pb. O CO, N 2 O
Классификация Химических веществ Оксиды Кислотные Основные Na 2 O Ca. O Cu. O SO 2, SO 3 P 2 O 5, Cl 2 O 7 Амфотерные Безразличные Al 2 O 3, Be. O Cr 2 O 3, Pb. O CO, N 2 O
 Основы номенклатуры неорг. веществ I. Простые вещества 1) Специальные названия: О 2 -кислород, О 3 -озон, Р 4 белый фосфор. 2) наименование хим. элемента с числовой приставкой, равной числу атомов в молекуле простого вещества (в одно слово): Mg – (моно)магний О 2 -дикислород, О 3 -трикислород Р 4 - тетрафосфор, S 8 -октасера
Основы номенклатуры неорг. веществ I. Простые вещества 1) Специальные названия: О 2 -кислород, О 3 -озон, Р 4 белый фосфор. 2) наименование хим. элемента с числовой приставкой, равной числу атомов в молекуле простого вещества (в одно слово): Mg – (моно)магний О 2 -дикислород, О 3 -трикислород Р 4 - тетрафосфор, S 8 -октасера
 Основы номенклатуры неорг. веществ II. Оксиды и бинарные соединения Название таких веществ составляют по химическим формулам справа налево, Mg. O – более электроотрицательная часть называется 1. Правая, (моно)оксид магния [оксид магния(II)] N 2 O – (моно)оксид латинский корень + суффикс – следующим образом: диазота [оксид азота (I)] N 2 O 4 – тетраоксид диазота ид с соответствующей числовой приставкой. ОF – дифторид кислорода 2. Левая, менее 2 электроотрицательная – русское название. Mg 3 N 2 – динитрид тримагния в родительном падеже с соответствующей числовой приставкой. или русское название элемента и в скобках его степень окисления
Основы номенклатуры неорг. веществ II. Оксиды и бинарные соединения Название таких веществ составляют по химическим формулам справа налево, Mg. O – более электроотрицательная часть называется 1. Правая, (моно)оксид магния [оксид магния(II)] N 2 O – (моно)оксид латинский корень + суффикс – следующим образом: диазота [оксид азота (I)] N 2 O 4 – тетраоксид диазота ид с соответствующей числовой приставкой. ОF – дифторид кислорода 2. Левая, менее 2 электроотрицательная – русское название. Mg 3 N 2 – динитрид тримагния в родительном падеже с соответствующей числовой приставкой. или русское название элемента и в скобках его степень окисления
 Основы номенклатуры неорг. веществ II. Кислоты и соли Номенклатура традиционная и научная H n. Эx. Om • традиционная – см. справочник (запоминать) • научная номенклатура кислот и солей: • по хим. формуле справа налево Числ. Приставка Лат. корень, название Суффикс С. О. Э. Водорода с соотв коэффицентом +оксо=m - ат
Основы номенклатуры неорг. веществ II. Кислоты и соли Номенклатура традиционная и научная H n. Эx. Om • традиционная – см. справочник (запоминать) • научная номенклатура кислот и солей: • по хим. формуле справа налево Числ. Приставка Лат. корень, название Суффикс С. О. Э. Водорода с соотв коэффицентом +оксо=m - ат
 Основы номенклатуры неорг. веществ Аналогично называются соли этих кислот, вместо водорода – наименование соответствующего металла (русское) в родит. традиционн. научное НСl. Oпадеже с указанием его степени окисления. – хлорноватистая к-та (моно)оксохлорат(+I)водорода Na. Cl. O – гипохлорит натрия ----- «» ----- натрия H 2 Cr. O 4 – хромовая кислота тетраоксохромат(VI) водорода Количество катионов и анионов в формуле не указываются! Na 2 Cr. O 4 – хромат натрия ----- «» -----натрия H 2 Cr 2 O 7 – дихромовая к-та гептаоксодихромат(VI) водорода K 2 Cr 2 O 7 – дихромат калия ---- «» ----- калия HPO 3 – метафосфорная к-та триоксофосфат(V) водорода KPO 3 – метафосфат калия ---- «» ----калия H 3 PO 4 –ортофосфорная к-та тетраоксофосфат(V) водорода Ca 3(PO 4)2–ортофосфат кальция ---- «» ---- кальция HCl. O 4 – хлорная к-та тетраоксохлорат(+VII) водорода Na. Cl. O 4 – перхлорат натрия ----- «» ---- натрия
Основы номенклатуры неорг. веществ Аналогично называются соли этих кислот, вместо водорода – наименование соответствующего металла (русское) в родит. традиционн. научное НСl. Oпадеже с указанием его степени окисления. – хлорноватистая к-та (моно)оксохлорат(+I)водорода Na. Cl. O – гипохлорит натрия ----- «» ----- натрия H 2 Cr. O 4 – хромовая кислота тетраоксохромат(VI) водорода Количество катионов и анионов в формуле не указываются! Na 2 Cr. O 4 – хромат натрия ----- «» -----натрия H 2 Cr 2 O 7 – дихромовая к-та гептаоксодихромат(VI) водорода K 2 Cr 2 O 7 – дихромат калия ---- «» ----- калия HPO 3 – метафосфорная к-та триоксофосфат(V) водорода KPO 3 – метафосфат калия ---- «» ----калия H 3 PO 4 –ортофосфорная к-та тетраоксофосфат(V) водорода Ca 3(PO 4)2–ортофосфат кальция ---- «» ---- кальция HCl. O 4 – хлорная к-та тетраоксохлорат(+VII) водорода Na. Cl. O 4 – перхлорат натрия ----- «» ---- натрия
 Уравнения химических реакций νАА+νВВ=νСС+νDD Реагенты Продукты νА, В, С, D – стехиометрические коэффициенты реакции (обычно целые числа) Схема: Na. HCO 3 →Na 2 CO 3+CO 2+H 2 O Уравнение: 2 Na. HCO 3 = Na 2 CO 3+CO 2+H 2 O
Уравнения химических реакций νАА+νВВ=νСС+νDD Реагенты Продукты νА, В, С, D – стехиометрические коэффициенты реакции (обычно целые числа) Схема: Na. HCO 3 →Na 2 CO 3+CO 2+H 2 O Уравнение: 2 Na. HCO 3 = Na 2 CO 3+CO 2+H 2 O
 Классификация химических реакций IV. тепловому эффекту III. По типу взаимодействияреакции II. степени протекания I. наличию или отсутствию изменения С. О. если она протекает до реакция необратимая, 1)конца, т. е. все реагенты или один=2 Na. Cl Соединения 2 Na+Cl из них окислительно-восстановительные реакции 2 1) Экзотермическая участвующих (ОВР), в которых изменяются С. О. полностью превращаются в продукты. Обозначается веществ: 2) Разложениянеобратимая реакция = - S +6 H O=2 Al(OH) +3 H S выделениеt°тепла 2 Сu+O 2=2 Cu. O Al 3) 2 3 Сa. CO 3(T) =Ca. O(T) + CO 2(p) 2 3(T) 2 (г) +Q; ΔH<0 обменные реакции (реакции обмена) (ОР) Замещения изменения С. О. лишь частично, в обратимая реакция проходит протекают без смеси остаются все реаганты, =Fe. SO Cu. SO 4(p)+ Fe(T) и все продукты. Cu(T) 4(p) + Обозначается обратимая Ag. Cl Na. Cl + Обмена Ag. NO 3 = реакция (T) + Na. NO 3 2) Эндотермическая 4) - поглощение тепла 2 KOH+H 2 SO 4=2 H 2 O+K 2ΔH>0 Na 2 SO 4+Ba. Cl 2=Ba. SO 4(T)+2 Na. Cl SO 4 N 2(г)+3 H 2(г) -Q; 2 NH 3(г)
Классификация химических реакций IV. тепловому эффекту III. По типу взаимодействияреакции II. степени протекания I. наличию или отсутствию изменения С. О. если она протекает до реакция необратимая, 1)конца, т. е. все реагенты или один=2 Na. Cl Соединения 2 Na+Cl из них окислительно-восстановительные реакции 2 1) Экзотермическая участвующих (ОВР), в которых изменяются С. О. полностью превращаются в продукты. Обозначается веществ: 2) Разложениянеобратимая реакция = - S +6 H O=2 Al(OH) +3 H S выделениеt°тепла 2 Сu+O 2=2 Cu. O Al 3) 2 3 Сa. CO 3(T) =Ca. O(T) + CO 2(p) 2 3(T) 2 (г) +Q; ΔH<0 обменные реакции (реакции обмена) (ОР) Замещения изменения С. О. лишь частично, в обратимая реакция проходит протекают без смеси остаются все реаганты, =Fe. SO Cu. SO 4(p)+ Fe(T) и все продукты. Cu(T) 4(p) + Обозначается обратимая Ag. Cl Na. Cl + Обмена Ag. NO 3 = реакция (T) + Na. NO 3 2) Эндотермическая 4) - поглощение тепла 2 KOH+H 2 SO 4=2 H 2 O+K 2ΔH>0 Na 2 SO 4+Ba. Cl 2=Ba. SO 4(T)+2 Na. Cl SO 4 N 2(г)+3 H 2(г) -Q; 2 NH 3(г)
 Классификация химических реакций обменные реакции (реакции обмена) (ОР) протекают без изменения С. О. (Cu. OH)2 CO 3(т) + 4 HCl = 3 H 2 O + CO 2 + 2 Cu. Cl Na 2 HPO 4 + Na. OH = Na 3 PO 4 + H 2 O (Cu. OH)2 CO 3(т) = 3 Na+ + PO 3 -= H O + 4 H + + 4 Cl- + Na+ + HPO 2 - + Na+ + OH 4 4 2 = 3 H 2 O + CO 2 + 2 Cu 2+ + 4 Cl- HPO 42 - + OH-=PO 43 - + H 2 O (Cu. OH)2 CO 3(т) + 4 H+ = 3 H 2 O + CO 2 + Cu 2+
Классификация химических реакций обменные реакции (реакции обмена) (ОР) протекают без изменения С. О. (Cu. OH)2 CO 3(т) + 4 HCl = 3 H 2 O + CO 2 + 2 Cu. Cl Na 2 HPO 4 + Na. OH = Na 3 PO 4 + H 2 O (Cu. OH)2 CO 3(т) = 3 Na+ + PO 3 -= H O + 4 H + + 4 Cl- + Na+ + HPO 2 - + Na+ + OH 4 4 2 = 3 H 2 O + CO 2 + 2 Cu 2+ + 4 Cl- HPO 42 - + OH-=PO 43 - + H 2 O (Cu. OH)2 CO 3(т) + 4 H+ = 3 H 2 O + CO 2 + Cu 2+
 Правило Полинга Лайнус Полинг (1901 - 1994) Hn. ЭOm Американский ученый. Внес большой вклад в исследование природы химической связи, разработал метод валентных связей, теорию резонанса. В 1954 г. За «исследование природы химической связи» получил Нобелевскую премию. В 1962 г. Нобелевская премия мира. Если m-n ≥ 2 Кислота сильная
Правило Полинга Лайнус Полинг (1901 - 1994) Hn. ЭOm Американский ученый. Внес большой вклад в исследование природы химической связи, разработал метод валентных связей, теорию резонанса. В 1954 г. За «исследование природы химической связи» получил Нобелевскую премию. В 1962 г. Нобелевская премия мира. Если m-n ≥ 2 Кислота сильная
 Уравнение реакций в растворе Признаки необратимости реакций в растворе: Реакции в растворе протекают практически до конца (необратимо), если хотя бы один из продуктов: • Газ (↑), (г) • Осадок (↓), (т) • Слабый электролит, например вода
Уравнение реакций в растворе Признаки необратимости реакций в растворе: Реакции в растворе протекают практически до конца (необратимо), если хотя бы один из продуктов: • Газ (↑), (г) • Осадок (↓), (т) • Слабый электролит, например вода
 Уравнение реакций в растворе Для реакций, протекающих в растворе, составляют два вида уравнений: Молекулярное ионное: • Молекулярные • Ионные Na 2 CO 3 + 2 HCl = 2 Na. Cl + CO 2(г)+ Hи 2 O в которых формула твердых Ba. Cl 2 + H 2 SO 4 газообразных 4(T) + 2 HCl = Ba. SO веществ и слабых Полное ионное: 2 Na+ + CO 32 - + электролитов не изменяются, а сильные, + хорошо = 2 Na+ + 2 Cl-+CO - растворимые электролиты O 2 H записываются в виде ионов. 2(г) + H 2 + 2 Cl Краткое ионное: Ba 2+ + 2 Cl-CO 2 -++ 2 H+4= =Ba. SO 4(T) + 2 H+ + + 2 H + SO 2 - CO + H O 3 2(г) 2 2 Cl-
Уравнение реакций в растворе Для реакций, протекающих в растворе, составляют два вида уравнений: Молекулярное ионное: • Молекулярные • Ионные Na 2 CO 3 + 2 HCl = 2 Na. Cl + CO 2(г)+ Hи 2 O в которых формула твердых Ba. Cl 2 + H 2 SO 4 газообразных 4(T) + 2 HCl = Ba. SO веществ и слабых Полное ионное: 2 Na+ + CO 32 - + электролитов не изменяются, а сильные, + хорошо = 2 Na+ + 2 Cl-+CO - растворимые электролиты O 2 H записываются в виде ионов. 2(г) + H 2 + 2 Cl Краткое ионное: Ba 2+ + 2 Cl-CO 2 -++ 2 H+4= =Ba. SO 4(T) + 2 H+ + + 2 H + SO 2 - CO + H O 3 2(г) 2 2 Cl-
 Способы получения солей 9) Разложение кислых соль 7) Соль + гидрооксид (к-та) 5) Оксид + гидрооксид (к-та) 3) Активный металл +солей 1) Из простых веществ: t= = S SO 2 + 2 Na. OH K 2 Na 2 SO 3+Al 2 O +H 2 K+S 3 Ca +t 2 Al. Cl 3=3 Ca. Cl 2 O + CO Ca. CO 3 + 2 = = Ca. Cl 2 CO 2 Ca(HCO 3)2 HCl. Ca. CO 3 +t + H 2 O 2 2 Na+S+2 O 2 = Na 2 H 2 4 Ba. O + H 2 SO 4 = Ba. SO 4 + SOO 8) Соль + солькислота 6) Гидроксид + гидроксид 4) Оксид + оксид 2) Металл + Ba. Cl 2 SO++HNO=Ag. Cl+Ba(NO 2 O Na. OH 2+ HNa 23 O = Zn. SO 43+ H 23)2 +2 Ag. NO 4 = Na. NO 4+ H Zn SO 3 Na 2 SO 2 Zn(OH) +(SO = 3 = + NO ) Cu+2 HNO 3(K)=Cu(NO=)2(SO 4)32 +4 H 24] K 2 Al 24 + +2 3 SO 3 4)3 Al 2 K 2[Zn(OH) O SO O 3 Al 2 2 KOH 2 KAl(SO 2
Способы получения солей 9) Разложение кислых соль 7) Соль + гидрооксид (к-та) 5) Оксид + гидрооксид (к-та) 3) Активный металл +солей 1) Из простых веществ: t= = S SO 2 + 2 Na. OH K 2 Na 2 SO 3+Al 2 O +H 2 K+S 3 Ca +t 2 Al. Cl 3=3 Ca. Cl 2 O + CO Ca. CO 3 + 2 = = Ca. Cl 2 CO 2 Ca(HCO 3)2 HCl. Ca. CO 3 +t + H 2 O 2 2 Na+S+2 O 2 = Na 2 H 2 4 Ba. O + H 2 SO 4 = Ba. SO 4 + SOO 8) Соль + солькислота 6) Гидроксид + гидроксид 4) Оксид + оксид 2) Металл + Ba. Cl 2 SO++HNO=Ag. Cl+Ba(NO 2 O Na. OH 2+ HNa 23 O = Zn. SO 43+ H 23)2 +2 Ag. NO 4 = Na. NO 4+ H Zn SO 3 Na 2 SO 2 Zn(OH) +(SO = 3 = + NO ) Cu+2 HNO 3(K)=Cu(NO=)2(SO 4)32 +4 H 24] K 2 Al 24 + +2 3 SO 3 4)3 Al 2 K 2[Zn(OH) O SO O 3 Al 2 2 KOH 2 KAl(SO 2
 Конец Лекции
Конец Лекции
