Апоптоз 2-2014.ppt
- Количество слайдов: 38
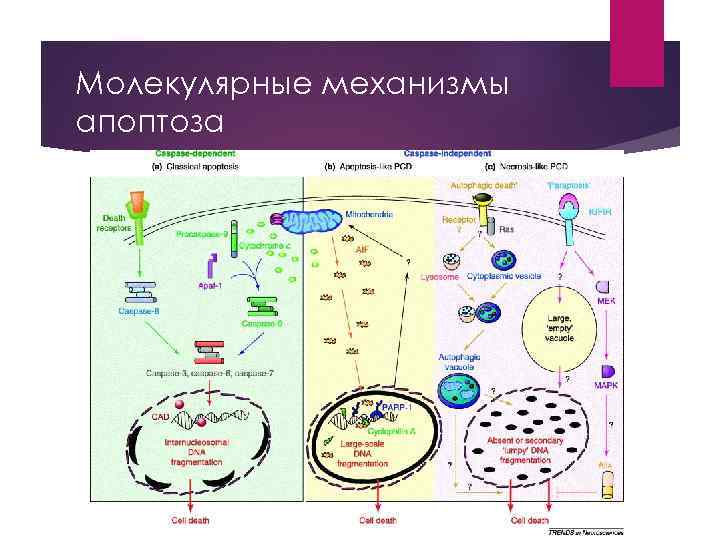 Молекулярные механизмы апоптоза
Молекулярные механизмы апоптоза
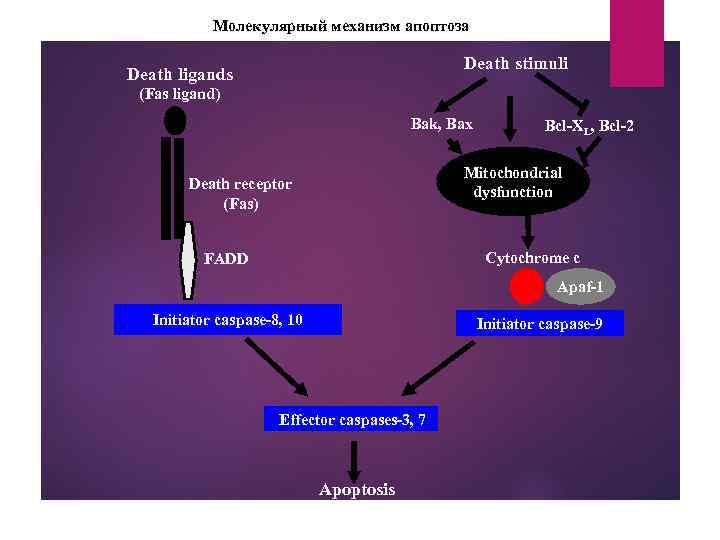 Молекулярный механизм апоптоза Death stimuli Death ligands (Fas ligand) Bak, Bax Bcl-XL, Bcl-2 Mitochondrial dysfunction Death receptor (Fas) Cytochrome c FADD Apaf-1 Initiator caspase-8, 10 Initiator caspase-9 Effector caspases-3, 7 Apoptosis
Молекулярный механизм апоптоза Death stimuli Death ligands (Fas ligand) Bak, Bax Bcl-XL, Bcl-2 Mitochondrial dysfunction Death receptor (Fas) Cytochrome c FADD Apaf-1 Initiator caspase-8, 10 Initiator caspase-9 Effector caspases-3, 7 Apoptosis
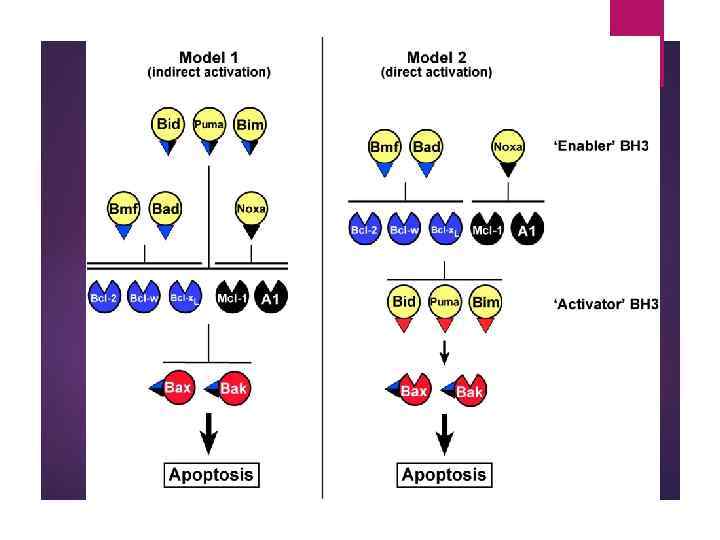
 Mammalian Bcl-2 family members Pro-apoptotic: Bax, Bak, Bok/Mtd, Bcl-Xs, «bcl-2 -активаторы» Bcl-GL, Bad, Bik/Nbk, Blk, Hrk/DP 5, Bim/Bod, Bmf, Nip 3/BNIP 3, Nix/Bnip 3 L, Noxa/APR, PUMA, MAP-1, Bcl-Gs Anti-apoptotic: Bcl-2, Bcl-XL, Bcl-w, Mcl-1, «bcl-2 -ингибиторы» A 1/Bfl-1, Boo/Diva, Bcl-B/Bcl-2 L-10/Nrh
Mammalian Bcl-2 family members Pro-apoptotic: Bax, Bak, Bok/Mtd, Bcl-Xs, «bcl-2 -активаторы» Bcl-GL, Bad, Bik/Nbk, Blk, Hrk/DP 5, Bim/Bod, Bmf, Nip 3/BNIP 3, Nix/Bnip 3 L, Noxa/APR, PUMA, MAP-1, Bcl-Gs Anti-apoptotic: Bcl-2, Bcl-XL, Bcl-w, Mcl-1, «bcl-2 -ингибиторы» A 1/Bfl-1, Boo/Diva, Bcl-B/Bcl-2 L-10/Nrh
 Про-апоптотические белки млекопитающих семейства Bcl-2
Про-апоптотические белки млекопитающих семейства Bcl-2
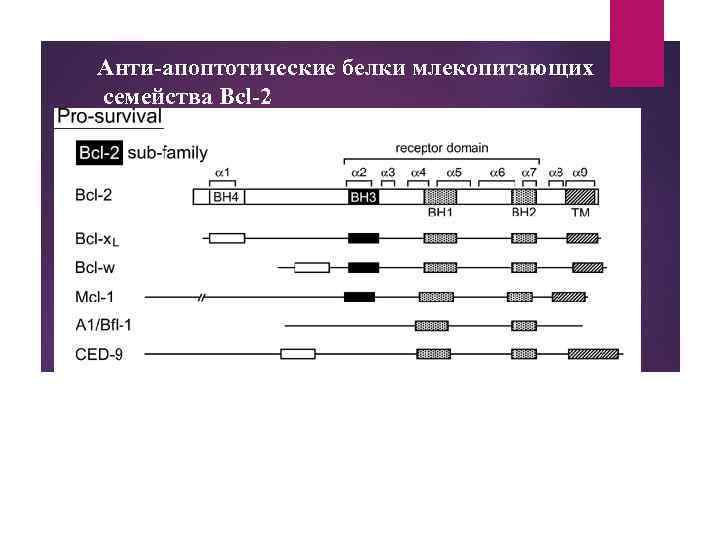 Анти-апоптотические белки млекопитающих семейства Bcl-2
Анти-апоптотические белки млекопитающих семейства Bcl-2
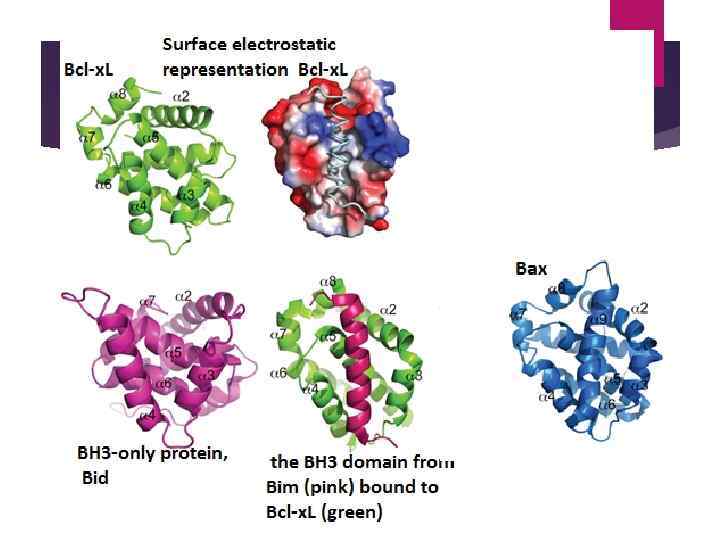
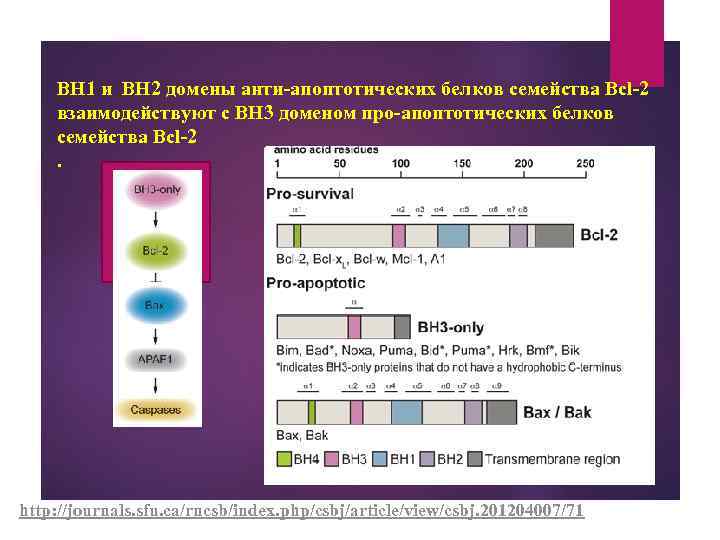 BH 1 и BH 2 домены анти-апоптотических белков семейства Bcl-2 взаимодействуют с BH 3 доменом про-апоптотических белков семейства Bcl-2. http: //journals. sfu. ca/rncsb/index. php/csbj/article/view/csbj. 201204007/71
BH 1 и BH 2 домены анти-апоптотических белков семейства Bcl-2 взаимодействуют с BH 3 доменом про-апоптотических белков семейства Bcl-2. http: //journals. sfu. ca/rncsb/index. php/csbj/article/view/csbj. 201204007/71
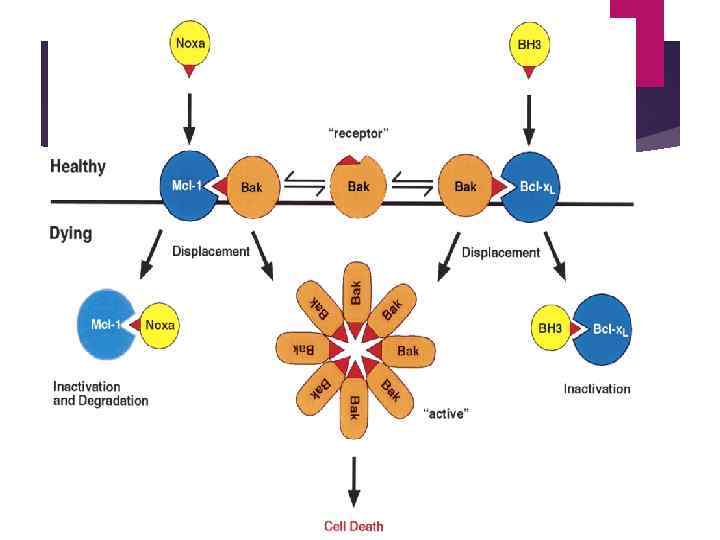
 Белки семейства bcl-2 формируют как гомо- так и гетеродимеры. bcl-2 -ингибиторы могут образовать димеры с bcl 2 -активаторами. bcl-2 взаимодействует с bax; при преобладании первого жизнеспособность клетки повышается, при избытке второго – уменьшается
Белки семейства bcl-2 формируют как гомо- так и гетеродимеры. bcl-2 -ингибиторы могут образовать димеры с bcl 2 -активаторами. bcl-2 взаимодействует с bax; при преобладании первого жизнеспособность клетки повышается, при избытке второго – уменьшается
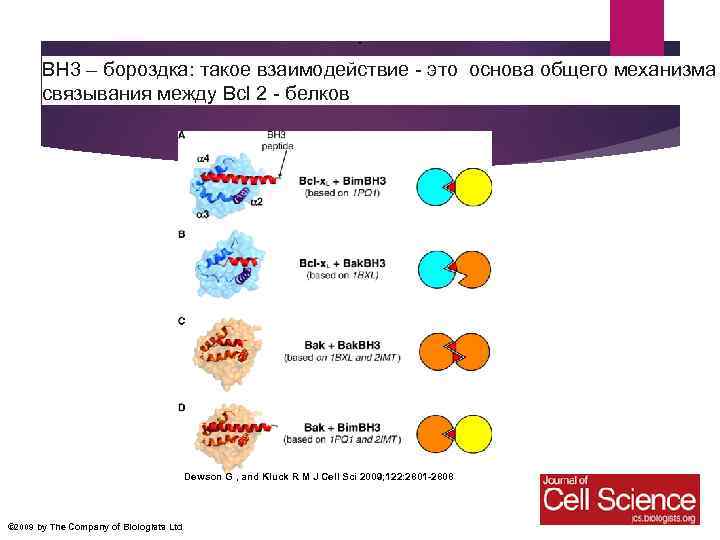 . ВН 3 – бороздка: такое взаимодействие - это основа общего механизма связывания между Bcl 2 - белков Dewson G , and Kluck R M J Cell Sci 2009; 122: 2801 -2808 © 2009 by The Company of Biologists Ltd
. ВН 3 – бороздка: такое взаимодействие - это основа общего механизма связывания между Bcl 2 - белков Dewson G , and Kluck R M J Cell Sci 2009; 122: 2801 -2808 © 2009 by The Company of Biologists Ltd
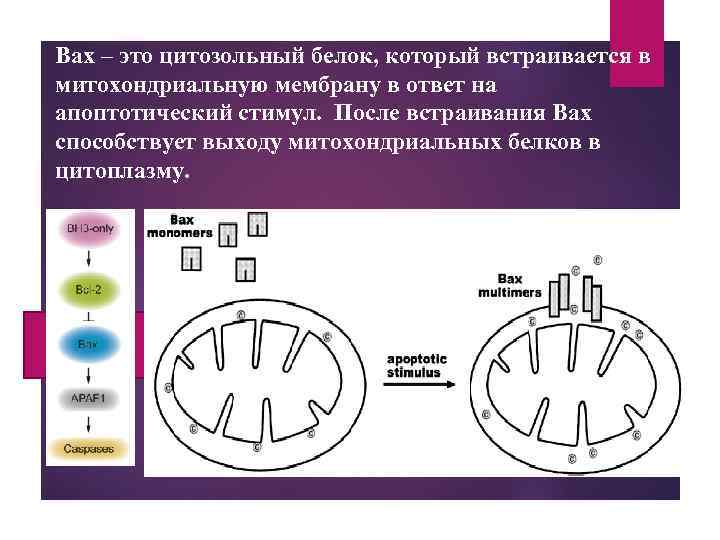 Bax – это цитозольный белок, который встраивается в митохондриальную мембрану в ответ на апоптотический стимул. После встраивания Bax способствует выходу митохондриальных белков в цитоплазму.
Bax – это цитозольный белок, который встраивается в митохондриальную мембрану в ответ на апоптотический стимул. После встраивания Bax способствует выходу митохондриальных белков в цитоплазму.
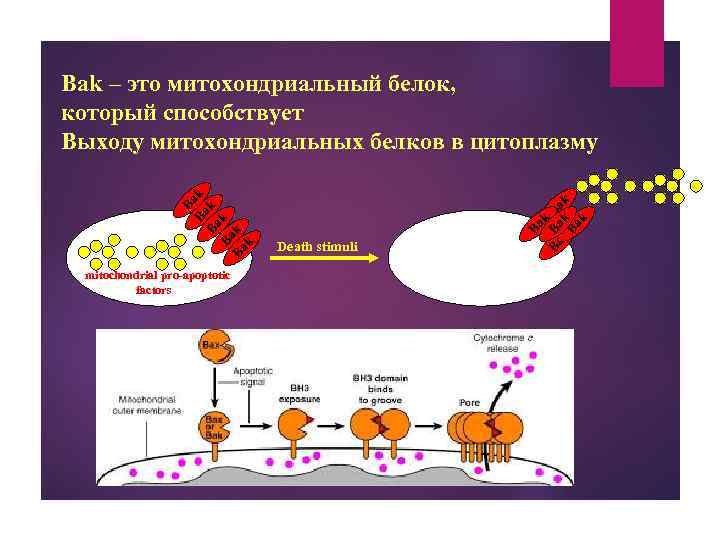 mitochondrial pro-apoptotic factors Death stimuli Ba k Ba Ba Ba k. B k k ak B Ba ak Ba k k Bak – это митохондриальный белок, который способствует Выходу митохондриальных белков в цитоплазму
mitochondrial pro-apoptotic factors Death stimuli Ba k Ba Ba Ba k. B k k ak B Ba ak Ba k k Bak – это митохондриальный белок, который способствует Выходу митохондриальных белков в цитоплазму
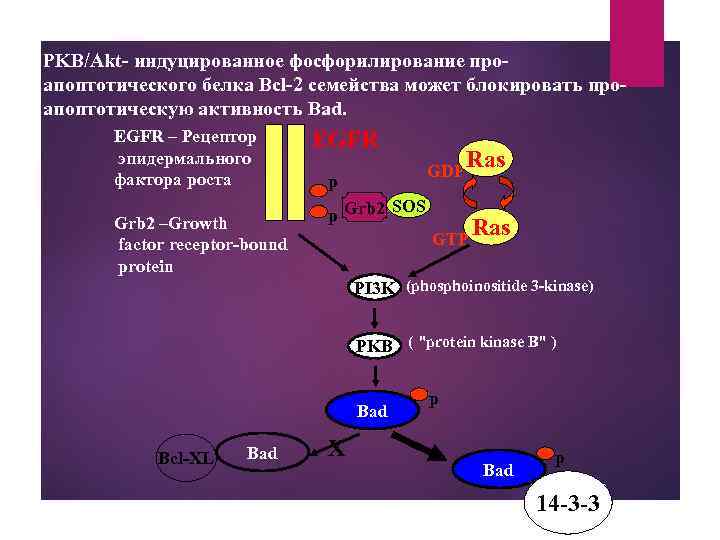 PKB/Akt- индуцированное фосфорилирование про- апоптотического белка Bcl-2 семейства может блокировать проапоптотическую активность Bad. EGFR – Рецептор эпидермального фактора роста Grb 2 –Growth factor receptor-bound protein EGFR GDP p Ras SOS p Grb 2 GTP Ras PI 3 K (phosphoinositide 3 -kinase) PKB ( "protein kinase B" ) Bad Bcl-XL Bad X p Bad p 14 -3 -3
PKB/Akt- индуцированное фосфорилирование про- апоптотического белка Bcl-2 семейства может блокировать проапоптотическую активность Bad. EGFR – Рецептор эпидермального фактора роста Grb 2 –Growth factor receptor-bound protein EGFR GDP p Ras SOS p Grb 2 GTP Ras PI 3 K (phosphoinositide 3 -kinase) PKB ( "protein kinase B" ) Bad Bcl-XL Bad X p Bad p 14 -3 -3
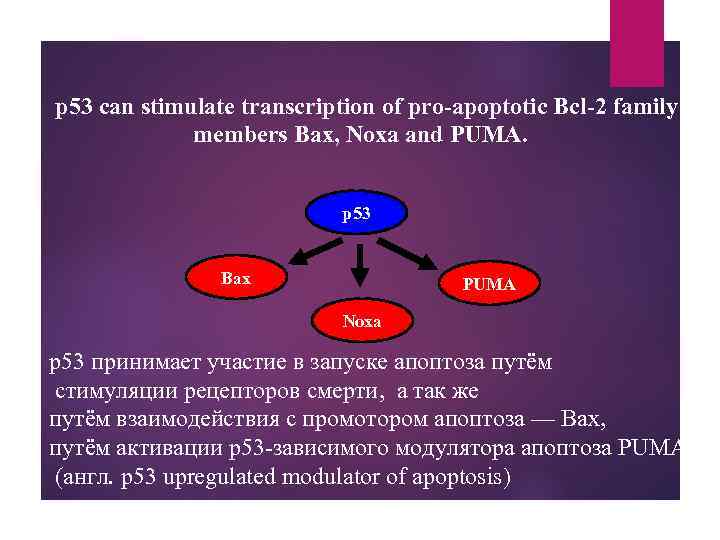 p 53 can stimulate transcription of pro-apoptotic Bcl-2 family members Bax, Noxa and PUMA. p 53 Bax PUMA Noxa p 53 принимает участие в запуске апоптоза путём стимуляции рецепторов смерти, а так же путём взаимодействия с промотором апоптоза — Bax, путём активации p 53 -зависимого модулятора апоптоза PUMA (англ. p 53 upregulated modulator of apoptosis)
p 53 can stimulate transcription of pro-apoptotic Bcl-2 family members Bax, Noxa and PUMA. p 53 Bax PUMA Noxa p 53 принимает участие в запуске апоптоза путём стимуляции рецепторов смерти, а так же путём взаимодействия с промотором апоптоза — Bax, путём активации p 53 -зависимого модулятора апоптоза PUMA (англ. p 53 upregulated modulator of apoptosis)
 Альтернативный сплайсинг Bcl-X m. RNA может увеличить количество анти-апоптотического белка Bcl-XL или про-апоптотичемского Bcl-XS. BH 4 BH 3 BH 1 BH 2 TM Bcl-XL anti-apoptotic BH 4 BH 3 pro-apoptotic TM Bcl-Xs
Альтернативный сплайсинг Bcl-X m. RNA может увеличить количество анти-апоптотического белка Bcl-XL или про-апоптотичемского Bcl-XS. BH 4 BH 3 BH 1 BH 2 TM Bcl-XL anti-apoptotic BH 4 BH 3 pro-apoptotic TM Bcl-Xs
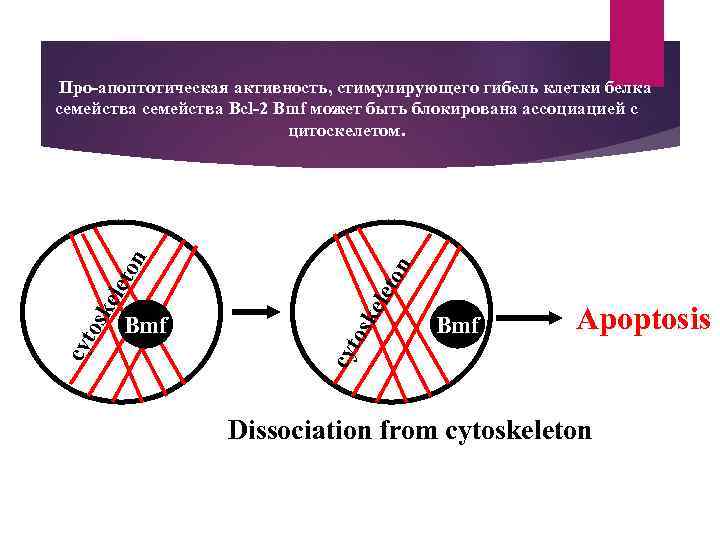 ton ele osk Bmf Apoptosis cyt osk ele ton Про-апоптотическая активность, стимулирующего гибель клетки белка семейства Bcl-2 Bmf может быть блокирована ассоциацией с цитоскелетом. Dissociation from cytoskeleton
ton ele osk Bmf Apoptosis cyt osk ele ton Про-апоптотическая активность, стимулирующего гибель клетки белка семейства Bcl-2 Bmf может быть блокирована ассоциацией с цитоскелетом. Dissociation from cytoskeleton
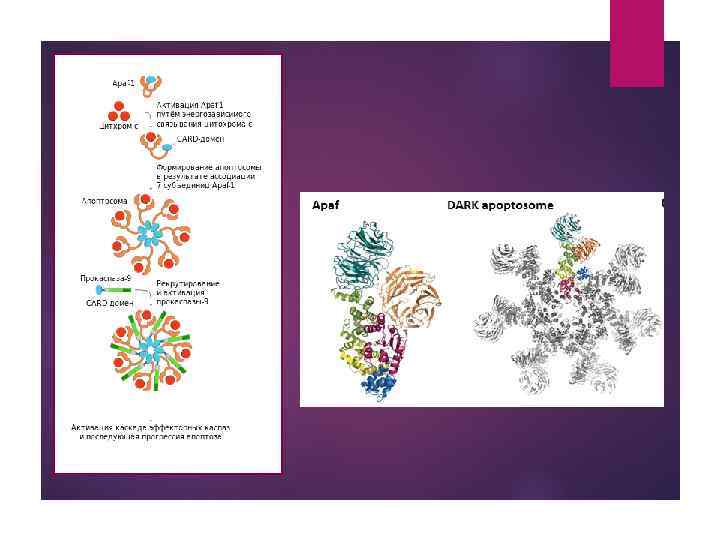
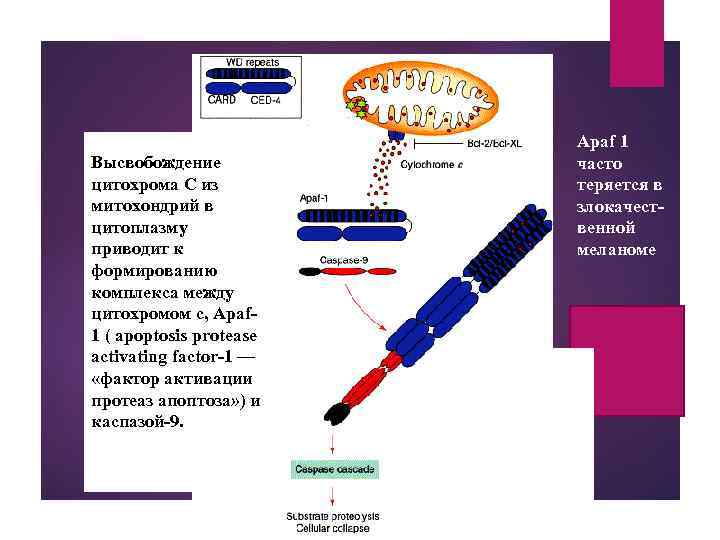 Высвобождение цитохрома С из митохондрий в цитоплазму приводит к формированию комплекса между цитохромом с, Apaf 1 ( apoptosis protease activating factor-1 — «фактор активации протеаз апоптоза» ) и каспазой-9. Apaf 1 часто теряется в злокачественной меланоме
Высвобождение цитохрома С из митохондрий в цитоплазму приводит к формированию комплекса между цитохромом с, Apaf 1 ( apoptosis protease activating factor-1 — «фактор активации протеаз апоптоза» ) и каспазой-9. Apaf 1 часто теряется в злокачественной меланоме
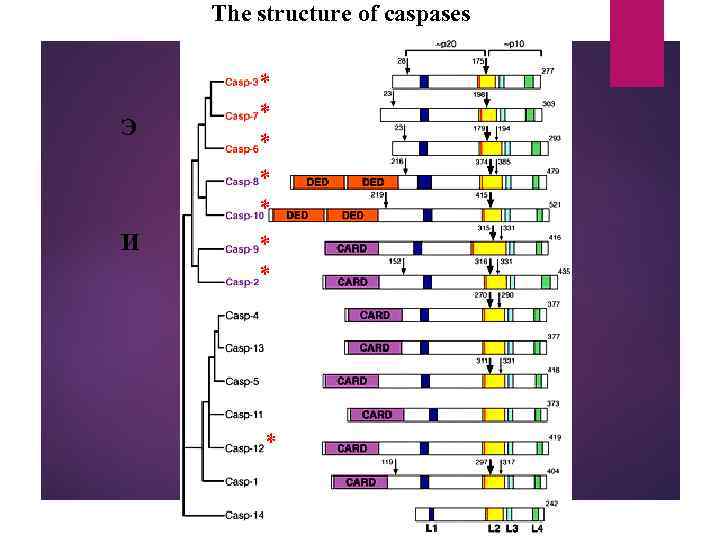 The structure of caspases Э И * * * *
The structure of caspases Э И * * * *
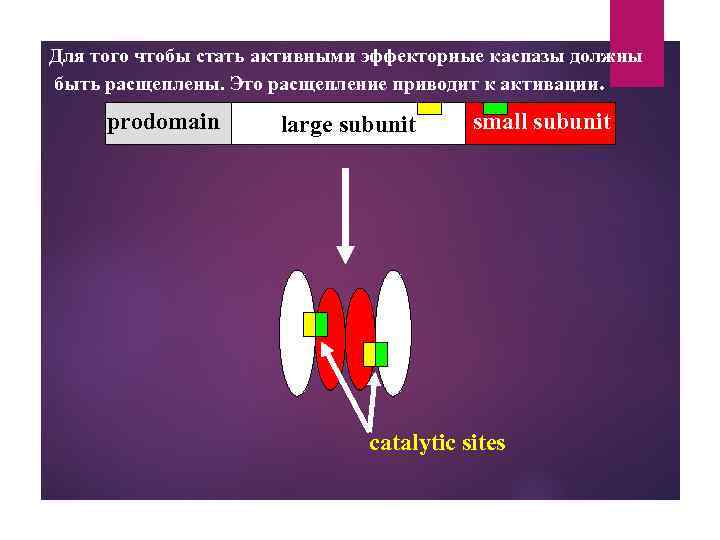 Для того чтобы стать активными эффекторные каспазы должны быть расщеплены. Это расщепление приводит к активации. prodomain large subunit small subunit catalytic sites
Для того чтобы стать активными эффекторные каспазы должны быть расщеплены. Это расщепление приводит к активации. prodomain large subunit small subunit catalytic sites
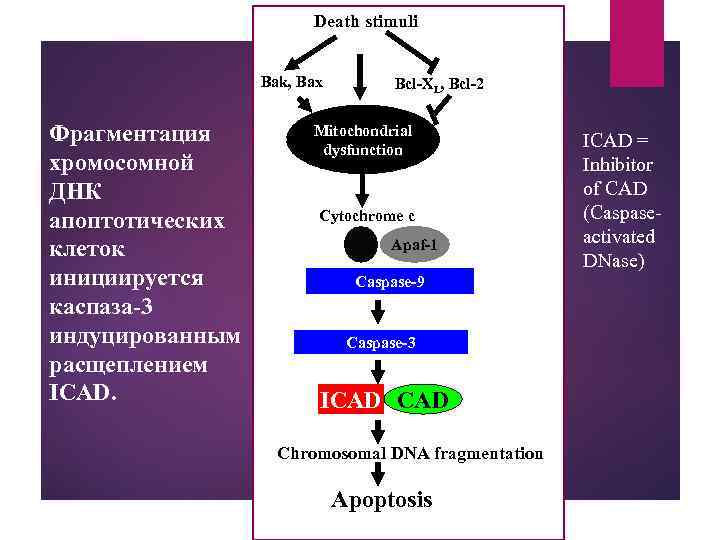 Death stimuli Bak, Bax Фрагментация хромосомной ДНК апоптотических клеток инициируется каспаза-3 индуцированным расщеплением ICAD. Bcl-XL, Bcl-2 Mitochondrial dysfunction Cytochrome c Apaf-1 Caspase-9 Caspase-3 ICAD Chromosomal DNA fragmentation Apoptosis ICAD = Inhibitor of CAD (Caspaseactivated DNase)
Death stimuli Bak, Bax Фрагментация хромосомной ДНК апоптотических клеток инициируется каспаза-3 индуцированным расщеплением ICAD. Bcl-XL, Bcl-2 Mitochondrial dysfunction Cytochrome c Apaf-1 Caspase-9 Caspase-3 ICAD Chromosomal DNA fragmentation Apoptosis ICAD = Inhibitor of CAD (Caspaseactivated DNase)
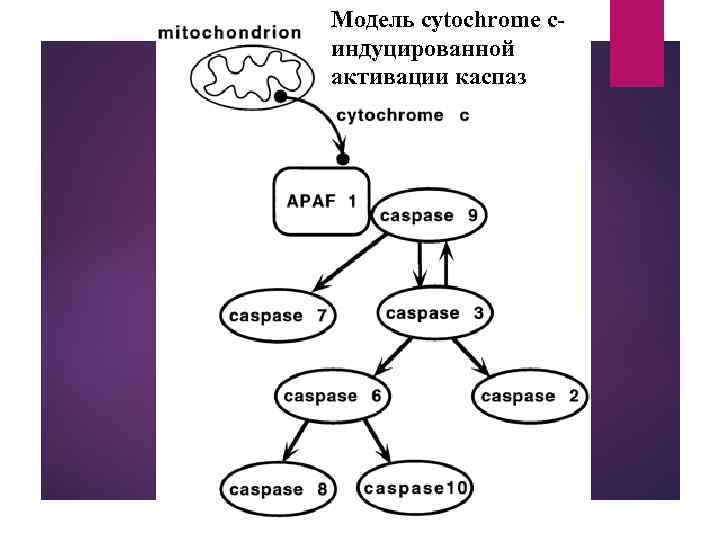 Модель cytochrome cиндуцированной активации каспаз
Модель cytochrome cиндуцированной активации каспаз
 Фенотипы нокаутных по генам каспаз мышей. Каспазы - 3 - Эмбриональная летальность. Избыток нервных клеток. Каспазы - 6 – жизнеспособны. Каспазы- 9 (и Apaf - 1 ) – Эмбриональная летальность. Тяжелые морфологические аномалии в ЦНС из-за избытка нервных клеток.
Фенотипы нокаутных по генам каспаз мышей. Каспазы - 3 - Эмбриональная летальность. Избыток нервных клеток. Каспазы - 6 – жизнеспособны. Каспазы- 9 (и Apaf - 1 ) – Эмбриональная летальность. Тяжелые морфологические аномалии в ЦНС из-за избытка нервных клеток.
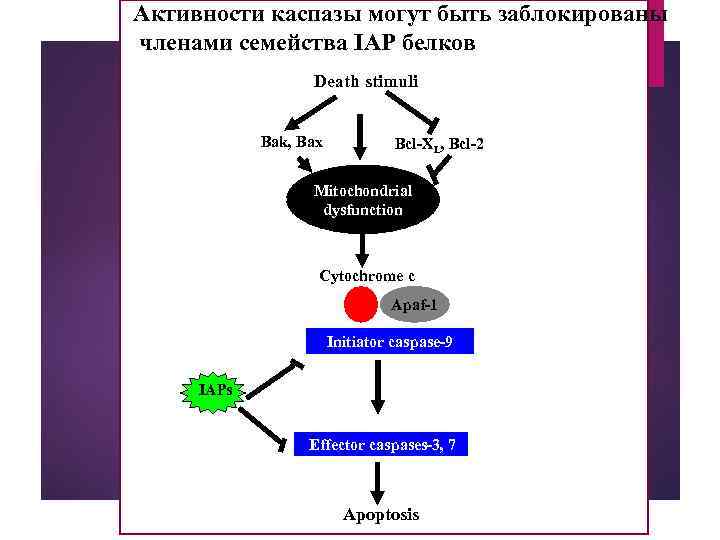 Активности каспазы могут быть заблокированы членами семейства IAP белков Death stimuli Bak, Bax Bcl-XL, Bcl-2 Mitochondrial dysfunction Cytochrome c Apaf-1 Initiator caspase-9 IAPs Effector caspases-3, 7 Apoptosis
Активности каспазы могут быть заблокированы членами семейства IAP белков Death stimuli Bak, Bax Bcl-XL, Bcl-2 Mitochondrial dysfunction Cytochrome c Apaf-1 Initiator caspase-9 IAPs Effector caspases-3, 7 Apoptosis
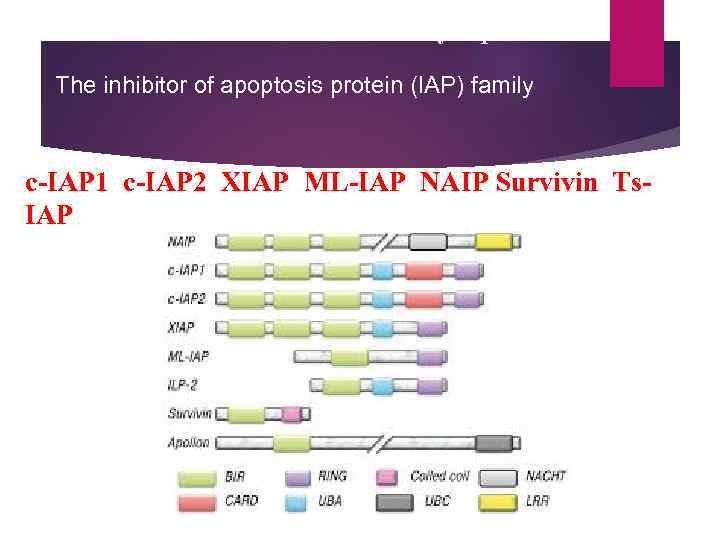 Members of the IAP family of proteins The inhibitor of apoptosis protein (IAP) family c-IAP 1 c-IAP 2 XIAP ML-IAP NAIP Survivin Ts. IAP
Members of the IAP family of proteins The inhibitor of apoptosis protein (IAP) family c-IAP 1 c-IAP 2 XIAP ML-IAP NAIP Survivin Ts. IAP
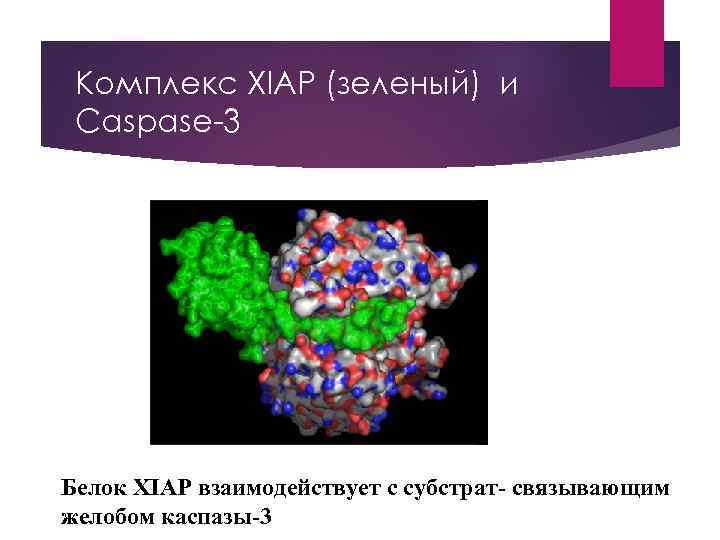 Комплекс XIAP (зеленый) и Caspase-3 Белок XIAP взаимодействует с субстрат- связывающим желобом каспазы-3
Комплекс XIAP (зеленый) и Caspase-3 Белок XIAP взаимодействует с субстрат- связывающим желобом каспазы-3
 Экспрессия Survivin увеличивается во многих злокачественных опухолях человека. Хромосомный регион, который содержит гены c. IAP 1 и c. IAP 2 амплифицируется в раке мозга, почек и раке желудка. Уровни c. IAP 2 и XIAP часто увеличивается в колоректальном раке , раке легких и простаты.
Экспрессия Survivin увеличивается во многих злокачественных опухолях человека. Хромосомный регион, который содержит гены c. IAP 1 и c. IAP 2 амплифицируется в раке мозга, почек и раке желудка. Уровни c. IAP 2 и XIAP часто увеличивается в колоректальном раке , раке легких и простаты.
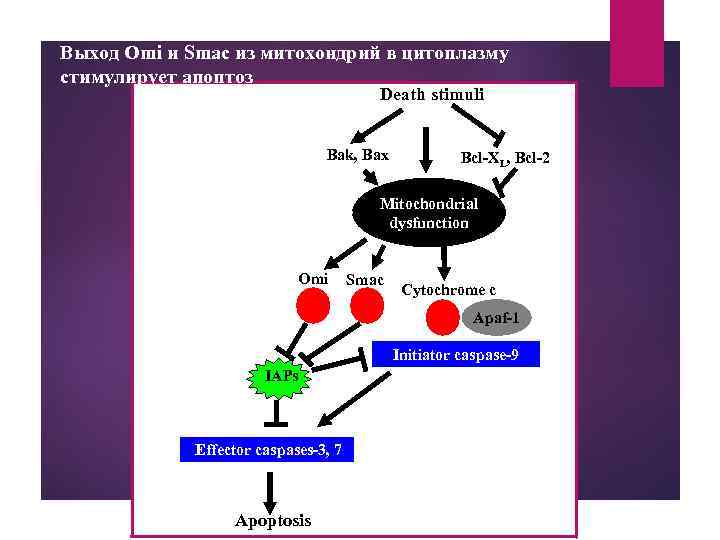 Выход Omi и Smac из митохондрий в цитоплазму стимулирует апоптоз Death stimuli Bak, Bax Bcl-XL, Bcl-2 Mitochondrial dysfunction Omi Smac Cytochrome c Apaf-1 Initiator caspase-9 IAPs Effector caspases-3, 7 Apoptosis
Выход Omi и Smac из митохондрий в цитоплазму стимулирует апоптоз Death stimuli Bak, Bax Bcl-XL, Bcl-2 Mitochondrial dysfunction Omi Smac Cytochrome c Apaf-1 Initiator caspase-9 IAPs Effector caspases-3, 7 Apoptosis
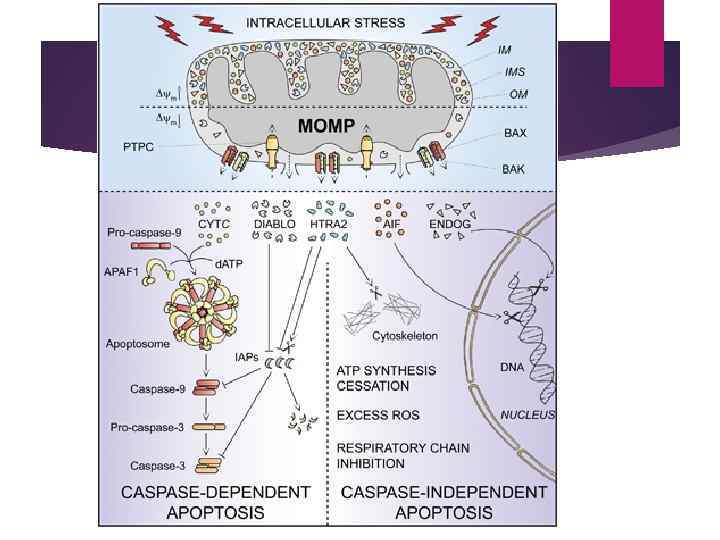
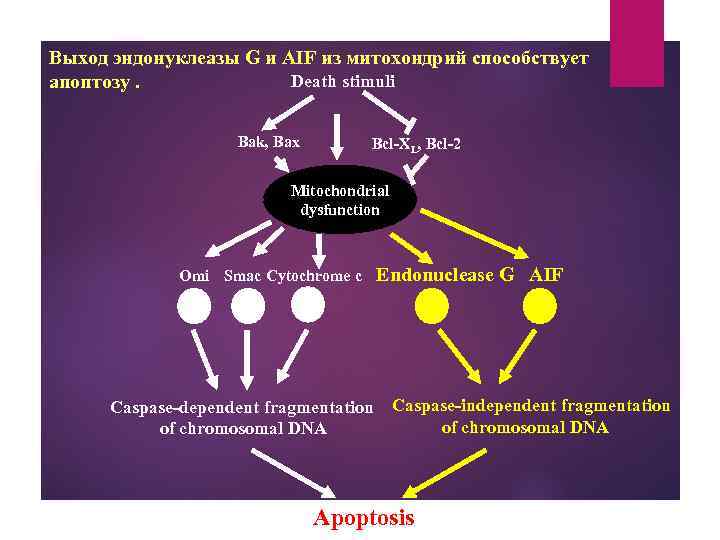 Выход эндонуклеазы G и AIF из митохондрий способствует Death stimuli апоптозу. Bak, Bax Bcl-XL, Bcl-2 Mitochondrial dysfunction Omi Smac Cytochrome c Caspase-dependent fragmentation of chromosomal DNA Endonuclease G AIF Caspase-independent fragmentation of chromosomal DNA Apoptosis
Выход эндонуклеазы G и AIF из митохондрий способствует Death stimuli апоптозу. Bak, Bax Bcl-XL, Bcl-2 Mitochondrial dysfunction Omi Smac Cytochrome c Caspase-dependent fragmentation of chromosomal DNA Endonuclease G AIF Caspase-independent fragmentation of chromosomal DNA Apoptosis
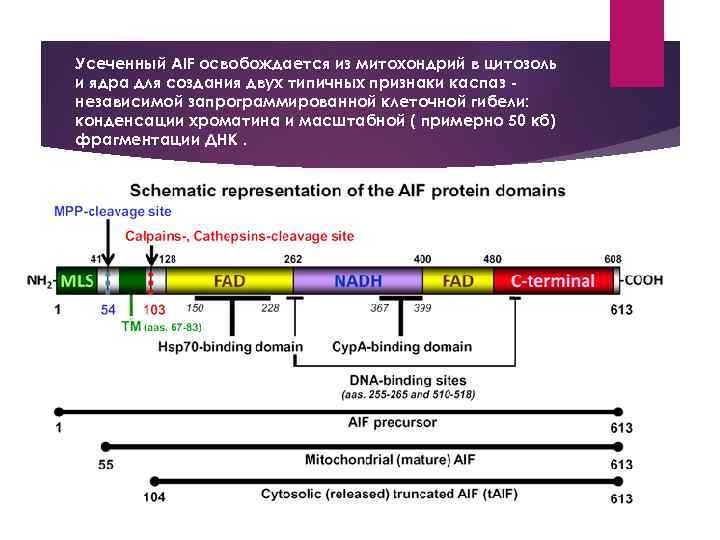 Усеченный AIF освобождается из митохондрий в цитозоль и ядра для создания двух типичных признаки каспаз независимой запрограммированной клеточной гибели: конденсации хроматина и масштабной ( примерно 50 кб) фрагментации ДНК.
Усеченный AIF освобождается из митохондрий в цитозоль и ядра для создания двух типичных признаки каспаз независимой запрограммированной клеточной гибели: конденсации хроматина и масштабной ( примерно 50 кб) фрагментации ДНК.
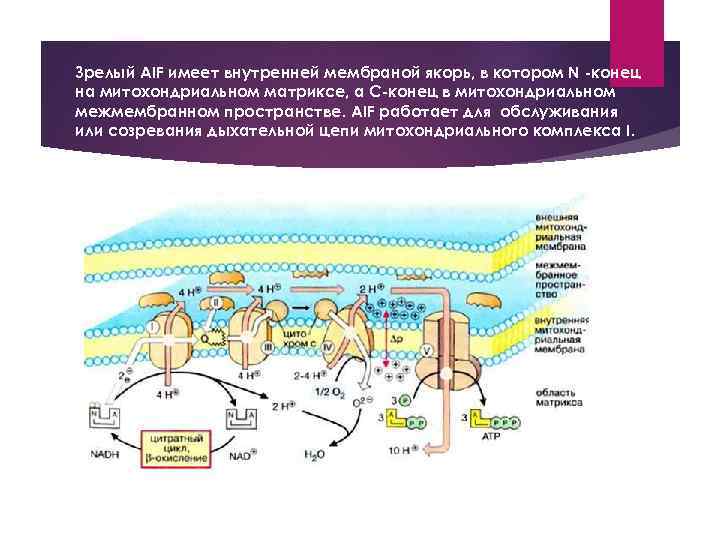 Зрелый AIF имеет внутренней мембраной якорь, в котором N -конец на митохондриальном матриксе, а С-конец в митохондриальном межмембранном пространстве. AIF работает для обслуживания или созревания дыхательной цепи митохондриального комплекса I.
Зрелый AIF имеет внутренней мембраной якорь, в котором N -конец на митохондриальном матриксе, а С-конец в митохондриальном межмембранном пространстве. AIF работает для обслуживания или созревания дыхательной цепи митохондриального комплекса I.
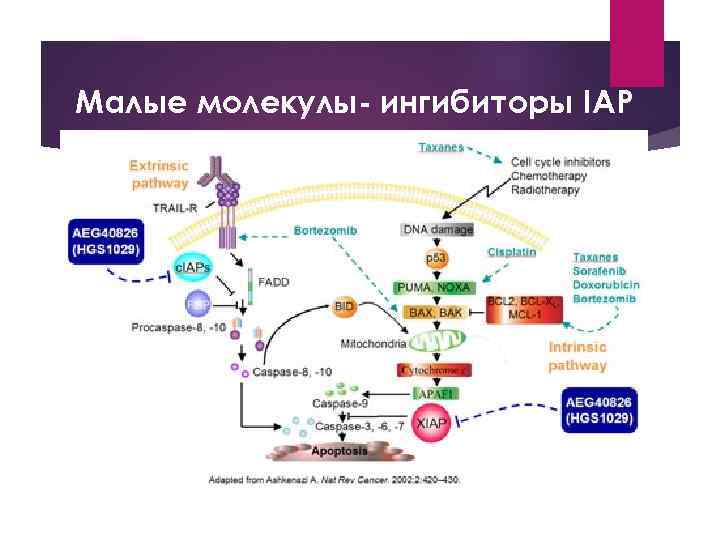 Малые молекулы- ингибиторы IAP
Малые молекулы- ингибиторы IAP
 Индукторы апоптоза Физиологические активаторы: цитокины группы TNF(Fas. L, TNF и др. ) Глюкокортикоиды Отсутствие фактора роста Защитные: р53
Индукторы апоптоза Физиологические активаторы: цитокины группы TNF(Fas. L, TNF и др. ) Глюкокортикоиды Отсутствие фактора роста Защитные: р53
 Ингибиторы апоптоза Физиологические ингибиторы ростовые факторы (IL-2, IL-3) гормоны (андрогены, эстрогены) регуляторные белки (bcl-2) Чужеродные ингибиторы продукты трансляции вирусов (аденовирусный E 1 B 19 K, Эпштейн-Барр-вирусный BHRF 1) ингибиторы каспазной активности недостаток кислорода (в кардиомиоцитах) ингибиторы энергетики митохондрий стабилизаторы митохондриальной мембраны
Ингибиторы апоптоза Физиологические ингибиторы ростовые факторы (IL-2, IL-3) гормоны (андрогены, эстрогены) регуляторные белки (bcl-2) Чужеродные ингибиторы продукты трансляции вирусов (аденовирусный E 1 B 19 K, Эпштейн-Барр-вирусный BHRF 1) ингибиторы каспазной активности недостаток кислорода (в кардиомиоцитах) ингибиторы энергетики митохондрий стабилизаторы митохондриальной мембраны
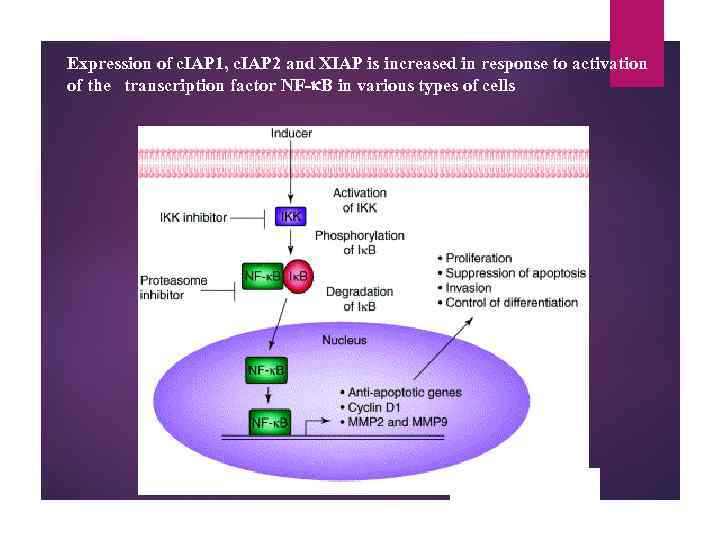 Expression of c. IAP 1, c. IAP 2 and XIAP is increased in response to activation of the transcription factor NF-k. B in various types of cells
Expression of c. IAP 1, c. IAP 2 and XIAP is increased in response to activation of the transcription factor NF-k. B in various types of cells
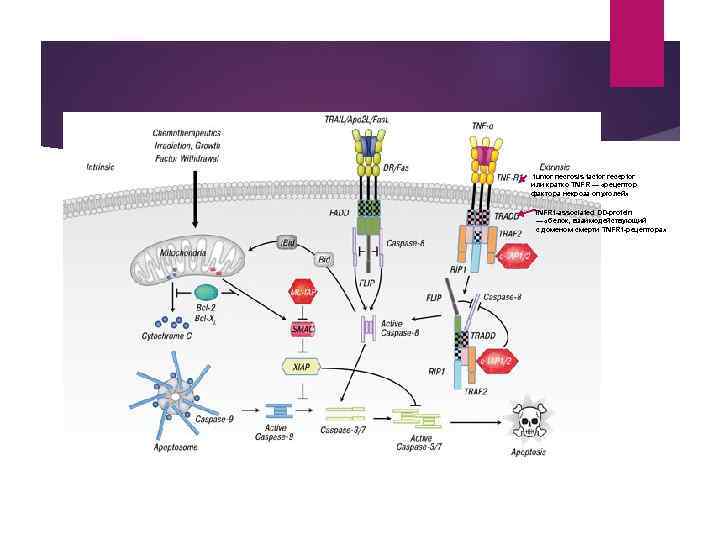 tumor necrosis factor receptor или кратко TNFR — «рецептор фактора некроза опухолей» TNFR 1 -associated DD-protein — «белок, взаимодействующий с доменом смерти TNFR 1 -рецептора»
tumor necrosis factor receptor или кратко TNFR — «рецептор фактора некроза опухолей» TNFR 1 -associated DD-protein — «белок, взаимодействующий с доменом смерти TNFR 1 -рецептора»
