молекулярно-генетические методы.ppt
- Количество слайдов: 35
 Молекулярно-генетические методы диагностики
Молекулярно-генетические методы диагностики
 К молекулярно-генетическим методам диагностики относят qамплификационные технологии, qгибридизационный анализ нуклеиновых кислот, q секвенирование ДНК, qметоды ДНК-чипов q оптические сенсоры.
К молекулярно-генетическим методам диагностики относят qамплификационные технологии, qгибридизационный анализ нуклеиновых кислот, q секвенирование ДНК, qметоды ДНК-чипов q оптические сенсоры.
 Области применения генетических технологий • • • • Диагностика заболеваний, Мониторинг лечения Трансплантация органов и тканей Идентификация животных (сельское хозяйство) Идентификация личности (судебно-медицинская экспертиза) Палеонтология (палео. ДНК), археология- ископаемые животные и растения, миграции вымерших видов. Идентификация бактерий, вирусов Обнаружение патогенов в продуктах и окружающей среде Определение мутаций вирусов и бактерий Определение резистентности к лекарственным препаратам Контроль фармацевтических производств Контроль качества вакцинных препаратов Обнаружение трансгенов в продуктах питания
Области применения генетических технологий • • • • Диагностика заболеваний, Мониторинг лечения Трансплантация органов и тканей Идентификация животных (сельское хозяйство) Идентификация личности (судебно-медицинская экспертиза) Палеонтология (палео. ДНК), археология- ископаемые животные и растения, миграции вымерших видов. Идентификация бактерий, вирусов Обнаружение патогенов в продуктах и окружающей среде Определение мутаций вирусов и бактерий Определение резистентности к лекарственным препаратам Контроль фармацевтических производств Контроль качества вакцинных препаратов Обнаружение трансгенов в продуктах питания
 • • • Амплификация (лат. amplificatio — усиление, увеличение), в молекулярной биологии — увеличение числа копий ДНК. В клетке амплификация происходит в результате репликации ДНК, в искусственных условиях увеличения числа копий ДНК добиваются с помощью полимеразной цепной реакции. Денатурация ДНК — переход ДНК из двунитевой формы в однонитевую при разрыве водородных связей между комплементарными парами оснований под воздействием высоких температур. Ренатурация или гибридизация — восстановление двухцепочечной структуры нуклеиновых кислот по принципу комплементарности. ДНК-полимераза — фермент, обеспечивающий репликацию путем последовательного присоединении нуклеотидов к растущей цепи ДНК в направлении 5' → 3'; не способна инициировать процесс репликации, лишь добавляет нуклеотиды к уже имеющемуся небольшому двунитевому участку - праймеру (затравке). Праймер — короткая олиго- или полинуклеотидная последовательность со свободной З’ОН-группой. Рестриктазы — группа ферментов (известно около 500 бактериальных рестриктаз) класса гидролаз, катализирующих гидролиз нуклеиновых кислот. В отличие от экзонуклеаз, рестриктазы расщепляют нуклеиновые кислоты не с конца молекулы, а в середине. При этом каждая рестриктаза узнаёт специфическую последовательность из 4 -6, реже 8 -12 нуклеотидов в двухцепочечной молекуле ДНК (сайты рестрикции) и "разрезает" её в местах локализации этих последовательностей внутри участка узнавания или вне его.
• • • Амплификация (лат. amplificatio — усиление, увеличение), в молекулярной биологии — увеличение числа копий ДНК. В клетке амплификация происходит в результате репликации ДНК, в искусственных условиях увеличения числа копий ДНК добиваются с помощью полимеразной цепной реакции. Денатурация ДНК — переход ДНК из двунитевой формы в однонитевую при разрыве водородных связей между комплементарными парами оснований под воздействием высоких температур. Ренатурация или гибридизация — восстановление двухцепочечной структуры нуклеиновых кислот по принципу комплементарности. ДНК-полимераза — фермент, обеспечивающий репликацию путем последовательного присоединении нуклеотидов к растущей цепи ДНК в направлении 5' → 3'; не способна инициировать процесс репликации, лишь добавляет нуклеотиды к уже имеющемуся небольшому двунитевому участку - праймеру (затравке). Праймер — короткая олиго- или полинуклеотидная последовательность со свободной З’ОН-группой. Рестриктазы — группа ферментов (известно около 500 бактериальных рестриктаз) класса гидролаз, катализирующих гидролиз нуклеиновых кислот. В отличие от экзонуклеаз, рестриктазы расщепляют нуклеиновые кислоты не с конца молекулы, а в середине. При этом каждая рестриктаза узнаёт специфическую последовательность из 4 -6, реже 8 -12 нуклеотидов в двухцепочечной молекуле ДНК (сайты рестрикции) и "разрезает" её в местах локализации этих последовательностей внутри участка узнавания или вне его.
 ПЦР (полимеразная цепная реакция) • Открытие Карри Мюллисом в 1983 году (США) метода полимеразной цепной реакции послужило толчком к активному развитию разнообразных технологий амплификации нуклеиновых кислот. • Кстати, термостабильную ДНК-полимеразу, необходимую для этой реакции, впервые выделили и исследовали за несколько лет до этого советские ученые А. С. Каледин, А. Г. Слюсаренко и С. И. Городецкий из института ВНИИ генетика. • Сам метод воспроизводит в искусственных условиях (in vitro) способность живых организмов к изолированному умножению гена или его фрагмента в процессе жизнедеятельности и (или) репликации.
ПЦР (полимеразная цепная реакция) • Открытие Карри Мюллисом в 1983 году (США) метода полимеразной цепной реакции послужило толчком к активному развитию разнообразных технологий амплификации нуклеиновых кислот. • Кстати, термостабильную ДНК-полимеразу, необходимую для этой реакции, впервые выделили и исследовали за несколько лет до этого советские ученые А. С. Каледин, А. Г. Слюсаренко и С. И. Городецкий из института ВНИИ генетика. • Сам метод воспроизводит в искусственных условиях (in vitro) способность живых организмов к изолированному умножению гена или его фрагмента в процессе жизнедеятельности и (или) репликации.
 Компоненты реакции Для проведения ПЦР в простейшем случае требуются следующие компоненты: • ДНК-матрица, содержащая тот участок ДНК, который требуется амплифицировать. • Два праймера, комплементарные противоположным концам разных цепей требуемого фрагмента ДНК. • Термостабильная ДНК-полимераза — фермент, который катализирует реакцию полимеризации ДНК. Полимераза для использования в ПЦР должна сохранять активность при высокой температуре длительное время, поэтому используют ферменты, выделенные из термофилов — Thermus aquaticus (Taq-полимераза), Pyrococcus furiosus (Pfuполимераза), Pyrococcus woesei (Pwo-полимераза) и другие. • Дезоксирибонуклеозидтрифосфаты (d. ATP, d. GTP, d. CTP, d. TTP). • Ионы Mg 2+, необходимые для работы полимеразы. • Буферный раствор, обеспечивающий необходимые условия реакции — р. Н, ионную силу раствора. Содержит соли, бычий сывороточный альбумин.
Компоненты реакции Для проведения ПЦР в простейшем случае требуются следующие компоненты: • ДНК-матрица, содержащая тот участок ДНК, который требуется амплифицировать. • Два праймера, комплементарные противоположным концам разных цепей требуемого фрагмента ДНК. • Термостабильная ДНК-полимераза — фермент, который катализирует реакцию полимеризации ДНК. Полимераза для использования в ПЦР должна сохранять активность при высокой температуре длительное время, поэтому используют ферменты, выделенные из термофилов — Thermus aquaticus (Taq-полимераза), Pyrococcus furiosus (Pfuполимераза), Pyrococcus woesei (Pwo-полимераза) и другие. • Дезоксирибонуклеозидтрифосфаты (d. ATP, d. GTP, d. CTP, d. TTP). • Ионы Mg 2+, необходимые для работы полимеразы. • Буферный раствор, обеспечивающий необходимые условия реакции — р. Н, ионную силу раствора. Содержит соли, бычий сывороточный альбумин.
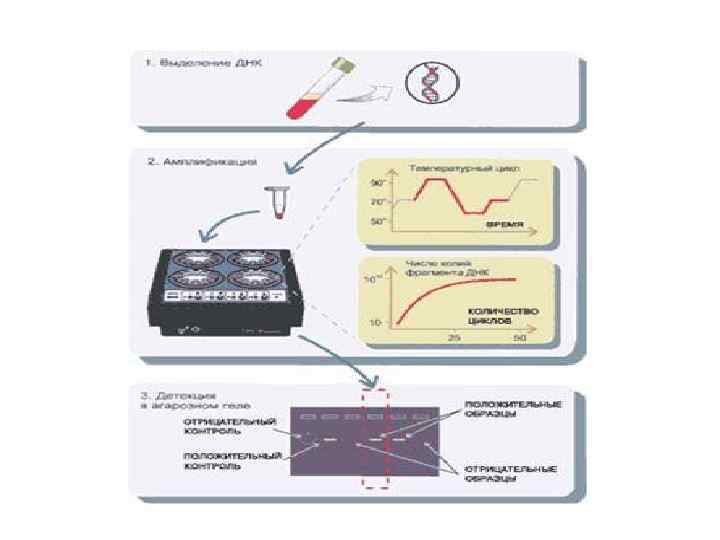
 Этапы ПЦР-исследования • • • 1. Выделение нуклеиновых кислот. На первом этапе выделяется вся ДНК (для ДНК-содержащих микроорганизмов) или РНК (для метода NASBA или РНК - содержащих вирусов) из исследуемого материала. 2. Собственно ПЦР или амплификация. В раствор, содержащий смесь нуклеотидов, ПЦР-буфер, полимеразу и праймеры добавляется ДНК, выделенная на первом этапе. ПЦР проводят следующим образом: сначала реакционную смесь нагревают до температуры 9094° С, вызывая этим денатурацию ДНК, затем температуру снижают до 50 -70° С в зависимости от нуклеотидной последовательности праймеров, чтобы отжиг происходил в строго комплементарных участках, и наконец, в смеси устанавливают температуру, оптимальную для работы ДНК-полимеразы. При повторении этих циклов количество копий участка ДНК, находящегося между местами посадки праймеров, возрастает в геометрической прогрессии. 3. Учет результатов. Накопленные продуты амплификации (большое число копий ДНК между местами посадки праймеров) можно выявить путем электрофореза в геле. Помимо этого, при использовании флуоресцентно меченых зондов, возможен учет результатов по изменению флуоресценции относительно отрицательного контроля.
Этапы ПЦР-исследования • • • 1. Выделение нуклеиновых кислот. На первом этапе выделяется вся ДНК (для ДНК-содержащих микроорганизмов) или РНК (для метода NASBA или РНК - содержащих вирусов) из исследуемого материала. 2. Собственно ПЦР или амплификация. В раствор, содержащий смесь нуклеотидов, ПЦР-буфер, полимеразу и праймеры добавляется ДНК, выделенная на первом этапе. ПЦР проводят следующим образом: сначала реакционную смесь нагревают до температуры 9094° С, вызывая этим денатурацию ДНК, затем температуру снижают до 50 -70° С в зависимости от нуклеотидной последовательности праймеров, чтобы отжиг происходил в строго комплементарных участках, и наконец, в смеси устанавливают температуру, оптимальную для работы ДНК-полимеразы. При повторении этих циклов количество копий участка ДНК, находящегося между местами посадки праймеров, возрастает в геометрической прогрессии. 3. Учет результатов. Накопленные продуты амплификации (большое число копий ДНК между местами посадки праймеров) можно выявить путем электрофореза в геле. Помимо этого, при использовании флуоресцентно меченых зондов, возможен учет результатов по изменению флуоресценции относительно отрицательного контроля.
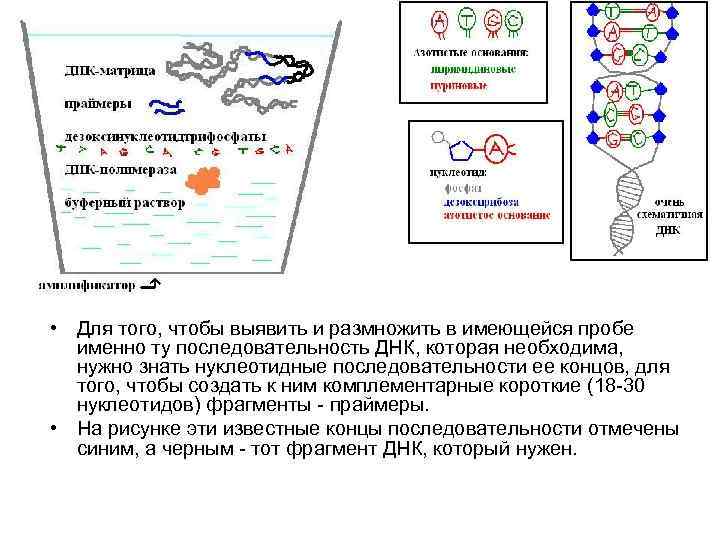 • Для того, чтобы выявить и размножить в имеющейся пробе именно ту последовательность ДНК, которая необходима, нужно знать нуклеотидные последовательности ее концов, для того, чтобы создать к ним комплементарные короткие (18 -30 нуклеотидов) фрагменты - праймеры. • На рисунке эти известные концы последовательности отмечены синим, а черным - тот фрагмент ДНК, который нужен.
• Для того, чтобы выявить и размножить в имеющейся пробе именно ту последовательность ДНК, которая необходима, нужно знать нуклеотидные последовательности ее концов, для того, чтобы создать к ним комплементарные короткие (18 -30 нуклеотидов) фрагменты - праймеры. • На рисунке эти известные концы последовательности отмечены синим, а черным - тот фрагмент ДНК, который нужен.
 Первая стадия - денатурация Двухцепочечную ДНК-матрицу нагревают до 94— 96 °C (или до 98 °C, если используется особенно термостабильная полимераза) на 0, 5— 2 мин. , чтобы цепи ДНК разошлись.
Первая стадия - денатурация Двухцепочечную ДНК-матрицу нагревают до 94— 96 °C (или до 98 °C, если используется особенно термостабильная полимераза) на 0, 5— 2 мин. , чтобы цепи ДНК разошлись.
 Вторая стадия - отжиг. Температуру снижают(обычно до 50 -60°С), и праймеры присоединяются к комплементарным участкам ДНК. Концетрация праймеров на несколько порядков выше концентрации ДНК из образца, поэтому отжиг праймеров протекает быстрее ренатурации ДНК. Главный элемент PCR - это многократный тепловой цикл, при котором образец ДНК подвергается воздействию трёх различных температур.
Вторая стадия - отжиг. Температуру снижают(обычно до 50 -60°С), и праймеры присоединяются к комплементарным участкам ДНК. Концетрация праймеров на несколько порядков выше концентрации ДНК из образца, поэтому отжиг праймеров протекает быстрее ренатурации ДНК. Главный элемент PCR - это многократный тепловой цикл, при котором образец ДНК подвергается воздействию трёх различных температур.
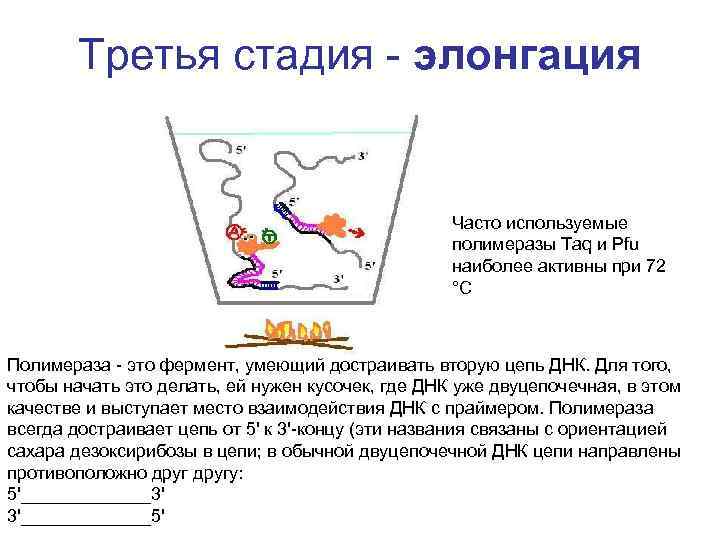 Третья стадия - элонгация Часто используемые полимеразы Taq и Pfu наиболее активны при 72 °C Полимераза - это фермент, умеющий достраивать вторую цепь ДНК. Для того, чтобы начать это делать, ей нужен кусочек, где ДНК уже двуцепочечная, в этом качестве и выступает место взаимодействия ДНК с праймером. Полимераза всегда достраивает цепь от 5' к 3'-концу (эти названия связаны с ориентацией сахара дезоксирибозы в цепи; в обычной двуцепочечной ДНК цепи направлены противоположно другу: 5'_______3' 3'_______5'
Третья стадия - элонгация Часто используемые полимеразы Taq и Pfu наиболее активны при 72 °C Полимераза - это фермент, умеющий достраивать вторую цепь ДНК. Для того, чтобы начать это делать, ей нужен кусочек, где ДНК уже двуцепочечная, в этом качестве и выступает место взаимодействия ДНК с праймером. Полимераза всегда достраивает цепь от 5' к 3'-концу (эти названия связаны с ориентацией сахара дезоксирибозы в цепи; в обычной двуцепочечной ДНК цепи направлены противоположно другу: 5'_______3' 3'_______5'
 • Теперь в растворе есть четыре длинных цепи ДНК. Две исходные и две, построенные по праймерам. • Температурный цикл амплификации многократно повторяется. За каждый следующий цикл амплификации происходит удвоение как исходного участка ДНК, так и вновь синтезированных фрагментов (амплификатов). Результатом циклического процесса является экспоненциальное увеличение количества коротких фрагментов ДНК
• Теперь в растворе есть четыре длинных цепи ДНК. Две исходные и две, построенные по праймерам. • Температурный цикл амплификации многократно повторяется. За каждый следующий цикл амплификации происходит удвоение как исходного участка ДНК, так и вновь синтезированных фрагментов (амплификатов). Результатом циклического процесса является экспоненциальное увеличение количества коротких фрагментов ДНК
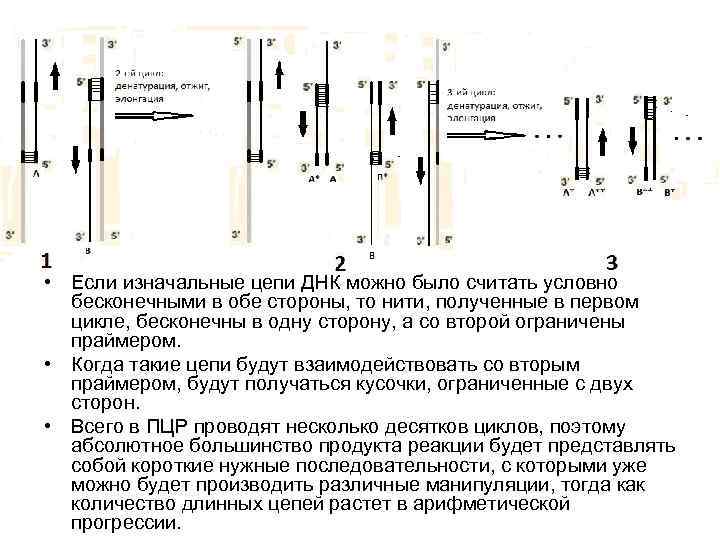 • Если изначальные цепи ДНК можно было считать условно бесконечными в обе стороны, то нити, полученные в первом цикле, бесконечны в одну сторону, а со второй ограничены праймером. • Когда такие цепи будут взаимодействовать со вторым праймером, будут получаться кусочки, ограниченные с двух сторон. • Всего в ПЦР проводят несколько десятков циклов, поэтому абсолютное большинство продукта реакции будет представлять собой короткие нужные последовательности, с которыми уже можно будет производить различные манипуляции, тогда как количество длинных цепей растет в арифметической прогрессии.
• Если изначальные цепи ДНК можно было считать условно бесконечными в обе стороны, то нити, полученные в первом цикле, бесконечны в одну сторону, а со второй ограничены праймером. • Когда такие цепи будут взаимодействовать со вторым праймером, будут получаться кусочки, ограниченные с двух сторон. • Всего в ПЦР проводят несколько десятков циклов, поэтому абсолютное большинство продукта реакции будет представлять собой короткие нужные последовательности, с которыми уже можно будет производить различные манипуляции, тогда как количество длинных цепей растет в арифметической прогрессии.
 Разновидности ПЦР 1. Конвенциональная ПЦР • По окончании 30 -40 циклов амплификации определяется наличие коротких двухцепочечных ДНК в смеси. • Положительная реакция свидетельствует о наличии хотя бы следовых количеств искомой ДНК в образце • Метод качественный • Основной метод выявления продукта ПЦР – электрофорез в агарозном или полиакриламидном геле
Разновидности ПЦР 1. Конвенциональная ПЦР • По окончании 30 -40 циклов амплификации определяется наличие коротких двухцепочечных ДНК в смеси. • Положительная реакция свидетельствует о наличии хотя бы следовых количеств искомой ДНК в образце • Метод качественный • Основной метод выявления продукта ПЦР – электрофорез в агарозном или полиакриламидном геле
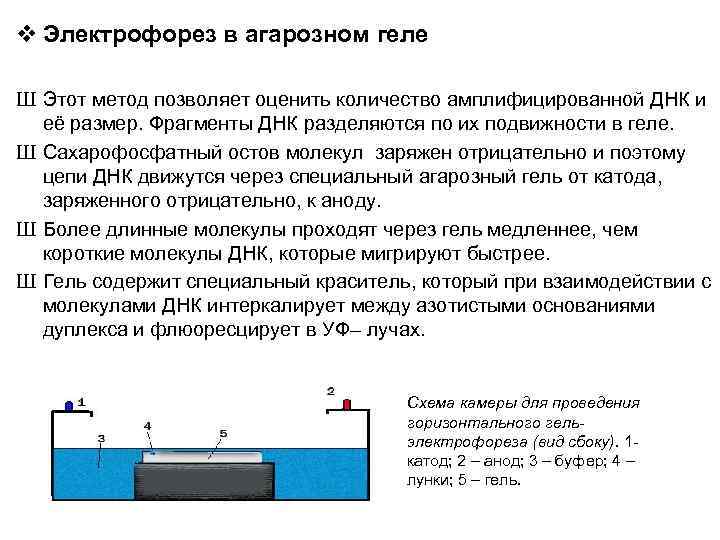 v Электрофорез в агарозном геле Ш Этот метод позволяет оценить количество амплифицированной ДНК и её размер. Фрагменты ДНК разделяются по их подвижности в геле. Ш Сахарофосфатный остов молекул заряжен отрицательно и поэтому цепи ДНК движутся через специальный агарозный гель от катода, заряженного отрицательно, к аноду. Ш Более длинные молекулы проходят через гель медленнее, чем короткие молекулы ДНК, которые мигрируют быстрее. Ш Гель содержит специальный краситель, который при взаимодействии с молекулами ДНК интеркалирует между азотистыми основаниями дуплекса и флюоресцирует в УФ– лучах. Схема камеры для проведения горизонтального гельэлектрофореза (вид сбоку). 1 - катод; 2 – анод; 3 – буфер; 4 – лунки; 5 – гель.
v Электрофорез в агарозном геле Ш Этот метод позволяет оценить количество амплифицированной ДНК и её размер. Фрагменты ДНК разделяются по их подвижности в геле. Ш Сахарофосфатный остов молекул заряжен отрицательно и поэтому цепи ДНК движутся через специальный агарозный гель от катода, заряженного отрицательно, к аноду. Ш Более длинные молекулы проходят через гель медленнее, чем короткие молекулы ДНК, которые мигрируют быстрее. Ш Гель содержит специальный краситель, который при взаимодействии с молекулами ДНК интеркалирует между азотистыми основаниями дуплекса и флюоресцирует в УФ– лучах. Схема камеры для проведения горизонтального гельэлектрофореза (вид сбоку). 1 - катод; 2 – анод; 3 – буфер; 4 – лунки; 5 – гель.
 Четвертая стадия - детекция. • В начале у нас был раствор с небольшим количеством длинных, полноценных клеточных молекул ДНК. • В конце ПЦР мы имеем раствор с огромным количеством размноженных нужных участков, кусочков ДНК • Раствор наносят на гель, к гелю прикладывают напряжение. За часокдругой кусочки молекул ДНК (они имеют заряд) перемещаются в геле на расстояние, пропорциональное их массе. • Гель кладут под ультрафиолет и масса одинаковых кусочков ДНК начинает светиться в том месте геля, где собралась. • Если собралась — значит в ДНК был участок, соответствующий праймеру, нужный «ген» . Если ничего не светится, мутная полоска без четкого участка — значит, нужного участка в ДНК нет.
Четвертая стадия - детекция. • В начале у нас был раствор с небольшим количеством длинных, полноценных клеточных молекул ДНК. • В конце ПЦР мы имеем раствор с огромным количеством размноженных нужных участков, кусочков ДНК • Раствор наносят на гель, к гелю прикладывают напряжение. За часокдругой кусочки молекул ДНК (они имеют заряд) перемещаются в геле на расстояние, пропорциональное их массе. • Гель кладут под ультрафиолет и масса одинаковых кусочков ДНК начинает светиться в том месте геля, где собралась. • Если собралась — значит в ДНК был участок, соответствующий праймеру, нужный «ген» . Если ничего не светится, мутная полоска без четкого участка — значит, нужного участка в ДНК нет.
 Преимущества метода ПЦР 1. Универсальность. При помощи ПЦР можно определять ДНК в любых биологических образцах. Причем это в равной степени относится как к ДНК микроорганизмов, так и к ДНК человека. 2. Высокая специфичность. Специфичность определяется тем, что в ПЦР определяется уникальный участок гена, характерный только для данного возбудителя. Для повышения специфичности возможно определять несколько разных генов одного микроба. Так, например, для определения Ureaplasma urealyticum можно выявлять как ген 16 S-RNA, так и ген уреазы. А для идентификации Chlamydia trachomatis, помимо определения хромосомальной ДНК и ДНК криптической плазмиды стало возможным выявлять рибосомальную РНК (NASBA). Это значительно повышает достоверность исследования. 3. Высокая чувствительность. Полимеразная цепная реакция способна выявлять единичные копии ДНК. В среднем порог чувствительности большинства современных тест-систем составляет от 10 до 100 копий ДНК. Это значительно превышает чувствительность культуральных методов исследования. 4. Малый объем биологического материала. Проведение анализа возможно в минимальном объеме пробы (до нескольких микролитров), что крайне важно в педиатрии, неонатологии, неврологии, судебной медицине. 5. Возможность диагностики не только острых, но и латентных инфекций. Особенно эффективен метод ПЦР для диагностики трудно культивируемых, некультивируемых и персистирующих форм микроорганизмов, с которыми часто приходится сталкиваться при латентных и хронических инфекциях.
Преимущества метода ПЦР 1. Универсальность. При помощи ПЦР можно определять ДНК в любых биологических образцах. Причем это в равной степени относится как к ДНК микроорганизмов, так и к ДНК человека. 2. Высокая специфичность. Специфичность определяется тем, что в ПЦР определяется уникальный участок гена, характерный только для данного возбудителя. Для повышения специфичности возможно определять несколько разных генов одного микроба. Так, например, для определения Ureaplasma urealyticum можно выявлять как ген 16 S-RNA, так и ген уреазы. А для идентификации Chlamydia trachomatis, помимо определения хромосомальной ДНК и ДНК криптической плазмиды стало возможным выявлять рибосомальную РНК (NASBA). Это значительно повышает достоверность исследования. 3. Высокая чувствительность. Полимеразная цепная реакция способна выявлять единичные копии ДНК. В среднем порог чувствительности большинства современных тест-систем составляет от 10 до 100 копий ДНК. Это значительно превышает чувствительность культуральных методов исследования. 4. Малый объем биологического материала. Проведение анализа возможно в минимальном объеме пробы (до нескольких микролитров), что крайне важно в педиатрии, неонатологии, неврологии, судебной медицине. 5. Возможность диагностики не только острых, но и латентных инфекций. Особенно эффективен метод ПЦР для диагностики трудно культивируемых, некультивируемых и персистирующих форм микроорганизмов, с которыми часто приходится сталкиваться при латентных и хронических инфекциях.
 Недостатки метода ПЦР 1. Амплифицируется ДНК как живого, так и погибшего микроорганизма. Это налагает определенные требования при использовании ПЦР для контроля эффективности лечения. В общем случае подобный контроль должен проводиться спустя промежуток времени, втечение которого происходит полная элиминация возбудителя. Однако, метод NASBA выявляет РНК только живых микроорганизмов и позволяет избежать этих ограничений. 2. Высокая чувствительность. Ряд микроорганизмов (условно - патогенная флора, УПФ) в норме может существовать у человека в малом количестве. При помощи метода ПЦР определяются даже самые малые количества УПФ, даже при отсутствии патологии. Однако эта проблема решена с появлением метода количественного определения ДНК (Real-time PCR). 3. Различия при использовании разных тест систем. Как говорилось выше, для амплификации можно использовать различные участки генома возбудителя. Однако в случае различных мутации микроорганизмов возможно изменение или утрата генов. Это приводит к разным результатам при использовании тест систем разных производителей.
Недостатки метода ПЦР 1. Амплифицируется ДНК как живого, так и погибшего микроорганизма. Это налагает определенные требования при использовании ПЦР для контроля эффективности лечения. В общем случае подобный контроль должен проводиться спустя промежуток времени, втечение которого происходит полная элиминация возбудителя. Однако, метод NASBA выявляет РНК только живых микроорганизмов и позволяет избежать этих ограничений. 2. Высокая чувствительность. Ряд микроорганизмов (условно - патогенная флора, УПФ) в норме может существовать у человека в малом количестве. При помощи метода ПЦР определяются даже самые малые количества УПФ, даже при отсутствии патологии. Однако эта проблема решена с появлением метода количественного определения ДНК (Real-time PCR). 3. Различия при использовании разных тест систем. Как говорилось выше, для амплификации можно использовать различные участки генома возбудителя. Однако в случае различных мутации микроорганизмов возможно изменение или утрата генов. Это приводит к разным результатам при использовании тест систем разных производителей.
 2. ПЦР в реальном времени • Принцип метода ПЦР в реальном времени (Real. Time PCR) основан на детекции продуктов амплификации уже в процессе реакции и проведении мониторинга кинетики накопления ампликонов. Это означает, что учет результата ПЦР (числа ампликонов) происходит после каждого цикла амплификации, а не в конце, как при обычной ПЦР. Чем больше в исходной пробе было специфической ДНК, тем раньше и больше увеличится число специфических фрагментов. • "ПЦР в реальном времени" (Real-Time PCR) позволяет осуществлять количественную оценку содержания ДНК в исследуемом материале.
2. ПЦР в реальном времени • Принцип метода ПЦР в реальном времени (Real. Time PCR) основан на детекции продуктов амплификации уже в процессе реакции и проведении мониторинга кинетики накопления ампликонов. Это означает, что учет результата ПЦР (числа ампликонов) происходит после каждого цикла амплификации, а не в конце, как при обычной ПЦР. Чем больше в исходной пробе было специфической ДНК, тем раньше и больше увеличится число специфических фрагментов. • "ПЦР в реальном времени" (Real-Time PCR) позволяет осуществлять количественную оценку содержания ДНК в исследуемом материале.
 Детекция продуктов амплификации 1. Выщепление 5' концевой метки (Taq. Man Assay). • Данная методика основана на использовании -экзонуклеазной активности полимеразы. В реакционную смесь добавляют ДНК-зонды, в состав которых входит флуоресцентная метка в 5'-положении и гаситель флуоресценции в 3 положении, а также фосфатная группа в 3'положении. Эти зонды имеют места посадки внутри амплифицируемой области. Гаситель поглощает испускаемое флуоресцентной меткой излучение, а фосфатная группа в 3'-положении блокирует полимеразу. В ходе ПЦР во время стадии отжига праймеров происходит присоединение ДНК-зонда к комплементарной цепи ДНК, причем больше продуктов амплификации образуется в ходе ПЦР, тем больше молекул зондов свяжется с соответствующими ампликонами. Во время стадии элонгации полимераза синтезирует комплементарную цепь ДНК и при достижении зонда начинает его расщеплять благодаря наличию 5'-экзонуклеазной активности. Таким образом происходит разъединение флуоресцентной метки и гасителя, что приводит к увеличению детектируемого свечения. Очевидно, что чем больше ампликонов было наработано в ходе ПЦР на данный момент времени, тем интенсивнее будет свечение.
Детекция продуктов амплификации 1. Выщепление 5' концевой метки (Taq. Man Assay). • Данная методика основана на использовании -экзонуклеазной активности полимеразы. В реакционную смесь добавляют ДНК-зонды, в состав которых входит флуоресцентная метка в 5'-положении и гаситель флуоресценции в 3 положении, а также фосфатная группа в 3'положении. Эти зонды имеют места посадки внутри амплифицируемой области. Гаситель поглощает испускаемое флуоресцентной меткой излучение, а фосфатная группа в 3'-положении блокирует полимеразу. В ходе ПЦР во время стадии отжига праймеров происходит присоединение ДНК-зонда к комплементарной цепи ДНК, причем больше продуктов амплификации образуется в ходе ПЦР, тем больше молекул зондов свяжется с соответствующими ампликонами. Во время стадии элонгации полимераза синтезирует комплементарную цепь ДНК и при достижении зонда начинает его расщеплять благодаря наличию 5'-экзонуклеазной активности. Таким образом происходит разъединение флуоресцентной метки и гасителя, что приводит к увеличению детектируемого свечения. Очевидно, что чем больше ампликонов было наработано в ходе ПЦР на данный момент времени, тем интенсивнее будет свечение.
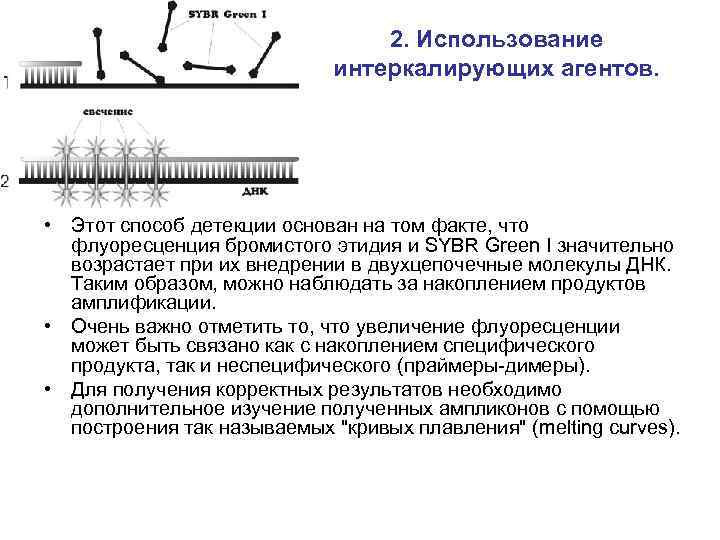 2. Использование интеркалирующих агентов. • Этот способ детекции основан на том факте, что флуоресценция бромистого этидия и SYBR Green I значительно возрастает при их внедрении в двухцепочечные молекулы ДНК. Таким образом, можно наблюдать за накоплением продуктов амплификации. • Очень важно отметить то, что увеличение флуоресценции может быть связано как с накоплением специфического продукта, так и неспецифического (праймеры-димеры). • Для получения корректных результатов необходимо дополнительное изучение полученных ампликонов с помощью построения так называемых "кривых плавления" (melting curves).
2. Использование интеркалирующих агентов. • Этот способ детекции основан на том факте, что флуоресценция бромистого этидия и SYBR Green I значительно возрастает при их внедрении в двухцепочечные молекулы ДНК. Таким образом, можно наблюдать за накоплением продуктов амплификации. • Очень важно отметить то, что увеличение флуоресценции может быть связано как с накоплением специфического продукта, так и неспецифического (праймеры-димеры). • Для получения корректных результатов необходимо дополнительное изучение полученных ампликонов с помощью построения так называемых "кривых плавления" (melting curves).
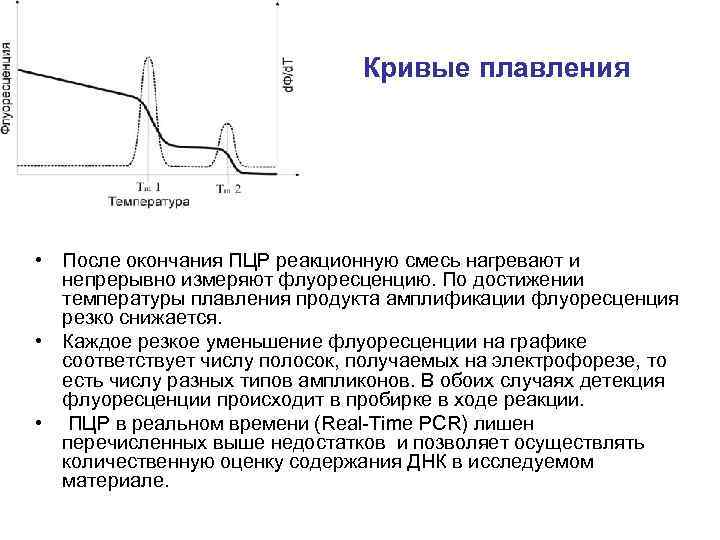 Кривые плавления • После окончания ПЦР реакционную смесь нагревают и непрерывно измеряют флуоресценцию. По достижении температуры плавления продукта амплификации флуоресценция резко снижается. • Каждое резкое уменьшение флуоресценции на графике соответствует числу полосок, получаемых на электрофорезе, то есть числу разных типов ампликонов. В обоих случаях детекция флуоресценции происходит в пробирке в ходе реакции. • ПЦР в реальном времени (Real-Time PCR) лишен перечисленных выше недостатков и позволяет осуществлять количественную оценку содержания ДНК в исследуемом материале.
Кривые плавления • После окончания ПЦР реакционную смесь нагревают и непрерывно измеряют флуоресценцию. По достижении температуры плавления продукта амплификации флуоресценция резко снижается. • Каждое резкое уменьшение флуоресценции на графике соответствует числу полосок, получаемых на электрофорезе, то есть числу разных типов ампликонов. В обоих случаях детекция флуоресценции происходит в пробирке в ходе реакции. • ПЦР в реальном времени (Real-Time PCR) лишен перечисленных выше недостатков и позволяет осуществлять количественную оценку содержания ДНК в исследуемом материале.
 Некоторые разновидности ПЦР • 1. «Вложенная» ПЦР (Nested PCR) - есть вторая пара праймеров, которая амплифицирует кусочек полученного кусочка. 2. «Инвертированная» ПЦР (Inverse PCR) - перед проведением ПЦР с помощью серии ферментативных реакций как бы приклеивают известные фрагменты на концы неизвестного, чтобы можно было его амплифицировать. 3. ПЦР с обратной транскрипцией (Reverse Transcription PCR, RT-PCR) - берется РНК (молекула, которая является промежуточным этапом между ДНК и белками в живой клетке), а из нее с помощью фермента обратной транскриптазы получают ДНК, с которой уже проводят ПЦР. Это удобно, например, для того, чтобы выявить, какие именно гены в данной клетке экспрессируются. 4. Ассиметричная ПЦР (Assymetric PCR) - если нужны продукты амплификации преимущественно одной из двух цепей ДНК. Добавляют неравное количество праймеров. 5. ПЦР длинных фрагментов (Long-range PCR) - чтобы амплифицировать длинный (больше 10 тысяч пар оснований) фрагмент, используют ПЦР с двумя полимеразами: одна из них, Taq-полимераза, может синтезировать длинную цепь, а вторая, ДНКполимераза с 3'5'-экзонуклеазной активностью, может исправить ошибки, допущенные первой. 6. Multiplex PCR - добавляют несколько пар праймеров и одновременно амплифицируют несколько фрагментов. 7. NASBA (Nucleic Acids Sequence-Based Amplification)- в отличие от обычной ПЦР, мишенью для NASBA (Nucleic Acids Sequence-Based Amplification) служат молекулы РНК рибосом микроорганизмов, что дает целый ряд преимуществ • 8. Цифровая количественная ПЦР- реакционная смесь, содержащая флуоресцентный краситель, на огромное число микроскопических объемов; по окончании реакции анализируется доля капелек с положительной реакцией. Эта доля будет пропорциональна количеству искомой ДНК в образце
Некоторые разновидности ПЦР • 1. «Вложенная» ПЦР (Nested PCR) - есть вторая пара праймеров, которая амплифицирует кусочек полученного кусочка. 2. «Инвертированная» ПЦР (Inverse PCR) - перед проведением ПЦР с помощью серии ферментативных реакций как бы приклеивают известные фрагменты на концы неизвестного, чтобы можно было его амплифицировать. 3. ПЦР с обратной транскрипцией (Reverse Transcription PCR, RT-PCR) - берется РНК (молекула, которая является промежуточным этапом между ДНК и белками в живой клетке), а из нее с помощью фермента обратной транскриптазы получают ДНК, с которой уже проводят ПЦР. Это удобно, например, для того, чтобы выявить, какие именно гены в данной клетке экспрессируются. 4. Ассиметричная ПЦР (Assymetric PCR) - если нужны продукты амплификации преимущественно одной из двух цепей ДНК. Добавляют неравное количество праймеров. 5. ПЦР длинных фрагментов (Long-range PCR) - чтобы амплифицировать длинный (больше 10 тысяч пар оснований) фрагмент, используют ПЦР с двумя полимеразами: одна из них, Taq-полимераза, может синтезировать длинную цепь, а вторая, ДНКполимераза с 3'5'-экзонуклеазной активностью, может исправить ошибки, допущенные первой. 6. Multiplex PCR - добавляют несколько пар праймеров и одновременно амплифицируют несколько фрагментов. 7. NASBA (Nucleic Acids Sequence-Based Amplification)- в отличие от обычной ПЦР, мишенью для NASBA (Nucleic Acids Sequence-Based Amplification) служат молекулы РНК рибосом микроорганизмов, что дает целый ряд преимуществ • 8. Цифровая количественная ПЦР- реакционная смесь, содержащая флуоресцентный краситель, на огромное число микроскопических объемов; по окончании реакции анализируется доля капелек с положительной реакцией. Эта доля будет пропорциональна количеству искомой ДНК в образце
 Гибридизация • Гибридизация - восстановление двухцепочечной структуры нуклеиновых кислот по принципу комплементарности после тепловой денатурации - происходит между любыми одинарными цепями, если они комплементарны: ДНК - ДНК, РНК - РНК, ДНК - РНК. • Для обнаружения ДНК бактерии или вируса необходимо иметь чистый одноцепочечный фрагмент ДНК, комплементарный известной последовательности - ДНК-зонд меченый изотопами, ферментами и др. • Получают ДНК-зонды клонированием или путем химического синтеза. В состав такого фрагмента входит от 15 до 1000 нуклеотидов.
Гибридизация • Гибридизация - восстановление двухцепочечной структуры нуклеиновых кислот по принципу комплементарности после тепловой денатурации - происходит между любыми одинарными цепями, если они комплементарны: ДНК - ДНК, РНК - РНК, ДНК - РНК. • Для обнаружения ДНК бактерии или вируса необходимо иметь чистый одноцепочечный фрагмент ДНК, комплементарный известной последовательности - ДНК-зонд меченый изотопами, ферментами и др. • Получают ДНК-зонды клонированием или путем химического синтеза. В состав такого фрагмента входит от 15 до 1000 нуклеотидов.
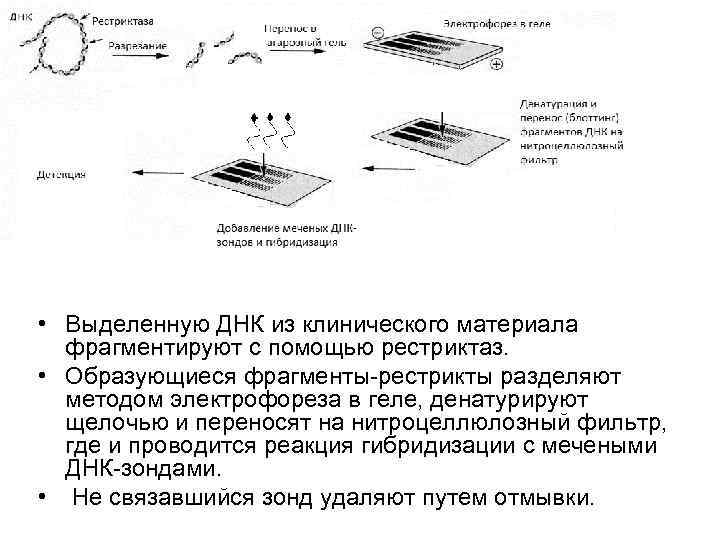 • Выделенную ДНК из клинического материала фрагментируют с помощью рестриктаз. • Образующиеся фрагменты-рестрикты разделяют методом электрофореза в геле, денатурируют щелочью и переносят на нитроцеллюлозный фильтр, где и проводится реакция гибридизации с мечеными ДНК-зондами. • Не связавшийся зонд удаляют путем отмывки.
• Выделенную ДНК из клинического материала фрагментируют с помощью рестриктаз. • Образующиеся фрагменты-рестрикты разделяют методом электрофореза в геле, денатурируют щелочью и переносят на нитроцеллюлозный фильтр, где и проводится реакция гибридизации с мечеными ДНК-зондами. • Не связавшийся зонд удаляют путем отмывки.
 Гибридизация(продолжение) • Этот метод был разработан Саузерном в 1975 году. В отечественной литературе его принято называть «южный блоттинг» ( «блоттинг» - англ. «промокашка» , «саузерн» - «южный» ). • Если в исследуемом образце есть последовательности, комплементарные последовательностям зонда, то гибридизацию можно определить радиоавтографически (изотопная метка), флуориметрически (флуоресцентная метка), постановкой ИФА (ферментная метка). • Метод применяется для диагностики инфекционных заболеваний, наследственных дефектов, установления экспрессии тех или иных генов
Гибридизация(продолжение) • Этот метод был разработан Саузерном в 1975 году. В отечественной литературе его принято называть «южный блоттинг» ( «блоттинг» - англ. «промокашка» , «саузерн» - «южный» ). • Если в исследуемом образце есть последовательности, комплементарные последовательностям зонда, то гибридизацию можно определить радиоавтографически (изотопная метка), флуориметрически (флуоресцентная метка), постановкой ИФА (ферментная метка). • Метод применяется для диагностики инфекционных заболеваний, наследственных дефектов, установления экспрессии тех или иных генов
 Гибридизация(продолжение) • Методы, основанные на гибридизации с ДНКзондами, признаны наиболее эффективными для ускоренной диагностики лекарственной устойчивости бактерий, в частности, для ускоренного скрининга пациентов с повышенным риском развития мультирезистентного туберкулеза. • Технология включает следующие этапы: выделение ДНК из культур M. tuberculosis или непосредственно клинического материала; полимеразная цепная реакция (ПЦР) с применением праймеров, меченых биотином, для амплификации фрагментов генов, ассоциированных с лекарственной устойчивостью; гибридизация биотин-меченых ПЦР-продуктов с ДНКзондами, иммобилизированными на мембранах.
Гибридизация(продолжение) • Методы, основанные на гибридизации с ДНКзондами, признаны наиболее эффективными для ускоренной диагностики лекарственной устойчивости бактерий, в частности, для ускоренного скрининга пациентов с повышенным риском развития мультирезистентного туберкулеза. • Технология включает следующие этапы: выделение ДНК из культур M. tuberculosis или непосредственно клинического материала; полимеразная цепная реакция (ПЦР) с применением праймеров, меченых биотином, для амплификации фрагментов генов, ассоциированных с лекарственной устойчивостью; гибридизация биотин-меченых ПЦР-продуктов с ДНКзондами, иммобилизированными на мембранах.
 Модификации метода • Метод разветвленной ДНК-гибридизации (b. DNA assay — branched DNA assay), в отличие от других методов, основан не на амплификации ДНК, а на амплификации сигнала. • Определяемая нуклеиновая кислота в этом случае связывается с зондом, один конец которого комплементарен мишени, а другой – определенному концу усиливающего зонда. • При этом усиливающий зонд может быть комплементарен следующему зонду и т. д. • В результате многоступенчатой гибридизации происходит присоединение многочисленных зондов, конъюгированных с меткой, и соответственно, усиление сигнала. • Данный метод дает возможность использования в одной реакции нескольких связывающихся с мишенью зондов, что обеспечивает преимущество при выявление геномов с высокой гетерогенностью (например ВИЧ).
Модификации метода • Метод разветвленной ДНК-гибридизации (b. DNA assay — branched DNA assay), в отличие от других методов, основан не на амплификации ДНК, а на амплификации сигнала. • Определяемая нуклеиновая кислота в этом случае связывается с зондом, один конец которого комплементарен мишени, а другой – определенному концу усиливающего зонда. • При этом усиливающий зонд может быть комплементарен следующему зонду и т. д. • В результате многоступенчатой гибридизации происходит присоединение многочисленных зондов, конъюгированных с меткой, и соответственно, усиление сигнала. • Данный метод дает возможность использования в одной реакции нескольких связывающихся с мишенью зондов, что обеспечивает преимущество при выявление геномов с высокой гетерогенностью (например ВИЧ).
 Модификации метода • Метод ДНК/РНК гибридного захвата основан на связывании моноклональных меченых антител с продуктами гибридизации РНК/ДНК или ДНК/РНК. • В данном случае манипуляции по подготовке материала минимальны, что составляет основное преимущество метода. • Метод иммунологического захвата гибрида ДНК/РНК с последующей иммунохимической детекцией широко используется для скрининга некоторых инфекционных агентов, таких как вирус папилломы человека, хламидий, ЦМВ.
Модификации метода • Метод ДНК/РНК гибридного захвата основан на связывании моноклональных меченых антител с продуктами гибридизации РНК/ДНК или ДНК/РНК. • В данном случае манипуляции по подготовке материала минимальны, что составляет основное преимущество метода. • Метод иммунологического захвата гибрида ДНК/РНК с последующей иммунохимической детекцией широко используется для скрининга некоторых инфекционных агентов, таких как вирус папилломы человека, хламидий, ЦМВ.
 ВПЧ Digene-тест
ВПЧ Digene-тест
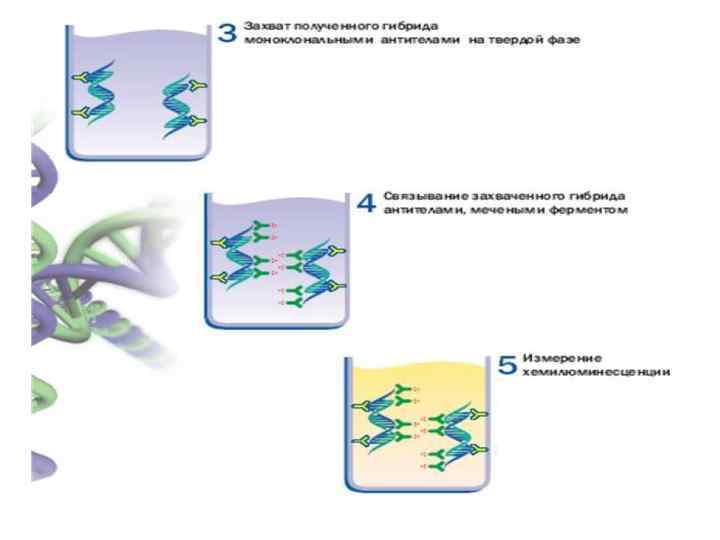
 ВПЧ Digene-тест • • • Прогностическая ценность теста: 99% Чувствительность теста: свыше 95% Специфичность теста эквивалентна цитологическому исследованию Исследование автоматизировано, время 2, 5 ч. • Образцы клеток эпителия, биопсийного • материала
ВПЧ Digene-тест • • • Прогностическая ценность теста: 99% Чувствительность теста: свыше 95% Специфичность теста эквивалентна цитологическому исследованию Исследование автоматизировано, время 2, 5 ч. • Образцы клеток эпителия, биопсийного • материала
 • Перспективен метод гибридизации нуклеиновых кислот in situ. В этом случае меченую ДНК наносят на биоптаты тканей (в том числе на фиксированные формалином или заключённые в парафиновые блоки) и регистрируют взаимодействие с комплементарной ДНК. • Вариант метода – флуоресцентная гибридизация in situ (FISH -fluorescein in situ hybradization). В качестве метки зонда используются флуорохромы, что сокращает время проведения процедуры. Метод используют для выявления вирусов простого герпеса, папилломы человека, Эпштейна. Барр и др.
• Перспективен метод гибридизации нуклеиновых кислот in situ. В этом случае меченую ДНК наносят на биоптаты тканей (в том числе на фиксированные формалином или заключённые в парафиновые блоки) и регистрируют взаимодействие с комплементарной ДНК. • Вариант метода – флуоресцентная гибридизация in situ (FISH -fluorescein in situ hybradization). В качестве метки зонда используются флуорохромы, что сокращает время проведения процедуры. Метод используют для выявления вирусов простого герпеса, папилломы человека, Эпштейна. Барр и др.
 • Молекулярная гибридизация - один из первых и наиболее простых подходов к определению вирусных нуклеиновых кислот. • Методы гибридизации позволяют количественно оценить содержание в исследуемом образце, но обладают значительно меньшей чувствительностью, чем ПЦР. • Чувствительность и специфичность этих методов сопоставима с серологическими методами анализа, они позволяют получить непосредственное представление о репликации вируса, а также распознать инфекцию на ранней стадии, когда результаты иммунологических и биохимических тестов могут еще не отклоняться от нормы. • К достоинствам метода относится хорошая стандартизация и относительная простота исполнения.
• Молекулярная гибридизация - один из первых и наиболее простых подходов к определению вирусных нуклеиновых кислот. • Методы гибридизации позволяют количественно оценить содержание в исследуемом образце, но обладают значительно меньшей чувствительностью, чем ПЦР. • Чувствительность и специфичность этих методов сопоставима с серологическими методами анализа, они позволяют получить непосредственное представление о репликации вируса, а также распознать инфекцию на ранней стадии, когда результаты иммунологических и биохимических тестов могут еще не отклоняться от нормы. • К достоинствам метода относится хорошая стандартизация и относительная простота исполнения.
