Молекулярная эволюция-лекция 4.ppt
- Количество слайдов: 69
 МОЛЕКУЛЯРНАЯ ЭВОЛЮЦИЯ ИММУННОЙ СИСТЕМЫ У высших позвоночных (рептилий, птиц, млекопитающих) эта система представляет собой целый комплекс мультигенных семейств (МС), кодирующих молекулы иммуноглобулинов (ИГ) и других ИГ-подобных иммунных рецепторов. Дифференциальная экспрессия МС и определяет принадлежность иммуннокомпетентных клеток к тому или иному функциональному типу. В целом весь этот сложный ансамбль МС функционирует так, чтобы обеспечить две основные функции иммунной системы: достаточное опознание и ликвидацию любого чужеродного антигена (АГ), не важно эндо- или экзогенного происхождения.
МОЛЕКУЛЯРНАЯ ЭВОЛЮЦИЯ ИММУННОЙ СИСТЕМЫ У высших позвоночных (рептилий, птиц, млекопитающих) эта система представляет собой целый комплекс мультигенных семейств (МС), кодирующих молекулы иммуноглобулинов (ИГ) и других ИГ-подобных иммунных рецепторов. Дифференциальная экспрессия МС и определяет принадлежность иммуннокомпетентных клеток к тому или иному функциональному типу. В целом весь этот сложный ансамбль МС функционирует так, чтобы обеспечить две основные функции иммунной системы: достаточное опознание и ликвидацию любого чужеродного антигена (АГ), не важно эндо- или экзогенного происхождения.
 ВНУТРЕННИЕ ПРИЧИНЫ ПРОГРЕССИВНОЙ ЭВОЛЮЦИИ ИММУННОЙ СИСТЕМЫ. • Рассмотрим в качестве биосистемы иммунную систему и будем исходить из предположения, что любая отдельная клетка может активироваться для действий по определенной программе (для выполнения которой она и предназначена), но в отсутствие реального сигнала к активации. Будем называть это событие для краткости спонтанной активацией (СA).
ВНУТРЕННИЕ ПРИЧИНЫ ПРОГРЕССИВНОЙ ЭВОЛЮЦИИ ИММУННОЙ СИСТЕМЫ. • Рассмотрим в качестве биосистемы иммунную систему и будем исходить из предположения, что любая отдельная клетка может активироваться для действий по определенной программе (для выполнения которой она и предназначена), но в отсутствие реального сигнала к активации. Будем называть это событие для краткости спонтанной активацией (СA).
 ВНУТРЕННИЕ ПРИЧИНЫ ПРОГРЕССИВНОЙ ЭВОЛЮЦИИ ИММУННОЙ СИСТЕМЫ. • Произойти это может по многим причинам: мутация, заражение вирусом и пр. Подобная спонтанная активация представляет собой "сбой программы" и некоторым образом аналогична злокачественному перерождению клетки. Эта аналогия особенно отчетливо просматривается на примере иммунной системы, т. к. активация компетентного иммуноцита для уничтожения АГ подразумевает и его (иммуноцита) пролиферацию, т. е. ускоренное размножение
ВНУТРЕННИЕ ПРИЧИНЫ ПРОГРЕССИВНОЙ ЭВОЛЮЦИИ ИММУННОЙ СИСТЕМЫ. • Произойти это может по многим причинам: мутация, заражение вирусом и пр. Подобная спонтанная активация представляет собой "сбой программы" и некоторым образом аналогична злокачественному перерождению клетки. Эта аналогия особенно отчетливо просматривается на примере иммунной системы, т. к. активация компетентного иммуноцита для уничтожения АГ подразумевает и его (иммуноцита) пролиферацию, т. е. ускоренное размножение
 ВНУТРЕННИЕ ПРИЧИНЫ ПРОГРЕССИВНОЙ ЭВОЛЮЦИИ ИММУННОЙ СИСТЕМЫ. • Чтобы любая такая спонтанная активация клетки была ощутима для организма, необходимо, чтобы сложная система обладала тремя свойствами: • 1) большое количество клеток- в системе должно быть достаточно много клеток, чтобы событие СА могло реально произойти;
ВНУТРЕННИЕ ПРИЧИНЫ ПРОГРЕССИВНОЙ ЭВОЛЮЦИИ ИММУННОЙ СИСТЕМЫ. • Чтобы любая такая спонтанная активация клетки была ощутима для организма, необходимо, чтобы сложная система обладала тремя свойствами: • 1) большое количество клеток- в системе должно быть достаточно много клеток, чтобы событие СА могло реально произойти;
 ВНУТРЕННИЕ ПРИЧИНЫ ПРОГРЕССИВНОЙ ЭВОЛЮЦИИ ИММУННОЙ СИСТЕМЫ. • 2) усиление эффекта - система должна быть устроена таким образом, чтобы происшедшее на клеточном уровне даже единичное событие СА имело вполне ощутимые последствия на уровне организма, иначе это событие не будет замечено естественным отбором; • 3) отсутствие эффективной отрицательной обратной связи - конечный продукт ответа на какой-либо раздражающий сигнал не должен эффективно ингибировать начальные стадии собственного синтеза.
ВНУТРЕННИЕ ПРИЧИНЫ ПРОГРЕССИВНОЙ ЭВОЛЮЦИИ ИММУННОЙ СИСТЕМЫ. • 2) усиление эффекта - система должна быть устроена таким образом, чтобы происшедшее на клеточном уровне даже единичное событие СА имело вполне ощутимые последствия на уровне организма, иначе это событие не будет замечено естественным отбором; • 3) отсутствие эффективной отрицательной обратной связи - конечный продукт ответа на какой-либо раздражающий сигнал не должен эффективно ингибировать начальные стадии собственного синтеза.
 ВНУТРЕННИЕ ПРИЧИНЫ ПРОГРЕССИВНОЙ ЭВОЛЮЦИИ ИММУННОЙ СИСТЕМЫ. • Рассмотрим в качестве объекта СА В-лимфоцит. Предположим, что покоящийся В-лимфоцит спонтанно (неантигенно) активировался и начал синтезировать антитела к отсутствующему реально АГ. В пользу того, что такое событие может произойти, говорит факт существования миелом - опухолей иммунной системы, при развитии которых клеточный клон В-лимфоцитов не поддается межклеточной регуляции, бесконтрольно размножается и в избытке образует специфические антитела только одного типа
ВНУТРЕННИЕ ПРИЧИНЫ ПРОГРЕССИВНОЙ ЭВОЛЮЦИИ ИММУННОЙ СИСТЕМЫ. • Рассмотрим в качестве объекта СА В-лимфоцит. Предположим, что покоящийся В-лимфоцит спонтанно (неантигенно) активировался и начал синтезировать антитела к отсутствующему реально АГ. В пользу того, что такое событие может произойти, говорит факт существования миелом - опухолей иммунной системы, при развитии которых клеточный клон В-лимфоцитов не поддается межклеточной регуляции, бесконтрольно размножается и в избытке образует специфические антитела только одного типа
 ВНУТРЕННИЕ ПРИЧИНЫ ПРОГРЕССИВНОЙ ЭВОЛЮЦИИ ИММУННОЙ СИСТЕМЫ. • Поскольку частота злокачественного перерождения оценивается как 10 -6, то можно считать, что частота спонтанной активации (СА) В-клетки в отсутствие АГ не ниже, чем 10 -6. Насколько большой вред может нанести организму подобное событие?
ВНУТРЕННИЕ ПРИЧИНЫ ПРОГРЕССИВНОЙ ЭВОЛЮЦИИ ИММУННОЙ СИСТЕМЫ. • Поскольку частота злокачественного перерождения оценивается как 10 -6, то можно считать, что частота спонтанной активации (СА) В-клетки в отсутствие АГ не ниже, чем 10 -6. Насколько большой вред может нанести организму подобное событие?
 ВНУТРЕННИЕ ПРИЧИНЫ ПРОГРЕССИВНОЙ ЭВОЛЮЦИИ ИММУННОЙ СИСТЕМЫ. • Если принять частоту СА В-клетки за 10 -6, то в организме мыши, например, должны одновременно пролиферировать в отсутствие стимулирующеего их АГ более 200 В-лимфоцитов (что количественно эквивалентно примерно 20 клонам)
ВНУТРЕННИЕ ПРИЧИНЫ ПРОГРЕССИВНОЙ ЭВОЛЮЦИИ ИММУННОЙ СИСТЕМЫ. • Если принять частоту СА В-клетки за 10 -6, то в организме мыши, например, должны одновременно пролиферировать в отсутствие стимулирующеего их АГ более 200 В-лимфоцитов (что количественно эквивалентно примерно 20 клонам)
 ВНУТРЕННИЕ ПРИЧИНЫ ПРОГРЕССИВНОЙ ЭВОЛЮЦИИ ИММУННОЙ СИСТЕМЫ. • Таким образом, если в организме мыши спонтанно активировавшиеся В-клетки дойдут до стадии плазмоклетки (синтезирующей огромное количества молекул иммуноглобулина), то их суммарный иммунный ответ "ни на что" будет таким, каким был бы ответ на примерно 20 АГ-детерминант.
ВНУТРЕННИЕ ПРИЧИНЫ ПРОГРЕССИВНОЙ ЭВОЛЮЦИИ ИММУННОЙ СИСТЕМЫ. • Таким образом, если в организме мыши спонтанно активировавшиеся В-клетки дойдут до стадии плазмоклетки (синтезирующей огромное количества молекул иммуноглобулина), то их суммарный иммунный ответ "ни на что" будет таким, каким был бы ответ на примерно 20 АГ-детерминант.
 ВНУТРЕННИЕ ПРИЧИНЫ ПРОГРЕССИВНОЙ ЭВОЛЮЦИИ ИММУННОЙ СИСТЕМЫ. • Для человека ситуация аналогичная, но, естественно, с большими количествами клеток. Ясно, что в реальных иммунных системах имеются "предохранители" от подобных нежелательных эффектов. Появление в эволюционном прошлом субпопуляции Т-хелперов могло оказаться одним из основных таких "предохранителей".
ВНУТРЕННИЕ ПРИЧИНЫ ПРОГРЕССИВНОЙ ЭВОЛЮЦИИ ИММУННОЙ СИСТЕМЫ. • Для человека ситуация аналогичная, но, естественно, с большими количествами клеток. Ясно, что в реальных иммунных системах имеются "предохранители" от подобных нежелательных эффектов. Появление в эволюционном прошлом субпопуляции Т-хелперов могло оказаться одним из основных таких "предохранителей".
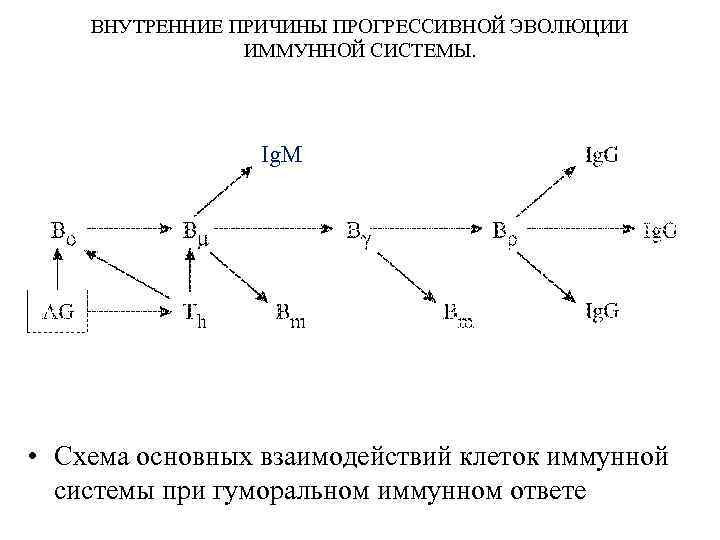 ВНУТРЕННИЕ ПРИЧИНЫ ПРОГРЕССИВНОЙ ЭВОЛЮЦИИ ИММУННОЙ СИСТЕМЫ. Ig. M • Схема основных взаимодействий клеток иммунной системы при гуморальном иммунном ответе
ВНУТРЕННИЕ ПРИЧИНЫ ПРОГРЕССИВНОЙ ЭВОЛЮЦИИ ИММУННОЙ СИСТЕМЫ. Ig. M • Схема основных взаимодействий клеток иммунной системы при гуморальном иммунном ответе
 ВНУТРЕННИЕ ПРИЧИНЫ ПРОГРЕССИВНОЙ ЭВОЛЮЦИИ ИММУННОЙ СИСТЕМЫ. • Неактивированный В-лимфоцит (обозначен В 0), после встречи с антигеном (AG) и получение дополнительного сигнала от T-хелпера (Th) переходит в состояние Вμ (синтез молекул иммуноглобулина М (Ig. M), специфичных к AG). T-хелпер (Th) получает сигнал от AG посредством антигенпредставляющей клетки (чаще всего макрофага). Кроме того, T-хелпер (Th) помогает Вμ –лимфоциту перейти в стадию Вγ, когда происходит переключение на активный синтез иммуноглобулина G (Ig. G) высокоспецифичного к AG. Попутно образуются клетки памяти Вm, активирующиеся при вторичном заражении тем же AG. Из состояния Вγ лимфоцит переходит в стадию Вp – плазмоклетки или антителобразующей клетки (АОК). В этой стадии синтезируется огромное количество высокоспецифичного к AG иммуноглобулина G.
ВНУТРЕННИЕ ПРИЧИНЫ ПРОГРЕССИВНОЙ ЭВОЛЮЦИИ ИММУННОЙ СИСТЕМЫ. • Неактивированный В-лимфоцит (обозначен В 0), после встречи с антигеном (AG) и получение дополнительного сигнала от T-хелпера (Th) переходит в состояние Вμ (синтез молекул иммуноглобулина М (Ig. M), специфичных к AG). T-хелпер (Th) получает сигнал от AG посредством антигенпредставляющей клетки (чаще всего макрофага). Кроме того, T-хелпер (Th) помогает Вμ –лимфоциту перейти в стадию Вγ, когда происходит переключение на активный синтез иммуноглобулина G (Ig. G) высокоспецифичного к AG. Попутно образуются клетки памяти Вm, активирующиеся при вторичном заражении тем же AG. Из состояния Вγ лимфоцит переходит в стадию Вp – плазмоклетки или антителобразующей клетки (АОК). В этой стадии синтезируется огромное количество высокоспецифичного к AG иммуноглобулина G.
 ВНУТРЕННИЕ ПРИЧИНЫ ПРОГРЕССИВНОЙ ЭВОЛЮЦИИ ИММУННОЙ СИСТЕМЫ. • В схеме на рисунке опущено множество деталей, поскольку для наших рассуждений существенно лишь то, что для перехода от стадии покоя к стадии АОК В-лимфоциту требуется двойной сигнал: первый непосредственно от АГ, второй - от Т-хелпера. В то же время известно, что для дифференцировки, например, эритроидной клетки- предшественника, представляющей собой не менее сложный процесс, чем антигензависимое созревание В-лимфоцита, достаточно одного сигнала, представляемого эритропоэтином.
ВНУТРЕННИЕ ПРИЧИНЫ ПРОГРЕССИВНОЙ ЭВОЛЮЦИИ ИММУННОЙ СИСТЕМЫ. • В схеме на рисунке опущено множество деталей, поскольку для наших рассуждений существенно лишь то, что для перехода от стадии покоя к стадии АОК В-лимфоциту требуется двойной сигнал: первый непосредственно от АГ, второй - от Т-хелпера. В то же время известно, что для дифференцировки, например, эритроидной клетки- предшественника, представляющей собой не менее сложный процесс, чем антигензависимое созревание В-лимфоцита, достаточно одного сигнала, представляемого эритропоэтином.
 ВНУТРЕННИЕ ПРИЧИНЫ ПРОГРЕССИВНОЙ ЭВОЛЮЦИИ ИММУННОЙ СИСТЕМЫ. • Однако Т-хелпер тоже получает сигнал к активации от АГ. Таким образом, сигнал фактически раздваивается: связав АГ и интернализировав его, антигенпредставляющие клетки представляет АГ-детерминанты Тхелперу, который, активировавшись, секретирует различные лимфокины (регуляторные молекулы иммунной системы) и, тем самым, дает В-клетке дополнительный сигнал, идущий в конечном счете, от антигена же.
ВНУТРЕННИЕ ПРИЧИНЫ ПРОГРЕССИВНОЙ ЭВОЛЮЦИИ ИММУННОЙ СИСТЕМЫ. • Однако Т-хелпер тоже получает сигнал к активации от АГ. Таким образом, сигнал фактически раздваивается: связав АГ и интернализировав его, антигенпредставляющие клетки представляет АГ-детерминанты Тхелперу, который, активировавшись, секретирует различные лимфокины (регуляторные молекулы иммунной системы) и, тем самым, дает В-клетке дополнительный сигнал, идущий в конечном счете, от антигена же.
 ВНУТРЕННИЕ ПРИЧИНЫ ПРОГРЕССИВНОЙ ЭВОЛЮЦИИ ИММУННОЙ СИСТЕМЫ. • Зачем нужен второй сигнал, почему бы Вклетке не проходить весь путь от стадии покоящейся клетки до АОК, проконтактировав только с АГ? • В свете изложенных выше соображений легко увидеть, что если бы этот «oднocигнaльный» , путь был реализован, то в организмах с большим количеством эффекторных лимфоцитов с широким спектром специфичностей события СА могли бы приводить к достаточно частым неприятностям.
ВНУТРЕННИЕ ПРИЧИНЫ ПРОГРЕССИВНОЙ ЭВОЛЮЦИИ ИММУННОЙ СИСТЕМЫ. • Зачем нужен второй сигнал, почему бы Вклетке не проходить весь путь от стадии покоящейся клетки до АОК, проконтактировав только с АГ? • В свете изложенных выше соображений легко увидеть, что если бы этот «oднocигнaльный» , путь был реализован, то в организмах с большим количеством эффекторных лимфоцитов с широким спектром специфичностей события СА могли бы приводить к достаточно частым неприятностям.
 ВНУТРЕННИЕ ПРИЧИНЫ ПРОГРЕССИВНОЙ ЭВОЛЮЦИИ ИММУННОЙ СИСТЕМЫ. • Приобретение в процессе эволюции системы Т-хелперов и, соответственно, необходимость дополнительного сигнала от них для последующего развития минимизируют негативные последствия для организма от случаев СА.
ВНУТРЕННИЕ ПРИЧИНЫ ПРОГРЕССИВНОЙ ЭВОЛЮЦИИ ИММУННОЙ СИСТЕМЫ. • Приобретение в процессе эволюции системы Т-хелперов и, соответственно, необходимость дополнительного сигнала от них для последующего развития минимизируют негативные последствия для организма от случаев СА.
 ВНУТРЕННИЕ ПРИЧИНЫ ПРОГРЕССИВНОЙ ЭВОЛЮЦИИ ИММУННОЙ СИСТЕМЫ. • Клетки-регуляторы, подавляющие иммунный ответ, не могут эффективно ингибировать спонтанно активировавшийся лимфоцит-эффектор, если они АГ - специфические, т. к. в этом случае АГ отсутствует и они не инициируются к супрессии. Если же эти клетки-регуляторы АГ- неспецифические, то они должны (как это происходит в реальных иммунных системах) ингибировать лишь конечные стадии иммунного ответа (чтобы не мешать нормальному иммунному ответу на реальный антиген) и, следовательно, не мешают и спонтанно активировавшимся лимфоцитам.
ВНУТРЕННИЕ ПРИЧИНЫ ПРОГРЕССИВНОЙ ЭВОЛЮЦИИ ИММУННОЙ СИСТЕМЫ. • Клетки-регуляторы, подавляющие иммунный ответ, не могут эффективно ингибировать спонтанно активировавшийся лимфоцит-эффектор, если они АГ - специфические, т. к. в этом случае АГ отсутствует и они не инициируются к супрессии. Если же эти клетки-регуляторы АГ- неспецифические, то они должны (как это происходит в реальных иммунных системах) ингибировать лишь конечные стадии иммунного ответа (чтобы не мешать нормальному иммунному ответу на реальный антиген) и, следовательно, не мешают и спонтанно активировавшимся лимфоцитам.
 ВНУТРЕННИЕ ПРИЧИНЫ ПРОГРЕССИВНОЙ ЭВОЛЮЦИИ ИММУННОЙ СИСТЕМЫ. • Если мы предполагаем, что В-клетка может претерпевать СА, то такую же возможность следует предположить и для Т-хелперов. Однако, это никак существенно не влияет на ситуацию. Событие СА для Т-хелперов будет состоять в том, что клетка активируется и, в отсутствие реального АГ, начнет "помогать" переходу В 0 -лимфоцита в стадию Вμ и в стадию Вγ.
ВНУТРЕННИЕ ПРИЧИНЫ ПРОГРЕССИВНОЙ ЭВОЛЮЦИИ ИММУННОЙ СИСТЕМЫ. • Если мы предполагаем, что В-клетка может претерпевать СА, то такую же возможность следует предположить и для Т-хелперов. Однако, это никак существенно не влияет на ситуацию. Событие СА для Т-хелперов будет состоять в том, что клетка активируется и, в отсутствие реального АГ, начнет "помогать" переходу В 0 -лимфоцита в стадию Вμ и в стадию Вγ.
 ВНУТРЕННИЕ ПРИЧИНЫ ПРОГРЕССИВНОЙ ЭВОЛЮЦИИ ИММУННОЙ СИСТЕМЫ. • Если считать действие хелперных факторов неспецифичным относительно AГ (Т-хелпер, активированный одним АГ может "помочь" Влимфоцитам активированным другими АГ), то в случае, если две спонтанно активировавшиеся клетки - В-лимфоцит и Тхелпер окажутся достаточно близко друг от друга, В-клетка пройдет все стадии пролиферации и дифференциации вплоть до АОК. Однако вероятность этого события пренебрежимо мала
ВНУТРЕННИЕ ПРИЧИНЫ ПРОГРЕССИВНОЙ ЭВОЛЮЦИИ ИММУННОЙ СИСТЕМЫ. • Если считать действие хелперных факторов неспецифичным относительно AГ (Т-хелпер, активированный одним АГ может "помочь" Влимфоцитам активированным другими АГ), то в случае, если две спонтанно активировавшиеся клетки - В-лимфоцит и Тхелпер окажутся достаточно близко друг от друга, В-клетка пройдет все стадии пролиферации и дифференциации вплоть до АОК. Однако вероятность этого события пренебрежимо мала
 ВНУТРЕННИЕ ПРИЧИНЫ ПРОГРЕССИВНОЙ ЭВОЛЮЦИИ ИММУННОЙ СИСТЕМЫ. • Если же рассматривать "помощь" Т-хелперов как специфический процесс, то вероятность того, что два лимфоцита: Т- и В-клетки с одинаковой специфичностью спонтанно активируются одновременно и окажутся рядом друг с другом, представляется совершенно ничтожной. • Всю вышеизложенную логику можно применить и к Т-клеточному иммунному ответу, где также через Т-хелперы передается второй сигнал от АГ к клеткам- предшественникам цитотоксических Т-клеток.
ВНУТРЕННИЕ ПРИЧИНЫ ПРОГРЕССИВНОЙ ЭВОЛЮЦИИ ИММУННОЙ СИСТЕМЫ. • Если же рассматривать "помощь" Т-хелперов как специфический процесс, то вероятность того, что два лимфоцита: Т- и В-клетки с одинаковой специфичностью спонтанно активируются одновременно и окажутся рядом друг с другом, представляется совершенно ничтожной. • Всю вышеизложенную логику можно применить и к Т-клеточному иммунному ответу, где также через Т-хелперы передается второй сигнал от АГ к клеткам- предшественникам цитотоксических Т-клеток.
 ВНУТРЕННИЕ ПРИЧИНЫ ПРОГРЕССИВНОЙ ЭВОЛЮЦИИ ИММУННОЙ СИСТЕМЫ. • Таким образом, по излагаемой гипотезе, организм, приобретший в своем эволюционном развитии иммунную систему состоящую из достаточно большого количества клеток, ставится перед фактом возможности СA своих эффекторных клеток. В этом случае приобретение подсистемы, ставящей "барьер" на пути ускоренного размножения и дифференциации СА клонов (в рассмотренном случае барьер заключается в отсутствии "помощи" от Т-хелперов) было бы явно адаптивно, поскольку минимизировало бы отрицательные последствия событий СА.
ВНУТРЕННИЕ ПРИЧИНЫ ПРОГРЕССИВНОЙ ЭВОЛЮЦИИ ИММУННОЙ СИСТЕМЫ. • Таким образом, по излагаемой гипотезе, организм, приобретший в своем эволюционном развитии иммунную систему состоящую из достаточно большого количества клеток, ставится перед фактом возможности СA своих эффекторных клеток. В этом случае приобретение подсистемы, ставящей "барьер" на пути ускоренного размножения и дифференциации СА клонов (в рассмотренном случае барьер заключается в отсутствии "помощи" от Т-хелперов) было бы явно адаптивно, поскольку минимизировало бы отрицательные последствия событий СА.
 ВНУТРЕННИЕ ПРИЧИНЫ ПРОГРЕССИВНОЙ ЭВОЛЮЦИИ ИММУННОЙ СИСТЕМЫ. • При этом приобретение такой подсистемы стимулировалось бы свойствами самой системы ее величиной и сложностью функционирования (при неизменных внешних условиях существования). • Аналогичную "страховку" системы от случайных "сбоев" можно увидеть в организации нервных центров спинного мозга, т. е. центров, куда сходятся сигналы от периферийных рецепторов. • Также "страховку" системы от случайных "сбоев" можно наблюдать и в социальных системах.
ВНУТРЕННИЕ ПРИЧИНЫ ПРОГРЕССИВНОЙ ЭВОЛЮЦИИ ИММУННОЙ СИСТЕМЫ. • При этом приобретение такой подсистемы стимулировалось бы свойствами самой системы ее величиной и сложностью функционирования (при неизменных внешних условиях существования). • Аналогичную "страховку" системы от случайных "сбоев" можно увидеть в организации нервных центров спинного мозга, т. е. центров, куда сходятся сигналы от периферийных рецепторов. • Также "страховку" системы от случайных "сбоев" можно наблюдать и в социальных системах.
 ВИРУСНАЯ ИНФЕКЦИЯ КАК ФАКТОР ПРОГРЕССИВНОЙ ДИВЕРГЕНЦИИ ИММУННОЙ СИСТЕМЫ В ХОДЕ ЭВОЛЮЦИИ • Одним из факторов, относительно которого следует оценивать адаптивность конкретных особенностей молекулярной организации иммунной системы, являются инфекционные микроорганизмы и прежде всего вирусы и бактерии. Этот фактор относится к числу эволюционно наиболее древних, постоянно действовавших факторов
ВИРУСНАЯ ИНФЕКЦИЯ КАК ФАКТОР ПРОГРЕССИВНОЙ ДИВЕРГЕНЦИИ ИММУННОЙ СИСТЕМЫ В ХОДЕ ЭВОЛЮЦИИ • Одним из факторов, относительно которого следует оценивать адаптивность конкретных особенностей молекулярной организации иммунной системы, являются инфекционные микроорганизмы и прежде всего вирусы и бактерии. Этот фактор относится к числу эволюционно наиболее древних, постоянно действовавших факторов
 ВИРУСНАЯ ИНФЕКЦИЯ КАК ФАКТОР ПРОГРЕССИВНОЙ ДИВЕРГЕНЦИИ ИММУННОЙ СИСТЕМЫ В ХОДЕ ЭВОЛЮЦИИ • В контексте проблемы анализа возможных селективных факторов прогрессивной эволюции (от более простой к более сложной) иммунной системы особенно интересной представляется ситуация, когда вирусы и другие инфекционные микроорганизмы (микобактерии, простейшие и т. п. ) в качестве мишени поражают непосредственно клетки самой иммунной системы.
ВИРУСНАЯ ИНФЕКЦИЯ КАК ФАКТОР ПРОГРЕССИВНОЙ ДИВЕРГЕНЦИИ ИММУННОЙ СИСТЕМЫ В ХОДЕ ЭВОЛЮЦИИ • В контексте проблемы анализа возможных селективных факторов прогрессивной эволюции (от более простой к более сложной) иммунной системы особенно интересной представляется ситуация, когда вирусы и другие инфекционные микроорганизмы (микобактерии, простейшие и т. п. ) в качестве мишени поражают непосредственно клетки самой иммунной системы.
 ВИРУСНАЯ ИНФЕКЦИЯ КАК ФАКТОР ПРОГРЕССИВНОЙ ДИВЕРГЕНЦИИ ИММУННОЙ СИСТЕМЫ В ХОДЕ ЭВОЛЮЦИИ • Для иммуноцитов современных позвоночных таких инфекций известно немало: лимфоцитарный хориоменингит, полимиелит, грипп, лейкемия Френда, алеутская болезнь норок; инфекции вызванные цитомегаловирусом мышей, вирусами Денге 2, простого герпеса и т. п. Широко известен вирус — возбудитель СПИДа (AIDS). Повидимому, любая популяция или субпопуляция клеток иммунной системы может стать прямой мишенью для подобных инфекций.
ВИРУСНАЯ ИНФЕКЦИЯ КАК ФАКТОР ПРОГРЕССИВНОЙ ДИВЕРГЕНЦИИ ИММУННОЙ СИСТЕМЫ В ХОДЕ ЭВОЛЮЦИИ • Для иммуноцитов современных позвоночных таких инфекций известно немало: лимфоцитарный хориоменингит, полимиелит, грипп, лейкемия Френда, алеутская болезнь норок; инфекции вызванные цитомегаловирусом мышей, вирусами Денге 2, простого герпеса и т. п. Широко известен вирус — возбудитель СПИДа (AIDS). Повидимому, любая популяция или субпопуляция клеток иммунной системы может стать прямой мишенью для подобных инфекций.
 ВИРУСНАЯ ИНФЕКЦИЯ КАК ФАКТОР ПРОГРЕССИВНОЙ ДИВЕРГЕНЦИИ ИММУННОЙ СИСТЕМЫ В ХОДЕ ЭВОЛЮЦИИ • Математическая модель именно таких инфекций, в которых некий «обобщенный» вирус (любая внутриклеточная инфекция) поражает клетки некой эволюционно древней иммунной системы, позволяет выяснить, существуют ли (и какие) способы противостоять столь опасным для организма-хозяина инфекциям
ВИРУСНАЯ ИНФЕКЦИЯ КАК ФАКТОР ПРОГРЕССИВНОЙ ДИВЕРГЕНЦИИ ИММУННОЙ СИСТЕМЫ В ХОДЕ ЭВОЛЮЦИИ • Математическая модель именно таких инфекций, в которых некий «обобщенный» вирус (любая внутриклеточная инфекция) поражает клетки некой эволюционно древней иммунной системы, позволяет выяснить, существуют ли (и какие) способы противостоять столь опасным для организма-хозяина инфекциям
 ВИРУСНАЯ ИНФЕКЦИЯ КАК ФАКТОР ПРОГРЕССИВНОЙ ДИВЕРГЕНЦИИ ИММУННОЙ СИСТЕМЫ В ХОДЕ ЭВОЛЮЦИИ • Модель рассматривает гипотетический предковый организм с примитивной, слабо дифференцированной иммунной системой. Предположим, что соответствующие предковые иммунные клетки (пралимфоциты) в процессе онтогенеза переходят из состояния незрелости (незрелые пралимфоциты - НП) в зрелое состояние (зрелые пралимфоциты – ЗП). Всюду в дальнейшем будем говорить о вирусных инфекциях данной иммунной системы, имея, однако, в виду, что и любые другие инфекции (см. выше) подобного рода описываются таким же образом.
ВИРУСНАЯ ИНФЕКЦИЯ КАК ФАКТОР ПРОГРЕССИВНОЙ ДИВЕРГЕНЦИИ ИММУННОЙ СИСТЕМЫ В ХОДЕ ЭВОЛЮЦИИ • Модель рассматривает гипотетический предковый организм с примитивной, слабо дифференцированной иммунной системой. Предположим, что соответствующие предковые иммунные клетки (пралимфоциты) в процессе онтогенеза переходят из состояния незрелости (незрелые пралимфоциты - НП) в зрелое состояние (зрелые пралимфоциты – ЗП). Всюду в дальнейшем будем говорить о вирусных инфекциях данной иммунной системы, имея, однако, в виду, что и любые другие инфекции (см. выше) подобного рода описываются таким же образом.
 ВИРУСНАЯ ИНФЕКЦИЯ КАК ФАКТОР ПРОГРЕССИВНОЙ ДИВЕРГЕНЦИИ ИММУННОЙ СИСТЕМЫ В ХОДЕ ЭВОЛЮЦИИ • Предположим также, что вирусы способны поражать только клетки НП, т. е. незрелые пралимфоциты. Будем считать при этом, что молекулярно-генетическая система иммунитета предельно проста, а именно для адсорбции вирус использует тот самый рецептор клетки НП, которым клетки типа ЗП в свою очередь опознают и инактивируют вирусы. Адсорбция вируса на НП ведет к образованию зараженных клеток из которых путем лизиса выходят дочерние вирусы частицы. Связывание ЗП с вирусом, напротив, приводит к уничтожению вирусов.
ВИРУСНАЯ ИНФЕКЦИЯ КАК ФАКТОР ПРОГРЕССИВНОЙ ДИВЕРГЕНЦИИ ИММУННОЙ СИСТЕМЫ В ХОДЕ ЭВОЛЮЦИИ • Предположим также, что вирусы способны поражать только клетки НП, т. е. незрелые пралимфоциты. Будем считать при этом, что молекулярно-генетическая система иммунитета предельно проста, а именно для адсорбции вирус использует тот самый рецептор клетки НП, которым клетки типа ЗП в свою очередь опознают и инактивируют вирусы. Адсорбция вируса на НП ведет к образованию зараженных клеток из которых путем лизиса выходят дочерние вирусы частицы. Связывание ЗП с вирусом, напротив, приводит к уничтожению вирусов.
 ВИРУСНАЯ ИНФЕКЦИЯ КАК ФАКТОР ПРОГРЕССИВНОЙ ДИВЕРГЕНЦИИ ИММУННОЙ СИСТЕМЫ В ХОДЕ ЭВОЛЮЦИИ • Эта разница в свойствах клеток ЗП и НП может быть объяснена различными способами. Например, пралимфоциты могли обладать способностью фагоцитировать вирусные частицы, но зрелые клетки разрушали их с помощью нуклеаз или/и протеаз, а в незрелых клетках соответствующие ферменты либо еще не синтезировались, либо были неактивны. • Возможна в некотором роде обратная ситуация, когда зрелый пралимфоцит «сбрасывает» с поверхности связанный с вирусом рецептор, избегая тем самым заражения и инактивируя вирус.
ВИРУСНАЯ ИНФЕКЦИЯ КАК ФАКТОР ПРОГРЕССИВНОЙ ДИВЕРГЕНЦИИ ИММУННОЙ СИСТЕМЫ В ХОДЕ ЭВОЛЮЦИИ • Эта разница в свойствах клеток ЗП и НП может быть объяснена различными способами. Например, пралимфоциты могли обладать способностью фагоцитировать вирусные частицы, но зрелые клетки разрушали их с помощью нуклеаз или/и протеаз, а в незрелых клетках соответствующие ферменты либо еще не синтезировались, либо были неактивны. • Возможна в некотором роде обратная ситуация, когда зрелый пралимфоцит «сбрасывает» с поверхности связанный с вирусом рецептор, избегая тем самым заражения и инактивируя вирус.
 ВИРУСНАЯ ИНФЕКЦИЯ КАК ФАКТОР ПРОГРЕССИВНОЙ ДИВЕРГЕНЦИИ ИММУННОЙ СИСТЕМЫ В ХОДЕ ЭВОЛЮЦИИ • Данная модель описывает процессы, в общем аналогичные тем, которые происходят в тимусе млекопитающих или в бурсе птиц. И в том, и в другом органе предшественники лимфоцитов, пришедшие из костного мозга, размножаются и созревают в отсутствие антигенов. Зрелые лимфоциты секретируются наружу и заселяют периферические лимфоидные органы. Однако в целом модель не описывает современную иммунную систему высших позвоночных, а является описанием лишь тех простых систем защиты, которые могли существовать на ранних этапах эволюции.
ВИРУСНАЯ ИНФЕКЦИЯ КАК ФАКТОР ПРОГРЕССИВНОЙ ДИВЕРГЕНЦИИ ИММУННОЙ СИСТЕМЫ В ХОДЕ ЭВОЛЮЦИИ • Данная модель описывает процессы, в общем аналогичные тем, которые происходят в тимусе млекопитающих или в бурсе птиц. И в том, и в другом органе предшественники лимфоцитов, пришедшие из костного мозга, размножаются и созревают в отсутствие антигенов. Зрелые лимфоциты секретируются наружу и заселяют периферические лимфоидные органы. Однако в целом модель не описывает современную иммунную систему высших позвоночных, а является описанием лишь тех простых систем защиты, которые могли существовать на ранних этапах эволюции.
 ВИРУСНАЯ ИНФЕКЦИЯ КАК ФАКТОР ПРОГРЕССИВНОЙ ДИВЕРГЕНЦИИ ИММУННОЙ СИСТЕМЫ В ХОДЕ ЭВОЛЮЦИИ • Итак, рассмотрим гипотетический предковый организм с примитивной, слабо дифференцированной иммунной системой. Обозначив символами L, V, Z, Т концентрации соответственно незрелых пралимфоцитов, вирусов, зараженных клеток и зрелых пралимфоцитов, запишем следующую систему дифференциальных уравнений динамики:
ВИРУСНАЯ ИНФЕКЦИЯ КАК ФАКТОР ПРОГРЕССИВНОЙ ДИВЕРГЕНЦИИ ИММУННОЙ СИСТЕМЫ В ХОДЕ ЭВОЛЮЦИИ • Итак, рассмотрим гипотетический предковый организм с примитивной, слабо дифференцированной иммунной системой. Обозначив символами L, V, Z, Т концентрации соответственно незрелых пралимфоцитов, вирусов, зараженных клеток и зрелых пралимфоцитов, запишем следующую систему дифференциальных уравнений динамики:
 ВИРУСНАЯ ИНФЕКЦИЯ КАК ФАКТОР ПРОГРЕССИВНОЙ ДИВЕРГЕНЦИИ ИММУННОЙ СИСТЕМЫ В ХОДЕ ЭВОЛЮЦИИ
ВИРУСНАЯ ИНФЕКЦИЯ КАК ФАКТОР ПРОГРЕССИВНОЙ ДИВЕРГЕНЦИИ ИММУННОЙ СИСТЕМЫ В ХОДЕ ЭВОЛЮЦИИ
 ВИРУСНАЯ ИНФЕКЦИЯ КАК ФАКТОР ПРОГРЕССИВНОЙ ДИВЕРГЕНЦИИ ИММУННОЙ СИСТЕМЫ В ХОДЕ ЭВОЛЮЦИИ • Здесь F(L)—функция, описывающая скорость размножения незрелых пралимфоцитов. Количество локальных минимумов и максимумов не ограничено, хотя из биологических соображений наиболее правдоподобно выглядит «одногорбый» вид функции F(L). Функция F(L) может иметь, например, вид F(L)=s. L—r. L 2 s, r>0. Функция G(L, V) описывает скорость заражения незрелых пралимфоцитов L вирусами V. Явный вид функции G(L, V) может быть, например, таким: G(L, V)=c. LV, c>0.
ВИРУСНАЯ ИНФЕКЦИЯ КАК ФАКТОР ПРОГРЕССИВНОЙ ДИВЕРГЕНЦИИ ИММУННОЙ СИСТЕМЫ В ХОДЕ ЭВОЛЮЦИИ • Здесь F(L)—функция, описывающая скорость размножения незрелых пралимфоцитов. Количество локальных минимумов и максимумов не ограничено, хотя из биологических соображений наиболее правдоподобно выглядит «одногорбый» вид функции F(L). Функция F(L) может иметь, например, вид F(L)=s. L—r. L 2 s, r>0. Функция G(L, V) описывает скорость заражения незрелых пралимфоцитов L вирусами V. Явный вид функции G(L, V) может быть, например, таким: G(L, V)=c. LV, c>0.
 ВИРУСНАЯ ИНФЕКЦИЯ КАК ФАКТОР ПРОГРЕССИВНОЙ ДИВЕРГЕНЦИИ ИММУННОЙ СИСТЕМЫ В ХОДЕ ЭВОЛЮЦИИ Примерный вид функций F(L) и G(L, V). Вид функции Q(T, V) аналогичен виду G(L, V).
ВИРУСНАЯ ИНФЕКЦИЯ КАК ФАКТОР ПРОГРЕССИВНОЙ ДИВЕРГЕНЦИИ ИММУННОЙ СИСТЕМЫ В ХОДЕ ЭВОЛЮЦИИ Примерный вид функций F(L) и G(L, V). Вид функции Q(T, V) аналогичен виду G(L, V).
 ВИРУСНАЯ ИНФЕКЦИЯ КАК ФАКТОР ПРОГРЕССИВНОЙ ДИВЕРГЕНЦИИ ИММУННОЙ СИСТЕМЫ В ХОДЕ ЭВОЛЮЦИИ • Будем анализировать устойчивость к малому возмущению особых точек систем, где все производные равны нулю. Нетривиальные точки покоя, где концентрации всех компонент положительны, не рассматриваются, поскольку отражают состояние хронической болезни, которая рано или поздно все равно кончается либо гибелью, либо выздоровлением организмахозяина, и именно эти крайние альтернативные состояния в основном и оценивает естественный отбор.
ВИРУСНАЯ ИНФЕКЦИЯ КАК ФАКТОР ПРОГРЕССИВНОЙ ДИВЕРГЕНЦИИ ИММУННОЙ СИСТЕМЫ В ХОДЕ ЭВОЛЮЦИИ • Будем анализировать устойчивость к малому возмущению особых точек систем, где все производные равны нулю. Нетривиальные точки покоя, где концентрации всех компонент положительны, не рассматриваются, поскольку отражают состояние хронической болезни, которая рано или поздно все равно кончается либо гибелью, либо выздоровлением организмахозяина, и именно эти крайние альтернативные состояния в основном и оценивает естественный отбор.
 ВИРУСНАЯ ИНФЕКЦИЯ КАК ФАКТОР ПРОГРЕССИВНОЙ ДИВЕРГЕНЦИИ ИММУННОЙ СИСТЕМЫ В ХОДЕ ЭВОЛЮЦИИ • Система имеет полутривиальные точки покоя: I — (0, , 0, 0), — произвольное (может быть =0); II — ( , 0, 0, ), где = a/k , a — корень уравнения F(L)=a. L • Первая точка соответствует состоянию «смерти» популяции пралимфоцитов в очаге инфекции, вторая – здоровому состоянию организма.
ВИРУСНАЯ ИНФЕКЦИЯ КАК ФАКТОР ПРОГРЕССИВНОЙ ДИВЕРГЕНЦИИ ИММУННОЙ СИСТЕМЫ В ХОДЕ ЭВОЛЮЦИИ • Система имеет полутривиальные точки покоя: I — (0, , 0, 0), — произвольное (может быть =0); II — ( , 0, 0, ), где = a/k , a — корень уравнения F(L)=a. L • Первая точка соответствует состоянию «смерти» популяции пралимфоцитов в очаге инфекции, вторая – здоровому состоянию организма.
 ВИРУСНАЯ ИНФЕКЦИЯ КАК ФАКТОР ПРОГРЕССИВНОЙ ДИВЕРГЕНЦИИ ИММУННОЙ СИСТЕМЫ В ХОДЕ ЭВОЛЮЦИИ • Анализ локальной устойчивости точки I показывает, что, если в очаге заражения накопилось мало вирусов и/или они недостаточно инфекционны, а скорость размножения незрелых пралимфоцитов достаточно велика, то поступление извне в очаг инфекции новых клеток типа L позволит им размножиться и восстановить популяцию
ВИРУСНАЯ ИНФЕКЦИЯ КАК ФАКТОР ПРОГРЕССИВНОЙ ДИВЕРГЕНЦИИ ИММУННОЙ СИСТЕМЫ В ХОДЕ ЭВОЛЮЦИИ • Анализ локальной устойчивости точки I показывает, что, если в очаге заражения накопилось мало вирусов и/или они недостаточно инфекционны, а скорость размножения незрелых пралимфоцитов достаточно велика, то поступление извне в очаг инфекции новых клеток типа L позволит им размножиться и восстановить популяцию
 ВИРУСНАЯ ИНФЕКЦИЯ КАК ФАКТОР ПРОГРЕССИВНОЙ ДИВЕРГЕНЦИИ ИММУННОЙ СИСТЕМЫ В ХОДЕ ЭВОЛЮЦИИ • Локальная устойчивость или неустойчивость точки II системы имеет биологический смысл устойчивости или неустойчивости этой пралимфоидной ткани против малой инфекции. Естественно предположить, что организм, улучшающий свою устойчивость против инфекции, получает селективное преимущество.
ВИРУСНАЯ ИНФЕКЦИЯ КАК ФАКТОР ПРОГРЕССИВНОЙ ДИВЕРГЕНЦИИ ИММУННОЙ СИСТЕМЫ В ХОДЕ ЭВОЛЮЦИИ • Локальная устойчивость или неустойчивость точки II системы имеет биологический смысл устойчивости или неустойчивости этой пралимфоидной ткани против малой инфекции. Естественно предположить, что организм, улучшающий свою устойчивость против инфекции, получает селективное преимущество.
 ВИРУСНАЯ ИНФЕКЦИЯ КАК ФАКТОР ПРОГРЕССИВНОЙ ДИВЕРГЕНЦИИ ИММУННОЙ СИСТЕМЫ В ХОДЕ ЭВОЛЮЦИИ • Точка II устойчива, если и неустойчива, если Случай строгого равенства не рассматривается по причине его биологической нереальности. • Таким образом, увеличения устойчивости состояния II (фактически состояния «здоровья» ) можно достигнуть за счет увеличения значения QV'( , 0) и/или уменьшения значения GV'( , 0).
ВИРУСНАЯ ИНФЕКЦИЯ КАК ФАКТОР ПРОГРЕССИВНОЙ ДИВЕРГЕНЦИИ ИММУННОЙ СИСТЕМЫ В ХОДЕ ЭВОЛЮЦИИ • Точка II устойчива, если и неустойчива, если Случай строгого равенства не рассматривается по причине его биологической нереальности. • Таким образом, увеличения устойчивости состояния II (фактически состояния «здоровья» ) можно достигнуть за счет увеличения значения QV'( , 0) и/или уменьшения значения GV'( , 0).
 ВИРУСНАЯ ИНФЕКЦИЯ КАК ФАКТОР ПРОГРЕССИВНОЙ ДИВЕРГЕНЦИИ ИММУННОЙ СИСТЕМЫ В ХОДЕ ЭВОЛЮЦИИ • Значение w зависит от вируса и, по предположению, не изменяется иммунной системой. В свою очередь усиление связывания вирусов зрелыми пралимфоцитами (QV'( , 0)) может быть достигнуто как увеличением стационарной концентрации , так и увеличением сродства рецепторов клетки Т к вирусу V. Аналогичным образом ослабить связь вирусов с незрелыми пралимфоцитами (GV'( , 0)) можно как через уменьшение стационарной концентрации , так и снизив сродство рецепторов клетки L к вирусу V
ВИРУСНАЯ ИНФЕКЦИЯ КАК ФАКТОР ПРОГРЕССИВНОЙ ДИВЕРГЕНЦИИ ИММУННОЙ СИСТЕМЫ В ХОДЕ ЭВОЛЮЦИИ • Значение w зависит от вируса и, по предположению, не изменяется иммунной системой. В свою очередь усиление связывания вирусов зрелыми пралимфоцитами (QV'( , 0)) может быть достигнуто как увеличением стационарной концентрации , так и увеличением сродства рецепторов клетки Т к вирусу V. Аналогичным образом ослабить связь вирусов с незрелыми пралимфоцитами (GV'( , 0)) можно как через уменьшение стационарной концентрации , так и снизив сродство рецепторов клетки L к вирусу V
 ВИРУСНАЯ ИНФЕКЦИЯ КАК ФАКТОР ПРОГРЕССИВНОЙ ДИВЕРГЕНЦИИ ИММУННОЙ СИСТЕМЫ В ХОДЕ ЭВОЛЮЦИИ • Однако поскольку единственным источником зрелых пралимфоцитов являются незрелые, то при уменьшении будет уменьшается и. Для увеличения же необходимо увеличивать , причем как видно из рисунка,
ВИРУСНАЯ ИНФЕКЦИЯ КАК ФАКТОР ПРОГРЕССИВНОЙ ДИВЕРГЕНЦИИ ИММУННОЙ СИСТЕМЫ В ХОДЕ ЭВОЛЮЦИИ • Однако поскольку единственным источником зрелых пралимфоцитов являются незрелые, то при уменьшении будет уменьшается и. Для увеличения же необходимо увеличивать , причем как видно из рисунка,
 ВИРУСНАЯ ИНФЕКЦИЯ КАК ФАКТОР ПРОГРЕССИВНОЙ ДИВЕРГЕНЦИИ ИММУННОЙ СИСТЕМЫ В ХОДЕ ЭВОЛЮЦИИ • Таким образом, в рамках данной модели единственным удачным решением проблемы стало бы приобретение рецепторов L и Т с различной авидностью к V. По сути дела это означает, что необходимо обеспечить пралимфоцитам смену АГ-специфичных рецепторов в процессе онтогенеза, причем у рецепторов, экспрессирующихся позднее, специфичность к АГ должна быть выше.
ВИРУСНАЯ ИНФЕКЦИЯ КАК ФАКТОР ПРОГРЕССИВНОЙ ДИВЕРГЕНЦИИ ИММУННОЙ СИСТЕМЫ В ХОДЕ ЭВОЛЮЦИИ • Таким образом, в рамках данной модели единственным удачным решением проблемы стало бы приобретение рецепторов L и Т с различной авидностью к V. По сути дела это означает, что необходимо обеспечить пралимфоцитам смену АГ-специфичных рецепторов в процессе онтогенеза, причем у рецепторов, экспрессирующихся позднее, специфичность к АГ должна быть выше.
 ВИРУСНАЯ ИНФЕКЦИЯ КАК ФАКТОР ПРОГРЕССИВНОЙ ДИВЕРГЕНЦИИ ИММУННОЙ СИСТЕМЫ В ХОДЕ ЭВОЛЮЦИИ • Возможность стимулированной АГ пролиферации зрелых пралимфоцитов вывода не меняет, как показывает исследование соответственно модифицированной модели. Все приведенные выше рассуждения остаются в силе и в более сложном случае, когда вирус несет сразу несколько АГ-детерминант и соответственно защитная система пралимфоцитов способна на каждую АГдетерминанту вируса реагировать специфичным клоном.
ВИРУСНАЯ ИНФЕКЦИЯ КАК ФАКТОР ПРОГРЕССИВНОЙ ДИВЕРГЕНЦИИ ИММУННОЙ СИСТЕМЫ В ХОДЕ ЭВОЛЮЦИИ • Возможность стимулированной АГ пролиферации зрелых пралимфоцитов вывода не меняет, как показывает исследование соответственно модифицированной модели. Все приведенные выше рассуждения остаются в силе и в более сложном случае, когда вирус несет сразу несколько АГ-детерминант и соответственно защитная система пралимфоцитов способна на каждую АГдетерминанту вируса реагировать специфичным клоном.
 ВИРУСНАЯ ИНФЕКЦИЯ КАК ФАКТОР ПРОГРЕССИВНОЙ ДИВЕРГЕНЦИИ ИММУННОЙ СИСТЕМЫ В ХОДЕ ЭВОЛЮЦИИ • Таким образом, к сравнительно просто организованной иммунной системе, отвечающей ранним этапам ее эволюции, предъявляются требования взаимно исключающие друга. С одной стороны, чем точнее будет опознаваться чужеродный (например, вирусный) АГ, тем эффективнее будет происходить инактивация этих вирусов с помощью соответствующих рецепторов пралимфоцитов, но с другой — чем эффективнее идет адсорбция вируса на пралимфоцитахмишенях, тем больше опасность их гибели.
ВИРУСНАЯ ИНФЕКЦИЯ КАК ФАКТОР ПРОГРЕССИВНОЙ ДИВЕРГЕНЦИИ ИММУННОЙ СИСТЕМЫ В ХОДЕ ЭВОЛЮЦИИ • Таким образом, к сравнительно просто организованной иммунной системе, отвечающей ранним этапам ее эволюции, предъявляются требования взаимно исключающие друга. С одной стороны, чем точнее будет опознаваться чужеродный (например, вирусный) АГ, тем эффективнее будет происходить инактивация этих вирусов с помощью соответствующих рецепторов пралимфоцитов, но с другой — чем эффективнее идет адсорбция вируса на пралимфоцитахмишенях, тем больше опасность их гибели.
 ВИРУСНАЯ ИНФЕКЦИЯ КАК ФАКТОР ПРОГРЕССИВНОЙ ДИВЕРГЕНЦИИ ИММУННОЙ СИСТЕМЫ В ХОДЕ ЭВОЛЮЦИИ • Повысить устойчивость пралимфоидной системы к малой инфекции можно (в рамках указанных упрощений) двумя способами. Первый — через увеличение количества клонов пралимфоцитов, специфичных к разным АГ-детерминантам, второй — путем изменения авидности АГспецифичного рецептора в ходе созревания пралимфоцитов.
ВИРУСНАЯ ИНФЕКЦИЯ КАК ФАКТОР ПРОГРЕССИВНОЙ ДИВЕРГЕНЦИИ ИММУННОЙ СИСТЕМЫ В ХОДЕ ЭВОЛЮЦИИ • Повысить устойчивость пралимфоидной системы к малой инфекции можно (в рамках указанных упрощений) двумя способами. Первый — через увеличение количества клонов пралимфоцитов, специфичных к разным АГ-детерминантам, второй — путем изменения авидности АГспецифичного рецептора в ходе созревания пралимфоцитов.
 ВИРУСНАЯ ИНФЕКЦИЯ КАК ФАКТОР ПРОГРЕССИВНОЙ ДИВЕРГЕНЦИИ ИММУННОЙ СИСТЕМЫ В ХОДЕ ЭВОЛЮЦИИ • В рассмотренном случае рецепторы должны быть похожи друг на друга, но не слишком: похожи, чтобы зрелый пралимфоцит как можно лучше опознавал вирус, не слишком, чтобы вирус как можно хуже опознавал незрелый пралимфоцит. Второй способ представляется особенно действенным в условиях слабодифференцированной иммунной системы, способной опознавать ограниченный круг АГ-детерминант.
ВИРУСНАЯ ИНФЕКЦИЯ КАК ФАКТОР ПРОГРЕССИВНОЙ ДИВЕРГЕНЦИИ ИММУННОЙ СИСТЕМЫ В ХОДЕ ЭВОЛЮЦИИ • В рассмотренном случае рецепторы должны быть похожи друг на друга, но не слишком: похожи, чтобы зрелый пралимфоцит как можно лучше опознавал вирус, не слишком, чтобы вирус как можно хуже опознавал незрелый пралимфоцит. Второй способ представляется особенно действенным в условиях слабодифференцированной иммунной системы, способной опознавать ограниченный круг АГ-детерминант.
 ВИРУСНАЯ ИНФЕКЦИЯ КАК ФАКТОР ПРОГРЕССИВНОЙ ДИВЕРГЕНЦИИ ИММУННОЙ СИСТЕМЫ В ХОДЕ ЭВОЛЮЦИИ • Обе эти возможности были реализованы в процессе эволюции. Наличие большого числа АГ-специфичных клонов лимфоцитов у современных высших позвоночных — факт, признаваемый всеми современными теориями иммунитета. У мыши, например, насчитывается ~108 клонов Влимфоцитов разной специфичности
ВИРУСНАЯ ИНФЕКЦИЯ КАК ФАКТОР ПРОГРЕССИВНОЙ ДИВЕРГЕНЦИИ ИММУННОЙ СИСТЕМЫ В ХОДЕ ЭВОЛЮЦИИ • Обе эти возможности были реализованы в процессе эволюции. Наличие большого числа АГ-специфичных клонов лимфоцитов у современных высших позвоночных — факт, признаваемый всеми современными теориями иммунитета. У мыши, например, насчитывается ~108 клонов Влимфоцитов разной специфичности
 ВИРУСНАЯ ИНФЕКЦИЯ КАК ФАКТОР ПРОГРЕССИВНОЙ ДИВЕРГЕНЦИИ ИММУННОЙ СИСТЕМЫ В ХОДЕ ЭВОЛЮЦИИ • Второй способ фактически означает, что в адсорбции вирусов на иммуноцитах-мишенях и вместе с тем в опознании вирусов (вирусных АГ) с последующей их инактивацией и разрушением не могут участвовать в точности идентичные рецепторные молекулы: организм может справиться с инфекцией только тогда, когда эти функции будут выполнять гомологичные, но не идентичные ИГ-подобные белки.
ВИРУСНАЯ ИНФЕКЦИЯ КАК ФАКТОР ПРОГРЕССИВНОЙ ДИВЕРГЕНЦИИ ИММУННОЙ СИСТЕМЫ В ХОДЕ ЭВОЛЮЦИИ • Второй способ фактически означает, что в адсорбции вирусов на иммуноцитах-мишенях и вместе с тем в опознании вирусов (вирусных АГ) с последующей их инактивацией и разрушением не могут участвовать в точности идентичные рецепторные молекулы: организм может справиться с инфекцией только тогда, когда эти функции будут выполнять гомологичные, но не идентичные ИГ-подобные белки.
 ВИРУСНАЯ ИНФЕКЦИЯ КАК ФАКТОР ПРОГРЕССИВНОЙ ДИВЕРГЕНЦИИ ИММУННОЙ СИСТЕМЫ В ХОДЕ ЭВОЛЮЦИИ • Следовательно, стратегическим решением проблемы для жертвы являются мультипликация генов ИГ-подобных рецепторов и последующая коадаптивная дивергенция соответствующих МС на новые подсемейства. В ответ вирусы вынуждены изменяться так, чтобы приобрести способность адсорбироваться на новых иммунорецепторах (и, следовательно, инфицировать новую популяцию иммунных клеток-мишеней).
ВИРУСНАЯ ИНФЕКЦИЯ КАК ФАКТОР ПРОГРЕССИВНОЙ ДИВЕРГЕНЦИИ ИММУННОЙ СИСТЕМЫ В ХОДЕ ЭВОЛЮЦИИ • Следовательно, стратегическим решением проблемы для жертвы являются мультипликация генов ИГ-подобных рецепторов и последующая коадаптивная дивергенция соответствующих МС на новые подсемейства. В ответ вирусы вынуждены изменяться так, чтобы приобрести способность адсорбироваться на новых иммунорецепторах (и, следовательно, инфицировать новую популяцию иммунных клеток-мишеней).
 Роль отрицательного регуляторного контура при разных видах отбора. • Биологические системы являются открытыми неравновесными системами, которые функционируют и воспроизводятся на основе обмена с окружающей средой потоками вещества, энергии и информации. К числу фундаментальных свойств биологических систем, независимо от уровня их сложности и особенностей организации, относится их способность к самовоспроизведению. Под самовоспроизводящейся будем понимать любую систему, способную к воспроизведению своих копий на основе содержащейся в ней наследственной информации.
Роль отрицательного регуляторного контура при разных видах отбора. • Биологические системы являются открытыми неравновесными системами, которые функционируют и воспроизводятся на основе обмена с окружающей средой потоками вещества, энергии и информации. К числу фундаментальных свойств биологических систем, независимо от уровня их сложности и особенностей организации, относится их способность к самовоспроизведению. Под самовоспроизводящейся будем понимать любую систему, способную к воспроизведению своих копий на основе содержащейся в ней наследственной информации.
 • Одноклеточный про- или эукариотический организм представляет из себя СВ-систему минимального уровня сложности, способную к полностью автономному воспроизведению своих копий. • Глобальными СВ-системами иерархически более высоких уровней являются биосфера Земли и ее ноосфера в понимании Вернадского
• Одноклеточный про- или эукариотический организм представляет из себя СВ-систему минимального уровня сложности, способную к полностью автономному воспроизведению своих копий. • Глобальными СВ-системами иерархически более высоких уровней являются биосфера Земли и ее ноосфера в понимании Вернадского
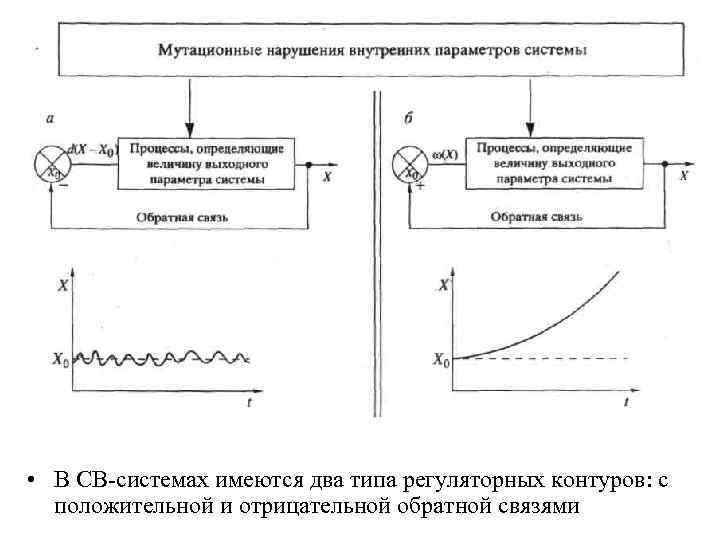 • В СВ-системах имеются два типа регуляторных контуров: с положительной и отрицательной обратной связями
• В СВ-системах имеются два типа регуляторных контуров: с положительной и отрицательной обратной связями
 • Контур с отрицательной обратной связью предназначен для поддержания величины контролируемого признака X вблизи оптимального для данных средовых условий уровня Х 0. Значение признака X измеряется системой рецепции и по информационному каналу передается в блок регуляции. В организмах в качестве информационных каналов используются потоки метаболитов, гормонов, медиаторов, нервных импульсов и т. д.
• Контур с отрицательной обратной связью предназначен для поддержания величины контролируемого признака X вблизи оптимального для данных средовых условий уровня Х 0. Значение признака X измеряется системой рецепции и по информационному каналу передается в блок регуляции. В организмах в качестве информационных каналов используются потоки метаболитов, гормонов, медиаторов, нервных импульсов и т. д.
 • Блок регуляции сравнивает текущее значение X с Х 0 и продуцирует управляющий сигнал d(X - Х 0). Если X значимо отклоняется от Х 0, то управляющий сигнал корректирует процесс формирования признака и приближает X к оптимальной величине Х 0.
• Блок регуляции сравнивает текущее значение X с Х 0 и продуцирует управляющий сигнал d(X - Х 0). Если X значимо отклоняется от Х 0, то управляющий сигнал корректирует процесс формирования признака и приближает X к оптимальной величине Х 0.
 • Функция контура с положительной обратной связью состоит в максимально эффективном отклонении контролируемого признака X от его исходного значения Х 0 Положительные обратные связи обеспечивают быстрое самовозбуждение элементов эндокринной и нервной системы (что важно, в частности, для осуществления стрессовых ответов), а также играют ключевую роль в регуляции процессов морфогенеза, роста и развития организмов, по своему смыслу представляющих быстрый уход от первоначального состояния.
• Функция контура с положительной обратной связью состоит в максимально эффективном отклонении контролируемого признака X от его исходного значения Х 0 Положительные обратные связи обеспечивают быстрое самовозбуждение элементов эндокринной и нервной системы (что важно, в частности, для осуществления стрессовых ответов), а также играют ключевую роль в регуляции процессов морфогенеза, роста и развития организмов, по своему смыслу представляющих быстрый уход от первоначального состояния.
 Роль отрицательного регуляторного контура при разных видах отбора. • Как возникают и усложняются регуляторные системы в эволюции? Рассмотрим простейший контур с отрицательной обратной связью (ООС), регулирующий концентрацию белка. Любое отклонение концентрации белка от нормы отслеживается регуляторным звеном ООС, компенсирующим его, путем изменения скорости биосинтеза белка (эффекторное звено ООС). Причем контуру безразлична природа факторов, приводящих к отклонениям от нормы.
Роль отрицательного регуляторного контура при разных видах отбора. • Как возникают и усложняются регуляторные системы в эволюции? Рассмотрим простейший контур с отрицательной обратной связью (ООС), регулирующий концентрацию белка. Любое отклонение концентрации белка от нормы отслеживается регуляторным звеном ООС, компенсирующим его, путем изменения скорости биосинтеза белка (эффекторное звено ООС). Причем контуру безразлична природа факторов, приводящих к отклонениям от нормы.
 • Рассмотрим простейшую систему, в которой концентрация белка X в организме определяется двумя процессами: его биосинтезом и деградацией. Возмущающими воздействиями отклоняющими концентрацию белка от оптимального уровня Х 0, являлись мутации, приводящие к понижению конформационной стабильности белка и как следствие - к увеличению его деградации.
• Рассмотрим простейшую систему, в которой концентрация белка X в организме определяется двумя процессами: его биосинтезом и деградацией. Возмущающими воздействиями отклоняющими концентрацию белка от оптимального уровня Х 0, являлись мутации, приводящие к понижению конформационной стабильности белка и как следствие - к увеличению его деградации.

 • Концентрация белка X описывается следующим уравнением: d. X/dt = Кs - Kd. X, где Ks и Kd - скорость синтеза белка и константа его деградации соответственно. • Рассмотрены два варианта модели: с отрицательной обратной связью и без нее. В системе без обратной связи скорость синтеза белка постоянна, а в системе с обратной связью она зависела от концентрации белка. В рамках этой модели получены следующие основные качественные результаты.
• Концентрация белка X описывается следующим уравнением: d. X/dt = Кs - Kd. X, где Ks и Kd - скорость синтеза белка и константа его деградации соответственно. • Рассмотрены два варианта модели: с отрицательной обратной связью и без нее. В системе без обратной связи скорость синтеза белка постоянна, а в системе с обратной связью она зависела от концентрации белка. В рамках этой модели получены следующие основные качественные результаты.
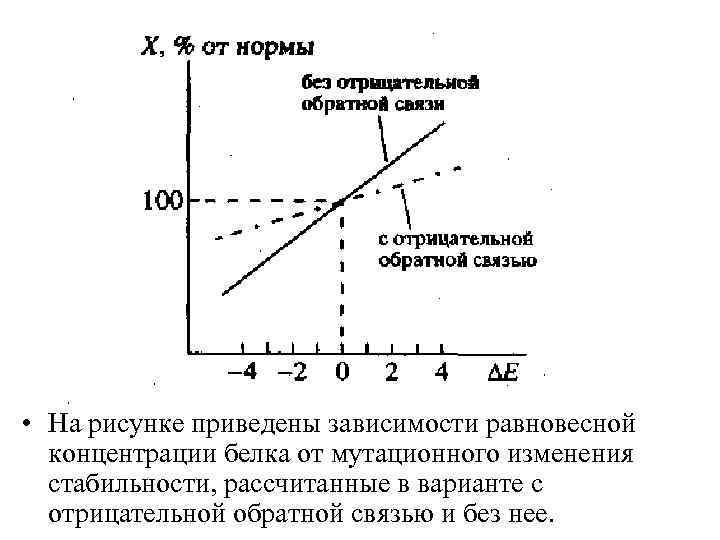 • На рисунке приведены зависимости равновесной концентрации белка от мутационного изменения стабильности, рассчитанные в варианте с отрицательной обратной связью и без нее.
• На рисунке приведены зависимости равновесной концентрации белка от мутационного изменения стабильности, рассчитанные в варианте с отрицательной обратной связью и без нее.
 • Итак, наличие в системе отрицательной обратной связи приводит к компенсации повреждающего эффекта мутаций. В данном случае это происходит за счет увеличения скорости биосинтеза белка при мутациях, увеличивающих скорость его деградации, и уменьшения скорости биосинтеза белка при мутациях, снижающих скорость его деградации.
• Итак, наличие в системе отрицательной обратной связи приводит к компенсации повреждающего эффекта мутаций. В данном случае это происходит за счет увеличения скорости биосинтеза белка при мутациях, увеличивающих скорость его деградации, и уменьшения скорости биосинтеза белка при мутациях, снижающих скорость его деградации.
 • Суть эффекта состоит в том, что отрицательная обратная связь за счет компенсаторного изменения интенсивности регулируемых процессов минимизирует (маскирует) фенотипическое проявление мутаций. Таким образом, под влиянием отрицательных обратных связей происходит "обнейтраливание"мутационного спектра
• Суть эффекта состоит в том, что отрицательная обратная связь за счет компенсаторного изменения интенсивности регулируемых процессов минимизирует (маскирует) фенотипическое проявление мутаций. Таким образом, под влиянием отрицательных обратных связей происходит "обнейтраливание"мутационного спектра
 • Мутационный спектр любого локуса (гена) характеризует распределение возникающих в нем мутаций по влиянию на приспособленность организма. Качественно можно выделить три основных класса возникающих мутаций: 1) повреждающие, 2) нейтральные, 3) адаптивные.
• Мутационный спектр любого локуса (гена) характеризует распределение возникающих в нем мутаций по влиянию на приспособленность организма. Качественно можно выделить три основных класса возникающих мутаций: 1) повреждающие, 2) нейтральные, 3) адаптивные.
 • Повреждающие мутации в ходе эволюции, как правило, фиксироваться не могут. Нейтральные мутации не влияют на приспособленность и могут фиксироваться в популяциях за счет генетического дрейфа. Адаптивные мутации могут фиксироваться в популяциях с весьма большой скоростью за счет положительного отбора.
• Повреждающие мутации в ходе эволюции, как правило, фиксироваться не могут. Нейтральные мутации не влияют на приспособленность и могут фиксироваться в популяциях за счет генетического дрейфа. Адаптивные мутации могут фиксироваться в популяциях с весьма большой скоростью за счет положительного отбора.
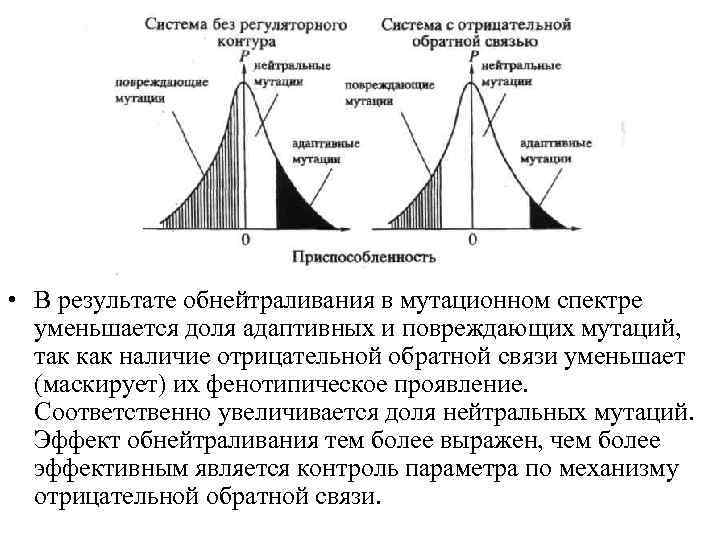 • В результате обнейтраливания в мутационном спектре уменьшается доля адаптивных и повреждающих мутаций, так как наличие отрицательной обратной связи уменьшает (маскирует) их фенотипическое проявление. Соответственно увеличивается доля нейтральных мутаций. Эффект обнейтраливания тем более выражен, чем более эффективным является контроль параметра по механизму отрицательной обратной связи.
• В результате обнейтраливания в мутационном спектре уменьшается доля адаптивных и повреждающих мутаций, так как наличие отрицательной обратной связи уменьшает (маскирует) их фенотипическое проявление. Соответственно увеличивается доля нейтральных мутаций. Эффект обнейтраливания тем более выражен, чем более эффективным является контроль параметра по механизму отрицательной обратной связи.
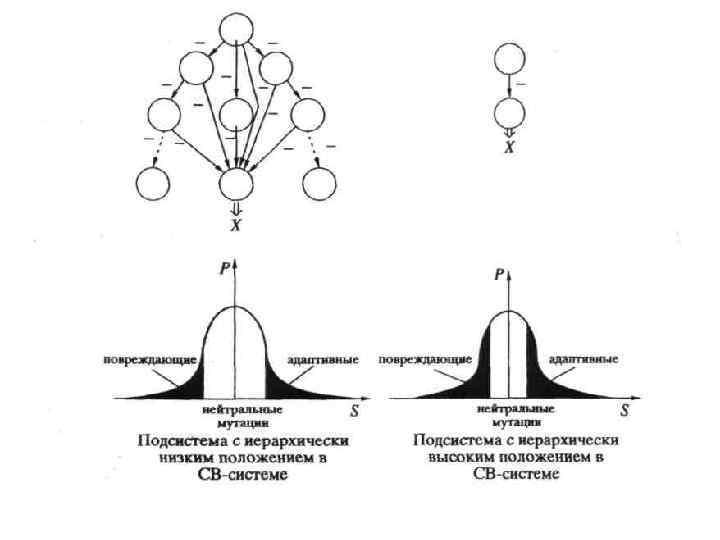
 • Эффективность контроля параметра по механизму отрицательной обратной связи, в свою очередь, зависит от иерархического положения подсистемы, определяющей данный параметр, в составе СВсистемы. При низком иерархическом положении подсистемы она контролируется большим количеством отрицательных обратных связей от вышележащих подсистем, что должно приводить к более выраженному эффекту обнейтраливания. Напротив, при более высоком иерархическом положении, когда подсистема контролируется меньшим количеством отрицательных обратных связей от вышележащих подсистем, эффект обнейтраливания должен быть выражен слабее
• Эффективность контроля параметра по механизму отрицательной обратной связи, в свою очередь, зависит от иерархического положения подсистемы, определяющей данный параметр, в составе СВсистемы. При низком иерархическом положении подсистемы она контролируется большим количеством отрицательных обратных связей от вышележащих подсистем, что должно приводить к более выраженному эффекту обнейтраливания. Напротив, при более высоком иерархическом положении, когда подсистема контролируется меньшим количеством отрицательных обратных связей от вышележащих подсистем, эффект обнейтраливания должен быть выражен слабее
 • Таким образом, стабилизирующий и движущий/дизруптивный отборы противоположным образом влияют на регуляторные системы организмов, что приводит к так называемым эволюционным качелям. Поочередно при стабилизирующем отборе происходит возникновение и усиление ООС, а при движущем отборе - ослабление или разрушение некоторых ООС. Спектр мутаций, среди которых есть вредные, нейтральные, инадаптивные и адаптивные должен фиксироваться в геномах таксонов в период стазиса в нейтральном режиме.
• Таким образом, стабилизирующий и движущий/дизруптивный отборы противоположным образом влияют на регуляторные системы организмов, что приводит к так называемым эволюционным качелям. Поочередно при стабилизирующем отборе происходит возникновение и усиление ООС, а при движущем отборе - ослабление или разрушение некоторых ООС. Спектр мутаций, среди которых есть вредные, нейтральные, инадаптивные и адаптивные должен фиксироваться в геномах таксонов в период стазиса в нейтральном режиме.
 • В процессе захвата новой экологической ниши (или изменения старой) происходит слом контура ООС и гиперманифестация изменчивости, после чего таксоны с вредными мутациями быстро вымирают, следом за ними в ходе отбора постепенно вымирают или вытесняются в другие экологические ниши таксоны с инадаптивными мутациями. Если это действительно так, то фиксация практически всего спектра адаптивных для новой ниши мутаций должна проходить за короткое время и именно в периоды заселения (формирования) новых экологических ниш, что подтверждают эксперименты.
• В процессе захвата новой экологической ниши (или изменения старой) происходит слом контура ООС и гиперманифестация изменчивости, после чего таксоны с вредными мутациями быстро вымирают, следом за ними в ходе отбора постепенно вымирают или вытесняются в другие экологические ниши таксоны с инадаптивными мутациями. Если это действительно так, то фиксация практически всего спектра адаптивных для новой ниши мутаций должна проходить за короткое время и именно в периоды заселения (формирования) новых экологических ниш, что подтверждают эксперименты.
