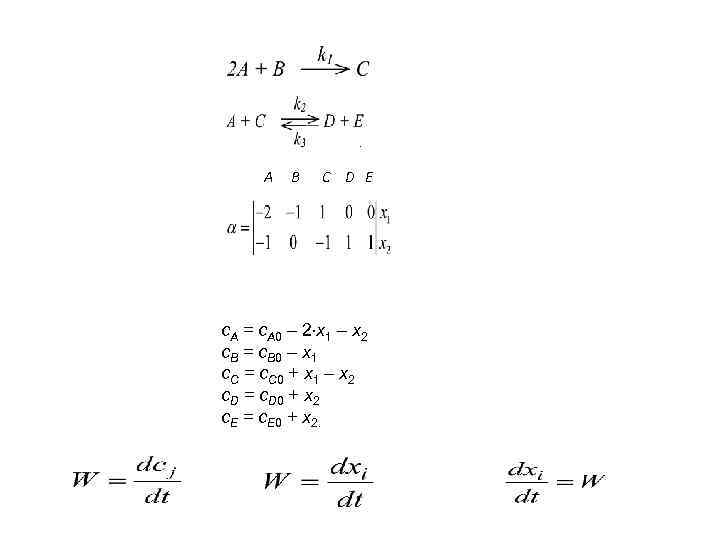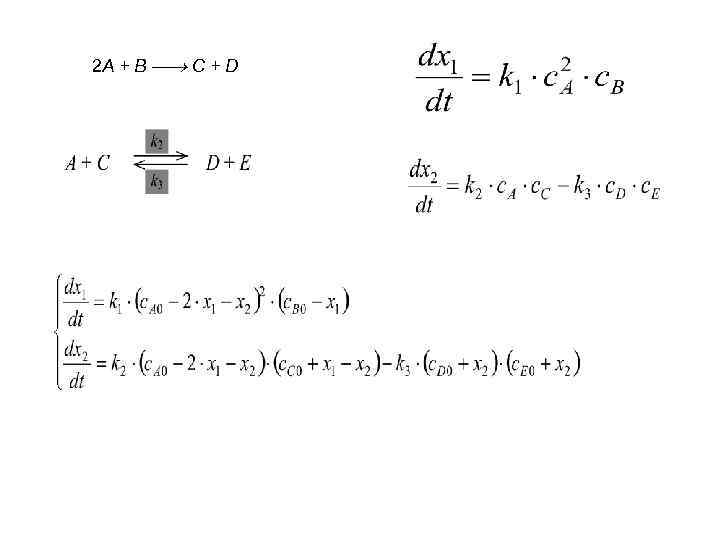Моделирование кинетики химических реакций
Моделирование кинетики химических реакций
 Скорость химической реакции (5. 1) где V – объем реакционной фазы; NA – количество молей вещества A; c. A – концентрация реагента A. Если А – продукт реакции, то скорость реакции положительна; если же А – исходный реагент, то – отрицательна. r. A = F(температура, давление, состав).
Скорость химической реакции (5. 1) где V – объем реакционной фазы; NA – количество молей вещества A; c. A – концентрация реагента A. Если А – продукт реакции, то скорость реакции положительна; если же А – исходный реагент, то – отрицательна. r. A = F(температура, давление, состав).
 Выражение (5. 1) может быть преобразовано . (5. 3) . Часто объем V является постоянной величиной, тогда скорость реакции равно (5. 4) . Для гетерогенной системы скорость реакции записывается следующим образом (5. 5) где S – площадь поверхности раздела фаз
Выражение (5. 1) может быть преобразовано . (5. 3) . Часто объем V является постоянной величиной, тогда скорость реакции равно (5. 4) . Для гетерогенной системы скорость реакции записывается следующим образом (5. 5) где S – площадь поверхности раздела фаз
 . Кинетические уравнения (5. 6) (5. 7). r. A = k c. Aa c. Bb … c. Dd a + b + … + d = n. rj = k F 1(температура) F 2(состав k = k 0 e – E/RT,
. Кинетические уравнения (5. 6) (5. 7). r. A = k c. Aa c. Bb … c. Dd a + b + … + d = n. rj = k F 1(температура) F 2(состав k = k 0 e – E/RT,
 Механизм химической реакции . . В действительности же реакция протекает по более сложной схеме: Для реакции кинетическое уравнение запишется в виде (5. 11)
Механизм химической реакции . . В действительности же реакция протекает по более сложной схеме: Для реакции кинетическое уравнение запишется в виде (5. 11)
 . . Скорость реакции описывается уравнением :
. . Скорость реакции описывается уравнением :
 Примеры простых элементарных реакций
Примеры простых элементарных реакций
 для компонента А . для компонента В для компонента S
для компонента А . для компонента В для компонента S
 Примеры сложных химических реакций – последовательная – параллельная реакция
Примеры сложных химических реакций – последовательная – параллельная реакция
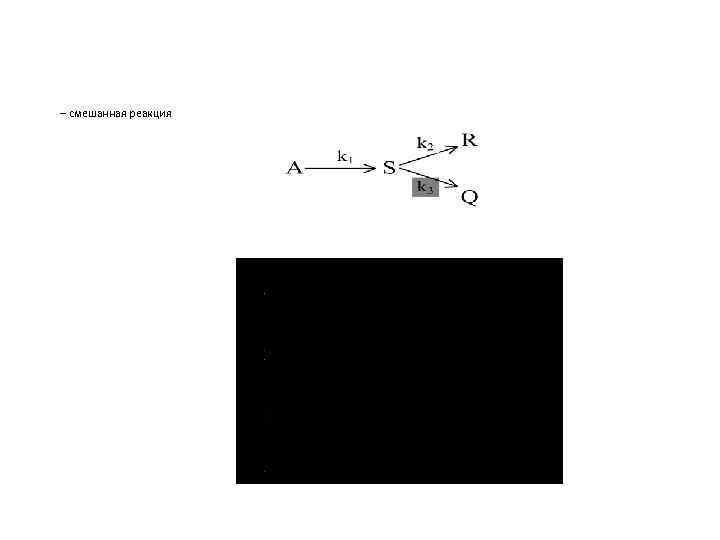 – смешанная реакция
– смешанная реакция
 Степень превращения. . . где x. A – степень превращения, NA 0 – начальное количество вещества A (моль), NA – текущее количество вещества A (моль). Зная степень превращения, можно определить текущую концентрацию реагента NA = NA 0 (1 – x. A), (5. 17) откуда Скорость химической реакции также можно выразить через степень превращения (5. 18)
Степень превращения. . . где x. A – степень превращения, NA 0 – начальное количество вещества A (моль), NA – текущее количество вещества A (моль). Зная степень превращения, можно определить текущую концентрацию реагента NA = NA 0 (1 – x. A), (5. 17) откуда Скорость химической реакции также можно выразить через степень превращения (5. 18)
 . Степень полноты реакции , Обозначим через Nj, Nj 0 соответственно число молей компонента А после реакции и до реакции, тогда (5. 20) где – степень полноты реакции (экстенсивная величина, выражающая общее количественное изменение вещества A), моль; j – стехиометрический коэффициент вещества A в данной реакции Из формулы (5. 20) получаем Если реакция протекает при постоянном объеме (V = const), то мольная концентрация вещества Аj равна , , и формула (5. 20) записывается следующим образом:
. Степень полноты реакции , Обозначим через Nj, Nj 0 соответственно число молей компонента А после реакции и до реакции, тогда (5. 20) где – степень полноты реакции (экстенсивная величина, выражающая общее количественное изменение вещества A), моль; j – стехиометрический коэффициент вещества A в данной реакции Из формулы (5. 20) получаем Если реакция протекает при постоянном объеме (V = const), то мольная концентрация вещества Аj равна , , и формула (5. 20) записывается следующим образом:
 Формулирование критерия адекватности cj. Р = c. Р(k 1, k 2, …, k. R), S = S(k 1, k 2, …, k. R).
Формулирование критерия адекватности cj. Р = c. Р(k 1, k 2, …, k. R), S = S(k 1, k 2, …, k. R).
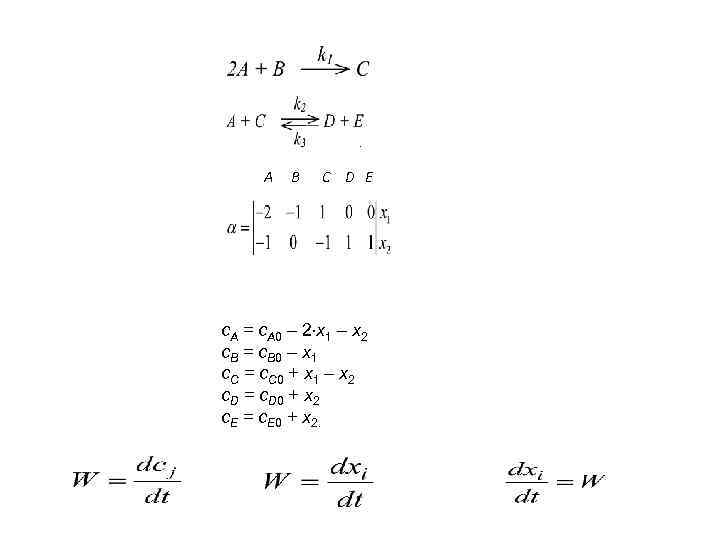 . A B C D E c. A = c. A 0 – 2 х1 – х2 c. B = c. B 0 – х1 c. C = c. C 0 + х1 – х2 c. D = c. D 0 + х2 c. E = c. E 0 + х2.
. A B C D E c. A = c. A 0 – 2 х1 – х2 c. B = c. B 0 – х1 c. C = c. C 0 + х1 – х2 c. D = c. D 0 + х2 c. E = c. E 0 + х2.
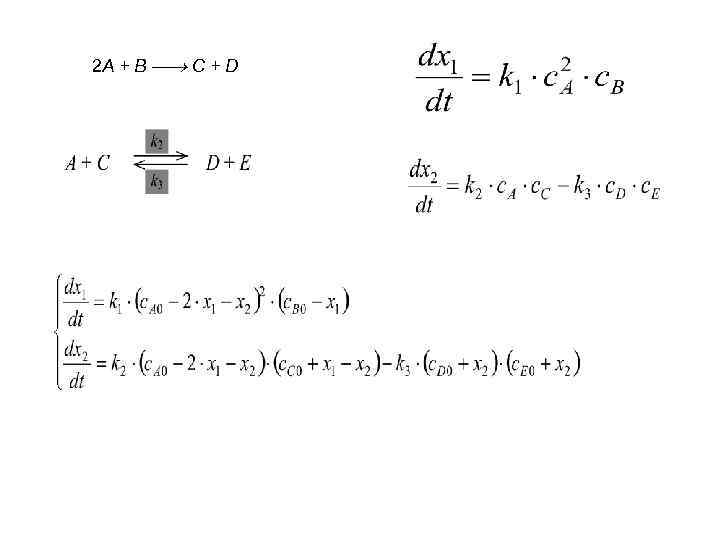 2 A + B C + D
2 A + B C + D
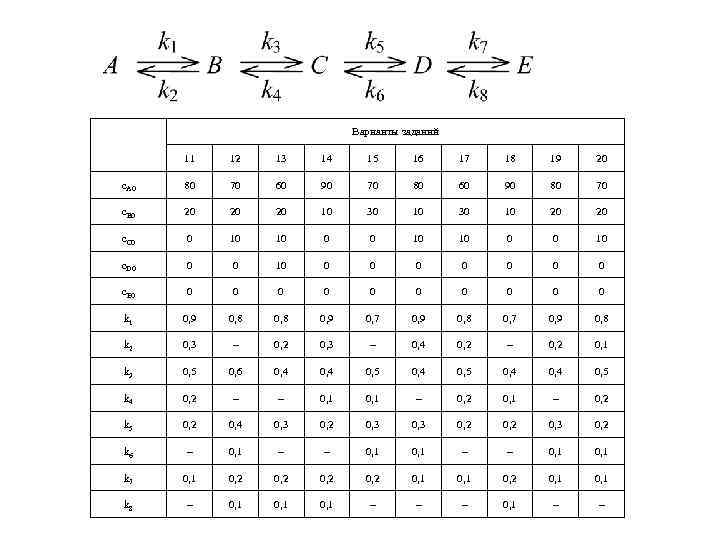 Варианты заданий 11 12 13 14 15 16 17 18 19 20 c. A 0 80 70 60 90 70 80 60 90 80 70 c. B 0 20 20 20 10 30 10 20 20 c. C 0 0 10 10 0 0 10 c. D 0 0 0 10 0 0 0 c. E 0 0 0 k 1 0, 9 0, 8 0, 9 0, 7 0, 9 0, 8 k 2 0, 3 – 0, 4 0, 2 – 0, 2 0, 1 k 3 0, 5 0, 6 0, 4 0, 5 0, 4 0, 5 k 4 0, 2 – – 0, 1 – 0, 2 k 5 0, 2 0, 4 0, 3 0, 2 0, 3 0, 2 k 6 – 0, 1 – – 0, 1 k 7 0, 1 0, 2 0, 1 0, 2 0, 1 k 8 – 0, 1 – – – 0, 1 – –
Варианты заданий 11 12 13 14 15 16 17 18 19 20 c. A 0 80 70 60 90 70 80 60 90 80 70 c. B 0 20 20 20 10 30 10 20 20 c. C 0 0 10 10 0 0 10 c. D 0 0 0 10 0 0 0 c. E 0 0 0 k 1 0, 9 0, 8 0, 9 0, 7 0, 9 0, 8 k 2 0, 3 – 0, 4 0, 2 – 0, 2 0, 1 k 3 0, 5 0, 6 0, 4 0, 5 0, 4 0, 5 k 4 0, 2 – – 0, 1 – 0, 2 k 5 0, 2 0, 4 0, 3 0, 2 0, 3 0, 2 k 6 – 0, 1 – – 0, 1 k 7 0, 1 0, 2 0, 1 0, 2 0, 1 k 8 – 0, 1 – – – 0, 1 – –