Mitochondrial disease may cause any symptom in




























mitohondrialynye_encefalopatii.ppt
- Размер: 1.4 Мб
- Автор: Александра Айрапетова
- Количество слайдов: 33
Описание презентации Mitochondrial disease may cause any symptom in по слайдам

 Mitochondrial disease may cause any symptom in any tissue at any age by any inheritance. A Munnich. Митохондриальные болезни могут быть причиной любого симптома в любой ткани в любом возрасте с любым типом наследования.
Mitochondrial disease may cause any symptom in any tissue at any age by any inheritance. A Munnich. Митохондриальные болезни могут быть причиной любого симптома в любой ткани в любом возрасте с любым типом наследования.
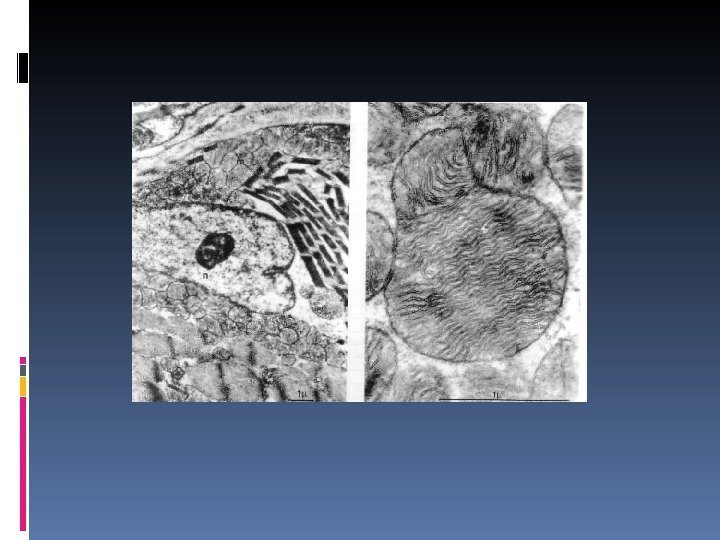
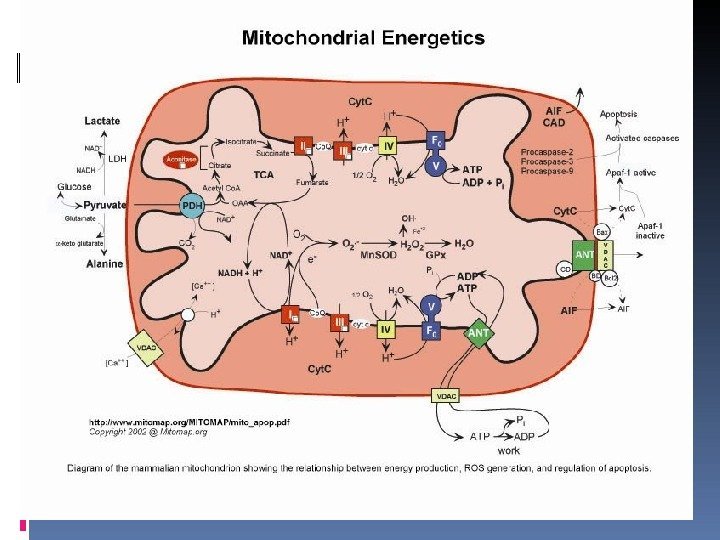
 Митохондрия является органеллой, которая присутствует практически в каждой клетке, за исключением зрелых эритроцитов. Поэтому митохондриальные болезни могут поражать любые системы органов. В связи с этим правильнее называть эти состояния митохондриальными цитопатиями [Sarnat HB, Menkes JH 2006] Митохондриальные нарушения – это обширная группа патологических состояний, обусловленных генетическими, структурными, биохимическими дефектами митохондрий, нарушением тканевого дыхания и, как следствие, недостаточностью энергетического обмена. Митохондриальные дыхательные цепи- главный конечный путь аэробного метаболизма.
Митохондрия является органеллой, которая присутствует практически в каждой клетке, за исключением зрелых эритроцитов. Поэтому митохондриальные болезни могут поражать любые системы органов. В связи с этим правильнее называть эти состояния митохондриальными цитопатиями [Sarnat HB, Menkes JH 2006] Митохондриальные нарушения – это обширная группа патологических состояний, обусловленных генетическими, структурными, биохимическими дефектами митохондрий, нарушением тканевого дыхания и, как следствие, недостаточностью энергетического обмена. Митохондриальные дыхательные цепи- главный конечный путь аэробного метаболизма.

 Нарушения клеточной энергетики приводят к полисистемным заболеваниям. В первую очередь страдают органы и ткани, наиболее энергозависимые – нервная система (энцефалопатии, полиневропатии), мышечная система (миопатии), сердце (кардиомиопатии), почки, печень, эндокринная система и другие. До самого недавнего времени все эти заболевания определялись под многочисленными масками других патологических форм. К настоящему времени выявлено более 200 заболеваний, причиной которых являются мутации митохондриальной ДНК. Митохондриальные болезни могут быть обусловлены патологией как митохондриального, так и ядерного генома.
Нарушения клеточной энергетики приводят к полисистемным заболеваниям. В первую очередь страдают органы и ткани, наиболее энергозависимые – нервная система (энцефалопатии, полиневропатии), мышечная система (миопатии), сердце (кардиомиопатии), почки, печень, эндокринная система и другие. До самого недавнего времени все эти заболевания определялись под многочисленными масками других патологических форм. К настоящему времени выявлено более 200 заболеваний, причиной которых являются мутации митохондриальной ДНК. Митохондриальные болезни могут быть обусловлены патологией как митохондриального, так и ядерного генома.
 Распространенность митохондриальных заболеваний составляет 11. 5/100000. Среди жителей Испании в возрасте свыше 14 лет – 5. 7/100000 [ Arpa et al , 2003] Мутации мт. ДНК были выявлены у 1 / 8 000 населения [Chinnery PF, Di. Mauro S et all 2004]
Распространенность митохондриальных заболеваний составляет 11. 5/100000. Среди жителей Испании в возрасте свыше 14 лет – 5. 7/100000 [ Arpa et al , 2003] Мутации мт. ДНК были выявлены у 1 / 8 000 населения [Chinnery PF, Di. Mauro S et all 2004]

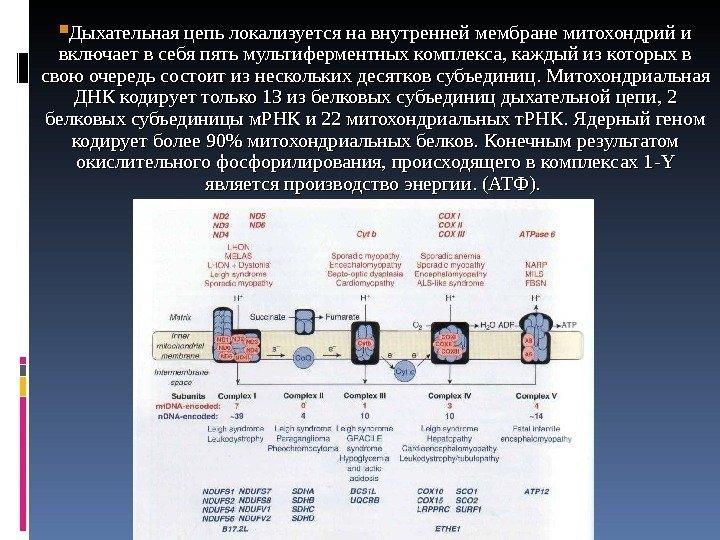
 Дыхательная цепь локализуется на внутренней мембране митохондрий и включает в себя пять мультиферментных комплекса, каждый из которых в свою очередь состоит из нескольких десятков субъединиц. Митохондриальная ДНК кодирует только 13 из белковых субъединиц дыхательной цепи, 2 белковых субъединицы м. РНК и 22 митохондриальных т. РНК. Ядерный геном кодирует более 90% митохондриальных белков. Конечным результатом окислительного фосфорилирования, происходящего в комплексах 1 — YY является производство энергии. (АТФ).
Дыхательная цепь локализуется на внутренней мембране митохондрий и включает в себя пять мультиферментных комплекса, каждый из которых в свою очередь состоит из нескольких десятков субъединиц. Митохондриальная ДНК кодирует только 13 из белковых субъединиц дыхательной цепи, 2 белковых субъединицы м. РНК и 22 митохондриальных т. РНК. Ядерный геном кодирует более 90% митохондриальных белков. Конечным результатом окислительного фосфорилирования, происходящего в комплексах 1 — YY является производство энергии. (АТФ).
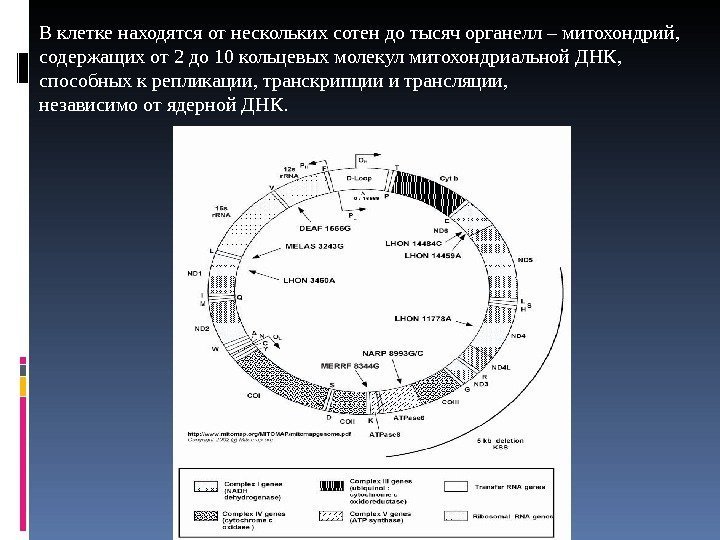
 В клетке находятся от нескольких сотен до тысяч органелл – митохондрий, содержащих от 2 до 10 кольцевых молекул митохондриальной ДНК, способных к репликации, транскрипции и трансляции, независимо от ядерной ДНК.
В клетке находятся от нескольких сотен до тысяч органелл – митохондрий, содержащих от 2 до 10 кольцевых молекул митохондриальной ДНК, способных к репликации, транскрипции и трансляции, независимо от ядерной ДНК.
 На основе этиологии и патогенеза существует классификация митохондриальных болезней 1. Болезни, обусловленные дефектами мт. ДНК: а) точковыми мутациями; б)делециями; в)изолированными дупликациями или в сочетании с делециями; 2. Болезни, обусловленные дефектами ядерной ДНК: а) мутациями, нарушающими работу электронтранспортной цепи митохондрий; б) мутациями, нарушающими окислительное фосфорилирование в) мутациями, вызывающими дефекты ферментов цикла Кребса г) мутациями, нарушающими утилизацию субстратов д) мутациями, нарушающими транспорт субстратов 3. Болезни, обусловленные дефектами мт. ДНК, которые вызваны нарушением ядерной ДНК: а) тканеспецифическими делециями или дупликациями мт. ДНК; б) истощением (делецией) мт. ДНК.
На основе этиологии и патогенеза существует классификация митохондриальных болезней 1. Болезни, обусловленные дефектами мт. ДНК: а) точковыми мутациями; б)делециями; в)изолированными дупликациями или в сочетании с делециями; 2. Болезни, обусловленные дефектами ядерной ДНК: а) мутациями, нарушающими работу электронтранспортной цепи митохондрий; б) мутациями, нарушающими окислительное фосфорилирование в) мутациями, вызывающими дефекты ферментов цикла Кребса г) мутациями, нарушающими утилизацию субстратов д) мутациями, нарушающими транспорт субстратов 3. Болезни, обусловленные дефектами мт. ДНК, которые вызваны нарушением ядерной ДНК: а) тканеспецифическими делециями или дупликациями мт. ДНК; б) истощением (делецией) мт. ДНК.
 ТИП НАСЛЕДОВАНИЯ Митохондриальная генетика отличается от менделевской в трех важнейших аспектах : Материнское наследование — всю цитоплазму, вместе с находящимися в ней органеллами потомки получают вместе с яйцеклеткой. Гетероплазмия — одновременное существование в клетке нормального (дикий) и мутантного типов ДНК Митотическая сегрегация- оба типа мт. ДНК в процессе деления клетки могут распределяться случайным образом между дочерними клетками.
ТИП НАСЛЕДОВАНИЯ Митохондриальная генетика отличается от менделевской в трех важнейших аспектах : Материнское наследование — всю цитоплазму, вместе с находящимися в ней органеллами потомки получают вместе с яйцеклеткой. Гетероплазмия — одновременное существование в клетке нормального (дикий) и мутантного типов ДНК Митотическая сегрегация- оба типа мт. ДНК в процессе деления клетки могут распределяться случайным образом между дочерними клетками.
 Основные особенности митохондриальных цитопатий Выраженный полиморфизм клинических симптомов Мультисистемный характер поражения Вариабельность течения Прогрессирование Неадекватное реагирование на применяемую терапию
Основные особенности митохондриальных цитопатий Выраженный полиморфизм клинических симптомов Мультисистемный характер поражения Вариабельность течения Прогрессирование Неадекватное реагирование на применяемую терапию
 КРИТЕРИИ ДИАГНОСТИКИ МИТОХОНДРИАЛЬНЫХ БОЛЕЗНЕЙ Клинические : миопатический симптомокомплекс (непереносимость физических нагрузок, мышечная слабость, снижение мышечного тонуса), судороги ( миоклонические или мультифокальные судорог ) , мозжечковый синдром (атаксия, интенционный тремор), поражение глазодвигательных нервов (птоз, наружная офтальмоплегия), полиневропатия, инсультоподобные пароксизмы, мигренеподобные головные боли, черепно-лицевая дисморфия, дисметаболические проявления (рвота, эпизоды летаргии, комы), дыхательные нарушения (апноэ, гипервентилляция, тахипноэ) поражение сердца, печени, почек, прогрессирующее течение заболевания.
КРИТЕРИИ ДИАГНОСТИКИ МИТОХОНДРИАЛЬНЫХ БОЛЕЗНЕЙ Клинические : миопатический симптомокомплекс (непереносимость физических нагрузок, мышечная слабость, снижение мышечного тонуса), судороги ( миоклонические или мультифокальные судорог ) , мозжечковый синдром (атаксия, интенционный тремор), поражение глазодвигательных нервов (птоз, наружная офтальмоплегия), полиневропатия, инсультоподобные пароксизмы, мигренеподобные головные боли, черепно-лицевая дисморфия, дисметаболические проявления (рвота, эпизоды летаргии, комы), дыхательные нарушения (апноэ, гипервентилляция, тахипноэ) поражение сердца, печени, почек, прогрессирующее течение заболевания.
 Признаки поражения соединительной ткани (гипермобильный синдром, гиперэластичность кожи, нарушение осанки и др. ) Нейродегенеративные проявления, лейкопатии на МРТ Повторные эпизоды нарушения сознания или необъяснимые эпизоды рвоты у новорожденных Необъяснимая атаксия Отставание в умственном развитии без определенных причин ( John H. Menkes 2006, 2007) Семейный анамнез Внезапное ухудшение состояния ребенка (судороги, рвота, расстройства дыхания, вялость, слабость, нарушения мышечного тонуса (чаще мышечная гипотония), кома, летаргия, поражение печени и почек, не поддающееся обычной терапии
Признаки поражения соединительной ткани (гипермобильный синдром, гиперэластичность кожи, нарушение осанки и др. ) Нейродегенеративные проявления, лейкопатии на МРТ Повторные эпизоды нарушения сознания или необъяснимые эпизоды рвоты у новорожденных Необъяснимая атаксия Отставание в умственном развитии без определенных причин ( John H. Menkes 2006, 2007) Семейный анамнез Внезапное ухудшение состояния ребенка (судороги, рвота, расстройства дыхания, вялость, слабость, нарушения мышечного тонуса (чаще мышечная гипотония), кома, летаргия, поражение печени и почек, не поддающееся обычной терапии
 Биохимические тесты лактат-пируват-ацидоз. НОРМАЛЬНЫЕ ПОКАЗАТЕЛИ МОЛОЧНОЙ КИСЛОТЫ НЕ ИСКЛЮЧАЮТ МИТОХОНДРИАЛЬНОГО ЗАБОЛЕВАНИЯ [Chinnery P 2006] кетоновые тела ацилкарнитины плазмы, органические и аминокислоты крови и мочи. Биопсия скелетных мышц с проведением специфических гистохимических реакций, выявление феномена “рваных красных волокон”. Синдромы с RRF – MELAS, MERRF, KSS, PEO (прогрессирующая наружная офтальмоплегия, синдром Пирсона. Синдромы без RRF – болезнь Лея, NARP , LHON (наследственная оптическая нейропатия Лебера) Оценка содержания мышечного коэнзима Q 10 у детей с дефектом ферментов дыхательной цепи митохондрий [Miles MV et all, 2008] Цитоморфоденситометрическое исследование активности митохондрий лимфоцитов – снижение количества, увеличение объема, снижение активности Генетические исследования – определение частых мутаций, сиквенс митохондриальной ДНК
Биохимические тесты лактат-пируват-ацидоз. НОРМАЛЬНЫЕ ПОКАЗАТЕЛИ МОЛОЧНОЙ КИСЛОТЫ НЕ ИСКЛЮЧАЮТ МИТОХОНДРИАЛЬНОГО ЗАБОЛЕВАНИЯ [Chinnery P 2006] кетоновые тела ацилкарнитины плазмы, органические и аминокислоты крови и мочи. Биопсия скелетных мышц с проведением специфических гистохимических реакций, выявление феномена “рваных красных волокон”. Синдромы с RRF – MELAS, MERRF, KSS, PEO (прогрессирующая наружная офтальмоплегия, синдром Пирсона. Синдромы без RRF – болезнь Лея, NARP , LHON (наследственная оптическая нейропатия Лебера) Оценка содержания мышечного коэнзима Q 10 у детей с дефектом ферментов дыхательной цепи митохондрий [Miles MV et all, 2008] Цитоморфоденситометрическое исследование активности митохондрий лимфоцитов – снижение количества, увеличение объема, снижение активности Генетические исследования – определение частых мутаций, сиквенс митохондриальной ДНК
 НАИБОЛЕЕ ЧАСТО ВСТРЕЧАЮЩИЕСЯ В ДЕТСКОМ ВОЗРАСТЕ КЛИНИЧЕСКИЕ СИНДРОМЫ Синдром MELAS – митохондриальная энцефаломиопатия, лактат-ацидоз и инсультоподобные пароксизмы Синдром MERRF – миоклонус-эпилепсия, рваные красные волокна KSS – синдром Кернса-Сейра – характеризуется птозом, офтальмоплегией, пигментным ретинитом, атаксией, нарушением сердечного проведения Синдром NARP – нейропатия, атаксия, пигментный ретинит Синдром Лея – подострая некротизирующая энцефаломиелопатия Болезнь Лебера – наследственная оптическая нейропатия
НАИБОЛЕЕ ЧАСТО ВСТРЕЧАЮЩИЕСЯ В ДЕТСКОМ ВОЗРАСТЕ КЛИНИЧЕСКИЕ СИНДРОМЫ Синдром MELAS – митохондриальная энцефаломиопатия, лактат-ацидоз и инсультоподобные пароксизмы Синдром MERRF – миоклонус-эпилепсия, рваные красные волокна KSS – синдром Кернса-Сейра – характеризуется птозом, офтальмоплегией, пигментным ретинитом, атаксией, нарушением сердечного проведения Синдром NARP – нейропатия, атаксия, пигментный ретинит Синдром Лея – подострая некротизирующая энцефаломиелопатия Болезнь Лебера – наследственная оптическая нейропатия
 Синдром Лея Подострая некротизирующая энцефаломиелопатия – описана в 1951 году Denis Leigh – у 6 мес младенца, развившего регресс психо-моторного развития и погибшего через 6 недель. На аутопсии выявлены множественные симметричные очаги губчатой дегенерации с микроваскулярной пролиферацией в таламусе, мозжечке, задних столбах спинного мозга, оптического нерва. Дебют – часто острое начало, после перенесенного интеркуррентного заболевания, большинство пациентов – раннего возраста- до 2 лет, однако, некоторые пациенты – детского и подросткового возраста. Клинические проявления – регресс развития, диффузная мышечная гипотония, проблемы вскармливания, прогрессирующая потеря зрения, потеря слуха, нистагм, атаксия, судороги, респираторные нарушения. У детей старшего возраста – атаксия, мышечная дистония, нарушения интеллектуального развития, дизартрия, рвота, диаррея. Диагностика- МРТ, лактат-пируват ацидоз, генетические исследования
Синдром Лея Подострая некротизирующая энцефаломиелопатия – описана в 1951 году Denis Leigh – у 6 мес младенца, развившего регресс психо-моторного развития и погибшего через 6 недель. На аутопсии выявлены множественные симметричные очаги губчатой дегенерации с микроваскулярной пролиферацией в таламусе, мозжечке, задних столбах спинного мозга, оптического нерва. Дебют – часто острое начало, после перенесенного интеркуррентного заболевания, большинство пациентов – раннего возраста- до 2 лет, однако, некоторые пациенты – детского и подросткового возраста. Клинические проявления – регресс развития, диффузная мышечная гипотония, проблемы вскармливания, прогрессирующая потеря зрения, потеря слуха, нистагм, атаксия, судороги, респираторные нарушения. У детей старшего возраста – атаксия, мышечная дистония, нарушения интеллектуального развития, дизартрия, рвота, диаррея. Диагностика- МРТ, лактат-пируват ацидоз, генетические исследования
 Болезнь Лея (подострая некротизирующая энцефаломиелопатия) Мутации митохондриальных или ядерных генов, отвечающие за возникновение болезни Лея. Ген Локализация II комплекс дыхательной цепи митохондрий MTND 3, 3, MTND 5, MTND 66 NDUFV 1, 1, NDUFS 1, NDUFS 3, 3, NDUFS 4, NDUFS 7, 7, NDUFS 8 8 Митохондриальный геном Ядерный геном IIII комплекс дыхательной цепи митохондрий SDHA Ядерный геном IIIIII комплекс дыхательной цепи митохондрий BCS 1 L Ядерный геном IVIV комплекс дыхательной цепи митохондрий MTCO 33 COX 10, COX 15, SCO 2, SURF 1 Митохондриальный геном Ядерный геном V V комплекс дыхательной цепи митохондрий MTATP 6 Митохондриальный геном Митохондриальная т РНК Валин MTTV Митохондриальная т РНК лизин MTTK Митохондриальный геном
Болезнь Лея (подострая некротизирующая энцефаломиелопатия) Мутации митохондриальных или ядерных генов, отвечающие за возникновение болезни Лея. Ген Локализация II комплекс дыхательной цепи митохондрий MTND 3, 3, MTND 5, MTND 66 NDUFV 1, 1, NDUFS 1, NDUFS 3, 3, NDUFS 4, NDUFS 7, 7, NDUFS 8 8 Митохондриальный геном Ядерный геном IIII комплекс дыхательной цепи митохондрий SDHA Ядерный геном IIIIII комплекс дыхательной цепи митохондрий BCS 1 L Ядерный геном IVIV комплекс дыхательной цепи митохондрий MTCO 33 COX 10, COX 15, SCO 2, SURF 1 Митохондриальный геном Ядерный геном V V комплекс дыхательной цепи митохондрий MTATP 6 Митохондриальный геном Митохондриальная т РНК Валин MTTV Митохондриальная т РНК лизин MTTK Митохондриальный геном
 Синдром MERRF Мультисистемное заболевание – основные характеристики Миоклонус Генерализованная эпилепсия Мозжечковая атаксия Рваные красные волокна при мышечной биопсии Дополнительные критерии Психомоторный регресс Мышечная слабость, миопатия Аксональная периферическая нейропатия нейросенсорная тугоухость Низкий рост лактат-ацидоз, гиперкетонемия; Могут встречаться- атрофия зрительного нерва, кардиомиопатия, пигментная ретинопатия, множественный липоматоз COX-негативные красные миофибриллы с рваными краями и SDH-позитивные миофибриллы; A 8344 G и Т 8356 С мутация в гене т. РНКLys мт. ДНК- 80% пациентов. MERRF ассоциирован примерно с 6 точковыми мутациями мт. ДНК
Синдром MERRF Мультисистемное заболевание – основные характеристики Миоклонус Генерализованная эпилепсия Мозжечковая атаксия Рваные красные волокна при мышечной биопсии Дополнительные критерии Психомоторный регресс Мышечная слабость, миопатия Аксональная периферическая нейропатия нейросенсорная тугоухость Низкий рост лактат-ацидоз, гиперкетонемия; Могут встречаться- атрофия зрительного нерва, кардиомиопатия, пигментная ретинопатия, множественный липоматоз COX-негативные красные миофибриллы с рваными краями и SDH-позитивные миофибриллы; A 8344 G и Т 8356 С мутация в гене т. РНКLys мт. ДНК- 80% пациентов. MERRF ассоциирован примерно с 6 точковыми мутациями мт. ДНК
 Синдром Кернса-Сейра Описан в 1958 году у 2 пациентов с пигментным ретинитом, наружной офтальмоплегией и нарушением внутрисердечного проведения. Облигатные характеристики синдрома , определенные Lewis P. Rowland 1983 дебют до 20 летнего возраста, пигментный ретинит прогрессирующая наружная офтальмоплегия Дополнительные – сердечные блокады Мозжечковая атаксия Белок в CM Ж – более 100 мг\ d. L.
Синдром Кернса-Сейра Описан в 1958 году у 2 пациентов с пигментным ретинитом, наружной офтальмоплегией и нарушением внутрисердечного проведения. Облигатные характеристики синдрома , определенные Lewis P. Rowland 1983 дебют до 20 летнего возраста, пигментный ретинит прогрессирующая наружная офтальмоплегия Дополнительные – сердечные блокады Мозжечковая атаксия Белок в CM Ж – более 100 мг\ d. L.
 У большинства пациентов встречаются -низкий рост -потеря слуха -нарушение интеллектуального развития -мышечная слабость Начало заболевания – птоз, офтальмопарез или оба эти состояния Генетика – делеция мт ДНК у 90%, у некоторых пациентов может быть дупликация [Moraes CT et al 1989]
У большинства пациентов встречаются -низкий рост -потеря слуха -нарушение интеллектуального развития -мышечная слабость Начало заболевания – птоз, офтальмопарез или оба эти состояния Генетика – делеция мт ДНК у 90%, у некоторых пациентов может быть дупликация [Moraes CT et al 1989]
 МИТОХОНДРИАЛЬНАЯ ЭНЦЕФАЛОМИОПАТИЯ, ЛАКТАТ-АЦИДОЗ И ИНСУЛЬТОПОДОБНЫЕ ПАРОКСИЗМЫ ( MELAS) Мультисистемное заболевание, описанное в 1984 г Pavlakis SG et all, характеризующееся — Инсультоподобными пароксизмами, возникающими в молодом возрасте (до 40 лет) У более 60 % пациентов заболевание дебютирует до 15 лет. — Энцефалопатией, характеризующейся судорогами, деменцией — Митохондриальной миопатией с лактат-ацидозом, рваными красными волокнами(COX- позитивные красные миофибриллы с рваными краями, SDH-позитивные миофибриллы и SDH-реактивные кровеносные сосуды в мышечном биоптате)(сочетанная недостаточность комплексов дыхательной цепи митохондрий), гиперкетонемия Дополнительные проявления : низкий рост, кардиомиопатия, кальцинаты базальных ганглиев, миоклонус, атаксия, мигренеподобные головные боли, атрофия зрительных нервов, пигментная ретинопатия, потеря слуха, офтальмоплегия, диабет, нарушение сердечной проводимости, гастроинтестинальные нарушения, нефропатия, тошнота Основная характеристика этого заболевания – инсультоподобные пароксизмы, наиболее часто локализующиеся в затылочной области, приводящие к гемианопсии или корковой слепоте. Однако, зоны могут быть различными.
МИТОХОНДРИАЛЬНАЯ ЭНЦЕФАЛОМИОПАТИЯ, ЛАКТАТ-АЦИДОЗ И ИНСУЛЬТОПОДОБНЫЕ ПАРОКСИЗМЫ ( MELAS) Мультисистемное заболевание, описанное в 1984 г Pavlakis SG et all, характеризующееся — Инсультоподобными пароксизмами, возникающими в молодом возрасте (до 40 лет) У более 60 % пациентов заболевание дебютирует до 15 лет. — Энцефалопатией, характеризующейся судорогами, деменцией — Митохондриальной миопатией с лактат-ацидозом, рваными красными волокнами(COX- позитивные красные миофибриллы с рваными краями, SDH-позитивные миофибриллы и SDH-реактивные кровеносные сосуды в мышечном биоптате)(сочетанная недостаточность комплексов дыхательной цепи митохондрий), гиперкетонемия Дополнительные проявления : низкий рост, кардиомиопатия, кальцинаты базальных ганглиев, миоклонус, атаксия, мигренеподобные головные боли, атрофия зрительных нервов, пигментная ретинопатия, потеря слуха, офтальмоплегия, диабет, нарушение сердечной проводимости, гастроинтестинальные нарушения, нефропатия, тошнота Основная характеристика этого заболевания – инсультоподобные пароксизмы, наиболее часто локализующиеся в затылочной области, приводящие к гемианопсии или корковой слепоте. Однако, зоны могут быть различными.
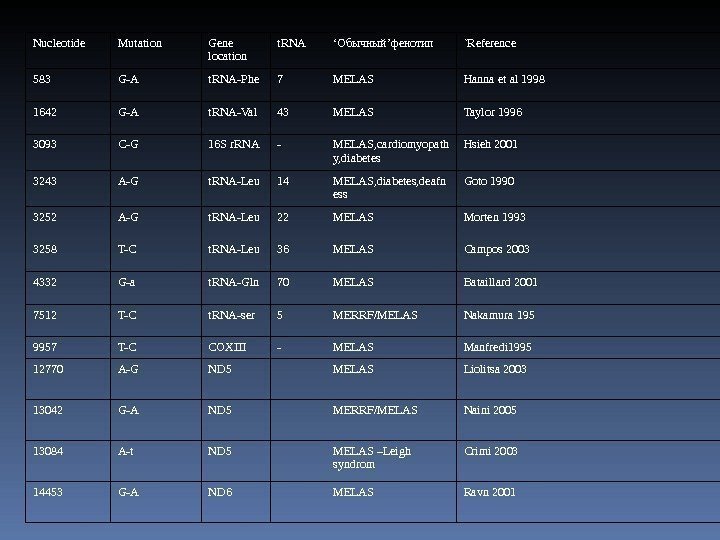
 Nucleotide Mutation Gene location t. RNA ‘ Обычный ’ фенотип `Reference 583 G-A t. RNA-Phe 7 MELAS Hanna et al 1998 1642 G-A t. RNA-Val 43 MELAS Taylor 1996 3093 C-G 16 S r. RNA — MELAS, cardiomyopath y, diabetes Hsieh 2001 3243 A-G t. RNA-Leu 14 MELAS, diabetes, deafn ess Goto 1990 3252 A-G t. RNA-Leu 22 MELAS Morten 1993 3258 T-C t. RNA-Leu 36 MELAS Campos 2003 4332 G-a t. RNA-Gln 70 MELAS Bataillard 2001 7512 T-C t. RNA-ser 5 MERRF/MELAS Nakamura 195 9957 T-C COXIII — MELAS Manfredi 1995 12770 A-G ND 5 MELAS Liolitsa 2003 13042 G-A ND 5 MERRF/MELAS Naini 2005 13084 A-t ND 5 MELAS –Leigh syndrom Crimi 2003 14453 G-A ND 6 MELAS Ravn
Nucleotide Mutation Gene location t. RNA ‘ Обычный ’ фенотип `Reference 583 G-A t. RNA-Phe 7 MELAS Hanna et al 1998 1642 G-A t. RNA-Val 43 MELAS Taylor 1996 3093 C-G 16 S r. RNA — MELAS, cardiomyopath y, diabetes Hsieh 2001 3243 A-G t. RNA-Leu 14 MELAS, diabetes, deafn ess Goto 1990 3252 A-G t. RNA-Leu 22 MELAS Morten 1993 3258 T-C t. RNA-Leu 36 MELAS Campos 2003 4332 G-a t. RNA-Gln 70 MELAS Bataillard 2001 7512 T-C t. RNA-ser 5 MERRF/MELAS Nakamura 195 9957 T-C COXIII — MELAS Manfredi 1995 12770 A-G ND 5 MELAS Liolitsa 2003 13042 G-A ND 5 MERRF/MELAS Naini 2005 13084 A-t ND 5 MELAS –Leigh syndrom Crimi 2003 14453 G-A ND 6 MELAS Ravn
 ОСОБЕННОСТИ ИНСУЛЬТА ПРИ СИНДРОМЕ MELAS Частая локализация в затылочной области, приводящая к гемианопсии или корковой слепоте. Инсультоподобные пароксизмы атипичные, т. е. поражают в основном молодых , часто провоцируются заболеваниями, сопровождающимися фебрильной температурой, мигренеподобной головной болью, возникают после судорог Очаги часто лежат вне региона крупных церебральных артерий, чаще поражая кору или глубинные структуры белого вещества головного мозга ( Mathews PM et al 1991) Острые MELAS очаги могут флюктуировать, мигрировать или даже исчезать. Кальцификаты базальных ганглиев – частая находка ( Sue SM et al, 1998) Ангиография подтверждает отсутствие патологии со стороны крупных сосудов ( Hirano M, Pavlakis S 1994).
ОСОБЕННОСТИ ИНСУЛЬТА ПРИ СИНДРОМЕ MELAS Частая локализация в затылочной области, приводящая к гемианопсии или корковой слепоте. Инсультоподобные пароксизмы атипичные, т. е. поражают в основном молодых , часто провоцируются заболеваниями, сопровождающимися фебрильной температурой, мигренеподобной головной болью, возникают после судорог Очаги часто лежат вне региона крупных церебральных артерий, чаще поражая кору или глубинные структуры белого вещества головного мозга ( Mathews PM et al 1991) Острые MELAS очаги могут флюктуировать, мигрировать или даже исчезать. Кальцификаты базальных ганглиев – частая находка ( Sue SM et al, 1998) Ангиография подтверждает отсутствие патологии со стороны крупных сосудов ( Hirano M, Pavlakis S 1994).
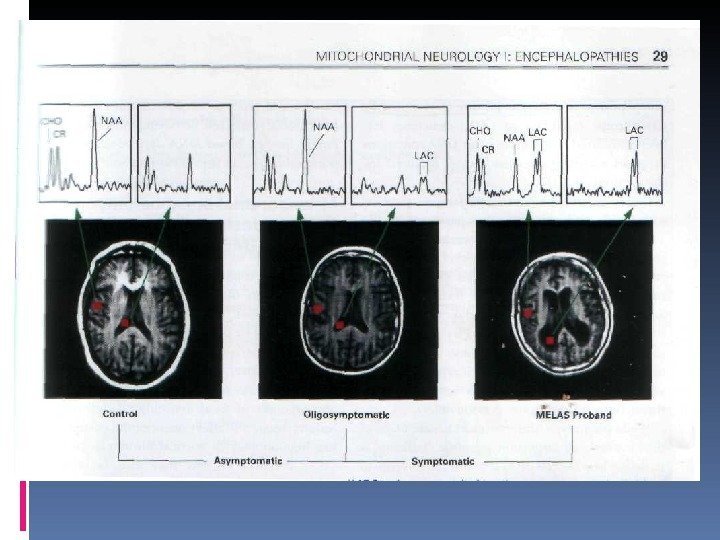
 Количественный анализ церебрального кровотока, исследованный с помощью ксенон КТ выявил нормальный или усиленный кровоток в зоне острого повреждения и непораженных областях, что предполагает, что инсультоподобные проявления возникают не из-за фокальной ишемии( Morita K, et. al 1989, Ooiwa Y et al. 1993) SPECT обычно выявляет снижение аккумуляции вводимого вещества в зонах повреждения, возможно, в связи с потерей метаболически активных клеток( Saton M et al 1991, Watanabe Y et al 1998) Имеются интересные наблюдения об увеличении поглощения вещества при SPECT и увеличение регионального кровотока при PET исследованиях за 3 -6 дней до появления инсульта ( Takahashi S et al 1998). Возможно, что повышение кровотока до острого инсультоподобного эпизода может отражать локализованный ответ на повышение уровня лактата, фокального повышения метаболизма или повреждения вазорегуляции. MRS (магниторезонансная спектроскопия) выявляет повышение лактата в головном мозга, отражающее компенсаторное повышение анаэробного гликолиза. Выявлено также, что содержание вентрикулярного лактата находится в прямой корреляционной зависимости от неврологическогодефицита при MELAS ( Dubeau F et al 2000, Kaufmann P et al 2004)
Количественный анализ церебрального кровотока, исследованный с помощью ксенон КТ выявил нормальный или усиленный кровоток в зоне острого повреждения и непораженных областях, что предполагает, что инсультоподобные проявления возникают не из-за фокальной ишемии( Morita K, et. al 1989, Ooiwa Y et al. 1993) SPECT обычно выявляет снижение аккумуляции вводимого вещества в зонах повреждения, возможно, в связи с потерей метаболически активных клеток( Saton M et al 1991, Watanabe Y et al 1998) Имеются интересные наблюдения об увеличении поглощения вещества при SPECT и увеличение регионального кровотока при PET исследованиях за 3 -6 дней до появления инсульта ( Takahashi S et al 1998). Возможно, что повышение кровотока до острого инсультоподобного эпизода может отражать локализованный ответ на повышение уровня лактата, фокального повышения метаболизма или повреждения вазорегуляции. MRS (магниторезонансная спектроскопия) выявляет повышение лактата в головном мозга, отражающее компенсаторное повышение анаэробного гликолиза. Выявлено также, что содержание вентрикулярного лактата находится в прямой корреляционной зависимости от неврологическогодефицита при MELAS ( Dubeau F et al 2000, Kaufmann P et al 2004)

 Т. О. суммируя все вышеизложенное, нейрорадиологические исследования при синдроме MELAS выявили, что атипичные инсультоподобные пароксизмы возникают не столько от острой ишемии, сколько от метаболической дисфункции со снижением окислительного фосфорилирования, повышением уровня лактата и снижением синтеза АТФ [ Di. Mauro S. et al 2006]. Это доказывает необходимость дифференцированного подхода в терапии данных состояний, которые могут мимикрировать под ишемический инсульт [ Finsterer J 2009]. Несмотря на интенсивное изучение патогенеза инсультоподобных пароксизмов при синдроме MELAS , он остается неясным. Однако, предложены 2 основные теории : ишемическая васкулярная – “митохондриальная ангиопатия” и общая цитопатическая гипотеза, причиной которой является “митохондриальная цитопатия” [ Iizuka t. , Sakai F 2005]. Однако, большинство исследователей придерживается теории, что инсультоподобные пароксизмы являются неишемическим нейроваскулярным событием [ Iizuka T et al 2007]. Дифференциальная диагностика – коагулопатии, антифосфолипидный синдром, тромбофилии, синдром Эллерса-Данлоса 1 Y типа, гомоцистинурия
Т. О. суммируя все вышеизложенное, нейрорадиологические исследования при синдроме MELAS выявили, что атипичные инсультоподобные пароксизмы возникают не столько от острой ишемии, сколько от метаболической дисфункции со снижением окислительного фосфорилирования, повышением уровня лактата и снижением синтеза АТФ [ Di. Mauro S. et al 2006]. Это доказывает необходимость дифференцированного подхода в терапии данных состояний, которые могут мимикрировать под ишемический инсульт [ Finsterer J 2009]. Несмотря на интенсивное изучение патогенеза инсультоподобных пароксизмов при синдроме MELAS , он остается неясным. Однако, предложены 2 основные теории : ишемическая васкулярная – “митохондриальная ангиопатия” и общая цитопатическая гипотеза, причиной которой является “митохондриальная цитопатия” [ Iizuka t. , Sakai F 2005]. Однако, большинство исследователей придерживается теории, что инсультоподобные пароксизмы являются неишемическим нейроваскулярным событием [ Iizuka T et al 2007]. Дифференциальная диагностика – коагулопатии, антифосфолипидный синдром, тромбофилии, синдром Эллерса-Данлоса 1 Y типа, гомоцистинурия
 ЛЕЧЕНИЕ МИТОХОНДРИАЛЬНЫХ БОЛЕЗНЕЙ Нет достоверных подтверждений, что какая-либо терапия может быть эффективна в отношении митохондриальных болезней. Различные антиоксиданты, витамины, кофакторы дыхательной цепи применяются у детей, страдающих обменными расстройствами. При синдроме MELAS лечение должно быть направлено на лечение судорог, эндокринных расстройств, устранение последствий инсульта. Т. к. уровень лактата часто коррелирует с тяжестью неврологических проявлений, целесообразно применять дихлорацетат (у нас в стране используется демифосфон) для снижения уровня лактата ( Kaufmann P et al, 2006) В исследованиях японских авторов Koga Y et al, 2002, 2005, 2008 использовался в\в L -аргинин, предшественник NO , для стимуляции вазодилятации в остром периоде инсульта с хорошими результатами, а также пероральное его применение для снижения тяжести последующих эпизодов Казанцева Л. З. , Юрьева Э. А. , Николаева Е. А. и др 2001 -Основные методы лечения детей, страдающих митохондриальными заболеваниями
ЛЕЧЕНИЕ МИТОХОНДРИАЛЬНЫХ БОЛЕЗНЕЙ Нет достоверных подтверждений, что какая-либо терапия может быть эффективна в отношении митохондриальных болезней. Различные антиоксиданты, витамины, кофакторы дыхательной цепи применяются у детей, страдающих обменными расстройствами. При синдроме MELAS лечение должно быть направлено на лечение судорог, эндокринных расстройств, устранение последствий инсульта. Т. к. уровень лактата часто коррелирует с тяжестью неврологических проявлений, целесообразно применять дихлорацетат (у нас в стране используется демифосфон) для снижения уровня лактата ( Kaufmann P et al, 2006) В исследованиях японских авторов Koga Y et al, 2002, 2005, 2008 использовался в\в L -аргинин, предшественник NO , для стимуляции вазодилятации в остром периоде инсульта с хорошими результатами, а также пероральное его применение для снижения тяжести последующих эпизодов Казанцева Л. З. , Юрьева Э. А. , Николаева Е. А. и др 2001 -Основные методы лечения детей, страдающих митохондриальными заболеваниями
 ИСПОЛЬЗУЕМЫЕ ПРЕПАРТЫ Коэнзим Q 10 – от 90 до 200 мг/сут L карнитин – от 10 мг до 1 -2 г/сут Вит В 1 400 мг/сут Вит В 2 100 мг/сут Вит С до 1 г/сут Вит Е 400 МЕ в сут Никотинамид до 500 мг / сут Янтарная кислота от 25 мг до 1. 5 г в сутки Демифосфон 15% 1 мл на 5 кг веса Цитохром С 4. 0 в, в, Реамберин в/в, цитофлавин в / в и перорально
ИСПОЛЬЗУЕМЫЕ ПРЕПАРТЫ Коэнзим Q 10 – от 90 до 200 мг/сут L карнитин – от 10 мг до 1 -2 г/сут Вит В 1 400 мг/сут Вит В 2 100 мг/сут Вит С до 1 г/сут Вит Е 400 МЕ в сут Никотинамид до 500 мг / сут Янтарная кислота от 25 мг до 1. 5 г в сутки Демифосфон 15% 1 мл на 5 кг веса Цитохром С 4. 0 в, в, Реамберин в/в, цитофлавин в / в и перорально
 Кортикостероиды, минералокортикоиды — при развитии надпочечниковой недостаточности Антиконвульсанты (исключая вальпроевую кислоту и ее производные, ограничивая барбитураты) В наших исследованиях наиболее эффективной противосудорожной терапией являлось использование препарата леветирацетам, топирамат или их сочетаний
Кортикостероиды, минералокортикоиды — при развитии надпочечниковой недостаточности Антиконвульсанты (исключая вальпроевую кислоту и ее производные, ограничивая барбитураты) В наших исследованиях наиболее эффективной противосудорожной терапией являлось использование препарата леветирацетам, топирамат или их сочетаний
 Имеется большой пул заболеваний, причиной которых является не мутации митохондриальной ДНК, а мутации ядерной ДНК, кодирующей работу митохондрий. К ним относятся Болезнь Барта – миопатия, кардиомиопатия, транзиторные нейтро и тромбоцитопении Митохондриальная гастроинтестинальная энцефалопатия (аутосомно-рецессивное мультисистемное заболевание)-птоз, офтальмоплегия, периферическая нейропатия, гастроинтестинальная дисфункция, приводящая к кахексии, лейкоэнцефалопатия. Дебют от периода новорожденности до 43 лет Синдром Лея
Имеется большой пул заболеваний, причиной которых является не мутации митохондриальной ДНК, а мутации ядерной ДНК, кодирующей работу митохондрий. К ним относятся Болезнь Барта – миопатия, кардиомиопатия, транзиторные нейтро и тромбоцитопении Митохондриальная гастроинтестинальная энцефалопатия (аутосомно-рецессивное мультисистемное заболевание)-птоз, офтальмоплегия, периферическая нейропатия, гастроинтестинальная дисфункция, приводящая к кахексии, лейкоэнцефалопатия. Дебют от периода новорожденности до 43 лет Синдром Лея
 Важность своевременной диагностики митохондриальных болезней, поиска клинических и параклинических критериев этих заболеваний на этапе предварительном, догенетическом, необходимо для подбора адекватной метаболической терапии и предотвращения ухудшения состояния или инвалидизации больных с этими редкими заболеваниями.
Важность своевременной диагностики митохондриальных болезней, поиска клинических и параклинических критериев этих заболеваний на этапе предварительном, догенетическом, необходимо для подбора адекватной метаболической терапии и предотвращения ухудшения состояния или инвалидизации больных с этими редкими заболеваниями.


