 Межмолекулярные силы. Водородная связь.
Межмолекулярные силы. Водородная связь.
 Доказательства существования сил притяжения: Не идеальность реальных газов, т.е. реальные газа не подчиняются уравнению: . Эффект Джоуля – Томсона: газ проходящий через пористую перегородку свободно расширяясь обычно охлаждается. Это доказывает, что при расширении газ преодолевает силы притяжения на что тратит энергию – охлаждаясь. Инертные газы, которые не образуют валентные связи могут конденсироваться в жидкую и твердую фазы с выделением энергии, что указывает на наличие сил сцепления.
Доказательства существования сил притяжения: Не идеальность реальных газов, т.е. реальные газа не подчиняются уравнению: . Эффект Джоуля – Томсона: газ проходящий через пористую перегородку свободно расширяясь обычно охлаждается. Это доказывает, что при расширении газ преодолевает силы притяжения на что тратит энергию – охлаждаясь. Инертные газы, которые не образуют валентные связи могут конденсироваться в жидкую и твердую фазы с выделением энергии, что указывает на наличие сил сцепления.
 Для реальных газов с учетом сил Ван-дер-Ваальса записывается в следующем виде: где а – эмпирический коэффициент учитывающий природу взаимодействий, b – собственный объем молекул, P – давление газа, V – объем газа. учитывает межмолекулярное взаимодействие молекул,
Для реальных газов с учетом сил Ван-дер-Ваальса записывается в следующем виде: где а – эмпирический коэффициент учитывающий природу взаимодействий, b – собственный объем молекул, P – давление газа, V – объем газа. учитывает межмолекулярное взаимодействие молекул,
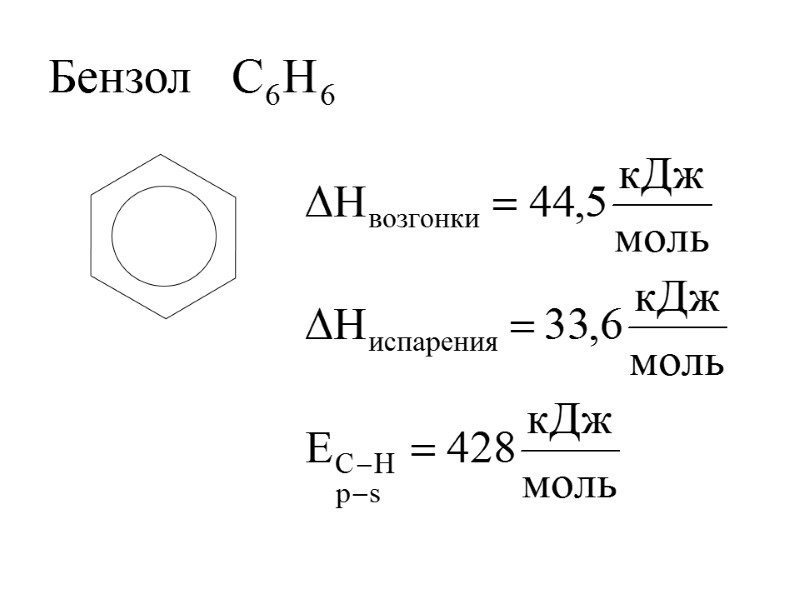 Бензол
Бензол
 Свойства межмолекулярных взаимодействий: Неполная насыщенность; Слабая направленность; Малые энергии.
Свойства межмолекулярных взаимодействий: Неполная насыщенность; Слабая направленность; Малые энергии.
 Физические модели межмолекулярных взаимодействий. Ориентационные взаимодействия.
Физические модели межмолекулярных взаимодействий. Ориентационные взаимодействия.
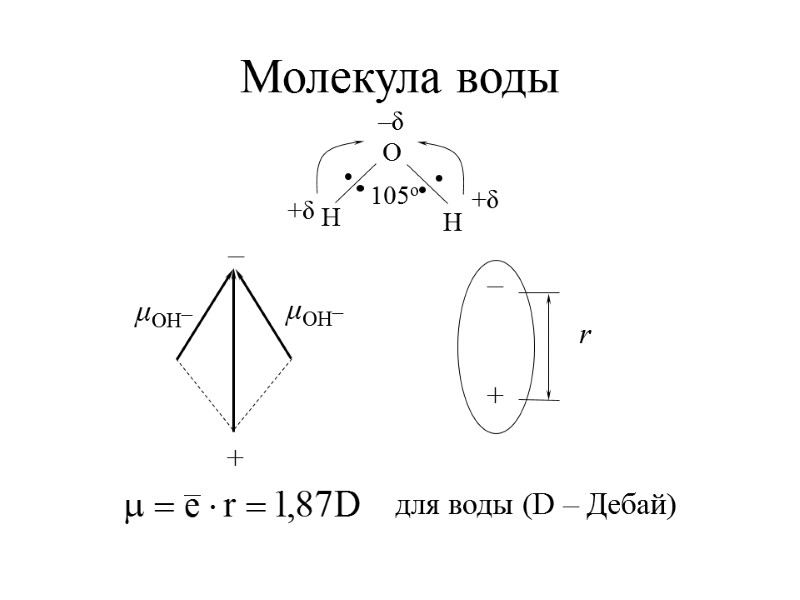 Молекула воды для воды (D – Дебай)
Молекула воды для воды (D – Дебай)
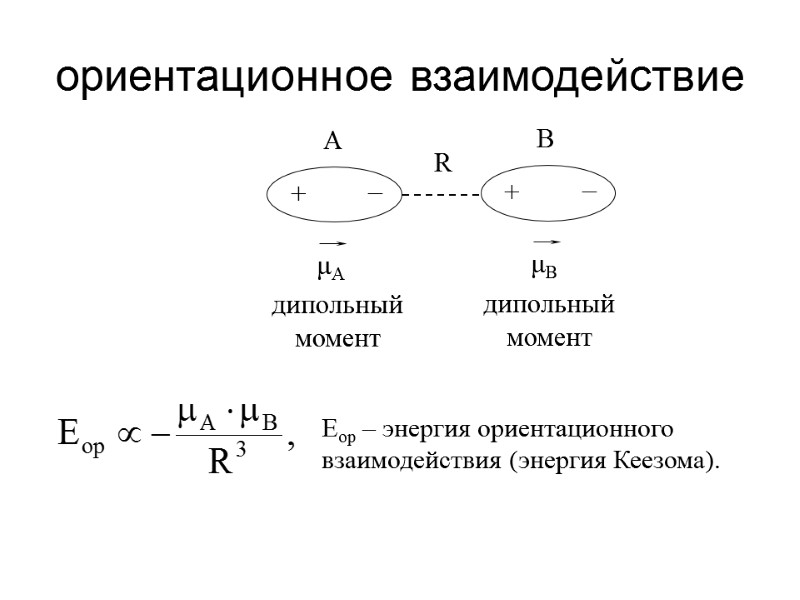 ориентационное взаимодействие Eор – энергия ориентационного взаимодействия (энергия Кеезома).
ориентационное взаимодействие Eор – энергия ориентационного взаимодействия (энергия Кеезома).
 Индукционное взаимодействие. Взаимодействие полярных и неполярных молекул.
Индукционное взаимодействие. Взаимодействие полярных и неполярных молекул.
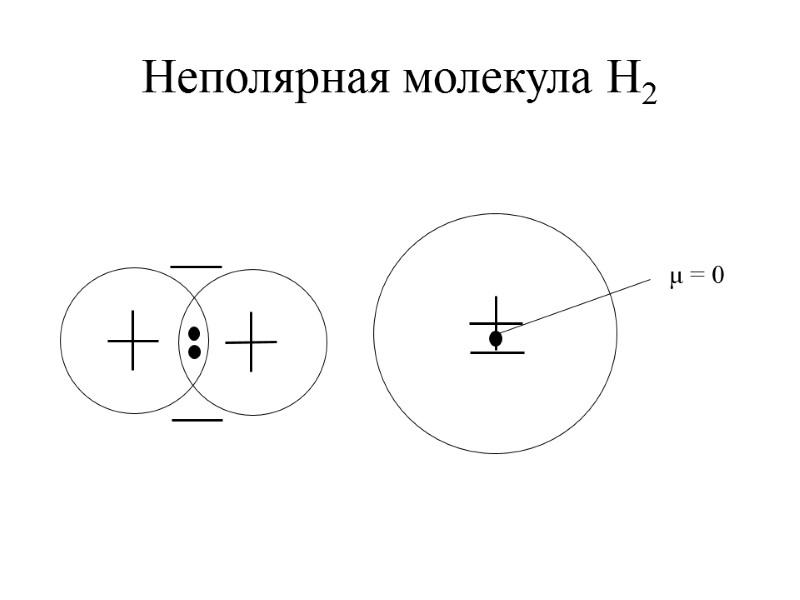 Неполярная молекула H2
Неполярная молекула H2
 Энергия индукционного взаимодействия не зависит от температуры, а определяется дипольным моментом полярной молекулы и поляризуемостью неполярной молекулы – α. Питер Дебай (1920 г.)
Энергия индукционного взаимодействия не зависит от температуры, а определяется дипольным моментом полярной молекулы и поляризуемостью неполярной молекулы – α. Питер Дебай (1920 г.)
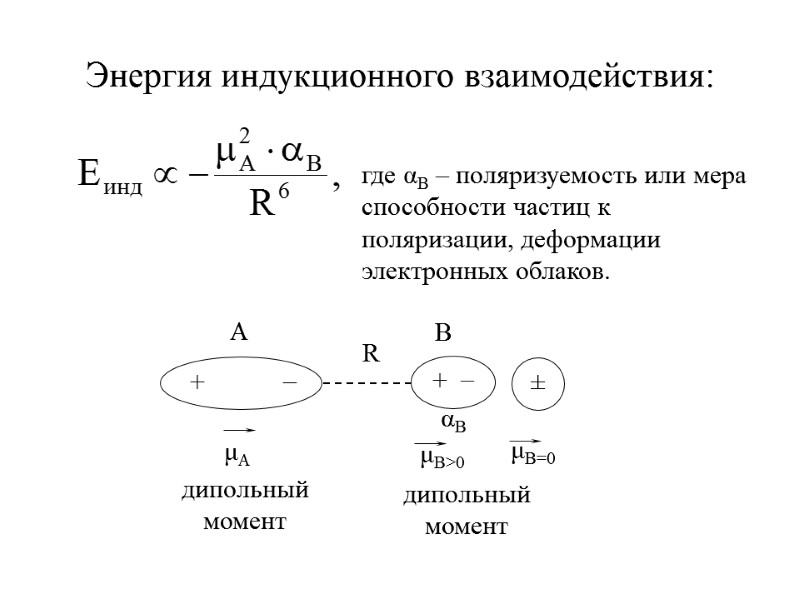 где αB – поляризуемость или мера способности частиц к поляризации, деформации электронных облаков. Энергия индукционного взаимодействия:
где αB – поляризуемость или мера способности частиц к поляризации, деформации электронных облаков. Энергия индукционного взаимодействия:
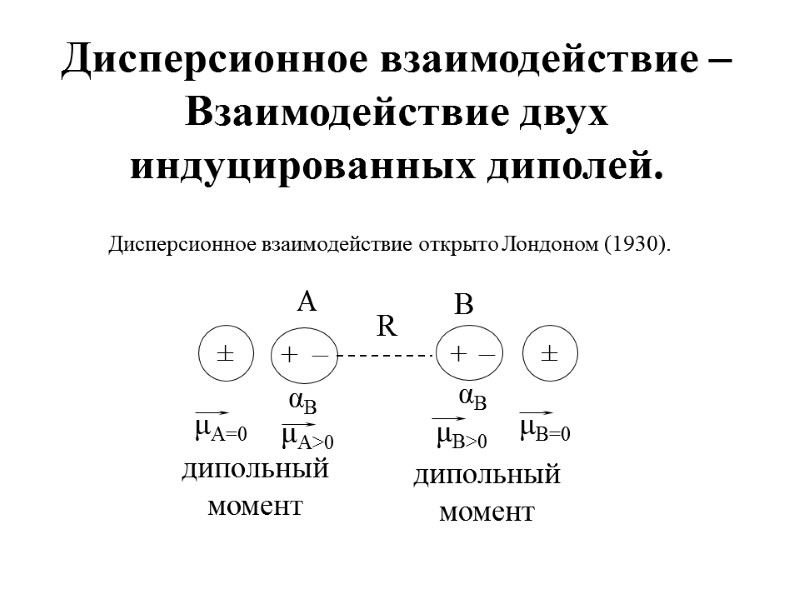 Дисперсионное взаимодействие – Взаимодействие двух индуцированных диполей. Дисперсионное взаимодействие открыто Лондоном (1930).
Дисперсионное взаимодействие – Взаимодействие двух индуцированных диполей. Дисперсионное взаимодействие открыто Лондоном (1930).
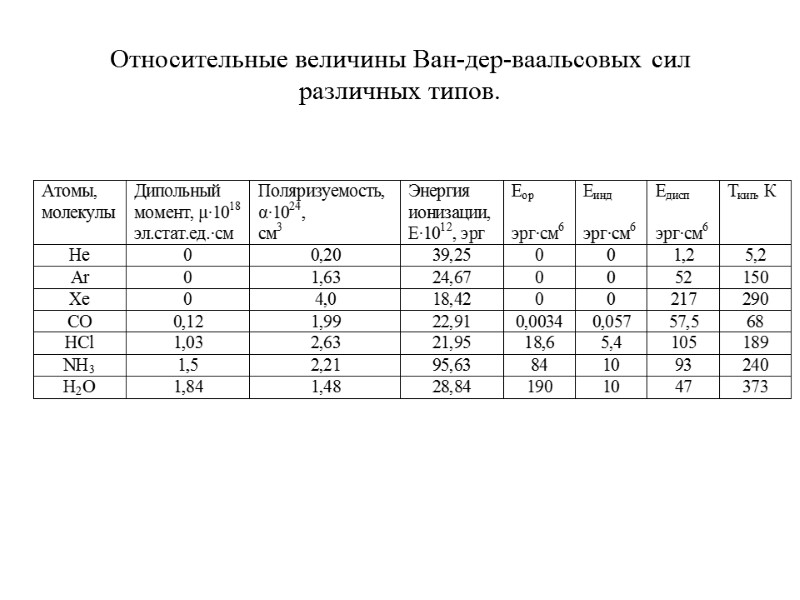 Относительные величины Ван-дер-ваальсовых сил различных типов.
Относительные величины Ван-дер-ваальсовых сил различных типов.
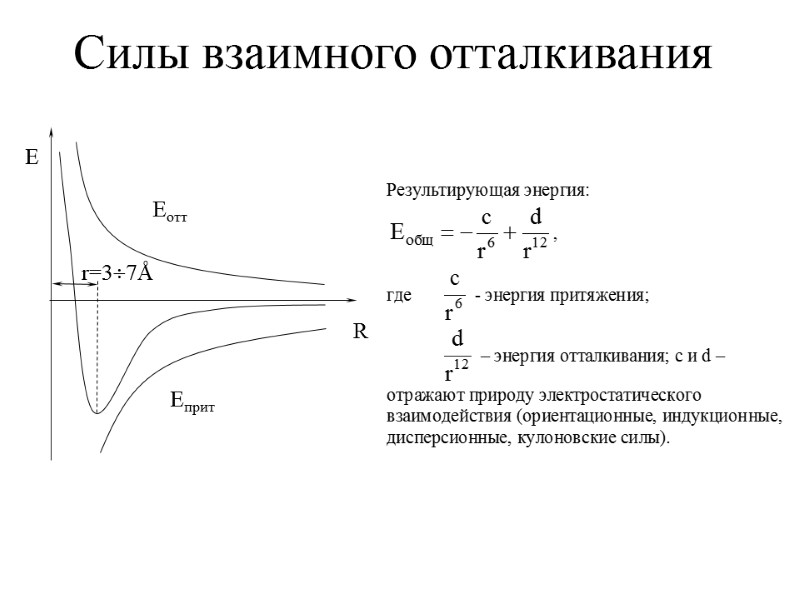 Силы взаимного отталкивания
Силы взаимного отталкивания
 Водородная связь. Например:
Водородная связь. Например:
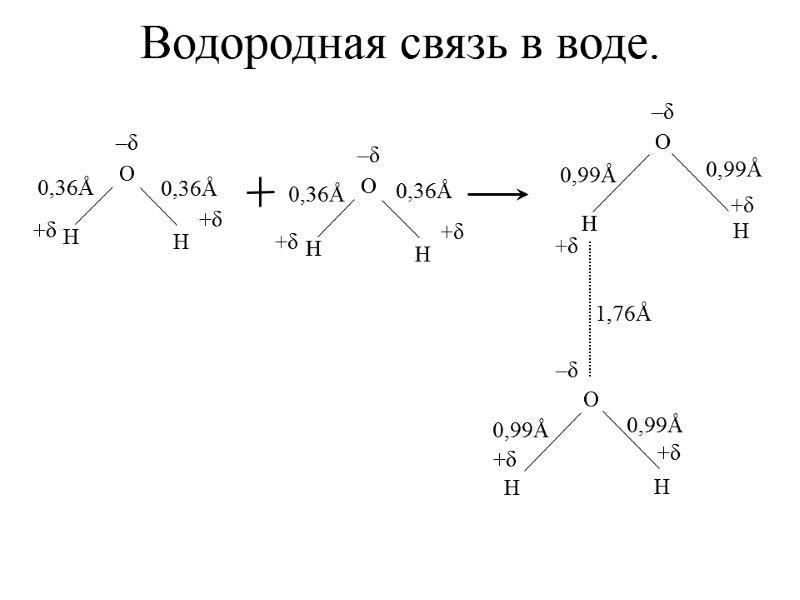 Водородная связь в воде.
Водородная связь в воде.
 Закона Кулона: где ε – диэлектрическая проницаемость среды. Некоторые значения водородной связи: HF (H – F 42 кДж), H2O (O – H 21 кДж); в NH3 (N – H 8,4 кДж)
Закона Кулона: где ε – диэлектрическая проницаемость среды. Некоторые значения водородной связи: HF (H – F 42 кДж), H2O (O – H 21 кДж); в NH3 (N – H 8,4 кДж)
 - жидкая вода является неорганическим полимером со степенью полимеризации n.
- жидкая вода является неорганическим полимером со степенью полимеризации n.
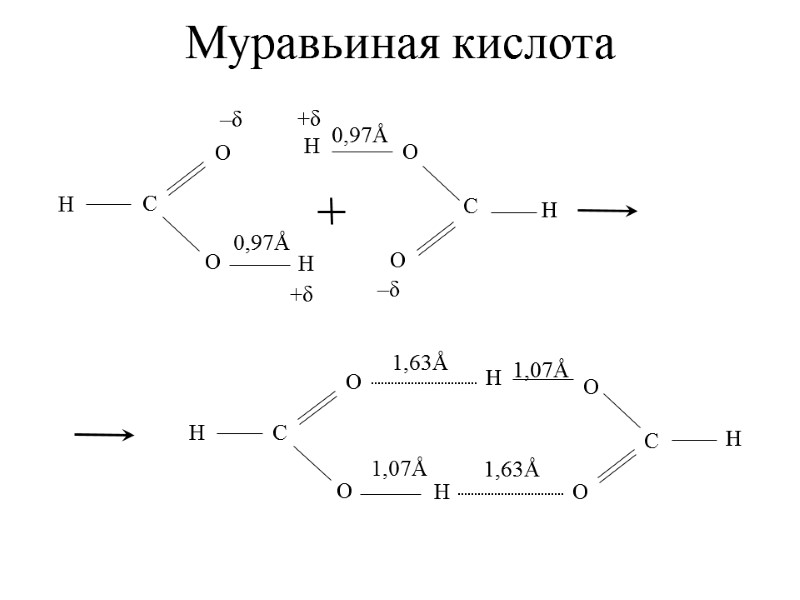 Муравьиная кислота
Муравьиная кислота
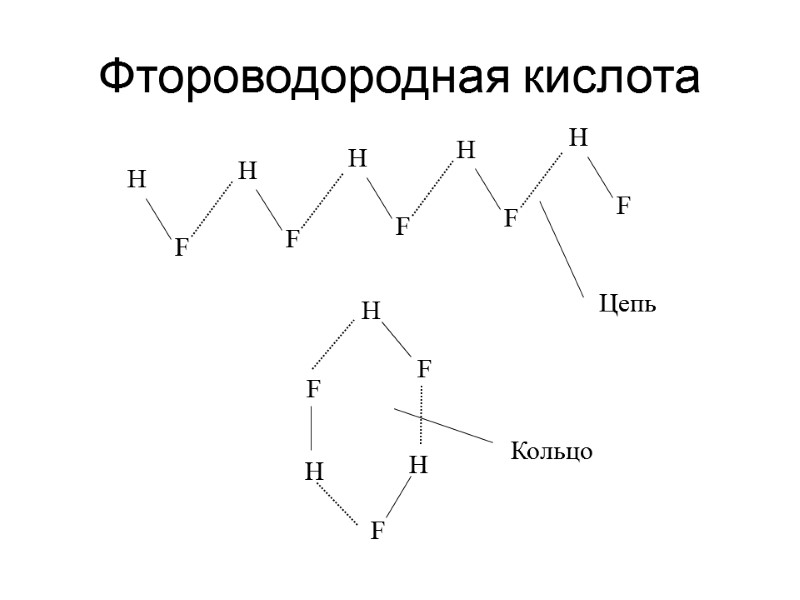 Фтороводородная кислота
Фтороводородная кислота









































