МЕТОД КИСЛОТНО- ОСНОВНОГО ТИТРОВАНИЯ Химизм






















Метод кислотно-основного титрованияя.ppt
- Количество слайдов: 24
 МЕТОД КИСЛОТНО- ОСНОВНОГО ТИТРОВАНИЯ Химизм метода и его разновидности • Титранты • Установочные вещества • Индикаторы, • Примеры определяемых веществ
МЕТОД КИСЛОТНО- ОСНОВНОГО ТИТРОВАНИЯ Химизм метода и его разновидности • Титранты • Установочные вещества • Индикаторы, • Примеры определяемых веществ
 МЕТОД КИСЛОТНО- ОСНОВНОГО ТИТРОВАНИЯ (НЕЙТРАЛИЗАЦИИ). В ОСНОВЕ МЕТОДА НЕЙТРАЛИЗАЦИИ ЛЕЖАТ РЕАКЦИИ НЕЙТРАЛИЗАЦИИ: Н+ + ОН— —-> Н 2 О
МЕТОД КИСЛОТНО- ОСНОВНОГО ТИТРОВАНИЯ (НЕЙТРАЛИЗАЦИИ). В ОСНОВЕ МЕТОДА НЕЙТРАЛИЗАЦИИ ЛЕЖАТ РЕАКЦИИ НЕЙТРАЛИЗАЦИИ: Н+ + ОН— —-> Н 2 О
 КИСЛОТНО – ОСНОВНОЕ ТИТРОВАНИЕ Ацидиметрия Алкалиметрия Титрование кислотами основаниями
КИСЛОТНО – ОСНОВНОЕ ТИТРОВАНИЕ Ацидиметрия Алкалиметрия Титрование кислотами основаниями
 • АЦИДИМЕТРИЯ Рабочий раствор: 0, 1 н и 0, 01 н НСI или H 2 SO 4. Применяют для определения : веществ основного характера, содержащие азот (алкалоиды, любые гетероциклические соединения), основания, соли образованные слабой кислотой и сильным основанием (например, Nа. НСОз, Nа 2 СОз и др).
• АЦИДИМЕТРИЯ Рабочий раствор: 0, 1 н и 0, 01 н НСI или H 2 SO 4. Применяют для определения : веществ основного характера, содержащие азот (алкалоиды, любые гетероциклические соединения), основания, соли образованные слабой кислотой и сильным основанием (например, Nа. НСОз, Nа 2 СОз и др).
 УСТАНОВОЧНЫЕ ВЕЩЕСТВА Для стандартизации кислот 1. Натрия карбонат Na 2 CO 3, высушенный при 270 -3000 С, 2. Hатрия тетраборат Na 2 B 4 O 7* 10 H 2 O, перекристаллизованный при 600 С из воды и высушенный, Э= М. м. /2
УСТАНОВОЧНЫЕ ВЕЩЕСТВА Для стандартизации кислот 1. Натрия карбонат Na 2 CO 3, высушенный при 270 -3000 С, 2. Hатрия тетраборат Na 2 B 4 O 7* 10 H 2 O, перекристаллизованный при 600 С из воды и высушенный, Э= М. м. /2
 ИНДИКАТОРЫ М/о Т) (переход окраски при р. Н 3, 1 - 4, 4) от жёлтого до красного • М/К(метиловый красный) (переход окраски при р. Н 4, 2 - 6, 3) от жёлтого до красного • Бромфеноловый синий (р. Н З - 4, 6) от жёлтого до фиолетового
ИНДИКАТОРЫ М/о Т) (переход окраски при р. Н 3, 1 - 4, 4) от жёлтого до красного • М/К(метиловый красный) (переход окраски при р. Н 4, 2 - 6, 3) от жёлтого до красного • Бромфеноловый синий (р. Н З - 4, 6) от жёлтого до фиолетового
 Индикатор
Индикатор
 ИНДИКАТОРЫ • СМЕШАННЫЙ ИНДИКАТОР М/О+ М/С В НАЧАЛЕ ТИТРОВАНИЯ -ЖЁЛТЫЙ + СИНИЙ= ЗЕЛЁНЫЙ В КОНЦЕ ТИТРОВАНИЯ- РОЗОВЫЙ + СИНИЙ=ФИОЛЕТОВЫЙ
ИНДИКАТОРЫ • СМЕШАННЫЙ ИНДИКАТОР М/О+ М/С В НАЧАЛЕ ТИТРОВАНИЯ -ЖЁЛТЫЙ + СИНИЙ= ЗЕЛЁНЫЙ В КОНЦЕ ТИТРОВАНИЯ- РОЗОВЫЙ + СИНИЙ=ФИОЛЕТОВЫЙ
 ПРИМЕРЫ ЛЕКАРСТВЕННЫХ ВЕЩЕСТВ - Бензоат натрия - Na. HC 03 - Натрия салицилат - Сульфацил натрия - Этазол натрия - Гексаметилтетрамин
ПРИМЕРЫ ЛЕКАРСТВЕННЫХ ВЕЩЕСТВ - Бензоат натрия - Na. HC 03 - Натрия салицилат - Сульфацил натрия - Этазол натрия - Гексаметилтетрамин
 ПРИМЕР МЕТОДИКИ ОПРЕДЕЛЕНИЯ И РАСЧЁТА Натрия гидрокарбонат Ацидиметрия Na. HCO 3 +HCL→ Na. CL +CO 2 +H 2 O Э= М (Na. HCO 3) Точную навеску препарата (или его раствора)растворяют в свежепрокипяченой и охлажденной воде, добавляют индикатор М/К и титруют 0, 1 н. HCL от желтого до красного окрашивания. X% = V*K*T*100% а
ПРИМЕР МЕТОДИКИ ОПРЕДЕЛЕНИЯ И РАСЧЁТА Натрия гидрокарбонат Ацидиметрия Na. HCO 3 +HCL→ Na. CL +CO 2 +H 2 O Э= М (Na. HCO 3) Точную навеску препарата (или его раствора)растворяют в свежепрокипяченой и охлажденной воде, добавляют индикатор М/К и титруют 0, 1 н. HCL от желтого до красного окрашивания. X% = V*K*T*100% а
 • АЛКАЛИМЕТРИЯ Рабочий раствор: 1 н и 0, 01 н, стандартные растворы Na. OH и КОН, реже Ва (ОН)2. Применяют для определения сильных и слабых кислот, органических соединений, проявляющих кислотный характер.
• АЛКАЛИМЕТРИЯ Рабочий раствор: 1 н и 0, 01 н, стандартные растворы Na. OH и КОН, реже Ва (ОН)2. Применяют для определения сильных и слабых кислот, органических соединений, проявляющих кислотный характер.
 УСТАНОВОЧНЫЕ ВЕЩЕСТВА Для стандартизации оснований щавелевая кислота(дигидрат) H 2 C 2 O 4 *2 H 2 O, перекристаллизованная из соляной кислоты и воды и высушенная Э= М. м. /2
УСТАНОВОЧНЫЕ ВЕЩЕСТВА Для стандартизации оснований щавелевая кислота(дигидрат) H 2 C 2 O 4 *2 H 2 O, перекристаллизованная из соляной кислоты и воды и высушенная Э= М. м. /2
 ИНДИКАТОРЫ Ф/Ф (интервал изменения окраски р. Н 8, 2 - 10, 0) от бесцветного до бледно- розово-малинового. Тимолфталеин верно перетитровано (интервал изменения окраски р. Н 9, 3 - 10, 3) от бесцветного до синего
ИНДИКАТОРЫ Ф/Ф (интервал изменения окраски р. Н 8, 2 - 10, 0) от бесцветного до бледно- розово-малинового. Тимолфталеин верно перетитровано (интервал изменения окраски р. Н 9, 3 - 10, 3) от бесцветного до синего
 ОПРЕДЕЛЯЮТ ЛЕКАРСТВЕННЫЕ ВЕЩЕСТВА - НCI - кислота ацетилсалициловая - кислота борная - новокаин - дибазол - пиридоксин гидрохлорид - кислота глютаминовая - кислота аскорбиновая - кислота бензойная - кислота салициловая - промедол, барбитураты
ОПРЕДЕЛЯЮТ ЛЕКАРСТВЕННЫЕ ВЕЩЕСТВА - НCI - кислота ацетилсалициловая - кислота борная - новокаин - дибазол - пиридоксин гидрохлорид - кислота глютаминовая - кислота аскорбиновая - кислота бензойная - кислота салициловая - промедол, барбитураты
 • КИСЛОТНО-ОСНОВНОЕ ТИТРОВАНИЕ В НЕВОДНЫХ РАСТВОРАХ Для проведения кислотно-неводного титрования используются неводные растворители. 1. Амфитропные (амфотерные) - Н 20 - Метанол - Этанол и др. 2. Протогенные ( кислотные) - Плавиковая кислота - H 2 SO 4 - СН 3 СООН - Муравьиная кислота
• КИСЛОТНО-ОСНОВНОЕ ТИТРОВАНИЕ В НЕВОДНЫХ РАСТВОРАХ Для проведения кислотно-неводного титрования используются неводные растворители. 1. Амфитропные (амфотерные) - Н 20 - Метанол - Этанол и др. 2. Протогенные ( кислотные) - Плавиковая кислота - H 2 SO 4 - СН 3 СООН - Муравьиная кислота
 3. Протофильные (основные) - Аммиак жид - Пиридин - Диметилформамид 4. Индиферентные (апротные) • Бензол С 6 Н 12
3. Протофильные (основные) - Аммиак жид - Пиридин - Диметилформамид 4. Индиферентные (апротные) • Бензол С 6 Н 12
 ТИТРИМЕТРИЧЕСКИЕ МЕТОДЫ АНАЛИЗА. РАСЧЕТЫ Концентрацию растворов вычисляют одним из указанных ниже способов: 1 способ - по навеске химически чистого вещества. Молярность (М, моль/л) вычисляют по формуле: а * 1000 N = ------ Э * V а - навеска химически чистого вещества в граммах Э - молярная масса условных частиц химически чистого вещества в граммах на моль (эквивалент). V - объем раствора , пошедшего на титрование навески в мл. 1000 - количество мл в 1 л раствора.
ТИТРИМЕТРИЧЕСКИЕ МЕТОДЫ АНАЛИЗА. РАСЧЕТЫ Концентрацию растворов вычисляют одним из указанных ниже способов: 1 способ - по навеске химически чистого вещества. Молярность (М, моль/л) вычисляют по формуле: а * 1000 N = ------ Э * V а - навеска химически чистого вещества в граммах Э - молярная масса условных частиц химически чистого вещества в граммах на моль (эквивалент). V - объем раствора , пошедшего на титрование навески в мл. 1000 - количество мл в 1 л раствора.
 2 способ - по титрованному раствору известной концентрации. Молярность (нормальность) вычисляют по следующей формуле: N 0 V 0 N = ------- V N 0 - нормальность раствора вещества, по которому устанавливается титр, V 0 - объем раствора, по которому устанавливается титр, V - объем раствора, молярность которого устанавливают в миллилитрах.
2 способ - по титрованному раствору известной концентрации. Молярность (нормальность) вычисляют по следующей формуле: N 0 V 0 N = ------- V N 0 - нормальность раствора вещества, по которому устанавливается титр, V 0 - объем раствора, по которому устанавливается титр, V - объем раствора, молярность которого устанавливают в миллилитрах.
 ТИТРОВАННЫХ РАСТВОРОВ ВЫЧИСЛЯЮТ ПОПРАВОЧНЫЙ КОЭФФИЦИЕНТ В НОРМАЛЬНОСТИ (К) Рассчитывают по следующей формуле: Тпр Vпр. К = ------------ Ттеор Vтеор. Тпр- титр действительного раствора, Ттеор- теоретический титр.
ТИТРОВАННЫХ РАСТВОРОВ ВЫЧИСЛЯЮТ ПОПРАВОЧНЫЙ КОЭФФИЦИЕНТ В НОРМАЛЬНОСТИ (К) Рассчитывают по следующей формуле: Тпр Vпр. К = ------------ Ттеор Vтеор. Тпр- титр действительного раствора, Ттеор- теоретический титр.
 ОСНОВНЫЕ ОПЕРАЦИИ Взвешивание навесок Отмеривание объёмов Титрование: • прямое • обратное • заместительное
ОСНОВНЫЕ ОПЕРАЦИИ Взвешивание навесок Отмеривание объёмов Титрование: • прямое • обратное • заместительное
 ПРИ ПРЯМОМ ТИТРОВАНИИ По количеству пошедшего на титрование титранта ( V ) рассчитывают результаты анализа. V K Т 100 Х% = ----------- а V K Т Р Х = -------- а а – навеска исследуемого вещества, Т – титр соответствия
ПРИ ПРЯМОМ ТИТРОВАНИИ По количеству пошедшего на титрование титранта ( V ) рассчитывают результаты анализа. V K Т 100 Х% = ----------- а V K Т Р Х = -------- а а – навеска исследуемого вещества, Т – титр соответствия
 ЕСЛИ ИСПОЛЬЗУЮТ РАЗВЕДЕНИЕ V K Т 100 А V K Т Р А Х = ----------- , Х = ------------ а А 1 А-объём колбы, до которого разводят А 1 -объём аликвоты, отобранный на титрование
ЕСЛИ ИСПОЛЬЗУЮТ РАЗВЕДЕНИЕ V K Т 100 А V K Т Р А Х = ----------- , Х = ------------ а А 1 А-объём колбы, до которого разводят А 1 -объём аликвоты, отобранный на титрование
 ПРИ ОБРАТНОМ ТИТРОВАНИИ ИСПОЛЬЗУЮТ ДВА ТИТРАНТА Количество вещества рассчитывают по формуле: Т (V 1 К 1 – V 2 К 2) 100% Х%=С%= ---------------- ; а Т(V 1 К 1 – V 2 К 2) Р Х =m= -----------------. а
ПРИ ОБРАТНОМ ТИТРОВАНИИ ИСПОЛЬЗУЮТ ДВА ТИТРАНТА Количество вещества рассчитывают по формуле: Т (V 1 К 1 – V 2 К 2) 100% Х%=С%= ---------------- ; а Т(V 1 К 1 – V 2 К 2) Р Х =m= -----------------. а
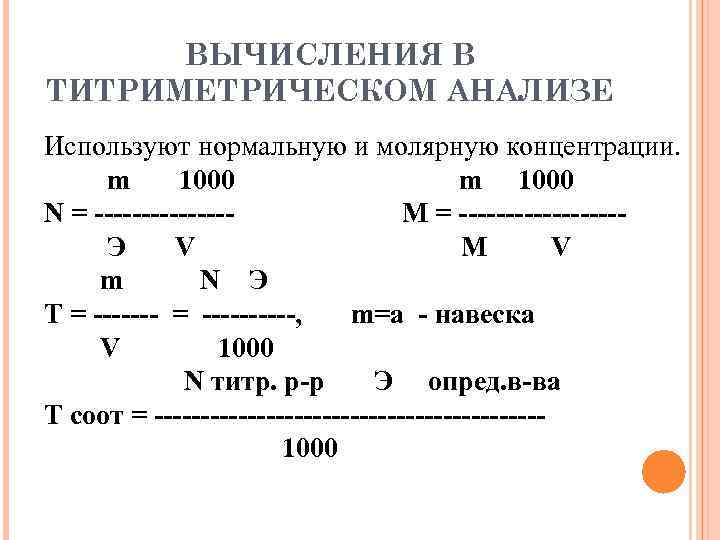
 ВЫЧИСЛЕНИЯ В ТИТРИМЕТРИЧЕСКОМ АНАЛИЗЕ Используют нормальную и молярную концентрации. m 1000 m 1000 N = -------- M = --------- Э V M V m N Э Т = ----------, m=а - навеска V 1000 N титр. р-р Э опред. в-ва Т соот = --------------------- 1000
ВЫЧИСЛЕНИЯ В ТИТРИМЕТРИЧЕСКОМ АНАЛИЗЕ Используют нормальную и молярную концентрации. m 1000 m 1000 N = -------- M = --------- Э V M V m N Э Т = ----------, m=а - навеска V 1000 N титр. р-р Э опред. в-ва Т соот = --------------------- 1000
