Металокомплексний каталіз Промислове використання гомогенних катал і









12_metal_complex_and_enzymatic_catalysis.ppt
- Размер: 1.7 Mегабайта
- Количество слайдов: 23
Описание презентации Металокомплексний каталіз Промислове використання гомогенних катал і по слайдам
 Металокомплексний каталіз
Металокомплексний каталіз
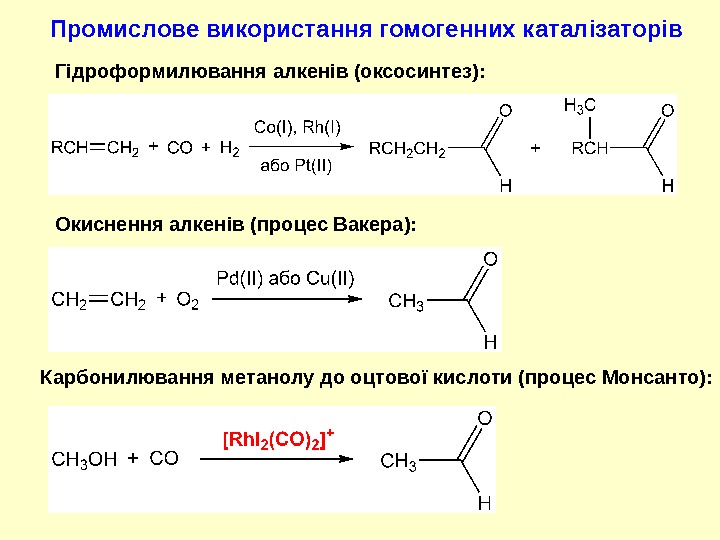
 Промислове використання гомогенних катал і заторів Гідроформилювання алкенів (оксосинтез): Окиснення алкенів (процес Вакера): Карбонилювання метанолу до оцтово ї кислоти (процес Монсанто):
Промислове використання гомогенних катал і заторів Гідроформилювання алкенів (оксосинтез): Окиснення алкенів (процес Вакера): Карбонилювання метанолу до оцтово ї кислоти (процес Монсанто):
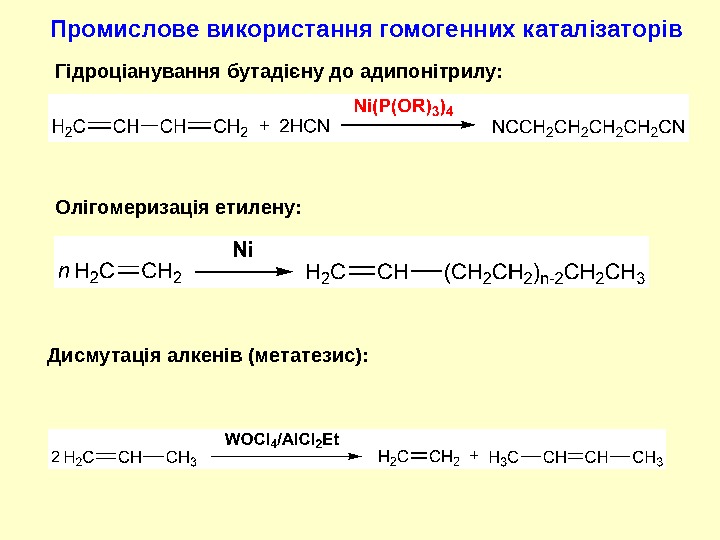
 Промислове використання гомогенних катал і заторів Гідроціанування бутадієну до адипонітрилу: Олігомеризація етилену: Дисмутація алкенів (метатезис):
Промислове використання гомогенних катал і заторів Гідроціанування бутадієну до адипонітрилу: Олігомеризація етилену: Дисмутація алкенів (метатезис):
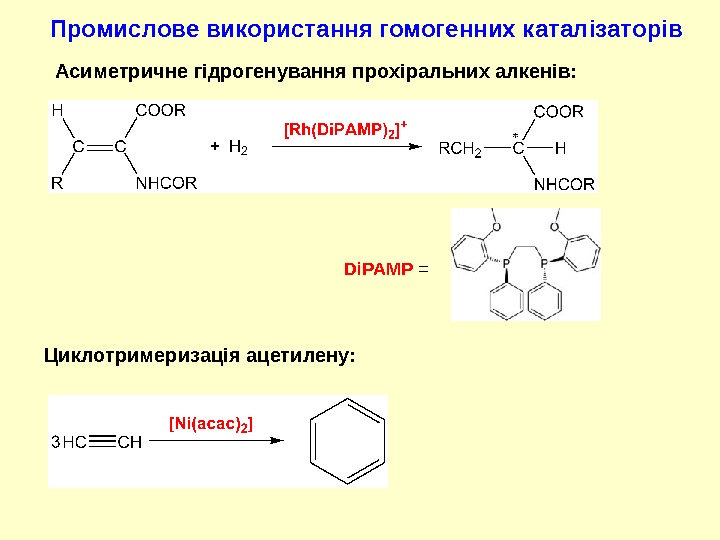
 Промислове використання гомогенних катал і заторів Асиметричне гідрогенування прохіральних алкенів: Циклотримеризація ацетилену: Di. PAMP =
Промислове використання гомогенних катал і заторів Асиметричне гідрогенування прохіральних алкенів: Циклотримеризація ацетилену: Di. PAMP =
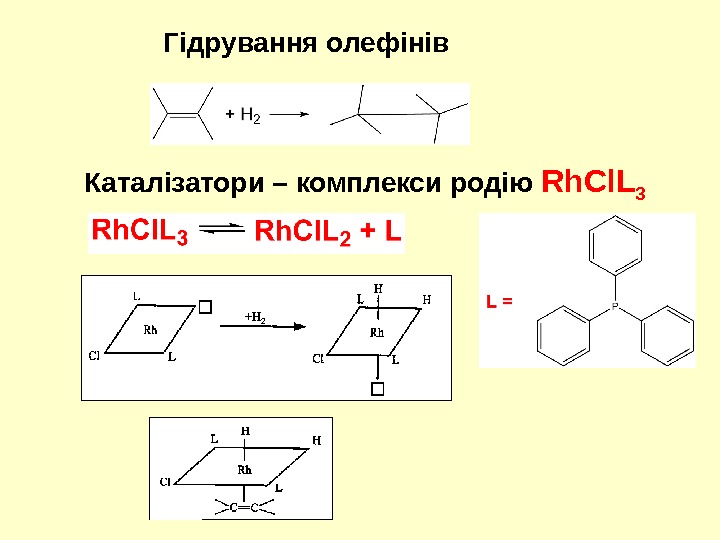
 Гідрування олефінів Каталізатори – комплекси родію Rh. Cl. L
Гідрування олефінів Каталізатори – комплекси родію Rh. Cl. L
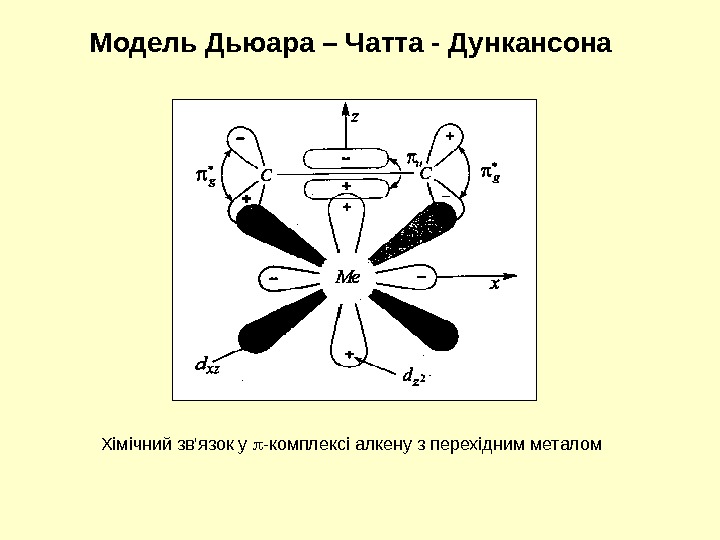
 Хімічний зв’язок у -комплексі алкену з перехідним металом. Модель Дьюара – Чатта — Дункансона
Хімічний зв’язок у -комплексі алкену з перехідним металом. Модель Дьюара – Чатта — Дункансона
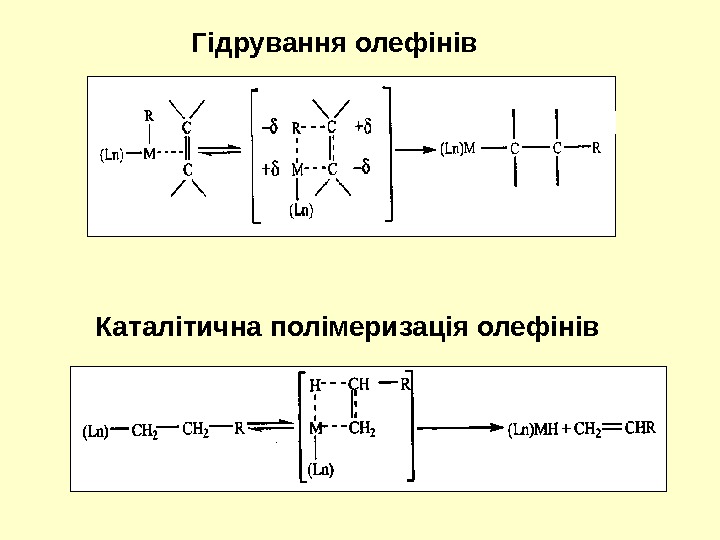
 Гідрування олефінів Каталітична полімеризація олефінів
Гідрування олефінів Каталітична полімеризація олефінів
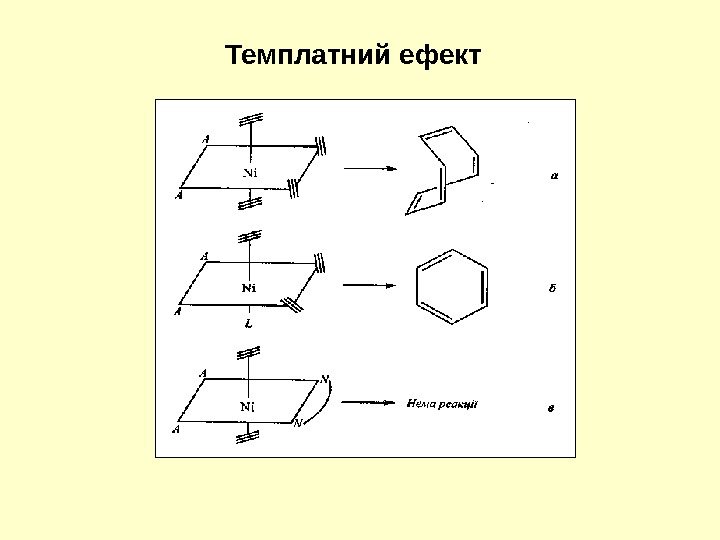
 Темплатний ефект
Темплатний ефект
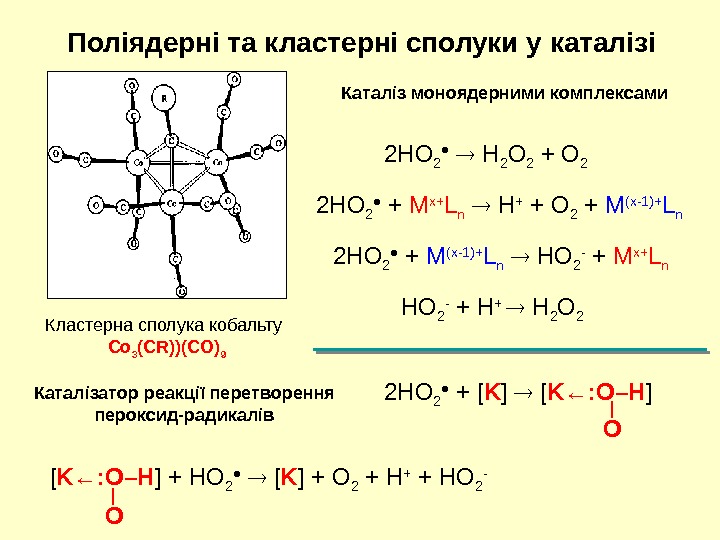
 Кластерна сполука кобальту Co 3 (CR))(CO) 9 Поліядерні та кластерні сполуки у каталізі Каталізатор реакції перетворення пероксид-радикалів 2 HO 2 ● H 2 O 2 + O 2 2 HO 2 ● + M x+ L n H + + O 2 + M (x-1)+ L n 2 HO 2 ● + M (x-1)+ L n HO 2 — + M x+ L n HO 2 — + H + H 2 O 2 [ K ←: O–H ] + HO 2 ● [ K ] + O 2 + H + + HO 2 — I O Каталіз моноядерними комплексами 2 HO 2 ● + [ K ] [ K ←: O–H ] I O
Кластерна сполука кобальту Co 3 (CR))(CO) 9 Поліядерні та кластерні сполуки у каталізі Каталізатор реакції перетворення пероксид-радикалів 2 HO 2 ● H 2 O 2 + O 2 2 HO 2 ● + M x+ L n H + + O 2 + M (x-1)+ L n 2 HO 2 ● + M (x-1)+ L n HO 2 — + M x+ L n HO 2 — + H + H 2 O 2 [ K ←: O–H ] + HO 2 ● [ K ] + O 2 + H + + HO 2 — I O Каталіз моноядерними комплексами 2 HO 2 ● + [ K ] [ K ←: O–H ] I O
 Ферментативний каталіз
Ферментативний каталіз
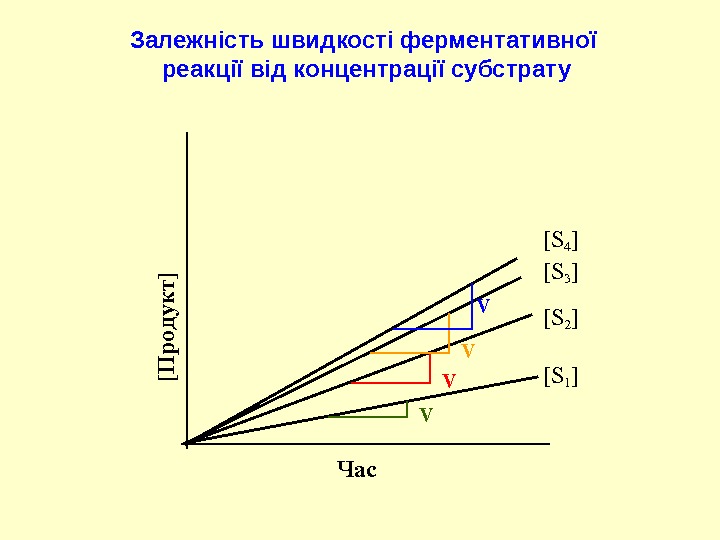
![[П р о д у к т ]Час [S 1 ] VЗалежність швидкості ферментативної [П р о д у к т ]Час [S 1 ] VЗалежність швидкості ферментативної](/docs//12_metal_complex_and_enzymatic_catalysis_images/12_metal_complex_and_enzymatic_catalysis_10.jpg) [П р о д у к т ]Час [S 1 ] VЗалежність швидкості ферментативної реакції від концентрації субстрату [S 2 ] V [S 3 ] V [S 4 ] V
[П р о д у к т ]Час [S 1 ] VЗалежність швидкості ферментативної реакції від концентрації субстрату [S 2 ] V [S 3 ] V [S 4 ] V
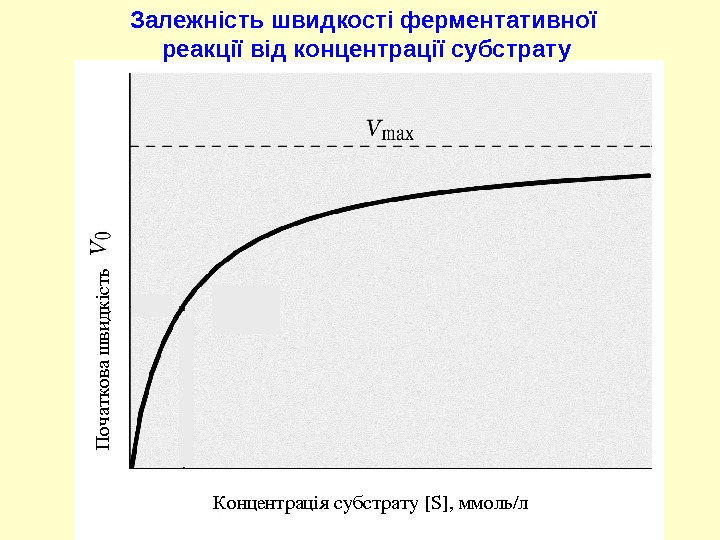
![П о чатк о ваш ви д к ість [S] Концентрація субстрату [S] , П о чатк о ваш ви д к ість [S] Концентрація субстрату [S] ,](/docs//12_metal_complex_and_enzymatic_catalysis_images/12_metal_complex_and_enzymatic_catalysis_11.jpg) П о чатк о ваш ви д к ість [S] Концентрація субстрату [S] , ммоль/л. Залежність швидкості ферментативної реакції від концентрації субстрату
П о чатк о ваш ви д к ість [S] Концентрація субстрату [S] , ммоль/л. Залежність швидкості ферментативної реакції від концентрації субстрату
 Схема Міхаеліса – Ментен E + S E Sk 1 k — 1 k 2 E + P 21 21 [E][S] V kk kk [ES]-][E[E] t 211 [E][S] ]ES[ kk k 21 t 1[ES])[S]-]([E ]ES[ kk k [ES] [P] V 2 k dt d ][EVt 2 max k В станідинамічноїрівноваги( steadystate )швидкістьутвореннясубстрат ензимного комплексудорівнюєшвидкостійогорозпаду: ]E][S[V 1. kутв ]ES)[(V 21. kk розп
Схема Міхаеліса – Ментен E + S E Sk 1 k — 1 k 2 E + P 21 21 [E][S] V kk kk [ES]-][E[E] t 211 [E][S] ]ES[ kk k 21 t 1[ES])[S]-]([E ]ES[ kk k [ES] [P] V 2 k dt d ][EVt 2 max k В станідинамічноїрівноваги( steadystate )швидкістьутвореннясубстрат ензимного комплексудорівнюєшвидкостійогорозпаду: ]E][S[V 1. kутв ]ES)[(V 21. kk розп
![Схема Міхаеліса – Ментен [ES]-][E[E]0 2101 [ES])[S]-]([E ]ES[ kkk M K k kk Схема Міхаеліса – Ментен [ES]-][E[E]0 2101 [ES])[S]-]([E ]ES[ kkk M K k kk](/docs//12_metal_complex_and_enzymatic_catalysis_images/12_metal_complex_and_enzymatic_catalysis_13.jpg) Схема Міхаеліса – Ментен [ES]-][E[E]0 2101 [ES])[S]-]([E ]ES[ kkk M K k kk 1 21 MK [ES])[S]-]([E ]ES[ 0 [S]][S][E ]ES[ 0 MK [S][S]V V max MK V= V max [S] K M + [S]Рівняння Міхаеліса. Ментен [ES][S]-][S][E]ES[ 0 MK
Схема Міхаеліса – Ментен [ES]-][E[E]0 2101 [ES])[S]-]([E ]ES[ kkk M K k kk 1 21 MK [ES])[S]-]([E ]ES[ 0 [S]][S][E ]ES[ 0 MK [S][S]V V max MK V= V max [S] K M + [S]Рівняння Міхаеліса. Ментен [ES][S]-][S][E]ES[ 0 MK
 Константа Міхаеліса якщо k 2 << k 1 , тоді K M фактичноявляєтьсяконстантоюдисоціації K D ES комплексу принизькихконцентраціяхсубстрату. Vпрямопропорційно[S] придужевисокихконцентраціяхсубстрату. Vнезалежитьвід[S] ( реакція„псевдо“нульовогопорядку) K M маєрозмірністьконцентрації(моль/літр) типові величини K M : від 10 -1 до 10 -7 моль/літр ) K M чисельнодорівнюєконцентраціїсубстрату, приякійшвидкість реакціїдосягає V max /
Константа Міхаеліса якщо k 2 << k 1 , тоді K M фактичноявляєтьсяконстантоюдисоціації K D ES комплексу принизькихконцентраціяхсубстрату. Vпрямопропорційно[S] придужевисокихконцентраціяхсубстрату. Vнезалежитьвід[S] ( реакція„псевдо“нульовогопорядку) K M маєрозмірністьконцентрації(моль/літр) типові величини K M : від 10 -1 до 10 -7 моль/літр ) K M чисельнодорівнюєконцентраціїсубстрату, приякійшвидкість реакціїдосягає V max /
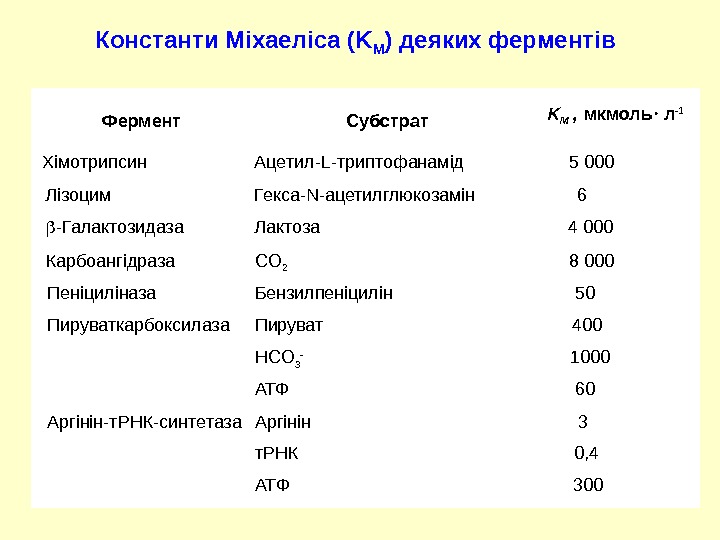
 Фермент Субстрат K M , мкмоль л -1 Хімотрипсин Ацетил- L -триптофанамід 5 000 Лізоцим Гекса- N -ацетилглюкозамін 6 -Галактозидаза Лактоза 4 000 Карбоангідраза CO 2 8 000 Пеніциліназа Бензилпен і цилін 50 Пируваткарбоксилаза Пируват 400 НС O 3 — 1000 АТФ 60 Аргінін-т. РНК-синтетаза Арг і нін 3 т. РНК 0, 4 АТФ 300 Константи М і хаеліса (K M ) деяких ферментів
Фермент Субстрат K M , мкмоль л -1 Хімотрипсин Ацетил- L -триптофанамід 5 000 Лізоцим Гекса- N -ацетилглюкозамін 6 -Галактозидаза Лактоза 4 000 Карбоангідраза CO 2 8 000 Пеніциліназа Бензилпен і цилін 50 Пируваткарбоксилаза Пируват 400 НС O 3 — 1000 АТФ 60 Аргінін-т. РНК-синтетаза Арг і нін 3 т. РНК 0, 4 АТФ 300 Константи М і хаеліса (K M ) деяких ферментів
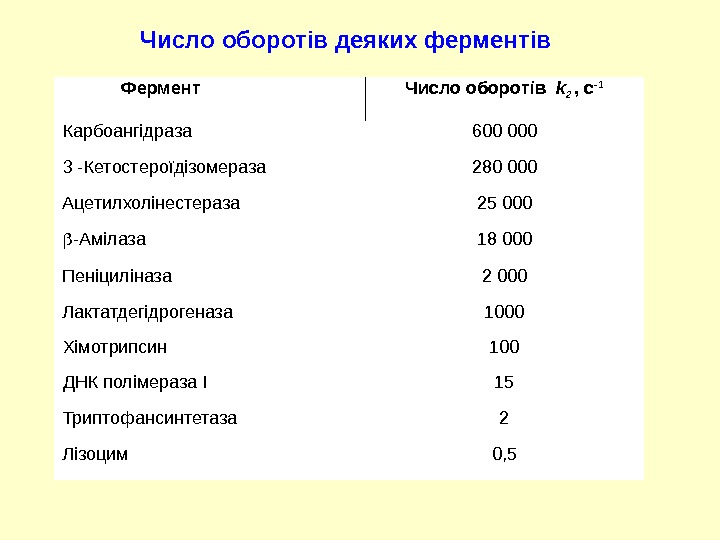
 Фермент Число оборотів k 2 , с -1 Карбоангідраза 600 000 3 -Кетостероїдізомераза 280 000 Ацетилхолінестераза 25 000 -Амілаза 18 000 Пеніциліназа 2 000 Лактатдегідрогеназа 1000 Хімотрипсин 100 ДНК полімераза I 15 Триптофансинтетаза 2 Лізоцим 0, 5 Число оборот і в деяких ферментів
Фермент Число оборотів k 2 , с -1 Карбоангідраза 600 000 3 -Кетостероїдізомераза 280 000 Ацетилхолінестераза 25 000 -Амілаза 18 000 Пеніциліназа 2 000 Лактатдегідрогеназа 1000 Хімотрипсин 100 ДНК полімераза I 15 Триптофансинтетаза 2 Лізоцим 0, 5 Число оборот і в деяких ферментів
 • Каталітична ефективність = kcat /Km • Міра оцінки “досконалості” ензиму • k cat /Km фактично є константою другого порядку (моль -1 • л • сек-1 ) • Верхня межа k cat /Km є дифузійною межею – швидкість, з якою ензим та субстрат дифундують разом (10 9 моль-1 • л • сек-1 ) • Багато ензимів наближається до цієї межі (напр. , каталаза, ацетилхолінестераза) Каталітична ефективність ензимів
• Каталітична ефективність = kcat /Km • Міра оцінки “досконалості” ензиму • k cat /Km фактично є константою другого порядку (моль -1 • л • сек-1 ) • Верхня межа k cat /Km є дифузійною межею – швидкість, з якою ензим та субстрат дифундують разом (10 9 моль-1 • л • сек-1 ) • Багато ензимів наближається до цієї межі (напр. , каталаза, ацетилхолінестераза) Каталітична ефективність ензимів
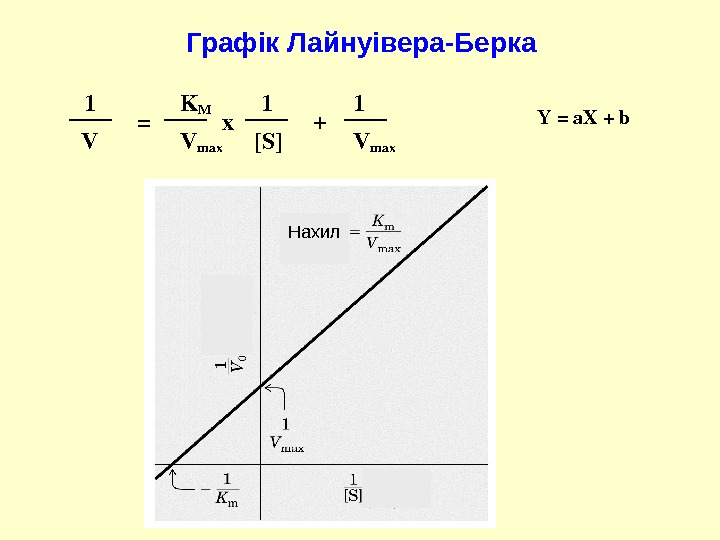
![= + x 1 K M 1 V V max [S] 1 V max = + x 1 K M 1 V V max [S] 1 V max](/docs//12_metal_complex_and_enzymatic_catalysis_images/12_metal_complex_and_enzymatic_catalysis_18.jpg) = + x 1 K M 1 V V max [S] 1 V max Y=a. X+b. Графік Лайнуівера-Берка Нахил
= + x 1 K M 1 V V max [S] 1 V max Y=a. X+b. Графік Лайнуівера-Берка Нахил

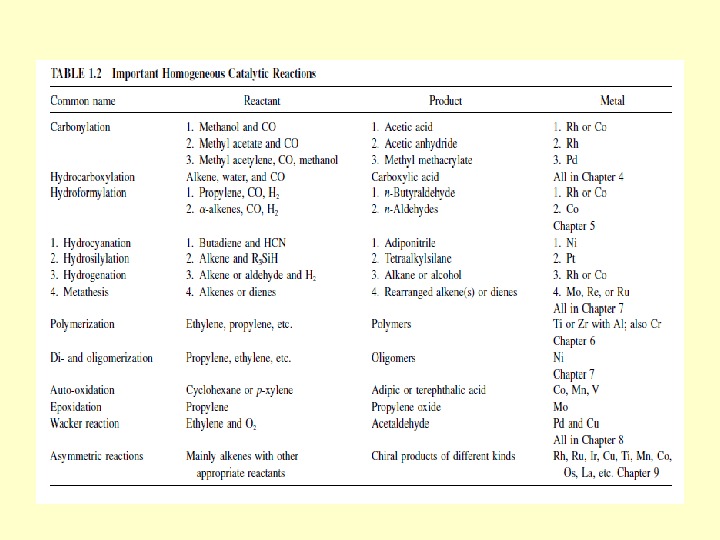
 Industrial use of homogeneous catalysis
Industrial use of homogeneous catalysis

 Доделать • Из Крылова стр. 315 – 336. • Перевести предідущий слайд
Доделать • Из Крылова стр. 315 – 336. • Перевести предідущий слайд
