Медиаторы воспаления - схемы.ppt
- Количество слайдов: 25
 Медиаторы воспаления. Регенерация
Медиаторы воспаления. Регенерация
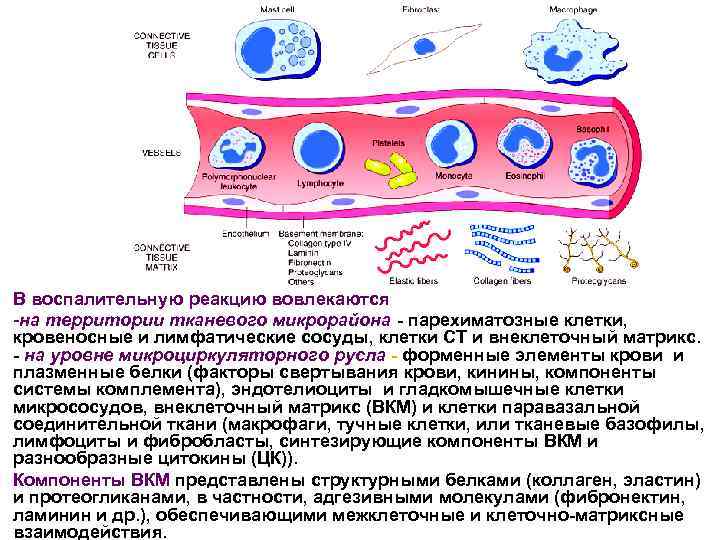 В воспалительную реакцию вовлекаются -на территории тканевого микрорайона - парехиматозные клетки, кровеносные и лимфатические сосуды, клетки СТ и внеклеточный матрикс. - на уровне микроциркуляторного русла - форменные элементы крови и плазменные белки (факторы свертывания крови, кинины, компоненты системы комплемента), эндотелиоциты и гладкомышечные клетки микрососудов, внеклеточный матрикс (ВКМ) и клетки паравазальной соединительной ткани (макрофаги, тучные клетки, или тканевые базофилы, лимфоциты и фибробласты, синтезирующие компоненты ВКМ и разнообразные цитокины (ЦК)). Компоненты ВКМ представлены структурными белками (коллаген, эластин) и протеогликанами, в частности, адгезивными молекулами (фибронектин, ламинин и др. ), обеспечивающими межклеточные и клеточно-матриксные взаимодействия.
В воспалительную реакцию вовлекаются -на территории тканевого микрорайона - парехиматозные клетки, кровеносные и лимфатические сосуды, клетки СТ и внеклеточный матрикс. - на уровне микроциркуляторного русла - форменные элементы крови и плазменные белки (факторы свертывания крови, кинины, компоненты системы комплемента), эндотелиоциты и гладкомышечные клетки микрососудов, внеклеточный матрикс (ВКМ) и клетки паравазальной соединительной ткани (макрофаги, тучные клетки, или тканевые базофилы, лимфоциты и фибробласты, синтезирующие компоненты ВКМ и разнообразные цитокины (ЦК)). Компоненты ВКМ представлены структурными белками (коллаген, эластин) и протеогликанами, в частности, адгезивными молекулами (фибронектин, ламинин и др. ), обеспечивающими межклеточные и клеточно-матриксные взаимодействия.
 Воспаление классифицируют по особенностям клинических проявлений и времени ответа. Острое воспаление продолжается от нескольких минут, часов до нескольких дней. Хроническое воспаление – длительный процесс (недели, месяцы, годы), при котором повреждение, воспаление и репарация, сосуществуя одновременно, характеризуются разной степенью выраженности, что клинически отражается в обострениях или ремиссиях
Воспаление классифицируют по особенностям клинических проявлений и времени ответа. Острое воспаление продолжается от нескольких минут, часов до нескольких дней. Хроническое воспаление – длительный процесс (недели, месяцы, годы), при котором повреждение, воспаление и репарация, сосуществуя одновременно, характеризуются разной степенью выраженности, что клинически отражается в обострениях или ремиссиях
 Фазы воспаления: - альтерация (повреждение) - экссудация (сосудистая реакция) - репарация (полное восстановление ткани - реституция или нет - субституция) 1. Альтерация (повреждение или раздражение) → выделение медиаторов воспаления (важнейший - гистамин) → реакция микроциркуляторного русла с нарушением реологических свойств крови, ↑ сосудистой проницаемости в виде плазматической экссудации и миграции в очаг воспаления клеток, осуществляющих фагоцитоз.
Фазы воспаления: - альтерация (повреждение) - экссудация (сосудистая реакция) - репарация (полное восстановление ткани - реституция или нет - субституция) 1. Альтерация (повреждение или раздражение) → выделение медиаторов воспаления (важнейший - гистамин) → реакция микроциркуляторного русла с нарушением реологических свойств крови, ↑ сосудистой проницаемости в виде плазматической экссудации и миграции в очаг воспаления клеток, осуществляющих фагоцитоз.
 2. Экссудация - обусловлена реакцией микроциркуляторного русла, складывающейся из следующих феноменов: - нарушение реологических свойств крови - ↑ проницаемости сосудов - плазматическая экссудация - миграция клеток в очаг Возможная в начальной стадии повреж- воспаления дения вазомоторная спастическая реакция артериол сменяется воспалительной- фагоцитоз гиперемией, замедлением тока крови, переходящим в стаз, особенно выраженный в посткапиллярах и венулах, длительный стаз (несколько дней) может закончиться тромбозом.
2. Экссудация - обусловлена реакцией микроциркуляторного русла, складывающейся из следующих феноменов: - нарушение реологических свойств крови - ↑ проницаемости сосудов - плазматическая экссудация - миграция клеток в очаг Возможная в начальной стадии повреж- воспаления дения вазомоторная спастическая реакция артериол сменяется воспалительной- фагоцитоз гиперемией, замедлением тока крови, переходящим в стаз, особенно выраженный в посткапиллярах и венулах, длительный стаз (несколько дней) может закончиться тромбозом.
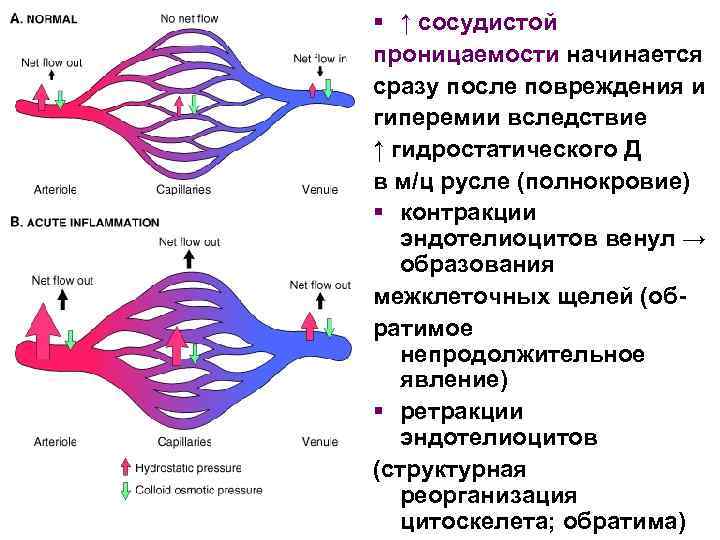 § ↑ сосудистой проницаемости начинается сразу после повреждения и гиперемии вследствие ↑ гидростатического Д в м/ц русле (полнокровие) § контракции эндотелиоцитов венул → образования межклеточных щелей (обратимое непродолжительное явление) § ретракции эндотелиоцитов (структурная реорганизация цитоскелета; обратима)
§ ↑ сосудистой проницаемости начинается сразу после повреждения и гиперемии вследствие ↑ гидростатического Д в м/ц русле (полнокровие) § контракции эндотелиоцитов венул → образования межклеточных щелей (обратимое непродолжительное явление) § ретракции эндотелиоцитов (структурная реорганизация цитоскелета; обратима)
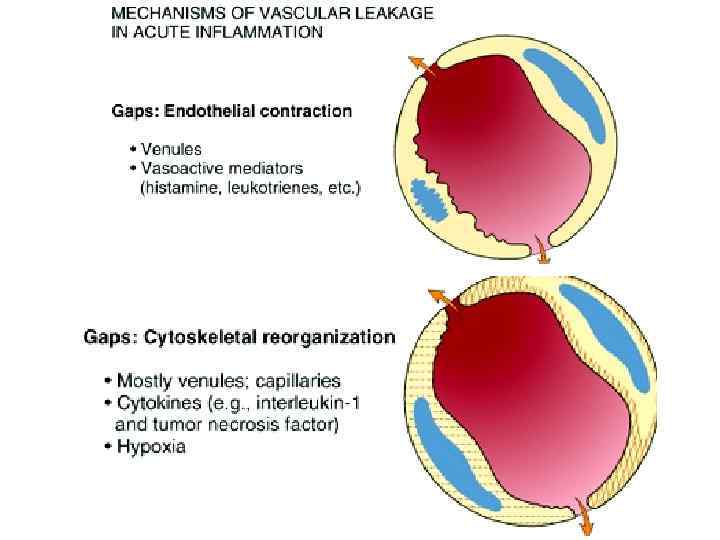
 Кроме того, наблюдается усиленная везикуляция эндотелия (пиноцитоз), благодаря которой происходит увеличение транспорта жидкости через клетку. В зависимости от степени повреждения стенки венул состав просачиваемой жидкости оказывается неоднородным, что и определяет образование разных экссудатов.
Кроме того, наблюдается усиленная везикуляция эндотелия (пиноцитоз), благодаря которой происходит увеличение транспорта жидкости через клетку. В зависимости от степени повреждения стенки венул состав просачиваемой жидкости оказывается неоднородным, что и определяет образование разных экссудатов.
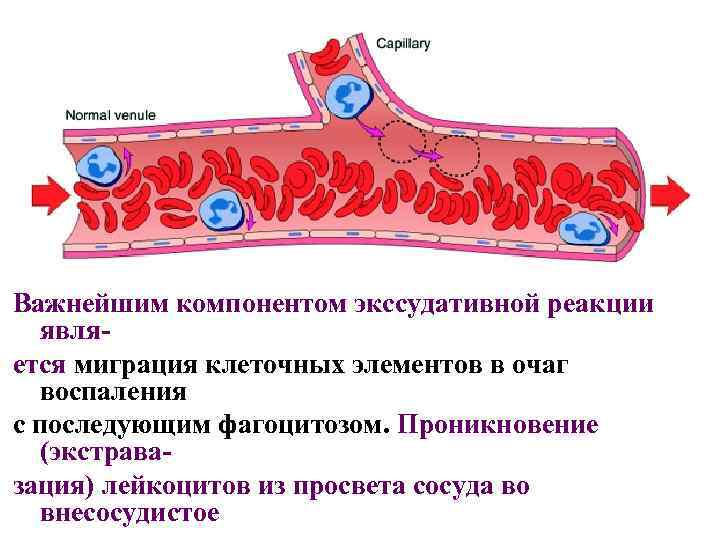 Важнейшим компонентом экссудативной реакции является миграция клеточных элементов в очаг воспаления с последующим фагоцитозом. Проникновение (экстравазация) лейкоцитов из просвета сосуда во внесосудистое
Важнейшим компонентом экссудативной реакции является миграция клеточных элементов в очаг воспаления с последующим фагоцитозом. Проникновение (экстравазация) лейкоцитов из просвета сосуда во внесосудистое
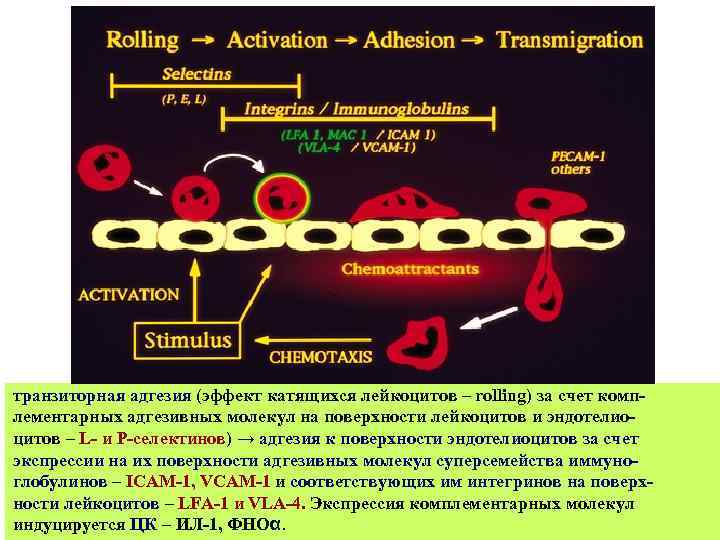 транзиторная адгезия (эффект катящихся лейкоцитов – rolling) за счет комплементарных адгезивных молекул на поверхности лейкоцитов и эндотелиоцитов – L- и P-селектинов) → адгезия к поверхности эндотелиоцитов за счет экспрессии на их поверхности адгезивных молекул суперсемейства иммуноглобулинов – ICAM-1, VCAM-1 и соответствующих им интегринов на поверхности лейкоцитов – LFA-1 и VLA-4. Экспрессия комплементарных молекул индуцируется ЦК – ИЛ-1, ФНОα.
транзиторная адгезия (эффект катящихся лейкоцитов – rolling) за счет комплементарных адгезивных молекул на поверхности лейкоцитов и эндотелиоцитов – L- и P-селектинов) → адгезия к поверхности эндотелиоцитов за счет экспрессии на их поверхности адгезивных молекул суперсемейства иммуноглобулинов – ICAM-1, VCAM-1 и соответствующих им интегринов на поверхности лейкоцитов – LFA-1 и VLA-4. Экспрессия комплементарных молекул индуцируется ЦК – ИЛ-1, ФНОα.
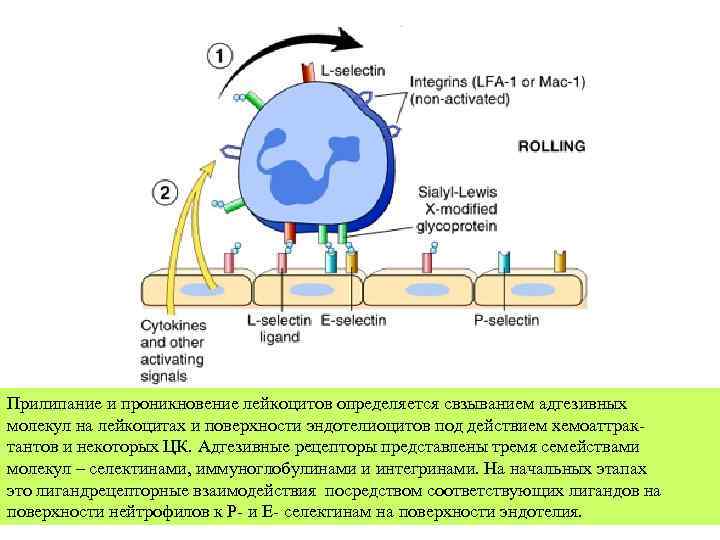 Прилипание и проникновение лейкоцитов определяется свзыванием адгезивных молекул на лейкоцитах и поверхности эндотелиоцитов под действием хемоаттрактантов и некоторых ЦК. Адгезивные рецепторы представлены тремя семействами молекул – селектинами, иммуноглобулинами и интегринами. На начальных этапах это лигандрецепторные взаимодействия посредством соответствующих лигандов на поверхности нейтрофилов к Р- и Е- селектинам на поверхности эндотелия.
Прилипание и проникновение лейкоцитов определяется свзыванием адгезивных молекул на лейкоцитах и поверхности эндотелиоцитов под действием хемоаттрактантов и некоторых ЦК. Адгезивные рецепторы представлены тремя семействами молекул – селектинами, иммуноглобулинами и интегринами. На начальных этапах это лигандрецепторные взаимодействия посредством соответствующих лигандов на поверхности нейтрофилов к Р- и Е- селектинам на поверхности эндотелия.
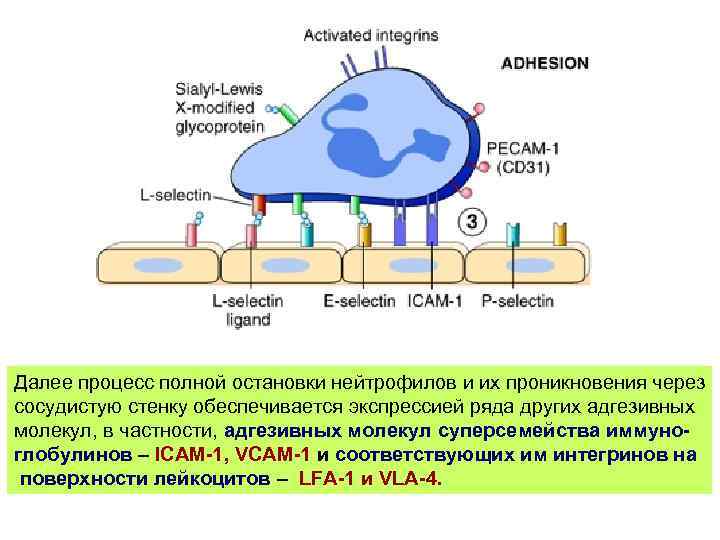 Далее процесс полной остановки нейтрофилов и их проникновения через сосудистую стенку обеспечивается экспрессией ряда других адгезивных молекул, в частности, адгезивных молекул суперсемейства иммуноглобулинов – ICAM-1, VCAM-1 и соответствующих им интегринов на поверхности лейкоцитов – LFA-1 и VLA-4.
Далее процесс полной остановки нейтрофилов и их проникновения через сосудистую стенку обеспечивается экспрессией ряда других адгезивных молекул, в частности, адгезивных молекул суперсемейства иммуноглобулинов – ICAM-1, VCAM-1 и соответствующих им интегринов на поверхности лейкоцитов – LFA-1 и VLA-4.
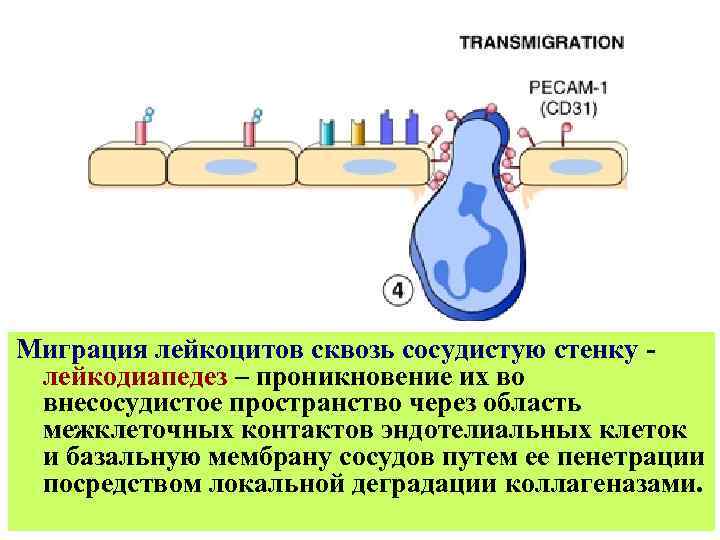 Миграция лейкоцитов сквозь сосудистую стенку лейкодиапедез – проникновение их во внесосудистое пространство через область межклеточных контактов эндотелиальных клеток и базальную мембрану сосудов путем ее пенетрации посредством локальной деградации коллагеназами.
Миграция лейкоцитов сквозь сосудистую стенку лейкодиапедез – проникновение их во внесосудистое пространство через область межклеточных контактов эндотелиальных клеток и базальную мембрану сосудов путем ее пенетрации посредством локальной деградации коллагеназами.
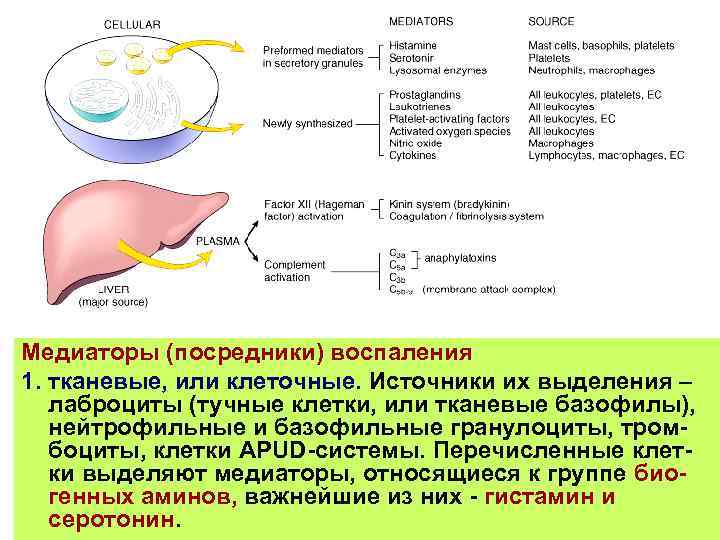 Медиаторы (посредники) воспаления 1. тканевые, или клеточные. Источники их выделения – лаброциты (тучные клетки, или тканевые базофилы), нейтрофильные и базофильные гранулоциты, тромбоциты, клетки APUD-системы. Перечисленные клетки выделяют медиаторы, относящиеся к группе биогенных аминов, важнейшие из них - гистамин и серотонин.
Медиаторы (посредники) воспаления 1. тканевые, или клеточные. Источники их выделения – лаброциты (тучные клетки, или тканевые базофилы), нейтрофильные и базофильные гранулоциты, тромбоциты, клетки APUD-системы. Перечисленные клетки выделяют медиаторы, относящиеся к группе биогенных аминов, важнейшие из них - гистамин и серотонин.
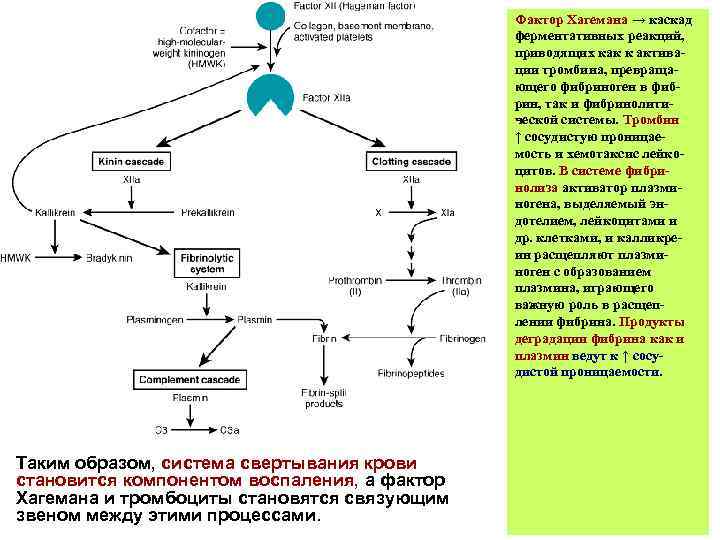 Фактор Хагемана → каскад ферментативных реакций, приводящих как к активации тромбина, превращающего фибриноген в фибрин, так и фибринолитической системы. Тромбин ↑ сосудистую проницаемость и хемотаксис лейкоцитов. В системе фибринолиза активатор плазминогена, выделяемый эндотелием, лейкоцитами и др. клетками, и калликреин расщепляют плазминоген с образованием плазмина, играющего важную роль в расщеплении фибрина. Продукты деградации фибрина как и плазмин ведут к ↑ сосудистой проницаемости. Таким образом, система свертывания крови становится компонентом воспаления, а фактор Хагемана и тромбоциты становятся связующим звеном между этими процессами.
Фактор Хагемана → каскад ферментативных реакций, приводящих как к активации тромбина, превращающего фибриноген в фибрин, так и фибринолитической системы. Тромбин ↑ сосудистую проницаемость и хемотаксис лейкоцитов. В системе фибринолиза активатор плазминогена, выделяемый эндотелием, лейкоцитами и др. клетками, и калликреин расщепляют плазминоген с образованием плазмина, играющего важную роль в расщеплении фибрина. Продукты деградации фибрина как и плазмин ведут к ↑ сосудистой проницаемости. Таким образом, система свертывания крови становится компонентом воспаления, а фактор Хагемана и тромбоциты становятся связующим звеном между этими процессами.
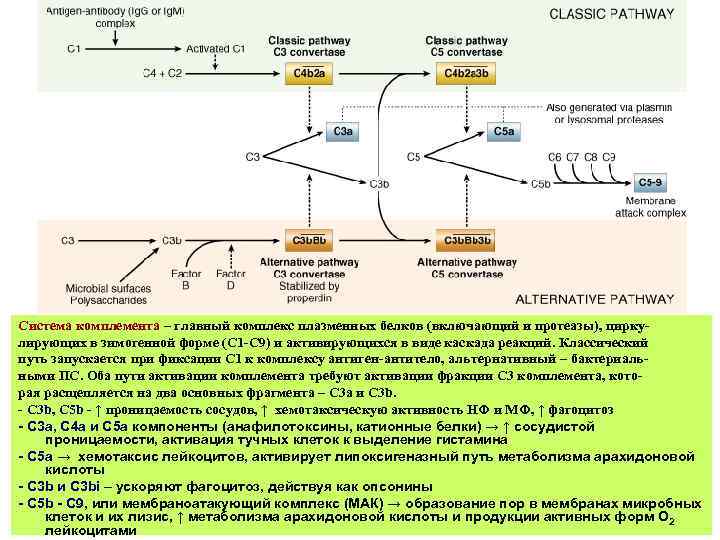 Система комплемента – главный комплекс плазменных белков (включающий и протеазы), циркулирующих в зимогенной форме (С 1 -С 9) и активирующихся в виде каскада реакций. Классический путь запускается при фиксации С 1 к комплексу антиген-антитело, альтернативный – бактериальными ПС. Оба пути активации комплемента требуют активации фракции С 3 комплемента, которая расщепляется на два основных фрагмента – С 3 а и С 3 b. - С 3 b, C 5 b - ↑ проницаемость сосудов, ↑ хемотаксическую активность НФ и МФ, ↑ фагоцитоз - С 3 а, С 4 а и С 5 а компоненты (анафилотоксины, катионные белки) → ↑ сосудистой проницаемости, активация тучных клеток к выделение гистамина - С 5 а → хемотаксис лейкоцитов, активирует липоксигеназный путь метаболизма арахидоновой кислоты - С 3 b и С 3 bi – ускоряют фагоцитоз, действуя как опсонины - С 5 b - С 9, или мембраноатакующий комплекс (МАК) → образование пор в мембранах микробных клеток и их лизис, ↑ метаболизма арахидоновой кислоты и продукции активных форм О 2 лейкоцитами
Система комплемента – главный комплекс плазменных белков (включающий и протеазы), циркулирующих в зимогенной форме (С 1 -С 9) и активирующихся в виде каскада реакций. Классический путь запускается при фиксации С 1 к комплексу антиген-антитело, альтернативный – бактериальными ПС. Оба пути активации комплемента требуют активации фракции С 3 комплемента, которая расщепляется на два основных фрагмента – С 3 а и С 3 b. - С 3 b, C 5 b - ↑ проницаемость сосудов, ↑ хемотаксическую активность НФ и МФ, ↑ фагоцитоз - С 3 а, С 4 а и С 5 а компоненты (анафилотоксины, катионные белки) → ↑ сосудистой проницаемости, активация тучных клеток к выделение гистамина - С 5 а → хемотаксис лейкоцитов, активирует липоксигеназный путь метаболизма арахидоновой кислоты - С 3 b и С 3 bi – ускоряют фагоцитоз, действуя как опсонины - С 5 b - С 9, или мембраноатакующий комплекс (МАК) → образование пор в мембранах микробных клеток и их лизис, ↑ метаболизма арахидоновой кислоты и продукции активных форм О 2 лейкоцитами
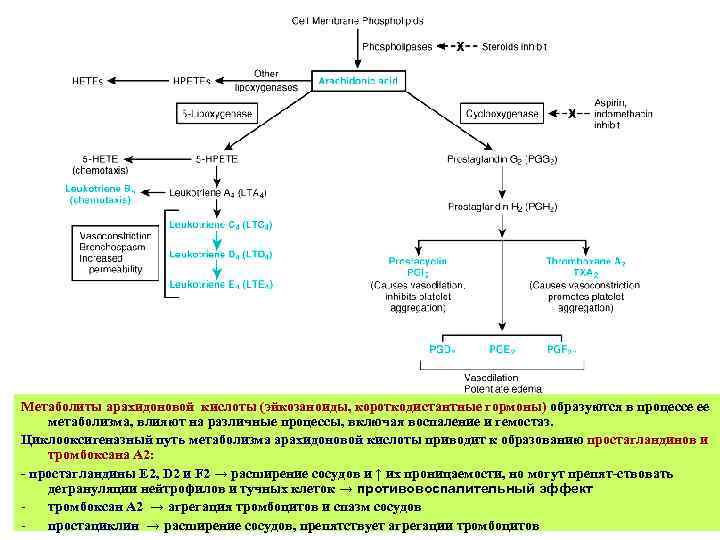 Метаболиты арахидоновой кислоты (эйкозаноиды, короткодистантные гормоны) образуются в процессе ее метаболизма, влияют на различные процессы, включая воспаление и гемостаз. Циклооксигеназный путь метаболизма арахидоновой кислоты приводит к образованию простагландинов и тромбоксана А 2: - простагландины Е 2, D 2 и F 2 → расширение сосудов и ↑ их проницаемости, но могут препят-ствовать дегрануляции нейтрофилов и тучных клеток → противовоспалительный эффект тромбоксан А 2 → агрегация тромбоцитов и спазм сосудов простациклин → расширение сосудов, препятствует агрегации тромбоцитов
Метаболиты арахидоновой кислоты (эйкозаноиды, короткодистантные гормоны) образуются в процессе ее метаболизма, влияют на различные процессы, включая воспаление и гемостаз. Циклооксигеназный путь метаболизма арахидоновой кислоты приводит к образованию простагландинов и тромбоксана А 2: - простагландины Е 2, D 2 и F 2 → расширение сосудов и ↑ их проницаемости, но могут препят-ствовать дегрануляции нейтрофилов и тучных клеток → противовоспалительный эффект тромбоксан А 2 → агрегация тромбоцитов и спазм сосудов простациклин → расширение сосудов, препятствует агрегации тромбоцитов
 Липооксигеназный путь метаболизма приводит к образованию лейкотриенов (В 4, С 4, D 4, Е 4) и гидроксиэйкозатетрано-идной кислоты (НЕТЕ) Лейкотриен В 4 - сильный хемотаксический агент → агрегация и адгезия лейкоцитов к эндотелию венул. Лейкотриены С 4, D 4 и Е 4 → гистаминнезависимый спазм сосудов, бронхоспазм, ↑ сосудистой проницаемости
Липооксигеназный путь метаболизма приводит к образованию лейкотриенов (В 4, С 4, D 4, Е 4) и гидроксиэйкозатетрано-идной кислоты (НЕТЕ) Лейкотриен В 4 - сильный хемотаксический агент → агрегация и адгезия лейкоцитов к эндотелию венул. Лейкотриены С 4, D 4 и Е 4 → гистаминнезависимый спазм сосудов, бронхоспазм, ↑ сосудистой проницаемости
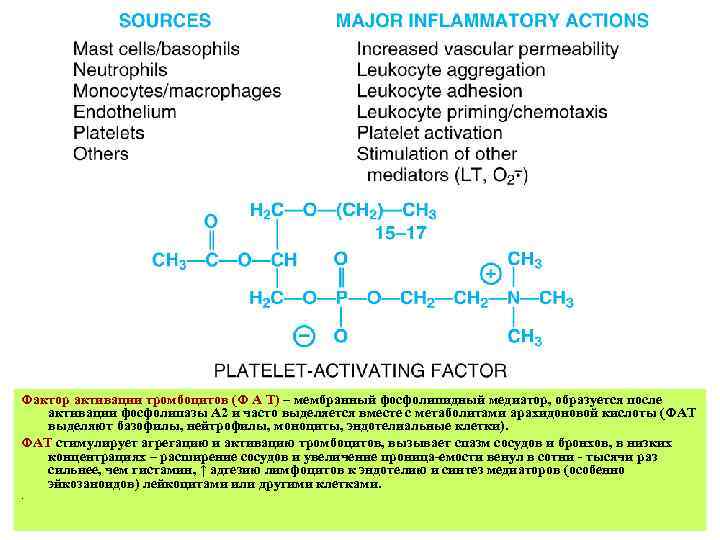 Фактор активации тромбоцитов (Ф А Т) – мембранный фосфолипидный медиатор, образуется после активации фосфолипазы А 2 и часто выделяется вместе с метаболитами арахидоновой кислоты (ФАТ выделяют базофилы, нейтрофилы, моноциты, эндотелиальные клетки). ФАТ стимулирует агрегацию и активацию тромбоцитов, вызывает спазм сосудов и бронхов, в низких концентрациях – расширение сосудов и увеличение проница-емости венул в сотни - тысячи раз сильнее, чем гистамин, ↑ адгезию лимфоцитов к эндотелию и синтез медиаторов (особенно эйкозаноидов) лейкоцитами или другими клетками. .
Фактор активации тромбоцитов (Ф А Т) – мембранный фосфолипидный медиатор, образуется после активации фосфолипазы А 2 и часто выделяется вместе с метаболитами арахидоновой кислоты (ФАТ выделяют базофилы, нейтрофилы, моноциты, эндотелиальные клетки). ФАТ стимулирует агрегацию и активацию тромбоцитов, вызывает спазм сосудов и бронхов, в низких концентрациях – расширение сосудов и увеличение проница-емости венул в сотни - тысячи раз сильнее, чем гистамин, ↑ адгезию лимфоцитов к эндотелию и синтез медиаторов (особенно эйкозаноидов) лейкоцитами или другими клетками. .
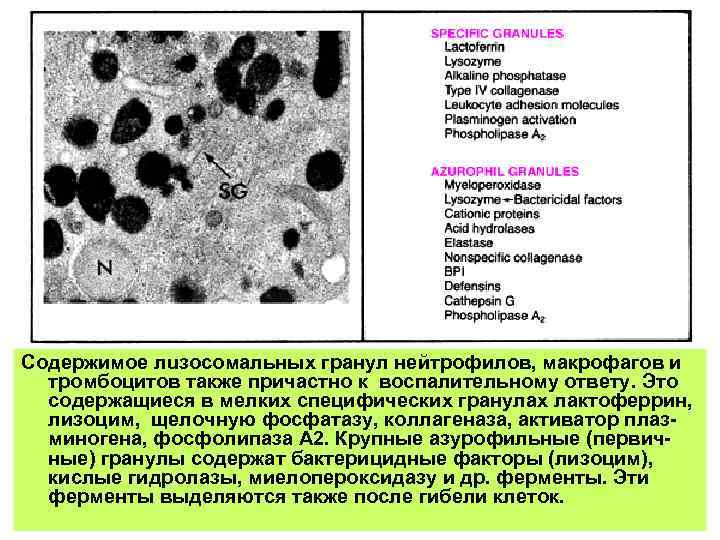 Содержимое лuзосомальных гранул нейтрофилов, макрофагов и тромбоцитов также причастно к воспалительному ответу. Это содержащиеся в мелких специфических гранулах лактоферрин, лизоцим, щелочную фосфатазу, коллагеназа, активатор плазминогена, фосфолипаза А 2. Крупные азурофильные (первичные) гранулы содержат бактерицидные факторы (лизоцим), кислые гидролазы, миелопероксидазу и др. ферменты. Эти ферменты выделяются также после гибели клеток.
Содержимое лuзосомальных гранул нейтрофилов, макрофагов и тромбоцитов также причастно к воспалительному ответу. Это содержащиеся в мелких специфических гранулах лактоферрин, лизоцим, щелочную фосфатазу, коллагеназа, активатор плазминогена, фосфолипаза А 2. Крупные азурофильные (первичные) гранулы содержат бактерицидные факторы (лизоцим), кислые гидролазы, миелопероксидазу и др. ферменты. Эти ферменты выделяются также после гибели клеток.
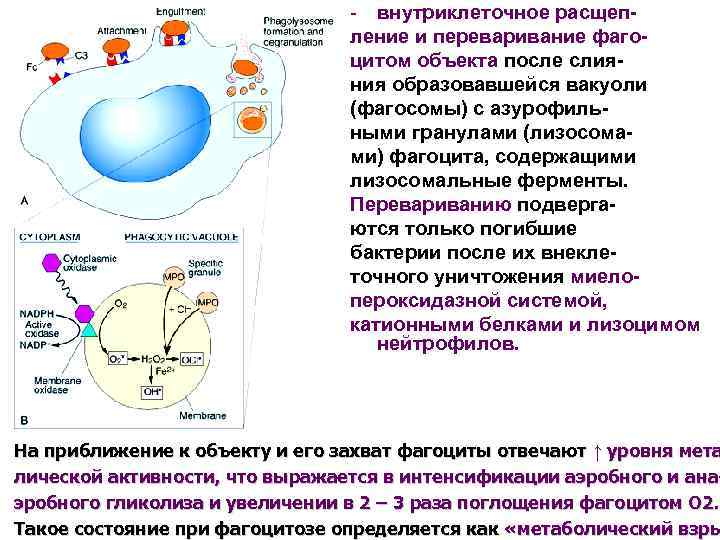 - внутриклеточное расщепление и переваривание фагоцитом объекта после слияния образовавшейся вакуоли (фагосомы) с азурофильными гранулами (лизосомами) фагоцита, содержащими лизосомальные ферменты. Перевариванию подвергаются только погибшие бактерии после их внеклеточного уничтожения миелопероксидазной системой, катионными белками и лизоцимом нейтрофилов. На приближение к объекту и его захват фагоциты отвечают ↑ уровня мета лической активности, что выражается в интенсификации аэробного и анаэробного гликолиза и увеличении в 2 – 3 раза поглощения фагоцитом О 2. Такое состояние при фагоцитозе определяется как «метаболический взры
- внутриклеточное расщепление и переваривание фагоцитом объекта после слияния образовавшейся вакуоли (фагосомы) с азурофильными гранулами (лизосомами) фагоцита, содержащими лизосомальные ферменты. Перевариванию подвергаются только погибшие бактерии после их внеклеточного уничтожения миелопероксидазной системой, катионными белками и лизоцимом нейтрофилов. На приближение к объекту и его захват фагоциты отвечают ↑ уровня мета лической активности, что выражается в интенсификации аэробного и анаэробного гликолиза и увеличении в 2 – 3 раза поглощения фагоцитом О 2. Такое состояние при фагоцитозе определяется как «метаболический взры
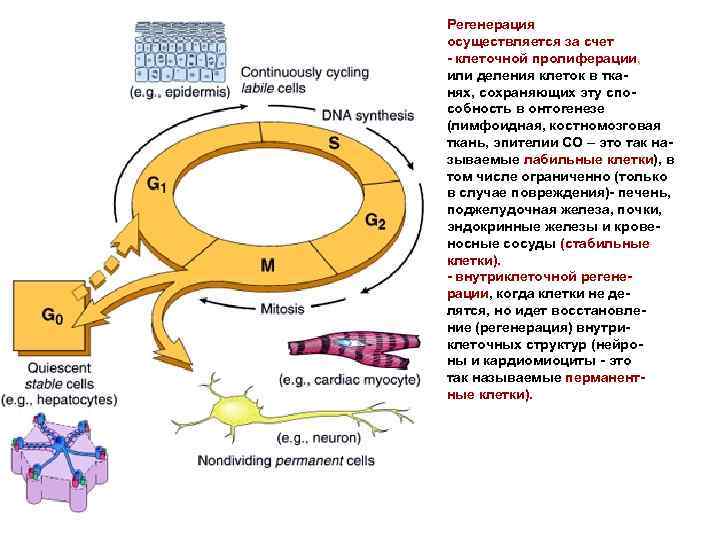 Регенерация осуществляется за счет - клеточной пролиферации, или деления клеток в тканях, сохраняющих эту способность в онтогенезе (лимфоидная, костномозговая ткань, эпителии СО – это так называемые лабильные клетки), в том числе ограниченно (только в случае повреждения)- печень, поджелудочная железа, почки, эндокринные железы и кровеносные сосуды (стабильные клетки). - внутриклеточной регенерации, когда клетки не делятся, но идет восстановление (регенерация) внутриклеточных структур (нейроны и кардиомиоциты - это так называемые перманентные клетки).
Регенерация осуществляется за счет - клеточной пролиферации, или деления клеток в тканях, сохраняющих эту способность в онтогенезе (лимфоидная, костномозговая ткань, эпителии СО – это так называемые лабильные клетки), в том числе ограниченно (только в случае повреждения)- печень, поджелудочная железа, почки, эндокринные железы и кровеносные сосуды (стабильные клетки). - внутриклеточной регенерации, когда клетки не делятся, но идет восстановление (регенерация) внутриклеточных структур (нейроны и кардиомиоциты - это так называемые перманентные клетки).
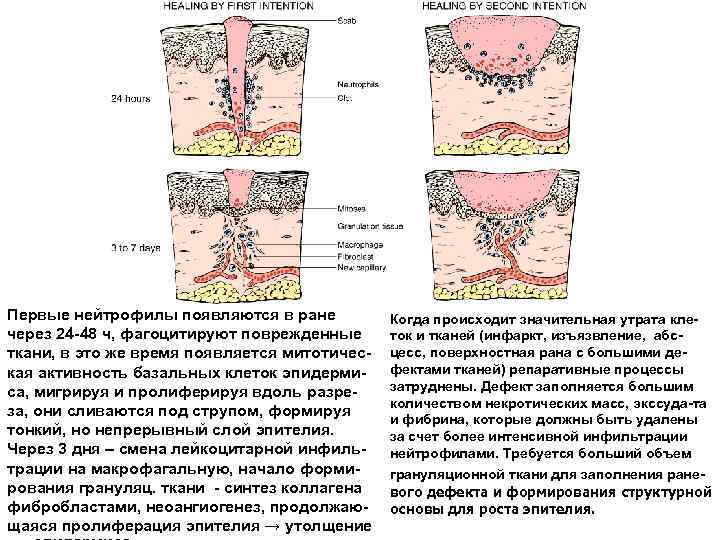 Первые нейтрофилы появляются в ране через 24 -48 ч, фагоцитируют поврежденные ткани, в это же время появляется митотическая активность базальных клеток эпидермиса, мигрируя и пролиферируя вдоль разреза, они сливаются под струпом, формируя тонкий, но непрерывный слой эпителия. Через 3 дня – смена лейкоцитарной инфильтрации на макрофагальную, начало формирования грануляц. ткани - синтез коллагена фибробластами, неоангиогенез, продолжающаяся пролиферация эпителия → утолщение Когда происходит значительная утрата клеток и тканей (инфаркт, изъязвление, абсцесс, поверхностная рана с большими дефектами тканей) репаративные процессы затруднены. Дефект заполняется большим количеством некротических масс, экссуда-та и фибрина, которые должны быть удалены за счет более интенсивной инфильтрации нейтрофилами. Требуется больший объем грануляционной ткани для заполнения раневого дефекта и формирования структурной основы для роста эпителия.
Первые нейтрофилы появляются в ране через 24 -48 ч, фагоцитируют поврежденные ткани, в это же время появляется митотическая активность базальных клеток эпидермиса, мигрируя и пролиферируя вдоль разреза, они сливаются под струпом, формируя тонкий, но непрерывный слой эпителия. Через 3 дня – смена лейкоцитарной инфильтрации на макрофагальную, начало формирования грануляц. ткани - синтез коллагена фибробластами, неоангиогенез, продолжающаяся пролиферация эпителия → утолщение Когда происходит значительная утрата клеток и тканей (инфаркт, изъязвление, абсцесс, поверхностная рана с большими дефектами тканей) репаративные процессы затруднены. Дефект заполняется большим количеством некротических масс, экссуда-та и фибрина, которые должны быть удалены за счет более интенсивной инфильтрации нейтрофилами. Требуется больший объем грануляционной ткани для заполнения раневого дефекта и формирования структурной основы для роста эпителия.
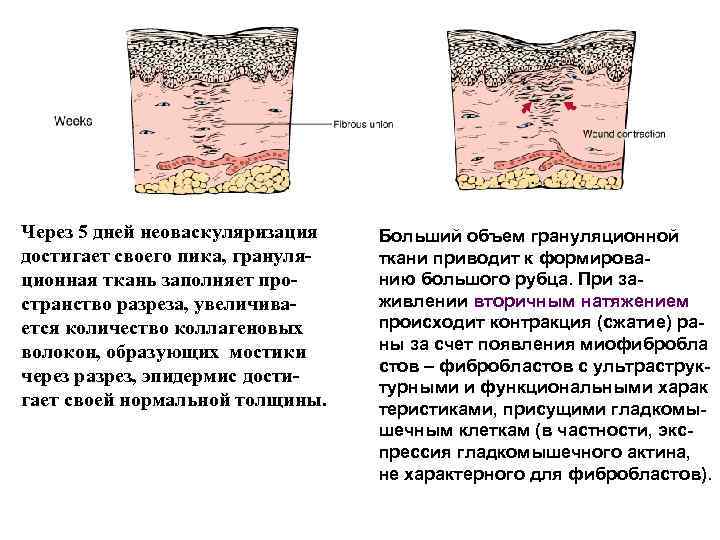 Через 5 дней неоваскуляризация достигает своего пика, грануляционная ткань заполняет пространство разреза, увеличивается количество коллагеновых волокон, образующих мостики через разрез, эпидермис достигает своей нормальной толщины. Больший объем грануляционной ткани приводит к формированию большого рубца. При заживлении вторичным натяжением происходит контракция (сжатие) раны за счет появления миофибробла стов – фибробластов с ультраструктурными и функциональными харак теристиками, присущими гладкомышечным клеткам (в частности, экспрессия гладкомышечного актина, не характерного для фибробластов).
Через 5 дней неоваскуляризация достигает своего пика, грануляционная ткань заполняет пространство разреза, увеличивается количество коллагеновых волокон, образующих мостики через разрез, эпидермис достигает своей нормальной толщины. Больший объем грануляционной ткани приводит к формированию большого рубца. При заживлении вторичным натяжением происходит контракция (сжатие) раны за счет появления миофибробла стов – фибробластов с ультраструктурными и функциональными харак теристиками, присущими гладкомышечным клеткам (в частности, экспрессия гладкомышечного актина, не характерного для фибробластов).
 Исход воспаления зависит от особенностей ткани, природы повреждающего агента и иммунного статуса организма, важными причинами задержки заживления являются инфекция, неадекватное кровоснабжение, инородные тела или персистенция повреждающего агента (частицы пыли). При малых объемах повреждения воспали-тельная реакция разрешается без остаточных явлений. При массивной экссудации фибрина, низкой или отсутствующей способности ткани к реге-нерации, нарушении равновесия между про-цессами фиброплазии и фибролизиса зажив-ление поврежденной ткани идет путем заме-щения соединительной тканью (фиброз), ло-кально – образованием рубца. Персистенция повреждающего агента, несостоятельность процессов репарации (регенерации) → хронизация процесса.
Исход воспаления зависит от особенностей ткани, природы повреждающего агента и иммунного статуса организма, важными причинами задержки заживления являются инфекция, неадекватное кровоснабжение, инородные тела или персистенция повреждающего агента (частицы пыли). При малых объемах повреждения воспали-тельная реакция разрешается без остаточных явлений. При массивной экссудации фибрина, низкой или отсутствующей способности ткани к реге-нерации, нарушении равновесия между про-цессами фиброплазии и фибролизиса зажив-ление поврежденной ткани идет путем заме-щения соединительной тканью (фиброз), ло-кально – образованием рубца. Персистенция повреждающего агента, несостоятельность процессов репарации (регенерации) → хронизация процесса.
