ЛЕКЦИЯ 8 Азолы Химия гетероциклических соединений 2


2016_bak_heterocycles_8.ppt
- Размер: 1.6 Мб
- Автор:
- Количество слайдов: 14
Описание презентации ЛЕКЦИЯ 8 Азолы Химия гетероциклических соединений 2 по слайдам
 ЛЕКЦИЯ 8 Азолы Химия гетероциклических соединений
ЛЕКЦИЯ 8 Азолы Химия гетероциклических соединений
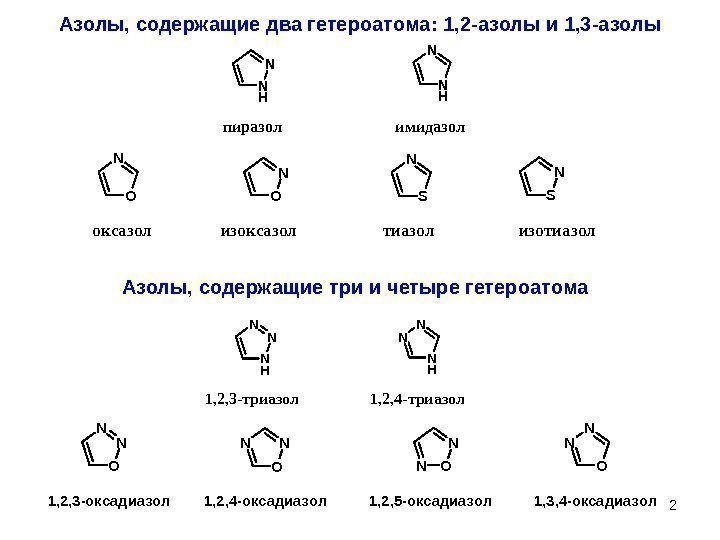
 2 Азолы, содержащие два гетероатома : 1, 2 -азолы и 1, 3 -азолы N HN N H N пиразол имидазол. O N S N оксазол изоксазол тиазолизотиазол N HN N N H NN 1, 2, 3 -триазол 1, 2, 4 -триазол O N N O NN NO N 1, 2, 3 -оксадиазол 1, 2, 4 -оксадиазол 1, 2, 5 -оксадиазол 1, 3, 4 -оксадиазол. Азолы, содержащие три и четыре гетероатома
2 Азолы, содержащие два гетероатома : 1, 2 -азолы и 1, 3 -азолы N HN N H N пиразол имидазол. O N S N оксазол изоксазол тиазолизотиазол N HN N N H NN 1, 2, 3 -триазол 1, 2, 4 -триазол O N N O NN NO N 1, 2, 3 -оксадиазол 1, 2, 4 -оксадиазол 1, 2, 5 -оксадиазол 1, 3, 4 -оксадиазол. Азолы, содержащие три и четыре гетероатома
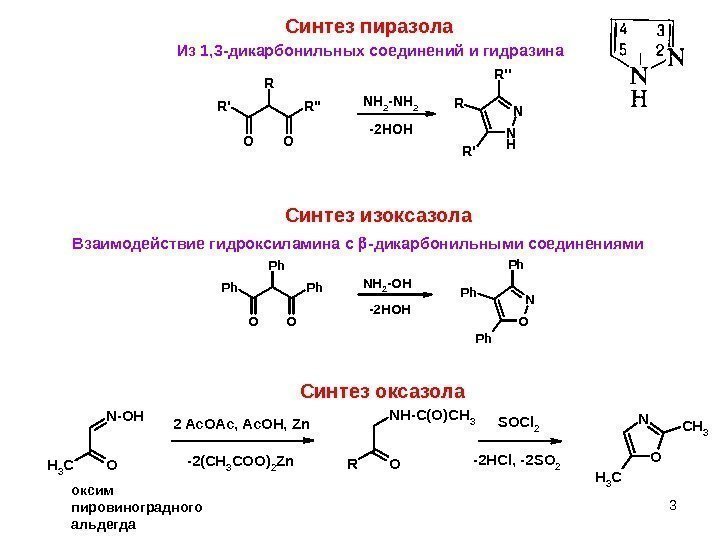
 3 Синтез пиразола. R’ O R» O R NH 2 -NH 2 N H N R’ R R» -2 HOH Из 1, 3 -дикарбонильных соединений и гидразина Синтез изоксазола OO Ph Ph. NH 2 -OH O N Ph Ph Ph -2 HOHВзаимодействие гидроксиламина с -дикарбонильными соединениями Синтез оксазола N-OH CH 3 ORO NH-C(O)CH 3 SOCl 2 O NCH 3 2 Ac. OAc, Ac. OH, Zn -2(CH 3 COO)2 Zn-2 HCl, -2 SO 2 оксим пировиноградного альдегда
3 Синтез пиразола. R’ O R» O R NH 2 -NH 2 N H N R’ R R» -2 HOH Из 1, 3 -дикарбонильных соединений и гидразина Синтез изоксазола OO Ph Ph. NH 2 -OH O N Ph Ph Ph -2 HOHВзаимодействие гидроксиламина с -дикарбонильными соединениями Синтез оксазола N-OH CH 3 ORO NH-C(O)CH 3 SOCl 2 O NCH 3 2 Ac. OAc, Ac. OH, Zn -2(CH 3 COO)2 Zn-2 HCl, -2 SO 2 оксим пировиноградного альдегда
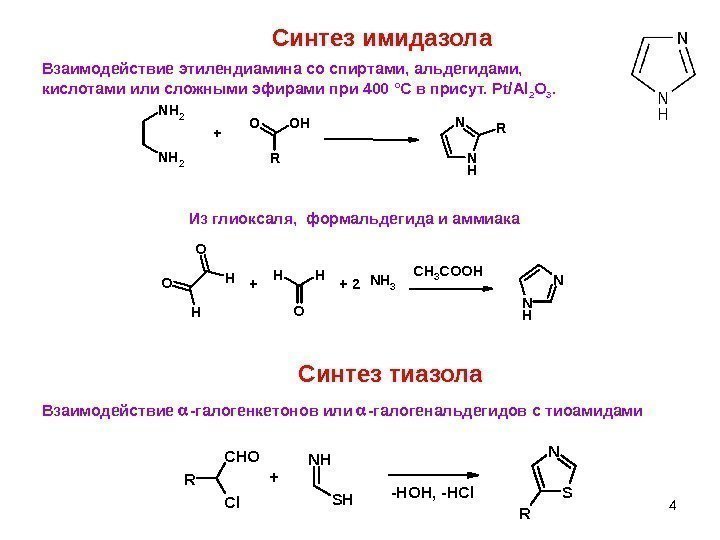
 4 Синтез имидазола Взаимодействие этилендиамина со спиртами, альдегидами, кислотами или сложными эфирами при 400 °С в присут. Pt/Al 2 O 3. Из глиоксаля, формальдегида и аммиака N H NCH 3 COOHH O O H HH O NH 3++ 2 R O HO N HN RN H 2 + Синтез тиазола R Cl. C H O N H SN R-HOH, -HCl+Взаимодействие -галогенкетонов или -галогенальдегидов с тиоамидами
4 Синтез имидазола Взаимодействие этилендиамина со спиртами, альдегидами, кислотами или сложными эфирами при 400 °С в присут. Pt/Al 2 O 3. Из глиоксаля, формальдегида и аммиака N H NCH 3 COOHH O O H HH O NH 3++ 2 R O HO N HN RN H 2 + Синтез тиазола R Cl. C H O N H SN R-HOH, -HCl+Взаимодействие -галогенкетонов или -галогенальдегидов с тиоамидами
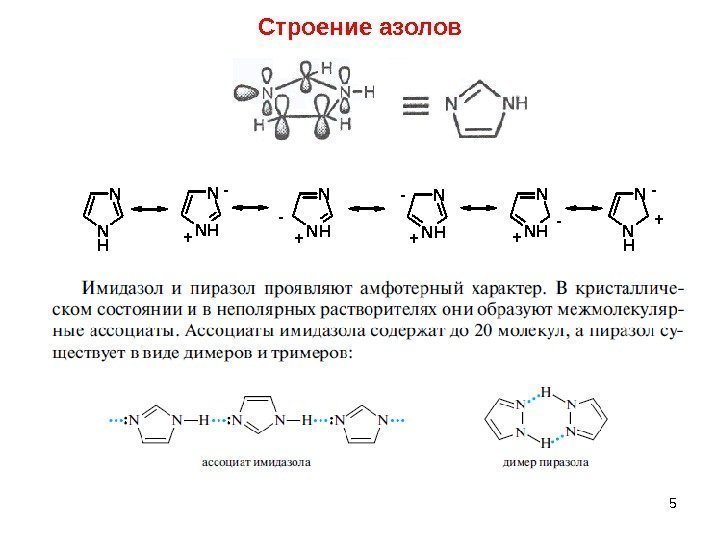
 5 Строение азолов. N N H N NH N N H+ — — + — +
5 Строение азолов. N N H N NH N N H+ — — + — +
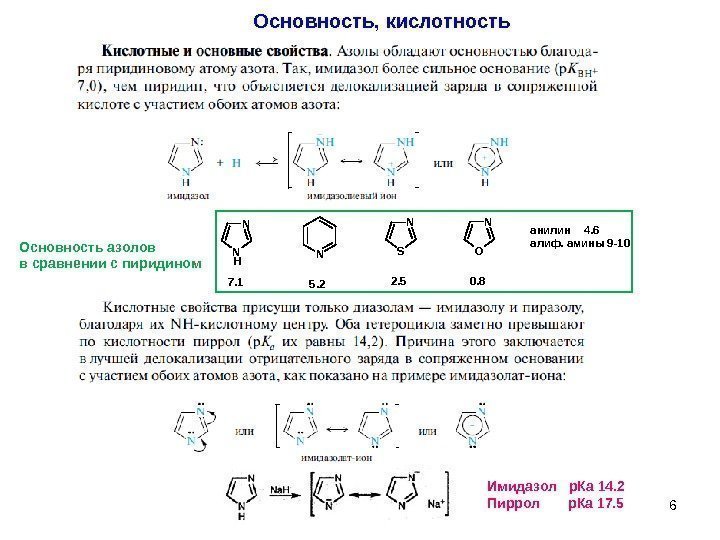
 6 Основность, кислотность Имидазол р. Ка 14. 2 Пиррол р. Ка 17. 5 N N H N N S N O 7. 1 5. 2 2. 5 0. 8 анилин 4. 6 алиф. амины 9 -10 Основность азолов в сравнении с пиридином
6 Основность, кислотность Имидазол р. Ка 14. 2 Пиррол р. Ка 17. 5 N N H N N S N O 7. 1 5. 2 2. 5 0. 8 анилин 4. 6 алиф. амины 9 -10 Основность азолов в сравнении с пиридином
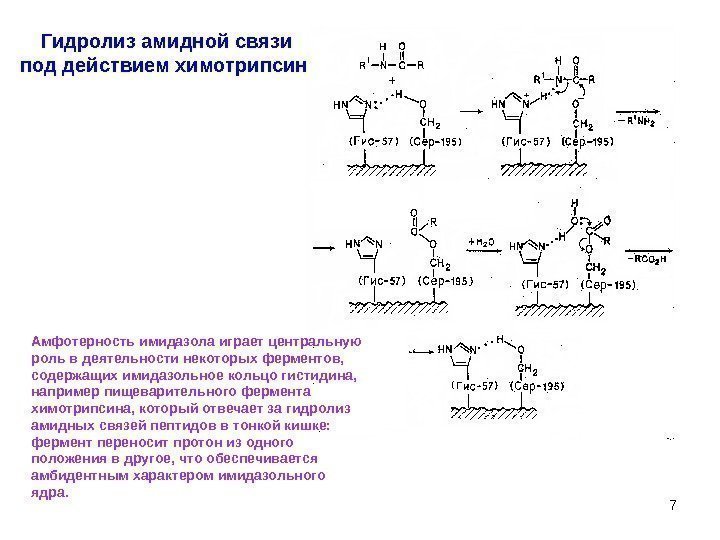
 7 Гидролиз амидной связи под действием химотрипсина Амфотерность имидазола играет центральную роль в деятельности некоторых ферментов, содержащих имидазольное кольцо гистидина, например пищеварительного фермента химотрипсина, который отвечает за гидролиз амидных связей пептидов в тонкой кишке: фермент переносит протон из одного положения в другое, что обеспечивается амбидентным характером имидазольного ядра.
7 Гидролиз амидной связи под действием химотрипсина Амфотерность имидазола играет центральную роль в деятельности некоторых ферментов, содержащих имидазольное кольцо гистидина, например пищеварительного фермента химотрипсина, который отвечает за гидролиз амидных связей пептидов в тонкой кишке: фермент переносит протон из одного положения в другое, что обеспечивается амбидентным характером имидазольного ядра.
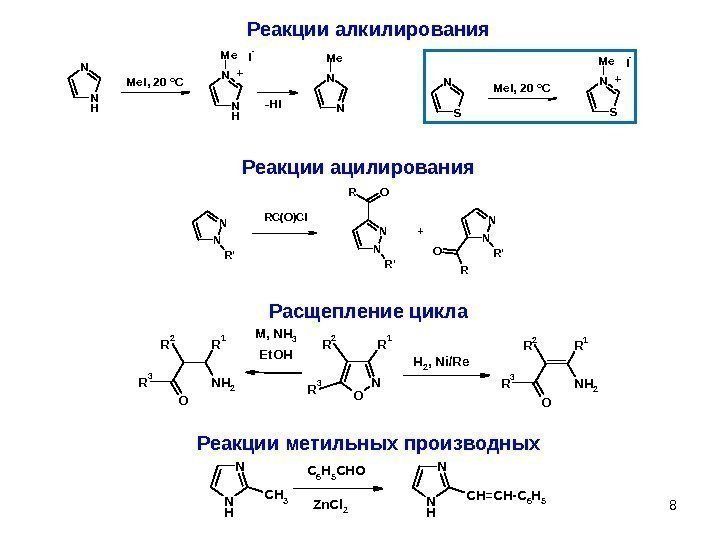
 8 Реакции алкилирования SN SNM e I — Me. I, 20 o C + N HNM e I — NNM e Me. I, 20 o C + -HI Реакции ацилирования. N N R’ RC(O)Cl N N R’ OR N N R’O R + N O R 1 R 2 R 3 H 2, Ni/Re R 2 R 3 O NH 2 R 1 M, NH 3 R 2 R 3 O NH 2 R 1 Et. OH Расщепление цикла Реакции метильных производных N N H CH 3 C 6 H 5 CHO Zn. Cl 2 N N H CH=CH-C 6 H
8 Реакции алкилирования SN SNM e I — Me. I, 20 o C + N HNM e I — NNM e Me. I, 20 o C + -HI Реакции ацилирования. N N R’ RC(O)Cl N N R’ OR N N R’O R + N O R 1 R 2 R 3 H 2, Ni/Re R 2 R 3 O NH 2 R 1 M, NH 3 R 2 R 3 O NH 2 R 1 Et. OH Расщепление цикла Реакции метильных производных N N H CH 3 C 6 H 5 CHO Zn. Cl 2 N N H CH=CH-C 6 H
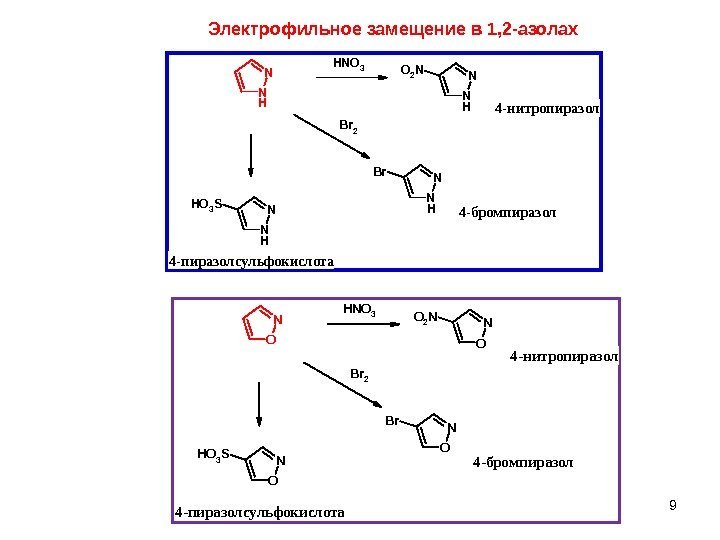
 9 Электрофильное замещение в 1, 2 -азолах N H N O 3 N H NO 2 N N H NBr. B r 2 N H NH O 3 S 4 -нитропиразол 4 -бромпиразол 4 -пиразолсульфокислота O N H N O 3 O NO 2 N O NBr. B r 2 O NH O 3 S 4 -нитропиразол 4 -бромпиразол 4 -пиразолсульфокислота
9 Электрофильное замещение в 1, 2 -азолах N H N O 3 N H NO 2 N N H NBr. B r 2 N H NH O 3 S 4 -нитропиразол 4 -бромпиразол 4 -пиразолсульфокислота O N H N O 3 O NO 2 N O NBr. B r 2 O NH O 3 S 4 -нитропиразол 4 -бромпиразол 4 -пиразолсульфокислота
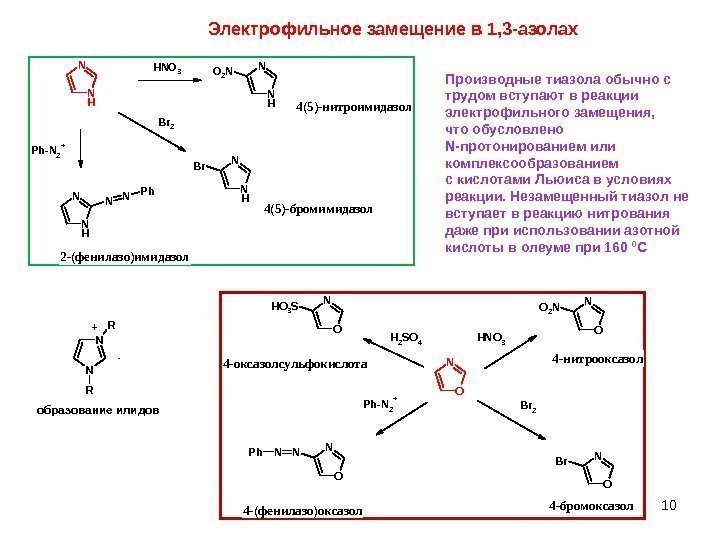
 10 Электрофильное замещение в 1, 3 -азолах N HN H N O 3 N HN O 2 N N HN Br. B r 2 N HN N N P h — N 2 +4(5)-нитроимидазол 4(5)-бромимидазол 2 -(фенилазо)имидазол O N HNO 3 O NO 2 N O NBr Br 2 O NNNPh Ph-N 2 + H 2 SO 4 O NHO 3 S 4 -нитрооксазол 4 -бромоксазол 4 -(фенилазо)оксазол 4 -оксазолсульфокислота Производные тиазола обычно с трудом вступают в реакции электрофильного замещения, что обусловлено N-протонированием или комплексообразованием с кислотами Льюиса в условиях реакции. Незамещенный тиазол не вступает в реакцию нитрования даже при использовании азотной кислоты в олеуме при 160 0 С N N R R — + образование илидов
10 Электрофильное замещение в 1, 3 -азолах N HN H N O 3 N HN O 2 N N HN Br. B r 2 N HN N N P h — N 2 +4(5)-нитроимидазол 4(5)-бромимидазол 2 -(фенилазо)имидазол O N HNO 3 O NO 2 N O NBr Br 2 O NNNPh Ph-N 2 + H 2 SO 4 O NHO 3 S 4 -нитрооксазол 4 -бромоксазол 4 -(фенилазо)оксазол 4 -оксазолсульфокислота Производные тиазола обычно с трудом вступают в реакции электрофильного замещения, что обусловлено N-протонированием или комплексообразованием с кислотами Льюиса в условиях реакции. Незамещенный тиазол не вступает в реакцию нитрования даже при использовании азотной кислоты в олеуме при 160 0 С N N R R — + образование илидов
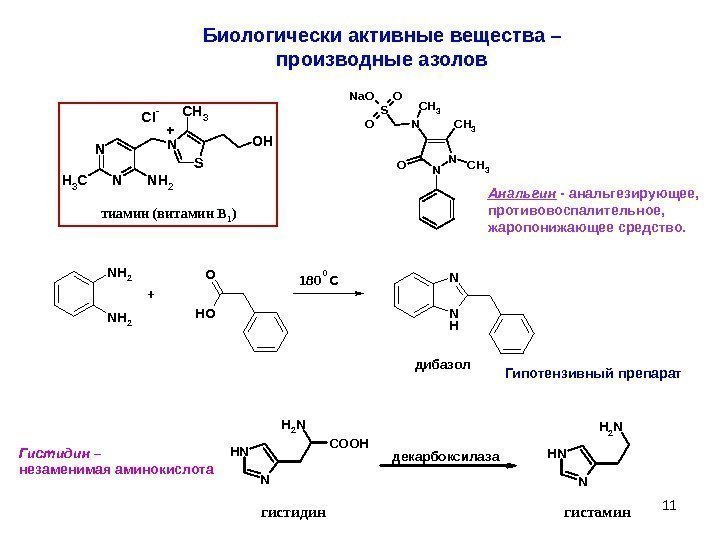
 11 Биологически активные вещества – производные азолов N NCH 3 N H 2 N SC H 3 O HC l — + тиамин (витамин В 1 )N NCH 3 N O CH 3 S O O Na. O Анальгин — анальгезирующее, противовоспалительное, жаропонижающее средство. N H 2 O OH N HN + 180 C 0 дибазол Гипотензивный препарат NH N NH 2 COOH NH N NH 2 гистидин гистамин декарбоксилаза Гистидин – незаменимая аминокислота
11 Биологически активные вещества – производные азолов N NCH 3 N H 2 N SC H 3 O HC l — + тиамин (витамин В 1 )N NCH 3 N O CH 3 S O O Na. O Анальгин — анальгезирующее, противовоспалительное, жаропонижающее средство. N H 2 O OH N HN + 180 C 0 дибазол Гипотензивный препарат NH N NH 2 COOH NH N NH 2 гистидин гистамин декарбоксилаза Гистидин – незаменимая аминокислота
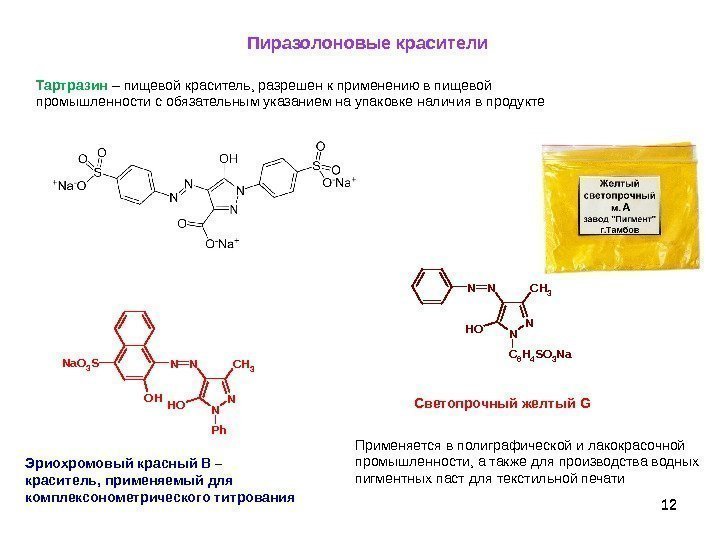
 12 12 Пиразолоновые красители Тартразин – пищевой краситель, разрешен к применению в пищевой промышленности с обязательным указанием на упаковке наличия в продукте Эриохромовый красный В – краситель, применяемый для комплексонометрического титрования. N N Ph CH 3 NN OH Na. O 3 S OH N N C 6 H 4 S O 3 N a. C H 3 NN OH Светопрочный желтый G Применяется в полиграфической и лакокрасочной промышленности, а также для производства водных пигментных паст для текстильной печати
12 12 Пиразолоновые красители Тартразин – пищевой краситель, разрешен к применению в пищевой промышленности с обязательным указанием на упаковке наличия в продукте Эриохромовый красный В – краситель, применяемый для комплексонометрического титрования. N N Ph CH 3 NN OH Na. O 3 S OH N N C 6 H 4 S O 3 N a. C H 3 NN OH Светопрочный желтый G Применяется в полиграфической и лакокрасочной промышленности, а также для производства водных пигментных паст для текстильной печати
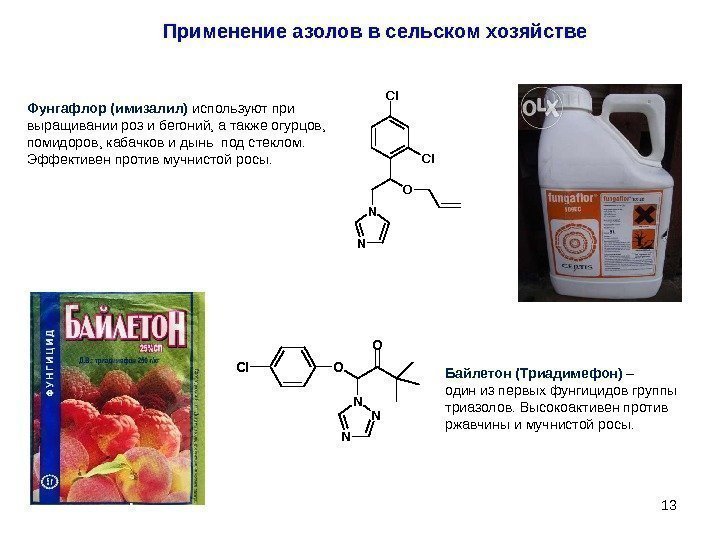
 13 N N O Cl Cl. Фунгафлор (имизалил) используют при выращивании роз и бегоний, а также огурцов, помидоров, кабачков и дынь под стеклом. Эффективен против мучнистой росы. N N NOCl O Байлетон (Триадимефон) – один из первых фунгицидов группы триазолов. Высокоактивен против ржавчины и мучнистой росы. Применение азолов в сельском хозяйстве
13 N N O Cl Cl. Фунгафлор (имизалил) используют при выращивании роз и бегоний, а также огурцов, помидоров, кабачков и дынь под стеклом. Эффективен против мучнистой росы. N N NOCl O Байлетон (Триадимефон) – один из первых фунгицидов группы триазолов. Высокоактивен против ржавчины и мучнистой росы. Применение азолов в сельском хозяйстве
 14 1 1 Курс лекций является частью учебно-методического комплекса «Химия гетероциклических соединений» автор: • Носова Эмилия Владимировна, д. х. н. , доцент кафедры органической и биомолекулярной химии ХТИ Ур. ФУ лектор Учебно-методический комплекс подготовлен на кафедре органической химии химико-технологического института Ур. ФУ Никакая часть презентации не может быть воспроизведена в какой бы то ни было форме без письменного разрешения авторов
14 1 1 Курс лекций является частью учебно-методического комплекса «Химия гетероциклических соединений» автор: • Носова Эмилия Владимировна, д. х. н. , доцент кафедры органической и биомолекулярной химии ХТИ Ур. ФУ лектор Учебно-методический комплекс подготовлен на кафедре органической химии химико-технологического института Ур. ФУ Никакая часть презентации не может быть воспроизведена в какой бы то ни было форме без письменного разрешения авторов
