Лекция 5 Пиридин Химия гетероциклических соединений 2



2016_bak_heterocycles_5.ppt
- Размер: 1.1 Мб
- Автор:
- Количество слайдов: 21
Описание презентации Лекция 5 Пиридин Химия гетероциклических соединений 2 по слайдам
 Лекция 5 Пиридин Химия гетероциклических соединений
Лекция 5 Пиридин Химия гетероциклических соединений
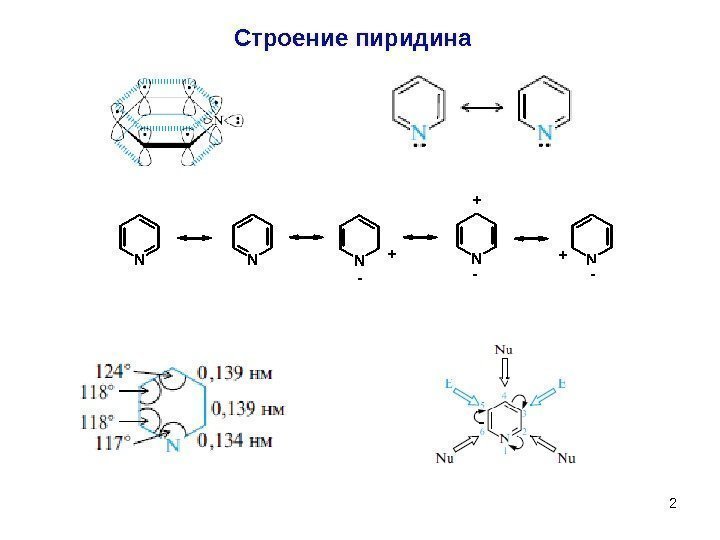
 2 Строение пиридина NNNNN — + + —
2 Строение пиридина NNNNN — + + —
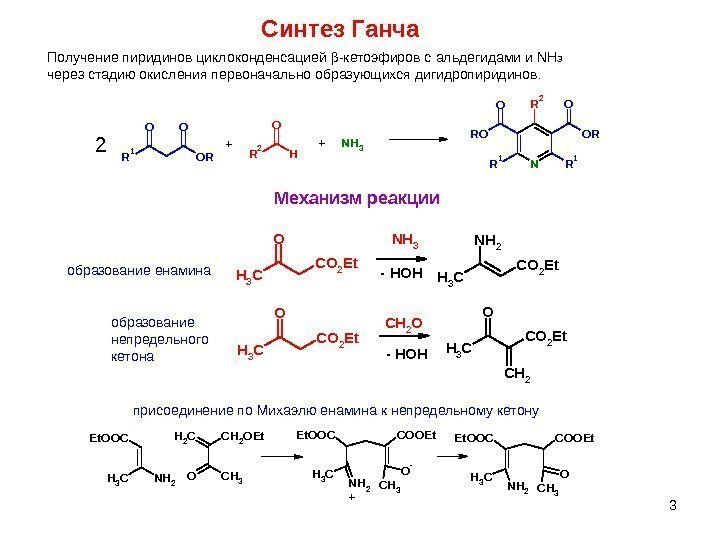
 3 Синтез Ганча Получение пиридинов циклоконденсацией — кетоэфиров с альдегидами и NH 3 через стадию окисления первоначально образующихся дигидропиридинов. OO ORR 1 R 2 H O NH 3 NR 1 R 1 OR OO RO R 2 2++ Механизм реакции O CH 3 C O 2 E t N H 3 N H 2 CH 3 C O 2 E t O CH 3 C O 2 E t C H 2 O O CH 3 C O 2 E t C H 2 — HOHобразование енамина образование непредельного кетона присоединение по Михаэлю енамина к непредельному кетону CH 3 NH 2 Et. OOCCH 2 OEt. CH 2 OCH 3 COOEt. Et. OOC NH 2 CH 3 O — +
3 Синтез Ганча Получение пиридинов циклоконденсацией — кетоэфиров с альдегидами и NH 3 через стадию окисления первоначально образующихся дигидропиридинов. OO ORR 1 R 2 H O NH 3 NR 1 R 1 OR OO RO R 2 2++ Механизм реакции O CH 3 C O 2 E t N H 3 N H 2 CH 3 C O 2 E t O CH 3 C O 2 E t C H 2 O O CH 3 C O 2 E t C H 2 — HOHобразование енамина образование непредельного кетона присоединение по Михаэлю енамина к непредельному кетону CH 3 NH 2 Et. OOCCH 2 OEt. CH 2 OCH 3 COOEt. Et. OOC NH 2 CH 3 O — +
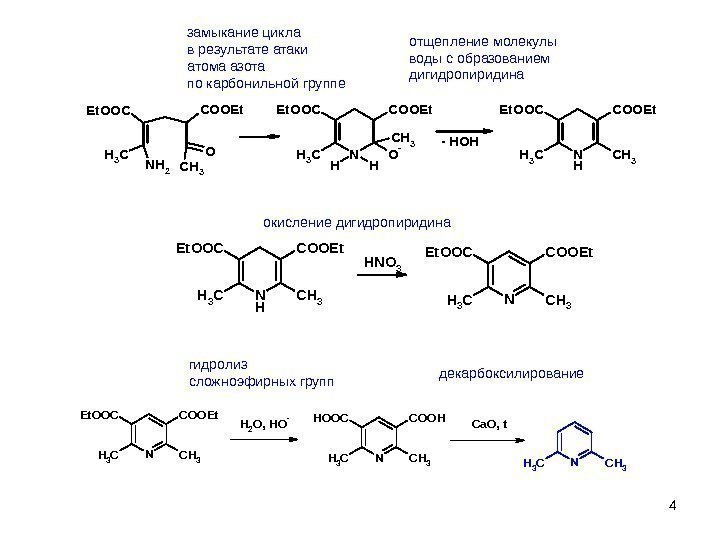
 4 замыкание цикла в результате атаки атома азота по карбонильной группе COOEt. OOC NH 2 CH 3 ON HH CH 3 O-CH 3 COOEt. OOC N H CH 3 COOEt. OOC — HOH отщепление молекулы воды с образованием дигидропиридина окисление дигидропиридина N H CH 3 COOEt. OOC HNO 3 NCH 3 COOEt. OOC гидролиз сложноэфирных групп декарбоксилирование NCH 3 COOEt. OOCH 2 O, HO- NCH 3 CH 3 COOHHOOCCa. O, t
4 замыкание цикла в результате атаки атома азота по карбонильной группе COOEt. OOC NH 2 CH 3 ON HH CH 3 O-CH 3 COOEt. OOC N H CH 3 COOEt. OOC — HOH отщепление молекулы воды с образованием дигидропиридина окисление дигидропиридина N H CH 3 COOEt. OOC HNO 3 NCH 3 COOEt. OOC гидролиз сложноэфирных групп декарбоксилирование NCH 3 COOEt. OOCH 2 O, HO- NCH 3 CH 3 COOHHOOCCa. O, t
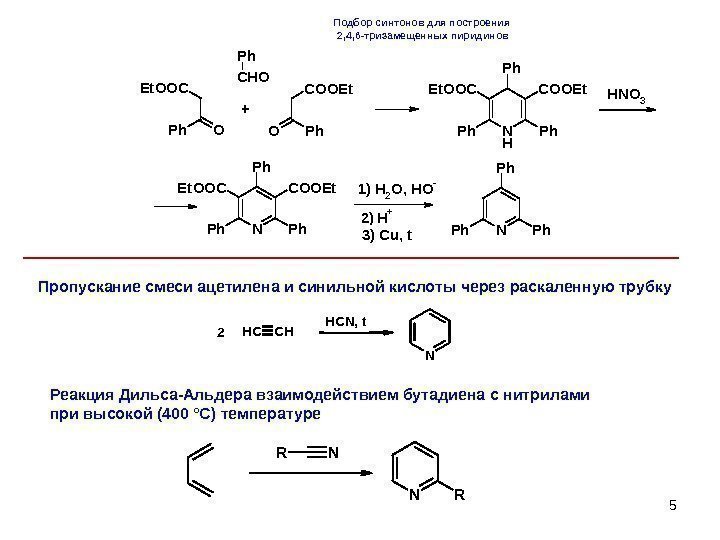
 5 O Et. OOC Ph CHO Ph O COOEt Ph. N H Ph. Ph Ph COOEt. OOCHNO 3 NPh. Ph Ph COOEt. OOCH 2 O, HO- H+ NPh. Ph Ph + 1) 2) 3) Cu, t. Подбор синтонов для построения 2, 4, 6 -тризамещенных пиридинов N CHCH HCN, t 2 Пропускание смеси ацетилена и синильной кислоты через раскаленную трубку Реакция Дильса-Альдера взаимодействием бутадиена с нитрилами при высокой (400 °С) температуре N RNR
5 O Et. OOC Ph CHO Ph O COOEt Ph. N H Ph. Ph Ph COOEt. OOCHNO 3 NPh. Ph Ph COOEt. OOCH 2 O, HO- H+ NPh. Ph Ph + 1) 2) 3) Cu, t. Подбор синтонов для построения 2, 4, 6 -тризамещенных пиридинов N CHCH HCN, t 2 Пропускание смеси ацетилена и синильной кислоты через раскаленную трубку Реакция Дильса-Альдера взаимодействием бутадиена с нитрилами при высокой (400 °С) температуре N RNR
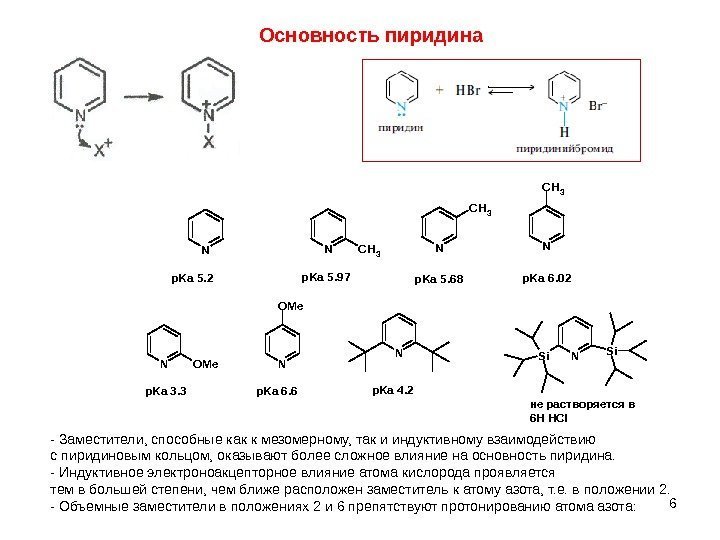
 6 Основность пиридина. NNCH 3 N CH 3 p. Ka 5. 2 p. Ka 5. 97 p. Ka 5. 68 p. Ka 6. 02 — Заместители, способные как к мезомерному, так и индуктивному взаимодействию с пиридиновым кольцом, оказывают более сложное влияние на основность пиридина. — Индуктивное электроноакцепторное влияние атома кислорода проявляется тем в большей степени, чем ближе расположен заместитель к атому азота, т. е. в положении 2. — Объемные заместители в положениях 2 и 6 препятствуют протонированию атома азота: N O M e N N Si Si p. Ka 3. 3 p. Ka 6. 6 p. Ka 4. 2 не растворя ется в 6 Н HCl
6 Основность пиридина. NNCH 3 N CH 3 p. Ka 5. 2 p. Ka 5. 97 p. Ka 5. 68 p. Ka 6. 02 — Заместители, способные как к мезомерному, так и индуктивному взаимодействию с пиридиновым кольцом, оказывают более сложное влияние на основность пиридина. — Индуктивное электроноакцепторное влияние атома кислорода проявляется тем в большей степени, чем ближе расположен заместитель к атому азота, т. е. в положении 2. — Объемные заместители в положениях 2 и 6 препятствуют протонированию атома азота: N O M e N N Si Si p. Ka 3. 3 p. Ka 6. 6 p. Ka 4. 2 не растворя ется в 6 Н HCl
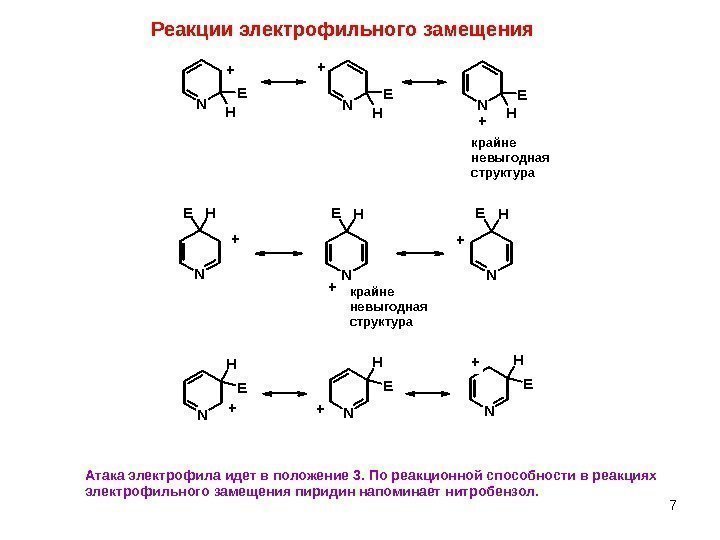
 7 Реакции электрофильного замещения. N E HN E H N EH N H E ++ + + ++ + крайне невыгодная структура Атака электрофила идет в положение 3. По реакционной способности в реакциях электрофильного замещения пиридин напоминает нитробензол.
7 Реакции электрофильного замещения. N E HN E H N EH N H E ++ + + ++ + крайне невыгодная структура Атака электрофила идет в положение 3. По реакционной способности в реакциях электрофильного замещения пиридин напоминает нитробензол.
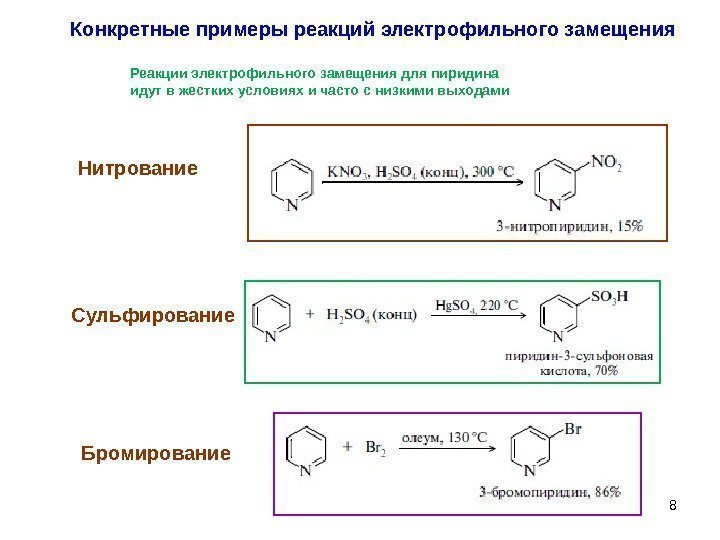
 8 Конкретные примеры реакций электрофильного замещения Реакции электрофильного замещения для пиридина идут в жестких условиях и часто с низкими выходами Нитрование Сульфирование Бромирование
8 Конкретные примеры реакций электрофильного замещения Реакции электрофильного замещения для пиридина идут в жестких условиях и часто с низкими выходами Нитрование Сульфирование Бромирование
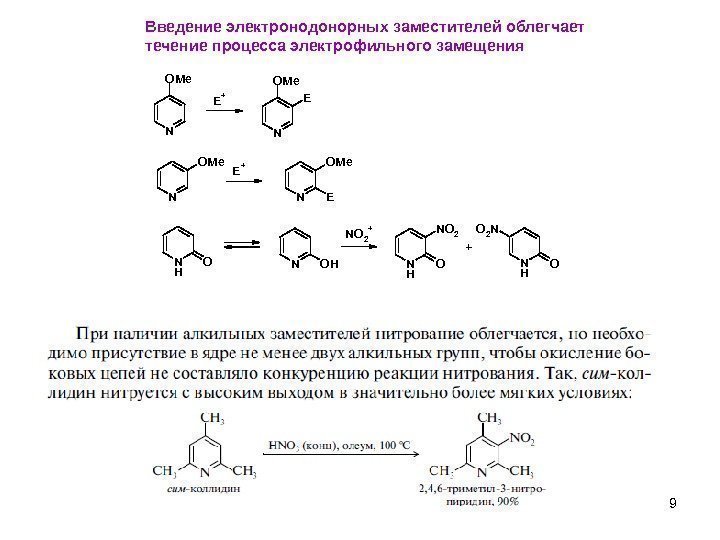
 9 Введение электронодонорных заместителей облегчает течение процесса электрофильного замещения N OMe E + N OMe E N OMe. E + N OMe E NHONOH NO 2 + NHO NO 2 NHO O 2 N +
9 Введение электронодонорных заместителей облегчает течение процесса электрофильного замещения N OMe E + N OMe E N OMe. E + N OMe E NHONOH NO 2 + NHO NO 2 NHO O 2 N +
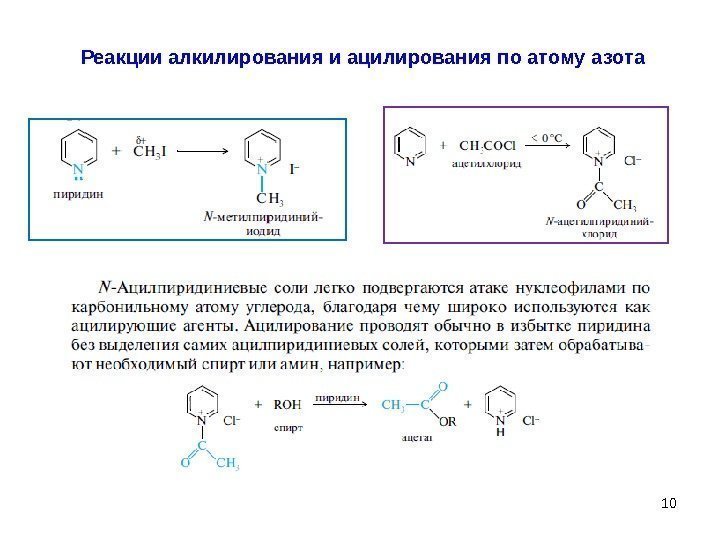
 10 Реакции алкилирования и ацилирования по атому азота
10 Реакции алкилирования и ацилирования по атому азота
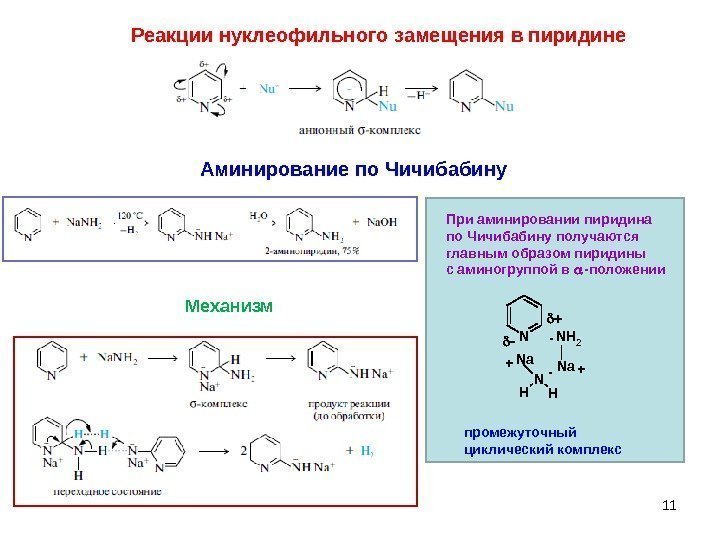
 11 Реакции нуклеофильного замещения в пиридине При аминировании пиридина по Чичибабину получаются главным образом пиридины с аминогруппой в -положении NNH 2 Na N HH Na+-+ — промежуточный циклический комплекс Аминирование по Чичибабину Механизм
11 Реакции нуклеофильного замещения в пиридине При аминировании пиридина по Чичибабину получаются главным образом пиридины с аминогруппой в -положении NNH 2 Na N HH Na+-+ — промежуточный циклический комплекс Аминирование по Чичибабину Механизм
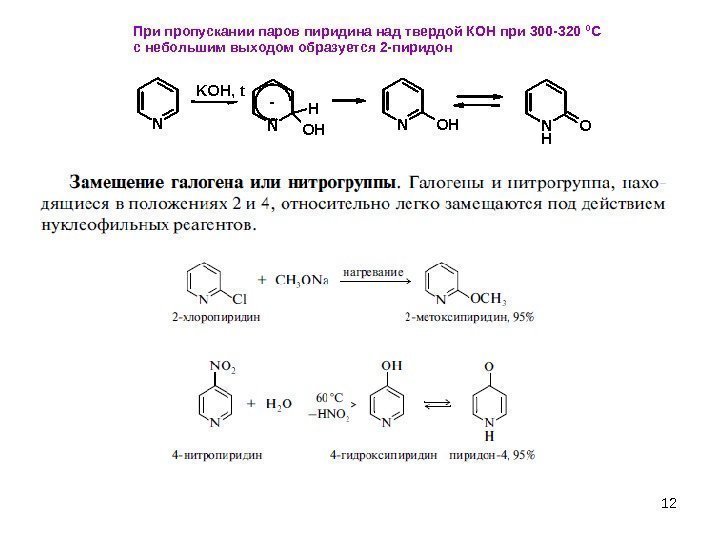
 12 NN H OHNOHN H O KOH, t -При пропускании паров пиридина над твердой КОН при 300 -320 0 С с небольшим выходом образуется 2 -пиридон
12 NN H OHNOHN H O KOH, t -При пропускании паров пиридина над твердой КОН при 300 -320 0 С с небольшим выходом образуется 2 -пиридон
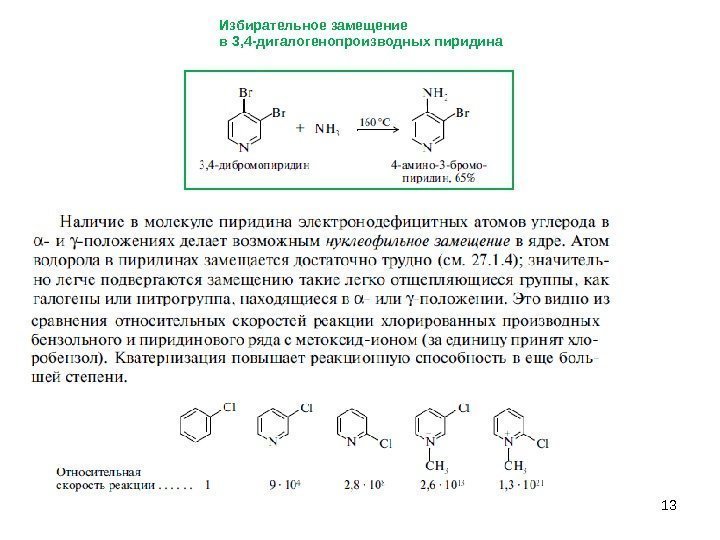
 13 Избирательное замещение в 3, 4 -дигалогенопроизводных пиридина
13 Избирательное замещение в 3, 4 -дигалогенопроизводных пиридина
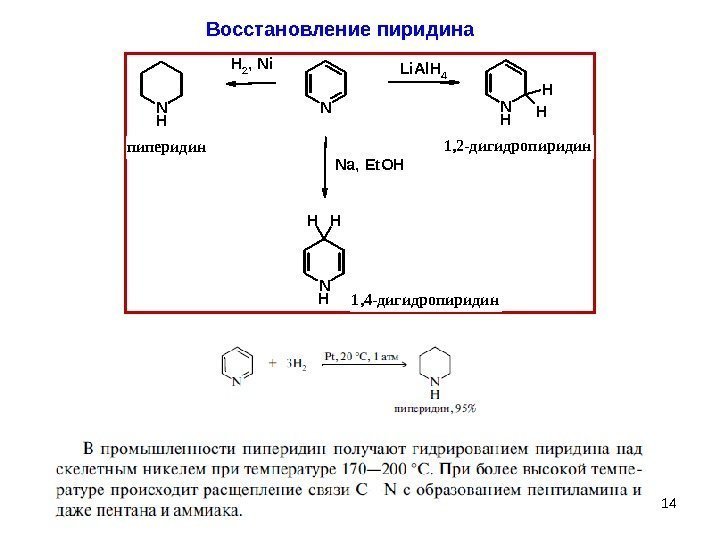
 14 Восстановление пиридина. N Li. Al. H 4 N H H H N H HH H 2, Ni N H Na, Et. OH 1, 2 -дигидропиридин 1, 4 -дигидропиридин пиперидин
14 Восстановление пиридина. N Li. Al. H 4 N H H H N H HH H 2, Ni N H Na, Et. OH 1, 2 -дигидропиридин 1, 4 -дигидропиридин пиперидин
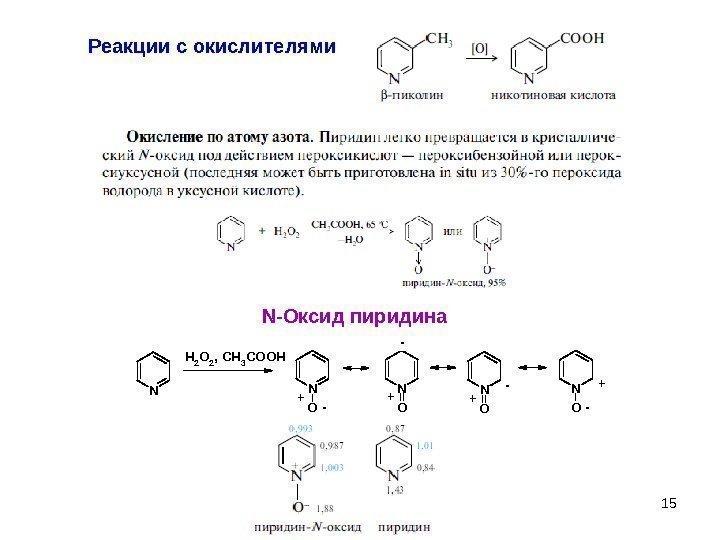
 15 Реакции с окислителями. N H 2 O 2, CH 3 COOH N O N O + — + -+ — N -Оксид пиридина
15 Реакции с окислителями. N H 2 O 2, CH 3 COOH N O N O + — + -+ — N -Оксид пиридина
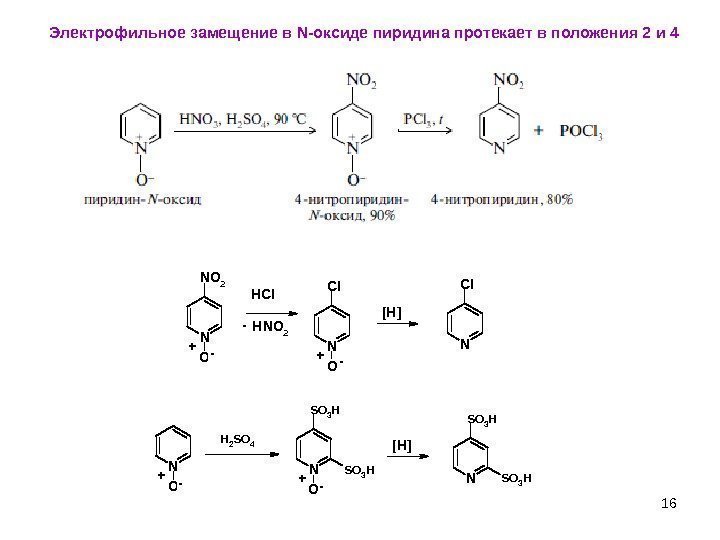
 16 Электрофильное замещение в N- оксиде пиридина протекает в положения 2 и 4 N O NO 2 HNO 2 N O Cl N O H 2 S O 4 N O S O 3 H N S O 3 H +- HCl — +- [H] +-+- [H]
16 Электрофильное замещение в N- оксиде пиридина протекает в положения 2 и 4 N O NO 2 HNO 2 N O Cl N O H 2 S O 4 N O S O 3 H N S O 3 H +- HCl — +- [H] +-+- [H]
 17 Конденсации с участием 2 -метилпиридина и 4 -метилпиридна
17 Конденсации с участием 2 -метилпиридина и 4 -метилпиридна
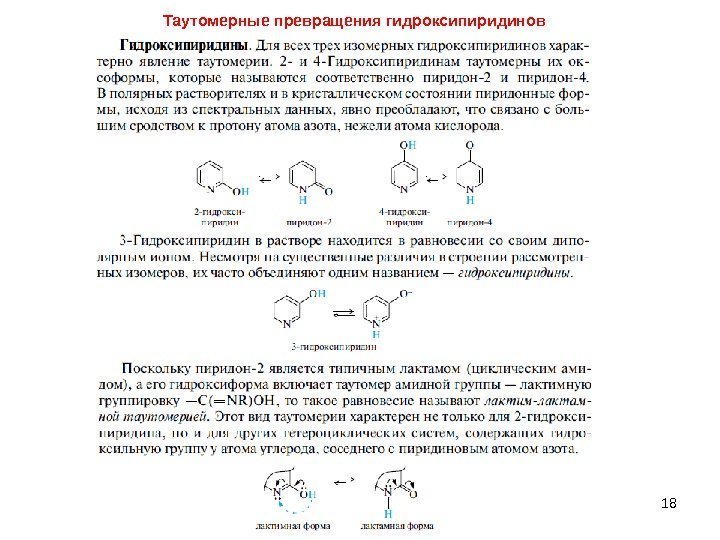
 18 Таутомерные превращения гидроксипиридинов
18 Таутомерные превращения гидроксипиридинов
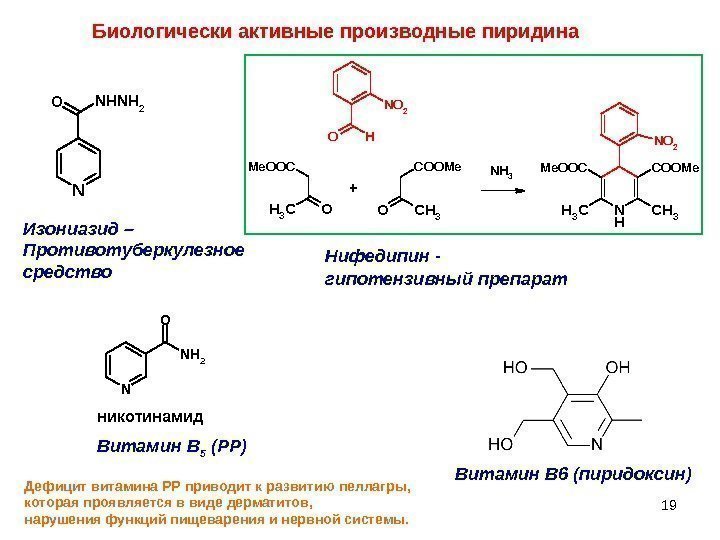
 19 Биологически активные производные пиридина NNHNH 2 O Изониазид – Противотуберкулезное средство N N H 2 O никотинамид Витамин В 5 (РР) Дефицит витамина РР приводит к развитию пеллагры, которая проявляется в виде дерматитов, нарушения функций пищеварения и нервной системы. Витамин В 6 (пиридоксин)Нифедипин — гипотензивный препарат OCH 3 Me. OOC OCH 3 COOMe N H CH 3 COOMe. OOC NO 2 OH NH 3 +
19 Биологически активные производные пиридина NNHNH 2 O Изониазид – Противотуберкулезное средство N N H 2 O никотинамид Витамин В 5 (РР) Дефицит витамина РР приводит к развитию пеллагры, которая проявляется в виде дерматитов, нарушения функций пищеварения и нервной системы. Витамин В 6 (пиридоксин)Нифедипин — гипотензивный препарат OCH 3 Me. OOC OCH 3 COOMe N H CH 3 COOMe. OOC NO 2 OH NH 3 +
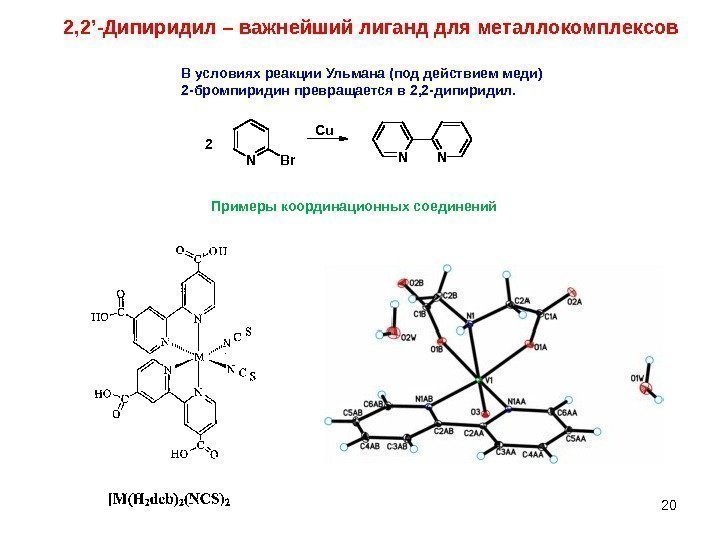
 20 В условиях реакции Ульмана (под действием меди) 2 -бромпиридин превращается в 2, 2 -дипиридил. N Br N N 2 Cu 2, 2 ’ -Дипиридил – важнейший лиганд для металлокомплексов Примеры координационных соединений
20 В условиях реакции Ульмана (под действием меди) 2 -бромпиридин превращается в 2, 2 -дипиридил. N Br N N 2 Cu 2, 2 ’ -Дипиридил – важнейший лиганд для металлокомплексов Примеры координационных соединений
 21 12 Курс лекций является частью учебно-методического комплекса «Химия гетероциклических соединений» автор: • Носова Эмилия Владимировна, д. х. н. , доцент кафедры органической химии УГТУ-УПИ Учебно-методический комплекс подготовлен на кафедре органической и биомолекулярной химии химико-технологического института Ур. ФУ Никакая часть презентации не может быть воспроизведена в какой бы то ни было форме без письменного разрешения авторов
21 12 Курс лекций является частью учебно-методического комплекса «Химия гетероциклических соединений» автор: • Носова Эмилия Владимировна, д. х. н. , доцент кафедры органической химии УГТУ-УПИ Учебно-методический комплекс подготовлен на кафедре органической и биомолекулярной химии химико-технологического института Ур. ФУ Никакая часть презентации не может быть воспроизведена в какой бы то ни было форме без письменного разрешения авторов
