ЛЕКЦИЯ 3 Производные фурана, пиррола, тиофена Химия



2016_bak_heterocycles_3.ppt
- Размер: 2.3 Мб
- Автор:
- Количество слайдов: 35
Описание презентации ЛЕКЦИЯ 3 Производные фурана, пиррола, тиофена Химия по слайдам
 ЛЕКЦИЯ 3 Производные фурана, пиррола, тиофена Химия гетероциклических соединений
ЛЕКЦИЯ 3 Производные фурана, пиррола, тиофена Химия гетероциклических соединений
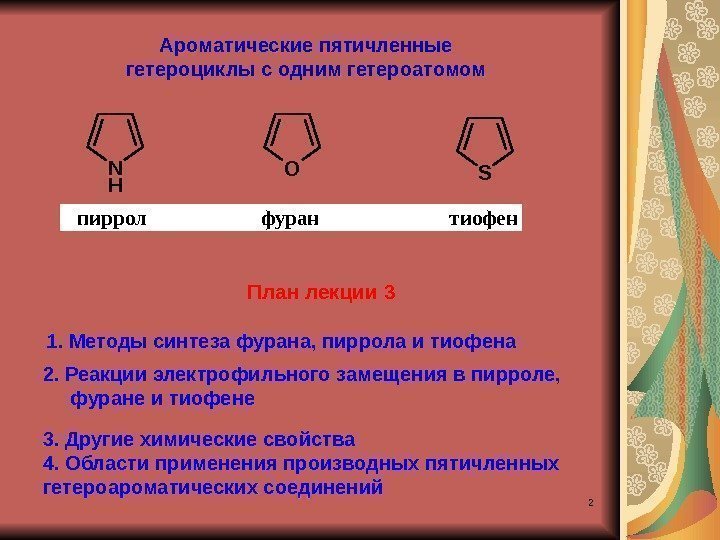
 2 OSN H пиррол фуран тиофен. Ароматические пятичленные гетероциклы с одним гетероатомом 1. Методы синтеза фурана, пиррола и тиофена План лекции 3 2. Реакции электрофильного замещения в пирроле, фуране и тиофене 3. Другие химические свойства 4. Области применения производных пятичленных гетероароматических соединений
2 OSN H пиррол фуран тиофен. Ароматические пятичленные гетероциклы с одним гетероатомом 1. Методы синтеза фурана, пиррола и тиофена План лекции 3 2. Реакции электрофильного замещения в пирроле, фуране и тиофене 3. Другие химические свойства 4. Области применения производных пятичленных гетероароматических соединений
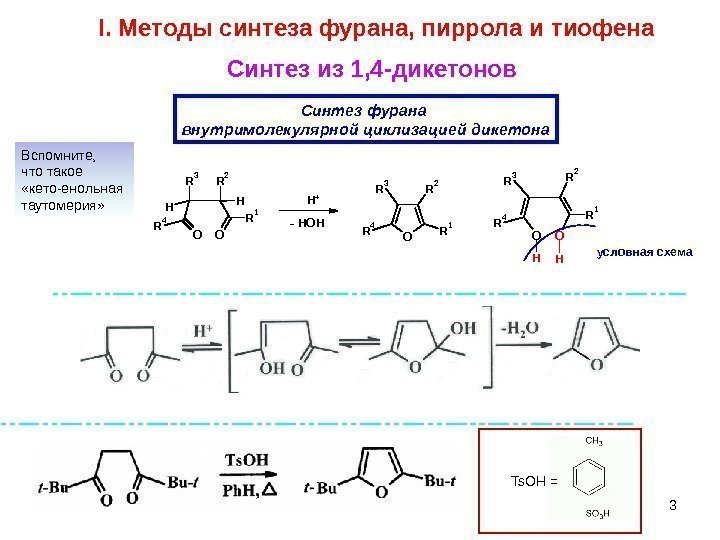
 3 OR 1 R 2 R 3 R 4 OO R 1 R 4 H R 3 H R 2 OO R 1 R 4 R 3 R 2 HH — HOH H + условная схема. Синтез из 1, 4 -дикетонов C интез фурана внутримолекулярной циклизацией дикетона. I. Методы синтеза фурана, пиррола и тиофена Вспомните, что такое «кето-енольная таутомерия» Ts. OH =
3 OR 1 R 2 R 3 R 4 OO R 1 R 4 H R 3 H R 2 OO R 1 R 4 R 3 R 2 HH — HOH H + условная схема. Синтез из 1, 4 -дикетонов C интез фурана внутримолекулярной циклизацией дикетона. I. Методы синтеза фурана, пиррола и тиофена Вспомните, что такое «кето-енольная таутомерия» Ts. OH =
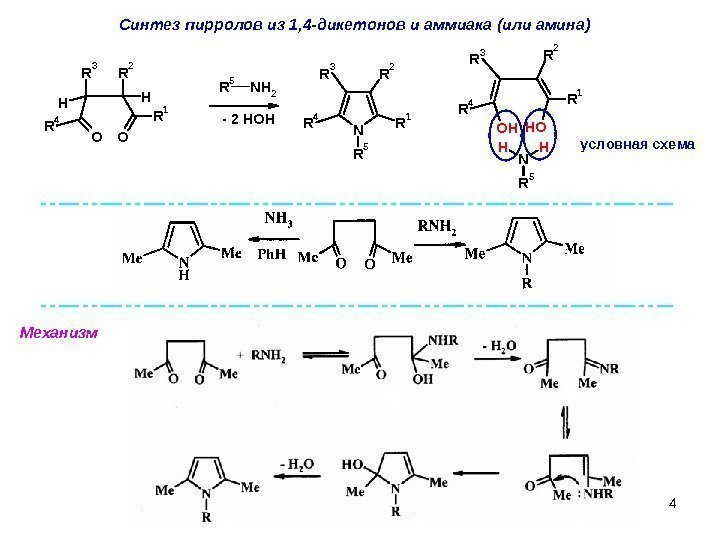
 4 N R 1 R 2 R 3 R 4 R 5 O O R 1 R 4 H R 3 HR 2 R 5 N H 2 O H OH R 1 R 4 R 3 R 2 N H H R 5 — 2 HOH условная схема. C интез пирролов из 1, 4 -дикетонов и аммиака (или амина) Механизм
4 N R 1 R 2 R 3 R 4 R 5 O O R 1 R 4 H R 3 HR 2 R 5 N H 2 O H OH R 1 R 4 R 3 R 2 N H H R 5 — 2 HOH условная схема. C интез пирролов из 1, 4 -дикетонов и аммиака (или амина) Механизм
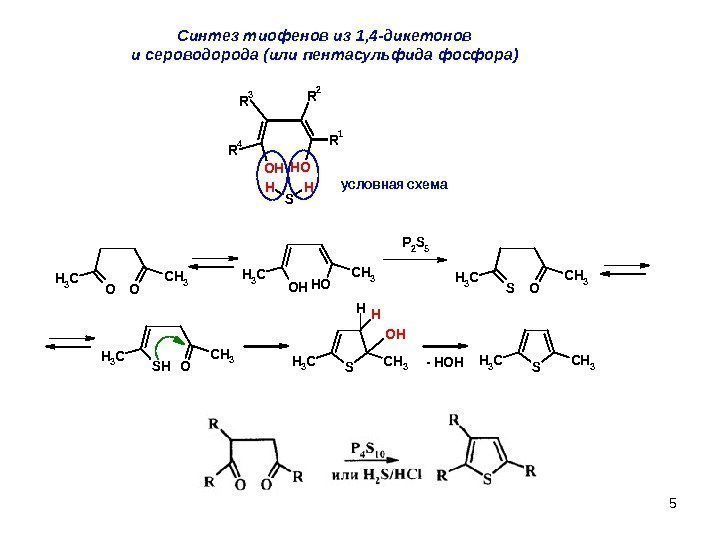
 5 C интез тиофенов из 1, 4 -дикетонов и сероводорода (или пентасульфида фосфора) SCH 3 OO CH 3 OHOH CH 3 P 2 S 5 OHOH R 1 R 4 R 3 R 2 S HH SO CH 3 SHO CH 3 SCH 3 OH HH — HOH условная схема
5 C интез тиофенов из 1, 4 -дикетонов и сероводорода (или пентасульфида фосфора) SCH 3 OO CH 3 OHOH CH 3 P 2 S 5 OHOH R 1 R 4 R 3 R 2 S HH SO CH 3 SHO CH 3 SCH 3 OH HH — HOH условная схема
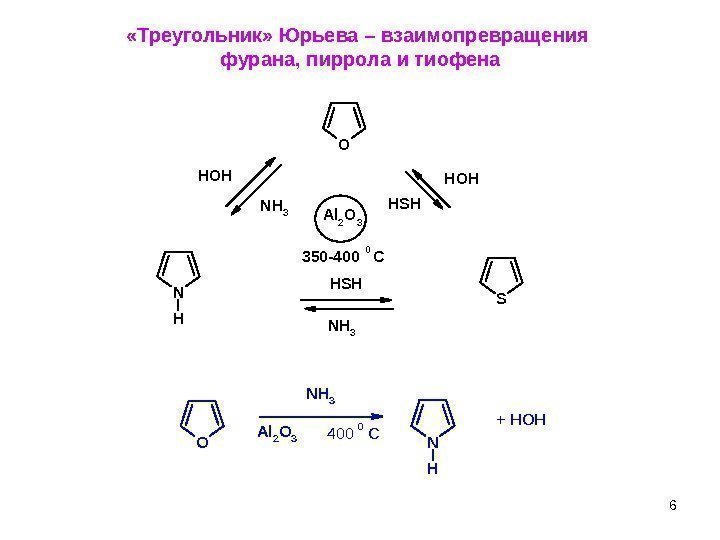
 6 «Треугольник» Юрьева – взаимопревращения фурана, пиррола и тиофена N HO N H 3 A l 2 O 3 400 C 0 + HOHN H HOH NH 3 O HSH NH 3 HSH HOH S Al 2 O 3 350 —
6 «Треугольник» Юрьева – взаимопревращения фурана, пиррола и тиофена N HO N H 3 A l 2 O 3 400 C 0 + HOHN H HOH NH 3 O HSH NH 3 HSH HOH S Al 2 O 3 350 —
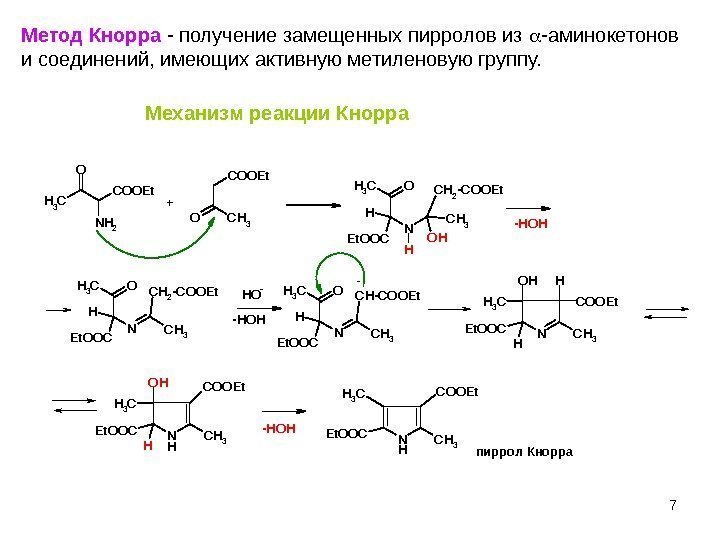
 7 Метод Кнорра — получение замещенных пирролов из -аминокетонов и соединений, имеющих активную метиленовую группу. O CH 3 N H 2 C O O E t OCH 3 H N E t O O C C H 3 C H 2 — C O O E t O H H NO H CH 3 HE t O O C H 3 C O O E t N HCH 3 E t O O C C H 3 C O O E t. O C H 3 C O O E t OCH 3 H N E t O O C C H 3 C H 2 — C O O E t H O- OCH 3 H N E t O O C C H 3 C H — C O O E t N HO H CH 3 HE t O O C C H 3 C O O E t -HOH+ — -HOH пиррол Кнорра-HOHМеханизм реакции Кнорра
7 Метод Кнорра — получение замещенных пирролов из -аминокетонов и соединений, имеющих активную метиленовую группу. O CH 3 N H 2 C O O E t OCH 3 H N E t O O C C H 3 C H 2 — C O O E t O H H NO H CH 3 HE t O O C H 3 C O O E t N HCH 3 E t O O C C H 3 C O O E t. O C H 3 C O O E t OCH 3 H N E t O O C C H 3 C H 2 — C O O E t H O- OCH 3 H N E t O O C C H 3 C H — C O O E t N HO H CH 3 HE t O O C C H 3 C O O E t -HOH+ — -HOH пиррол Кнорра-HOHМеханизм реакции Кнорра
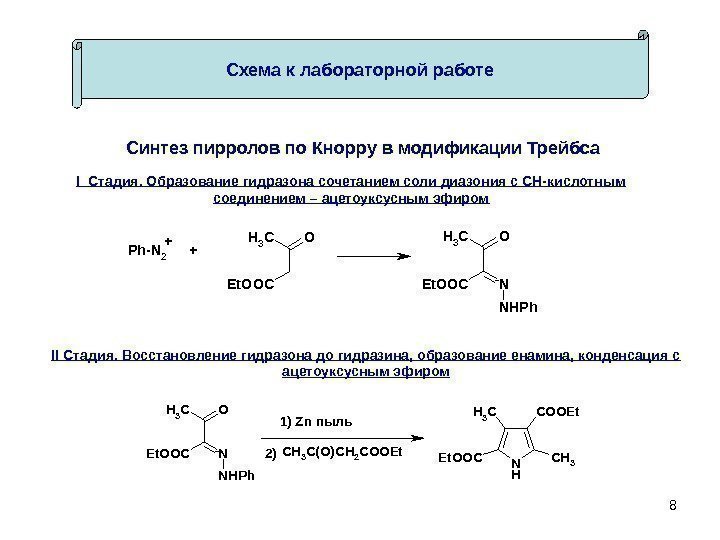
 8 Схема к лабораторной работе Синтез пирролов по Кнорру в модификации Трейбса. Ph-N 2 OCH 3 Et. OOC OCH 3 N NHPh Et. OOC ++ OCH 3 N NHPh Et. OOCCH 3 C(O)CH 2 COOEt N H CH 3 COOEt Et. OOC 1) Zn пыль 2) I Стадия. Образование гидразона сочетанием соли диазония с СН-кислотным соединением – ацетоуксусным эфиром II Стадия. Восстановление гидразона до гидразина, образование енамина, конденсация с ацетоуксусным эфиром
8 Схема к лабораторной работе Синтез пирролов по Кнорру в модификации Трейбса. Ph-N 2 OCH 3 Et. OOC OCH 3 N NHPh Et. OOC ++ OCH 3 N NHPh Et. OOCCH 3 C(O)CH 2 COOEt N H CH 3 COOEt Et. OOC 1) Zn пыль 2) I Стадия. Образование гидразона сочетанием соли диазония с СН-кислотным соединением – ацетоуксусным эфиром II Стадия. Восстановление гидразона до гидразина, образование енамина, конденсация с ацетоуксусным эфиром
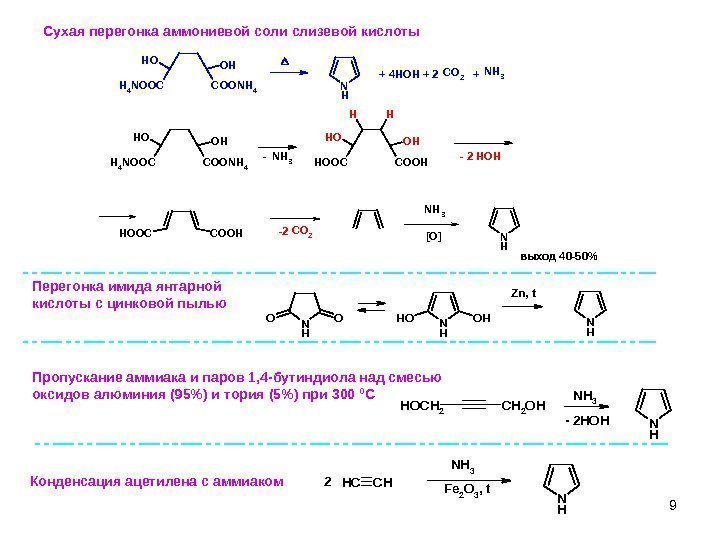
 9 N H C O 2 N H 3 OH O H C O O N H 4 H 4 N O O C N H 3 OH O H C O O HH O O C HH C O O HH O O C C O 2 N H 3 N H+ 4 HOH + 2 + — — 2 HOH -2 [O] выход 40 -50%Сухая перегонка аммониевой соли слизевой кислоты N HN H 3 C H 2 O HH O C H 2 — 2 HOHNHNH OONH OHOH Zn, t F e 2 O 3 , t. N H 3 CH C H N H 2 Пропускание аммиака и паров 1, 4 -бутиндиола над смесью оксидов алюминия (95%) и тория (5%) при 300 0 С Перегонка имида янтарной кислоты с цинковой пылью Конденсация ацетилена с аммиаком
9 N H C O 2 N H 3 OH O H C O O N H 4 H 4 N O O C N H 3 OH O H C O O HH O O C HH C O O HH O O C C O 2 N H 3 N H+ 4 HOH + 2 + — — 2 HOH -2 [O] выход 40 -50%Сухая перегонка аммониевой соли слизевой кислоты N HN H 3 C H 2 O HH O C H 2 — 2 HOHNHNH OONH OHOH Zn, t F e 2 O 3 , t. N H 3 CH C H N H 2 Пропускание аммиака и паров 1, 4 -бутиндиола над смесью оксидов алюминия (95%) и тория (5%) при 300 0 С Перегонка имида янтарной кислоты с цинковой пылью Конденсация ацетилена с аммиаком
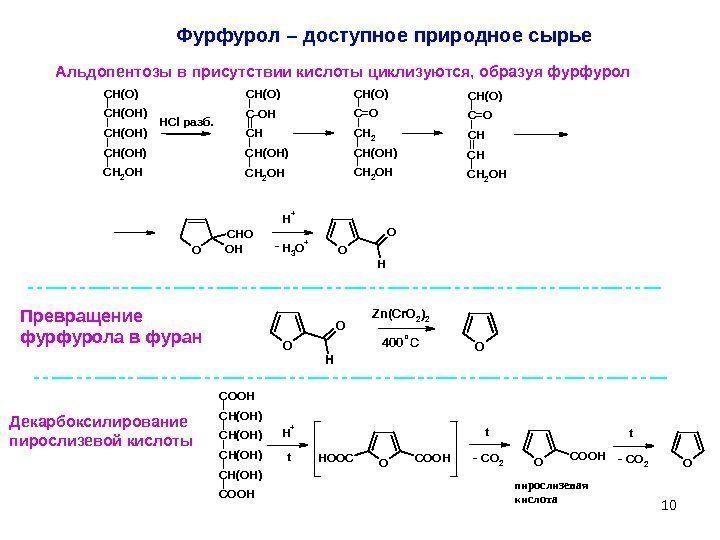
 10 Фурфурол – доступное природное сырье. CH(OH) CH 2 OH CH(O) O H O C-OH CH CH(OH) CH 2 OH CH(O) C=О CH 2 CH(OH) CH 2 OH CH(O) C=О CH CH CH 2 OH CH(O) OOH CHO H+ H 3 O+ HCl разб. — Альдопентозы в присутствии кислоты циклизуются, образуя фурфурол O H O O Zn(Cr. O 2)2 400 C 0 Превращение фурфурола в фуран Декарбоксилирование пирослизевой кислоты OCOOHHOOC CH(OH) COOH H+ OCOOHOCO 2 t пирослизевая кислота t —
10 Фурфурол – доступное природное сырье. CH(OH) CH 2 OH CH(O) O H O C-OH CH CH(OH) CH 2 OH CH(O) C=О CH 2 CH(OH) CH 2 OH CH(O) C=О CH CH CH 2 OH CH(O) OOH CHO H+ H 3 O+ HCl разб. — Альдопентозы в присутствии кислоты циклизуются, образуя фурфурол O H O O Zn(Cr. O 2)2 400 C 0 Превращение фурфурола в фуран Декарбоксилирование пирослизевой кислоты OCOOHHOOC CH(OH) COOH H+ OCOOHOCO 2 t пирослизевая кислота t —
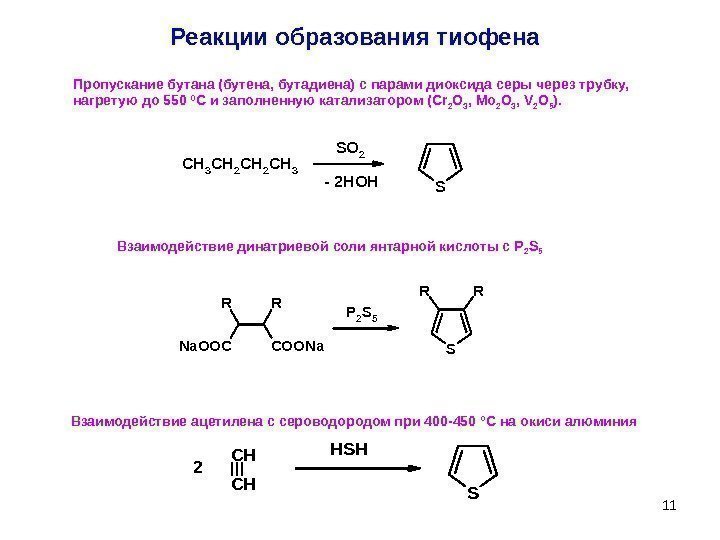
 11 Взаимодействие динатриевой соли янтарной кислоты с P 2 S 5 Реакции образования тиофена SS O 2 C H 3 C H 2 C H 3 — 2 HOHS RR RR Na. OOCCOONa P 2 S 5 S HSHCH CH 2 Пропускание бутана (бутена, бутадиена) с парами диоксида серы через трубку, нагретую до 550 0 С и заполненную катализатором (Cr 2 O 3 , Mo 2 O 3 , V 2 O 5 ). Взаимодействие ацетилена с сероводородом при 400 -450 °С на окиси алюминия
11 Взаимодействие динатриевой соли янтарной кислоты с P 2 S 5 Реакции образования тиофена SS O 2 C H 3 C H 2 C H 3 — 2 HOHS RR RR Na. OOCCOONa P 2 S 5 S HSHCH CH 2 Пропускание бутана (бутена, бутадиена) с парами диоксида серы через трубку, нагретую до 550 0 С и заполненную катализатором (Cr 2 O 3 , Mo 2 O 3 , V 2 O 5 ). Взаимодействие ацетилена с сероводородом при 400 -450 °С на окиси алюминия
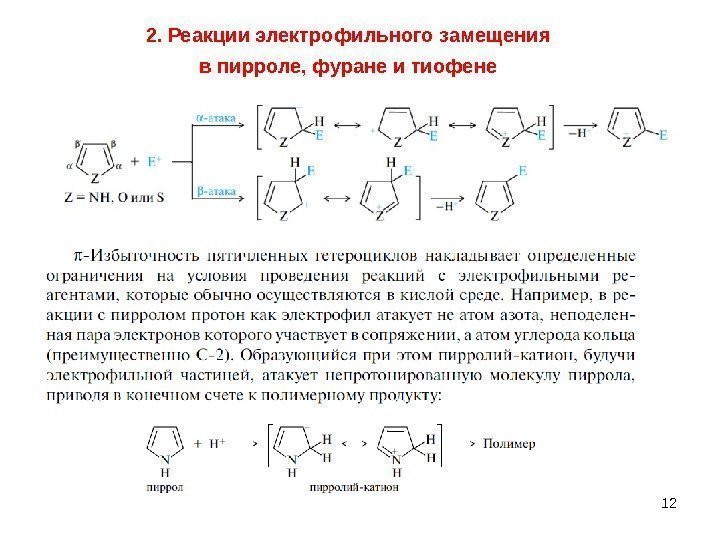
 122. Реакции электрофильного замещения в пирроле, фуране и тиофене
122. Реакции электрофильного замещения в пирроле, фуране и тиофене
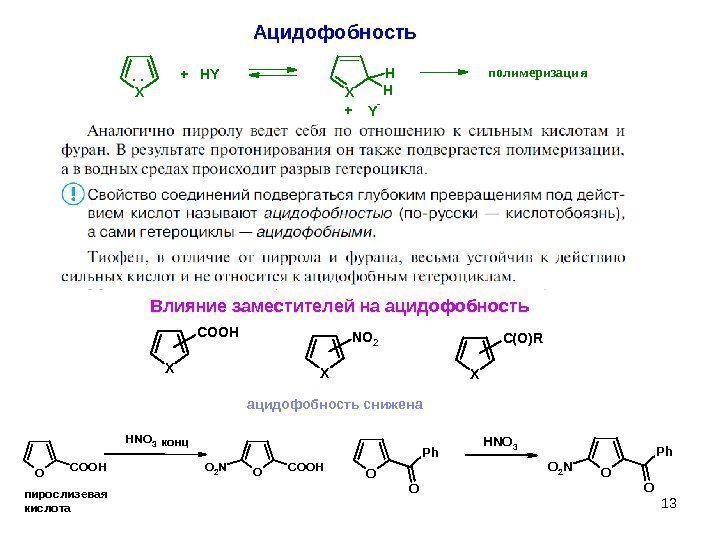
 13 Ацидофобность. XX H H Y- + HY +. . полимеризация Влияние заместителей на ацидофобность X C O O H X N O 2 X C ( O ) R ацидофобность снижена OCOOH HNO 3 OO 2 NCOOH конц пирослизевая кислота O O P h H N O 3 O O P h O 2 N
13 Ацидофобность. XX H H Y- + HY +. . полимеризация Влияние заместителей на ацидофобность X C O O H X N O 2 X C ( O ) R ацидофобность снижена OCOOH HNO 3 OO 2 NCOOH конц пирослизевая кислота O O P h H N O 3 O O P h O 2 N
 14 Реакции нитрования Условия реакций электрофильного замещения
14 Реакции нитрования Условия реакций электрофильного замещения
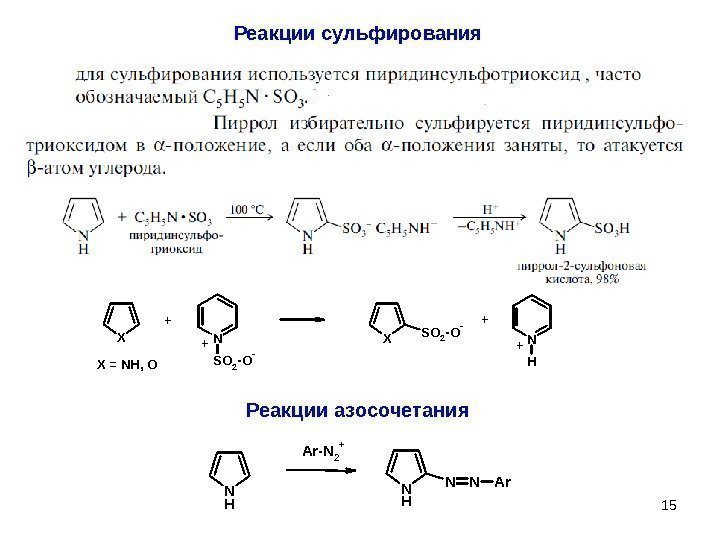
 15 Реакции сульфирования. XN SO 2 -O- XSO 2 -O- N H + + X = NH, O + + Реакции азосочетания N H Ar-N 2 + N H NNAr
15 Реакции сульфирования. XN SO 2 -O- XSO 2 -O- N H + + X = NH, O + + Реакции азосочетания N H Ar-N 2 + N H NNAr
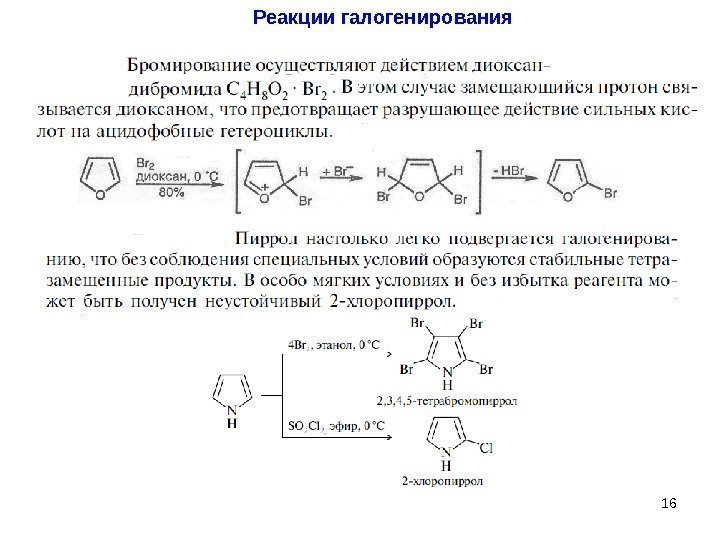
 16 Реакции галогенирования
16 Реакции галогенирования
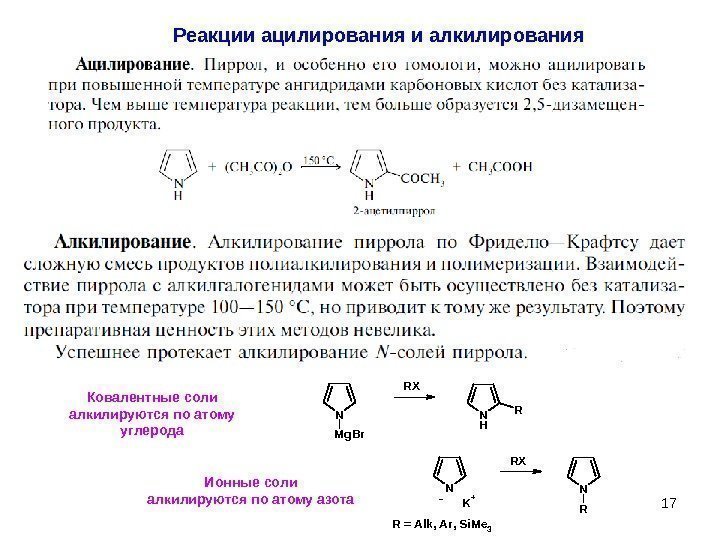
 17 Реакции ацилирования и алкилирования N M g B r N H RRX N N RK + R = A l k , A r , S i M e 3 RX -Ковалентные соли алкилируются по атому углерода Ионные соли алкилируются по атому азота
17 Реакции ацилирования и алкилирования N M g B r N H RRX N N RK + R = A l k , A r , S i M e 3 RX -Ковалентные соли алкилируются по атому углерода Ионные соли алкилируются по атому азота

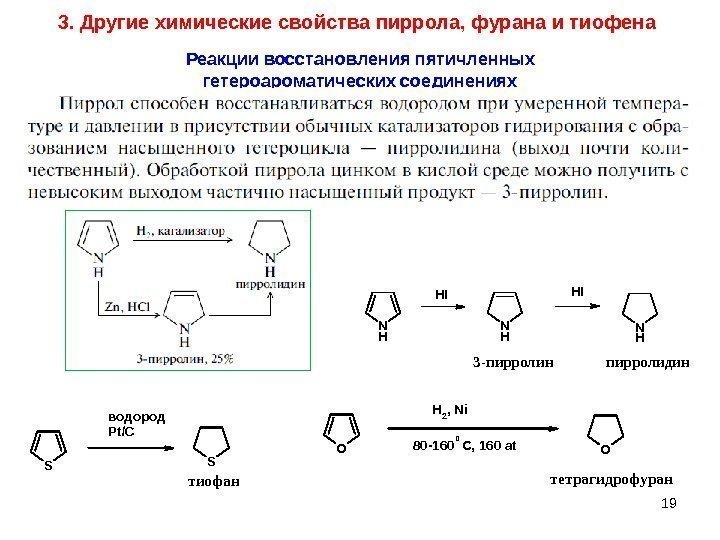
 193. Другие химические свойства пиррола, фурана и тиофена Реакции восстановления пятичленных гетероароматических соединениях. N HN H HI 3 -пирролин HI пирролидин S Sводород Pt/C тиофан OO H 2, Ni тетрагидрофуран 80 -160 C, 160 at
193. Другие химические свойства пиррола, фурана и тиофена Реакции восстановления пятичленных гетероароматических соединениях. N HN H HI 3 -пирролин HI пирролидин S Sводород Pt/C тиофан OO H 2, Ni тетрагидрофуран 80 -160 C, 160 at
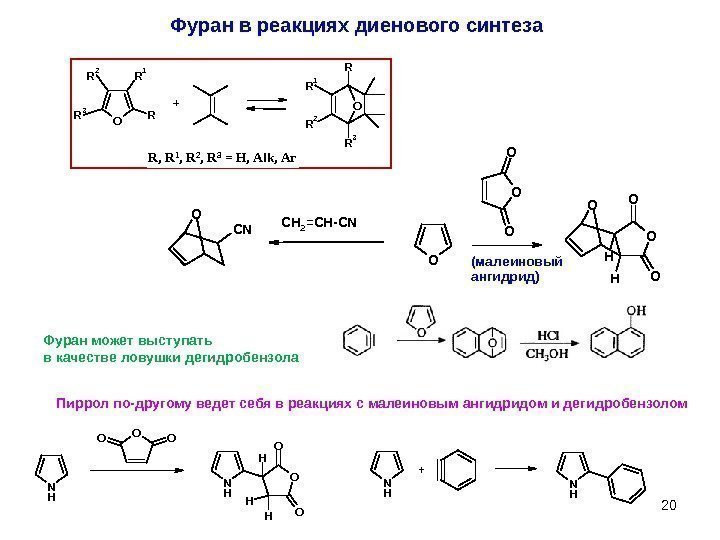
 20 Фуран в реакциях диенового синтеза. OR R 1 R 2 R 3 O R R 2 R 3 R 1 + R, R 1, R 2, R 3 = H, Alk, Ar O OO O H H O OC H 2 = C H — C NO C N (малеиновый ангидрид) Фуран может выступать в качестве ловушки дегидробензола N H O OO N H OH H H O O N H+Пиррол по-другому ведет себя в реакциях с малеиновым ангидридом и дегидробензолом
20 Фуран в реакциях диенового синтеза. OR R 1 R 2 R 3 O R R 2 R 3 R 1 + R, R 1, R 2, R 3 = H, Alk, Ar O OO O H H O OC H 2 = C H — C NO C N (малеиновый ангидрид) Фуран может выступать в качестве ловушки дегидробензола N H O OO N H OH H H O O N H+Пиррол по-другому ведет себя в реакциях с малеиновым ангидридом и дегидробензолом
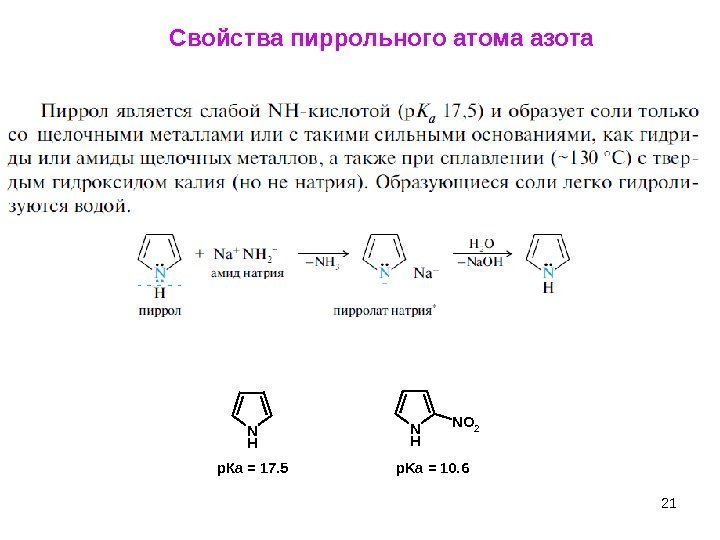
 21 Свойства пиррольного атома азота. N H NO 2 р. Ка = 17. 5 p. Ka = 10.
21 Свойства пиррольного атома азота. N H NO 2 р. Ка = 17. 5 p. Ka = 10.
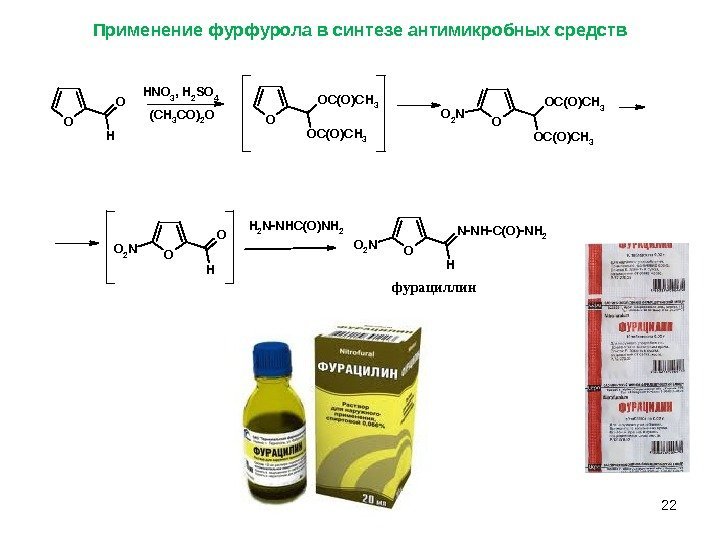
 22 Применение фурфурола в синтезе антимикробных средств O H N O 3 , H 2 S O 4 ( C H 3 C O )2 O O O C ( O ) C H 3 O C ( O ) C H 3 O 2 N O H O O 2 N O H N — N H — C ( O ) — N H 2 O 2 NH 2 N — N H C ( O ) N H 2 фурациллин
22 Применение фурфурола в синтезе антимикробных средств O H N O 3 , H 2 S O 4 ( C H 3 C O )2 O O O C ( O ) C H 3 O C ( O ) C H 3 O 2 N O H O O 2 N O H N — N H — C ( O ) — N H 2 O 2 NH 2 N — N H C ( O ) N H 2 фурациллин
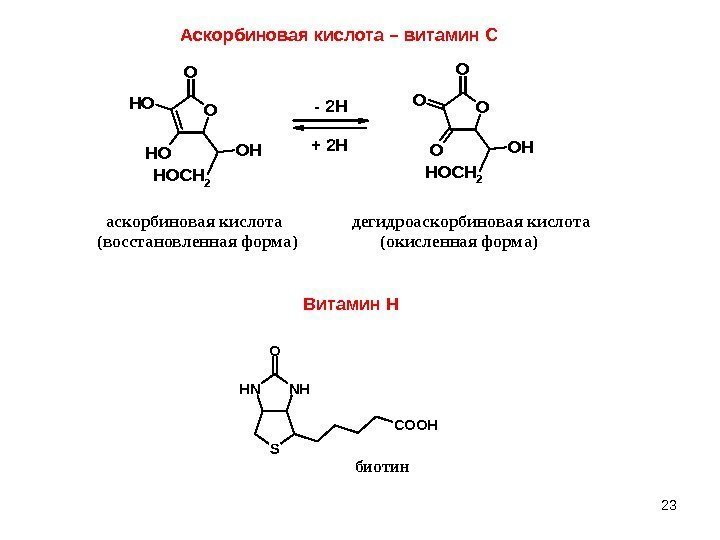
 23 Аскорбиновая кислота – витамин СO O OH OH HOCH 2 OH O O HOCH 2 OH — 2 H + 2 H аскорбиновая кислота дегидроаскорбиновая кислота (восстановленная форма) (окисленная форма) NHNH S O COOH биотин Витамин Н
23 Аскорбиновая кислота – витамин СO O OH OH HOCH 2 OH O O HOCH 2 OH — 2 H + 2 H аскорбиновая кислота дегидроаскорбиновая кислота (восстановленная форма) (окисленная форма) NHNH S O COOH биотин Витамин Н
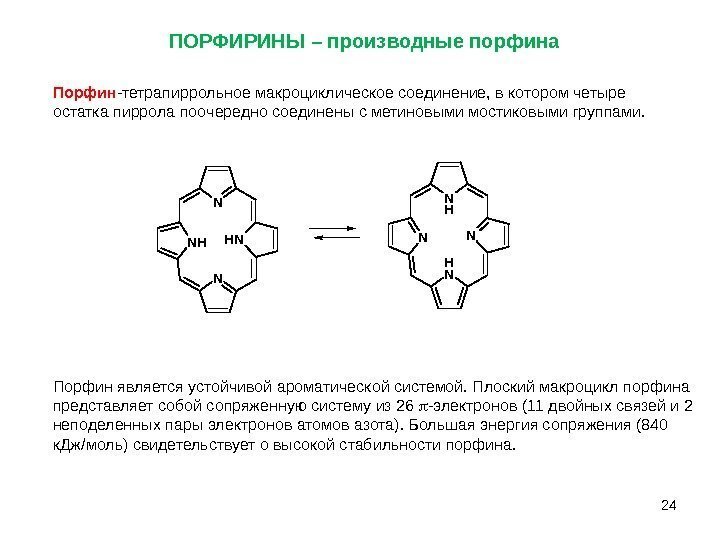
 24 Порфин -тетрапиррольное макроциклическое соединение, в котором четыре остатка пиррола поочередно соединены с метиновыми мостиковыми группами. ПОРФИРИНЫ – производные порфина N H N N NH N N H NH N Порфин является устойчивой ароматической системой. Плоский макроцикл порфина представляет собой сопряженную систему из 26 -электронов (11 двойных связей и 2 неподеленных пары электронов атомов азота). Большая энергия сопряжения (840 к. Дж/моль) свидетельствует о высокой стабильности порфина.
24 Порфин -тетрапиррольное макроциклическое соединение, в котором четыре остатка пиррола поочередно соединены с метиновыми мостиковыми группами. ПОРФИРИНЫ – производные порфина N H N N NH N N H NH N Порфин является устойчивой ароматической системой. Плоский макроцикл порфина представляет собой сопряженную систему из 26 -электронов (11 двойных связей и 2 неподеленных пары электронов атомов азота). Большая энергия сопряжения (840 к. Дж/моль) свидетельствует о высокой стабильности порфина.
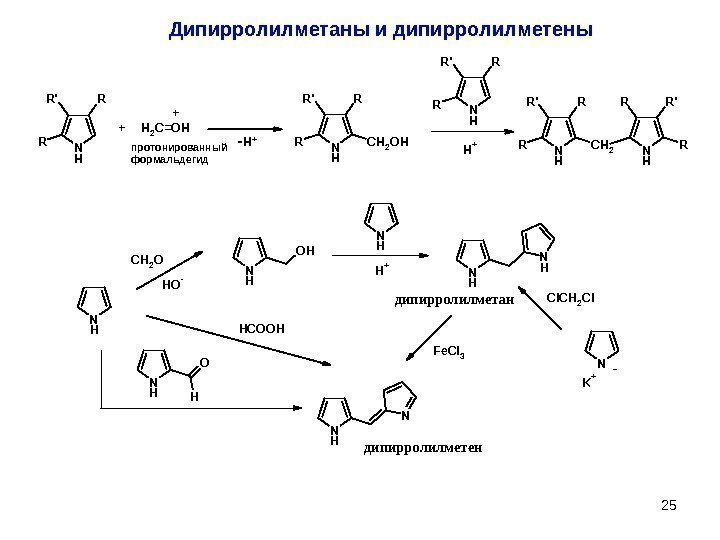
 25 N H CH 2 O HO-N H OH N H H+N H N HH O N HCOOH Fe. Cl 3 N K+ Cl. CH 2 Clдипирролилметан дипирролилметен — N H R R’R N H CH 2 OHR R’R H 2 C=OH N H R R’R H +N H CH 2 R R’R N H R R’R + +протонированный формальдегид -H +Дипирролилметаны и дипирролилметены
25 N H CH 2 O HO-N H OH N H H+N H N HH O N HCOOH Fe. Cl 3 N K+ Cl. CH 2 Clдипирролилметан дипирролилметен — N H R R’R N H CH 2 OHR R’R H 2 C=OH N H R R’R H +N H CH 2 R R’R N H R R’R + +протонированный формальдегид -H +Дипирролилметаны и дипирролилметены
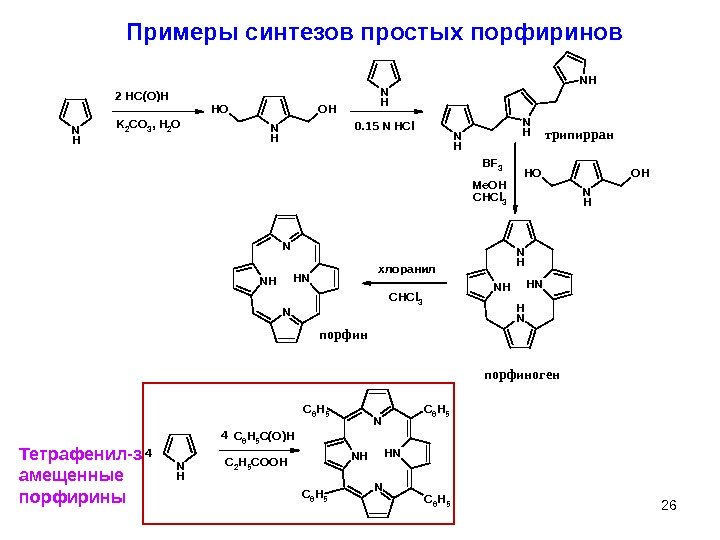
 26 Примеры синтезов простых порфиринов. NH K 2 CO 3, H 2 ONH OHOH NH NH NH OHOH BF 3 CHCl 3 NH NH CHCl 3 NH N N NH 2 HC(O)H 0. 15 N HClтрипирран Me. OH хлоранил порфиноген N H N N NH C 6 H 5 C 6 H 5 N H C 2 H 5 C O O HC 6 H 5 C ( O ) H 4 4 Тетрафенил-з амещенные порфирины
26 Примеры синтезов простых порфиринов. NH K 2 CO 3, H 2 ONH OHOH NH NH NH OHOH BF 3 CHCl 3 NH NH CHCl 3 NH N N NH 2 HC(O)H 0. 15 N HClтрипирран Me. OH хлоранил порфиноген N H N N NH C 6 H 5 C 6 H 5 N H C 2 H 5 C O O HC 6 H 5 C ( O ) H 4 4 Тетрафенил-з амещенные порфирины
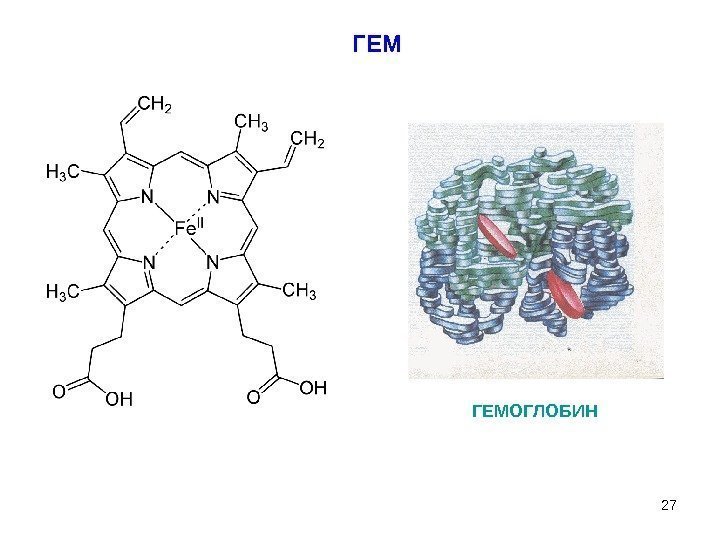
 27 ГЕМ ГЕМОГЛОБИН
27 ГЕМ ГЕМОГЛОБИН
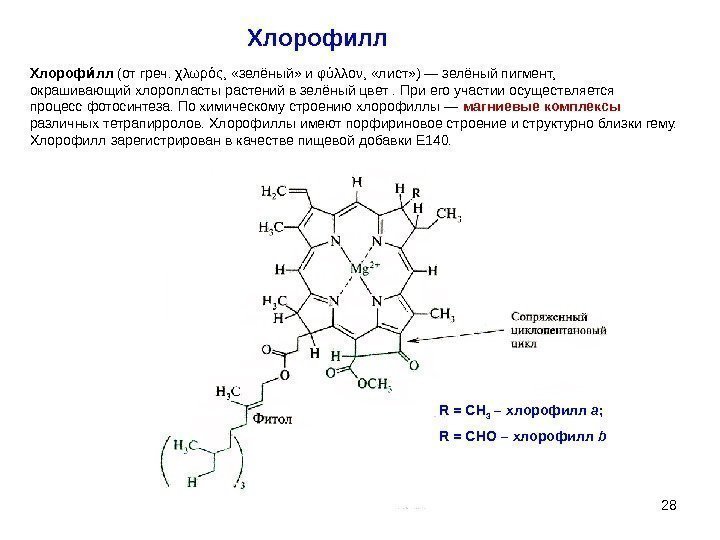
 2828 Хлорофилл R = CH 3 – хлорофилл a ; R = CHO – хлорофилл b Хлороф ллии (от греч. χλωρός, «зелёный» и φύλλον, «лист» ) — зелёный пигмент, окрашивающий хлоропласты растений в зелёный цвет. При его участии осуществляется процесс фотосинтеза. По химическому строению хлорофиллы — магниевые комплексы различных тетрапирролов. Хлорофиллы имеют порфириновое строение и структурно близки гему. Хлорофилл зарегистрирован в качестве пищевой добавки Е 140.
2828 Хлорофилл R = CH 3 – хлорофилл a ; R = CHO – хлорофилл b Хлороф ллии (от греч. χλωρός, «зелёный» и φύλλον, «лист» ) — зелёный пигмент, окрашивающий хлоропласты растений в зелёный цвет. При его участии осуществляется процесс фотосинтеза. По химическому строению хлорофиллы — магниевые комплексы различных тетрапирролов. Хлорофиллы имеют порфириновое строение и структурно близки гему. Хлорофилл зарегистрирован в качестве пищевой добавки Е 140.
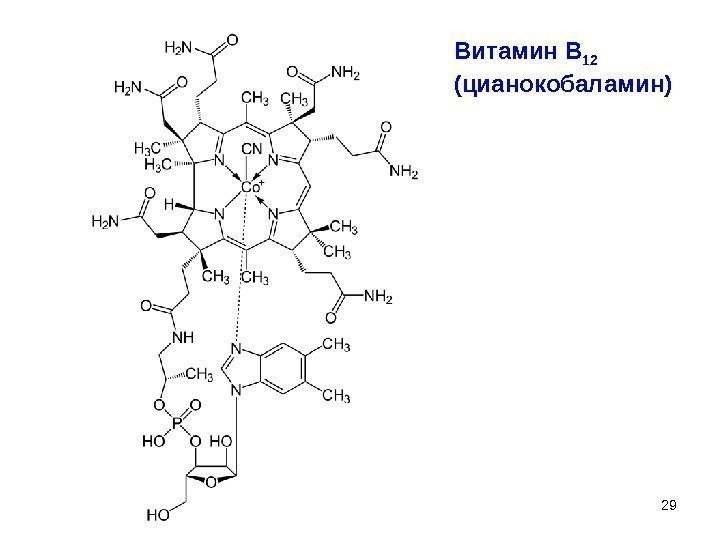
 29 Витамин В 12 (цианокобаламин)
29 Витамин В 12 (цианокобаламин)
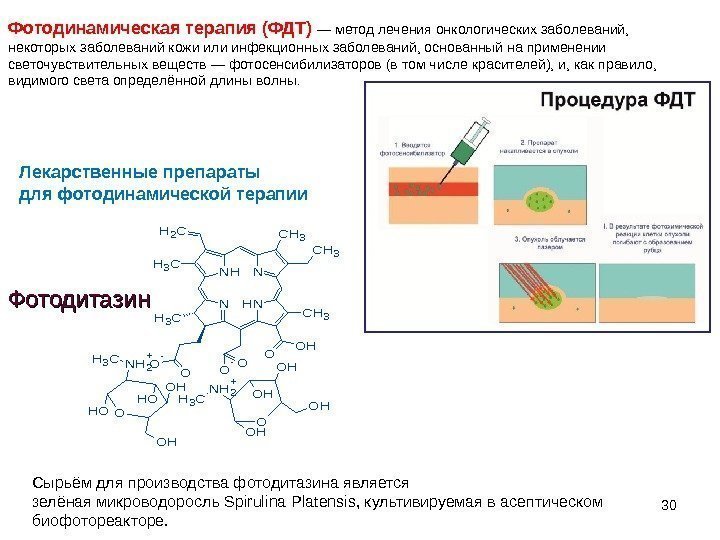
 30 Фотодинамическая терапия (ФДТ) — метод лечения онкологических заболеваний, некоторых заболеваний кожи или инфекционных заболеваний, основанный на применении светочувствительных веществ — фотосенсибилизаторов (в том числе красителей), и, как правило, видимого света определённой длины волны. Лекарственные препараты для фотодинамической терапии. CH 3 O NH 2 + OH OH NHN N OH OO O- CH 3 O- O CH 3 NH CH 2 CH 3 Фотодитазин Сырьём для производства фотодитазина является зелёная микроводоросль Spirulina Platensis, культивируемая в асептическом биофотореакторе.
30 Фотодинамическая терапия (ФДТ) — метод лечения онкологических заболеваний, некоторых заболеваний кожи или инфекционных заболеваний, основанный на применении светочувствительных веществ — фотосенсибилизаторов (в том числе красителей), и, как правило, видимого света определённой длины волны. Лекарственные препараты для фотодинамической терапии. CH 3 O NH 2 + OH OH NHN N OH OO O- CH 3 O- O CH 3 NH CH 2 CH 3 Фотодитазин Сырьём для производства фотодитазина является зелёная микроводоросль Spirulina Platensis, культивируемая в асептическом биофотореакторе.
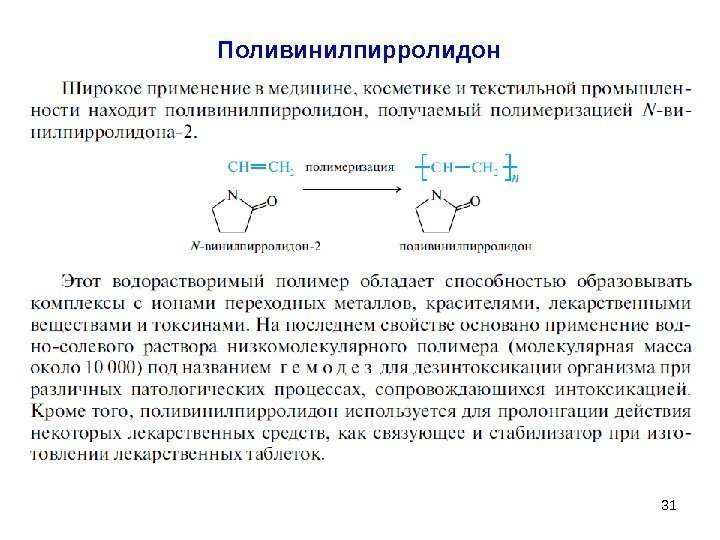
 31 Поливинилпирролидон
31 Поливинилпирролидон
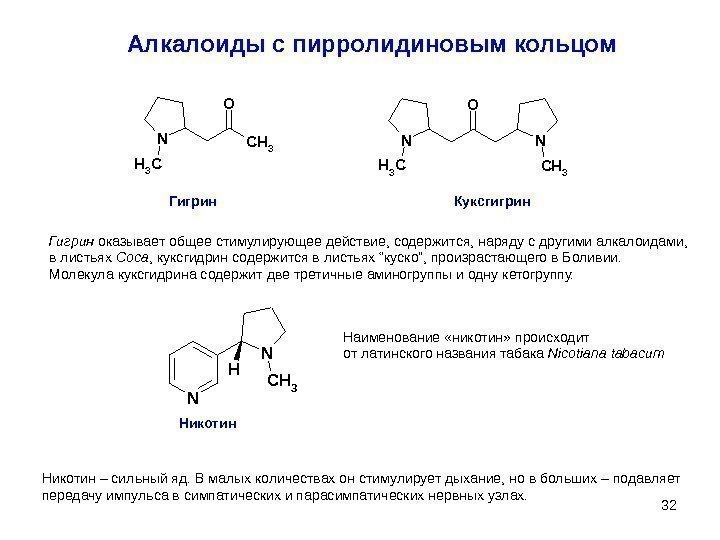
 32 Алкалоиды с пирролидиновым кольцом. CH 3 O N CH 3 Гигрин Куксгигрин Гигрин оказывает общее стимулирующее действие, содержится, наряду с другими алкалоидами, в листьях C оса , куксгидрин содержится в листьях “куско”, произрастающего в Боливии. Молекула куксгидрина содержит две третичные аминогруппы и одну кетогруппу. Никотин Наименование «никотин» происходит от латинского названия табака Nicotiana tabacum Никотин – сильный яд. В малых количествах он стимулирует дыхание, но в больших – подавляет передачу импульса в симпатических и парасимпатических нервных узлах. N N H CH
32 Алкалоиды с пирролидиновым кольцом. CH 3 O N CH 3 Гигрин Куксгигрин Гигрин оказывает общее стимулирующее действие, содержится, наряду с другими алкалоидами, в листьях C оса , куксгидрин содержится в листьях “куско”, произрастающего в Боливии. Молекула куксгидрина содержит две третичные аминогруппы и одну кетогруппу. Никотин Наименование «никотин» происходит от латинского названия табака Nicotiana tabacum Никотин – сильный яд. В малых количествах он стимулирует дыхание, но в больших – подавляет передачу импульса в симпатических и парасимпатических нервных узлах. N N H CH
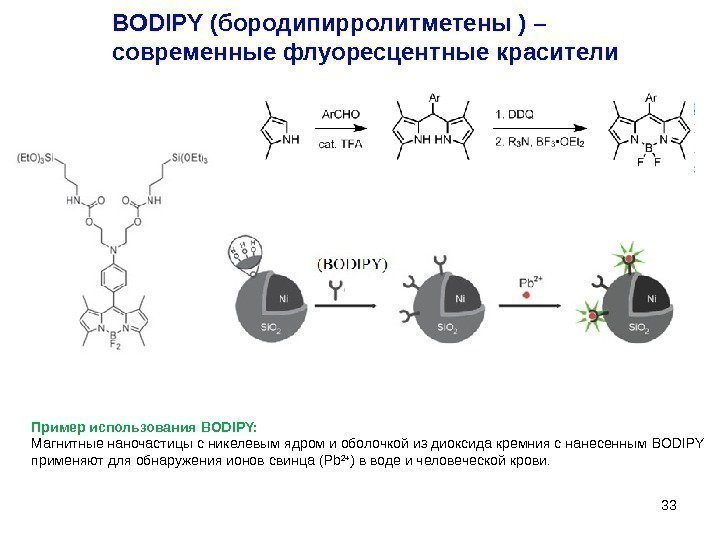
 33 BODIPY (бородипирролитметены ) – современные флуоресцентные красители Пример использования BODIPY: Магнитные наночастицы с никелевым ядром и оболочкой из диоксида кремния с нанесенным BODIPY применяют для обнаружения ионов свинца ( Pb 2 + ) в воде и человеческой крови.
33 BODIPY (бородипирролитметены ) – современные флуоресцентные красители Пример использования BODIPY: Магнитные наночастицы с никелевым ядром и оболочкой из диоксида кремния с нанесенным BODIPY применяют для обнаружения ионов свинца ( Pb 2 + ) в воде и человеческой крови.
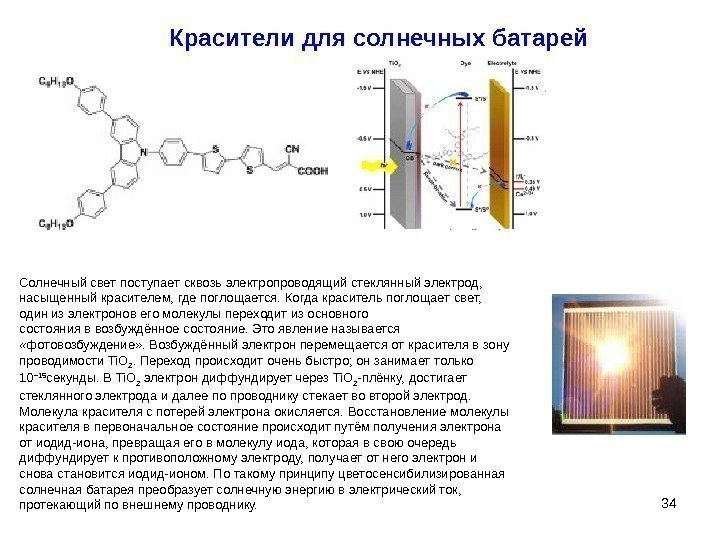
 34 Красители для солнечных батарей Солнечный свет поступает сквозь электропроводящий стеклянный электрод, насыщенный красителем, где поглощается. Когда краситель поглощает свет, один из электронов его молекулы переходит из основного состояния в возбуждённое состояние. Это явление называется «фотовозбуждение» . Возбуждённый электрон перемещается от красителя в зону проводимости Ti. O 2. Переход происходит очень быстро; он занимает только 10 − 15 секунды. В Ti. O 2 электрон диффундирует через Ti. O 2 -плёнку, достигает стеклянного электрода и далее по проводнику стекает во второй электрод. Молекула красителя с потерей электрона окисляется. Восстановление молекулы красителя в первоначальное состояние происходит путём получения электрона от иодид-иона, превращая его в молекулу иода, которая в свою очередь диффундирует к противоположному электроду, получает от него электрон и снова становится иодид-ионом. По такому принципу цветосенсибилизированная солнечная батарея преобразует солнечную энергию в электрический ток, протекающий по внешнему проводнику.
34 Красители для солнечных батарей Солнечный свет поступает сквозь электропроводящий стеклянный электрод, насыщенный красителем, где поглощается. Когда краситель поглощает свет, один из электронов его молекулы переходит из основного состояния в возбуждённое состояние. Это явление называется «фотовозбуждение» . Возбуждённый электрон перемещается от красителя в зону проводимости Ti. O 2. Переход происходит очень быстро; он занимает только 10 − 15 секунды. В Ti. O 2 электрон диффундирует через Ti. O 2 -плёнку, достигает стеклянного электрода и далее по проводнику стекает во второй электрод. Молекула красителя с потерей электрона окисляется. Восстановление молекулы красителя в первоначальное состояние происходит путём получения электрона от иодид-иона, превращая его в молекулу иода, которая в свою очередь диффундирует к противоположному электроду, получает от него электрон и снова становится иодид-ионом. По такому принципу цветосенсибилизированная солнечная батарея преобразует солнечную энергию в электрический ток, протекающий по внешнему проводнику.
 35 20 Курс лекций является частью учебно-методического комплекса «Химия гетероциклических соединений» автор: • Носова Эмилия Владимировна, д. х. н. , доцент кафедры органической химии УГТУ-УПИ – лектор Учебно-методический комплекс подготовлен на кафедре органической и биомолеклярной химии химико-технологического института Ур. ФУ Никакая часть презентации не может быть воспроизведена в какой бы то ни было форме без письменного разрешения авторов
35 20 Курс лекций является частью учебно-методического комплекса «Химия гетероциклических соединений» автор: • Носова Эмилия Владимировна, д. х. н. , доцент кафедры органической химии УГТУ-УПИ – лектор Учебно-методический комплекс подготовлен на кафедре органической и биомолеклярной химии химико-технологического института Ур. ФУ Никакая часть презентации не может быть воспроизведена в какой бы то ни было форме без письменного разрешения авторов
