Электролиз лк 15.ppt
- Количество слайдов: 14
 Лекция № 15 ЭЛЕКТРОЛИЗ
Лекция № 15 ЭЛЕКТРОЛИЗ
 Электролиз – окислительновосстановительные процессы, протекающие на электродах под действием электрического тока, подаваемого от внешнего источника.
Электролиз – окислительновосстановительные процессы, протекающие на электродах под действием электрического тока, подаваемого от внешнего источника.
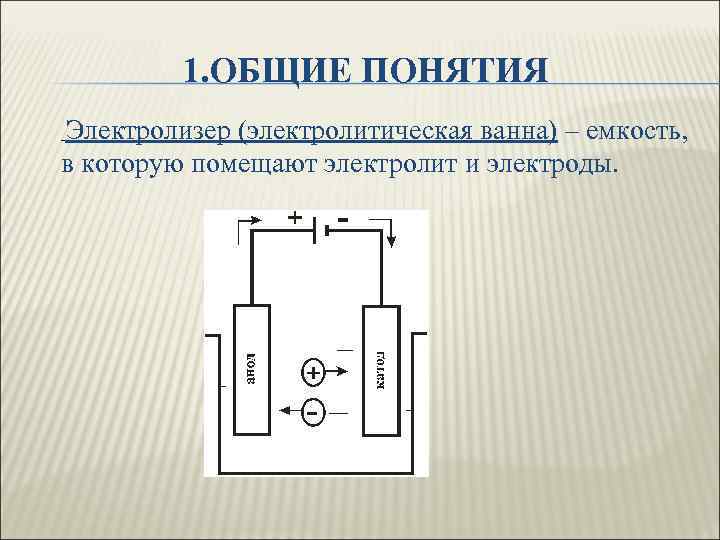 1. ОБЩИЕ ПОНЯТИЯ Электролизер (электролитическая ванна) – емкость, в которую помещают электролит и электроды.
1. ОБЩИЕ ПОНЯТИЯ Электролизер (электролитическая ванна) – емкость, в которую помещают электролит и электроды.
 Катод – электрод, на котором идет реакция восстановления (всегда). В случае гальванического элемента ионы Cu 2+ подходили к катоду, восстанавливались, отбирая электроны у самого катода, поэтому катод в гальваническом элементе заряжен положительно. В случае электролиза, электроны, необходимые для реакции восстановления, в большом избытке подаются от внешнего источника тока, поэтому при электролизе катод заряжен отрицательно, его подключают к “минусу” источника тока.
Катод – электрод, на котором идет реакция восстановления (всегда). В случае гальванического элемента ионы Cu 2+ подходили к катоду, восстанавливались, отбирая электроны у самого катода, поэтому катод в гальваническом элементе заряжен положительно. В случае электролиза, электроны, необходимые для реакции восстановления, в большом избытке подаются от внешнего источника тока, поэтому при электролизе катод заряжен отрицательно, его подключают к “минусу” источника тока.
 Анод – электрод, на котором идет реакция окисления (всегда). При электролизе анод подключают к “плюсу” источника тока. Источник тока как гигантский насос перекачивает электроны с анода на катод. Электроды бывают растворимые и нерастворимые. Нерастворимые электроды – это инертные электроды, которые собственных ионов в раствор не посылают и служат только проводниками электрического тока - например, графитовый, Au, Pt. Растворимые электроды (аноды) при электролизе окисляются, т. е. растворяются, поддерживая концентрацию ионов металла в растворе постоянной.
Анод – электрод, на котором идет реакция окисления (всегда). При электролизе анод подключают к “плюсу” источника тока. Источник тока как гигантский насос перекачивает электроны с анода на катод. Электроды бывают растворимые и нерастворимые. Нерастворимые электроды – это инертные электроды, которые собственных ионов в раствор не посылают и служат только проводниками электрического тока - например, графитовый, Au, Pt. Растворимые электроды (аноды) при электролизе окисляются, т. е. растворяются, поддерживая концентрацию ионов металла в растворе постоянной.
 Например, при электролизе Cu. SO 4 Анод: Cu – 2 = Cu 2+ Катод: Cu 2+ + 2 = Cu
Например, при электролизе Cu. SO 4 Анод: Cu – 2 = Cu 2+ Катод: Cu 2+ + 2 = Cu
 2. ЗАКОНЫ ФАРАДЕЯ I закон При электролизе масса вещества, выделяющегося на электроде, прямо пропорциональна количеству прошедшего электричества. m = k·Q = k·I·τ где m – масса вещества, г; Q – количество электричества, Кл; I – сила тока, А; τ - время, с; k – электрохимический эквивалент вещества (это масса вещества, которая выделяется при прохождении 1 Кл электричества), г/Кл.
2. ЗАКОНЫ ФАРАДЕЯ I закон При электролизе масса вещества, выделяющегося на электроде, прямо пропорциональна количеству прошедшего электричества. m = k·Q = k·I·τ где m – масса вещества, г; Q – количество электричества, Кл; I – сила тока, А; τ - время, с; k – электрохимический эквивалент вещества (это масса вещества, которая выделяется при прохождении 1 Кл электричества), г/Кл.
 II закон Для выделения 1 моля эквивалентов любого вещества необходимо затратить одно и то же количество электричества, а именно 96500 Кл – число Фарадея. где М (Э) – молярная масса эквивалента вещества. где n – число электронов , участвующих в электродной реакции.
II закон Для выделения 1 моля эквивалентов любого вещества необходимо затратить одно и то же количество электричества, а именно 96500 Кл – число Фарадея. где М (Э) – молярная масса эквивалента вещества. где n – число электронов , участвующих в электродной реакции.
 Например, Cu 2+ + 2 = Cu Объединенный закон Законы Фарадея являются точными, но масса вещества, выделившегося на электроде, может оказаться меньше расчетной.
Например, Cu 2+ + 2 = Cu Объединенный закон Законы Фарадея являются точными, но масса вещества, выделившегося на электроде, может оказаться меньше расчетной.
 Это связано с протеканием на электроде не одной главной реакции, но и побочных и вторичных реакций, на которые расходуется часть прошедшего электричества. Потери электричества оцениваются величиной выхода по току (ВТ). Чаще всего ВТ < 100%.
Это связано с протеканием на электроде не одной главной реакции, но и побочных и вторичных реакций, на которые расходуется часть прошедшего электричества. Потери электричества оцениваются величиной выхода по току (ВТ). Чаще всего ВТ < 100%.
 3. ПОСЛЕДОВАТЕЛЬНОСТЬ ЭЛЕКТРОДНЫХ РЕАКЦИЙ В общем случае к катоду или аноду при электролизе подходит не один вид, а несколько различных видов ионов. Для определения последовательности электродных реакций необходимо сравнить их электродные потенциалы в данных условиях. На катоде в первую очередь будет протекать реакция с более положительным потенциалом. На аноде будет протекать реакция с более отрицательным потенциалом.
3. ПОСЛЕДОВАТЕЛЬНОСТЬ ЭЛЕКТРОДНЫХ РЕАКЦИЙ В общем случае к катоду или аноду при электролизе подходит не один вид, а несколько различных видов ионов. Для определения последовательности электродных реакций необходимо сравнить их электродные потенциалы в данных условиях. На катоде в первую очередь будет протекать реакция с более положительным потенциалом. На аноде будет протекать реакция с более отрицательным потенциалом.
 Например, электролиз водного раствора Cu. Cl 2 на медных электродах. Cu. Cl 2 диссоциирует: Cu. Cl 2 Cu 2+ + 2 Cl¯ Следовательно, к катоду подойдут ионы Cu 2+, а к аноду ионы Cl¯. Кроме того, сама вода может восстанавливаться на катоде и окисляться на аноде. Кроме того, окисляться может сам анод – Cu.
Например, электролиз водного раствора Cu. Cl 2 на медных электродах. Cu. Cl 2 диссоциирует: Cu. Cl 2 Cu 2+ + 2 Cl¯ Следовательно, к катоду подойдут ионы Cu 2+, а к аноду ионы Cl¯. Кроме того, сама вода может восстанавливаться на катоде и окисляться на аноде. Кроме того, окисляться может сам анод – Cu.
 Таким образом, на катоде всегда возможно два варианта – восстановление катионов металла и восстановление молекул H 2 O: (1) Cu 2+ + 2 = Cu (2) Если идет преимущественно вторая реакция, то в прикатодном пространстве происходит образование и накопление ионов ОН -, т. е. произойдет подщелачивание раствора, которое можно обнаружить с помощью соответствующего индикатора.
Таким образом, на катоде всегда возможно два варианта – восстановление катионов металла и восстановление молекул H 2 O: (1) Cu 2+ + 2 = Cu (2) Если идет преимущественно вторая реакция, то в прикатодном пространстве происходит образование и накопление ионов ОН -, т. е. произойдет подщелачивание раствора, которое можно обнаружить с помощью соответствующего индикатора.
 На аноде возможны 3 варианта: окисление аниона соли, окисление молекул Н 2 О и окисление анода: (1) 2 Cl - - 2 = Cl 2 (2) (3) Cu - 2 = Cu 2+ Если идет преимущественно вторая реакция, то в прианодном пространстве происходит образование и накопление ионов Н +, т. е. произойдет подкисление раствора, которое можно обнаружить с помощью соответствующего индикатора.
На аноде возможны 3 варианта: окисление аниона соли, окисление молекул Н 2 О и окисление анода: (1) 2 Cl - - 2 = Cl 2 (2) (3) Cu - 2 = Cu 2+ Если идет преимущественно вторая реакция, то в прианодном пространстве происходит образование и накопление ионов Н +, т. е. произойдет подкисление раствора, которое можно обнаружить с помощью соответствующего индикатора.
