L_11-12Kin.ppt
- Количество слайдов: 72
 Лекция № 14 Скорость химических реакций
Лекция № 14 Скорость химических реакций
 Одним из основных параметров химических процессов в промышленности является скорость, с которой протекает данный процесс. Например, способ переработки химического сырья может быть простым и доступным, но время, необходимое для получения конечного продукта оказывается весьма значительным. Поэтому процесс может оказаться нерентабельным для промышленности. Для оценки рентабельности процесса необходимо знать: маршрут реакции (целевые продукты) условия, скорость, количество стадий (механизм).
Одним из основных параметров химических процессов в промышленности является скорость, с которой протекает данный процесс. Например, способ переработки химического сырья может быть простым и доступным, но время, необходимое для получения конечного продукта оказывается весьма значительным. Поэтому процесс может оказаться нерентабельным для промышленности. Для оценки рентабельности процесса необходимо знать: маршрут реакции (целевые продукты) условия, скорость, количество стадий (механизм).
 Оценка рентабельности процесса • маршрут реакции (целевые продукты) • условия, скорость, • механизм (количество стадий)
Оценка рентабельности процесса • маршрут реакции (целевые продукты) • условия, скорость, • механизм (количество стадий)
 Химическая кинетика – раздел химии, изучающий скорость и механизм химических реакций. Скорость химической реакции – изменение количества вещества в единицу времени в единице реакционного пространства.
Химическая кинетика – раздел химии, изучающий скорость и механизм химических реакций. Скорость химической реакции – изменение количества вещества в единицу времени в единице реакционного пространства.
 Некоторые понятия. Система – объект нашего изучения. Вещество или совокупность веществ в реакционном пространстве. Фаза – часть системы, которая отделена от других частей поверхностью раздела.
Некоторые понятия. Система – объект нашего изучения. Вещество или совокупность веществ в реакционном пространстве. Фаза – часть системы, которая отделена от других частей поверхностью раздела.
 Гомогенные гетерогенные системы. Гомогенные системы (однородные), системы состоящие из одной фазы (газовые смеси, растворы) Гетерогенные системы (неоднородные)– системы, состоящие из двух и более фаз (т-т, т-ж, т-г)
Гомогенные гетерогенные системы. Гомогенные системы (однородные), системы состоящие из одной фазы (газовые смеси, растворы) Гетерогенные системы (неоднородные)– системы, состоящие из двух и более фаз (т-т, т-ж, т-г)
 Гомогенные гетерогенные реакции Гомогенные реакции, протекающие в гомогенных системах. Гомогенные реакции протекают во всем объеме реакционной смеси
Гомогенные гетерогенные реакции Гомогенные реакции, протекающие в гомогенных системах. Гомогенные реакции протекают во всем объеме реакционной смеси
 Гетерогенные реакции, реакции протекающие в гетерогенных системах • Гетерогенные реакции протекают на поверхности раздела фаз
Гетерогенные реакции, реакции протекающие в гетерогенных системах • Гетерогенные реакции протекают на поверхности раздела фаз
 Скорость гомогенной реакции. Скоростью гомогенной реакции называется изменение количества вещества, вступающего в реакцию или образующегося в результате реакции за единицу времени в единице объема системы.
Скорость гомогенной реакции. Скоростью гомогенной реакции называется изменение количества вещества, вступающего в реакцию или образующегося в результате реакции за единицу времени в единице объема системы.
 Формула Обозначение vгом=( 2 - 1)/V (t 2 -t 1)
Формула Обозначение vгом=( 2 - 1)/V (t 2 -t 1)
 продолжение • vгом=± / (V t) • 2 и 1 – число молей реагирующих веществ в момент времени t 2 и t 1 соответственно
продолжение • vгом=± / (V t) • 2 и 1 – число молей реагирующих веществ в момент времени t 2 и t 1 соответственно
 Молярная концентрация • / V=См • См-молярная концентрация- количество вещества в 1 литре гомогенной системы (раствор или газовая система).
Молярная концентрация • / V=См • См-молярная концентрация- количество вещества в 1 литре гомогенной системы (раствор или газовая система).
 Формула через См, размерность vгом =± C/ t C-изменение молярной концентрации «-» относится к C реагентов «+» относится к C продуктов реакции Размерность [моль/л сек]
Формула через См, размерность vгом =± C/ t C-изменение молярной концентрации «-» относится к C реагентов «+» относится к C продуктов реакции Размерность [моль/л сек]
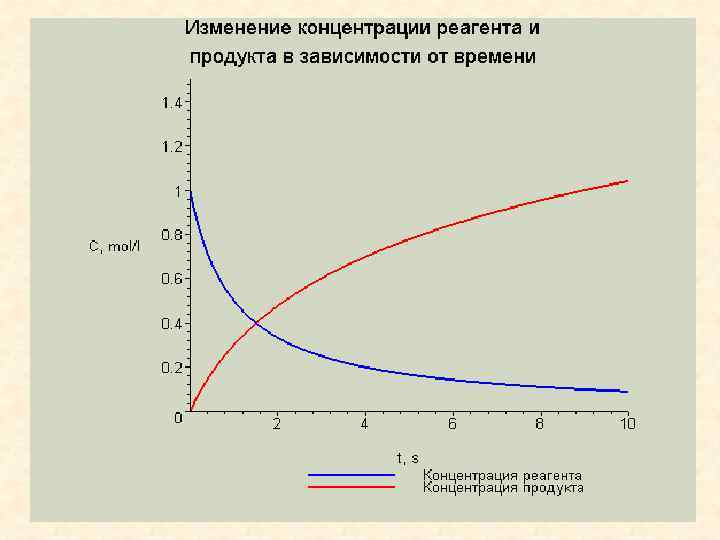 График
График
 Скорость гетерогенной реакции Поверхность раздела служит реакционным пространством. Поэтому следует учитывать влияние площади реакционной поверхности на скорость реакции.
Скорость гетерогенной реакции Поверхность раздела служит реакционным пространством. Поэтому следует учитывать влияние площади реакционной поверхности на скорость реакции.
 Скоростью гетерогенной реакции называется изменение количества вещества, которое вступает в реакцию или образуется в результате реакции за единицу времени на единице поверхности раздела фаз S
Скоростью гетерогенной реакции называется изменение количества вещества, которое вступает в реакцию или образуется в результате реакции за единицу времени на единице поверхности раздела фаз S
 Формула Обозначение vгет=± /S t
Формула Обозначение vгет=± /S t
 Факторы влияющие на скорость реакции 1. Природа веществ; реагирующих 2. Условия - концентрация, температура, давление (для газов), облучение квантами света и т. д.
Факторы влияющие на скорость реакции 1. Природа веществ; реагирующих 2. Условия - концентрация, температура, давление (для газов), облучение квантами света и т. д.
 продолжение 3. Присутствие катализатора 4. Для гетерогенных реакций –площадь контакта (степень измельчения)
продолжение 3. Присутствие катализатора 4. Для гетерогенных реакций –площадь контакта (степень измельчения)
 Влияние природы реагирующих веществ В зависимости от природы реагирующих веществ реакции протекают в доли секунды (разложение взрывчатых веществ), другие протекают веками (окисление бронзы на воздухе, образование минералов и горючих ископаемых).
Влияние природы реагирующих веществ В зависимости от природы реагирующих веществ реакции протекают в доли секунды (разложение взрывчатых веществ), другие протекают веками (окисление бронзы на воздухе, образование минералов и горючих ископаемых).
 Примеры реакций H 2+F 2 2 HF реакция протекает со взрывом H 2+Br 2 2 HBr реакция протекает медленно даже при нагревании.
Примеры реакций H 2+F 2 2 HF реакция протекает со взрывом H 2+Br 2 2 HBr реакция протекает медленно даже при нагревании.
 Зависимость скорости от концентрации. Для протекания химической реакции необходимо столкновение реагирующих частиц. При постоянной температуре число столкновений зависит от количества частиц в единице реакционного пространства, т. е. от концентрации.
Зависимость скорости от концентрации. Для протекания химической реакции необходимо столкновение реагирующих частиц. При постоянной температуре число столкновений зависит от количества частиц в единице реакционного пространства, т. е. от концентрации.
 Закон действующих масс. 1864 -1867 гг. норвежские химики К. Гульдберг и П. Вааге установили химический закон действия масс «Скорость химической реакции при данной температуре пропорциональна произведению концентраций реагирующих веществ»
Закон действующих масс. 1864 -1867 гг. норвежские химики К. Гульдберг и П. Вааге установили химический закон действия масс «Скорость химической реакции при данной температуре пропорциональна произведению концентраций реагирующих веществ»
 Уравнение реакции Для простейших одностадийных реакций концентрации реагирующих веществ берутся в степенях равных стехиометрическим коэффициентам m. A+n. B С.
Уравнение реакции Для простейших одностадийных реакций концентрации реагирующих веществ берутся в степенях равных стехиометрическим коэффициентам m. A+n. B С.
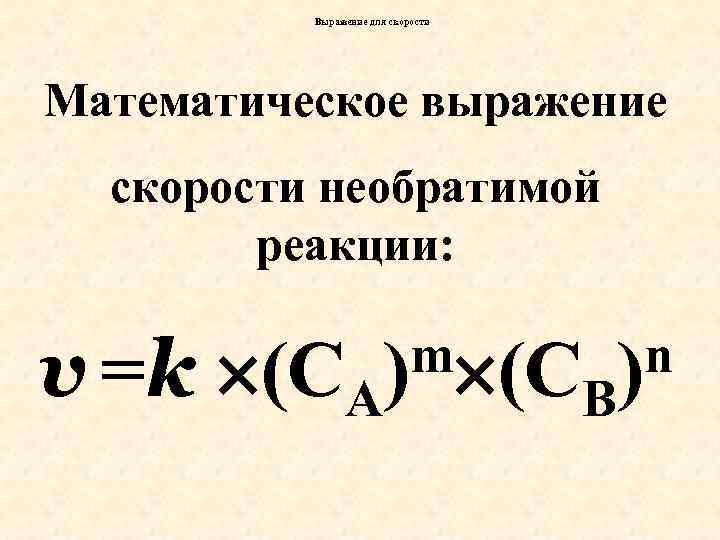 Выражение для скорости Математическое выражение скорости необратимой реакции: v =k (CA m (C ) B n )
Выражение для скорости Математическое выражение скорости необратимой реакции: v =k (CA m (C ) B n )
 продолжение • CA , CB – молярные концентрации реагентов ( в уравнение входят только концентрации жидких и газообразных веществ). • m и n – коэффициенты в уравнении элементарной химической реакции
продолжение • CA , CB – молярные концентрации реагентов ( в уравнение входят только концентрации жидких и газообразных веществ). • m и n – коэффициенты в уравнении элементарной химической реакции
 Физический смысл константы скорости CA =CB=1 моль/л v =k При концентрации реагентов равных единице v=k
Физический смысл константы скорости CA =CB=1 моль/л v =k При концентрации реагентов равных единице v=k
 продолжение k – константа скорости (коэффициент пропорциональности в уравнении) Константа скорости зависит от температуры природы реагентов (продуктов), но не зависит от их концентраций. k – различных реакций (при t=const) позволяет сравнить способность реагентов к взаимодействию при данной температуре
продолжение k – константа скорости (коэффициент пропорциональности в уравнении) Константа скорости зависит от температуры природы реагентов (продуктов), но не зависит от их концентраций. k – различных реакций (при t=const) позволяет сравнить способность реагентов к взаимодействию при данной температуре
 Пример Запишите математическое выражение скорости следующих элементарных химических реакций Са. О(кр. )+СО 2(г)=Са. СО 3(кр. ) v=k C(СО 2) H 2(г)+I 2(г)=2 HI(г) v=k C(Н 2) C(I 2)
Пример Запишите математическое выражение скорости следующих элементарных химических реакций Са. О(кр. )+СО 2(г)=Са. СО 3(кр. ) v=k C(СО 2) H 2(г)+I 2(г)=2 HI(г) v=k C(Н 2) C(I 2)
 Зависимость скорости химической реакции от температуры Правило Вант-Гоффа – при увеличении температуры на каждые 100 С скорость химической реакции увеличивается в 2 -4 раза.
Зависимость скорости химической реакции от температуры Правило Вант-Гоффа – при увеличении температуры на каждые 100 С скорость химической реакции увеличивается в 2 -4 раза.
 Математическая запись t/10 v 2/v 1= v 2 и v 1 - скорости реакций при температурах t 2 и t 1. t= t 2 t 1 -температурный коэффициент
Математическая запись t/10 v 2/v 1= v 2 и v 1 - скорости реакций при температурах t 2 и t 1. t= t 2 t 1 -температурный коэффициент
 Активные молекулы Увеличение скорости реакции с повышением температуры объясняется увеличением числа активных молекул. Это молекулы обладающие достаточной энергией для осуществления химического взаимодействия.
Активные молекулы Увеличение скорости реакции с повышением температуры объясняется увеличением числа активных молекул. Это молекулы обладающие достаточной энергией для осуществления химического взаимодействия.
 Продолжение В ходе химической реакции происходит изменение химических связей и перераспределение электронной плотности. Для полного разрушения исходных химических связей необходимы большие затраты энергии и скорость реакции была бы небольшой.
Продолжение В ходе химической реакции происходит изменение химических связей и перераспределение электронной плотности. Для полного разрушения исходных химических связей необходимы большие затраты энергии и скорость реакции была бы небольшой.
 Активированный комплекс Как показали исследования в ходе реакции система проходит через переходное состояние АК.
Активированный комплекс Как показали исследования в ходе реакции система проходит через переходное состояние АК.
![Схема образования активированного комплекса схема А 2+В 2 [А 2 В 2] 2 АВ Схема образования активированного комплекса схема А 2+В 2 [А 2 В 2] 2 АВ](https://present5.com/presentation/90992014_142242842/image-35.jpg) Схема образования активированного комплекса схема А 2+В 2 [А 2 В 2] 2 АВ А А А В В А А + + В Реагенты А В Активированный комплекс В В Продукты
Схема образования активированного комплекса схема А 2+В 2 [А 2 В 2] 2 АВ А А А В В А А + + В Реагенты А В Активированный комплекс В В Продукты
 Энергия активации (Еа) – энергия необходимая для перехода вещества в состояние активированного комплекса. Молекула энергия которой достаточна для образования АК называется активной молекулой
Энергия активации (Еа) – энергия необходимая для перехода вещества в состояние активированного комплекса. Молекула энергия которой достаточна для образования АК называется активной молекулой
 Снижение энергии активации Уменьшить энергию активации можно повысив температуру. Однако иногда требуются слишком высокие температуры. Каким образом можно снизить Еа и увеличить скорость реакции. Этого позволяют добиться каталитические процессы. В результате введения катализатора образуются промежуточные соединения с меньшим энергетическим барьером. Перейти в картинку !!!!
Снижение энергии активации Уменьшить энергию активации можно повысив температуру. Однако иногда требуются слишком высокие температуры. Каким образом можно снизить Еа и увеличить скорость реакции. Этого позволяют добиться каталитические процессы. В результате введения катализатора образуются промежуточные соединения с меньшим энергетическим барьером. Перейти в картинку !!!!
 Катализаторы – вещества, ускоряющие химические реакции, но не испытывающие химические превращения.
Катализаторы – вещества, ускоряющие химические реакции, но не испытывающие химические превращения.
 продолжение • Катализатор не изменяет свой химический состав в ходе реакции. • Катализ – изменение скорости реакции под воздействием катализаторов.
продолжение • Катализатор не изменяет свой химический состав в ходе реакции. • Катализ – изменение скорости реакции под воздействием катализаторов.
 Гомогенный катализ й Гомогенный катализ В основе теория промежуточных соединений (П. Сабатье и Н. Д. Зелинский) Катализатор и реагирующие вещества находятся в одной фазе.
Гомогенный катализ й Гомогенный катализ В основе теория промежуточных соединений (П. Сабатье и Н. Д. Зелинский) Катализатор и реагирующие вещества находятся в одной фазе.
![продолжение • А+В AB (без катализатора) • А+К АК • АК+В [АКВ] • [АКВ] продолжение • А+В AB (без катализатора) • А+К АК • АК+В [АКВ] • [АКВ]](https://present5.com/presentation/90992014_142242842/image-41.jpg) продолжение • А+В AB (без катализатора) • А+К АК • АК+В [АКВ] • [АКВ] АВ+К
продолжение • А+В AB (без катализатора) • А+К АК • АК+В [АКВ] • [АКВ] АВ+К
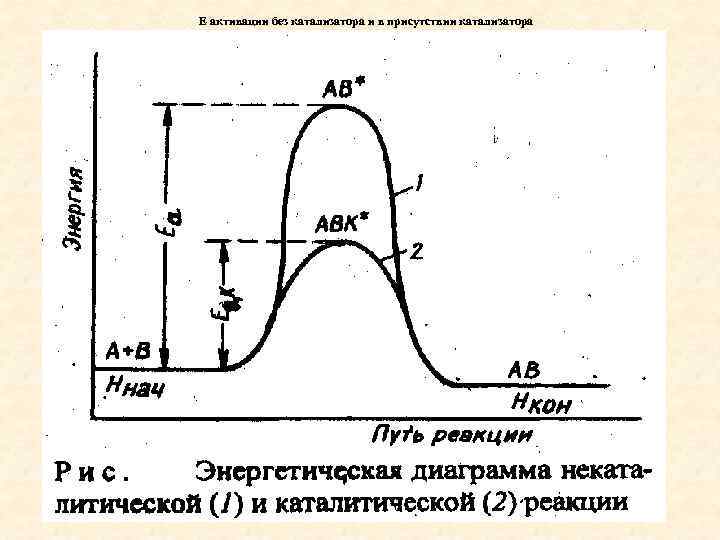 Е активации без катализатора и в присутствии катализатора
Е активации без катализатора и в присутствии катализатора
 Гетерогенный катализ Реагенты и катализатор в разных фазах. Гетерогенный катализ распространен больше, т. к. катализатор легко отделить от продуктов реакции.
Гетерогенный катализ Реагенты и катализатор в разных фазах. Гетерогенный катализ распространен больше, т. к. катализатор легко отделить от продуктов реакции.
 продолжение • В качестве таких катализаторов широко используются индивидуальные оксиды и их смеси, катализаторы на носителях. • Механизм гетерогенного катализа сложен и в данном курсе не рассматривается.
продолжение • В качестве таких катализаторов широко используются индивидуальные оксиды и их смеси, катализаторы на носителях. • Механизм гетерогенного катализа сложен и в данном курсе не рассматривается.
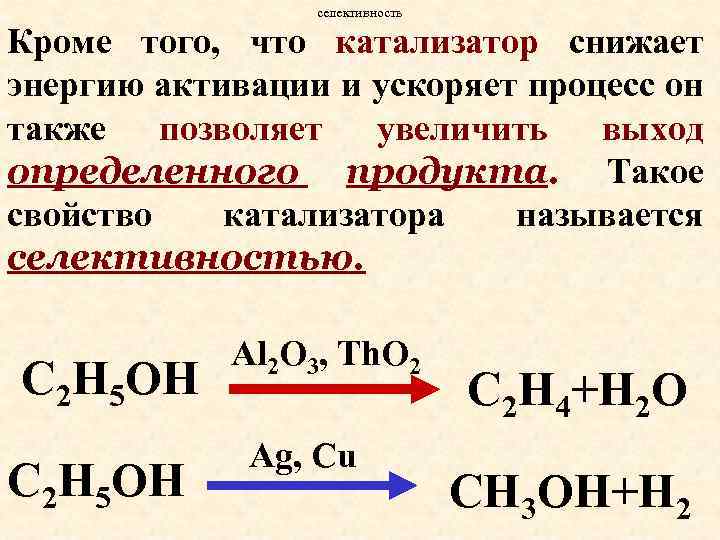 селективность Кроме того, что катализатор снижает энергию активации и ускоряет процесс он также позволяет увеличить выход определенного продукта. Такое свойство катализатора называется селективностью. С 2 Н 5 ОН Al 2 O 3, Th. O 2 Ag, Cu С 2 Н 4+H 2 O СН 3 OH+H 2
селективность Кроме того, что катализатор снижает энергию активации и ускоряет процесс он также позволяет увеличить выход определенного продукта. Такое свойство катализатора называется селективностью. С 2 Н 5 ОН Al 2 O 3, Th. O 2 Ag, Cu С 2 Н 4+H 2 O СН 3 OH+H 2
 Доля каталитических процессов в нефтехимической , фармацевтической и пищевой промышленности составляет около 90%.
Доля каталитических процессов в нефтехимической , фармацевтической и пищевой промышленности составляет около 90%.
 Каталитические промышленные процессы неорганической химии Получение водорода, аммиака, серной, азотной кислот
Каталитические промышленные процессы неорганической химии Получение водорода, аммиака, серной, азотной кислот
 Каталитические процессы переработки углеводородного сырья Производство • бензинов • моторных топлив • многих ценных продуктов нефтехимии и органического синтеза (этилен, спирты, фенолы, синтетические волокна и смолы, красители и др. )
Каталитические процессы переработки углеводородного сырья Производство • бензинов • моторных топлив • многих ценных продуктов нефтехимии и органического синтеза (этилен, спирты, фенолы, синтетические волокна и смолы, красители и др. )
 Химическое равновесие Необратимые и обратимые реакции (см. лекцию № 13). Реакция необратимая при одних условиях может стать обратимой при других. В результате в реакционном пространстве присутствуют как исходные вещества так и продукты реакции.
Химическое равновесие Необратимые и обратимые реакции (см. лекцию № 13). Реакция необратимая при одних условиях может стать обратимой при других. В результате в реакционном пространстве присутствуют как исходные вещества так и продукты реакции.
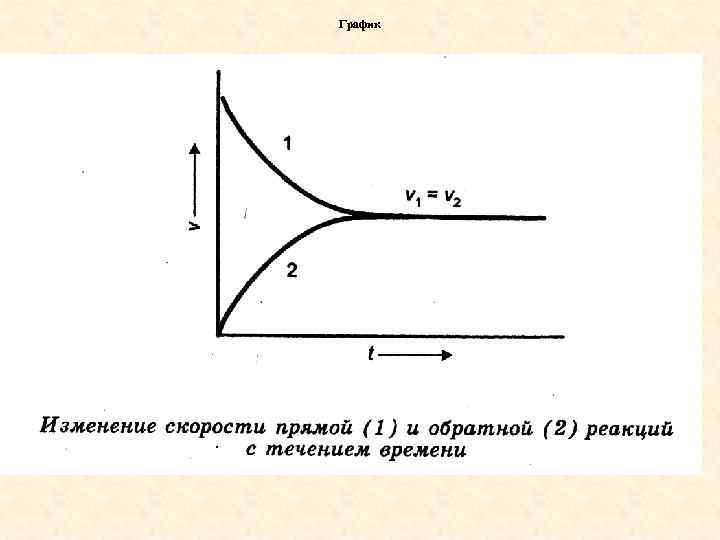
 С течением времени скорость прямой реакции уменьшается а обратной увеличивается. = Наступает момент когда v v
С течением времени скорость прямой реакции уменьшается а обратной увеличивается. = Наступает момент когда v v
 График
График
 Оределение равнов Химическим равновесием называется состояние обратимой реакции, при котором скорость прямой реакции равна скорости обратной реакции.
Оределение равнов Химическим равновесием называется состояние обратимой реакции, при котором скорость прямой реакции равна скорости обратной реакции.
 продолжение Химическое равновесие является динамическим равновесием. В равновесном состоянии продолжают протекать и прямая и обратная реакция, но т. к. скорости их равны, концентрации всех веществ в системе не изменяются.
продолжение Химическое равновесие является динамическим равновесием. В равновесном состоянии продолжают протекать и прямая и обратная реакция, но т. к. скорости их равны, концентрации всех веществ в системе не изменяются.
 Равновесные концентрации Концентрации веществ в состоянии равновесия называются равновесными. а. А + b. В с. С + d. D
Равновесные концентрации Концентрации веществ в состоянии равновесия называются равновесными. а. А + b. В с. С + d. D
![продолжение a [B]b [A] • vпр= k 1 ; c [D]d • vобр. = продолжение a [B]b [A] • vпр= k 1 ; c [D]d • vобр. =](https://present5.com/presentation/90992014_142242842/image-55.jpg) продолжение a [B]b [A] • vпр= k 1 ; c [D]d • vобр. = k 2 [C] • [A]; [B] ; [C]; [D] – равновесные концентрации
продолжение a [B]b [A] • vпр= k 1 ; c [D]d • vобр. = k 2 [C] • [A]; [B] ; [C]; [D] – равновесные концентрации
 Константа равновесия Состояние равновесия характеризуется константой равновесия – К.
Константа равновесия Состояние равновесия характеризуется константой равновесия – К.
 продолжение Константа равновесия равна отношению константы скорости прямой реакции к константе скорости обратной реакции
продолжение Константа равновесия равна отношению константы скорости прямой реакции к константе скорости обратной реакции
![формула K=k 1/ k 2=const K= c [D]d /[A]a [B]b [C] формула K=k 1/ k 2=const K= c [D]d /[A]a [B]b [C]](https://present5.com/presentation/90992014_142242842/image-58.jpg) формула K=k 1/ k 2=const K= c [D]d /[A]a [B]b [C]
формула K=k 1/ k 2=const K= c [D]d /[A]a [B]b [C]
 продолжение • Концентрации твердых веществ не входят в выражение константы равновесия. • Са. СО 3(к) Са. О(к)+СО 2(г) • K=[СО 2]
продолжение • Концентрации твердых веществ не входят в выражение константы равновесия. • Са. СО 3(к) Са. О(к)+СО 2(г) • K=[СО 2]
 От чего зависит К Константа равновесия данной реакции зависит от температуры, давления. Не влияют на величину К изменение концентраций реагирующих веществ, присутствие катализатора.
От чего зависит К Константа равновесия данной реакции зависит от температуры, давления. Не влияют на величину К изменение концентраций реагирующих веществ, присутствие катализатора.
 продолжение • Катализатор одинаково ускоряет прямую и обратную реакцию, но не смещает равновесие. • Катализатор уменьшает время достижения равновесия.
продолжение • Катализатор одинаково ускоряет прямую и обратную реакцию, но не смещает равновесие. • Катализатор уменьшает время достижения равновесия.
 Выход продуктоа. Принцип Ле-шателье Численное значение К характеризует выход продуктов реакции. Чем больше К тем полнее исходные вещества превращаются в продукты и тем выше выход продуктов реакции. v >v равновесие смещается вправо v
Выход продуктоа. Принцип Ле-шателье Численное значение К характеризует выход продуктов реакции. Чем больше К тем полнее исходные вещества превращаются в продукты и тем выше выход продуктов реакции. v >v равновесие смещается вправо v
 Химическое равновесие является подвижным и, поэтому при изменении условий, его можно смещать (изменять скорость прямой или обратной реакции)
Химическое равновесие является подвижным и, поэтому при изменении условий, его можно смещать (изменять скорость прямой или обратной реакции)
 Принцип Ле-Шателье 1884 Если на равновесную систему оказывать внешнее воздействие, то равновесие смещается в сторону реакции ослабляющей это воздействие
Принцип Ле-Шателье 1884 Если на равновесную систему оказывать внешнее воздействие, то равновесие смещается в сторону реакции ослабляющей это воздействие
 Факторы, влияющие на смещение равновесия 1. Влияние концентрации С (исх. ) ; С (прод. )
Факторы, влияющие на смещение равновесия 1. Влияние концентрации С (исх. ) ; С (прод. )
 2. Влияние температуры • При повышении температуры равновесие смещается в сторону эндотермической реакции (t H>0). • При понижении температуры – в сторону экзотермической реакции(t H<0)
2. Влияние температуры • При повышении температуры равновесие смещается в сторону эндотермической реакции (t H>0). • При понижении температуры – в сторону экзотермической реакции(t H<0)
 давление 3. Влияние давления При увеличении давления (уменьшении объема) равновесие смещается в сторону меньшего числа молей газообразных веществ. При понижении давления (увеличении объема) в сторону большего числа молей газообразных веществ.
давление 3. Влияние давления При увеличении давления (уменьшении объема) равновесие смещается в сторону меньшего числа молей газообразных веществ. При понижении давления (увеличении объема) в сторону большего числа молей газообразных веществ.
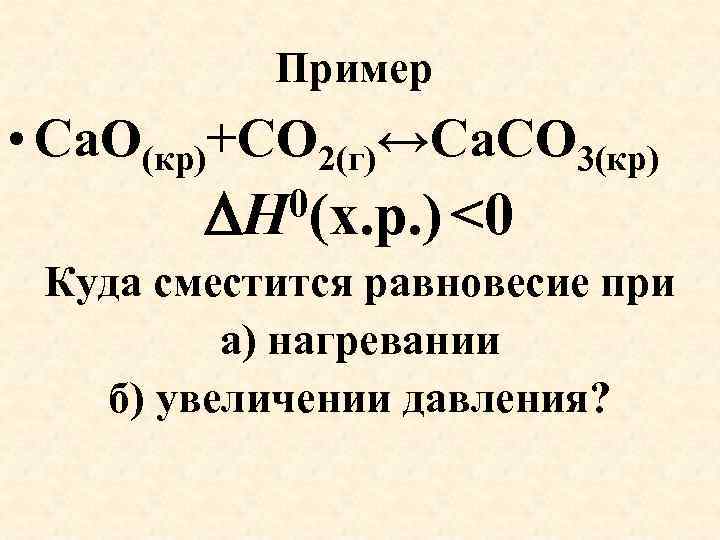 Пример • Са. О(кр)+СО 2(г)↔Са. СО 3(кр) 0(х. р. ) <0 Н Куда сместится равновесие при а) нагревании б) увеличении давления?
Пример • Са. О(кр)+СО 2(г)↔Са. СО 3(кр) 0(х. р. ) <0 Н Куда сместится равновесие при а) нагревании б) увеличении давления?
![ответ а) t • б) P Кр=1/[CO 2] ответ а) t • б) P Кр=1/[CO 2]](https://present5.com/presentation/90992014_142242842/image-69.jpg) ответ а) t • б) P Кр=1/[CO 2]
ответ а) t • б) P Кр=1/[CO 2]
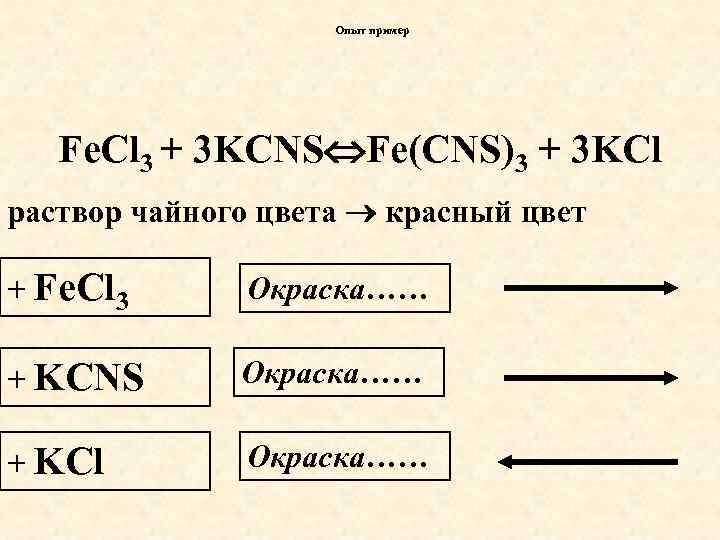 Опыт пример Fe. Cl 3 + 3 KCNS Fe(CNS)3 + 3 KCl раствор чайного цвета красный цвет + Fe. Cl 3 Окраска…… + KCNS Окраска…… + KCl Окраска……
Опыт пример Fe. Cl 3 + 3 KCNS Fe(CNS)3 + 3 KCl раствор чайного цвета красный цвет + Fe. Cl 3 Окраска…… + KCNS Окраска…… + KCl Окраска……
 Опыт Зависимость от концентрации 1–я стадия Na 2 S 2 O 3+H 2 SO 4 H 2 S 2 O 3+Na 2 SO 4 2 -я стадия H 2 S 2 O 3 S+SO 2+ H 2 O № опыта С моль/л 1 С 2 2 С 3 3 С Время сек. Скорость сек-1
Опыт Зависимость от концентрации 1–я стадия Na 2 S 2 O 3+H 2 SO 4 H 2 S 2 O 3+Na 2 SO 4 2 -я стадия H 2 S 2 O 3 S+SO 2+ H 2 O № опыта С моль/л 1 С 2 2 С 3 3 С Время сек. Скорость сек-1
 1. Не производя расчета определите как изменяется энтропия в результате реакции ( S 0>0, S 0<0, S 0=0): Проверочная работа по т. д. Sr. CO 3(кр)=Sr. O(кр)+CO 2(г) у 2. Используя, приведенные справочные данные расположите вещества в порядке уменьшения химической активности Вещество С 2 Н 2 СН 4 G 0298 209, 2 50, 8 к. Дж/моль С 2 Н 6 32, 9 С 2 Н 4 68, 1
1. Не производя расчета определите как изменяется энтропия в результате реакции ( S 0>0, S 0<0, S 0=0): Проверочная работа по т. д. Sr. CO 3(кр)=Sr. O(кр)+CO 2(г) у 2. Используя, приведенные справочные данные расположите вещества в порядке уменьшения химической активности Вещество С 2 Н 2 СН 4 G 0298 209, 2 50, 8 к. Дж/моль С 2 Н 6 32, 9 С 2 Н 4 68, 1
