Лекция 13 Химия p-элементов VI и VII группы






























lekciya_g.m._boleyko_№_13.ppt
- Размер: 1.6 Мб
- Автор:
- Количество слайдов: 39
Описание презентации Лекция 13 Химия p-элементов VI и VII группы по слайдам
 Лекция 13 Химия p-элементов VI и VII группы главные подгруппы
Лекция 13 Химия p-элементов VI и VII группы главные подгруппы
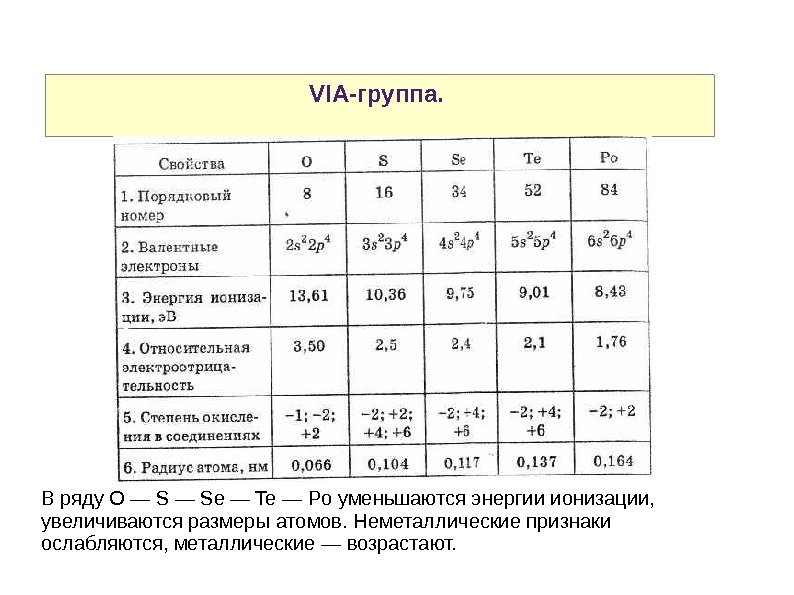
 VIA-группа. В ряду O — Se — Te — Po уменьшаются энергии ионизации, увеличиваются размеры атомов. Неметаллические признаки ослабляются, металлические — возрастают.
VIA-группа. В ряду O — Se — Te — Po уменьшаются энергии ионизации, увеличиваются размеры атомов. Неметаллические признаки ослабляются, металлические — возрастают.
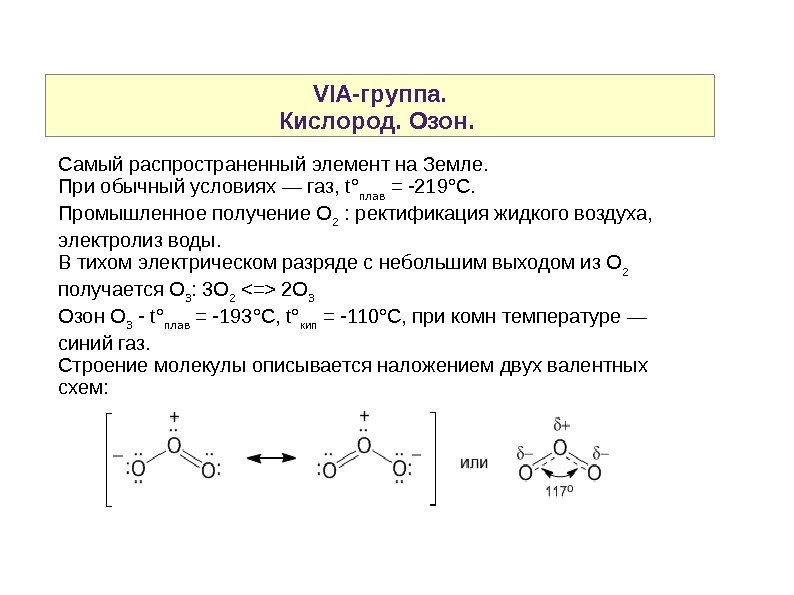
 VIA-группа. Кислород. Озон. Самый распространенный элемент на Земле. При обычный условиях — газ, t ° плав = -219°С. Промышленное получение О 2 : ректификация жидкого воздуха, электролиз воды. В тихом электрическом разряде с небольшим выходом из О 2 получается О 3 : 3 О 2 2 О 3 Озон О 3 — t° плав = -193°С, t° кип = -110°С, при комн температуре — синий газ. Строение молекулы описывается наложением двух валентных схем:
VIA-группа. Кислород. Озон. Самый распространенный элемент на Земле. При обычный условиях — газ, t ° плав = -219°С. Промышленное получение О 2 : ректификация жидкого воздуха, электролиз воды. В тихом электрическом разряде с небольшим выходом из О 2 получается О 3 : 3 О 2 2 О 3 Озон О 3 — t° плав = -193°С, t° кип = -110°С, при комн температуре — синий газ. Строение молекулы описывается наложением двух валентных схем:
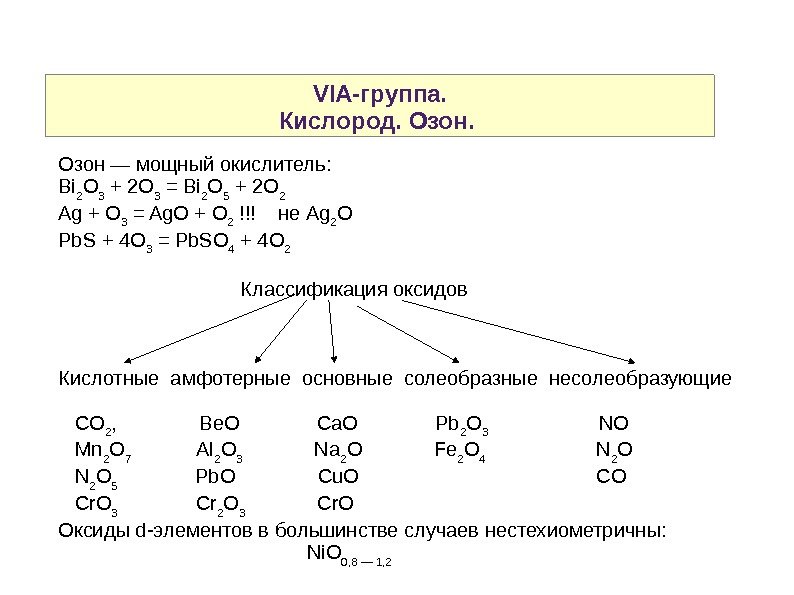
 VIA-группа. Кислород. Озон — мощный окислитель: Bi 2 O 3 + 2 O 3 = Bi 2 O 5 + 2 O 2 Ag + O 3 = Ag. O + O 2 !!! не Ag 2 O Pb. S + 4 O 3 = Pb. SO 4 + 4 O 2 Классификация оксидов Кислотные амфотерные основные солеобразные несолеобразующие CO 2 , Be. O Ca. O Pb 2 O 3 NO Mn 2 O 7 Al 2 O 3 Na 2 O Fe 2 O 4 N 2 O 5 Pb. O Cu. O CO Cr. O 3 Cr 2 O 3 Cr. O Оксиды d-элементов в большинстве случаев нестехиометричны: Ni. O 0, 8 — 1,
VIA-группа. Кислород. Озон — мощный окислитель: Bi 2 O 3 + 2 O 3 = Bi 2 O 5 + 2 O 2 Ag + O 3 = Ag. O + O 2 !!! не Ag 2 O Pb. S + 4 O 3 = Pb. SO 4 + 4 O 2 Классификация оксидов Кислотные амфотерные основные солеобразные несолеобразующие CO 2 , Be. O Ca. O Pb 2 O 3 NO Mn 2 O 7 Al 2 O 3 Na 2 O Fe 2 O 4 N 2 O 5 Pb. O Cu. O CO Cr. O 3 Cr 2 O 3 Cr. O Оксиды d-элементов в большинстве случаев нестехиометричны: Ni. O 0, 8 — 1,
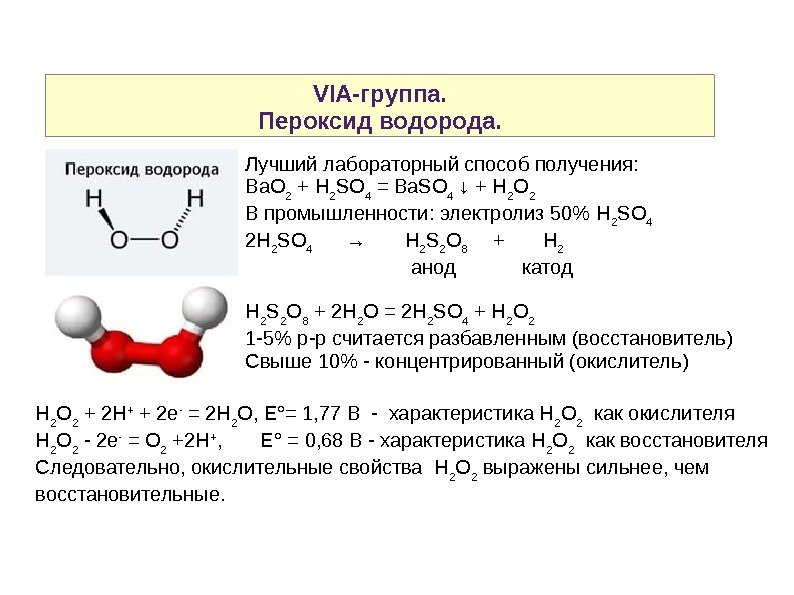
 VIA-группа. Пероксид водорода. Лучший лабораторный способ получения: Ba. O 2 + H 2 SO 4 = Ba. SO 4 ↓ + H 2 O 2 В промышленности: электролиз 50% H 2 SO 4 2 H 2 SO 4 → H 2 S 2 O 8 + H 2 анод катод H 2 S 2 O 8 + 2 H 2 O = 2 H 2 SO 4 + H 2 O 2 1 -5% р-р считается разбавленным (восстановитель) Свыше 10% — концентрированный (окислитель) H 2 O 2 + 2 H + + 2 e — = 2 H 2 O, E °= 1, 77 B — характеристика H 2 O 2 как окислителя H 2 O 2 — 2 e — = O 2 +2 H + , E° = 0, 68 B — характеристика H 2 O 2 как восстановителя Следовательно, окислительные свойства H 2 O 2 выражены сильнее, чем восстановительные.
VIA-группа. Пероксид водорода. Лучший лабораторный способ получения: Ba. O 2 + H 2 SO 4 = Ba. SO 4 ↓ + H 2 O 2 В промышленности: электролиз 50% H 2 SO 4 2 H 2 SO 4 → H 2 S 2 O 8 + H 2 анод катод H 2 S 2 O 8 + 2 H 2 O = 2 H 2 SO 4 + H 2 O 2 1 -5% р-р считается разбавленным (восстановитель) Свыше 10% — концентрированный (окислитель) H 2 O 2 + 2 H + + 2 e — = 2 H 2 O, E °= 1, 77 B — характеристика H 2 O 2 как окислителя H 2 O 2 — 2 e — = O 2 +2 H + , E° = 0, 68 B — характеристика H 2 O 2 как восстановителя Следовательно, окислительные свойства H 2 O 2 выражены сильнее, чем восстановительные.
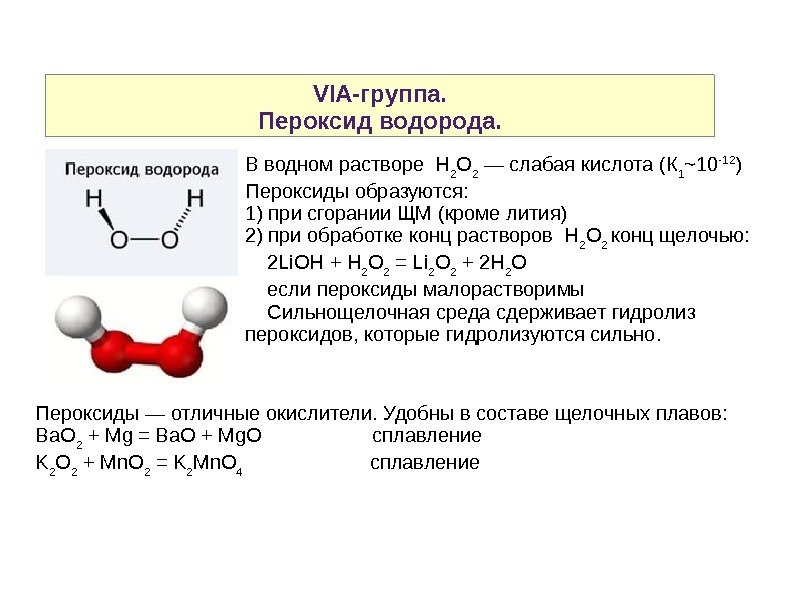
 VIA-группа. Пероксид водорода. В водном растворе H 2 O 2 — слабая кислота (К 1 ~10 -12 ) Пероксиды образуются: 1) при сгорании ЩМ (кроме лития) 2) при обработке конц растворов H 2 O 2 конц щелочью: 2 Li. OH + H 2 O 2 = Li 2 O 2 + 2 H 2 O если пероксиды малорастворимы Сильнощелочная среда сдерживает гидролиз пероксидов, которые гидролизуются сильно. Пероксиды — отличные окислители. Удобны в составе щелочных плавов: Ba. O 2 + Mg = Ba. O + Mg. O сплавление K 2 O 2 + Mn. O 2 = K 2 Mn. O 4 сплавление
VIA-группа. Пероксид водорода. В водном растворе H 2 O 2 — слабая кислота (К 1 ~10 -12 ) Пероксиды образуются: 1) при сгорании ЩМ (кроме лития) 2) при обработке конц растворов H 2 O 2 конц щелочью: 2 Li. OH + H 2 O 2 = Li 2 O 2 + 2 H 2 O если пероксиды малорастворимы Сильнощелочная среда сдерживает гидролиз пероксидов, которые гидролизуются сильно. Пероксиды — отличные окислители. Удобны в составе щелочных плавов: Ba. O 2 + Mg = Ba. O + Mg. O сплавление K 2 O 2 + Mn. O 2 = K 2 Mn. O 4 сплавление
 VIA-группа. Сера. Содержание в природе. Самородная сера Сульфиды: пирит Fe. S 2 цинковая обманка Zn. S (сфалерит) Сульфаты: Глауберова соль Мирабиллит Na 2 SO 4 · 10 H 2 O Барит Гипс Ba. SO 4 Ca. SO 4 · 2 H 2 O O
VIA-группа. Сера. Содержание в природе. Самородная сера Сульфиды: пирит Fe. S 2 цинковая обманка Zn. S (сфалерит) Сульфаты: Глауберова соль Мирабиллит Na 2 SO 4 · 10 H 2 O Барит Гипс Ba. SO 4 Ca. SO 4 · 2 H 2 O O
 VIA-группа. Аллотропные модификации серы Природная — почти вся α. β-сера устойчива при t° > 96°C.
VIA-группа. Аллотропные модификации серы Природная — почти вся α. β-сера устойчива при t° > 96°C.
 VIA-группа. Сера. Химические свойства. Валентность: II, IV, VI. Степени окисления: -2, (+2), +4, +6. Все Нерастворима в воде, но растворяется в CS 2. эти S + O 2 = SO 2 реакции 2 S + C = CS 2 идут S + 3 F 2 = SF 6 при S + Cl 2 (Br 2 ) = смесь галогенных соединений нагревании S + порошки = сульфиды металлов S + мин. кислоты = не взаимодействует S + 2 H 2 SO 4(конц) = 3 SO 2 + 2 H 2 O кипятить несколько S + 6 HNO 3(конц) = H 2 SO 4 + 6 NO 2 + 2 H 2 O часов 3 S + 6 KOH = 2 K 2 S + K 2 SO 3 + 3 H 2 O в горячем растворе
VIA-группа. Сера. Химические свойства. Валентность: II, IV, VI. Степени окисления: -2, (+2), +4, +6. Все Нерастворима в воде, но растворяется в CS 2. эти S + O 2 = SO 2 реакции 2 S + C = CS 2 идут S + 3 F 2 = SF 6 при S + Cl 2 (Br 2 ) = смесь галогенных соединений нагревании S + порошки = сульфиды металлов S + мин. кислоты = не взаимодействует S + 2 H 2 SO 4(конц) = 3 SO 2 + 2 H 2 O кипятить несколько S + 6 HNO 3(конц) = H 2 SO 4 + 6 NO 2 + 2 H 2 O часов 3 S + 6 KOH = 2 K 2 S + K 2 SO 3 + 3 H 2 O в горячем растворе
 VIA-группа. Сероводород. Сульфиды. H 2 S — газ с запахом тухлых яиц. Получают: Fe. S + H 2 SO 4 = H 2 S↑ + Fe. SO 4 Ядовит. Водный раствор — слабая двухосновная кислота (К 1 ~10 -7 , К 2 ~10 -13 — близка к воде). Сульфиды все сильно гидролизованы. Гидролиз не только по первой, но и в большой степени — по второй ступени. Сульфиды Me 3+ в водных растворах не могут быть получены: 2 Cr. Cl 3 + 3 K 2 S + 6 H 2 O = 2 Cr(OH) 3 ↓ + 3 H 2 S + 6 KCl Почему не существует Pb. S 2 ?
VIA-группа. Сероводород. Сульфиды. H 2 S — газ с запахом тухлых яиц. Получают: Fe. S + H 2 SO 4 = H 2 S↑ + Fe. SO 4 Ядовит. Водный раствор — слабая двухосновная кислота (К 1 ~10 -7 , К 2 ~10 -13 — близка к воде). Сульфиды все сильно гидролизованы. Гидролиз не только по первой, но и в большой степени — по второй ступени. Сульфиды Me 3+ в водных растворах не могут быть получены: 2 Cr. Cl 3 + 3 K 2 S + 6 H 2 O = 2 Cr(OH) 3 ↓ + 3 H 2 S + 6 KCl Почему не существует Pb. S 2 ?
 VIA-группа. Сероводород. Сульфиды. H 2 S и сульфиды — исключительные восстановители. Окисляются, как правило, до S 0. 5 H 2 S + 2 KMn. O 4 + 3 H 2 SO 4 = 5 S↓ + 2 Mn. SO 4 + K 2 SO 4 + 8 H 2 O 3 K 2 S + K 2 Cr 2 O 7 + 7 H 2 SO 4 = 3 S↓ + Cr 2 (SO 4 ) 3 + 4 K 2 SO 4 + 7 H 2 O И только HNO 3 (конц) в обычных условиях способна окислить S 2 — до SO 4 2 -. Окисление H 2 S при недостатке О 2 ведет к образованию серы: H 2 S + 0, 5 O 2 = S + H 2 O в минеральных источниках А сгорание 2 H 2 S +3 O 2 = 2 SO 2 + 2 H 2 O Из-за чего погибла Помпея?
VIA-группа. Сероводород. Сульфиды. H 2 S и сульфиды — исключительные восстановители. Окисляются, как правило, до S 0. 5 H 2 S + 2 KMn. O 4 + 3 H 2 SO 4 = 5 S↓ + 2 Mn. SO 4 + K 2 SO 4 + 8 H 2 O 3 K 2 S + K 2 Cr 2 O 7 + 7 H 2 SO 4 = 3 S↓ + Cr 2 (SO 4 ) 3 + 4 K 2 SO 4 + 7 H 2 O И только HNO 3 (конц) в обычных условиях способна окислить S 2 — до SO 4 2 -. Окисление H 2 S при недостатке О 2 ведет к образованию серы: H 2 S + 0, 5 O 2 = S + H 2 O в минеральных источниках А сгорание 2 H 2 S +3 O 2 = 2 SO 2 + 2 H 2 O Из-за чего погибла Помпея?
 VIA-группа. Сероводород. Сульфиды. Классификация сульфидов Растворимые растворимые нерастворимые в воде в минеральных K 2 S кислотах (оч низкое ПР) (NH 4 ) 2 S Fe. S, Zn. S Hg. S, Cu. S (их растворяют окисляя) Hg. S — абсолютно безопасное соединение, ПР = 10 -52 Сера может образовывать гомоцепи: Na 2 S + S = Na 2 S 2 Полисульфиды Na 2 S n где n = 2 — 9 жидкая темная масса с ужасным запахом Обработкой полисульфидов минеральной кислотой можно получить сульфаны: Na 2 S 2 + 2 HCl = 2 Na. Cl + H 2 S 2 (смесь сульфанов) Сульфаны менее устойчивы, чем H 2 S.
VIA-группа. Сероводород. Сульфиды. Классификация сульфидов Растворимые растворимые нерастворимые в воде в минеральных K 2 S кислотах (оч низкое ПР) (NH 4 ) 2 S Fe. S, Zn. S Hg. S, Cu. S (их растворяют окисляя) Hg. S — абсолютно безопасное соединение, ПР = 10 -52 Сера может образовывать гомоцепи: Na 2 S + S = Na 2 S 2 Полисульфиды Na 2 S n где n = 2 — 9 жидкая темная масса с ужасным запахом Обработкой полисульфидов минеральной кислотой можно получить сульфаны: Na 2 S 2 + 2 HCl = 2 Na. Cl + H 2 S 2 (смесь сульфанов) Сульфаны менее устойчивы, чем H 2 S.
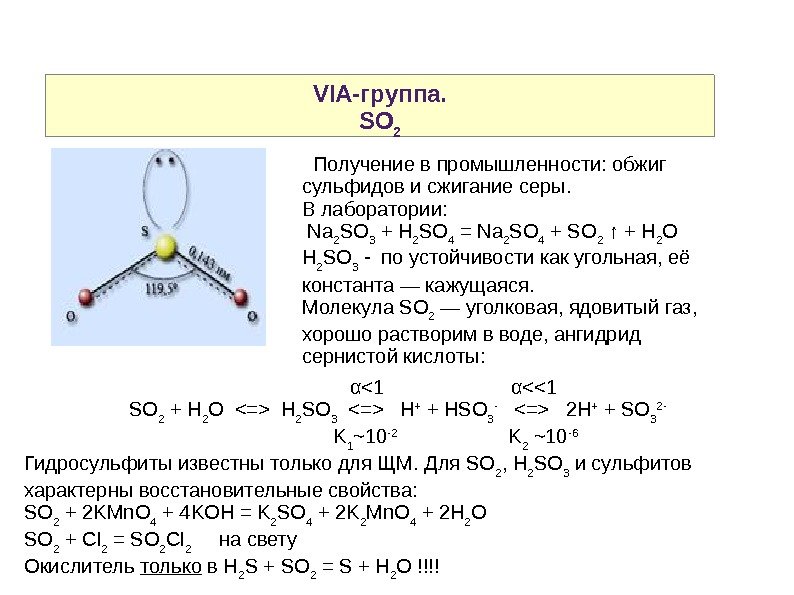
 VIA-группа. SO 2 Получение в промышленности: обжиг сульфидов и сжигание серы. В лаборатории: Na 2 SO 3 + H 2 SO 4 = Na 2 SO 4 + SO 2 ↑ + H 2 O H 2 SO 3 — по устойчивости как угольная, её константа — кажущаяся. Молекула SO 2 — уголковая, ядовитый газ, хорошо растворим в воде, ангидрид сернистой кислоты: α<1 α<<1 SO 2 + H 2 O H 2 SO 3 H + + HSO 3 — 2 H + + SO 3 2 — K 1 ~10 -2 K 2 ~10 -6 Гидросульфиты известны только для ЩМ. Для SO 2 , H 2 SO 3 и сульфитов характерны восстановительные свойства: SO 2 + 2 KMn. O 4 + 4 KOH = K 2 SO 4 + 2 K 2 Mn. O 4 + 2 H 2 O SO 2 + Cl 2 = SO 2 Cl 2 на свету Окислитель только в H 2 S + SO 2 = S + H 2 O !!!!
VIA-группа. SO 2 Получение в промышленности: обжиг сульфидов и сжигание серы. В лаборатории: Na 2 SO 3 + H 2 SO 4 = Na 2 SO 4 + SO 2 ↑ + H 2 O H 2 SO 3 — по устойчивости как угольная, её константа — кажущаяся. Молекула SO 2 — уголковая, ядовитый газ, хорошо растворим в воде, ангидрид сернистой кислоты: α<1 α<<1 SO 2 + H 2 O H 2 SO 3 H + + HSO 3 — 2 H + + SO 3 2 — K 1 ~10 -2 K 2 ~10 -6 Гидросульфиты известны только для ЩМ. Для SO 2 , H 2 SO 3 и сульфитов характерны восстановительные свойства: SO 2 + 2 KMn. O 4 + 4 KOH = K 2 SO 4 + 2 K 2 Mn. O 4 + 2 H 2 O SO 2 + Cl 2 = SO 2 Cl 2 на свету Окислитель только в H 2 S + SO 2 = S + H 2 O !!!!
 VIA-группа. SO 2 При хранении сульфиты легко окисляются кислородом воздуха и портятся. Сульфиты и гидросульфиты при нагревании диспропорционируют и разлагаются: 2 Na. HSO 3 → Na 2 S 2 O 5 + H 2 O при 150°С пиросульфит Na 2 S 2 O 5 → SO 2 + Na 2 SO 3 нагревание 4 Na 2 SO 3 → Na 2 S + 3 Na 2 SO 4 при 600°С встряхивание Na 2 SO 3 + S Na 2 S 2 O 3 — производится в больших масштабах для нужд химической промышленности. Получение в промышленности: окисление Na 2 S 2 горячим воздухом 2 Na 2 S 2 + 3 O 2 = 2 Na 2 S 2 O 3 при нагревании
VIA-группа. SO 2 При хранении сульфиты легко окисляются кислородом воздуха и портятся. Сульфиты и гидросульфиты при нагревании диспропорционируют и разлагаются: 2 Na. HSO 3 → Na 2 S 2 O 5 + H 2 O при 150°С пиросульфит Na 2 S 2 O 5 → SO 2 + Na 2 SO 3 нагревание 4 Na 2 SO 3 → Na 2 S + 3 Na 2 SO 4 при 600°С встряхивание Na 2 SO 3 + S Na 2 S 2 O 3 — производится в больших масштабах для нужд химической промышленности. Получение в промышленности: окисление Na 2 S 2 горячим воздухом 2 Na 2 S 2 + 3 O 2 = 2 Na 2 S 2 O 3 при нагревании
 VIA-группа. Na 2 S 2 O 3 и тиосерная кислота Na 2 S 2 O 3 — тиосульфат натрия, соль тиосерной кислоты обе формулы справедливы По силе тиосерная равна серной, но значительно менее устойчива: Na 2 S 2 O 3 + 2 HCl = 2 Na. Cl + H 2 S 2 O 3 SO 2 S H 2 O Средняя ст. ок. атома S в тиосульфате +4, но удобнее рассматривать степени +6 и -2.
VIA-группа. Na 2 S 2 O 3 и тиосерная кислота Na 2 S 2 O 3 — тиосульфат натрия, соль тиосерной кислоты обе формулы справедливы По силе тиосерная равна серной, но значительно менее устойчива: Na 2 S 2 O 3 + 2 HCl = 2 Na. Cl + H 2 S 2 O 3 SO 2 S H 2 O Средняя ст. ок. атома S в тиосульфате +4, но удобнее рассматривать степени +6 и -2.
 VIA-группа. Na 2 S 2 O 3 и тиосерная кислота При недостатке окислителя S 2 — окисляется до S 0 , а при избытке — до S +6 : хлорную воду наливаем в раствор тиосульфата Na 2 S 2 O 3 + Cl 2 + H 2 O = Na 2 SO 4 + S + 2 HCl тиосульфат наливаем в хлорную воду Na 2 S 2 O 3 + 4 Cl 2(изб) + 5 H 2 O = 2 Н 2 SO 4 + 2 Na. Cl + 6 HCl В аналитике концентрацию окислителей часто определяют по реакции окисления иодидов до I 2 раствором тиосульфата натрия: 2 Na 2 S 2 O 3 + l 2 = 2 Na 2 I + Na 2 S 4 O 6 r оричн б/цв тетратионат Na Это соль кислоты — представителя полисерных кислот (политионовых)
VIA-группа. Na 2 S 2 O 3 и тиосерная кислота При недостатке окислителя S 2 — окисляется до S 0 , а при избытке — до S +6 : хлорную воду наливаем в раствор тиосульфата Na 2 S 2 O 3 + Cl 2 + H 2 O = Na 2 SO 4 + S + 2 HCl тиосульфат наливаем в хлорную воду Na 2 S 2 O 3 + 4 Cl 2(изб) + 5 H 2 O = 2 Н 2 SO 4 + 2 Na. Cl + 6 HCl В аналитике концентрацию окислителей часто определяют по реакции окисления иодидов до I 2 раствором тиосульфата натрия: 2 Na 2 S 2 O 3 + l 2 = 2 Na 2 I + Na 2 S 4 O 6 r оричн б/цв тетратионат Na Это соль кислоты — представителя полисерных кислот (политионовых)
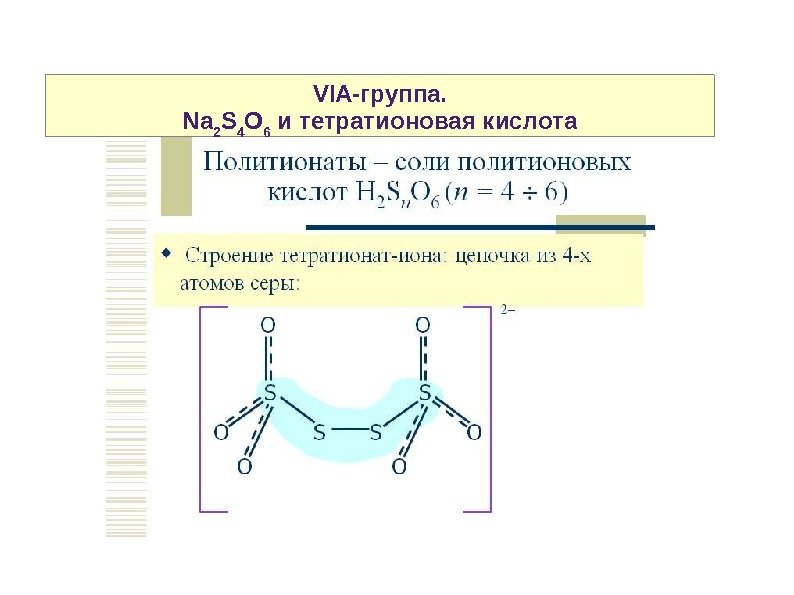
 VIA-группа. Na 2 S 4 O 6 и тетратионовая кислота
VIA-группа. Na 2 S 4 O 6 и тетратионовая кислота
 VIA-группа. SO 3 и серная кислота Легкокипящая жидкость t° кип = 45°С Симметричная молекула без дипольного момента => слабые межмолекулярные связи. Основной промышленный способ получения: V 2 O 5 , t° 2 SO 2 + O 2 = 2 SO 3 Типичный кислотный оксид: SO 3 + Na. OH + Na 2 SO 4 + H 2 O Сильный окислитель, обычно восстанавливается до SO 2 : 5 SO 3 + 2 P = P 2 O 5 + 5 SO 2 При взаимодействии с HСl дает хлорсерную (хлорсульфоновую) кислоту: SO 3 + HCl = HSO 3 Cl полукислота — полухлорангидрид
VIA-группа. SO 3 и серная кислота Легкокипящая жидкость t° кип = 45°С Симметричная молекула без дипольного момента => слабые межмолекулярные связи. Основной промышленный способ получения: V 2 O 5 , t° 2 SO 2 + O 2 = 2 SO 3 Типичный кислотный оксид: SO 3 + Na. OH + Na 2 SO 4 + H 2 O Сильный окислитель, обычно восстанавливается до SO 2 : 5 SO 3 + 2 P = P 2 O 5 + 5 SO 2 При взаимодействии с HСl дает хлорсерную (хлорсульфоновую) кислоту: SO 3 + HCl = HSO 3 Cl полукислота — полухлорангидрид
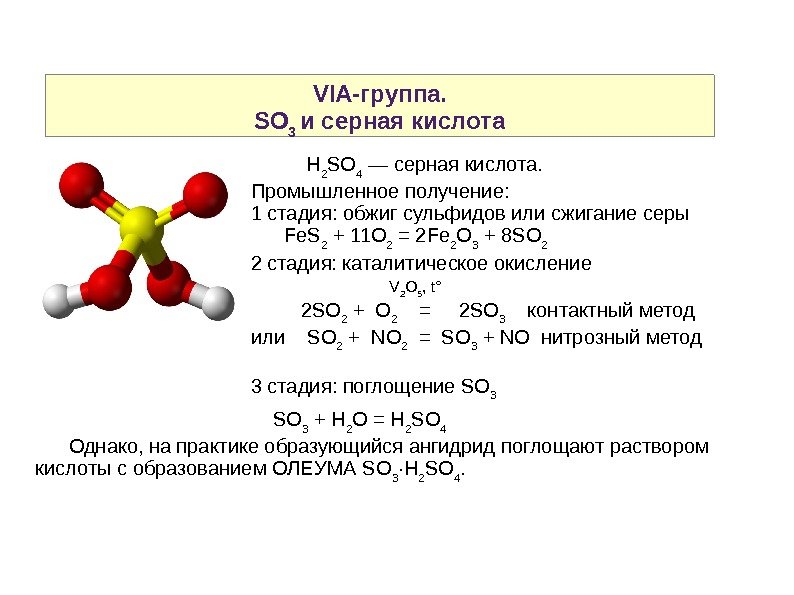
 VIA-группа. SO 3 и серная кислота H 2 SO 4 — серная кислота. Промышленное получение: 1 стадия: обжиг сульфидов или сжигание серы Fe. S 2 + 11 O 2 = 2 Fe 2 O 3 + 8 SO 2 2 стадия: каталитическое окисление V 2 O 5 , t° 2 SO 2 + O 2 = 2 SO 3 контактный метод или SO 2 + NO 2 = SO 3 + NO нитрозный метод 3 стадия: поглощение SO 3 SO 3 + H 2 O = H 2 SO 4 Однако, на практике образующийся ангидрид поглощают раствором кислоты с образованием ОЛЕУМА SO 3 ·H 2 SO 4.
VIA-группа. SO 3 и серная кислота H 2 SO 4 — серная кислота. Промышленное получение: 1 стадия: обжиг сульфидов или сжигание серы Fe. S 2 + 11 O 2 = 2 Fe 2 O 3 + 8 SO 2 2 стадия: каталитическое окисление V 2 O 5 , t° 2 SO 2 + O 2 = 2 SO 3 контактный метод или SO 2 + NO 2 = SO 3 + NO нитрозный метод 3 стадия: поглощение SO 3 SO 3 + H 2 O = H 2 SO 4 Однако, на практике образующийся ангидрид поглощают раствором кислоты с образованием ОЛЕУМА SO 3 ·H 2 SO 4.
 VIA-группа. SO 3 и серная кислота
VIA-группа. SO 3 и серная кислота
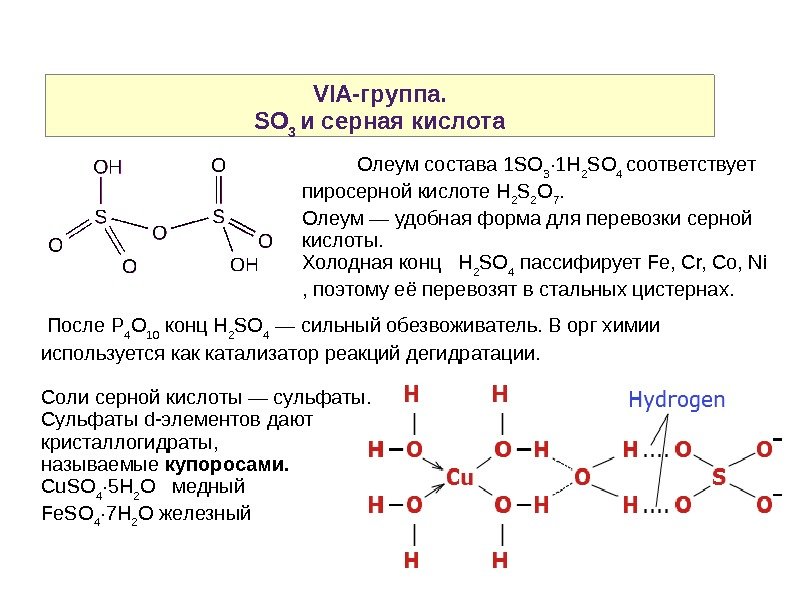
 VIA-группа. SO 3 и серная кислота Олеум состава 1 SO 3 · 1 H 2 SO 4 соответствует пиросерной кислоте H 2 S 2 O 7. Олеум — удобная форма для перевозки серной кислоты. Холодная конц H 2 SO 4 пассифирует Fe, Cr, Co, Ni , поэтому её перевозят в стальных цистернах. После P 4 O 10 конц Н 2 SO 4 — сильный обезвоживатель. В орг химии используется как катализатор реакций дегидратации. Соли серной кислоты — сульфаты. Сульфаты d-элементов дают кристаллогидраты, называемые купоросами. Cu. SO 4 · 5 H 2 O медный Fe. SO 4 · 7 H 2 O железный
VIA-группа. SO 3 и серная кислота Олеум состава 1 SO 3 · 1 H 2 SO 4 соответствует пиросерной кислоте H 2 S 2 O 7. Олеум — удобная форма для перевозки серной кислоты. Холодная конц H 2 SO 4 пассифирует Fe, Cr, Co, Ni , поэтому её перевозят в стальных цистернах. После P 4 O 10 конц Н 2 SO 4 — сильный обезвоживатель. В орг химии используется как катализатор реакций дегидратации. Соли серной кислоты — сульфаты. Сульфаты d-элементов дают кристаллогидраты, называемые купоросами. Cu. SO 4 · 5 H 2 O медный Fe. SO 4 · 7 H 2 O железный
 VIA-группа. Селен теллур полоний Основной источник — шламы электролизеров, в которых чистят медь и никель. Примеси к сульфидным рудам. Рудное сырье переводят в Se +4 и Te +4 и восстанавливают SO 2 : 2 S +4 + Se +4 = 2 S +6 + Se 0 Любимая с. о. селена и теллура — 0. Se и Te имеют неметаллические, полупроводниковые и металлические модификации. Se — один из самых удобных выпрямителей переменного тока. Ро — исключительно металл (Мария Склодовская-Кюри). Пар. Ы Se состоят из Se n (где n = 1 -10), Те — из Те
VIA-группа. Селен теллур полоний Основной источник — шламы электролизеров, в которых чистят медь и никель. Примеси к сульфидным рудам. Рудное сырье переводят в Se +4 и Te +4 и восстанавливают SO 2 : 2 S +4 + Se +4 = 2 S +6 + Se 0 Любимая с. о. селена и теллура — 0. Se и Te имеют неметаллические, полупроводниковые и металлические модификации. Se — один из самых удобных выпрямителей переменного тока. Ро — исключительно металл (Мария Склодовская-Кюри). Пар. Ы Se состоят из Se n (где n = 1 -10), Те — из Те
 VIA-группа. Селен, теллур, полоний: химические свойства. Тенденция проявляется своеобразно: Se и Те стремятся перейти не просто в низкую степень окисления, а в нулевую. Отличие от серы начинается уже со взаимодействия с водой: Se при нагревании, а Те уже при t комн медленно реагируют с водой: Э + 2 Н 2 О = ЭО 2 + Н 2 При сгорании: Э + О 2 = ЭО 2 Окисление HNO 3(конц) : 3 Э + 4 HNO 3(конц) = 3 ЭО 2 + 4 NO + 2 H 2 O (ЭО 2 ·х. Н 2 О) H 2 S и Н 2 Те получают из селенидов и теллуридов: Mg. Э + H 2 SO 4 = Mg. SO 4 + H 2 Э Если ΔG(H 2 S)0.
VIA-группа. Селен, теллур, полоний: химические свойства. Тенденция проявляется своеобразно: Se и Те стремятся перейти не просто в низкую степень окисления, а в нулевую. Отличие от серы начинается уже со взаимодействия с водой: Se при нагревании, а Те уже при t комн медленно реагируют с водой: Э + 2 Н 2 О = ЭО 2 + Н 2 При сгорании: Э + О 2 = ЭО 2 Окисление HNO 3(конц) : 3 Э + 4 HNO 3(конц) = 3 ЭО 2 + 4 NO + 2 H 2 O (ЭО 2 ·х. Н 2 О) H 2 S и Н 2 Те получают из селенидов и теллуридов: Mg. Э + H 2 SO 4 = Mg. SO 4 + H 2 Э Если ΔG(H 2 S)0.
 VIA-группа. Селен, теллур, полоний: химические свойства. H 2 Se H 2 Te Рост силы кислот в водном растворе Рост восстановительной активности SO 2 Se. O 2 Te. O 2 уменьшение кислотности Рост окислительной активности 2 SO 2 + Se. O 2 + 2 H 2 O = Se + 2 H 2 O H 2 Se. O 3 + 4 KI + 2 H 2 SO 4 = Se + 2 I 2 + 2 K 2 SO 4 + 3 H 2 O В отличие от сульфитов, селениты и теллуриты — окислители. H 2 SO 3 H 2 Se. O 3 H 2 Te. O 3 Падение силы кислот Рост окислительной активности
VIA-группа. Селен, теллур, полоний: химические свойства. H 2 Se H 2 Te Рост силы кислот в водном растворе Рост восстановительной активности SO 2 Se. O 2 Te. O 2 уменьшение кислотности Рост окислительной активности 2 SO 2 + Se. O 2 + 2 H 2 O = Se + 2 H 2 O H 2 Se. O 3 + 4 KI + 2 H 2 SO 4 = Se + 2 I 2 + 2 K 2 SO 4 + 3 H 2 O В отличие от сульфитов, селениты и теллуриты — окислители. H 2 SO 3 H 2 Se. O 3 H 2 Te. O 3 Падение силы кислот Рост окислительной активности
 VIA-группа. Селен, теллур, полоний: химические свойства. H 2 Se. O 4 (селеновая), H 6 Te. О 6 (Те(ОН) 6 или формально Н 2 Те. О 4 — теллуровая H 2 Se. O 4 — растворяет золото. Их получают, окисляя соединения в +4 очень сильными окислителями: H 2 Se. O 3 + H 2 O 2(конц) = H 2 Se. O 4 + H 2 O 25 -30% 5 Te. O 2 + 2 KMn. O 4 + 6 HNO 3 +12 H 2 O = 5 H 6 Te. O 6 + 2 Mn(NO 3 ) 2 + 2 KNO 3 H 2 Se. O 4 по силе практически равна серной, а H 6 Te. О 6 — оч слабая (К 1 ~10 -8 ) Они сильные окислители. H 2 Se. O 4 кинетически даже более энергичный окислитель, чем серная: 6 H 2 Se. O 4 + 2 Au = Au 2 (Se. O 4 ) 3 + 3 H 2 Se. O 3 + 3 H 2 O (Se. O 2 ·x. H 2 O) Галогенные соединения Se сходны с аналогичными соединениями S. Галогениды Te приближаются к солям, а галогениды Po — соли. Применение: селен — выпрямитель переменного тока, селениды и теллуриды — в полупроводниковой технике.
VIA-группа. Селен, теллур, полоний: химические свойства. H 2 Se. O 4 (селеновая), H 6 Te. О 6 (Те(ОН) 6 или формально Н 2 Те. О 4 — теллуровая H 2 Se. O 4 — растворяет золото. Их получают, окисляя соединения в +4 очень сильными окислителями: H 2 Se. O 3 + H 2 O 2(конц) = H 2 Se. O 4 + H 2 O 25 -30% 5 Te. O 2 + 2 KMn. O 4 + 6 HNO 3 +12 H 2 O = 5 H 6 Te. O 6 + 2 Mn(NO 3 ) 2 + 2 KNO 3 H 2 Se. O 4 по силе практически равна серной, а H 6 Te. О 6 — оч слабая (К 1 ~10 -8 ) Они сильные окислители. H 2 Se. O 4 кинетически даже более энергичный окислитель, чем серная: 6 H 2 Se. O 4 + 2 Au = Au 2 (Se. O 4 ) 3 + 3 H 2 Se. O 3 + 3 H 2 O (Se. O 2 ·x. H 2 O) Галогенные соединения Se сходны с аналогичными соединениями S. Галогениды Te приближаются к солям, а галогениды Po — соли. Применение: селен — выпрямитель переменного тока, селениды и теллуриды — в полупроводниковой технике.
 VIA-группа. Галогены В природе входят в состав очень многих минералов: Каменная соль Карналлит Плавиковый шпат, флюорит Na. Cl Kcl ·Mg. Cl 2 · 6 H 2 O Ca. F 2 Фторапатит Бромаргирит Виллиомит Ar. Br Na.
VIA-группа. Галогены В природе входят в состав очень многих минералов: Каменная соль Карналлит Плавиковый шпат, флюорит Na. Cl Kcl ·Mg. Cl 2 · 6 H 2 O Ca. F 2 Фторапатит Бромаргирит Виллиомит Ar. Br Na.
 VIA-группа. Галогены. Получение. Химические свойства. F 2 : электролиз расплава KHF 2 Cl 2 : электролиз расплавов и растворов хлоридов ЩМ Br 2 и I 2 : концентрируют растворы бромидов и иодидов (из морской воды), а затем пропускают газообразный хлор. Валентные возможности: I, III, V, VII Степени окисления: у фтора только -1, У остальных: -1, +3, +5, +7. Могут быть соединения и в других степенях окисления. F 2 — самое реакционноспособное простое вещество. Это обусловлено: — самой большой ЭО — маленьким r — отсутствием d-подуровня (оч легко диссоциирует на атомы)
VIA-группа. Галогены. Получение. Химические свойства. F 2 : электролиз расплава KHF 2 Cl 2 : электролиз расплавов и растворов хлоридов ЩМ Br 2 и I 2 : концентрируют растворы бромидов и иодидов (из морской воды), а затем пропускают газообразный хлор. Валентные возможности: I, III, V, VII Степени окисления: у фтора только -1, У остальных: -1, +3, +5, +7. Могут быть соединения и в других степенях окисления. F 2 — самое реакционноспособное простое вещество. Это обусловлено: — самой большой ЭО — маленьким r — отсутствием d-подуровня (оч легко диссоциирует на атомы)
 VIA-группа. Галогены. Получение. Химические свойства. F 2 : при t комн реагирует со всеми простыми веществами, кроме O 2 , N 2 и сладших благородных газов. В атмосфере фтора реакции идут с большими скоростями и огромными тепловыделениями: Ag + F 2 = Ag. F 2 !!!! 2 Fe + 3 F 2 = 2 Fe. F 3 P 4 + 10 F 2 = 4 PF 5 (взрыв) Если Cl 2 , Br 2 , I 2 растворяются в воде и слабо с ней взаимодействуют, то во фторе вода «горит» : 2 F 2 + H 2 O = OF 2 + 2 HF или 2 F 2 + 2 H 2 O = 4 HF + O 2 Cl 2 Br 2 I 2 Растворимость в воде уменьшается Г 2 (р-р) + Н 2 О H + + Г — + НОГ равновесие смещено влево Порядок К р этого процесса при t комн : для Cl 2 ~10 -4 , Br 2 ~10 -9 , I 2 ~10 -11. У йода взаимодействия практически нет.
VIA-группа. Галогены. Получение. Химические свойства. F 2 : при t комн реагирует со всеми простыми веществами, кроме O 2 , N 2 и сладших благородных газов. В атмосфере фтора реакции идут с большими скоростями и огромными тепловыделениями: Ag + F 2 = Ag. F 2 !!!! 2 Fe + 3 F 2 = 2 Fe. F 3 P 4 + 10 F 2 = 4 PF 5 (взрыв) Если Cl 2 , Br 2 , I 2 растворяются в воде и слабо с ней взаимодействуют, то во фторе вода «горит» : 2 F 2 + H 2 O = OF 2 + 2 HF или 2 F 2 + 2 H 2 O = 4 HF + O 2 Cl 2 Br 2 I 2 Растворимость в воде уменьшается Г 2 (р-р) + Н 2 О H + + Г — + НОГ равновесие смещено влево Порядок К р этого процесса при t комн : для Cl 2 ~10 -4 , Br 2 ~10 -9 , I 2 ~10 -11. У йода взаимодействия практически нет.
 VIA-группа. Галогены. Получение. Химические свойства. Равновесие в щелочном растворе сдвигается вправо за счет нейтрализации кислот: Г 2 + 2 Na. OH → Na. Г + Na. OГ + Н 2 О В горячей воде HГО диспропорционируют и поэтому суммарный процесс: 3 Г 2 (р-р) + 3 Н 2 О 5 HГ + НГО 3 В щелочи 3 Г 2 + 6 Na. OH → 5 Na. Г + Na. ГО 3 + 3 Н 2 О В реальной практике Br 2 предпочтительнее Cl 2. Причина: трудность создания хорошего контакта с реакционной средой.
VIA-группа. Галогены. Получение. Химические свойства. Равновесие в щелочном растворе сдвигается вправо за счет нейтрализации кислот: Г 2 + 2 Na. OH → Na. Г + Na. OГ + Н 2 О В горячей воде HГО диспропорционируют и поэтому суммарный процесс: 3 Г 2 (р-р) + 3 Н 2 О 5 HГ + НГО 3 В щелочи 3 Г 2 + 6 Na. OH → 5 Na. Г + Na. ГО 3 + 3 Н 2 О В реальной практике Br 2 предпочтительнее Cl 2. Причина: трудность создания хорошего контакта с реакционной средой.
 VIA-группа. Галогены. Соединения. HF и HCl получают: фторид/хлорид + H 2 SO 4 (конц, t°) Получение HBr и HI таким способом невозможно из-за окисления HBr и HI. Наиболее частые варианты: Pbr 3 + 3 H 2 O = H 3 PO 3 + 3 HBr гидролизный метод Ba. I 2 + H 2 SO 4 = Ba. SO 4 ↓ + 2 HI HF — самый неидеальный газ, удивительно похож на воду. Переход в жидкость при +19°С, ρ= 1 г/мл. Очень сильно ассоциированная жидкость. Водный раствор HF — слабая плавиковая кислота. В водном растворе — димеры (HF) 2. Поэтому при нейтрализации получается кислая соль: 2 HF + KOH = KHF 2 + H 2 O Энергия водородной связи между молекулами HF самая большая: почти 100 к. Дж/моль! Приближается к ковалентной.
VIA-группа. Галогены. Соединения. HF и HCl получают: фторид/хлорид + H 2 SO 4 (конц, t°) Получение HBr и HI таким способом невозможно из-за окисления HBr и HI. Наиболее частые варианты: Pbr 3 + 3 H 2 O = H 3 PO 3 + 3 HBr гидролизный метод Ba. I 2 + H 2 SO 4 = Ba. SO 4 ↓ + 2 HI HF — самый неидеальный газ, удивительно похож на воду. Переход в жидкость при +19°С, ρ= 1 г/мл. Очень сильно ассоциированная жидкость. Водный раствор HF — слабая плавиковая кислота. В водном растворе — димеры (HF) 2. Поэтому при нейтрализации получается кислая соль: 2 HF + KOH = KHF 2 + H 2 O Энергия водородной связи между молекулами HF самая большая: почти 100 к. Дж/моль! Приближается к ковалентной.
 VIA-группа. Галогенводороды. HF HCl HBr HI 1) снижается термодинамическая устойчивость 2) уменьшается термическая устойчивость 3) возрастает восстановительная активность 4) увеличивается сила кислот в растворе
VIA-группа. Галогенводороды. HF HCl HBr HI 1) снижается термодинамическая устойчивость 2) уменьшается термическая устойчивость 3) возрастает восстановительная активность 4) увеличивается сила кислот в растворе
 VIA-группа. Кислородные кислоты галогенов Галоген в степени окисления +1: галогеноватистые, соли — гипогалогениты. Кислоты малостабильны, известны только в водных растворах, частично образуются при растворении Г 2 в воде. Легко разлагаются и доспропорционируют: hν 2 HOCl → HCl +O 2 Ca. Cl 2 2 HOCl → Cl 2 O + H 2 O t 3 HOCl → HCl. O 3 + 2 HCl
VIA-группа. Кислородные кислоты галогенов Галоген в степени окисления +1: галогеноватистые, соли — гипогалогениты. Кислоты малостабильны, известны только в водных растворах, частично образуются при растворении Г 2 в воде. Легко разлагаются и доспропорционируют: hν 2 HOCl → HCl +O 2 Ca. Cl 2 2 HOCl → Cl 2 O + H 2 O t 3 HOCl → HCl. O 3 + 2 HCl
 VIA-группа. Кислородные кислоты галогенов Соли — гипогалогениты — более стабильны. В нейтральных растворах не проявляют окислительных свойств, но становятся сильными окислителями в кислых. Наиболее известная соль — хлорная известь, смесь Ca. Cl 2 и Ca(OCl) 2 Получается по реакции: 2 Сl 2 + 2 Ca(OH) 2 = Ca. Cl 2 + Ca. OCl 2 +2 H 2 O Газообразный хлор пропускают через раствор Ca(OH) 2 Некоторые реакции с гипогалогенитами: 2 Ca. OCl 2 → 2 Ca. Cl 2 + O 2 t 2 Na. OCl → Na. Cl. O 3 + 2 Na. Cl t Ca. OCl 2 + 2 HCl (Конц) → Cl 2 + Ca. Cl 2 + H 2 O Ca. OCl 2 + Pb(CH 3 COO) 2 + H 2 O = PBO 2 + Ca. Cl 2 + 2 CH 3 COOH
VIA-группа. Кислородные кислоты галогенов Соли — гипогалогениты — более стабильны. В нейтральных растворах не проявляют окислительных свойств, но становятся сильными окислителями в кислых. Наиболее известная соль — хлорная известь, смесь Ca. Cl 2 и Ca(OCl) 2 Получается по реакции: 2 Сl 2 + 2 Ca(OH) 2 = Ca. Cl 2 + Ca. OCl 2 +2 H 2 O Газообразный хлор пропускают через раствор Ca(OH) 2 Некоторые реакции с гипогалогенитами: 2 Ca. OCl 2 → 2 Ca. Cl 2 + O 2 t 2 Na. OCl → Na. Cl. O 3 + 2 Na. Cl t Ca. OCl 2 + 2 HCl (Конц) → Cl 2 + Ca. Cl 2 + H 2 O Ca. OCl 2 + Pb(CH 3 COO) 2 + H 2 O = PBO 2 + Ca. Cl 2 + 2 CH 3 COOH
 VIA-группа. Кислородные кислоты галогенов HOCl HOBr HOI Сила кислот уменьшается Окислительная активность уменьшается Образование HOI термодинамически маловероятно (лучше HIO 3 ) Галогены в степени окисления +3: галогенистые кислоты, соли — галогениты. Самые слабые кислоты. Из них наиболее известна HСl. O 2 — хлористая. Получают: Ba. O 2 + 2 Cl. O 2 = Ba(Cl. O 2 ) 2 + O 2 Ba(Cl. O 2 ) 2 + H 2 SO 4 = Ba. SO 4 + 2 HCl. O 2 Сравнительно сильная кислота, K д ~10 -2 , устойчива в водном растворе в темноте. Аналогичные кислоты брома и иода до сих пор считаются неполученными.
VIA-группа. Кислородные кислоты галогенов HOCl HOBr HOI Сила кислот уменьшается Окислительная активность уменьшается Образование HOI термодинамически маловероятно (лучше HIO 3 ) Галогены в степени окисления +3: галогенистые кислоты, соли — галогениты. Самые слабые кислоты. Из них наиболее известна HСl. O 2 — хлористая. Получают: Ba. O 2 + 2 Cl. O 2 = Ba(Cl. O 2 ) 2 + O 2 Ba(Cl. O 2 ) 2 + H 2 SO 4 = Ba. SO 4 + 2 HCl. O 2 Сравнительно сильная кислота, K д ~10 -2 , устойчива в водном растворе в темноте. Аналогичные кислоты брома и иода до сих пор считаются неполученными.
 VIA-группа. Кислородные кислоты галогенов Галогены в степени окисления +5: галогеноватые кислоты, соли — галогенаты. Известны все кислоты. Hl. O 3 — иодноватая, можно выделить в крист виде. Для неё известен и ангидрид, для двух других — нет. Варианты получения: 2 Na. Cl. O 3 + H 2 SO 4 = 2 HCl. O 3 + Na 2 SO 4 Br 2 + 5 Cl 2 + 6 H 2 O = 2 HBr. O 3 + 10 HCl I 2 + HNO 3(конц) = 2 HIO 3 10 NO 2 + 4 H 2 O I 2 + H 2 O 2(конц) = 2 HIO 3 + 4 H 2 O Все эти кислоты — активные окислители. HCl. O 3 HBr. O 3 HIO 3 Сила кислот уменьшается Окислительная активность уменьшается
VIA-группа. Кислородные кислоты галогенов Галогены в степени окисления +5: галогеноватые кислоты, соли — галогенаты. Известны все кислоты. Hl. O 3 — иодноватая, можно выделить в крист виде. Для неё известен и ангидрид, для двух других — нет. Варианты получения: 2 Na. Cl. O 3 + H 2 SO 4 = 2 HCl. O 3 + Na 2 SO 4 Br 2 + 5 Cl 2 + 6 H 2 O = 2 HBr. O 3 + 10 HCl I 2 + HNO 3(конц) = 2 HIO 3 10 NO 2 + 4 H 2 O I 2 + H 2 O 2(конц) = 2 HIO 3 + 4 H 2 O Все эти кислоты — активные окислители. HCl. O 3 HBr. O 3 HIO 3 Сила кислот уменьшается Окислительная активность уменьшается
 VIA-группа. Кислородные кислоты галогенов Иодноватые кислоты могут содержать разные количества воды и находится в форме: +H 2 O HIO 3 → H 3 IO 5 → H 5 IO 6 H 5 IO 6 — действительно пятиосновная! Все водороды можно заместить на атомы металлов
VIA-группа. Кислородные кислоты галогенов Иодноватые кислоты могут содержать разные количества воды и находится в форме: +H 2 O HIO 3 → H 3 IO 5 → H 5 IO 6 H 5 IO 6 — действительно пятиосновная! Все водороды можно заместить на атомы металлов
 VIA-группа. Кислородные кислоты галогенов Галогены в степени окисления +7: галогенные кислоты, соли — пергалогенаты. Известны все кислоты. Все кислоты являются активными окислителями, термически малоустойчивы, но гораздо устойчивее всех предыдущих кислот. HСl. O 4 — существует в 100% форме. Если в разбавленном растворе — вообще не является окислителем и ведет себя как обычная минеральная кислота, напрbмер, Hcl. A H 5 IO 6 — слабая. Перхлораты — самые устойчивые соединения хлора. Периодаты — малорастворимы в воде, устойчивы к нагреванию.
VIA-группа. Кислородные кислоты галогенов Галогены в степени окисления +7: галогенные кислоты, соли — пергалогенаты. Известны все кислоты. Все кислоты являются активными окислителями, термически малоустойчивы, но гораздо устойчивее всех предыдущих кислот. HСl. O 4 — существует в 100% форме. Если в разбавленном растворе — вообще не является окислителем и ведет себя как обычная минеральная кислота, напрbмер, Hcl. A H 5 IO 6 — слабая. Перхлораты — самые устойчивые соединения хлора. Периодаты — малорастворимы в воде, устойчивы к нагреванию.
 VIA-группа. Бинарные соединения галогенов Правило: вышестоящий галоген вытесняет нижестоящий из бинарных соединений. А в кислородсодержащих будет наоборот! I 2 будет вытеснять Br 2 и Cl 2 , и т. д. 2 HCl. O 4 + I 2 = Cl 2 + 2 HIO 4 2 KCl. O 3 + Br 2 = 2 KBr. O 3 + Cl 2 Существует большая группа межгалогенных соединений: IF 3 IF 5 IF 7 Br. F 3 Br. F 5 Cl. F 3 Чем дальше галогены стоят друг от друга, тем больше количество присоединяемых атомов. Соединения устойчивы, ΔG<0. Получают обычно прямым синтезом. В воде гидролизуются и диспропорционируют, особенно в случае Г +3 : Br. F 5 + 3 H 2 O = Hbr. O 3 + 5 HF 2 Br. F 3 + (H 2 O) = Br. F + Br.
VIA-группа. Бинарные соединения галогенов Правило: вышестоящий галоген вытесняет нижестоящий из бинарных соединений. А в кислородсодержащих будет наоборот! I 2 будет вытеснять Br 2 и Cl 2 , и т. д. 2 HCl. O 4 + I 2 = Cl 2 + 2 HIO 4 2 KCl. O 3 + Br 2 = 2 KBr. O 3 + Cl 2 Существует большая группа межгалогенных соединений: IF 3 IF 5 IF 7 Br. F 3 Br. F 5 Cl. F 3 Чем дальше галогены стоят друг от друга, тем больше количество присоединяемых атомов. Соединения устойчивы, ΔG<0. Получают обычно прямым синтезом. В воде гидролизуются и диспропорционируют, особенно в случае Г +3 : Br. F 5 + 3 H 2 O = Hbr. O 3 + 5 HF 2 Br. F 3 + (H 2 O) = Br. F + Br.
 Спасибо за внимание!
Спасибо за внимание!
