ЛЕКЦИЯ № 1 Введение. Основные понятия

























lekciya_№1_aud.607.ppt
- Размер: 4.5 Мб
- Автор: Гордей Сербаев
- Количество слайдов: 27
Описание презентации ЛЕКЦИЯ № 1 Введение. Основные понятия по слайдам
 ЛЕКЦИЯ № 1 Введение. Основные понятия химии. Законы стехиометрии.
ЛЕКЦИЯ № 1 Введение. Основные понятия химии. Законы стехиометрии.
 Поддубная Ольга Владимировна, канд. с. -х. наук, доцент Тел. (8 -0 -2233) 59489 кафедра Е -mail: olga. gorki@mail. ru , kh. baa@mail. ru
Поддубная Ольга Владимировна, канд. с. -х. наук, доцент Тел. (8 -0 -2233) 59489 кафедра Е -mail: olga. gorki@mail. ru , kh. baa@mail. ru
 Литература Химия: Учебно-методический комплекс: учебно-методическое пособие / О. В. Поддубная, И. В. Ковалева и др. – Горки: БГСХА, 2014. – 504 с.
Литература Химия: Учебно-методический комплекс: учебно-методическое пособие / О. В. Поддубная, И. В. Ковалева и др. – Горки: БГСХА, 2014. – 504 с.
 Литература Цыганов, А. Р. Сборник задач и упражнений по химии: Учеб. пособие / А. Р. Цыганов, О. В. Поддубная. – Минск: ИВЦ Минфина, 2013. – 236 с.
Литература Цыганов, А. Р. Сборник задач и упражнений по химии: Учеб. пособие / А. Р. Цыганов, О. В. Поддубная. – Минск: ИВЦ Минфина, 2013. – 236 с.
 Литература Химия. Учебно-методический комплекс: учебно-методическое пособие / О. В. Поддубная, И. В. Ковалева, Е. В. Мохова. – Горки : БГСХА, 2014. – 404 с.
Литература Химия. Учебно-методический комплекс: учебно-методическое пособие / О. В. Поддубная, И. В. Ковалева, Е. В. Мохова. – Горки : БГСХА, 2014. – 404 с.
 Литература • Химия. Общая химиясосновами аналитической : учебно-методическое пособие / А. Р. Цыганов [и др. ]. – Горки : БГСХА, 2012. – 204 с. • ISBN 978 -985 -467 -393 -6.
Литература • Химия. Общая химиясосновами аналитической : учебно-методическое пособие / А. Р. Цыганов [и др. ]. – Горки : БГСХА, 2012. – 204 с. • ISBN 978 -985 -467 -393 -6.
 План: 1. Химия как наука о веществах и их превращениях. Цели и задачи изучения дисциплины. 2. Международная номенклатура неорганических соединений. 3. Основные понятия химии. 4. Основные стехиометрические законы. 5. Химический эквивалент. Закон эквивалентов.
План: 1. Химия как наука о веществах и их превращениях. Цели и задачи изучения дисциплины. 2. Международная номенклатура неорганических соединений. 3. Основные понятия химии. 4. Основные стехиометрические законы. 5. Химический эквивалент. Закон эквивалентов.
 1. Химия как наука о веществах и их превращениях. Цели и задачи изучения дисциплины.
1. Химия как наука о веществах и их превращениях. Цели и задачи изучения дисциплины.
 Химия — наука о составе, строении, свойствах и превращениях веществ. • Цель изучения химии — освоить современные представления о строениях как атомов и молекул, так и вещества в целом, а также об основных законах, управляющих процессами превращения веществ.
Химия — наука о составе, строении, свойствах и превращениях веществ. • Цель изучения химии — освоить современные представления о строениях как атомов и молекул, так и вещества в целом, а также об основных законах, управляющих процессами превращения веществ.
 2. Международная номенклатура неорганических соединений.
2. Международная номенклатура неорганических соединений.
 Основойхимическихвеществявляютсяхимические соединения. Внастоящеевремяизвестноболее 20 миллионовхимическихсоединений. Несмотрянастольмногочисленныйсостав, большинствонеорганическихсоединений укладываютсявобщуюсхемуклассификации, которая выглядитследующимобразом: • Металлы и неметаллы простые вещества • Оксиды • Основания сложные вещества • Кислоты • Соли
Основойхимическихвеществявляютсяхимические соединения. Внастоящеевремяизвестноболее 20 миллионовхимическихсоединений. Несмотрянастольмногочисленныйсостав, большинствонеорганическихсоединений укладываютсявобщуюсхемуклассификации, которая выглядитследующимобразом: • Металлы и неметаллы простые вещества • Оксиды • Основания сложные вещества • Кислоты • Соли
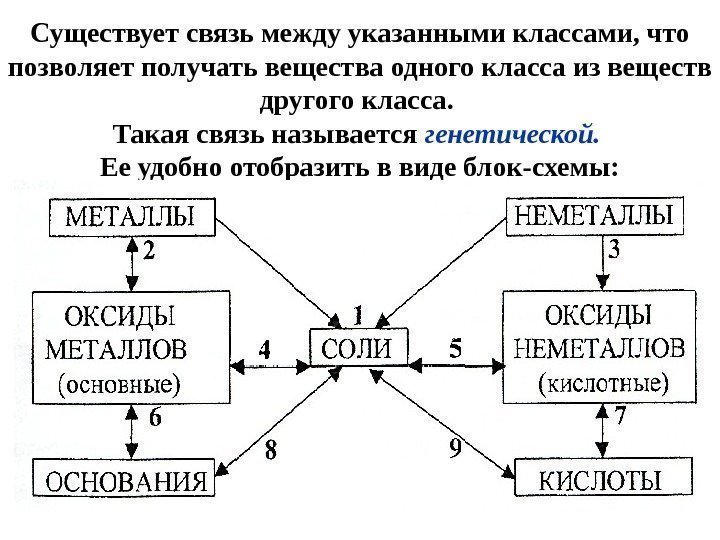
 Существуетсвязьмеждууказаннымиклассами, что позволяетполучатьвеществаодногоклассаизвеществ другогокласса. Такаясвязьназывается генетической. Ееудобноотобразитьввидеблок-схемы:
Существуетсвязьмеждууказаннымиклассами, что позволяетполучатьвеществаодногоклассаизвеществ другогокласса. Такаясвязьназывается генетической. Ееудобноотобразитьввидеблок-схемы:
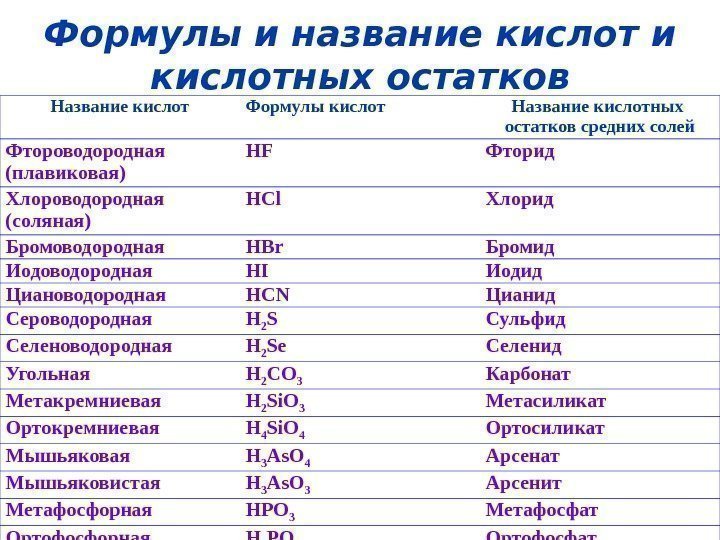
 Формулы и название кислот и кислотных остатков Названиекислот Формулыкислот Названиекислотных остатковсреднихсолей Фтороводородная (плавиковая) HF Фторид Хлороводородная (соляная) HCl Хлорид Бромоводородная HBr Бромид Иодоводородная HI Иодид Циановодородная HCN Цианид Сероводородная H 2 S Сульфид Селеноводородная H 2 Se Селенид Угольная H 2 CO 3 Карбонат Метакремниевая H 2 Si. O 3 Метасиликат Ортокремниевая H 4 Si. O 4 Ортосиликат Мышьяковая H 3 As. O 4 Арсенат Мышьяковистая H 3 As. O 3 Арсенит Метафосфорная HPO 3 Метафосфат Ортофосфорная H 3 PO 4 Ортофосфат Пиро(ди)фосфорная H 4 P 2 O 7 Пиро(ди)фосфат Фосфористая H 3 PO 3 Фосфит Фосфорноватистая H 3 PO 2 Гипофосфит Азотная HNO 3 Нитрат Азотистая HNO 2 Нитрит Серная H 2 SO 4 Сульфат Сернистая H 2 SO 3 Сульфит Хромовая H 2 Cr. O 4 Хромат Дихромовая H 2 Cr 2 O 7 Дихромат Марганцовая HMn. O 4 Перманганат
Формулы и название кислот и кислотных остатков Названиекислот Формулыкислот Названиекислотных остатковсреднихсолей Фтороводородная (плавиковая) HF Фторид Хлороводородная (соляная) HCl Хлорид Бромоводородная HBr Бромид Иодоводородная HI Иодид Циановодородная HCN Цианид Сероводородная H 2 S Сульфид Селеноводородная H 2 Se Селенид Угольная H 2 CO 3 Карбонат Метакремниевая H 2 Si. O 3 Метасиликат Ортокремниевая H 4 Si. O 4 Ортосиликат Мышьяковая H 3 As. O 4 Арсенат Мышьяковистая H 3 As. O 3 Арсенит Метафосфорная HPO 3 Метафосфат Ортофосфорная H 3 PO 4 Ортофосфат Пиро(ди)фосфорная H 4 P 2 O 7 Пиро(ди)фосфат Фосфористая H 3 PO 3 Фосфит Фосфорноватистая H 3 PO 2 Гипофосфит Азотная HNO 3 Нитрат Азотистая HNO 2 Нитрит Серная H 2 SO 4 Сульфат Сернистая H 2 SO 3 Сульфит Хромовая H 2 Cr. O 4 Хромат Дихромовая H 2 Cr 2 O 7 Дихромат Марганцовая HMn. O 4 Перманганат
 3. Основные понятия химии • В химических расчетах используется единица количества вещества – моль. Один моль любого вещества содержит число Авогадро ( N A =6, 02 10 23 ) частиц, из которых оносостоит. • Масса одного моль вещества называется молярной массой (М)
3. Основные понятия химии • В химических расчетах используется единица количества вещества – моль. Один моль любого вещества содержит число Авогадро ( N A =6, 02 10 23 ) частиц, из которых оносостоит. • Масса одного моль вещества называется молярной массой (М)
 4. Основные стехиометрические законы Стехиометрия – разделхимии, которыйрассматривает количественныесоотношениямежду реагирующимивеществами. Теоретическойосновойрасчетов количественныхсоотношениймежду элементамивсоединенияхилимежду веществамивуравненияххимических реакцийявляются стехиометрические законыхимии.
4. Основные стехиометрические законы Стехиометрия – разделхимии, которыйрассматривает количественныесоотношениямежду реагирующимивеществами. Теоретическойосновойрасчетов количественныхсоотношениймежду элементамивсоединенияхилимежду веществамивуравненияххимических реакцийявляются стехиометрические законыхимии.
 4. 1. Закон сохранения массы и энергии: (Ломоносов, 1748) Масса веществ, вступающих в реакцию равна массе веществ, образовавшихся в результате реакции: Ca + Cl 2 Ca. Cl 2 40 + 71 = 111 М. В. Ломоносов связывал закон сохранения массы веществ с законом сохранения энергии. Взаимодействие массы и энергии выражается уравнением А. Энштейна: E = mc 2 ; c =3 10 8 m / c. Современнаяформулировка: Визолированнойсистемесуммамасс(энергий)веществ дохимическойреакцииравнасуммемасс(энергий) образовавшихсявеществпослереакции.
4. 1. Закон сохранения массы и энергии: (Ломоносов, 1748) Масса веществ, вступающих в реакцию равна массе веществ, образовавшихся в результате реакции: Ca + Cl 2 Ca. Cl 2 40 + 71 = 111 М. В. Ломоносов связывал закон сохранения массы веществ с законом сохранения энергии. Взаимодействие массы и энергии выражается уравнением А. Энштейна: E = mc 2 ; c =3 10 8 m / c. Современнаяформулировка: Визолированнойсистемесуммамасс(энергий)веществ дохимическойреакцииравнасуммемасс(энергий) образовавшихсявеществпослереакции.
 4. 2. Закон постоянства состава (Пруст, 1808) • Любое сложное вещество молекулярного строение независимо от способа получения имеет постоянный качественный и количественный состав. В природе существуют вещества с молекулярной и кристаллической (ионной) структурой: вещества с постоянным составом – дальтониды ( H 2 O ; CO 2 ); • вещества переменного состава – бертоллиды (от Ti. O 0, 7 до Ti. O 1, 3 ).
4. 2. Закон постоянства состава (Пруст, 1808) • Любое сложное вещество молекулярного строение независимо от способа получения имеет постоянный качественный и количественный состав. В природе существуют вещества с молекулярной и кристаллической (ионной) структурой: вещества с постоянным составом – дальтониды ( H 2 O ; CO 2 ); • вещества переменного состава – бертоллиды (от Ti. O 0, 7 до Ti. O 1, 3 ).
 4. 3. Закон кратных отношений (Дальтон, 1803) • Атомы в молекуле, а также их массы относятся друг к другу как небольшие целые числа. C : H =1 : 2; • Если два элемента образуют между собой более одного соединения, то массы одного элемента, приходящиеся на одну и ту же массу другого элемента, относятся между собой как небольшие целые числа.
4. 3. Закон кратных отношений (Дальтон, 1803) • Атомы в молекуле, а также их массы относятся друг к другу как небольшие целые числа. C : H =1 : 2; • Если два элемента образуют между собой более одного соединения, то массы одного элемента, приходящиеся на одну и ту же массу другого элемента, относятся между собой как небольшие целые числа.
 4. 4. Закон простых объёмных отношений (Гей-Люссак, 1808) • Объёмы вступающих в реакцию газов, а также объёмы газообразных продуктов реакции относятся между собой как небольшие целые числа. N 2 + 3 H 2 2 NH 3 ; V(N 2 ) : V(H 2 ) : V(NH 3 ) = 1: 3: 2.
4. 4. Закон простых объёмных отношений (Гей-Люссак, 1808) • Объёмы вступающих в реакцию газов, а также объёмы газообразных продуктов реакции относятся между собой как небольшие целые числа. N 2 + 3 H 2 2 NH 3 ; V(N 2 ) : V(H 2 ) : V(NH 3 ) = 1: 3: 2.
 4. 5. Закон Авогадро • В равных объёмах различных газов при одинаковых условиях ( p , t ) содержится одинаковое число молекул. Следствие 1: Один моль любого газа в нормальных условиях занимает объём 22, 4 л/моль – V м молярный объём. Н. у. : p = 1 атм ; 101 к. Па, T = 0 С; 273 К. • Следствие 2: Отношение плотностей двух газов прямо пропорционально отношению их молярных масс: ρ 1 / ρ2 = М 1 / М 2 = D ; D ( H 2 ) = M (газа)/2 ; D (возд. ) = M (газа)/
4. 5. Закон Авогадро • В равных объёмах различных газов при одинаковых условиях ( p , t ) содержится одинаковое число молекул. Следствие 1: Один моль любого газа в нормальных условиях занимает объём 22, 4 л/моль – V м молярный объём. Н. у. : p = 1 атм ; 101 к. Па, T = 0 С; 273 К. • Следствие 2: Отношение плотностей двух газов прямо пропорционально отношению их молярных масс: ρ 1 / ρ2 = М 1 / М 2 = D ; D ( H 2 ) = M (газа)/2 ; D (возд. ) = M (газа)/
 4. 6. Закон Менделеева – Клапейрона p. V = n. RT ; R =8, 314; еслир=Па, V =м 3 ; R =0, 082; еслир=атм, V =л. 4. 7. Объединённый газовый закон. P V = P 0 V 0 T T
4. 6. Закон Менделеева – Клапейрона p. V = n. RT ; R =8, 314; еслир=Па, V =м 3 ; R =0, 082; еслир=атм, V =л. 4. 7. Объединённый газовый закон. P V = P 0 V 0 T T
 5. Химический эквивалент. Закон эквивалентов. • Эквивалент –условнаяилиреальная частицавещества, котораяв кислотно-основнойреакциисоответствует одномукатиону. Н+ , ав окислительно-восстановительнойреакции –одномуэлектрону. • Реальнаячастица–молекула, атомили ион, условнаячастица–определенная частьмолекулы, атомаилииона.
5. Химический эквивалент. Закон эквивалентов. • Эквивалент –условнаяилиреальная частицавещества, котораяв кислотно-основнойреакциисоответствует одномукатиону. Н+ , ав окислительно-восстановительнойреакции –одномуэлектрону. • Реальнаячастица–молекула, атомили ион, условнаячастица–определенная частьмолекулы, атомаилииона.
 Фактор эквивалентности ( fэкв ) – доля условной или реальной частицы эквивалентавещества. f экв = 1 / Z , где z –степеньокисленияэлементаили числоэквивалентности; f экв ≤ 1; fэкв ( O -2 )=½ M экв (х) – молярнаямассаэквивалента–это молярнаямасса 1 мольэквивалента вещества; рассчитываетсяпоформуле Мэкв (х) =М(х)* fэкв.
Фактор эквивалентности ( fэкв ) – доля условной или реальной частицы эквивалентавещества. f экв = 1 / Z , где z –степеньокисленияэлементаили числоэквивалентности; f экв ≤ 1; fэкв ( O -2 )=½ M экв (х) – молярнаямассаэквивалента–это молярнаямасса 1 мольэквивалента вещества; рассчитываетсяпоформуле Мэкв (х) =М(х)* fэкв.
 При вычислении молярных масс эквивалентов веществ необходимо учесть следующее: • молярная масса эквивалента оксида равна сумме молярных масс эквивалентов кислорода и элемента, входящего в состав оксида; • молярная масса эквивалента кислоты равна: Мэкв(к-ты) =М(к-ты)* fэкв , где fэкв(к-ты) =1/число. Н+ • молярная масса эквивалента основания равна: М экв(осн) =М(осн)* fэкв , где fэкв(осн) =1/число. ОН- • молярная масса эквивалента соли равна: М экв(соли) =М(соли)* fэкв , где fэкв(соли) =1/(число. Ме* ст. ок. Ме) • молярная масса эквивалента сложного вещества не является величиной постоянной, а зависит от химической реакции, в которой принимает участие данное соединение.
При вычислении молярных масс эквивалентов веществ необходимо учесть следующее: • молярная масса эквивалента оксида равна сумме молярных масс эквивалентов кислорода и элемента, входящего в состав оксида; • молярная масса эквивалента кислоты равна: Мэкв(к-ты) =М(к-ты)* fэкв , где fэкв(к-ты) =1/число. Н+ • молярная масса эквивалента основания равна: М экв(осн) =М(осн)* fэкв , где fэкв(осн) =1/число. ОН- • молярная масса эквивалента соли равна: М экв(соли) =М(соли)* fэкв , где fэкв(соли) =1/(число. Ме* ст. ок. Ме) • молярная масса эквивалента сложного вещества не является величиной постоянной, а зависит от химической реакции, в которой принимает участие данное соединение.
 Эквивалентныеобъёмыгазов: V экв (½Н 2 )=11, 2 л/моль; V экв ( 1 / 4 О 2 )=5, 6 л/моль.
Эквивалентныеобъёмыгазов: V экв (½Н 2 )=11, 2 л/моль; V экв ( 1 / 4 О 2 )=5, 6 л/моль.
 Закон эквивалентов массы веществ m, реагирующих друг с другом или получающихся в результате реакции, пропорциональны молярным массам их эквивалентов Мэкв : m 1 /m 2 = M экв 1 /M экв 2.
Закон эквивалентов массы веществ m, реагирующих друг с другом или получающихся в результате реакции, пропорциональны молярным массам их эквивалентов Мэкв : m 1 /m 2 = M экв 1 /M экв 2.
 Спасибо за внимание!
Спасибо за внимание!
