Lektsia_1_NKh_Perekhodnye_metally_4-7_gruppy-1.ppt
- Количество слайдов: 30
 Лекция № 1 Неорганическая химия Переходные металлы с 4 по 7 группы
Лекция № 1 Неорганическая химия Переходные металлы с 4 по 7 группы
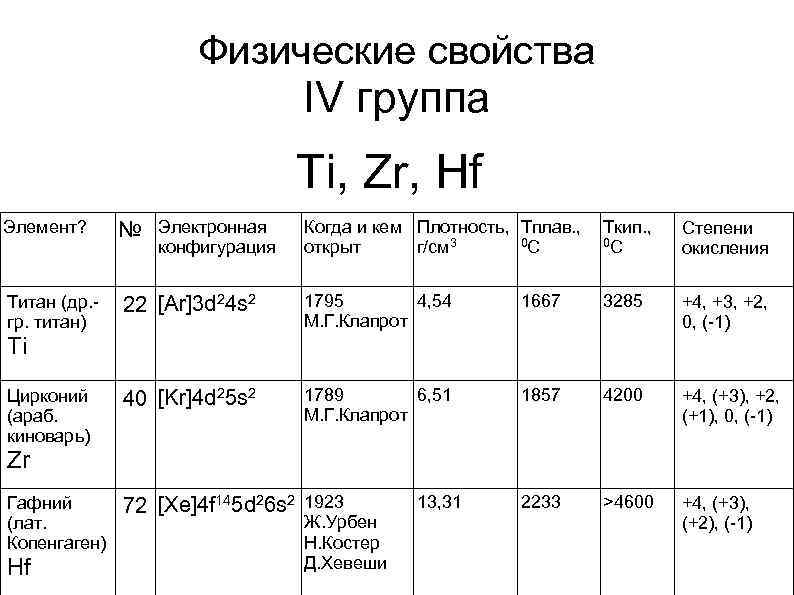 Физические свойства IV группа Ti, Zr, Hf Элемент? № Электронная Когда и кем Плотность, Тплав. , Tкип. , 0 С 0 С открыт г/см 3 Степени окисления Титан (др. гр. титан) 22 [Ar]3 d 24 s 2 1795 4, 54 М. Г. Клапрот 1667 3285 +4, +3, +2, 0, (-1) Цирконий (араб. киноварь) 40 [Kr]4 d 25 s 2 1789 6, 51 М. Г. Клапрот 1857 4200 +4, (+3), +2, (+1), 0, (-1) Гафний (лат. Копенгаген) 72 [Xe]4 f 145 d 26 s 2 1923 2233 >4600 +4, (+3), (+2), (-1) конфигурация Ti Zr Hf Ж. Урбен Н. Костер Д. Хевеши 13, 31
Физические свойства IV группа Ti, Zr, Hf Элемент? № Электронная Когда и кем Плотность, Тплав. , Tкип. , 0 С 0 С открыт г/см 3 Степени окисления Титан (др. гр. титан) 22 [Ar]3 d 24 s 2 1795 4, 54 М. Г. Клапрот 1667 3285 +4, +3, +2, 0, (-1) Цирконий (араб. киноварь) 40 [Kr]4 d 25 s 2 1789 6, 51 М. Г. Клапрот 1857 4200 +4, (+3), +2, (+1), 0, (-1) Гафний (лат. Копенгаген) 72 [Xe]4 f 145 d 26 s 2 1923 2233 >4600 +4, (+3), (+2), (-1) конфигурация Ti Zr Hf Ж. Урбен Н. Костер Д. Хевеши 13, 31
 Нахождение в природе ● ● ● Ti — в коре 0, 63% по массе, основные минералы: рутил Ti. O 2, ильменит Fe. Ti. O 3, перовскит Ca. Ti. O 3 и еще более ста других. Zr — в коре 0, 016% по массе, основные минералы: циркон Zr. Si. O 4, бадделеит Zr. O 2, всего более 30 минералов. Hf — 3*10 -4% по массе, собственных минералов не имеет, но часто сопутствует циркону в виде гафнона Hf. Si. O 4.
Нахождение в природе ● ● ● Ti — в коре 0, 63% по массе, основные минералы: рутил Ti. O 2, ильменит Fe. Ti. O 3, перовскит Ca. Ti. O 3 и еще более ста других. Zr — в коре 0, 016% по массе, основные минералы: циркон Zr. Si. O 4, бадделеит Zr. O 2, всего более 30 минералов. Hf — 3*10 -4% по массе, собственных минералов не имеет, но часто сопутствует циркону в виде гафнона Hf. Si. O 4.
 Получение в промышленности ● Все элементы IV группы обычно получают восстановлением хлоридов или фторидов МХ 4 с помощью активных металлов (Mg, Ca, Na). MCl 4+2 Mg → M+2 Mg. Cl 2 (9000 С) MCl 4+4 Na → M+4 Na. Cl (8000 С) ● Для более полной очистки используют, например, иодидное рафинирование (процесс Ван-Аркеля де Бура): Ti+2 I 2 → Ti. I 4↑ Ti. I 4 → Ti +2 I 2 (2000 С) (14000 С)
Получение в промышленности ● Все элементы IV группы обычно получают восстановлением хлоридов или фторидов МХ 4 с помощью активных металлов (Mg, Ca, Na). MCl 4+2 Mg → M+2 Mg. Cl 2 (9000 С) MCl 4+4 Na → M+4 Na. Cl (8000 С) ● Для более полной очистки используют, например, иодидное рафинирование (процесс Ван-Аркеля де Бура): Ti+2 I 2 → Ti. I 4↑ Ti. I 4 → Ti +2 I 2 (2000 С) (14000 С)
 Химические свойства ● Металлы инертны из-за пассивации, однако хорошо растворимы в плавиковой, щавелевой и т. п. кислотах ввиду комплексообразования: M+6 HF → H 2[MF 6]+2 H 2↑ ● Металлы и оксиды при нагревании медленно растворяются в щелочах: M+2 Na. OH+H 2 O → Na 2 MO 3+2 H 2↑ ● ● Галогениды МХ 4 — б/цв твердые в-ва, но Ti. Cl 4 — жидкость! Также возможно получение оксосоединений типа Ti. OSO 4 со сложным строением.
Химические свойства ● Металлы инертны из-за пассивации, однако хорошо растворимы в плавиковой, щавелевой и т. п. кислотах ввиду комплексообразования: M+6 HF → H 2[MF 6]+2 H 2↑ ● Металлы и оксиды при нагревании медленно растворяются в щелочах: M+2 Na. OH+H 2 O → Na 2 MO 3+2 H 2↑ ● ● Галогениды МХ 4 — б/цв твердые в-ва, но Ti. Cl 4 — жидкость! Также возможно получение оксосоединений типа Ti. OSO 4 со сложным строением.
 Химические свойства ● Низшие степени окисления характерны только для титана, так при нагревании он реагирует с разбавленными кислотами: 2 Ti+6 HCl → 2 Ti. Cl 3+3 H 2↑ ● Аналогично с плавиковой кислотой, но в таких условиях происодит диспропорционирование: 2 Ti+6 HF → [Ti. F 6]2 -+Ti 2++3 H 2 O Ti+6 HF → H 2[Ti. F 6]+2 H 2 O ● Кроме того, для титана получены субоксиды состава Ti 1 -x. O, Ti 3 O, Ti 6 O, имеющие кластерное строение.
Химические свойства ● Низшие степени окисления характерны только для титана, так при нагревании он реагирует с разбавленными кислотами: 2 Ti+6 HCl → 2 Ti. Cl 3+3 H 2↑ ● Аналогично с плавиковой кислотой, но в таких условиях происодит диспропорционирование: 2 Ti+6 HF → [Ti. F 6]2 -+Ti 2++3 H 2 O Ti+6 HF → H 2[Ti. F 6]+2 H 2 O ● Кроме того, для титана получены субоксиды состава Ti 1 -x. O, Ti 3 O, Ti 6 O, имеющие кластерное строение.
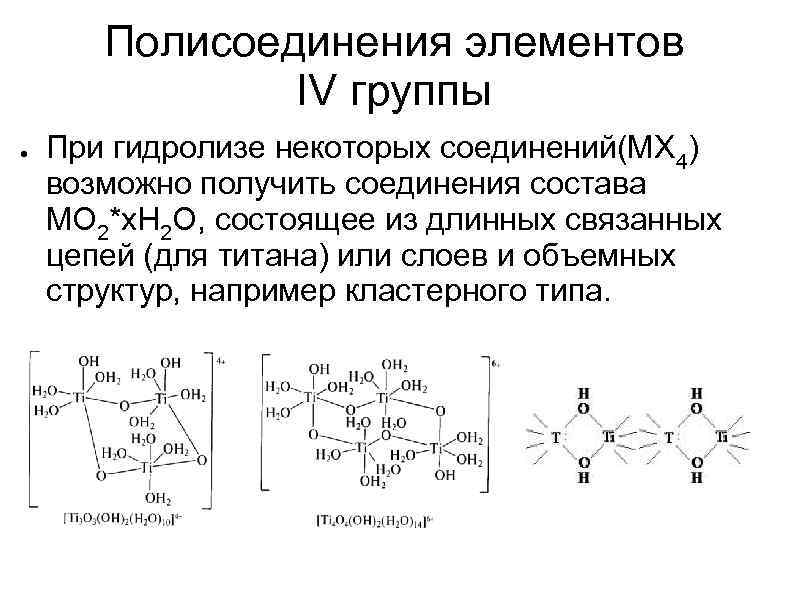 Полисоединения элементов IV группы ● При гидролизе некоторых соединений(МХ 4) возможно получить соединения состава MO 2*x. H 2 O, состоящее из длинных связанных цепей (для титана) или слоев и объемных структур, например кластерного типа.
Полисоединения элементов IV группы ● При гидролизе некоторых соединений(МХ 4) возможно получить соединения состава MO 2*x. H 2 O, состоящее из длинных связанных цепей (для титана) или слоев и объемных структур, например кластерного типа.
 Сводная таблица цветов ионов в растворе. +4 +3 +2 Ti Бесцветный (КЧ=6) Фиолетовый (КЧ=4) Зеленый (КЧ=6) Zr Бесцветный (КЧ=6) ? ? Hf Бесцветный (КЧ=6) ? ? Коричневый (КЧ=6)
Сводная таблица цветов ионов в растворе. +4 +3 +2 Ti Бесцветный (КЧ=6) Фиолетовый (КЧ=4) Зеленый (КЧ=6) Zr Бесцветный (КЧ=6) ? ? Hf Бесцветный (КЧ=6) ? ? Коричневый (КЧ=6)
 Применение ● ● ● Ti — активно используется в металлургии (сверхлегкие и сверхпрочные сплавы, сплавы с эффектом памяти), самоочищающиеся поверхности (Ti. O 2). Zr — добавка в некоторые сплавы, отражатель нейтронов. Hf — поглотитель нейтронов в ядерных реакциях
Применение ● ● ● Ti — активно используется в металлургии (сверхлегкие и сверхпрочные сплавы, сплавы с эффектом памяти), самоочищающиеся поверхности (Ti. O 2). Zr — добавка в некоторые сплавы, отражатель нейтронов. Hf — поглотитель нейтронов в ядерных реакциях
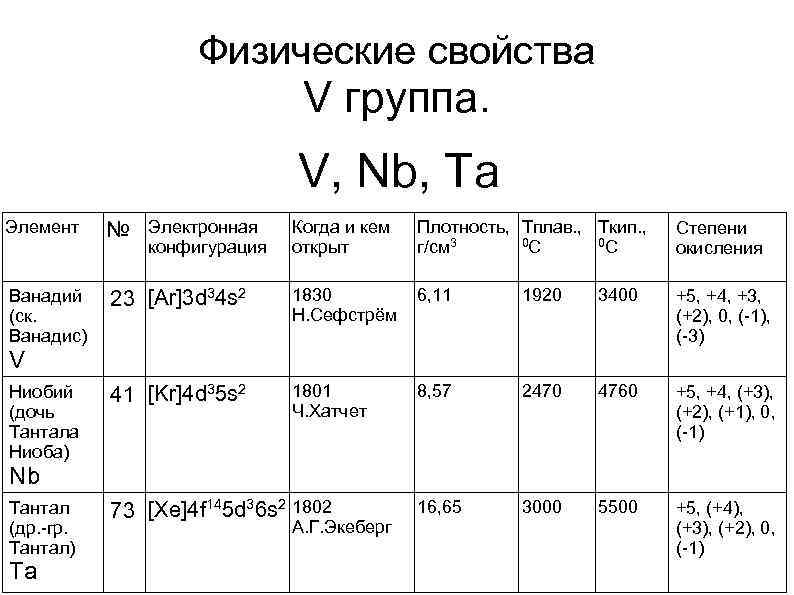 Физические свойства V группа. V, Nb, Ta Элемент № Электронная Когда и кем открыт Плотность, Тплав. , Tкип. , 0 С 0 С г/см 3 Степени окисления Ванадий (ск. Ванадис) 23 [Ar]3 d 34 s 2 1830 Н. Сефстрём 6, 11 1920 3400 +5, +4, +3, (+2), 0, (-1), (-3) Ниобий (дочь Тантала Ниоба) 41 [Kr]4 d 35 s 2 1801 Ч. Хатчет 8, 57 2470 4760 +5, +4, (+3), (+2), (+1), 0, (-1) Тантал (др. -гр. Тантал) 73 [Xe]4 f 145 d 36 s 2 1802 16, 65 3000 5500 +5, (+4), (+3), (+2), 0, (-1) конфигурация V Nb Ta А. Г. Экеберг
Физические свойства V группа. V, Nb, Ta Элемент № Электронная Когда и кем открыт Плотность, Тплав. , Tкип. , 0 С 0 С г/см 3 Степени окисления Ванадий (ск. Ванадис) 23 [Ar]3 d 34 s 2 1830 Н. Сефстрём 6, 11 1920 3400 +5, +4, +3, (+2), 0, (-1), (-3) Ниобий (дочь Тантала Ниоба) 41 [Kr]4 d 35 s 2 1801 Ч. Хатчет 8, 57 2470 4760 +5, +4, (+3), (+2), (+1), 0, (-1) Тантал (др. -гр. Тантал) 73 [Xe]4 f 145 d 36 s 2 1802 16, 65 3000 5500 +5, (+4), (+3), (+2), 0, (-1) конфигурация V Nb Ta А. Г. Экеберг
 Нахождение в природе ● ● V — в коре 0, 014% по массе, основные минералы: патронит VS 4, ванадинит Pb 5(VO 4)3 Cl и еще около 90 других. Nb — в коре 0, 002% по массе, основные минералы: ферроколумбит Fe. Nb 2 O 6 и пр. Ta — 0, 0017% по массе, основные минералы: ферротанталит Fe. Ta 2 O 6 и пр. Тем не менее, данные элементы намного чаще встречаются в виде примесей в иных минералах.
Нахождение в природе ● ● V — в коре 0, 014% по массе, основные минералы: патронит VS 4, ванадинит Pb 5(VO 4)3 Cl и еще около 90 других. Nb — в коре 0, 002% по массе, основные минералы: ферроколумбит Fe. Nb 2 O 6 и пр. Ta — 0, 0017% по массе, основные минералы: ферротанталит Fe. Ta 2 O 6 и пр. Тем не менее, данные элементы намного чаще встречаются в виде примесей в иных минералах.
 Получение в промышленности ● Ванадий чаще всего получают из шлака после обработки железных руд в виде Fe. V 2 O 4: 4 Fe. V 2 O 4+8 Na. Cl+7 O 2 → 8 Na. VO 3+2 Fe 2 O 3+4 Cl 2 (t) 2 Fe. V 2 O 4+9 Cl 2 → 4 VOCl 3+2 Fe. Cl 3+2 O 2 ● (t) Ниобий и тантал также получают из шлака, однако разделяют их фтороводородом: 4 Fe. Nb 2 O 6+64 HF+O 2 → → 4 H 3[Fe. F 6]+8 H 2[Nb. OF 5]+18 H 2 O 4 Fe. Ta 2 O 6+80 HF+O 2 → → 4 H 3[Fe. F 6]+8 H 2[Ta. F 7]+26 H 2 O
Получение в промышленности ● Ванадий чаще всего получают из шлака после обработки железных руд в виде Fe. V 2 O 4: 4 Fe. V 2 O 4+8 Na. Cl+7 O 2 → 8 Na. VO 3+2 Fe 2 O 3+4 Cl 2 (t) 2 Fe. V 2 O 4+9 Cl 2 → 4 VOCl 3+2 Fe. Cl 3+2 O 2 ● (t) Ниобий и тантал также получают из шлака, однако разделяют их фтороводородом: 4 Fe. Nb 2 O 6+64 HF+O 2 → → 4 H 3[Fe. F 6]+8 H 2[Nb. OF 5]+18 H 2 O 4 Fe. Ta 2 O 6+80 HF+O 2 → → 4 H 3[Fe. F 6]+8 H 2[Ta. F 7]+26 H 2 O
 Химические свойства ● ● Металлы также очень инертны, особенно Nb, Ta. Ванадий растворяется только в конц. кислотах, прочие же металлы — только в HF и его смесях: V+6 HNO 3 → VO 2 NO 3+5 NO 2↑+3 H 2 O 2 M+12 HF → 2 H[MF 6]+5 H 2↑ ● Также они растворимы при сплавлении с конц. щелочами в присутствии окислителей : 4 M+5 O 2+12 KOH → 4 K 3 MO 4+6 H 2 O
Химические свойства ● ● Металлы также очень инертны, особенно Nb, Ta. Ванадий растворяется только в конц. кислотах, прочие же металлы — только в HF и его смесях: V+6 HNO 3 → VO 2 NO 3+5 NO 2↑+3 H 2 O 2 M+12 HF → 2 H[MF 6]+5 H 2↑ ● Также они растворимы при сплавлении с конц. щелочами в присутствии окислителей : 4 M+5 O 2+12 KOH → 4 K 3 MO 4+6 H 2 O
 Формы ванадия в растворе ● В зависимости от р. Н ванадий может принимать различные формы: V+5 → VO 2+ → HVO 3 → VO 3 V+4 → VO 2+ → H 2 VO 3 → VO 32 сверх-кислая→нейтральная→щелочная ● ● Кроме того, известен аналогичный оксокатион для V+3 → VO+. Подобные оксокатионы проявляются и у Nb с Ta, но в чуть меньшей степени.
Формы ванадия в растворе ● В зависимости от р. Н ванадий может принимать различные формы: V+5 → VO 2+ → HVO 3 → VO 3 V+4 → VO 2+ → H 2 VO 3 → VO 32 сверх-кислая→нейтральная→щелочная ● ● Кроме того, известен аналогичный оксокатион для V+3 → VO+. Подобные оксокатионы проявляются и у Nb с Ta, но в чуть меньшей степени.
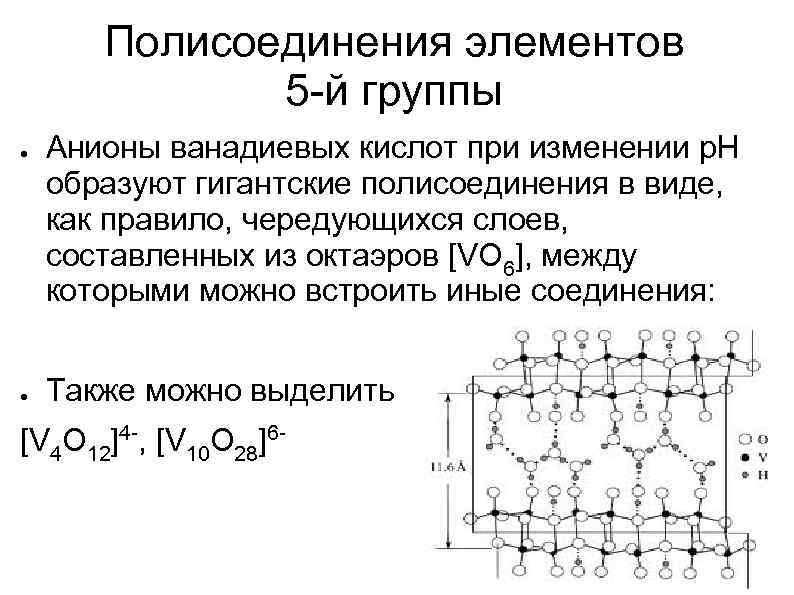 Полисоединения элементов 5 -й группы ● ● Анионы ванадиевых кислот при изменении р. Н образуют гигантские полисоединения в виде, как правило, чередующихся слоев, составленных из октаэров [VO 6], между которыми можно встроить иные соединения: Также можно выделить [V 4 O 12]4 -, [V 10 O 28]6
Полисоединения элементов 5 -й группы ● ● Анионы ванадиевых кислот при изменении р. Н образуют гигантские полисоединения в виде, как правило, чередующихся слоев, составленных из октаэров [VO 6], между которыми можно встроить иные соединения: Также можно выделить [V 4 O 12]4 -, [V 10 O 28]6
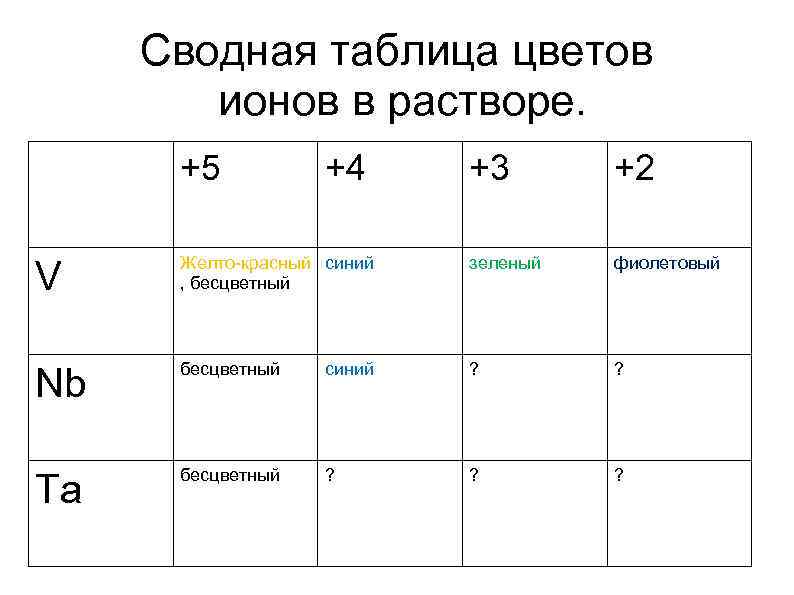 Сводная таблица цветов ионов в растворе. +5 +4 +3 +2 V Желто-красный синий , бесцветный зеленый фиолетовый Nb бесцветный синий ? ? Ta бесцветный ? ? ?
Сводная таблица цветов ионов в растворе. +5 +4 +3 +2 V Желто-красный синий , бесцветный зеленый фиолетовый Nb бесцветный синий ? ? Ta бесцветный ? ? ?
 Применение ● ● V, Nb и Ta часто используются как легирующие добавки к стали, а также иногда в виде отдельных сплавов (феррованадий) и бронз. Производные ванадия также активно используются в катализе, источниках тока и т. п. Соединения ниобия (карбид) изпользуются как антикоррозийные покрытия для турбин самолетов и т. д. Сверхпроводники
Применение ● ● V, Nb и Ta часто используются как легирующие добавки к стали, а также иногда в виде отдельных сплавов (феррованадий) и бронз. Производные ванадия также активно используются в катализе, источниках тока и т. п. Соединения ниобия (карбид) изпользуются как антикоррозийные покрытия для турбин самолетов и т. д. Сверхпроводники
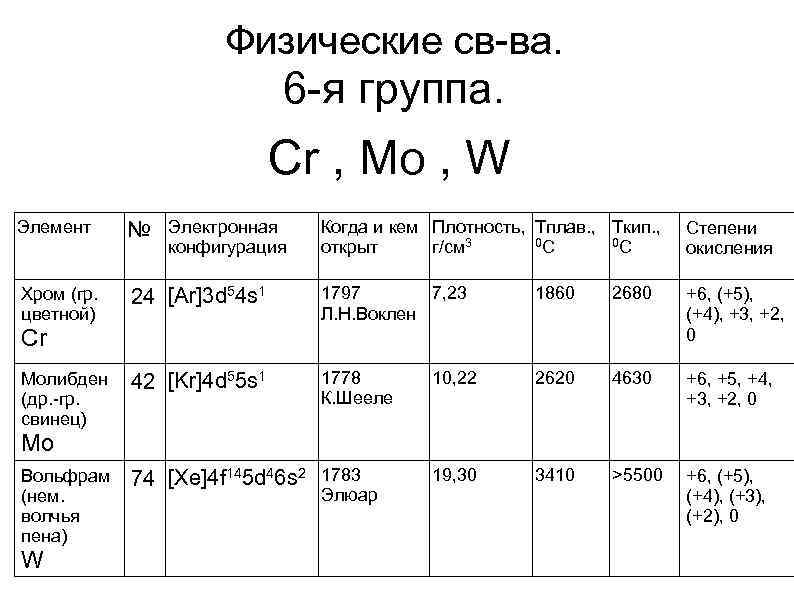 Физические св-ва. 6 -я группа. Cr , Mo , W Элемент № Электронная Когда и кем Плотность, Тплав. , Tкип. , 0 С 0 С открыт г/см 3 Степени окисления Хром (гр. цветной) 24 [Ar]3 d 54 s 1 1797 7, 23 Л. Н. Воклен 1860 2680 +6, (+5), (+4), +3, +2, 0 Молибден (др. -гр. свинец) 42 [Kr]4 d 55 s 1 1778 К. Шееле 10, 22 2620 4630 +6, +5, +4, +3, +2, 0 Вольфрам (нем. волчья пена) 74 [Xe]4 f 145 d 46 s 2 1783 19, 30 3410 >5500 +6, (+5), (+4), (+3), (+2), 0 конфигурация Cr Mo W Элюар
Физические св-ва. 6 -я группа. Cr , Mo , W Элемент № Электронная Когда и кем Плотность, Тплав. , Tкип. , 0 С 0 С открыт г/см 3 Степени окисления Хром (гр. цветной) 24 [Ar]3 d 54 s 1 1797 7, 23 Л. Н. Воклен 1860 2680 +6, (+5), (+4), +3, +2, 0 Молибден (др. -гр. свинец) 42 [Kr]4 d 55 s 1 1778 К. Шееле 10, 22 2620 4630 +6, +5, +4, +3, +2, 0 Вольфрам (нем. волчья пена) 74 [Xe]4 f 145 d 46 s 2 1783 19, 30 3410 >5500 +6, (+5), (+4), (+3), (+2), 0 конфигурация Cr Mo W Элюар
 Нахождение в природе ● ● ● Cr — в коре 0, 035% по массе, основные минералы: хромит Fe. Cr 2 O 4, крокоит Pb. Cr. O 4 и пр. Mo — в коре 3*10 -4% по массе, основные минералы: молибденит Mo. S 2, повеллит Ca. Mo. O 4 и пр. W — 0, 0017% по массе, основные минералы: вольфрамит (Fe, Mn)WO 4, шеелит Ca. WO 4 и пр.
Нахождение в природе ● ● ● Cr — в коре 0, 035% по массе, основные минералы: хромит Fe. Cr 2 O 4, крокоит Pb. Cr. O 4 и пр. Mo — в коре 3*10 -4% по массе, основные минералы: молибденит Mo. S 2, повеллит Ca. Mo. O 4 и пр. W — 0, 0017% по массе, основные минералы: вольфрамит (Fe, Mn)WO 4, шеелит Ca. WO 4 и пр.
 Получение в промышленности ● Технический хром удобно получать из хромита: 4 Fe. Cr 2 O 4+8 Na 2 CO 3+7 O 2 → → 8 Na 2 Cr. O 4+2 Fe 2 O 3+8 CO 2 (t) K 2 Cr 2 O 7+2 C → Cr 2 O 3+K 2 CO 3+CO ● (t) Вольфрам обогащают обычно флотацией, а после этого очищают т. н. щелочным методом: 2 Ca. WO 4+2 Na 2 CO 3+Si. O 2 → → 2 Na 2 WO 4+Ca 2 Si. O 4+2 CO (t)
Получение в промышленности ● Технический хром удобно получать из хромита: 4 Fe. Cr 2 O 4+8 Na 2 CO 3+7 O 2 → → 8 Na 2 Cr. O 4+2 Fe 2 O 3+8 CO 2 (t) K 2 Cr 2 O 7+2 C → Cr 2 O 3+K 2 CO 3+CO ● (t) Вольфрам обогащают обычно флотацией, а после этого очищают т. н. щелочным методом: 2 Ca. WO 4+2 Na 2 CO 3+Si. O 2 → → 2 Na 2 WO 4+Ca 2 Si. O 4+2 CO (t)
 Химические свойства ● Металлы пассивируются в конц. кислотах. ● Хром хорошо растворяется в разб. кислотах: Cr+2 HCl → Cr. Cl 2+H 2 (в отсутствии окислителей) ● Не происходит растворения в щелочах. ● Mo, W инертны по отношению к кислотам ● Все металлы окисляются в щелочных расплавах: M+3 KNO 3+2 KOH → K 2 MO 4+3 KNO 2+H 2 O
Химические свойства ● Металлы пассивируются в конц. кислотах. ● Хром хорошо растворяется в разб. кислотах: Cr+2 HCl → Cr. Cl 2+H 2 (в отсутствии окислителей) ● Не происходит растворения в щелочах. ● Mo, W инертны по отношению к кислотам ● Все металлы окисляются в щелочных расплавах: M+3 KNO 3+2 KOH → K 2 MO 4+3 KNO 2+H 2 O
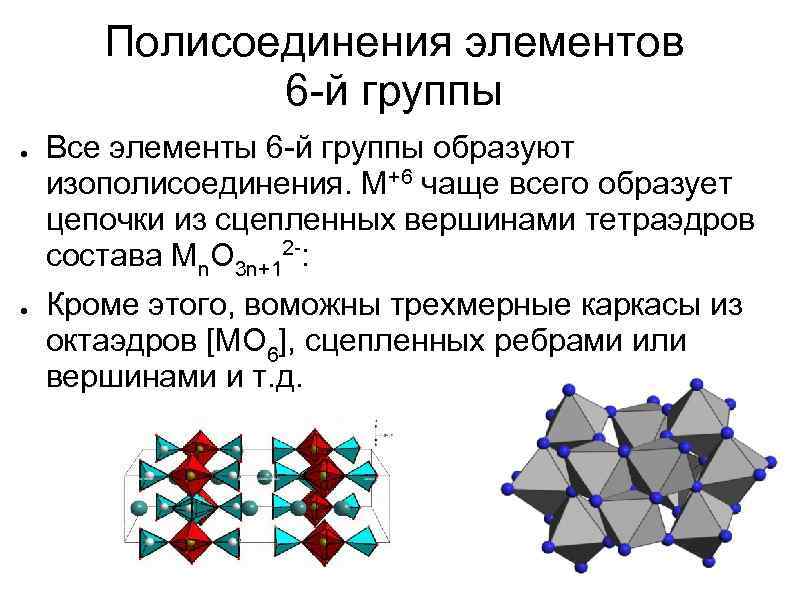 Полисоединения элементов 6 -й группы ● ● Все элементы 6 -й группы образуют изополисоединения. М+6 чаще всего образует цепочки из сцепленных вершинами тетраэдров состава Мn. O 3 n+12 -: Кроме этого, воможны трехмерные каркасы из октаэдров [МO 6], сцепленных ребрами или вершинами и т. д.
Полисоединения элементов 6 -й группы ● ● Все элементы 6 -й группы образуют изополисоединения. М+6 чаще всего образует цепочки из сцепленных вершинами тетраэдров состава Мn. O 3 n+12 -: Кроме этого, воможны трехмерные каркасы из октаэдров [МO 6], сцепленных ребрами или вершинами и т. д.
 Сводная таблица цветов ионов в растворе. +6 +5 +4 +3 +2 Cr Оранжевый, голубой жёлтый зеленый Фиолетовый (зависит от количества) голубой Mo Красный желтый бесцветный синий темнокоричневый черный зеленый оранжевый W Фиолетовый бесцветный желтый красный бурый темнокрасный черный ?
Сводная таблица цветов ионов в растворе. +6 +5 +4 +3 +2 Cr Оранжевый, голубой жёлтый зеленый Фиолетовый (зависит от количества) голубой Mo Красный желтый бесцветный синий темнокоричневый черный зеленый оранжевый W Фиолетовый бесцветный желтый красный бурый темнокрасный черный ?
 Применение ● ● Cr — в металлургии: нержавеющие стали, декоративные покрытия; также зеркала, абразивы; в хим. промышленности: пигменты, катализаторы и т. п. Mo, W — часто используются как добавка к сталям для придания жаропрочностии твердости сплавам, соединения известны как катализаторы. Кроме этого используются в электронике и т. п.
Применение ● ● Cr — в металлургии: нержавеющие стали, декоративные покрытия; также зеркала, абразивы; в хим. промышленности: пигменты, катализаторы и т. п. Mo, W — часто используются как добавка к сталям для придания жаропрочностии твердости сплавам, соединения известны как катализаторы. Кроме этого используются в электронике и т. п.
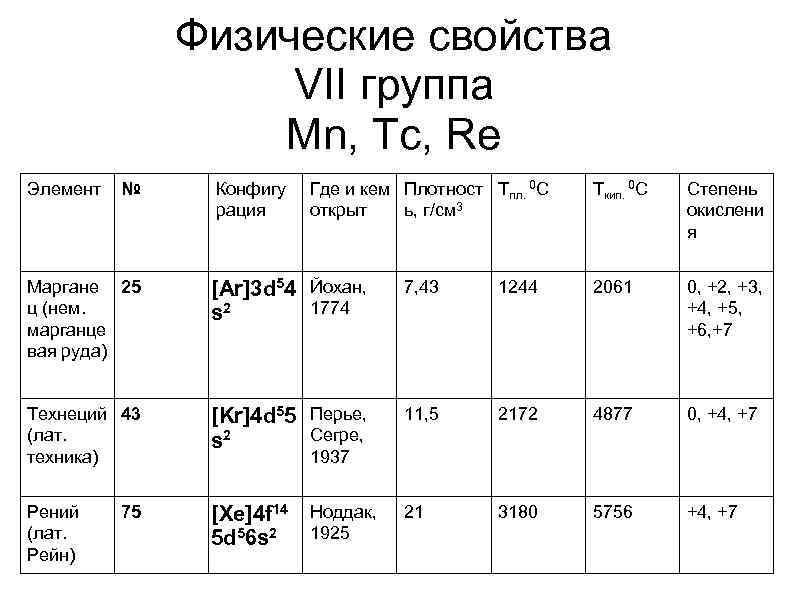 Физические свойства VII группа Mn, Tc, Re Элемент № Конфигу рация Где и кем Плотност Tпл. 0 С открыт ь, г/см 3 Tкип. 0 С Степень окислени я Маргане 25 ц (нем. марганце вая руда) [Ar]3 d 54 Йохан, 1774 s 2 7, 43 1244 2061 0, +2, +3, +4, +5, +6, +7 Технеций 43 (лат. техника) [Kr]4 d 55 Перье, Сегре, s 2 11, 5 2172 4877 0, +4, +7 Рений (лат. Рейн) [Xe]4 f 14 Ноддак, 5 d 56 s 2 1925 21 3180 5756 +4, +7 75 1937
Физические свойства VII группа Mn, Tc, Re Элемент № Конфигу рация Где и кем Плотност Tпл. 0 С открыт ь, г/см 3 Tкип. 0 С Степень окислени я Маргане 25 ц (нем. марганце вая руда) [Ar]3 d 54 Йохан, 1774 s 2 7, 43 1244 2061 0, +2, +3, +4, +5, +6, +7 Технеций 43 (лат. техника) [Kr]4 d 55 Перье, Сегре, s 2 11, 5 2172 4877 0, +4, +7 Рений (лат. Рейн) [Xe]4 f 14 Ноддак, 5 d 56 s 2 1925 21 3180 5756 +4, +7 75 1937
 Нахождение в природе • Mn – в коре 0, 1% по массе, основные минералы: пиролюзит Mn. O 2 • Tc – синтетический элемент • Re – в коре 7∙ 10 -8% по массе, рассеянный элемент (примесь молибденита), основной минерал: Cu. Re. S 4 – джезказганит.
Нахождение в природе • Mn – в коре 0, 1% по массе, основные минералы: пиролюзит Mn. O 2 • Tc – синтетический элемент • Re – в коре 7∙ 10 -8% по массе, рассеянный элемент (примесь молибденита), основной минерал: Cu. Re. S 4 – джезказганит.
 Получение в промышленности • Mn – восстановление пиролюзита при нагревании: 4 Mn. O 2=2 Mn 2 O 3 + O 2; Mn 2 O 3 + 2 Al = 2 Mn + Al 2 O 3 • Tc – получают из радиоактивных отходов промышленности • Re – обжиг минералов с последующим восстановлением: 4 Re. S 2+15 O 2=2 Re 2 O 7+8 SO 2; Re 2 O 7+7 H 2=2 Re+7 H 2 O
Получение в промышленности • Mn – восстановление пиролюзита при нагревании: 4 Mn. O 2=2 Mn 2 O 3 + O 2; Mn 2 O 3 + 2 Al = 2 Mn + Al 2 O 3 • Tc – получают из радиоактивных отходов промышленности • Re – обжиг минералов с последующим восстановлением: 4 Re. S 2+15 O 2=2 Re 2 O 7+8 SO 2; Re 2 O 7+7 H 2=2 Re+7 H 2 O
 Химические свойства • В высших степенях окисления – сильные окислительные свойства, в низших – практически не проявляют восстановительных • Марганец растворим в кислотах достаточно быстро, рений – гораздо медленнее • С щелочами марганец реагирует только в присутствии окислителей
Химические свойства • В высших степенях окисления – сильные окислительные свойства, в низших – практически не проявляют восстановительных • Марганец растворим в кислотах достаточно быстро, рений – гораздо медленнее • С щелочами марганец реагирует только в присутствии окислителей
 Сводная таблица цветов ионов в растворе • Тут с таблицей будет неудобно, так как рений и технеций в растворах являются бесцветными, а марганец проявляет самую различную окраску: +2 – бесцветный раствор (в твёрдом – очень слабо-розовый), +4 – бурый, +5 – синий (в сильнощелочных средах), +6 – зелёный, +7 – от розового до фиолетового (в зависимости от концентрации ионов)
Сводная таблица цветов ионов в растворе • Тут с таблицей будет неудобно, так как рений и технеций в растворах являются бесцветными, а марганец проявляет самую различную окраску: +2 – бесцветный раствор (в твёрдом – очень слабо-розовый), +4 – бурый, +5 – синий (в сильнощелочных средах), +6 – зелёный, +7 – от розового до фиолетового (в зависимости от концентрации ионов)
 Применение • Марганец: добавки в стали с самыми различными свойствами – прочность, износоустойчивость ит. д. Оксид марганца применяется в элементах Лекланше. Применение в органическом синтезе. • Технеций: источник излучения в медицине • Рений: высокая каталитическая способность, добавки к сталям повышают их жаропрочность, использование в высокостойких термопарах.
Применение • Марганец: добавки в стали с самыми различными свойствами – прочность, износоустойчивость ит. д. Оксид марганца применяется в элементах Лекланше. Применение в органическом синтезе. • Технеций: источник излучения в медицине • Рений: высокая каталитическая способность, добавки к сталям повышают их жаропрочность, использование в высокостойких термопарах.
