Круговые процессы (циклы ) Круговыми процессами называются замкнутые




















































lekciya_7-10.ppt
- Размер: 964.0 Кб
- Автор: Anastasia Verteletskaya
- Количество слайдов: 67
Описание презентации Круговые процессы (циклы ) Круговыми процессами называются замкнутые по слайдам
 Круговые процессы (циклы ) Круговыми процессами называются замкнутые процессы, характеризующиеся возвратом системы (рабочих тел) в исход-ное состояние, то есть в исходное состояние возвращаются параметры состояния, а значить интегральное изменение любой функции состояния равно нулю: 0 dz где z = p ; V(v); Т; U (и); H ( h ) и т. п. Круговые процессы, как периодически повторяющиеся, реализуются в тепловых машинах ( тепловых двигателях и холодильных машинах) и называются циклами. Различают прямые и обратные циклы. Те и другие могут быть обратимые и реальные.
Круговые процессы (циклы ) Круговыми процессами называются замкнутые процессы, характеризующиеся возвратом системы (рабочих тел) в исход-ное состояние, то есть в исходное состояние возвращаются параметры состояния, а значить интегральное изменение любой функции состояния равно нулю: 0 dz где z = p ; V(v); Т; U (и); H ( h ) и т. п. Круговые процессы, как периодически повторяющиеся, реализуются в тепловых машинах ( тепловых двигателях и холодильных машинах) и называются циклами. Различают прямые и обратные циклы. Те и другие могут быть обратимые и реальные.
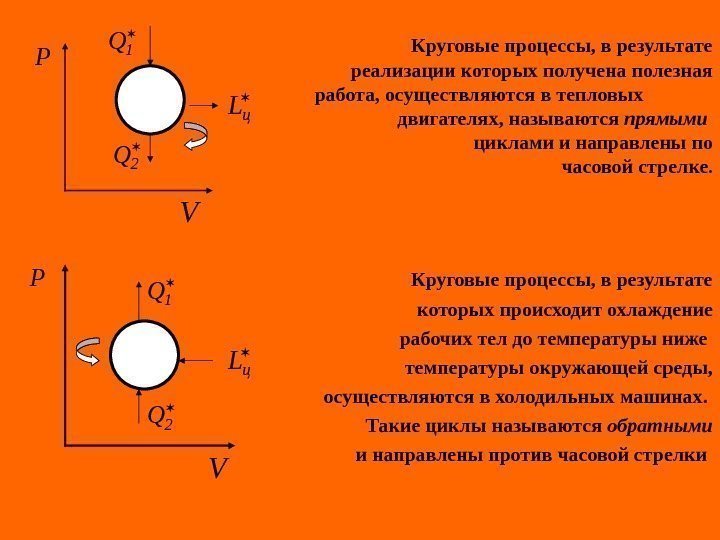
 Круговые процессы, в результате реализации которых получена полезная работа, осуществляются в тепловых двигателях, называются прямыми циклами и направлены по часовой стрелке. Круговые процессы, в результате которых происходит охлаждение рабочих тел до температуры ниже температуры окружающей среды, осуществляются в холодильных машинах. Такие циклы называются обратными и направлены против часовой стрелки P V 1 Q 2 Q ц. L P V 1 Q 2 Q ц L
Круговые процессы, в результате реализации которых получена полезная работа, осуществляются в тепловых двигателях, называются прямыми циклами и направлены по часовой стрелке. Круговые процессы, в результате которых происходит охлаждение рабочих тел до температуры ниже температуры окружающей среды, осуществляются в холодильных машинах. Такие циклы называются обратными и направлены против часовой стрелки P V 1 Q 2 Q ц. L P V 1 Q 2 Q ц L
 Выражение первого начала термодинамики по внешнему балансу для цикла записывается в следующем виде : С учетом того, что для кругового процесса получаем выражение первого начала термодинамики для кругового процесса Интегральные значения количества теплоты и работы в круговом процессе могут быть представлены в виде ** Ld. UQ 0 d. U ** LQ * Q * L ; QQQ 21 * . сж. расц* LLLL
Выражение первого начала термодинамики по внешнему балансу для цикла записывается в следующем виде : С учетом того, что для кругового процесса получаем выражение первого начала термодинамики для кругового процесса Интегральные значения количества теплоты и работы в круговом процессе могут быть представлены в виде ** Ld. UQ 0 d. U ** LQ * Q * L ; QQQ 21 * . сж. расц* LLLL
 Окончательно выражение первого начала термодинами- ки по внешнему балансу для цикла записывается в следующем виде : В циклах тепловых двигателей работа положительна , а в циклах холодильных машин — работа цикла отрицательна ; при этом для них справедливо условие . Различают три вида циклов тепловых машин: реальные , обратимые и термодинамические. 21 * ц. QQL )0 L( * ц 21 QQ
Окончательно выражение первого начала термодинами- ки по внешнему балансу для цикла записывается в следующем виде : В циклах тепловых двигателей работа положительна , а в циклах холодильных машин — работа цикла отрицательна ; при этом для них справедливо условие . Различают три вида циклов тепловых машин: реальные , обратимые и термодинамические. 21 * ц. QQL )0 L( * ц 21 QQ
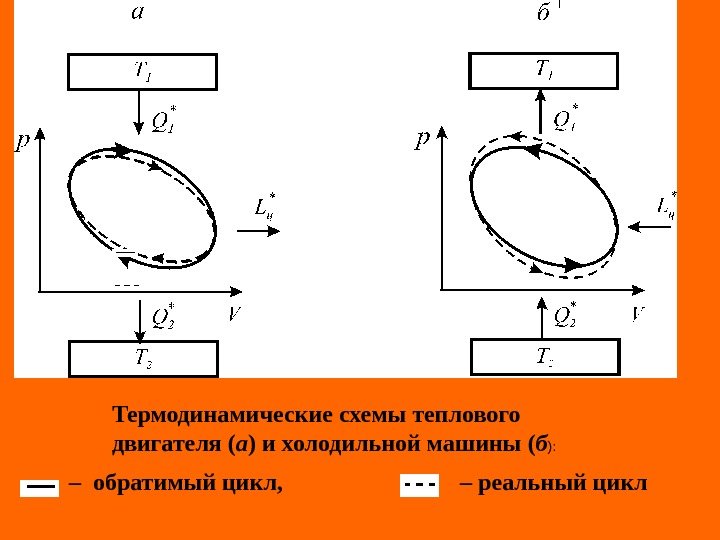
 Термодинамические схемы теплового двигателя ( а ) и холодильной машины ( б ): – обратимый цикл, – реальный цикл
Термодинамические схемы теплового двигателя ( а ) и холодильной машины ( б ): – обратимый цикл, – реальный цикл
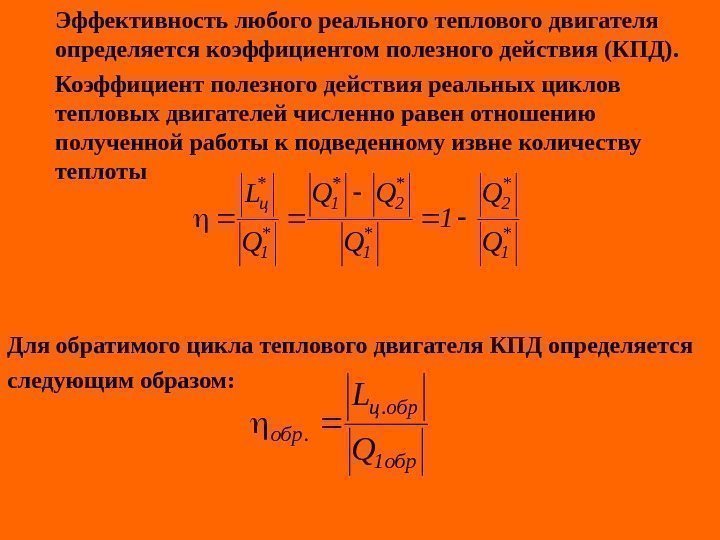
 Эффективность любого реального теплового двигателя определяется коэффициентом полезного действия (КПД). Коэффициент полезного действия реальных циклов тепловых двигателей численно равен отношению полученной работы к подведенному извне количеству теплоты Для обратимого цикла теплового двигателя КПД определяется c ледующим образом: * 1 * 2* 1 * 1* ц. Q Q 1 Q QQ Q L обр1 обр. ц. обр Q L
Эффективность любого реального теплового двигателя определяется коэффициентом полезного действия (КПД). Коэффициент полезного действия реальных циклов тепловых двигателей численно равен отношению полученной работы к подведенному извне количеству теплоты Для обратимого цикла теплового двигателя КПД определяется c ледующим образом: * 1 * 2* 1 * 1* ц. Q Q 1 Q QQ Q L обр1 обр. ц. обр Q L
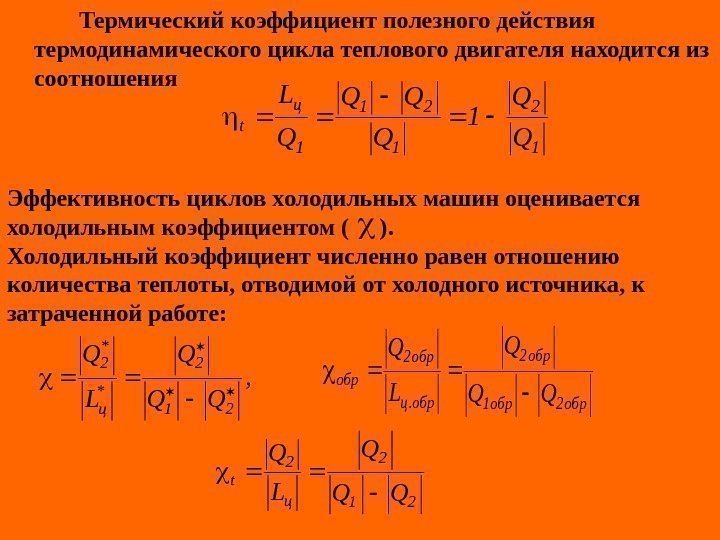
 Термический коэффициент полезного действия термодинамического цикла теплового двигателя находится из соотношения 1 21 1 ц t Q Q 1 Q QQ Q L Эффективность циклов х олодильных машин оценивается холодильным коэффициентом ( ). Холодильный коэффициент численно равен отношению количества теплоты, отводимой от холодного источника, к затраченной работе : , QQ Q L Q 21 2 * ц * 2 обр2 обр1 обр2 обр. ц обр2 обр QQ Q L Q 21 2 ц 2 t QQ Q L Q
Термический коэффициент полезного действия термодинамического цикла теплового двигателя находится из соотношения 1 21 1 ц t Q Q 1 Q QQ Q L Эффективность циклов х олодильных машин оценивается холодильным коэффициентом ( ). Холодильный коэффициент численно равен отношению количества теплоты, отводимой от холодного источника, к затраченной работе : , QQ Q L Q 21 2 * ц * 2 обр2 обр1 обр2 обр. ц обр2 обр QQ Q L Q 21 2 ц 2 t QQ Q L Q
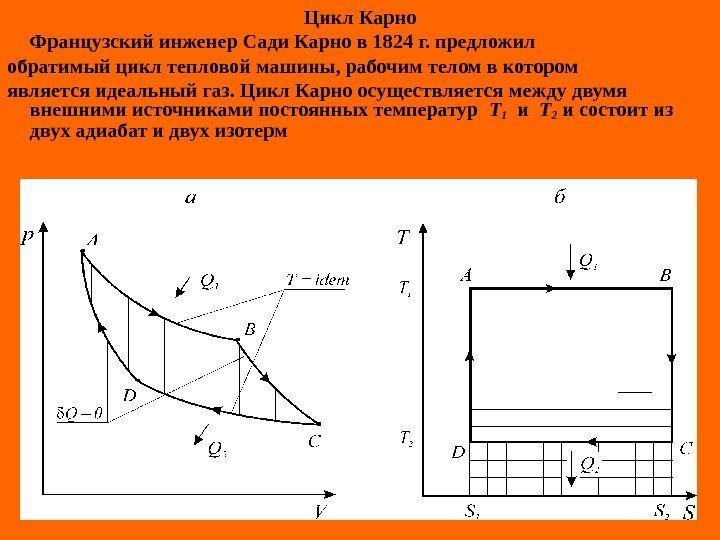
 Цикл Карно Французский инженер Сади Карно в 1824 г. предложил обратимый цикл тепловой машины, рабочим телом в котором является идеальный газ. Цикл Карно осуществляется между двумя внешними источниками постоянных температур Т 1 и Т 2 и состоит из двух адиабат и двух изотерм
Цикл Карно Французский инженер Сади Карно в 1824 г. предложил обратимый цикл тепловой машины, рабочим телом в котором является идеальный газ. Цикл Карно осуществляется между двумя внешними источниками постоянных температур Т 1 и Т 2 и состоит из двух адиабат и двух изотерм
 Согласно принципу существования энтропии для идеальных газов ( ) интегральные количество подве- денной и отведенной теплоты в цикле Карно может быть определено из следующих соотношений: Td. SQ B A 11 d. STQ B A 1 d. ST AB 1 SST C D 22 d. STQ C D 2 d. STDC 2 SST d. S = 0 , SSSSSDCAB ST 1 ST 2 , T T 1 ST S)TT( Q QQ Q L 12 1 21 11 1 ц K t 21 2 K t TT T
Согласно принципу существования энтропии для идеальных газов ( ) интегральные количество подве- денной и отведенной теплоты в цикле Карно может быть определено из следующих соотношений: Td. SQ B A 11 d. STQ B A 1 d. ST AB 1 SST C D 22 d. STQ C D 2 d. STDC 2 SST d. S = 0 , SSSSSDCAB ST 1 ST 2 , T T 1 ST S)TT( Q QQ Q L 12 1 21 11 1 ц K t 21 2 K t TT T
 Второе начало термодинамики Как отмечалось выше, первое начало термодинамики представляет собой количественное выражение закона сохранения и превращения энергии, оно позволяет составить энергетический баланс исследуемых процессов, но не определяет направление их протекания. Условия осуществления и направленности протекания процессов определяются на основании второго начала термодинамики. В совокупности первое и второе начало термодинамики являются фундаментом в построении теории тепловых машин и технической термодинамики в целом. Второе начало классической термодинамики обычно формулируется как объединенный принцип существования и возрастания некоторой функции состояния тел и сложных систем, названной энтропией : T Q d. S Знак равенства соответствует обратимому процессу, а неравенства реальному процессу 0 T Q d. Sизол
Второе начало термодинамики Как отмечалось выше, первое начало термодинамики представляет собой количественное выражение закона сохранения и превращения энергии, оно позволяет составить энергетический баланс исследуемых процессов, но не определяет направление их протекания. Условия осуществления и направленности протекания процессов определяются на основании второго начала термодинамики. В совокупности первое и второе начало термодинамики являются фундаментом в построении теории тепловых машин и технической термодинамики в целом. Второе начало классической термодинамики обычно формулируется как объединенный принцип существования и возрастания некоторой функции состояния тел и сложных систем, названной энтропией : T Q d. S Знак равенства соответствует обратимому процессу, а неравенства реальному процессу 0 T Q d. Sизол
 Н. И. Белоконь справедливо заметил, что принципы существования и возрастании энтропии различны по содержанию и значимости и предложил рассматривать эти принципы раздельно. Принцип существования энтропии справедлив для равновесных термодинамических систем и распространяется на любые процессы – обратимые и необратимые. Принцип существования энтропии и абсолютной температуры как термодинамических функций состояния равновесных систем, по терминологии проф. Н. И. Белоконь, был назван вторым началом термостатики. Принцип возрастания энтропии характеризует только наиболее вероятное направление течения реальных процессов и, следовательно, имеет несомненно меньшую область применения, чем принцип существования энтропии. Принцип возрастания энтропии изолированных систем при протекании в них реальных процессов Н. И. Белоконь назвал вторым началом термодинамики.
Н. И. Белоконь справедливо заметил, что принципы существования и возрастании энтропии различны по содержанию и значимости и предложил рассматривать эти принципы раздельно. Принцип существования энтропии справедлив для равновесных термодинамических систем и распространяется на любые процессы – обратимые и необратимые. Принцип существования энтропии и абсолютной температуры как термодинамических функций состояния равновесных систем, по терминологии проф. Н. И. Белоконь, был назван вторым началом термостатики. Принцип возрастания энтропии характеризует только наиболее вероятное направление течения реальных процессов и, следовательно, имеет несомненно меньшую область применения, чем принцип существования энтропии. Принцип возрастания энтропии изолированных систем при протекании в них реальных процессов Н. И. Белоконь назвал вторым началом термодинамики.
 Второе начало термостатики В качестве постулата второго начала термостатики используется утверждение, что «температура есть единственная функция состояния, определяющая направление самопроизвольного теплообмена» или между телами не находящихся в тепловом равновесии невозможен одновременный самопроизвольный теплообмен в противоположных направлениях. Непосредственно из пастулата следуют три следствия, каждое из которых позволяет получить математическое выражение второго начала термостатики-принципа существования энтропии и абсолютной температуры. Например два тела находящиеся в тепловом равновесии и образующие адиабатическую систему возвращаются в исходное состояние одновременно.
Второе начало термостатики В качестве постулата второго начала термостатики используется утверждение, что «температура есть единственная функция состояния, определяющая направление самопроизвольного теплообмена» или между телами не находящихся в тепловом равновесии невозможен одновременный самопроизвольный теплообмен в противоположных направлениях. Непосредственно из пастулата следуют три следствия, каждое из которых позволяет получить математическое выражение второго начала термостатики-принципа существования энтропии и абсолютной температуры. Например два тела находящиеся в тепловом равновесии и образующие адиабатическую систему возвращаются в исходное состояние одновременно.
 AIAII. . . I I t. II
AIAII. . . I I t. II
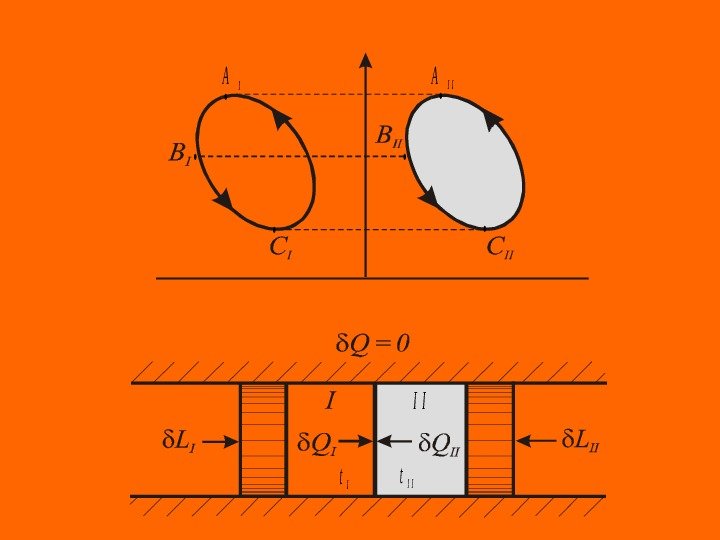
 Рассмотрим адиабатно изолированную систему, состоящую из термически сопряженных тел. Первое тело ( I ) – любое тело (например, реальный газ), совершает произвольные процессы — обратимые и необратимые, второе тело ( II ) – контрольное тело — идеальный газ, совершает обратимый круговой процесс. Оба тела в каждый момент имеют одинаковую температуру ( t. I = t. II = t ). Первое и второе тело осуществляют разнообразные процессы изменения состояния, к ним извне подводится (или отводится) работа, между телами происходит теплообмен, но для адиабатно изолированной системы выполняется обязательное условие 0 QQQIII
Рассмотрим адиабатно изолированную систему, состоящую из термически сопряженных тел. Первое тело ( I ) – любое тело (например, реальный газ), совершает произвольные процессы — обратимые и необратимые, второе тело ( II ) – контрольное тело — идеальный газ, совершает обратимый круговой процесс. Оба тела в каждый момент имеют одинаковую температуру ( t. I = t. II = t ). Первое и второе тело осуществляют разнообразные процессы изменения состояния, к ним извне подводится (или отводится) работа, между телами происходит теплообмен, но для адиабатно изолированной системы выполняется обязательное условие 0 QQQIII
 Разделив на некоторую функцию, зависящую только от температуры ( t ). С учетом равенства температур двух тел получаем Так как тела I и II возвращаются в исходное состояние одновременно (согласно теореме теплового равновесия тел в равновесных круговых процессах) последнее уравнение можно интегрировать по замкнутому контуру Второй интеграл для идеального газа, как интеграл функции состояния, равен нулю ( t. II ) = TII 0 )t( Q II II I I 0 d. S T Q )t( Q II II
Разделив на некоторую функцию, зависящую только от температуры ( t ). С учетом равенства температур двух тел получаем Так как тела I и II возвращаются в исходное состояние одновременно (согласно теореме теплового равновесия тел в равновесных круговых процессах) последнее уравнение можно интегрировать по замкнутому контуру Второй интеграл для идеального газа, как интеграл функции состояния, равен нулю ( t. II ) = TII 0 )t( Q II II I I 0 d. S T Q )t( Q II II
 следовательно и первый интеграл равен нулю Как известно если круговой интеграл равен нулю это значит, что подынтегральное выражение представляет из себя полный дифференциал некоторой функции состояния, названной энтропией ( S ), а функция ( t. I ) является интегрирующим делителем Так как тело I — любое тело полученное выражение распространяется на все равновесные процессы изменения состояния любых систем. 0 )t( Q I I I I d. S T Q )t( Q
следовательно и первый интеграл равен нулю Как известно если круговой интеграл равен нулю это значит, что подынтегральное выражение представляет из себя полный дифференциал некоторой функции состояния, названной энтропией ( S ), а функция ( t. I ) является интегрирующим делителем Так как тело I — любое тело полученное выражение распространяется на все равновесные процессы изменения состояния любых систем. 0 )t( Q I I I I d. S T Q )t( Q
 Выбранная функция ( t ) , которая не зависит от вида тел, называется абсолютной температурой ( t )= Т. Таким образом, получаем математическое выражение второго начала термостатики — принципа существования энтропии и абсолютной температуры для любых равновесных систем и для 1 кг системы Следствия второго начала термостатики широко применяются в термодинамических расчетах и формули-руются на основе анализа его математического выражения T QQ T Q d. S *** T qq T q ds ***
Выбранная функция ( t ) , которая не зависит от вида тел, называется абсолютной температурой ( t )= Т. Таким образом, получаем математическое выражение второго начала термостатики — принципа существования энтропии и абсолютной температуры для любых равновесных систем и для 1 кг системы Следствия второго начала термостатики широко применяются в термодинамических расчетах и формули-руются на основе анализа его математического выражения T QQ T Q d. S *** T qq T q ds ***
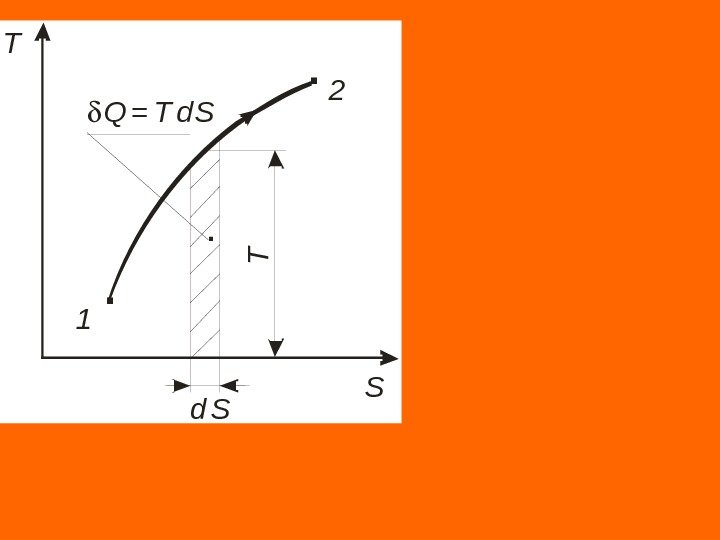
 Следствие I. Совместное выражение первого начала термодинамики и второго начала термостатики позволяет получить дифференциальное уравнение термодинамики, которое связывает между собой все термодинамические свойства веществ Следствие II. Координаты Т — S являются универсальными координатами термодинамического теплообмена. Исходя из математического выражения второго начала термостатики площадь под кривой элементарного участка процесса равна подводимому (отводимому) количеству теплоты d. Pv d. P dh d. Tcdvp dv du d. Tc. Tds. Tp T v Q = T d. S.
Следствие I. Совместное выражение первого начала термодинамики и второго начала термостатики позволяет получить дифференциальное уравнение термодинамики, которое связывает между собой все термодинамические свойства веществ Следствие II. Координаты Т — S являются универсальными координатами термодинамического теплообмена. Исходя из математического выражения второго начала термостатики площадь под кривой элементарного участка процесса равна подводимому (отводимому) количеству теплоты d. Pv d. P dh d. Tcdvp dv du d. Tc. Tds. Tp T v Q = T d. S.
 T S. . d S 1 2 T Q = T d S .
T S. . d S 1 2 T Q = T d S .

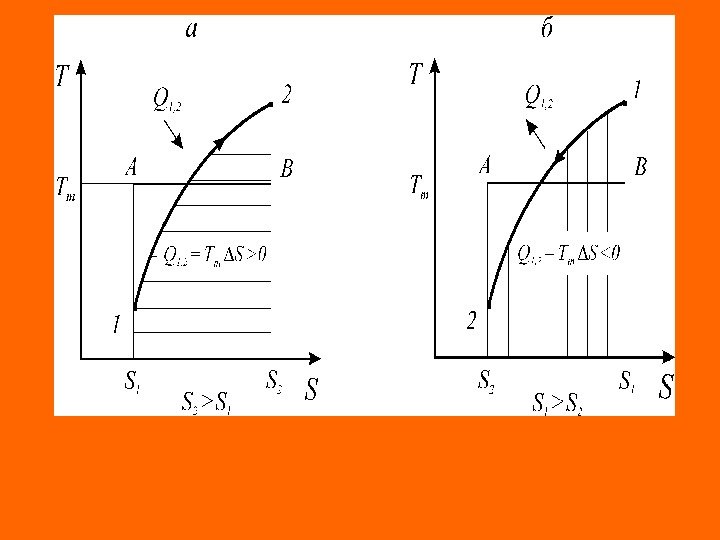
 Следствие III. Адиабатный процесс является процессом изоэнтропийным. Так как в адиабатном процессе теплообмен отсутствует ( Q = 0 ), то, согласно второму началу термостатики, в таком процессе изменение энтропии d. S = 0 ( S = idem ). Согласно этому следствию, показатель адиабатного процесса ( k ) равен показателю изоэнтропийного процесса ( ns ) Следствие IV. Коэффициент полезного действия и холодильный коэффициент термодинамических циклов тепловых машин не зависят от вида цикла и природы рабочего тела, а определяются лишь средними абсолютными температурами рабочего тела в процессах подвода и отвода теплоты. , TT — 1 QQ 1 m 2 1 2 t 2 m 1 m 2 m 21 2 t TT T QQ Q
Следствие III. Адиабатный процесс является процессом изоэнтропийным. Так как в адиабатном процессе теплообмен отсутствует ( Q = 0 ), то, согласно второму началу термостатики, в таком процессе изменение энтропии d. S = 0 ( S = idem ). Согласно этому следствию, показатель адиабатного процесса ( k ) равен показателю изоэнтропийного процесса ( ns ) Следствие IV. Коэффициент полезного действия и холодильный коэффициент термодинамических циклов тепловых машин не зависят от вида цикла и природы рабочего тела, а определяются лишь средними абсолютными температурами рабочего тела в процессах подвода и отвода теплоты. , TT — 1 QQ 1 m 2 1 2 t 2 m 1 m 2 m 21 2 t TT T QQ Q
 Следствие V. Коэффициент полезного действия и холо- дильный коэффициент цикла Карно всегда выше этих коэф- фициентов эффективности для любых других термодинами- ческих циклов тепловых машин, осуществляемых в одинако- вом диапазоне предельных температур рабочего тела ( Т 1 , Т 2 ). Следствие VI. Изменение энтропии системы равно сумме изменений энтропии всех тел, входящих в систему (теорема аддитивности энтропии). , t K t r 1 i id. S T Q Q T 1 T Q d. S, T Q d. S , d. S T Q T QQ T Q d. S
Следствие V. Коэффициент полезного действия и холо- дильный коэффициент цикла Карно всегда выше этих коэф- фициентов эффективности для любых других термодинами- ческих циклов тепловых машин, осуществляемых в одинако- вом диапазоне предельных температур рабочего тела ( Т 1 , Т 2 ). Следствие VI. Изменение энтропии системы равно сумме изменений энтропии всех тел, входящих в систему (теорема аддитивности энтропии). , t K t r 1 i id. S T Q Q T 1 T Q d. S, T Q d. S , d. S T Q T QQ T Q d. S
 Следствие VII. Абсолютная температура равновесной термодинамической системы определяется как первая частная производная внутренней энергии или энтальпии по энтропии при постояных значениях деформационных координатpvs h T, s u T
Следствие VII. Абсолютная температура равновесной термодинамической системы определяется как первая частная производная внутренней энергии или энтальпии по энтропии при постояных значениях деформационных координатpvs h T, s u T
 Второе начало термодинамики и его следствия Все явления природы, связанные с превращением энергии имеют необратимый характер. Обобщающим законом необратимости процессов в природе является принцип возрастания энтропии изолированных систем. В основу второго начала термодинамики положен постулат: работа может быть непосредственно и полностью превращена в теплоту путем трения или электронагрева. Эти формулировка подчеркивает специфичность теплоты при ее превращениях. В теплоту полностью превращаются все виды энергии. Превращения же теплоты всегда сопровождаются процессами, компенсирующими эти превращения. В тепловом двигателе такой компенсацией является передача некоторой части теплоты источнику низшей температуры (холодному источнику); в холодильных машинах такой компенсацией являются затраты работы. Анализ постулата второго начала термодинамики приводит к некоторым весьма важным следствиям.
Второе начало термодинамики и его следствия Все явления природы, связанные с превращением энергии имеют необратимый характер. Обобщающим законом необратимости процессов в природе является принцип возрастания энтропии изолированных систем. В основу второго начала термодинамики положен постулат: работа может быть непосредственно и полностью превращена в теплоту путем трения или электронагрева. Эти формулировка подчеркивает специфичность теплоты при ее превращениях. В теплоту полностью превращаются все виды энергии. Превращения же теплоты всегда сопровождаются процессами, компенсирующими эти превращения. В тепловом двигателе такой компенсацией является передача некоторой части теплоты источнику низшей температуры (холодному источнику); в холодильных машинах такой компенсацией являются затраты работы. Анализ постулата второго начала термодинамики приводит к некоторым весьма важным следствиям.
 Следствие I. Невозможно осуществление полного превращения теплоты работу, т. е. нельзя создать вечный двигатель второго рода ( Perpetuum mobile II рода) с коэффициентом полезного действия равным единице Следствие II. КПД реального теплового двигателя и холодильный коэффициент реальной холодильной машины, в которых осуществляются циклы при температурах внешних источников Т 1 и Т 2 , всегда меньше КПД и холодильного коэффициента обратимых тепловых машин, циклы в которых осуществляются между теми же внешними источниками < обр ; < обр 1 QQ 1 *
Следствие I. Невозможно осуществление полного превращения теплоты работу, т. е. нельзя создать вечный двигатель второго рода ( Perpetuum mobile II рода) с коэффициентом полезного действия равным единице Следствие II. КПД реального теплового двигателя и холодильный коэффициент реальной холодильной машины, в которых осуществляются циклы при температурах внешних источников Т 1 и Т 2 , всегда меньше КПД и холодильного коэффициента обратимых тепловых машин, циклы в которых осуществляются между теми же внешними источниками < обр ; < обр 1 QQ 1 *
 Следствие III. Абсолютный нуль по термодинамической абсолютной шкале температур (шкала Кельвина) недостижим ( ). Поскольку КПД любого теплового двигателя и даже работающего по эталонному циклу Карно всегда меньше 1 и в случае, если горячий источник теплоты имеет положительную температуру по термодинамической абсолютной шкале температур ( ), справедливо утверждение 1 T T 1 1 2 К t 0 T 1 K 0 T 0 T
Следствие III. Абсолютный нуль по термодинамической абсолютной шкале температур (шкала Кельвина) недостижим ( ). Поскольку КПД любого теплового двигателя и даже работающего по эталонному циклу Карно всегда меньше 1 и в случае, если горячий источник теплоты имеет положительную температуру по термодинамической абсолютной шкале температур ( ), справедливо утверждение 1 T T 1 1 2 К t 0 T 1 K 0 T 0 T
 Математическое выражение второго начала термодинамики При наличии второго начала термостатики (принцип существования энтропии) итоговое математическое выражение второго начала термодинамики(принци возрастания энтропии) в дифференциальной и интегральной формах , как принципа возрастания энтропии систем имеет следующий вид: Знак неравенства справедлив в случае реальных (необратимых) процессов, а равенства –обратимых процессов. T Q d. S* 2 1 * 122, 1 T Q SSS
Математическое выражение второго начала термодинамики При наличии второго начала термостатики (принцип существования энтропии) итоговое математическое выражение второго начала термодинамики(принци возрастания энтропии) в дифференциальной и интегральной формах , как принципа возрастания энтропии систем имеет следующий вид: Знак неравенства справедлив в случае реальных (необратимых) процессов, а равенства –обратимых процессов. T Q d. S* 2 1 * 122, 1 T Q SSS
 Если совместить математические выражения второго начала термостатики и второго начала термодинамики то получается следующее соотношение: T QQ T Q d. S *** T Q d. S * T QQ T Q d. S *** 0 T Q d. S **
Если совместить математические выражения второго начала термостатики и второго начала термодинамики то получается следующее соотношение: T QQ T Q d. S *** T Q d. S * T QQ T Q d. S *** 0 T Q d. S **
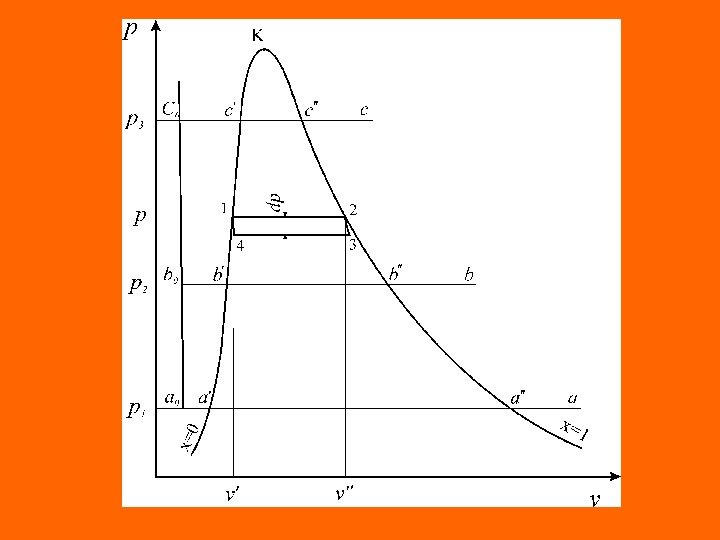
 Пары и парообразование Процесс парообразования. Основные определения Процесс парообразования и методика определения основных характеристик процесса парообразования для всех жидкостей практически аналогичны, что дает возможность рассматривать процесс парообразования на примере воды, как одного из наиболее распространенных веществ в природе. Рассмотрим изобарный процесс парообразования 1 кг воды в координатах р – v
Пары и парообразование Процесс парообразования. Основные определения Процесс парообразования и методика определения основных характеристик процесса парообразования для всех жидкостей практически аналогичны, что дает возможность рассматривать процесс парообразования на примере воды, как одного из наиболее распространенных веществ в природе. Рассмотрим изобарный процесс парообразования 1 кг воды в координатах р – v

 Процесс кипения протекает на участке а’- а» при постоянном давлении р1 и постоянной температуре ts 1. В точке ( а» ) вода полностью испаряется. Пар в этом состоянии называется сухим насыщенным. На участке ( а’-а» ) вода находится в двух фазах и состоит из смеси кипящей воды и сухого насыщенного пара. Эта двухфазная равновесная система называется насыщенным ( влажным ) паром. При дальнейшем изобарном подводе теплоты сухой насыщенный пар превращается в перегретый ( а ). Перегретый пар имеет температуру выше температуры кипения (насыщения) при данном давлении. Точки на линии a «- b «-с» характеризуют состояние сухого насыщенного пара, а кривая определяет зависимость удельного объема сухого пара от давления = f(p) и называется верхней пограничной кривой. Пограничные кривые пересекаются в точке (К), называемой критической.
Процесс кипения протекает на участке а’- а» при постоянном давлении р1 и постоянной температуре ts 1. В точке ( а» ) вода полностью испаряется. Пар в этом состоянии называется сухим насыщенным. На участке ( а’-а» ) вода находится в двух фазах и состоит из смеси кипящей воды и сухого насыщенного пара. Эта двухфазная равновесная система называется насыщенным ( влажным ) паром. При дальнейшем изобарном подводе теплоты сухой насыщенный пар превращается в перегретый ( а ). Перегретый пар имеет температуру выше температуры кипения (насыщения) при данном давлении. Точки на линии a «- b «-с» характеризуют состояние сухого насыщенного пара, а кривая определяет зависимость удельного объема сухого пара от давления = f(p) и называется верхней пограничной кривой. Пограничные кривые пересекаются в точке (К), называемой критической.
 Параметры и функции состояния кипящей воды на нижней пограничной кривой линии насыщения обозначаются одним штрихом, а сухого насыщенного пара — двумя штрихами. Для однозначного определения состояния кипящей воды и сухого насыщенного пара достаточно знание давления р или температуры насыщения t s , по значению которых в термодинамических таблицах водяного пара можно найти свойства кипящей воды — v’, u ‘, h ‘, s’ и сухого насыщенного пара — v «, u «, h «, s». В области между пограничными кривыми находится влажный насыщенный пар. Каждой температуре насыщенного пара соответствует определенное давление, то есть между этими параметрами существует однозначная зависимость.
Параметры и функции состояния кипящей воды на нижней пограничной кривой линии насыщения обозначаются одним штрихом, а сухого насыщенного пара — двумя штрихами. Для однозначного определения состояния кипящей воды и сухого насыщенного пара достаточно знание давления р или температуры насыщения t s , по значению которых в термодинамических таблицах водяного пара можно найти свойства кипящей воды — v’, u ‘, h ‘, s’ и сухого насыщенного пара — v «, u «, h «, s». В области между пограничными кривыми находится влажный насыщенный пар. Каждой температуре насыщенного пара соответствует определенное давление, то есть между этими параметрами существует однозначная зависимость.
 Для характеристики влажного насыщенного пара, помимо р или ts , в качестве второй независимой переменной используется массовая концентрация сухого насыщенного пара в смеси, называемая степенью сухости или паросодержанием ( x ) где G» – масса сухого насыщенного пара; – масса кипящей жидкости; G – масса насыщенного пара. На нижней пограничной кривой , а на верхней Отношение массы кипящей жидкости к массе смеси (влажного насыщенного пара) называется влагосодержанием G G GG G x G 0 x 1 x GG GG G x 1 y
Для характеристики влажного насыщенного пара, помимо р или ts , в качестве второй независимой переменной используется массовая концентрация сухого насыщенного пара в смеси, называемая степенью сухости или паросодержанием ( x ) где G» – масса сухого насыщенного пара; – масса кипящей жидкости; G – масса насыщенного пара. На нижней пограничной кривой , а на верхней Отношение массы кипящей жидкости к массе смеси (влажного насыщенного пара) называется влагосодержанием G G GG G x G 0 x 1 x GG GG G x 1 y
 Количество теплоты, которое необходимо подвести при постоянном давлении к 1 кг кипящей жидкости для превращения ее в сухой насыщенный пар, называется скрытой теплотой парообразования и обозначается символом r . Значение скрытой теплоты парообразования ( r ) можно определить из математического выражения первого начала термодинамики Так как процесс парообразования протекает при постоянном давлении ( ), скрытая теплота парообразования может быть определена из следующего соотношения: С ростом давления или температуры кипения (насыщения) жидкостей величина скрытой теплоты парообразования уменьшается и в критической точке становятся равными нулю. idemp vdpdhpdvduqqq *** hhdhqr 1 x 0 x p
Количество теплоты, которое необходимо подвести при постоянном давлении к 1 кг кипящей жидкости для превращения ее в сухой насыщенный пар, называется скрытой теплотой парообразования и обозначается символом r . Значение скрытой теплоты парообразования ( r ) можно определить из математического выражения первого начала термодинамики Так как процесс парообразования протекает при постоянном давлении ( ), скрытая теплота парообразования может быть определена из следующего соотношения: С ростом давления или температуры кипения (насыщения) жидкостей величина скрытой теплоты парообразования уменьшается и в критической точке становятся равными нулю. idemp vdpdhpdvduqqq *** hhdhqr 1 x 0 x p
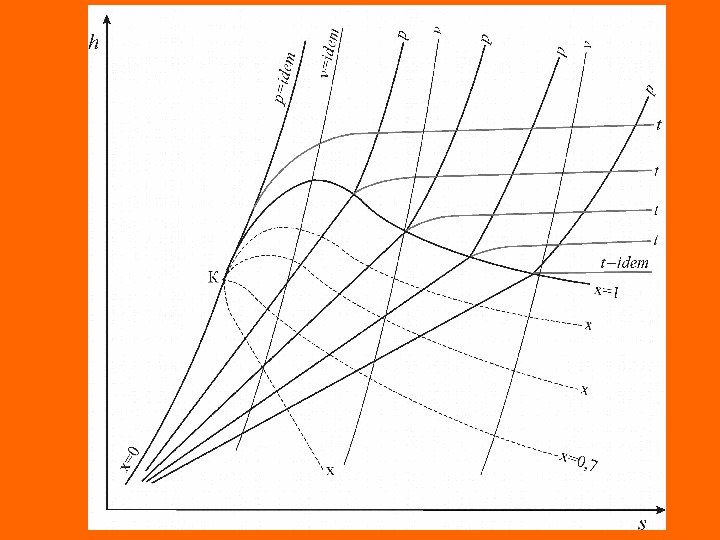
 Свойства влажного насыщенного и перегретого пара Влажный насыщенный пар является бинарной смесью. Свойства влажного насыщенного пара зависят от давления, при котором он находится, от концентраций жидкой и парообразной фаз в системе, которые определяются значением паросодержания. Известно, что объем , внутренняя энергия , энтальпия и энтропия системы зависят от массы вещества ( G ). Обозначим любую полную функцию через Z , а ее удельное значение z. Тогда Z=z. G . Для вычисления характеристик системы — влажного насыщенного пара, воспользуемся правилом аддитивности где и – экстенсивные характеристики кипящей воды и сухого насыщенного пара. ZZZ ZZ
Свойства влажного насыщенного и перегретого пара Влажный насыщенный пар является бинарной смесью. Свойства влажного насыщенного пара зависят от давления, при котором он находится, от концентраций жидкой и парообразной фаз в системе, которые определяются значением паросодержания. Известно, что объем , внутренняя энергия , энтальпия и энтропия системы зависят от массы вещества ( G ). Обозначим любую полную функцию через Z , а ее удельное значение z. Тогда Z=z. G . Для вычисления характеристик системы — влажного насыщенного пара, воспользуемся правилом аддитивности где и – экстенсивные характеристики кипящей воды и сухого насыщенного пара. ZZZ ZZ
 Выразив полные характеристики через соответствующие удельные величины получим Разделив на массу влажного насыщенного пара получим выражение для определения удельных значений характеристик влажного насыщенного пара С помощью данного соотношения можно записать соотношения для определения основных параметров и удельных значений функций состояния влажного насыщенного пара (удельного объема, внутренней энергии, энтальпии и энтропии): z. GGz x)zz(zzxz)x 1(z x)vv(vv ; x)uu(uu; rxhx)hh(hh ; x T r sx)ss(ss s
Выразив полные характеристики через соответствующие удельные величины получим Разделив на массу влажного насыщенного пара получим выражение для определения удельных значений характеристик влажного насыщенного пара С помощью данного соотношения можно записать соотношения для определения основных параметров и удельных значений функций состояния влажного насыщенного пара (удельного объема, внутренней энергии, энтальпии и энтропии): z. GGz x)zz(zzxz)x 1(z x)vv(vv ; x)uu(uu; rxhx)hh(hh ; x T r sx)ss(ss s
 Энтальпия, энтропия и внутренняя энергия перегретого пара определяются из уравнений приращения этих параметров в изобарическом процессе перегрева. В связи с тем, что перегретый пар по своим свойствам близок к идеальному газу, для изобарного процесса перегрева сухого насыщенного пара с некоторой долей приближения справедливы следующие соотношения: где , – удельные значения энтальпии и энтропии сухого насыщенного пара; сpm , – первая и вторая средние удельные теплоемкости перегретого пара в интервале температур Т-Т s ; v – удельный объем перегретого пара; – степень перегрева. ; d. Tcdhp ; T d. T cdsp s mp T T lncss Tch)TT(chhpmspm h s mp c T
Энтальпия, энтропия и внутренняя энергия перегретого пара определяются из уравнений приращения этих параметров в изобарическом процессе перегрева. В связи с тем, что перегретый пар по своим свойствам близок к идеальному газу, для изобарного процесса перегрева сухого насыщенного пара с некоторой долей приближения справедливы следующие соотношения: где , – удельные значения энтальпии и энтропии сухого насыщенного пара; сpm , – первая и вторая средние удельные теплоемкости перегретого пара в интервале температур Т-Т s ; v – удельный объем перегретого пара; – степень перегрева. ; d. Tcdhp ; T d. T cdsp s mp T T lncss Tch)TT(chhpmspm h s mp c T

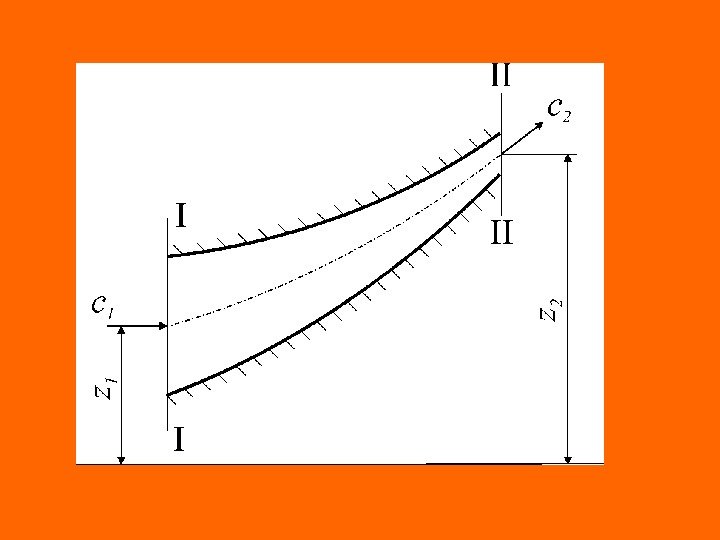
 Истечение жидкостей, паров и газов В общем случае процессы истечения удобно рассматривать как теоретические обратимые процессы истечения: политропный или адиабатный, а переход к реальным процессам осуществлять путем введения соответствующих поправочных коэффициентов, определяемых опытным путем Основной задачей при изучении процессов истечения является определение линейной ( с ) и массовой скорости ( и ), расхода ( G ), параметров и функций состояния рабочего тела ( p , v , t , u , h , s ) вдоль канала. Общие соотношения При обратимых процессах истечения жидкости из области большего давления р1 в область с меньшим давлением р2 , потенциальная работа расходуется на повышение кинетической энергии и на изменение высоты центра тяжести потока
Истечение жидкостей, паров и газов В общем случае процессы истечения удобно рассматривать как теоретические обратимые процессы истечения: политропный или адиабатный, а переход к реальным процессам осуществлять путем введения соответствующих поправочных коэффициентов, определяемых опытным путем Основной задачей при изучении процессов истечения является определение линейной ( с ) и массовой скорости ( и ), расхода ( G ), параметров и функций состояния рабочего тела ( p , v , t , u , h , s ) вдоль канала. Общие соотношения При обратимых процессах истечения жидкости из области большего давления р1 в область с меньшим давлением р2 , потенциальная работа расходуется на повышение кинетической энергии и на изменение высоты центра тяжести потока

 Дифференциальное уравнение распределения удельной потенциальной работы, при отсутствии эффективной потенциальной работы потока ( ), будет выглядеть следующим образом Отсюда теоретическая линейная скорость истечения жидкости в выходном сечении сопла ( с2 ) 0 w * gdzcdcvdpw )zz(g 2 c w 12 2 1 2 2 2, 1 )(22122, 1 2 12 zzgwcc
Дифференциальное уравнение распределения удельной потенциальной работы, при отсутствии эффективной потенциальной работы потока ( ), будет выглядеть следующим образом Отсюда теоретическая линейная скорость истечения жидкости в выходном сечении сопла ( с2 ) 0 w * gdzcdcvdpw )zz(g 2 c w 12 2 1 2 2 2, 1 )(22122, 1 2 12 zzgwcc
 Сопла или штуцеры, через которые происходят процессы истечения, обычно выполняются короткими, поэтому работой, идущей на изменение центра тяжести поток, можно пренебречь. При этом условии теоретическая линейная скорость истечения жидкости в выходном сечении сопла может быть определена из соотношения Скорость потока на входе в сопло может быть вычислена, в свою очередь, как теоретическая скорость истечения из воображаемого нулевого состояния (точка 0 ), в котором жидкость находится в состоянии покоя ( с0 =0 ), до заданного начального состояния ( 1 ), линейная скорость потока во входном сечении сопла определяется по формуле 12 zzg 2 2, 1 2 12 w 2 cc 1, 0 2 01 w 2 w 2 cc
Сопла или штуцеры, через которые происходят процессы истечения, обычно выполняются короткими, поэтому работой, идущей на изменение центра тяжести поток, можно пренебречь. При этом условии теоретическая линейная скорость истечения жидкости в выходном сечении сопла может быть определена из соотношения Скорость потока на входе в сопло может быть вычислена, в свою очередь, как теоретическая скорость истечения из воображаемого нулевого состояния (точка 0 ), в котором жидкость находится в состоянии покоя ( с0 =0 ), до заданного начального состояния ( 1 ), линейная скорость потока во входном сечении сопла определяется по формуле 12 zzg 2 2, 1 2 12 w 2 cc 1, 0 2 01 w 2 w 2 cc
 Сумма потенциальных работ w 0, 1 и w 1, 2 , представляет собой потенциальную работу жидкости (сжимаемой или несжимаемой) в обратимом адиабатном процессе истечения от нулевого состояния ( с 0 =0 ), определяемого параметрами торможения, до конечного давления p 2 ( ). Следовательно, соотношение для определения линейной теоретической скорости обратимого адиабатного процесса истечения жидкости можно записать следующим образом Важной характеристикой потока является его массовая скорость, численно равная секундному расходу жидкости через единицу площади поперечного сечения потока ( и , кг/(м 2 с) ) 2, 11, 02, 0 www 2, 02 w 2 с f G u
Сумма потенциальных работ w 0, 1 и w 1, 2 , представляет собой потенциальную работу жидкости (сжимаемой или несжимаемой) в обратимом адиабатном процессе истечения от нулевого состояния ( с 0 =0 ), определяемого параметрами торможения, до конечного давления p 2 ( ). Следовательно, соотношение для определения линейной теоретической скорости обратимого адиабатного процесса истечения жидкости можно записать следующим образом Важной характеристикой потока является его массовая скорость, численно равная секундному расходу жидкости через единицу площади поперечного сечения потока ( и , кг/(м 2 с) ) 2, 11, 02, 0 www 2, 02 w 2 с f G u
 Связь между массовой и линейной скоростью В соответствии с принципом неразрывности потока, массовый расход вещества ( G ) в любом поперечном сечении канала одинаков Истечение несжимаемых жидкостей Несжимаемая жидкость имеет практически неизменную плотность при любых давлениях и температурах. Соотношения для определения удельной потенциальной работы несжимаемой жидкости в обратимых процессах истечения 222 cu idemfufc. G 20 0 2 2 0 2, 0 pp dp 1 vdpw
Связь между массовой и линейной скоростью В соответствии с принципом неразрывности потока, массовый расход вещества ( G ) в любом поперечном сечении канала одинаков Истечение несжимаемых жидкостей Несжимаемая жидкость имеет практически неизменную плотность при любых давлениях и температурах. Соотношения для определения удельной потенциальной работы несжимаемой жидкости в обратимых процессах истечения 222 cu idemfufc. G 20 0 2 2 0 2, 0 pp dp 1 vdpw
 Теоретическая линейная скорость истечения несжимаемой жидкости в выходном сечении сопла ( с2 ) Массовая скорость потока несжимаемой жидкости на выходе из сопла Из соотношений видно, что с увеличением по длине канала ( x ) разности давления ( р 0 — рx ), повышается массовая скорость потока. При этом, исходя из принципа неразрывности потока ( G = idem ), площадь проходного сечения канала , должна непрерывно уменьшаться. Следовательно, при истечении несжимаемой жидкости следует применять суживающиеся сопла. 21 2 pp 2 с. pp 2 cu
Теоретическая линейная скорость истечения несжимаемой жидкости в выходном сечении сопла ( с2 ) Массовая скорость потока несжимаемой жидкости на выходе из сопла Из соотношений видно, что с увеличением по длине канала ( x ) разности давления ( р 0 — рx ), повышается массовая скорость потока. При этом, исходя из принципа неразрывности потока ( G = idem ), площадь проходного сечения канала , должна непрерывно уменьшаться. Следовательно, при истечении несжимаемой жидкости следует применять суживающиеся сопла. 21 2 pp 2 с. pp 2 cu
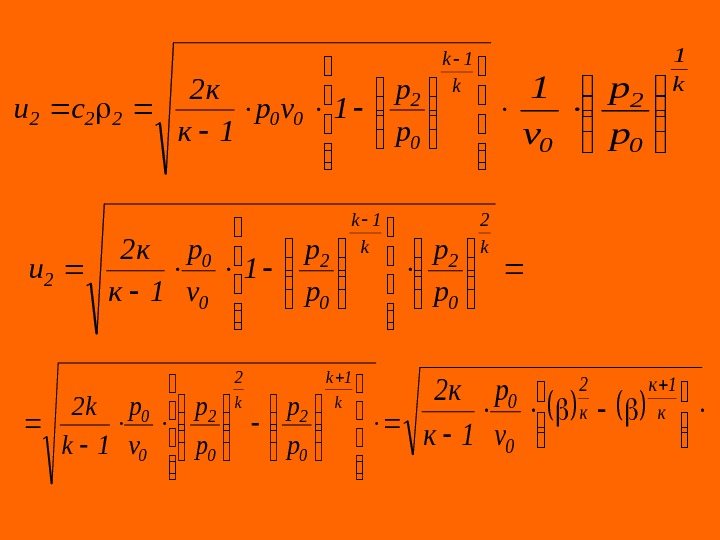
 Истечение сжимаемых жидкостей К классу сжимаемых жидкостей относятся вещества, плотность которых изменяется в зависимости от давления и температуры Газы (идеальные и реальные) относятся к классу сжимаемых жидкостей. Потенциальная работа обратимого адиабатного процесса истечения газа от нулевого до конечного состояния ( 0 -2 ) k 1 k 0 2 002, 0 p p 1 vp 1 k k w k 1 k 0 2 002, 02 p p 1 vp 1 k k 2 w 2 c
Истечение сжимаемых жидкостей К классу сжимаемых жидкостей относятся вещества, плотность которых изменяется в зависимости от давления и температуры Газы (идеальные и реальные) относятся к классу сжимаемых жидкостей. Потенциальная работа обратимого адиабатного процесса истечения газа от нулевого до конечного состояния ( 0 -2 ) k 1 k 0 2 002, 0 p p 1 vp 1 k k w k 1 k 0 2 002, 02 p p 1 vp 1 k k 2 w 2 c
 Для вычисления массовой скорости газа необходимо знать плотность газа в выходном сечении сопла, значение которой определяется из уравнения адиабаты k 1 0 2 2 k 1 20 k 1 0 p p v 1 , 1 v, vpvp 222 cu k 1 k 0 2 002, 02 p p 1 vp 1 k k 2 w 2 c
Для вычисления массовой скорости газа необходимо знать плотность газа в выходном сечении сопла, значение которой определяется из уравнения адиабаты k 1 0 2 2 k 1 20 k 1 0 p p v 1 , 1 v, vpvp 222 cu k 1 k 0 2 002, 02 p p 1 vp 1 k k 2 w 2 c
 k 2 0 2 k 1 k 0 2 0 0 2 pp pp 1 v p 1 к к 2 u k 1 k 0 2 00222 pp 1 vp 1 к к 2 си k 1 k 0 2 k 2 0 0 p p v p 1 k k 2 k 1 0 2 0 p p v 1 к 1 к к 2 0 0 v p 1 к к
k 2 0 2 k 1 k 0 2 0 0 2 pp pp 1 v p 1 к к 2 u k 1 k 0 2 00222 pp 1 vp 1 к к 2 си k 1 k 0 2 k 2 0 0 p p v p 1 k k 2 k 1 0 2 0 p p v 1 к 1 к к 2 0 0 v p 1 к к

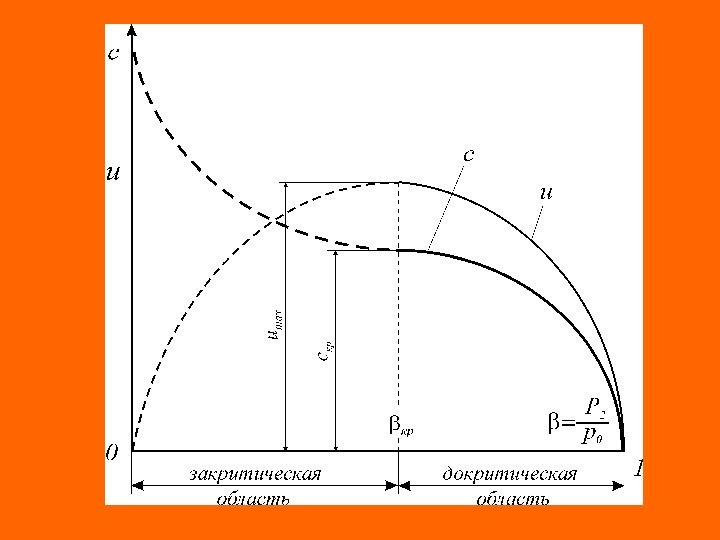
 Область диаграммы , в которой называется областью докритического (дозвукового)режима истечения. В этой области давление потока в выходном сечении сопла ( p 2 ) равно давлению среды ( p ср ), в которую происходит истечение ( p 2 =p ср ), а при снижении давления среды ( p ср ) наблюдается увеличение массового расхода через сопло ( G ), а также линейной ( c ) и массовой ( и ) скорости потока в выходном сечении сопла. После достижения критического соотношения давлений ( ) наступает критический (звуковой) режим истечения , при котором на выходе из сопла устанавливается критическое давление режима ( ). Этот режим характеризуется критическими значениями массового расхода ( G кр ), линейной ( c 2 =c кр ) и массовой ( и 2 = и кр ) скорости истечения в выходном сечении сопла. 1 кр кр кр0 кр2 ppp
Область диаграммы , в которой называется областью докритического (дозвукового)режима истечения. В этой области давление потока в выходном сечении сопла ( p 2 ) равно давлению среды ( p ср ), в которую происходит истечение ( p 2 =p ср ), а при снижении давления среды ( p ср ) наблюдается увеличение массового расхода через сопло ( G ), а также линейной ( c ) и массовой ( и ) скорости потока в выходном сечении сопла. После достижения критического соотношения давлений ( ) наступает критический (звуковой) режим истечения , при котором на выходе из сопла устанавливается критическое давление режима ( ). Этот режим характеризуется критическими значениями массового расхода ( G кр ), линейной ( c 2 =c кр ) и массовой ( и 2 = и кр ) скорости истечения в выходном сечении сопла. 1 кр кр кр0 кр2 ppp
 Дальнейшее снижение давления среды ( pср ), в которую происходит истечение вещества, не приводит к снижению давления на выходе из сопла, которое остается неизменным и равным критическому давлению ( c 2 =cкр ). Это явление называется «кризисом течения» . В критическом режиме истечения скорость потока в выходном сечении сопла устанавливается равной местной скорости звука в данной среде ( с 2 =скр = a ). С этой же скоростью (скоростью звука) в среде распространяется любое возмущение. Установившаяся в выходном сечении сопла критическая скорость истечения ( c кр ) препятствует подходу волны разряжения к этому сечению сопла, что и предопределяет стабилизацию линейной скорости истечения на уровне критического значения даже при дальнейшем снижении давления среды. При данных условиях истечения ( ) для увеличения кинетической энергии потока используется не весь располагаемый перепад давления ( ), а только часть его ( ). кр2 ср ppp ср0 pp 20 pp
Дальнейшее снижение давления среды ( pср ), в которую происходит истечение вещества, не приводит к снижению давления на выходе из сопла, которое остается неизменным и равным критическому давлению ( c 2 =cкр ). Это явление называется «кризисом течения» . В критическом режиме истечения скорость потока в выходном сечении сопла устанавливается равной местной скорости звука в данной среде ( с 2 =скр = a ). С этой же скоростью (скоростью звука) в среде распространяется любое возмущение. Установившаяся в выходном сечении сопла критическая скорость истечения ( c кр ) препятствует подходу волны разряжения к этому сечению сопла, что и предопределяет стабилизацию линейной скорости истечения на уровне критического значения даже при дальнейшем снижении давления среды. При данных условиях истечения ( ) для увеличения кинетической энергии потока используется не весь располагаемый перепад давления ( ), а только часть его ( ). кр2 ср ppp ср0 pp 20 pp
 Таким образом, при истечении через суживающиеся сопла и отверстия в тонких стенках возможны только два режима истечения — докритический и критический. Процесс истечения через суживающиеся сопла и отверстия в тонких стенках возможен только при выполнении следующего условия: Для обеспечения закритического режима истечения, характеризующегося условием ( ), необходимо дополнить суживающееся сопло расширяющейся частью, в выходном сечении которой возможно достичь значения давления ниже критического ( ). Такое комбинированное сопло называется соплом Лаваля. В комбинированных соплах для увеличения кинетической энергии потока может использоваться весь располагаемый перепад давления ( ). кр1 accкр2 pp ср0 pp
Таким образом, при истечении через суживающиеся сопла и отверстия в тонких стенках возможны только два режима истечения — докритический и критический. Процесс истечения через суживающиеся сопла и отверстия в тонких стенках возможен только при выполнении следующего условия: Для обеспечения закритического режима истечения, характеризующегося условием ( ), необходимо дополнить суживающееся сопло расширяющейся частью, в выходном сечении которой возможно достичь значения давления ниже критического ( ). Такое комбинированное сопло называется соплом Лаваля. В комбинированных соплах для увеличения кинетической энергии потока может использоваться весь располагаемый перепад давления ( ). кр1 accкр2 pp ср0 pp
 Анализ уравнения для массовой скорости потока показывает, что скорость газа изменяясь в зависимости от соотношения давлений в процессе истечения , дважды обращается в нуль — при р2 /р0 = 1 (нет движения), а также при = 0 (истечение в вакуум, р 2 = 0 ). Следовательно, значение массовой скорости, по теореме Ролля, проходит через экстремум. Соотношение давлений, при котором массовая скорость истечения становится максимальной ( ), называется критическим , а режим истечения при этом условии называется критическим режимом истечения. Для определения характеристик критического режима истечения обозначим через ψ выражение maxu кр 02 p/p k 1 k k
Анализ уравнения для массовой скорости потока показывает, что скорость газа изменяясь в зависимости от соотношения давлений в процессе истечения , дважды обращается в нуль — при р2 /р0 = 1 (нет движения), а также при = 0 (истечение в вакуум, р 2 = 0 ). Следовательно, значение массовой скорости, по теореме Ролля, проходит через экстремум. Соотношение давлений, при котором массовая скорость истечения становится максимальной ( ), называется критическим , а режим истечения при этом условии называется критическим режимом истечения. Для определения характеристик критического режима истечения обозначим через ψ выражение maxu кр 02 p/p k 1 k k
 Очевидно, что массовая скорость достигнет максимального значения при таком же βкр , что и функция. Условием максимума функции является Критическое соотношение давлений и значение характеристики адиабатного расширения сжимаемых жидкостей ; 1 k 2 1 k k кр 0 к 1 к к 2 d d 1 к 1 к k 1 к 2 k 1 k 2 vp pv 00 k кр
Очевидно, что массовая скорость достигнет максимального значения при таком же βкр , что и функция. Условием максимума функции является Критическое соотношение давлений и значение характеристики адиабатного расширения сжимаемых жидкостей ; 1 k 2 1 k k кр 0 к 1 к к 2 d d 1 к 1 к k 1 к 2 k 1 k 2 vp pv 00 k кр
 критическая линейная скорость истечения Действительная линейная скорость коэффициент скорости учитывающий реальный процесс Действительный расход = 0, 65 — 1 — коэффициент сжатия струи 00 крvp 1 k k 21 vp 1 k k 2 c кркр )pv(kc кр кр 00 pv vp cсд f f , fcfcfдс. G д ддд
критическая линейная скорость истечения Действительная линейная скорость коэффициент скорости учитывающий реальный процесс Действительный расход = 0, 65 — 1 — коэффициент сжатия струи 00 крvp 1 k k 21 vp 1 k k 2 c кркр )pv(kc кр кр 00 pv vp cсд f f , fcfcfдс. G д ддд
 Для обратимого адиабатного истечения любой сжимаемой жидкости критическая линейная скорость равна местной скорости звука в данной среде Значение массовой критической скорости истечения Для природных газов значения критических параметров истечения изменяются в следующих диапазонах: τкр =0, 85 — 0, 90 ; βкр =0, 53 — 0, 56 ; λкр =0, 48 — 0, 46. Махачисло a c M; )pv(kaкр , v p 2 u 0 0 кркр1 kk 2 кр кр
Для обратимого адиабатного истечения любой сжимаемой жидкости критическая линейная скорость равна местной скорости звука в данной среде Значение массовой критической скорости истечения Для природных газов значения критических параметров истечения изменяются в следующих диапазонах: τкр =0, 85 — 0, 90 ; βкр =0, 53 — 0, 56 ; λкр =0, 48 — 0, 46. Махачисло a c M; )pv(kaкр , v p 2 u 0 0 кркр1 kk 2 кр кр
 Общие закономерности процесса истечения. Цель : установление связи между f , c , p. 1. уравнение неразрывности 2. уравнение распределение потенциальной работы 3. показатель процесса Отсюда первое и второе дифференциальное уравнение c dc v dv f df ; idem v fc G dp c v c dc ; 2 c dcdcvdp 2 2 kp dp v dv ; pdv vdp k dp 1 M 1 kp 1 f df 2 c dc 1 M kp 1 f df
Общие закономерности процесса истечения. Цель : установление связи между f , c , p. 1. уравнение неразрывности 2. уравнение распределение потенциальной работы 3. показатель процесса Отсюда первое и второе дифференциальное уравнение c dc v dv f df ; idem v fc G dp c v c dc ; 2 c dcdcvdp 2 2 kp dp v dv ; pdv vdp k dp 1 M 1 kp 1 f df 2 c dc 1 M kp 1 f df
 Докритический (дозвуковой) М <1 df<0 dp0 сопло df>0 dp > 0 dc1 df>0 dp0 сопло df0 dc<0 диффузор
Докритический (дозвуковой) М <1 df<0 dp0 сопло df>0 dp > 0 dc1 df>0 dp0 сопло df0 dc<0 диффузор
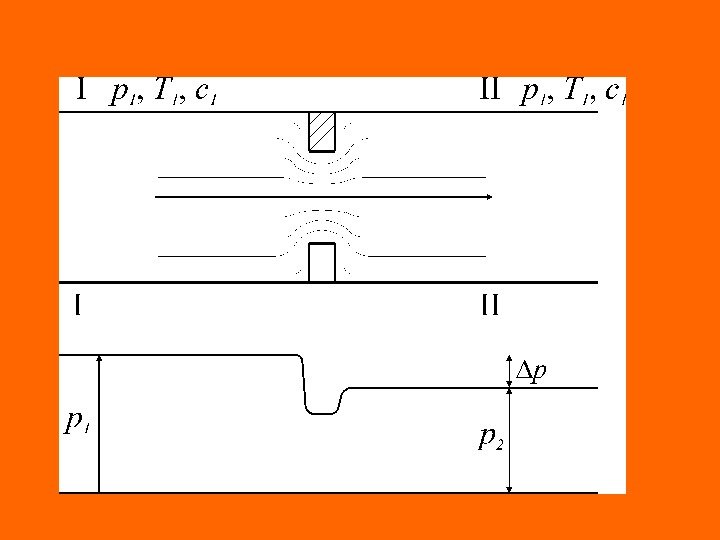
 Дросселирование. Эффект Джоуля-Томсона Эффект падения давления потока рабочего тела в процессе преодоления им (потоком) местного сопротивления называется дросселированием. Причинами возникновения местных сопротивлений при движении потока рабочего тела по каналам могут быть запорные, регулирующие и измерительные устройства; повороты, сужение, загрязнение каналов и т. д. Рассмотрим процесс дросселирования, протекающий без внешней работы ( = 0 ), в котором отсутствует теплообмен рабочего тела с внешней средой ( = 0 ). Падение давления за местным сопротивлением обусловлено диссипацией (потерей) энергии потока, расходуемой на преодоление этого сопротивления, то есть на работу необратимых потерь ( ). * 2, 1 W * 2, 1 Q ** 2, 1 W
Дросселирование. Эффект Джоуля-Томсона Эффект падения давления потока рабочего тела в процессе преодоления им (потоком) местного сопротивления называется дросселированием. Причинами возникновения местных сопротивлений при движении потока рабочего тела по каналам могут быть запорные, регулирующие и измерительные устройства; повороты, сужение, загрязнение каналов и т. д. Рассмотрим процесс дросселирования, протекающий без внешней работы ( = 0 ), в котором отсутствует теплообмен рабочего тела с внешней средой ( = 0 ). Падение давления за местным сопротивлением обусловлено диссипацией (потерей) энергии потока, расходуемой на преодоление этого сопротивления, то есть на работу необратимых потерь ( ). * 2, 1 W * 2, 1 Q ** 2, 1 W

 С учетом перечисленных условий рассматриваемого процесса дросселирования, уравнение первого начала термодинамики для потока по балансу рабочего тела примет вид Это значит, что рассматриваемый процесс дросселирования является процессом изоэнтальпийным: энтальпия рабочего тела до дросселя численно равна энтальпии рабочего тела после дросселя. При течении внутри дросселя энтальпия газа или пара меняется. WWd. HQQH 2 — H 1 = 0 или idem. H.
С учетом перечисленных условий рассматриваемого процесса дросселирования, уравнение первого начала термодинамики для потока по балансу рабочего тела примет вид Это значит, что рассматриваемый процесс дросселирования является процессом изоэнтальпийным: энтальпия рабочего тела до дросселя численно равна энтальпии рабочего тела после дросселя. При течении внутри дросселя энтальпия газа или пара меняется. WWd. HQQH 2 — H 1 = 0 или idem. H.
 Если рассматривать в качестве местного сопротивления сужение канала, в суженном сечении поток ускоряется, кинетическая энергия увеличивается и энтальпия рабочего тела уменьшается (процесс 1 — 2′ ). После дросселя сечение потока вновь возрастает, поток тормозится, кинетическая энергия уменьшается, а энтальпия увеличивается до прежнего значения (процесс 2′ — 2 ).
Если рассматривать в качестве местного сопротивления сужение канала, в суженном сечении поток ускоряется, кинетическая энергия увеличивается и энтальпия рабочего тела уменьшается (процесс 1 — 2′ ). После дросселя сечение потока вновь возрастает, поток тормозится, кинетическая энергия уменьшается, а энтальпия увеличивается до прежнего значения (процесс 2′ — 2 ).
 Процесс дросселирования является процессом необратимым; он всегда сопровождается ростом энтропии рабочего тела. Явление изменения температуры газа или жидкости при адиабатном дросселировании называется эффектом Джоуля – Томсона. Различают дифференциальный и интегральный дроссель – эффекты. Величина дифференциального дроссель – эффекта определяется из соотношения где – коэффициент дросселирования или коэффициент Джоуля – Томсона, . Интегральный дроссель-эффект определяется по соотношению h h p T D h. D 2 1 h 12 dp. DTT
Процесс дросселирования является процессом необратимым; он всегда сопровождается ростом энтропии рабочего тела. Явление изменения температуры газа или жидкости при адиабатном дросселировании называется эффектом Джоуля – Томсона. Различают дифференциальный и интегральный дроссель – эффекты. Величина дифференциального дроссель – эффекта определяется из соотношения где – коэффициент дросселирования или коэффициент Джоуля – Томсона, . Интегральный дроссель-эффект определяется по соотношению h h p T D h. D 2 1 h 12 dp. DTT
 Коэффициент Джоуля – Томсона определяется из следующего уравнения, выведенного из математических выражений первого начала термодинамики и второго начала термостатики Знак дифференциального дроссель–эффекта (коэффициента Джоуля – Томсона) определяется из анализа уравнения. В зависимости от характера изменения температуры T , имеют место три вида дроссель–эффекта (процесс дросселирования всегда происходит с падением давления dp 0 ), в этом случае процесс дросселирования сопровождается снижением температуры рабочего тела ( d. T<0 ); . c v T D p p h
Коэффициент Джоуля – Томсона определяется из следующего уравнения, выведенного из математических выражений первого начала термодинамики и второго начала термостатики Знак дифференциального дроссель–эффекта (коэффициента Джоуля – Томсона) определяется из анализа уравнения. В зависимости от характера изменения температуры T , имеют место три вида дроссель–эффекта (процесс дросселирования всегда происходит с падением давления dp 0 ), в этом случае процесс дросселирования сопровождается снижением температуры рабочего тела ( d. T<0 ); . c v T D p p h
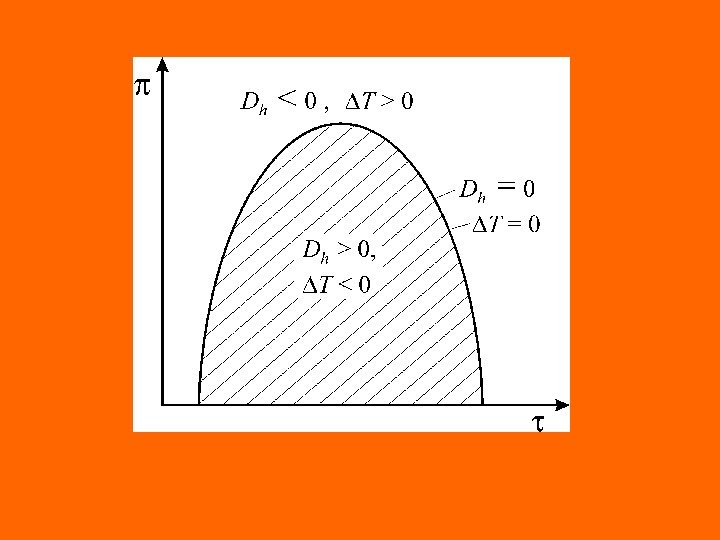
 2. Дроссель–эффект отрицательный ( Dh 0 ); 3. Дроссель–эффект равен нулю ( D h = 0 ), если в процессе дросселирования температура рабочего тела не изменяется. Нулевой дроссель-эффект наблюдается при дросселировании идеального газа. Как показывает опыт, для одного и того же вещества в зависимости от значений параметров состояния коэффициент Джоуля – Томсона D h может иметь положительные, отрицательные значения, а также быть равным нулю. Состояние газа или жидкости, которому соответствует условие D h = 0 , называется точкой инверсий. Геометрическое место точек инверсии на диаграмме состояния данного вещества называется кривой инверсии.
2. Дроссель–эффект отрицательный ( Dh 0 ); 3. Дроссель–эффект равен нулю ( D h = 0 ), если в процессе дросселирования температура рабочего тела не изменяется. Нулевой дроссель-эффект наблюдается при дросселировании идеального газа. Как показывает опыт, для одного и того же вещества в зависимости от значений параметров состояния коэффициент Джоуля – Томсона D h может иметь положительные, отрицательные значения, а также быть равным нулю. Состояние газа или жидкости, которому соответствует условие D h = 0 , называется точкой инверсий. Геометрическое место точек инверсии на диаграмме состояния данного вещества называется кривой инверсии.
 Кривая инверсии описывается уравнением . Для каждого вещества в диаграмме р — v имеется своя кривая инверсии. Закон соответственных состояний позволяет построить обобщенные кривые инверсии для групп термодинамически подобных веществ. Для природных газов инверсионная диаграмма приведена на графике в виде π = f (τ)T v p
Кривая инверсии описывается уравнением . Для каждого вещества в диаграмме р — v имеется своя кривая инверсии. Закон соответственных состояний позволяет построить обобщенные кривые инверсии для групп термодинамически подобных веществ. Для природных газов инверсионная диаграмма приведена на графике в виде π = f (τ)T v p

