Кремний.ppt
- Количество слайдов: 40
 Кремний История открытия кремния Кремний – химический элемент 1. Положение кремния в ПСХЭ Д. И. Менделеева 2. Строение атома кремния 3. Нахождение в природе Кремний – простое вещество 1. Аллотропные модификации углерода 2. Получение кремния 3. Химические свойства Соединения кремния
Кремний История открытия кремния Кремний – химический элемент 1. Положение кремния в ПСХЭ Д. И. Менделеева 2. Строение атома кремния 3. Нахождение в природе Кремний – простое вещество 1. Аллотропные модификации углерода 2. Получение кремния 3. Химические свойства Соединения кремния
 В 1825 году шведский химик Йёнс Якоб Берцелиус действием металлического калия на фторид кремния Si. F 4 получил чистый элементарный кремний. Новому элементу было дано название «силиций» (от лат. silex — кремень). Русское название «кремний» введено в 1834 году российским химиком Германом Ивановичем Гессом. В переводе c др. -греч. κρημνός — «утес, гора» .
В 1825 году шведский химик Йёнс Якоб Берцелиус действием металлического калия на фторид кремния Si. F 4 получил чистый элементарный кремний. Новому элементу было дано название «силиций» (от лат. silex — кремень). Русское название «кремний» введено в 1834 году российским химиком Германом Ивановичем Гессом. В переводе c др. -греч. κρημνός — «утес, гора» .
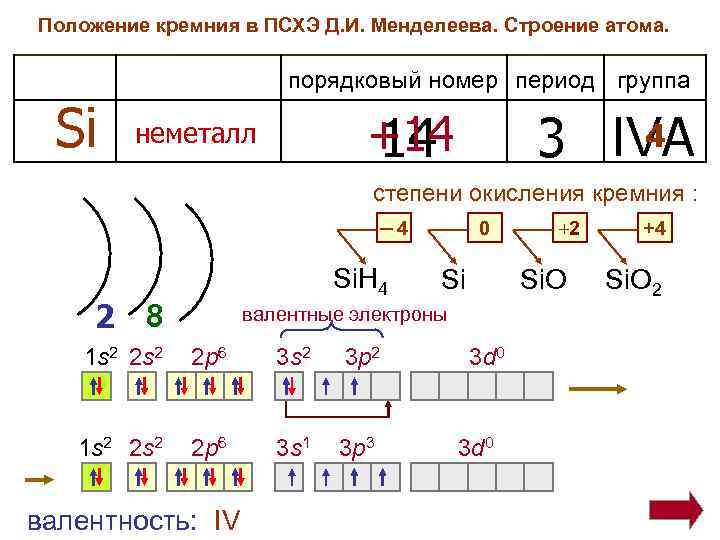 Положение кремния в ПСХЭ Д. И. Менделеева. Строение атома. порядковый номер период группа Si +14 14 неметалл 4 3 IVA степени окисления кремния : ─4 Si. H 4 2 8 0 Si Si. O валентные электроны 1 s 2 2 s 2 2 p 6 3 s 2 3 p 2 1 s 2 2 s 2 2 p 6 3 s 1 3 p 3 валентность: IV +2 3 d 0 +4 Si. O 2
Положение кремния в ПСХЭ Д. И. Менделеева. Строение атома. порядковый номер период группа Si +14 14 неметалл 4 3 IVA степени окисления кремния : ─4 Si. H 4 2 8 0 Si Si. O валентные электроны 1 s 2 2 s 2 2 p 6 3 s 2 3 p 2 1 s 2 2 s 2 2 p 6 3 s 1 3 p 3 валентность: IV +2 3 d 0 +4 Si. O 2
 Нахождение кремния в природе По распространённости в земной коре кремний среди всех элементов занимает второе место (после кислорода) Масса земной коры на 27, 6 — 29, 5 % состоит из кремния. Кремний входит в состав нескольких сотен различных природных силикатов и алюмосиликатов. Больше всего распространен кремнезём — многочисленные формы оксида кремния (IV) Si. O 2 (речной песок, кварц, кремень и др. ), составляющий около 12 % земной коры (по массе). В свободном виде кремний в природе не встречается.
Нахождение кремния в природе По распространённости в земной коре кремний среди всех элементов занимает второе место (после кислорода) Масса земной коры на 27, 6 — 29, 5 % состоит из кремния. Кремний входит в состав нескольких сотен различных природных силикатов и алюмосиликатов. Больше всего распространен кремнезём — многочисленные формы оксида кремния (IV) Si. O 2 (речной песок, кварц, кремень и др. ), составляющий около 12 % земной коры (по массе). В свободном виде кремний в природе не встречается.
 силикаты
силикаты
 Речной песок
Речной песок
 кварц
кварц
 кремень
кремень
 Аллотропные модификации кремния Аморфный кремний не имеет упорядоченной кристаллической решетки. Аморфный кремний - порошок бурого цвета, плотность 2, 3 г/см 3 Кристаллический Решетка кристаллической модификации кремния – атомная, сходна с решеткой алмаза. Кристаллический кремний - темно-серые со слабым блеском кристаллы, температура плавления 1415ºС, кипения 3250ºС, плотность 2, 4 г/см 3, полупроводник.
Аллотропные модификации кремния Аморфный кремний не имеет упорядоченной кристаллической решетки. Аморфный кремний - порошок бурого цвета, плотность 2, 3 г/см 3 Кристаллический Решетка кристаллической модификации кремния – атомная, сходна с решеткой алмаза. Кристаллический кремний - темно-серые со слабым блеском кристаллы, температура плавления 1415ºС, кипения 3250ºС, плотность 2, 4 г/см 3, полупроводник.
 Получение кремния Свободный кремний может быть получен прокаливанием с магнием мелкого белого песка, который по химическому составу является почти чистым оксидом кремния (IV) Составьте уравнение реакции получения кремния: Si. O 2+2 Mg = 2 Mg. O+Si образующийся при этом аморфный кремний имеет вид бурого порошка. В промышленности кремний технической чистоты получают, восстанавливая расплав Si. O 2 коксом при температуре около 1800°C в дуговых печах. Чистота полученного таким образом кремния может достигать 99, 9% (основные примеси - углерод, металлы). Составьте уравнение реакции получения кремния: Si. O 2+ 2 С = 2 СO+Si
Получение кремния Свободный кремний может быть получен прокаливанием с магнием мелкого белого песка, который по химическому составу является почти чистым оксидом кремния (IV) Составьте уравнение реакции получения кремния: Si. O 2+2 Mg = 2 Mg. O+Si образующийся при этом аморфный кремний имеет вид бурого порошка. В промышленности кремний технической чистоты получают, восстанавливая расплав Si. O 2 коксом при температуре около 1800°C в дуговых печах. Чистота полученного таким образом кремния может достигать 99, 9% (основные примеси - углерод, металлы). Составьте уравнение реакции получения кремния: Si. O 2+ 2 С = 2 СO+Si
 ° Si Химические свойства кремния – 4 e Si + O 2 (Cl 2, C) восстановитель +4 e окислитель Si + Mg Si+4 Si– 4 1. Взаимодействие с неметаллами. Химически кремний малоактивен. При комнатной температуре реагирует только с газообразным фтором, при этом образуется летучий тетрафторид кремния Si. F 4. При нагревании до температуры 400— 500°C кремний реагирует с кислородом с образованием оксида кремния (IV), с хлором, бромом и иодом — с образованием соответствующих легко летучих тетрагалогенидов Si. Hal 4. Составьте уравнения соответствующих реакций. Рассмотрите реакции как окислительно-восстановительные.
° Si Химические свойства кремния – 4 e Si + O 2 (Cl 2, C) восстановитель +4 e окислитель Si + Mg Si+4 Si– 4 1. Взаимодействие с неметаллами. Химически кремний малоактивен. При комнатной температуре реагирует только с газообразным фтором, при этом образуется летучий тетрафторид кремния Si. F 4. При нагревании до температуры 400— 500°C кремний реагирует с кислородом с образованием оксида кремния (IV), с хлором, бромом и иодом — с образованием соответствующих легко летучих тетрагалогенидов Si. Hal 4. Составьте уравнения соответствующих реакций. Рассмотрите реакции как окислительно-восстановительные.
 Si 0 + F 20 = Si+4 F 4¯ 2 Si 0 – 4 e → Si+4 4 1 F 20 + 2 e → 2 F¯ 2 2 Si 0 + Cl 20 = Si+4 Cl 4¯ 2 Si 0 – 4 e → Si+4 4 1 Cl 20 + 2 e → 2 Cl¯ 2 2 Si 0 + Br 20 = Si+4 Br 4¯ 2 Si 0 – 4 e → Si+4 4 1 Br 20 + 2 e → 2 Br¯ 2 2 Si 0 + I 20 = Si+4 I 4¯ 2 Si 0 – 4 e → Si+4 4 1 I 20 + 2 e → 2 I¯ 2 2 Si – восстановитель, процесс окисления. F 2 – окислитель, процесс восстановления. Si – восстановитель, процесс окисления. Cl 2 – окислитель, процесс восстановления. Si – восстановитель, процесс окисления. Br 2 – окислитель, процесс восстановления. Si – восстановитель, процесс окисления. I 2 – окислитель, процесс восстановления. Si 0 + O 20 = Si+4 O 2– 2 Si 0 – 4 e → Si+4 4 1 O 20 + 4 e → 2 O – 2 4 1 Si – восстановитель, процесс окисления. O 2 – окислитель, процесс восстановления.
Si 0 + F 20 = Si+4 F 4¯ 2 Si 0 – 4 e → Si+4 4 1 F 20 + 2 e → 2 F¯ 2 2 Si 0 + Cl 20 = Si+4 Cl 4¯ 2 Si 0 – 4 e → Si+4 4 1 Cl 20 + 2 e → 2 Cl¯ 2 2 Si 0 + Br 20 = Si+4 Br 4¯ 2 Si 0 – 4 e → Si+4 4 1 Br 20 + 2 e → 2 Br¯ 2 2 Si 0 + I 20 = Si+4 I 4¯ 2 Si 0 – 4 e → Si+4 4 1 I 20 + 2 e → 2 I¯ 2 2 Si – восстановитель, процесс окисления. F 2 – окислитель, процесс восстановления. Si – восстановитель, процесс окисления. Cl 2 – окислитель, процесс восстановления. Si – восстановитель, процесс окисления. Br 2 – окислитель, процесс восстановления. Si – восстановитель, процесс окисления. I 2 – окислитель, процесс восстановления. Si 0 + O 20 = Si+4 O 2– 2 Si 0 – 4 e → Si+4 4 1 O 20 + 4 e → 2 O – 2 4 1 Si – восстановитель, процесс окисления. O 2 – окислитель, процесс восстановления.
 При взаимодействии кремния с углем образуется карбид кремния Si. C – карборунд. Его кристаллическая решетка напоминает решетку алмаза, в ней атомы углерода и кремния чередуются. Карборунд по твердости приближается к алмазу. Из него изготавливают шлифовальные круги, точильные камни, наждачную бумагу. Составьте уравнение реакции. Назовите окислитель и восстановитель. Si 0 + С 0 = Si– 4 С+4 Si 0 + 4 e → Si – 4 4 1 Si – окислитель, процесс восстановления. С 0 – 4 e → С +4 4 1 C – восстановитель, процесс окисления. 2. Взаимодействие с металлами. Составьте уравнение реакции кремния с магнием. Назовите окислитель и восстановитель. Si 0 + Mg 0 = Mg 2+2 Si– 4 2 cилицид магния Si 0 + 4 e → Si – 4 4 1 Si – окислитель, процесс восстановления. Mg 0 – 2 e → Mg +2 2 2 Mg – восстановитель, процесс окисления. Mg 2 Si + 4 H 2 O = 2 Mg(OH)2 + Si. H 4↑ силан Mg 2 Si + 4 HCl = 2 Mg. Cl 2 + Si. H 4↑
При взаимодействии кремния с углем образуется карбид кремния Si. C – карборунд. Его кристаллическая решетка напоминает решетку алмаза, в ней атомы углерода и кремния чередуются. Карборунд по твердости приближается к алмазу. Из него изготавливают шлифовальные круги, точильные камни, наждачную бумагу. Составьте уравнение реакции. Назовите окислитель и восстановитель. Si 0 + С 0 = Si– 4 С+4 Si 0 + 4 e → Si – 4 4 1 Si – окислитель, процесс восстановления. С 0 – 4 e → С +4 4 1 C – восстановитель, процесс окисления. 2. Взаимодействие с металлами. Составьте уравнение реакции кремния с магнием. Назовите окислитель и восстановитель. Si 0 + Mg 0 = Mg 2+2 Si– 4 2 cилицид магния Si 0 + 4 e → Si – 4 4 1 Si – окислитель, процесс восстановления. Mg 0 – 2 e → Mg +2 2 2 Mg – восстановитель, процесс окисления. Mg 2 Si + 4 H 2 O = 2 Mg(OH)2 + Si. H 4↑ силан Mg 2 Si + 4 HCl = 2 Mg. Cl 2 + Si. H 4↑
 3. Взаимодействие со сложными веществами Кремний устойчив к действию большинства кислот, но аморфный кремний растворяется в плавиковой кислоте: Si + 6 HF = H 2[Si. F 6] + 2 H 2 Кремний хорошо растворяется в щелочах: Si + Na. OH + H 2 O → Na 2 Si. O 3 + H 2 Рассмотрите реакцию кремния с гидроксидом натрия как окислительновосстановительную. Назовите окислитель и восстановитель. Расставьте коэффициенты. Si 0 + Na. OH + H+2 O → Na 2 Si+4 O 3 + H 20 2 2 Si 0 – 4 e → Si+4 4 1 Si – восстановитель, процесс окисления. + 2 H+ + 2 e → H 20 2 2 H 2 O (за счет Н ) – окислитель, процесс восстановления. При взаимодействии кремния с сероводородом образуется сульфид кремния (IV) и водород. Напишите уравнение реакции. Si 0 + H+2 S = Si+4 S 2 + H 20 2 2 Si 0 – 4 e → Si+4 4 1 2 H+ + 2 e → H 20 2 2 Si – восстановитель, пр. окисления. H 2 S (за счет Н+) – окислитель, процесс восстановления.
3. Взаимодействие со сложными веществами Кремний устойчив к действию большинства кислот, но аморфный кремний растворяется в плавиковой кислоте: Si + 6 HF = H 2[Si. F 6] + 2 H 2 Кремний хорошо растворяется в щелочах: Si + Na. OH + H 2 O → Na 2 Si. O 3 + H 2 Рассмотрите реакцию кремния с гидроксидом натрия как окислительновосстановительную. Назовите окислитель и восстановитель. Расставьте коэффициенты. Si 0 + Na. OH + H+2 O → Na 2 Si+4 O 3 + H 20 2 2 Si 0 – 4 e → Si+4 4 1 Si – восстановитель, процесс окисления. + 2 H+ + 2 e → H 20 2 2 H 2 O (за счет Н ) – окислитель, процесс восстановления. При взаимодействии кремния с сероводородом образуется сульфид кремния (IV) и водород. Напишите уравнение реакции. Si 0 + H+2 S = Si+4 S 2 + H 20 2 2 Si 0 – 4 e → Si+4 4 1 2 H+ + 2 e → H 20 2 2 Si – восстановитель, пр. окисления. H 2 S (за счет Н+) – окислитель, процесс восстановления.
 Соединения кремния Оксид кремния (IV) 1. Cостав. Строение. Свойства 2. Химические свойства 3. Применение Кремниевая кислота 1. Состав. Строение. Свойства 2. Классификация 3. Химические свойства Соли кремниевой кислоты Силикатная промышленность
Соединения кремния Оксид кремния (IV) 1. Cостав. Строение. Свойства 2. Химические свойства 3. Применение Кремниевая кислота 1. Состав. Строение. Свойства 2. Классификация 3. Химические свойства Соли кремниевой кислоты Силикатная промышленность
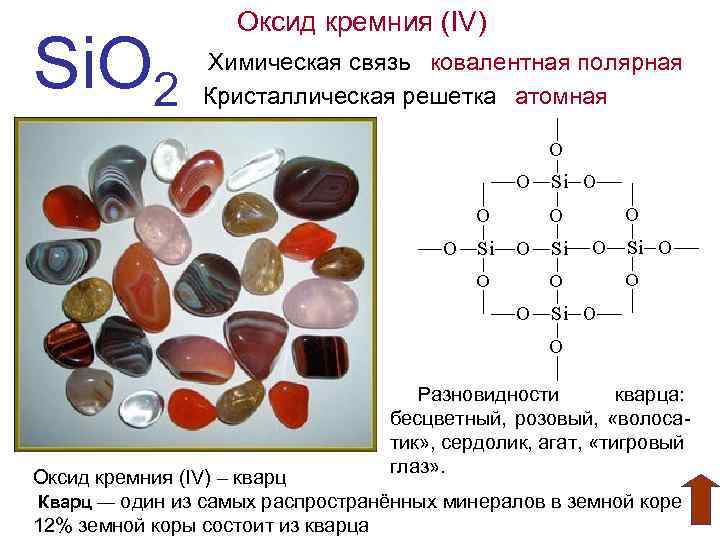 Si. O 2 Оксид кремния (IV) Химическая связь ковалентная полярная Кристаллическая решетка атомная Разновидности кварца: бесцветный, розовый, «волосатик» , сердолик, агат, «тигровый глаз» . Оксид кремния (IV) – кварц Кварц — один из самых распространённых минералов в земной коре 12% земной коры состоит из кварца
Si. O 2 Оксид кремния (IV) Химическая связь ковалентная полярная Кристаллическая решетка атомная Разновидности кварца: бесцветный, розовый, «волосатик» , сердолик, агат, «тигровый глаз» . Оксид кремния (IV) – кварц Кварц — один из самых распространённых минералов в земной коре 12% земной коры состоит из кварца
 Химические свойства оксида кремния (IV) Оксид кремния (IV) является оксидом: кислотным кислотный Оксид кремния (IV), как типичный оксид, способен реагировать с: 1. основными оксидами. 2. щелочами. Составьте уравнения реакций оксида кремния (IV) с оксидом кальция, гидроксидом натрия: Si. O 2 + Ca. O = Ca. Si. O 3 Si. O 2 + 2 Na. OH = Na 2 Si. O 3 + H 2 O Оксид кремния (IV) сплавляется с карбонатами щелочных металлов, также образуя силикаты: Si. O 2 + 2 Na 2 CO 3 = Na 2 Si. O 3 + CO 2 Оксид кремния (IV) взаимодействует с плавиковой кислотой SIO 2 + 6 HF = H 2[Si. F 6] + 2 H 2 O
Химические свойства оксида кремния (IV) Оксид кремния (IV) является оксидом: кислотным кислотный Оксид кремния (IV), как типичный оксид, способен реагировать с: 1. основными оксидами. 2. щелочами. Составьте уравнения реакций оксида кремния (IV) с оксидом кальция, гидроксидом натрия: Si. O 2 + Ca. O = Ca. Si. O 3 Si. O 2 + 2 Na. OH = Na 2 Si. O 3 + H 2 O Оксид кремния (IV) сплавляется с карбонатами щелочных металлов, также образуя силикаты: Si. O 2 + 2 Na 2 CO 3 = Na 2 Si. O 3 + CO 2 Оксид кремния (IV) взаимодействует с плавиковой кислотой SIO 2 + 6 HF = H 2[Si. F 6] + 2 H 2 O
 Применение оксида кремния (IV) Оксид кремния (IV) применяют: 1 2 3 4 5 6 7 8 в производстве стекла, керамики, абразивов, как наполнитель в производстве резин для получения кремния при производстве кремнезёмистых огнеупоров в хроматографии Кристаллы кварца используются: в радиотехнике, в зажигалках. ультразвуковых установках, Аморфный непористый оксид кремния (IV) применяется: в пищевой промышленности в качестве вспомогательного вещества E 551, препятствующего слёживанию и комкованию, парафармацевтике (зубные пасты), в фармацевтической промышленности в качестве вспомогательного вещества (внесён в большинство фармакопей), пищевой добавки или лекарственного препарата в качестве энтеросорбента. Искусственно полученные плёнки оксид кремния (IV) используются в качестве изолятора при производстве микросхем и других электронных компонентов. 9 Также используется для производства волоконно-оптических кабелей используется чистый плавленый оксид кремния (IV) с добавкой в него некоторых специальных ингредиентов
Применение оксида кремния (IV) Оксид кремния (IV) применяют: 1 2 3 4 5 6 7 8 в производстве стекла, керамики, абразивов, как наполнитель в производстве резин для получения кремния при производстве кремнезёмистых огнеупоров в хроматографии Кристаллы кварца используются: в радиотехнике, в зажигалках. ультразвуковых установках, Аморфный непористый оксид кремния (IV) применяется: в пищевой промышленности в качестве вспомогательного вещества E 551, препятствующего слёживанию и комкованию, парафармацевтике (зубные пасты), в фармацевтической промышленности в качестве вспомогательного вещества (внесён в большинство фармакопей), пищевой добавки или лекарственного препарата в качестве энтеросорбента. Искусственно полученные плёнки оксид кремния (IV) используются в качестве изолятора при производстве микросхем и других электронных компонентов. 9 Также используется для производства волоконно-оптических кабелей используется чистый плавленый оксид кремния (IV) с добавкой в него некоторых специальных ингредиентов
 1 стекло керамика абразивы
1 стекло керамика абразивы
 2 3 4 5
2 3 4 5
 Радиотехника 6 Ультрозвуковые установки Зажигалки
Радиотехника 6 Ультрозвуковые установки Зажигалки
 7 Зубная паста Е 551
7 Зубная паста Е 551
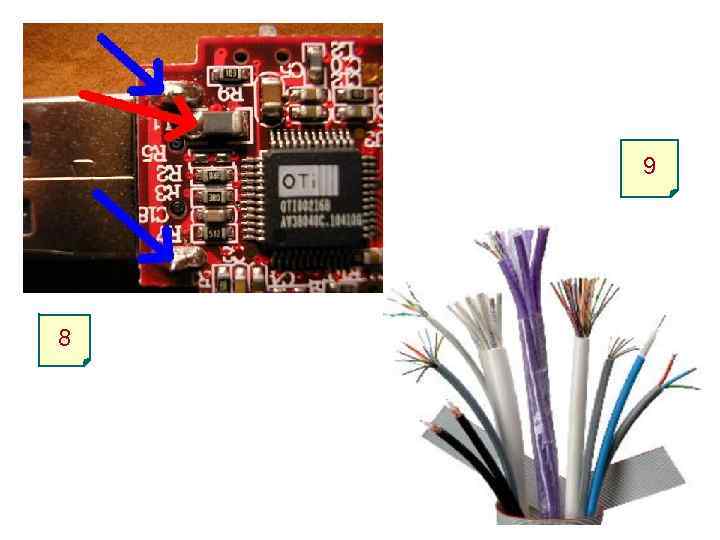 9 8
9 8
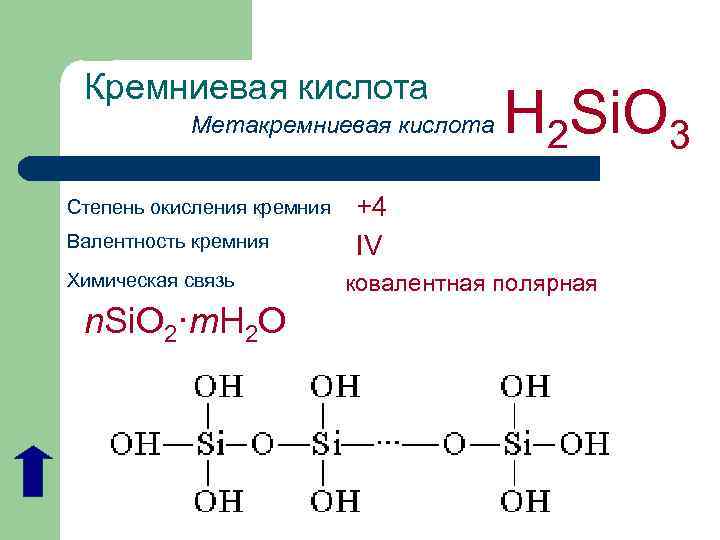 Кремниевая кислота Метакремниевая кислота Степень окисления кремния Валентность кремния Химическая связь n. Si. O 2·m. H 2 O H 2 Si. O 3 +4 IV ковалентная полярная
Кремниевая кислота Метакремниевая кислота Степень окисления кремния Валентность кремния Химическая связь n. Si. O 2·m. H 2 O H 2 Si. O 3 +4 IV ковалентная полярная
 Кремниевая кислота (Н 2 Si. О 3). Классификация кремниевая кислота по: наличию кислорода: основности: растворимости в воде: степени электролитической диссоциации: стабильности: кислородная двухосновная нерастворимая слабая нестабильная
Кремниевая кислота (Н 2 Si. О 3). Классификация кремниевая кислота по: наличию кислорода: основности: растворимости в воде: степени электролитической диссоциации: стабильности: кислородная двухосновная нерастворимая слабая нестабильная
 Кремниевая кислота образуется в виде белого студенистого осадка при действии на силикаты кислоты, например соляной Составьте уравнение реакции силиката натрия с соляной кислотой: Na 2 Si. O 3 + 2 HCl = 2 Na. Cl + H 2 Si. O 3↓ Кремниевая кислота очень слабая, она слабее угольной кислоты. Лабораторный опыт: пропустим углекислый газ через раствор силиката натрия. Выделяющийся белый осадок – это и есть кремниевая кислота. Составьте уравнение реакции: Na 2 Si. O 3 + H 2 О + СО 2 = Na 2 CО 3 + H 2 Si. O 3↓ Осадок, полученный в результате обмена, представляет собой смесь различных соединений: H 2 Si. O 3 H 4 Si. O 4 H 2 Si 2 O 5 (H 2 Si. O 3)n Поэтому состав кислот можно выразить общей формулой n. Si. O 2·m. H 2 O Кремниевая кислота при слабом нагревании теряет воду, превращаясь в кремнезем – кремниевый ангидрид: t H 2 Si. O 3 = Si. O 2 + H 2 O
Кремниевая кислота образуется в виде белого студенистого осадка при действии на силикаты кислоты, например соляной Составьте уравнение реакции силиката натрия с соляной кислотой: Na 2 Si. O 3 + 2 HCl = 2 Na. Cl + H 2 Si. O 3↓ Кремниевая кислота очень слабая, она слабее угольной кислоты. Лабораторный опыт: пропустим углекислый газ через раствор силиката натрия. Выделяющийся белый осадок – это и есть кремниевая кислота. Составьте уравнение реакции: Na 2 Si. O 3 + H 2 О + СО 2 = Na 2 CО 3 + H 2 Si. O 3↓ Осадок, полученный в результате обмена, представляет собой смесь различных соединений: H 2 Si. O 3 H 4 Si. O 4 H 2 Si 2 O 5 (H 2 Si. O 3)n Поэтому состав кислот можно выразить общей формулой n. Si. O 2·m. H 2 O Кремниевая кислота при слабом нагревании теряет воду, превращаясь в кремнезем – кремниевый ангидрид: t H 2 Si. O 3 = Si. O 2 + H 2 O
 Соли кремниевой кислоты силикаты Растворимы в воде силикаты щелочных металлов. Силикат натрия называют «растворимым или жидким стеклом» из-за способности образовывать вязкие растворы, постепенно превращающиеся в стекловидную массу.
Соли кремниевой кислоты силикаты Растворимы в воде силикаты щелочных металлов. Силикат натрия называют «растворимым или жидким стеклом» из-за способности образовывать вязкие растворы, постепенно превращающиеся в стекловидную массу.
 Нерастворимые в воде силикаты В природе силикаты представлены в виде минералов, входят в состав большинства горных пород, слагающих основную часть земной коры
Нерастворимые в воде силикаты В природе силикаты представлены в виде минералов, входят в состав большинства горных пород, слагающих основную часть земной коры
 Лабораторный опыт Испытание раствора силиката натрия индикатором Добавьте к выданному раствору силиката натрия одну каплю фенолфталиина. О чем свидетельствует появление окраски? Какую среду имеет раствор? Чем это вызвано? Напишите уравнение полного гидролиза. Na 2 Si. O 3 → 2 Na+ + Si. O 32– 1 ступень Si. O 32– + H 2 O ↔ HSi. O 3– + OH– Si. O 32– + 2 Na+ + H 2 O ↔ Na+ + HSi. O 3– + Na+ +OH– Na 2 Si. O 3+ H 2 O ↔ Na. HSi. O 3 + Na. OH HSi. O 3– + H 2 O = ↓H 2 Si. O 3 + OH– 2 ступень HSi. O 3– + Na+ + H 2 O = ↓H 2 Si. O 3– + Na+ +OH– Na. Si. O 3 + H 2 O = ↓H 2 Si. O 3 + Na. OH
Лабораторный опыт Испытание раствора силиката натрия индикатором Добавьте к выданному раствору силиката натрия одну каплю фенолфталиина. О чем свидетельствует появление окраски? Какую среду имеет раствор? Чем это вызвано? Напишите уравнение полного гидролиза. Na 2 Si. O 3 → 2 Na+ + Si. O 32– 1 ступень Si. O 32– + H 2 O ↔ HSi. O 3– + OH– Si. O 32– + 2 Na+ + H 2 O ↔ Na+ + HSi. O 3– + Na+ +OH– Na 2 Si. O 3+ H 2 O ↔ Na. HSi. O 3 + Na. OH HSi. O 3– + H 2 O = ↓H 2 Si. O 3 + OH– 2 ступень HSi. O 3– + Na+ + H 2 O = ↓H 2 Si. O 3– + Na+ +OH– Na. Si. O 3 + H 2 O = ↓H 2 Si. O 3 + Na. OH
 Силикатная промышленность Соединения кремния служат основой для производства керамики, стекла, цемента, фарфора, силикатного кирпича, т. е. всех тех материалов, которые составляют основу силикатной промышленности
Силикатная промышленность Соединения кремния служат основой для производства керамики, стекла, цемента, фарфора, силикатного кирпича, т. е. всех тех материалов, которые составляют основу силикатной промышленности
 Керамика (др. -греч. κέραμος — глина) — изделия из неорганических, неметаллических материалов (например, глины) и их смесей с минеральными добавками, изготовляемые под воздействием высокой температуры с последующим охлаждением. В узком смысле слово керамика обозначает глину прошедшую обжиг. Самая ранняя керамика использовалась как посуда из глины или из смесей её с другими материалами. В настоящее время керамика применяется как индустриальный материал (машиностроение, приборостроение, авиационная промышленность и др. ), как строительный, художественный, как материал, широко используемый в медицине.
Керамика (др. -греч. κέραμος — глина) — изделия из неорганических, неметаллических материалов (например, глины) и их смесей с минеральными добавками, изготовляемые под воздействием высокой температуры с последующим охлаждением. В узком смысле слово керамика обозначает глину прошедшую обжиг. Самая ранняя керамика использовалась как посуда из глины или из смесей её с другими материалами. В настоящее время керамика применяется как индустриальный материал (машиностроение, приборостроение, авиационная промышленность и др. ), как строительный, художественный, как материал, широко используемый в медицине.
 Стекло известно уже несколько тысячелетий. Первые упоминания о стекле связываются с находками, найденными в древнем Египте в 7 000 годах до нашей эры- стеклянными бусами и амулетами. А первые стекольные заводы начали появляться только в ХVIII веке. Стекло представляет собой находящуюся в застывшем состоянии жидкость. Это - аморфное вещество, которое не обладает в твердом состоянии свойствами кристаллического вещества. Основными компонентами, образующими стекло, являются: кварцевый песок (69 -74%); сода (12 -16%); известняк и доломит (5 -12%) и в небольших процентных соотношениях некоторые другие компоненты. Кроме основных сырьевых компонентов можно вводить различные добавки, например, для окрашивания стекла в желаемый цвет или для изменения других свойств стекла.
Стекло известно уже несколько тысячелетий. Первые упоминания о стекле связываются с находками, найденными в древнем Египте в 7 000 годах до нашей эры- стеклянными бусами и амулетами. А первые стекольные заводы начали появляться только в ХVIII веке. Стекло представляет собой находящуюся в застывшем состоянии жидкость. Это - аморфное вещество, которое не обладает в твердом состоянии свойствами кристаллического вещества. Основными компонентами, образующими стекло, являются: кварцевый песок (69 -74%); сода (12 -16%); известняк и доломит (5 -12%) и в небольших процентных соотношениях некоторые другие компоненты. Кроме основных сырьевых компонентов можно вводить различные добавки, например, для окрашивания стекла в желаемый цвет или для изменения других свойств стекла.

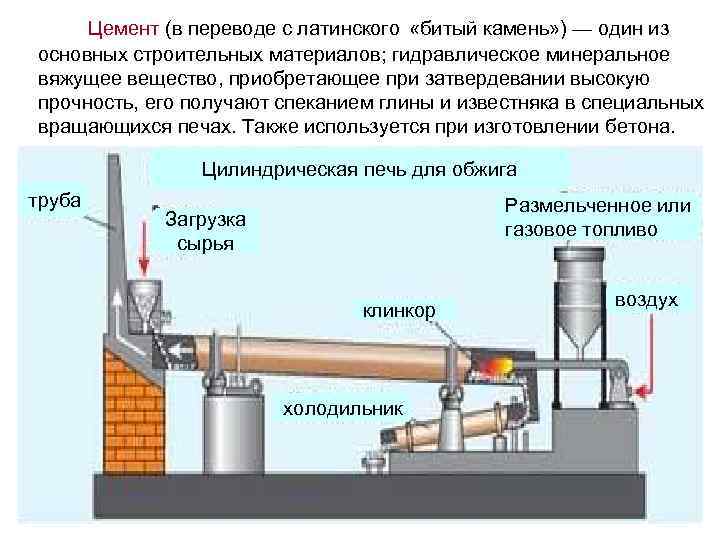 Цемент (в переводе с латинского «битый камень» ) — oдин из основных строительных материалов; гидравлическое минеральное вяжущее вещество, приобретающее при затвердевании высокую прочность, его получают спеканием глины и известняка в специальных вращающихся печах. Также используется при изготовлении бетона. Цилиндрическая печь для обжига труба Размельченное или газовое топливо Загрузка сырья клинкор холодильник воздух
Цемент (в переводе с латинского «битый камень» ) — oдин из основных строительных материалов; гидравлическое минеральное вяжущее вещество, приобретающее при затвердевании высокую прочность, его получают спеканием глины и известняка в специальных вращающихся печах. Также используется при изготовлении бетона. Цилиндрическая печь для обжига труба Размельченное или газовое топливо Загрузка сырья клинкор холодильник воздух

 Основные виды тонкой керамики – фарфор, полуфарфор, фаянс, майолика Фарфо р (тур. farfur, fagfur, от перс. фегфур) — вид керамики, непроницаемый для воды и газа. В тонком слое просвечивающийся. Фарфор обладает высокой механической прочностью, химической и термической стойкостью, электроизоляционными свойствами и применяется для изготовления высококачественной посуды, художественно-декоративных и санитарно-технических изделий, электро- и радиотехнических деталей, коррозионностойких аппаратов химической технологии, низкочастотных изоляторов и т. д. Фарфор обычно получают высокотемпературным обжигом тонкодисперсной смеси каолина, полевого шпата, кварца и пластичной глины.
Основные виды тонкой керамики – фарфор, полуфарфор, фаянс, майолика Фарфо р (тур. farfur, fagfur, от перс. фегфур) — вид керамики, непроницаемый для воды и газа. В тонком слое просвечивающийся. Фарфор обладает высокой механической прочностью, химической и термической стойкостью, электроизоляционными свойствами и применяется для изготовления высококачественной посуды, художественно-декоративных и санитарно-технических изделий, электро- и радиотехнических деталей, коррозионностойких аппаратов химической технологии, низкочастотных изоляторов и т. д. Фарфор обычно получают высокотемпературным обжигом тонкодисперсной смеси каолина, полевого шпата, кварца и пластичной глины.
 Фаянс (фр. faience, от названия итальянского города Фаэнца, где производился фаянс), керамические изделия (облицовочные плитки, архитектурные детали, посуда, умывальники и др. ), имеющие плотный мелкопористый черепок (обычно белый), покрытые прозрачной или глухой (непрозрачной) глазурью. Для изготовления фаянса применяются те же материалы, что и для производства фарфора (меняется лишь соотношение компонентов), и сходная технология (различия в режиме обжига)
Фаянс (фр. faience, от названия итальянского города Фаэнца, где производился фаянс), керамические изделия (облицовочные плитки, архитектурные детали, посуда, умывальники и др. ), имеющие плотный мелкопористый черепок (обычно белый), покрытые прозрачной или глухой (непрозрачной) глазурью. Для изготовления фаянса применяются те же материалы, что и для производства фарфора (меняется лишь соотношение компонентов), и сходная технология (различия в режиме обжига)
 Майолика (от итал. Maiolica — Мальорка) — разновидность керамики, изготавливаемой из обожжённой глины с использованием расписной глазури. В технике майолики изготовляются как декоративные панно, наличники, изразцы и т. п. , так и посуда и даже монументальные скульптурные изображения.
Майолика (от итал. Maiolica — Мальорка) — разновидность керамики, изготавливаемой из обожжённой глины с использованием расписной глазури. В технике майолики изготовляются как декоративные панно, наличники, изразцы и т. п. , так и посуда и даже монументальные скульптурные изображения.
 Силикатный кирпич (белый) — кирпич, состоящий из кварцевого песка и извести. Цветной силикатный кирпич Цветной силикатный камень используют для облицовки зданий
Силикатный кирпич (белый) — кирпич, состоящий из кварцевого песка и извести. Цветной силикатный кирпич Цветной силикатный камень используют для облицовки зданий
 1. Последовательность цифр 2 – 8 – 4 соответствует распределению электронов по энергетическим уровням атома: А) углерода; Б) кремния; В) олова; Г) германия. Б А 2. Высшую степень окисления кремний проявляет в веществе: А) оксид кремния (IV); Б) силицид натрия; В) силан; Г) силицид кальци 3. Кремний получают в результате взаимодействия оксида кремния (IV): В А) с натрием; Б) с бериллием; В) с магнием; Г) с калием. 4. Взаимодействие каких веществ соответствует ионное уравнение В 2 H+ + Si. O 32– = H 2 Si. O 3↓ А) силиката кальция и серной кислоты; В) силиката натрия и серной кты; Б) силиката натрия и углекислого газа; Г) воды и диоксида кремния. 5. Водный раствор, какого из данных соединений кремния называется Г силикатным клеем: А) H 2 Si. O 3; Б) Mg. Si. O 3; В) Ca. Si. O 3; Г) Na 2 Si. O 3 6. Формула неизвестного вещества в цепочке превращений: Si. O 2 → X → Mg 2 Si А) Si; Б) Mg; В) H 2 Si. O 3; Г) Na 2 Si. O 3 А 7. Какое из перечисленных веществ не реагирует с раствором силиката Г натрия: А) углекислый газ; Б) вода; В) серная кислота; Г) гидроксид натрия
1. Последовательность цифр 2 – 8 – 4 соответствует распределению электронов по энергетическим уровням атома: А) углерода; Б) кремния; В) олова; Г) германия. Б А 2. Высшую степень окисления кремний проявляет в веществе: А) оксид кремния (IV); Б) силицид натрия; В) силан; Г) силицид кальци 3. Кремний получают в результате взаимодействия оксида кремния (IV): В А) с натрием; Б) с бериллием; В) с магнием; Г) с калием. 4. Взаимодействие каких веществ соответствует ионное уравнение В 2 H+ + Si. O 32– = H 2 Si. O 3↓ А) силиката кальция и серной кислоты; В) силиката натрия и серной кты; Б) силиката натрия и углекислого газа; Г) воды и диоксида кремния. 5. Водный раствор, какого из данных соединений кремния называется Г силикатным клеем: А) H 2 Si. O 3; Б) Mg. Si. O 3; В) Ca. Si. O 3; Г) Na 2 Si. O 3 6. Формула неизвестного вещества в цепочке превращений: Si. O 2 → X → Mg 2 Si А) Si; Б) Mg; В) H 2 Si. O 3; Г) Na 2 Si. O 3 А 7. Какое из перечисленных веществ не реагирует с раствором силиката Г натрия: А) углекислый газ; Б) вода; В) серная кислота; Г) гидроксид натрия
