Кремний Историческая справка Несмотря на распространенность








kremniy.pptx
- Размер: 183.0 Кб
- Автор:
- Количество слайдов: 9
Описание презентации Кремний Историческая справка Несмотря на распространенность по слайдам
 Кремний
Кремний
 Историческая справка • Несмотря на распространенность в природе, элементарный кремний открыли довольно поздно, в 1825 г. Шведский химик Йенс Якоб Берцелиус выделил не очень чистый аморфный кремний коричневого цвета. Для этого он восстановил металлическим калием тетрафторид кремния. Элемент назван от латинского слова «силекс» – кремень.
Историческая справка • Несмотря на распространенность в природе, элементарный кремний открыли довольно поздно, в 1825 г. Шведский химик Йенс Якоб Берцелиус выделил не очень чистый аморфный кремний коричневого цвета. Для этого он восстановил металлическим калием тетрафторид кремния. Элемент назван от латинского слова «силекс» – кремень.
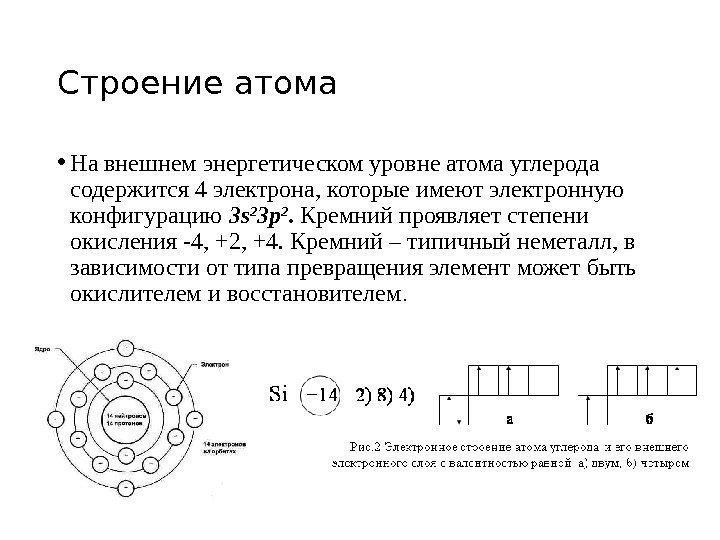
 Строение атома • На внешнем энергетическом уровне атома углерода содержится 4 электрона, которые имеют электронную конфигурацию 3 s 2 3 p 2. Кремний проявляет степени окисления -4, +2, +4. Кремний – типичный неметалл, в зависимости от типа превращения элемент может быть окислителем и восстановителем.
Строение атома • На внешнем энергетическом уровне атома углерода содержится 4 электрона, которые имеют электронную конфигурацию 3 s 2 3 p 2. Кремний проявляет степени окисления -4, +2, +4. Кремний – типичный неметалл, в зависимости от типа превращения элемент может быть окислителем и восстановителем.
 Получение • В лаборатории • Восстановлением из оксида магнием или алюминием: • Si. O 2 + 2 Mg = Si + 2 Mg. O; • 3 Si. O 2 + 4 Al = 3 Si + 2 Al 2 O 3. • В промышленности • Восстановлением из оксида коксом в электрических печах: • Si. O 2 + 2 C = Si + 2 CO. • При таком процессе кремний довольно сильно загрязнен карбидами кремния. • Наиболее чистый кремний получают восстановлением тетрахлорида кремния водородом при 1200 °С: • Si. Cl 4 + 2 H 2 = Si + 4 HCl, • или цинком: • Si. Cl 4 + 2 Zn = Si + 2 Zn. Cl 2. • Также чистый кремний получается при термическом разложении силана: • Si. H 4 = Si + 2 H 2.
Получение • В лаборатории • Восстановлением из оксида магнием или алюминием: • Si. O 2 + 2 Mg = Si + 2 Mg. O; • 3 Si. O 2 + 4 Al = 3 Si + 2 Al 2 O 3. • В промышленности • Восстановлением из оксида коксом в электрических печах: • Si. O 2 + 2 C = Si + 2 CO. • При таком процессе кремний довольно сильно загрязнен карбидами кремния. • Наиболее чистый кремний получают восстановлением тетрахлорида кремния водородом при 1200 °С: • Si. Cl 4 + 2 H 2 = Si + 4 HCl, • или цинком: • Si. Cl 4 + 2 Zn = Si + 2 Zn. Cl 2. • Также чистый кремний получается при термическом разложении силана: • Si. H 4 = Si + 2 H 2.
 Химические свойства • Взаимодействие с галогенами При обычных условиях кремний довольно инертен, что объясняется прочностью его кристаллической решетки, непосредственно взаимодействует только с фтором, при этом проявляет восстановительные свойства: • Si + 2 F 2 = Si. F 4. • С хлором реагирует при нагревании до 400– 600 °С: • Si + 2 Cl 2 = Si. Cl 4. • Взаимодействие с кислородом Измельченный кремний при нагревании до 400– 600 °С реагирует с кислородом: • Si + O 2 = Si. O 2. • Взаимодействие с другими неметаллами При очень высокой температуре около 2000 °С реагирует с углеродом: • Si + C = Si. C • и бором: • Si + 3 B = B 3 Si. • При 1000 °С реагирует с азотом: • 3 Si + 2 N 2 = Si 3 N 4. • С водородом не взаимодействует.
Химические свойства • Взаимодействие с галогенами При обычных условиях кремний довольно инертен, что объясняется прочностью его кристаллической решетки, непосредственно взаимодействует только с фтором, при этом проявляет восстановительные свойства: • Si + 2 F 2 = Si. F 4. • С хлором реагирует при нагревании до 400– 600 °С: • Si + 2 Cl 2 = Si. Cl 4. • Взаимодействие с кислородом Измельченный кремний при нагревании до 400– 600 °С реагирует с кислородом: • Si + O 2 = Si. O 2. • Взаимодействие с другими неметаллами При очень высокой температуре около 2000 °С реагирует с углеродом: • Si + C = Si. C • и бором: • Si + 3 B = B 3 Si. • При 1000 °С реагирует с азотом: • 3 Si + 2 N 2 = Si 3 N 4. • С водородом не взаимодействует.
 • Взаимодействие с галогеноводородами С фтороводородом реагирует при обычных условиях: • Si + 4 HF = Si. F 4 + 2 H 2 , • с хлороводородом – при 300 °С, с бромоводородом – при 500 °С. • Взаимодействие с металлами Окислительные свойства для кремния менее характерны, но они проявляются в реакциях с металлами, при этом образует силициды: • 2 Ca + Si = Ca 2 Si. • Взаимодействие с кислотами Кремний устойчив к действию кислот, в кислой среде он покрывается нерастворимой пленкой оксида и пассивируется. Кремний взаимодействует только со смесью плавиковой и азотной кислот: • 3 Si + 4 HNO 3 + 18 HF = 3 H 2 [Si. F 6 ] + 4 NO + 8 H 2 O. • Взаимодействие со щелочами Растворяется в щелочах, образуя силикат и водород: • Si + 2 Na. OH + H 2 O = Na 2 Si. O 3 + H 2.
• Взаимодействие с галогеноводородами С фтороводородом реагирует при обычных условиях: • Si + 4 HF = Si. F 4 + 2 H 2 , • с хлороводородом – при 300 °С, с бромоводородом – при 500 °С. • Взаимодействие с металлами Окислительные свойства для кремния менее характерны, но они проявляются в реакциях с металлами, при этом образует силициды: • 2 Ca + Si = Ca 2 Si. • Взаимодействие с кислотами Кремний устойчив к действию кислот, в кислой среде он покрывается нерастворимой пленкой оксида и пассивируется. Кремний взаимодействует только со смесью плавиковой и азотной кислот: • 3 Si + 4 HNO 3 + 18 HF = 3 H 2 [Si. F 6 ] + 4 NO + 8 H 2 O. • Взаимодействие со щелочами Растворяется в щелочах, образуя силикат и водород: • Si + 2 Na. OH + H 2 O = Na 2 Si. O 3 + H 2.
 Оксиды кремния • Взаимодействие с металлами При температуре выше 1000 °С реагирует с активными металлами, при этом образуется кремний: • Si. O 2 + 2 Mg = Si + 2 Mg. O • или при избытке восстановителя – силициды: • Si. O 2 + 4 Mg = Mg 2 Si + 2 Mg. O. • Взаимодействие с неметаллами Реагирует с водородом: • Si. O 2 + 2 Н 2 = Si + 2 Н 2 O. • Взаимодействует с углеродом: • Si. O 2 + 3 С = Si. С + 2 СO. • Свойства кислотного оксида Диоксид кремния – типичный кислотный оксид, но не растворяется в воде, при сплавлении реагирует со щелочами: • Si. O 2 + 2 KOH = K 2 Si. O 3 + H 2 O, • основными оксидами: • Si. O 2 + Mg. О = Mg. Si. O 3. • и карбонатами щелочных металлов: • Si. O 2 + K 2 CO 3 = K 2 Si. O 3 + CO 2. • С кислотами не реагирует, исключение составляет плавиковая кислота: • Si. O 2 + 6 HF = H 2 Si. F 6 + 2 H 2 O.
Оксиды кремния • Взаимодействие с металлами При температуре выше 1000 °С реагирует с активными металлами, при этом образуется кремний: • Si. O 2 + 2 Mg = Si + 2 Mg. O • или при избытке восстановителя – силициды: • Si. O 2 + 4 Mg = Mg 2 Si + 2 Mg. O. • Взаимодействие с неметаллами Реагирует с водородом: • Si. O 2 + 2 Н 2 = Si + 2 Н 2 O. • Взаимодействует с углеродом: • Si. O 2 + 3 С = Si. С + 2 СO. • Свойства кислотного оксида Диоксид кремния – типичный кислотный оксид, но не растворяется в воде, при сплавлении реагирует со щелочами: • Si. O 2 + 2 KOH = K 2 Si. O 3 + H 2 O, • основными оксидами: • Si. O 2 + Mg. О = Mg. Si. O 3. • и карбонатами щелочных металлов: • Si. O 2 + K 2 CO 3 = K 2 Si. O 3 + CO 2. • С кислотами не реагирует, исключение составляет плавиковая кислота: • Si. O 2 + 6 HF = H 2 Si. F 6 + 2 H 2 O.
 Силан • Многие силаны на воздухе воспламеняются и сгорают с большим выделением тепла: • Si. H 4 + 2 O 2 = Si. O 2 + 2 H 2 O. • Силаны – кислотные гидриды, активно взаимодействуют со щелочами: • Si. H 4 + 2 Na. OH + H 2 O = Na 2 Si. O 3 + 4 H 2. • В нейтральной и кислой среде силаны устойчивы. • Силан является сильным восстановителем: • Si. H 4 + 2 Ag. Cl = Si. H 3 Cl + HCl + 2 Ag. • При нагревании он разлагается: • Si. H 4 = Si + 2 H 2. • Образуются при действии на силицид магния соляной кислотой: • Mg 2 Si + 4 HCl = 2 Mg. Cl 2 + Si. H 4. • Силаны химически менее устойчивы, чем углеводороды. • https: //www. youtube. com/watch? v=f. K-r. Rx. ME 1 Fg
Силан • Многие силаны на воздухе воспламеняются и сгорают с большим выделением тепла: • Si. H 4 + 2 O 2 = Si. O 2 + 2 H 2 O. • Силаны – кислотные гидриды, активно взаимодействуют со щелочами: • Si. H 4 + 2 Na. OH + H 2 O = Na 2 Si. O 3 + 4 H 2. • В нейтральной и кислой среде силаны устойчивы. • Силан является сильным восстановителем: • Si. H 4 + 2 Ag. Cl = Si. H 3 Cl + HCl + 2 Ag. • При нагревании он разлагается: • Si. H 4 = Si + 2 H 2. • Образуются при действии на силицид магния соляной кислотой: • Mg 2 Si + 4 HCl = 2 Mg. Cl 2 + Si. H 4. • Силаны химически менее устойчивы, чем углеводороды. • https: //www. youtube. com/watch? v=f. K-r. Rx. ME 1 Fg
 Силициды
Силициды
