КОРРОЗИЯ МЕТАЛЛОВ Формы коррозии


















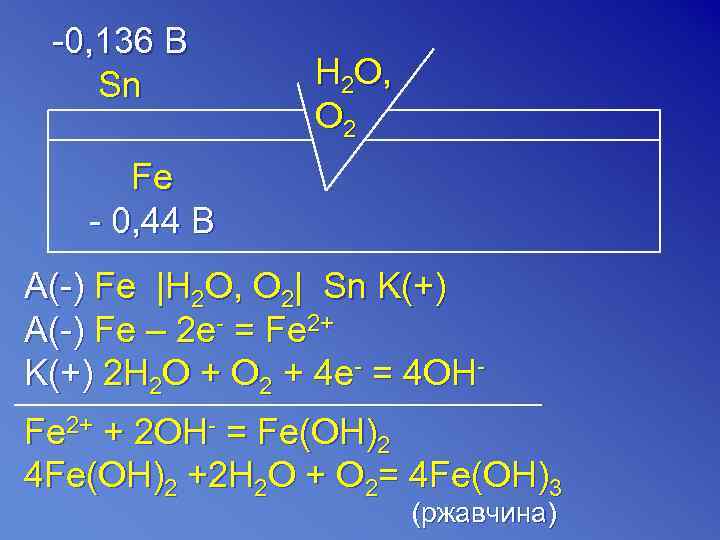
 КОРРОЗИЯ МЕТАЛЛОВ
КОРРОЗИЯ МЕТАЛЛОВ
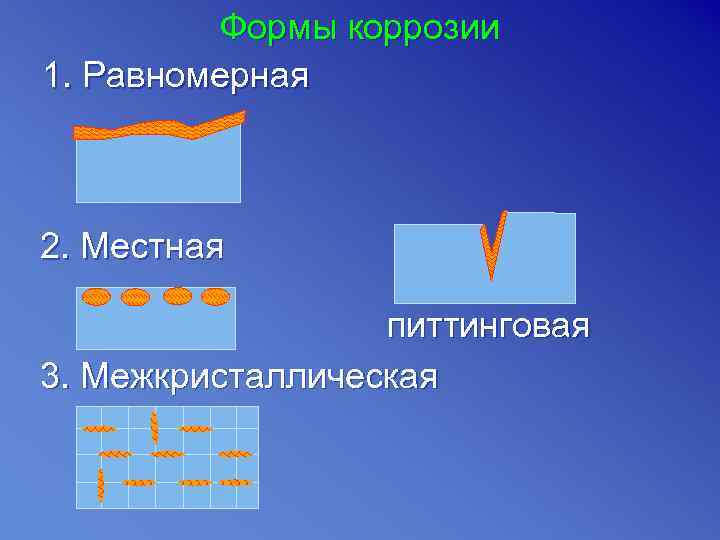
 Формы коррозии 1. Равномерная 2. Местная питтинговая 3. Межкристаллическая
Формы коррозии 1. Равномерная 2. Местная питтинговая 3. Межкристаллическая
 1. Химическая коррозия При 250° окисление железа 2 Fe – 2 e- = Fe 2+ 1 O 2 + 4 e- = 2 O 2 - 2 Fe + O 2 = 2 Fe. O Это О. B. процесс в отсутствии электролитов, при высоких температурах, в газовых и в неводных органических средах.
1. Химическая коррозия При 250° окисление железа 2 Fe – 2 e- = Fe 2+ 1 O 2 + 4 e- = 2 O 2 - 2 Fe + O 2 = 2 Fe. O Это О. B. процесс в отсутствии электролитов, при высоких температурах, в газовых и в неводных органических средах.
 В зависимости от воздействия на металл окружающей среды различают виды коррозии: 1. Химическая 2. Электрохимическая 3. Биологическая (связана с жизне- деятельностью простейших микроорганизмов, вирусов, бактерий – железобактерий, серобактерий) 4. Специфические виды коррозии (под действием излучения)
В зависимости от воздействия на металл окружающей среды различают виды коррозии: 1. Химическая 2. Электрохимическая 3. Биологическая (связана с жизне- деятельностью простейших микроорганизмов, вирусов, бактерий – железобактерий, серобактерий) 4. Специфические виды коррозии (под действием излучения)
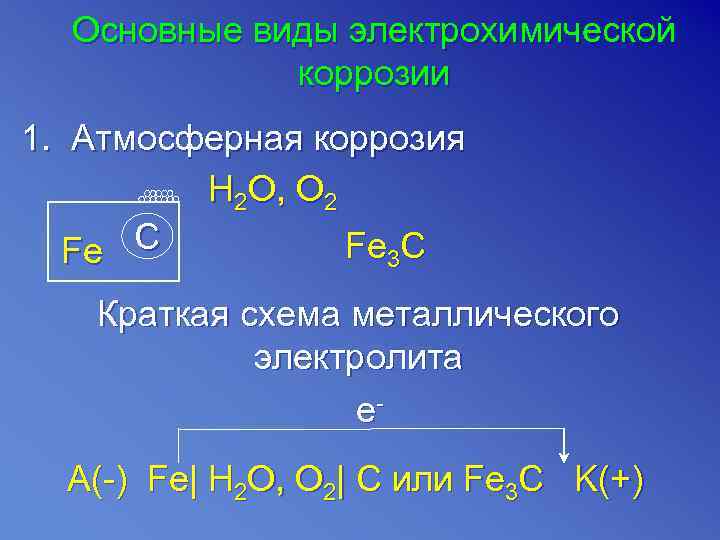
 Основные виды электрохимической коррозии 1. Атмосферная коррозия H 2 O , О 2 Fe C Fe 3 C Краткая схема металлического электролита e- A(-) Fe| H 2 O, O 2| C или Fe 3 C K(+)
Основные виды электрохимической коррозии 1. Атмосферная коррозия H 2 O , О 2 Fe C Fe 3 C Краткая схема металлического электролита e- A(-) Fe| H 2 O, O 2| C или Fe 3 C K(+)
 A(-) Fe – 2 e- → Fe 2+ K(+) 2 H 2 O + O 2 + 4 e- → 4 OH- Fe 2+ + 2 OH- = Fe(ОН)2 4 Fe(OH)2 + 2 H 2 O + O 2 = 4 Fe(OH)3 (продукт коррозии) 2. Почвенная коррозия. – коррозия в грунте. Водородная деполяризация 2 H+ + 2 e- = H 2↑
A(-) Fe – 2 e- → Fe 2+ K(+) 2 H 2 O + O 2 + 4 e- → 4 OH- Fe 2+ + 2 OH- = Fe(ОН)2 4 Fe(OH)2 + 2 H 2 O + O 2 = 4 Fe(OH)3 (продукт коррозии) 2. Почвенная коррозия. – коррозия в грунте. Водородная деполяризация 2 H+ + 2 e- = H 2↑
 Кислородная деполяризация О 2 + 2 H 2 O + 4 e- = 4 OH- Характер деполяризации зависит от среды. В кислой среде p. H<7 – водородная деполяризация A(-) Fe |HCl| Cu К(+) E 0 Fe/Fe 2+ = -0. 44 B E 0 Cu/Cu 2+ = + 0. 34 В
Кислородная деполяризация О 2 + 2 H 2 O + 4 e- = 4 OH- Характер деполяризации зависит от среды. В кислой среде p. H<7 – водородная деполяризация A(-) Fe |HCl| Cu К(+) E 0 Fe/Fe 2+ = -0. 44 B E 0 Cu/Cu 2+ = + 0. 34 В
 A(-) Fe – 2 e- = Fe 2+ K(+) 2 H+ + 2 e- = H 2↑ Fe + 2 H+ = Fe 2+ + H 2 В молекулярной форме Fe + 2 HCl = Fe. Cl 2 + H 2↑ При p. H = 7 в отсутствии кислорода в воде идет также водородная деполяризация.
A(-) Fe – 2 e- = Fe 2+ K(+) 2 H+ + 2 e- = H 2↑ Fe + 2 H+ = Fe 2+ + H 2 В молекулярной форме Fe + 2 HCl = Fe. Cl 2 + H 2↑ При p. H = 7 в отсутствии кислорода в воде идет также водородная деполяризация.
 A(-) Fe |H 2 O| Cu K(+) A(-) Fe – 2 e- = Fe 2+ K(+) 2 H 2 O + 2 e- = H 2 + 2 OH- Fe + 2 H 2 O = Fe 2+ + H 2 + 2 OH- Fe +2 H 2 O = Fe(OH)2 + H 2↑ При коррозии p. H = 7 или p. H > 7, в присутствии растворенного О 2 наблюдается кислородная деполяризация.
A(-) Fe |H 2 O| Cu K(+) A(-) Fe – 2 e- = Fe 2+ K(+) 2 H 2 O + 2 e- = H 2 + 2 OH- Fe + 2 H 2 O = Fe 2+ + H 2 + 2 OH- Fe +2 H 2 O = Fe(OH)2 + H 2↑ При коррозии p. H = 7 или p. H > 7, в присутствии растворенного О 2 наблюдается кислородная деполяризация.
 A(-) Fe |H 2 O, О 2| Cu K(+) A(-) Fe – 2 e- = Fe 2+ K(+) 2 H 2 O + О 2 + 4 e- = 4 OH- Fe 2+ + 2 OH- = Fe(OH)2 4 Fe(OH)2 +2 H 2 O + O 2= 4 Fe(OH)3 Возможность протекания электрической коррозии рассчитывается по Э. Д. С. = Евосст. – Еокис. Если Э. Д. С. положительная, то коррозия возможна.
A(-) Fe |H 2 O, О 2| Cu K(+) A(-) Fe – 2 e- = Fe 2+ K(+) 2 H 2 O + О 2 + 4 e- = 4 OH- Fe 2+ + 2 OH- = Fe(OH)2 4 Fe(OH)2 +2 H 2 O + O 2= 4 Fe(OH)3 Возможность протекания электрической коррозии рассчитывается по Э. Д. С. = Евосст. – Еокис. Если Э. Д. С. положительная, то коррозия возможна.
 Скорость коррозии тем больше: 1. чем больше Э. Д. С. электрохимического процесса, это определяется активностью коррозирующего металла и характером среды. 2. чем больше разница в электродных потенциалах металлов, образующих гальваническую пару.
Скорость коррозии тем больше: 1. чем больше Э. Д. С. электрохимического процесса, это определяется активностью коррозирующего металла и характером среды. 2. чем больше разница в электродных потенциалах металлов, образующих гальваническую пару.
 Методы защиты металлов от коррозии. 1. Защита поверхности металлов покрытиями. 2. Электрохимические методы. Защитные поверхностные покрытия металлов изолируют металл от внешней среды. К ним относят: а) Неметаллические - краски, эмали, лаки, полимерные плёнки. б) Металлические, которые подразделяют на катодные и анодные.
Методы защиты металлов от коррозии. 1. Защита поверхности металлов покрытиями. 2. Электрохимические методы. Защитные поверхностные покрытия металлов изолируют металл от внешней среды. К ним относят: а) Неметаллические - краски, эмали, лаки, полимерные плёнки. б) Металлические, которые подразделяют на катодные и анодные.
 К катодным покрытиям относят металлы, электродные потенциалы которых имеют более высокое значение, чем потенциал защищаемого металла. Например : Для железа катодными покрытиями могут быть металлы – медь, никель, серебро, олово, свинец. К анодным покрытиям относят металлы, электродные потенциалы
К катодным покрытиям относят металлы, электродные потенциалы которых имеют более высокое значение, чем потенциал защищаемого металла. Например : Для железа катодными покрытиями могут быть металлы – медь, никель, серебро, олово, свинец. К анодным покрытиям относят металлы, электродные потенциалы
 которых имеют более низкие значения, чем потенциал защищаемого металла. Например : Для железа анодными покрытиями могут быть металлы – цинк, алюминий, хром, магний, титан. Применение катодного или анодного защитных покрытий определяется условиями эксплуатации изделия.
которых имеют более низкие значения, чем потенциал защищаемого металла. Например : Для железа анодными покрытиями могут быть металлы – цинк, алюминий, хром, магний, титан. Применение катодного или анодного защитных покрытий определяется условиями эксплуатации изделия.
 При нарушении катодного защитного покрытия (железо покрыто оловом) в присутствии "влажного воздуха" возникает гальваническая пара железо- олово, где анодом является железо, катодом является олово O 2 Sn H 2 O Fe 2+ Fe
При нарушении катодного защитного покрытия (железо покрыто оловом) в присутствии "влажного воздуха" возникает гальваническая пара железо- олово, где анодом является железо, катодом является олово O 2 Sn H 2 O Fe 2+ Fe
 A (-) Fe | О 2 + Н 2 О | Sn К (+) e 0 Fe | Fe 2+ = - 0, 44 (В) e 0 Sn | Sn 2+ = - 0, 14 (В) Электроны переходят от железа к олову и связываются молекулами кислорода в присутствии молекул воды (кислородная деполяризация). А (-) 2 Fe - 2 е- =Fe 2+ K (+) 1 O 2 + 2 Н 2 O + 4 е- = 4 OН- 2 Fe + О 2 + 2 Н 2 О = 2 Fe(OH)2
A (-) Fe | О 2 + Н 2 О | Sn К (+) e 0 Fe | Fe 2+ = - 0, 44 (В) e 0 Sn | Sn 2+ = - 0, 14 (В) Электроны переходят от железа к олову и связываются молекулами кислорода в присутствии молекул воды (кислородная деполяризация). А (-) 2 Fe - 2 е- =Fe 2+ K (+) 1 O 2 + 2 Н 2 O + 4 е- = 4 OН- 2 Fe + О 2 + 2 Н 2 О = 2 Fe(OH)2
 При нарушении катодного защитного покрытия коррозия металла ускоряется. При нарушении анодного защитного покрытия (железо покрыто цинком) возникает гальваническая пара, где катодом является железо, а анодом является цинк. A (-) Zn | О 2 + Н 2 О | Fe К(+) e 0 Zn | Zn 2+ = -0, 76 (В) e 0 Fe | Fe 2+ = -0, 44 (В)
При нарушении катодного защитного покрытия коррозия металла ускоряется. При нарушении анодного защитного покрытия (железо покрыто цинком) возникает гальваническая пара, где катодом является железо, а анодом является цинк. A (-) Zn | О 2 + Н 2 О | Fe К(+) e 0 Zn | Zn 2+ = -0, 76 (В) e 0 Fe | Fe 2+ = -0, 44 (В)
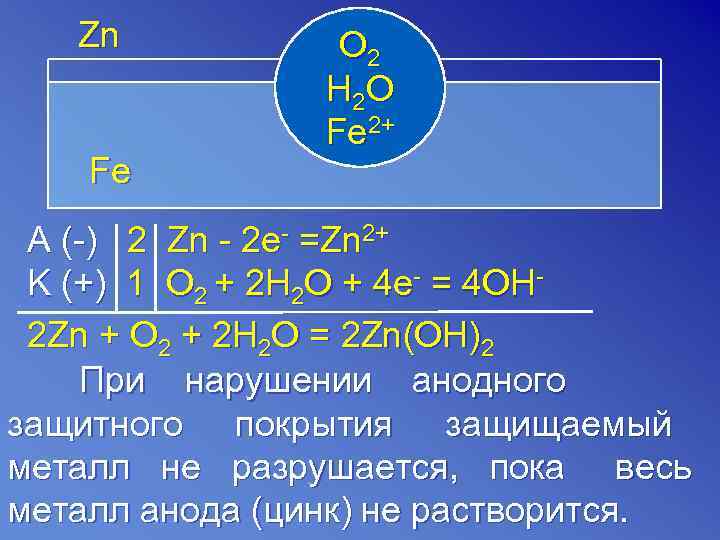
 Zn O 2 H 2 O Fe 2+ Fe A (-) 2 Zn - 2 e- =Zn 2+ K (+) 1 O 2 + 2 Н 2 О + 4 е- = 4 ОН- 2 Zn + O 2 + 2 H 2 O = 2 Zn(OH)2 При нарушении анодного защитного покрытия защищаемый металл не разрушается, пока весь металл анода (цинк) не растворится.
Zn O 2 H 2 O Fe 2+ Fe A (-) 2 Zn - 2 e- =Zn 2+ K (+) 1 O 2 + 2 Н 2 О + 4 е- = 4 ОН- 2 Zn + O 2 + 2 H 2 O = 2 Zn(OH)2 При нарушении анодного защитного покрытия защищаемый металл не разрушается, пока весь металл анода (цинк) не растворится.
 Электрохимические методы обеспечивают условия, при которых защищаемая конструкция (защищаемая деталь) в условиях эксплуатации становится катодом, на котором идет процесс восстановления. Протекторная защита применяется в тех случаях, когда защищаемая конструкция, находится в среде электролита (подземные, почвенные воды, морская вода и т. д. ). Сущность её заключается в том, что конструкцию
Электрохимические методы обеспечивают условия, при которых защищаемая конструкция (защищаемая деталь) в условиях эксплуатации становится катодом, на котором идет процесс восстановления. Протекторная защита применяется в тех случаях, когда защищаемая конструкция, находится в среде электролита (подземные, почвенные воды, морская вода и т. д. ). Сущность её заключается в том, что конструкцию
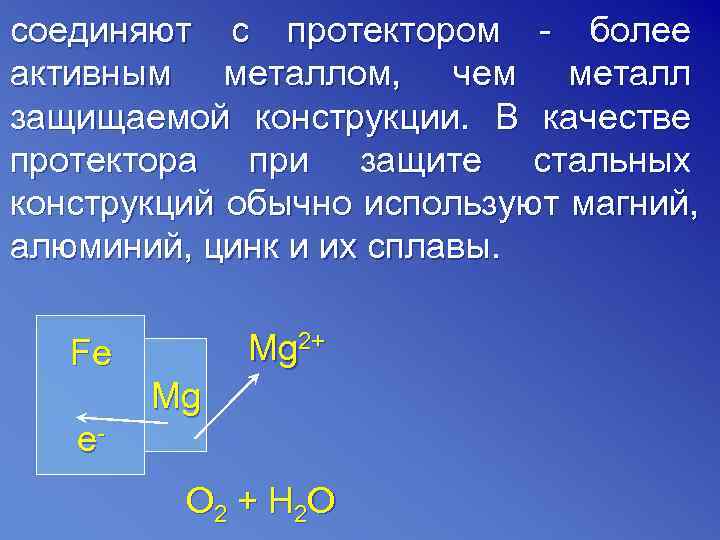
 соединяют с протектором - более активным металлом, чем металл защищаемой конструкции. В качестве протектора при защите стальных конструкций обычно используют магний, алюминий, цинк и их сплавы. Fe Mg 2+ Mg e- O 2 + H 2 O
соединяют с протектором - более активным металлом, чем металл защищаемой конструкции. В качестве протектора при защите стальных конструкций обычно используют магний, алюминий, цинк и их сплавы. Fe Mg 2+ Mg e- O 2 + H 2 O
 A (-) 2 Mg - 2 e- =Mg 2+ K (+) 1 O 2 + 2 Н 2 О + 4 е- = 4 ОН- 2 Mg + O 2 + 2 H 2 O = 2 Mg(OH)2 По мере разрушения протекторов их заменяют новыми. Электрозащита (катодная защита) применяется в тех же случаях, что и протекторная защита. Защищаемая конструкция подключается к отрицательному полюсу внешнего источника постоянного тока, поэтому
A (-) 2 Mg - 2 e- =Mg 2+ K (+) 1 O 2 + 2 Н 2 О + 4 е- = 4 ОН- 2 Mg + O 2 + 2 H 2 O = 2 Mg(OH)2 По мере разрушения протекторов их заменяют новыми. Электрозащита (катодная защита) применяется в тех же случаях, что и протекторная защита. Защищаемая конструкция подключается к отрицательному полюсу внешнего источника постоянного тока, поэтому
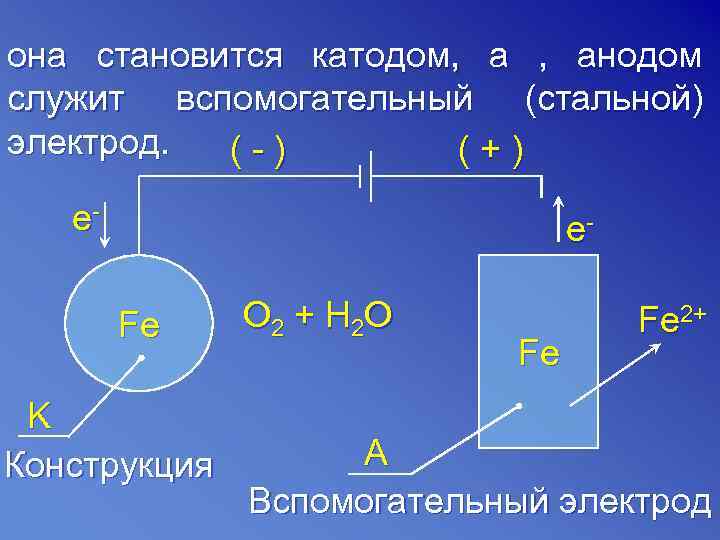
 она становится катодом, а , анодом служит вспомогательный (стальной) электрод. (-) (+) e- Fe O 2 + H 2 O Fe 2+ Fe K Конструкция A Вспомогательный электрод
она становится катодом, а , анодом служит вспомогательный (стальной) электрод. (-) (+) e- Fe O 2 + H 2 O Fe 2+ Fe K Конструкция A Вспомогательный электрод
 В этом случае электроны отнимаются от анода источником тока. Вспомогательный электрод (анод) растворяется, а на защищаемой конструкции идёт восстановления.
В этом случае электроны отнимаются от анода источником тока. Вспомогательный электрод (анод) растворяется, а на защищаемой конструкции идёт восстановления.
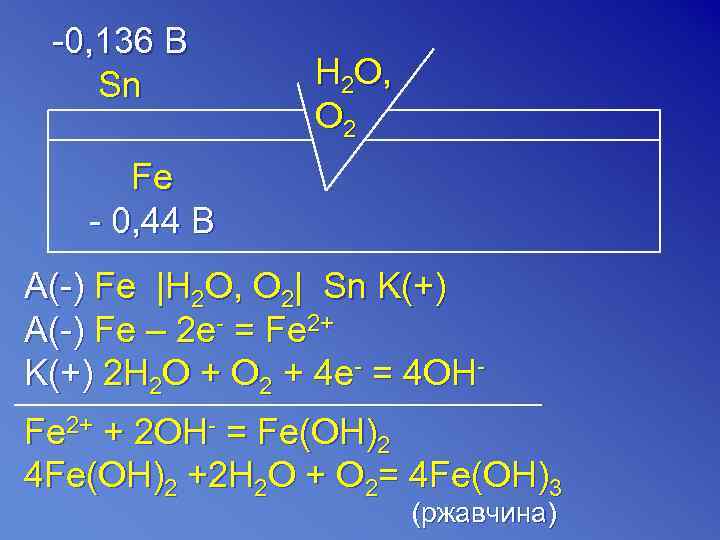 -0, 136 B Sn H 2 O, O 2 Fe - 0, 44 В A(-) Fe |H 2 O, О 2| Sn K(+) A(-) Fe – 2 e- = Fe 2+ K(+) 2 H 2 O + О 2 + 4 e- = 4 OH- Fe 2+ + 2 OH- = Fe(OH)2 4 Fe(OH)2 +2 H 2 O + O 2= 4 Fe(OH)3 (ржавчина)
-0, 136 B Sn H 2 O, O 2 Fe - 0, 44 В A(-) Fe |H 2 O, О 2| Sn K(+) A(-) Fe – 2 e- = Fe 2+ K(+) 2 H 2 O + О 2 + 4 e- = 4 OH- Fe 2+ + 2 OH- = Fe(OH)2 4 Fe(OH)2 +2 H 2 O + O 2= 4 Fe(OH)3 (ржавчина)
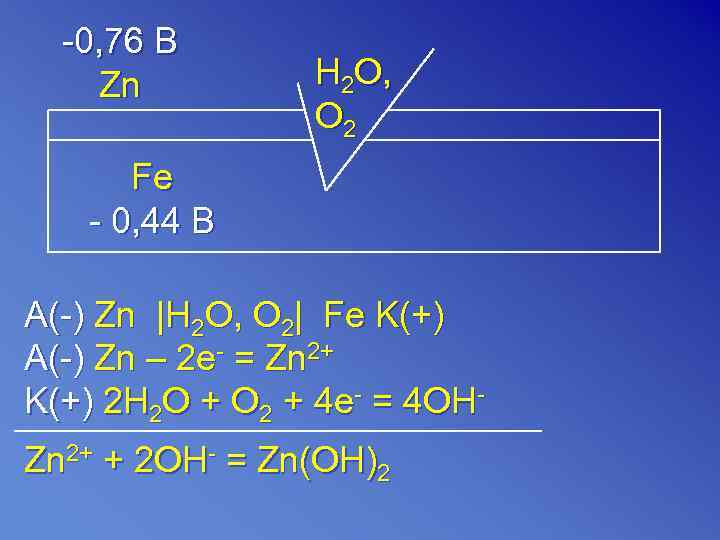
 -0, 76 B Zn H 2 O, O 2 Fe - 0, 44 В A(-) Zn |H 2 O, О 2| Fe K(+) A(-) Zn – 2 e- = Zn 2+ K(+) 2 H 2 O + О 2 + 4 e- = 4 OH- Zn 2+ + 2 OH- = Zn(OH)2
-0, 76 B Zn H 2 O, O 2 Fe - 0, 44 В A(-) Zn |H 2 O, О 2| Fe K(+) A(-) Zn – 2 e- = Zn 2+ K(+) 2 H 2 O + О 2 + 4 e- = 4 OH- Zn 2+ + 2 OH- = Zn(OH)2
