КЛАССИФИКАЦИЯ НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ ПЕРВАЯ ПОПЫТКА КЛАССИФИКАЦИИ НЕОРГАНИЧЕСКИХ ВЕЩЕСТВ







![КЛАССИФИКАЦИЯ СОЛЕЙ Комплексные ( [Cu(NH3)4][PtCl4] ) Смешанные (CaOCl2 (CaCl2Ca(OCl)2) Двойные (CaCO3MgCO3) КЛАССИФИКАЦИЯ СОЛЕЙ Комплексные ( [Cu(NH3)4][PtCl4] ) Смешанные (CaOCl2 (CaCl2Ca(OCl)2) Двойные (CaCO3MgCO3)](https://present5.com/presentacii-2/20171213\38960-neorg_chem_basic_2.ppt\38960-neorg_chem_basic_2_19.jpg)











![многоэлементные катионы: UO2+ – катион диоксоурана(V) (HgNO3)+ – катион нитратортути(II) [Ti(H2O)6]3+ – катион гексаакватитана(III) многоэлементные катионы: UO2+ – катион диоксоурана(V) (HgNO3)+ – катион нитратортути(II) [Ti(H2O)6]3+ – катион гексаакватитана(III)](https://present5.com/presentacii-2/20171213\38960-neorg_chem_basic_2.ppt\38960-neorg_chem_basic_2_32.jpg)























38960-neorg_chem_basic_2.ppt
- Количество слайдов: 66
 КЛАССИФИКАЦИЯ НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
КЛАССИФИКАЦИЯ НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
 ПЕРВАЯ ПОПЫТКА КЛАССИФИКАЦИИ НЕОРГАНИЧЕСКИХ ВЕЩЕСТВ простые вещества; оксиды (продукты горения простых веществ); кислоты и основания (продукты взаимодействия оксидов с водой) соли (продукты взаимодействия кислот и оснований) Антуан Лоран Лавуазье 1787 г.
ПЕРВАЯ ПОПЫТКА КЛАССИФИКАЦИИ НЕОРГАНИЧЕСКИХ ВЕЩЕСТВ простые вещества; оксиды (продукты горения простых веществ); кислоты и основания (продукты взаимодействия оксидов с водой) соли (продукты взаимодействия кислот и оснований) Антуан Лоран Лавуазье 1787 г.
 КЛАССИФИКАЦИЯ ПО ТИПУ ХИМИЧЕСКИХ ПРЕВРАЩЕНИЙ КИСЛОТЫ (HNO3, H2SO4, H3PO3, H3AsO4 и др.) ОСНОВАНИЯ (NaOH, NH3, Ca(OH)2, Fe(OH)3 и др.) СОЛИ (NaNO3, (NH4)2SO4, KHSO4, Na2HPO3 и др.) ОКИСЛИТЕЛИ (Cl2, KMnO4, H2O2, HNO3 и др.) ВОССТАНОВИТЕЛИ (Na, H2, CO, H2O2, K2S2O4 и др.) КОМПЛЕКСООБРАЗОВАТЕЛИ (Ni2+, Cu2+, Fe3+, Ti4+, Pt4+ и др.) ЛИГАНДЫ (NH3, OH, CO, CN и др.) КООРДИНАЦИОННЫЕ СОЕДИНЕНИЯ ([Cu(NH3)6]Cl2, K2[PtCl6] и др.) РАДИКАЛЫ (NO, NO2, O2 и др.) АССОЦИАТЫ (N2O4, Cl2O6 и др.) перенос разного рода частиц в химических превращениях (протоны, электроны, электронные пары , части молекул)
КЛАССИФИКАЦИЯ ПО ТИПУ ХИМИЧЕСКИХ ПРЕВРАЩЕНИЙ КИСЛОТЫ (HNO3, H2SO4, H3PO3, H3AsO4 и др.) ОСНОВАНИЯ (NaOH, NH3, Ca(OH)2, Fe(OH)3 и др.) СОЛИ (NaNO3, (NH4)2SO4, KHSO4, Na2HPO3 и др.) ОКИСЛИТЕЛИ (Cl2, KMnO4, H2O2, HNO3 и др.) ВОССТАНОВИТЕЛИ (Na, H2, CO, H2O2, K2S2O4 и др.) КОМПЛЕКСООБРАЗОВАТЕЛИ (Ni2+, Cu2+, Fe3+, Ti4+, Pt4+ и др.) ЛИГАНДЫ (NH3, OH, CO, CN и др.) КООРДИНАЦИОННЫЕ СОЕДИНЕНИЯ ([Cu(NH3)6]Cl2, K2[PtCl6] и др.) РАДИКАЛЫ (NO, NO2, O2 и др.) АССОЦИАТЫ (N2O4, Cl2O6 и др.) перенос разного рода частиц в химических превращениях (протоны, электроны, электронные пары , части молекул)
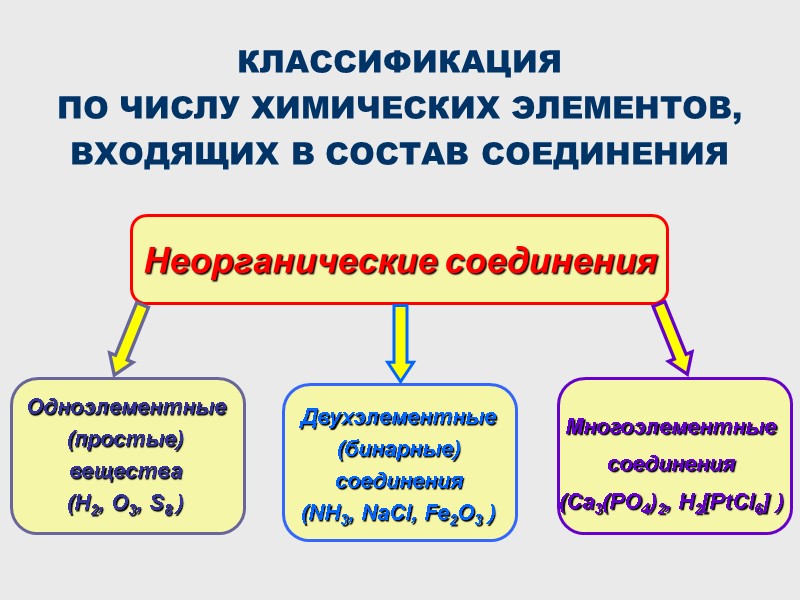
 КЛАССИФИКАЦИЯ ПО ЧИСЛУ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ, ВХОДЯЩИХ В СОСТАВ СОЕДИНЕНИЯ
КЛАССИФИКАЦИЯ ПО ЧИСЛУ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ, ВХОДЯЩИХ В СОСТАВ СОЕДИНЕНИЯ
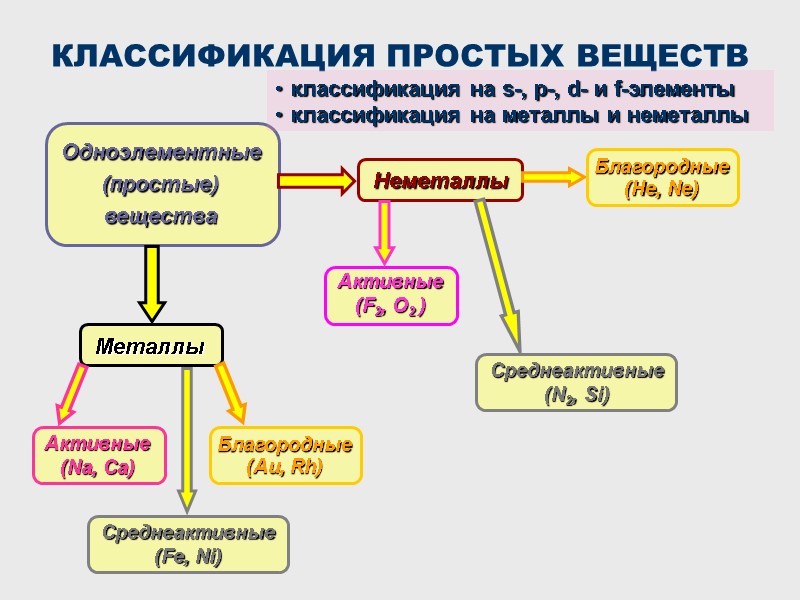
 КЛАССИФИКАЦИЯ ПРОСТЫХ ВЕЩЕСТВ Одноэлементные (простые) вещества Металлы классификация на s-, p-, d- и f-элементы классификация на металлы и неметаллы
КЛАССИФИКАЦИЯ ПРОСТЫХ ВЕЩЕСТВ Одноэлементные (простые) вещества Металлы классификация на s-, p-, d- и f-элементы классификация на металлы и неметаллы
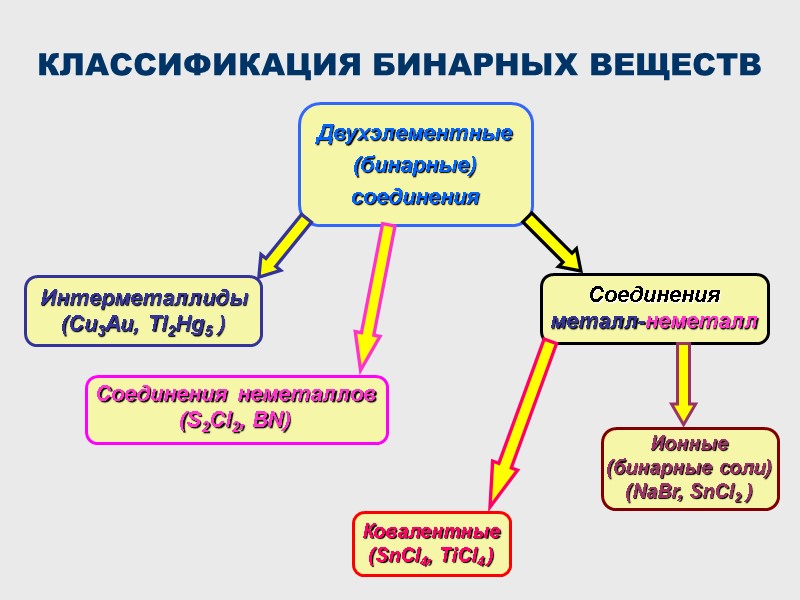
 КЛАССИФИКАЦИЯ БИНАРНЫХ ВЕЩЕСТВ
КЛАССИФИКАЦИЯ БИНАРНЫХ ВЕЩЕСТВ
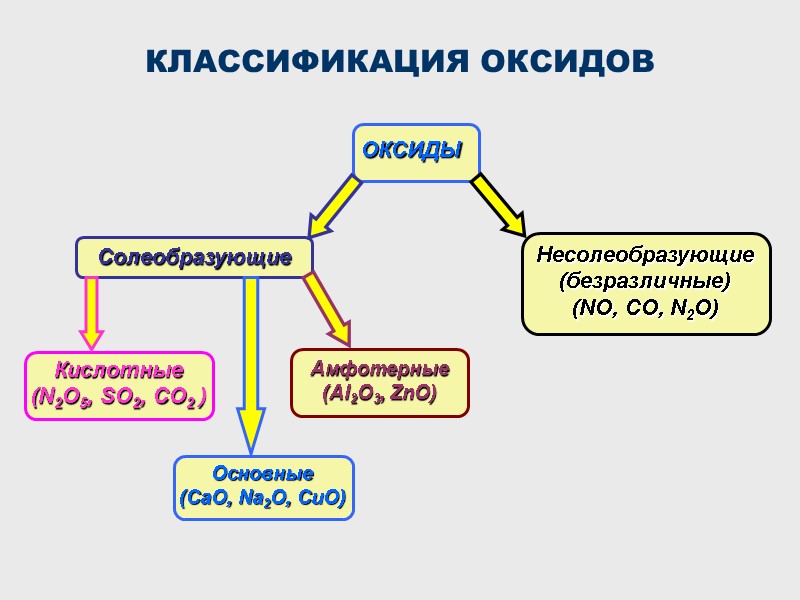
 КЛАССИФИКАЦИЯ ОКСИДОВ
КЛАССИФИКАЦИЯ ОКСИДОВ
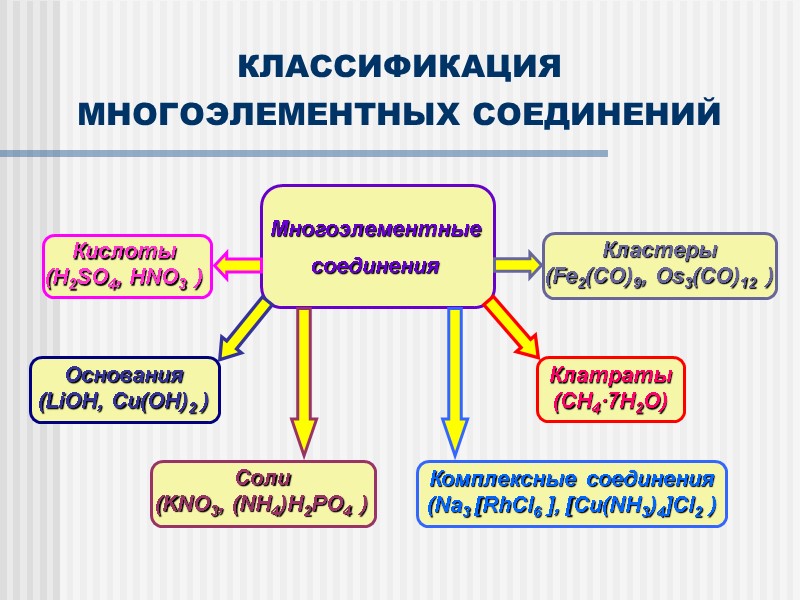
 КЛАССИФИКАЦИЯ МНОГОЭЛЕМЕНТНЫХ СОЕДИНЕНИЙ Соли (KNO3, (NH4)H2PO4 )
КЛАССИФИКАЦИЯ МНОГОЭЛЕМЕНТНЫХ СОЕДИНЕНИЙ Соли (KNO3, (NH4)H2PO4 )
 КИСЛОТА И ОСНОВАНИЕ Сванте Аррениус: Кислота – вещество, диссоциирующее в воде с образованием Н+ (HCl, HCOOH, H3PO4, KH2PO4, H2O) Основание – вещество, диссоциирующее в воде с образованием ОН (NaOH, Fe(OH)2, Al(OH)3, Mg(OH)Cl, H2O) HA H+ + A или BOH B+ + OH важнейшие количественные характеристики: – степень диссоциации – константа диссоциации
КИСЛОТА И ОСНОВАНИЕ Сванте Аррениус: Кислота – вещество, диссоциирующее в воде с образованием Н+ (HCl, HCOOH, H3PO4, KH2PO4, H2O) Основание – вещество, диссоциирующее в воде с образованием ОН (NaOH, Fe(OH)2, Al(OH)3, Mg(OH)Cl, H2O) HA H+ + A или BOH B+ + OH важнейшие количественные характеристики: – степень диссоциации – константа диссоциации
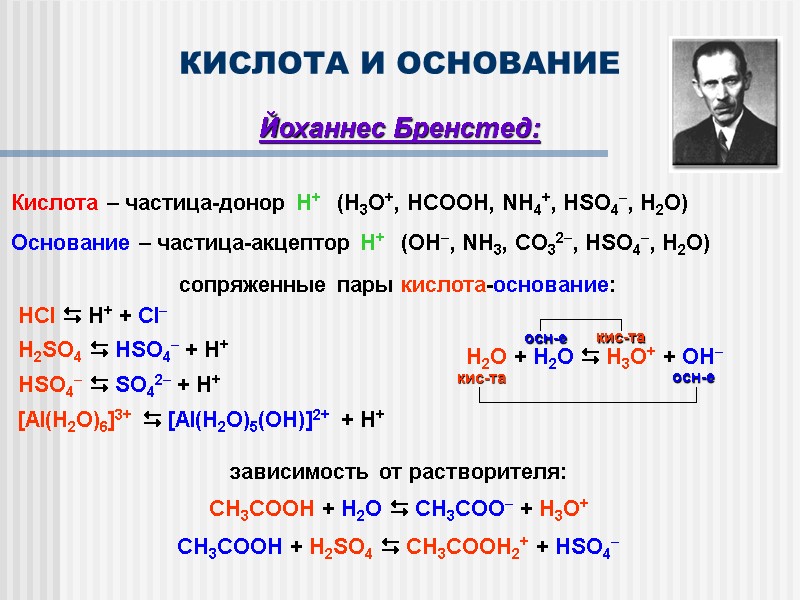
 КИСЛОТА И ОСНОВАНИЕ Йоханнес Бренстед: Кислота – частица-донор Н+ (H3O+, HCOOH, NH4+, HSO4, H2O) Основание – частица-акцептор Н+ (OH, NH3, CO32, HSO4, H2O) сопряженные пары кислота-основание: HCl H+ + Cl H2SO4 HSO4 + H+ HSO4 SO42 + H+ [Al(H2O)6]3+ [Al(H2O)5(OH)]2+ + H+ зависимость от растворителя: CH3COOH + H2O CH3COO + H3O+ CH3COOH + H2SO4 CH3COOH2+ + HSO4
КИСЛОТА И ОСНОВАНИЕ Йоханнес Бренстед: Кислота – частица-донор Н+ (H3O+, HCOOH, NH4+, HSO4, H2O) Основание – частица-акцептор Н+ (OH, NH3, CO32, HSO4, H2O) сопряженные пары кислота-основание: HCl H+ + Cl H2SO4 HSO4 + H+ HSO4 SO42 + H+ [Al(H2O)6]3+ [Al(H2O)5(OH)]2+ + H+ зависимость от растворителя: CH3COOH + H2O CH3COO + H3O+ CH3COOH + H2SO4 CH3COOH2+ + HSO4
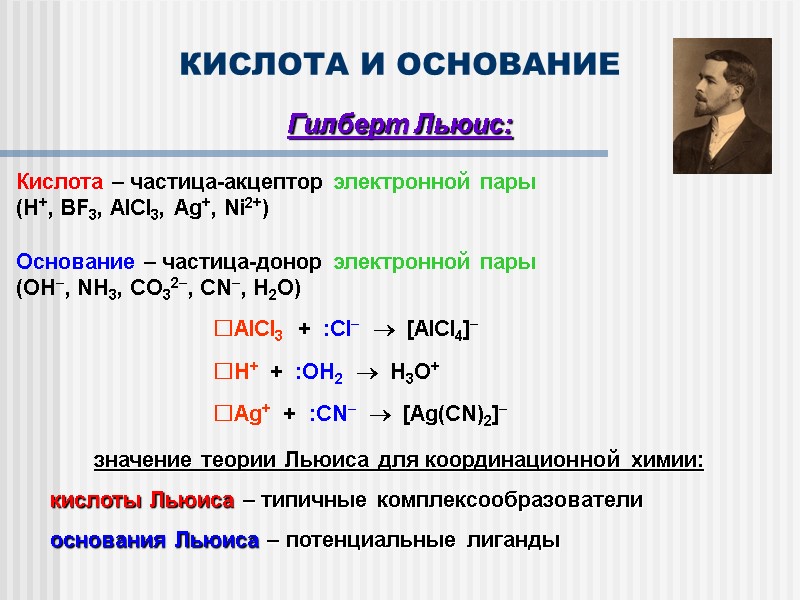
 КИСЛОТА И ОСНОВАНИЕ Гилберт Льюис: Кислота – частица-акцептор электронной пары (H+, BF3, AlCl3, Ag+, Ni2+) Основание – частица-донор электронной пары (OH, NH3, CO32, CN, H2O) AlCl3 + :Cl [AlCl4] H+ + :OH2 H3O+ Ag+ + :CN [Ag(CN)2] значение теории Льюиса для координационной химии: кислоты Льюиса – типичные комплексообразователи основания Льюиса – потенциальные лиганды
КИСЛОТА И ОСНОВАНИЕ Гилберт Льюис: Кислота – частица-акцептор электронной пары (H+, BF3, AlCl3, Ag+, Ni2+) Основание – частица-донор электронной пары (OH, NH3, CO32, CN, H2O) AlCl3 + :Cl [AlCl4] H+ + :OH2 H3O+ Ag+ + :CN [Ag(CN)2] значение теории Льюиса для координационной химии: кислоты Льюиса – типичные комплексообразователи основания Льюиса – потенциальные лиганды
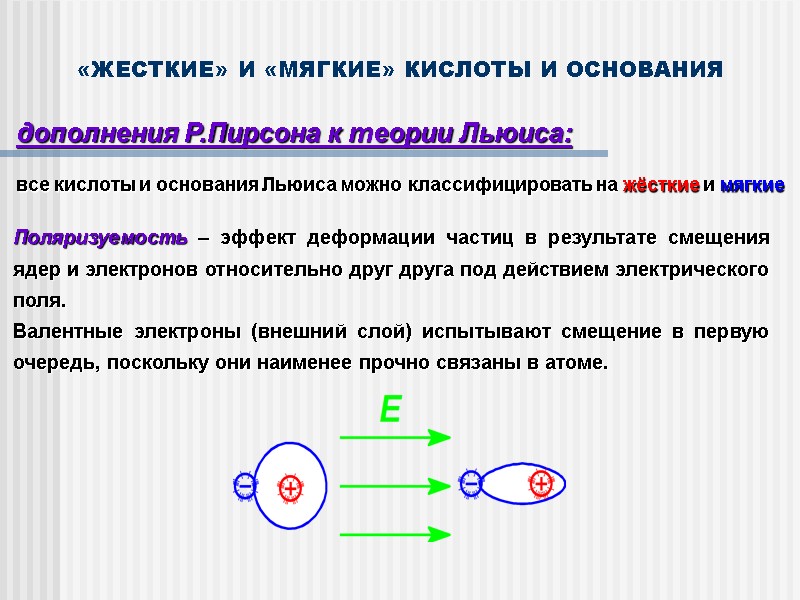
 «ЖЕСТКИЕ» И «МЯГКИЕ» КИСЛОТЫ И ОСНОВАНИЯ дополнения Р.Пирсона к теории Льюиса: все кислоты и основания Льюиса можно классифицировать на жёсткие и мягкие Поляризуемость – эффект деформации частиц в результате смещения ядер и электронов относительно друг друга под действием электрического поля. Валентные электроны (внешний слой) испытывают смещение в первую очередь, поскольку они наименее прочно связаны в атоме.
«ЖЕСТКИЕ» И «МЯГКИЕ» КИСЛОТЫ И ОСНОВАНИЯ дополнения Р.Пирсона к теории Льюиса: все кислоты и основания Льюиса можно классифицировать на жёсткие и мягкие Поляризуемость – эффект деформации частиц в результате смещения ядер и электронов относительно друг друга под действием электрического поля. Валентные электроны (внешний слой) испытывают смещение в первую очередь, поскольку они наименее прочно связаны в атоме.
 ЖЁСТКИЕ КИСЛОТЫ ЛЬЮИСА: высокий положительный заряд, малый размер и низкая поляризуемость (не имеют легко возбуждаемых внешних электронов, как правило, с трудом теряют электроны) H+, Li+, Na+, K+, Be2+, Mg2+, Ca2+, Sr2+, Mn2+, Al3+, Sc3+, Ga3+, In3+, La3+, Cr3+, Co3+, Fe3+, Si4+, Ti4+, Zr4+, Ce4+ и др. МЯГКИЕ КИСЛОТЫ ЛЬЮИСА: низкий положительный заряд, большой размер и высокая поляризуемость (имеют несколько легко возбуждаемых внешних электронов) Cu+, Ag+, Au+, Tl+, Hg22+, Pd2+, Co2+, Pt2+, Hg2+, Tl3+, BCl3, GaCl3, I2, Br2, ICN и др. КИСЛОТЫ ЛЬЮИСА, ЗАНИМАЮЩИЕ ПРОМЕЖУТОЧНОЕ ПОЛОЖЕНИЕ: Fe2+, Ni2+, Cu2+, Zn2+, Pb2+, Sn2+, Sb3+, Bi3+ и некоторые др.
ЖЁСТКИЕ КИСЛОТЫ ЛЬЮИСА: высокий положительный заряд, малый размер и низкая поляризуемость (не имеют легко возбуждаемых внешних электронов, как правило, с трудом теряют электроны) H+, Li+, Na+, K+, Be2+, Mg2+, Ca2+, Sr2+, Mn2+, Al3+, Sc3+, Ga3+, In3+, La3+, Cr3+, Co3+, Fe3+, Si4+, Ti4+, Zr4+, Ce4+ и др. МЯГКИЕ КИСЛОТЫ ЛЬЮИСА: низкий положительный заряд, большой размер и высокая поляризуемость (имеют несколько легко возбуждаемых внешних электронов) Cu+, Ag+, Au+, Tl+, Hg22+, Pd2+, Co2+, Pt2+, Hg2+, Tl3+, BCl3, GaCl3, I2, Br2, ICN и др. КИСЛОТЫ ЛЬЮИСА, ЗАНИМАЮЩИЕ ПРОМЕЖУТОЧНОЕ ПОЛОЖЕНИЕ: Fe2+, Ni2+, Cu2+, Zn2+, Pb2+, Sn2+, Sb3+, Bi3+ и некоторые др.
 ЖЁСТКИЕ ОСНОВАНИЯ ЛЬЮИСА: лиганды донорные атомы которых обладают низкой поляризуемостью, высокой электроотрицательностью, трудно окисляются H2O, OH, F, CH3COO, PO43, SO42, ClO4, NO3, NH3 и др. МЯГКИЕ ОСНОВАНИЯ ЛЬЮИСА: лиганды донорные атомы которых обладают высокой поляризуемостью, низкой электроотрицательностью, относительно легко окисляются R2S, RSH, I, SCN, S2O32, CN, CO, C2H4, C6H6 и др. ОСНОВАНИЯ ЛЬЮИСА, ЗАНИМАЮЩИЕ ПРОМЕЖУТОЧНОЕ ПОЛОЖЕНИЕ: N3, Br, NO2, SO32, C6H5NH2, C5H5N, N2 и некоторые др.
ЖЁСТКИЕ ОСНОВАНИЯ ЛЬЮИСА: лиганды донорные атомы которых обладают низкой поляризуемостью, высокой электроотрицательностью, трудно окисляются H2O, OH, F, CH3COO, PO43, SO42, ClO4, NO3, NH3 и др. МЯГКИЕ ОСНОВАНИЯ ЛЬЮИСА: лиганды донорные атомы которых обладают высокой поляризуемостью, низкой электроотрицательностью, относительно легко окисляются R2S, RSH, I, SCN, S2O32, CN, CO, C2H4, C6H6 и др. ОСНОВАНИЯ ЛЬЮИСА, ЗАНИМАЮЩИЕ ПРОМЕЖУТОЧНОЕ ПОЛОЖЕНИЕ: N3, Br, NO2, SO32, C6H5NH2, C5H5N, N2 и некоторые др.
 ПРИНЦИП «ЖЕСТКИХ» И «МЯГКИХ» КИСЛОТ И ОСНОВАНИЙ (ПРИНЦИП «ЖМКО») Жёсткие кислоты Льюиса предпочтительно связываются с жесткими основаниями Льюиса, а мягкие кислоты Льюиса – с мягкими основаниями Льюиса – элементы класса «А» (жёсткие кислоты Льюиса) (дают устойчивые комплексы с фтор-, кислород- и азотсодержащими лигандами) – элементы класса «Б» (мягкие кислоты Льюиса) (дают устойчивые комплексы с хлор-, серу- и фосфорсодержащими лигандами) – промежуточные элементы (промежуточные кислоты Льюиса)
ПРИНЦИП «ЖЕСТКИХ» И «МЯГКИХ» КИСЛОТ И ОСНОВАНИЙ (ПРИНЦИП «ЖМКО») Жёсткие кислоты Льюиса предпочтительно связываются с жесткими основаниями Льюиса, а мягкие кислоты Льюиса – с мягкими основаниями Льюиса – элементы класса «А» (жёсткие кислоты Льюиса) (дают устойчивые комплексы с фтор-, кислород- и азотсодержащими лигандами) – элементы класса «Б» (мягкие кислоты Льюиса) (дают устойчивые комплексы с хлор-, серу- и фосфорсодержащими лигандами) – промежуточные элементы (промежуточные кислоты Льюиса)
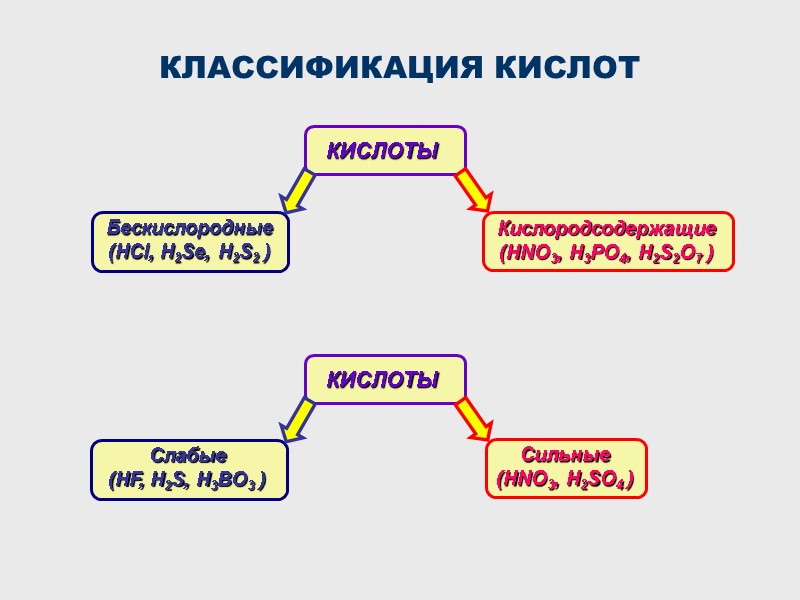
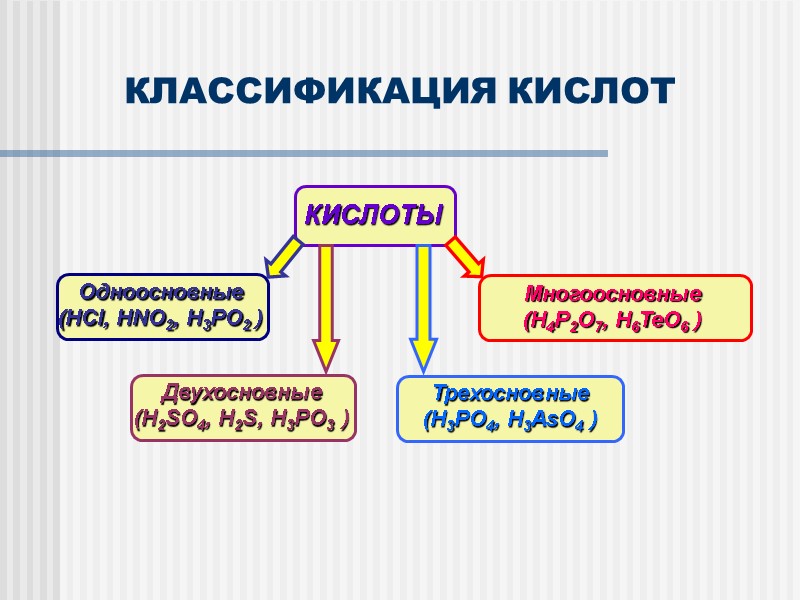
 КЛАССИФИКАЦИЯ КИСЛОТ
КЛАССИФИКАЦИЯ КИСЛОТ
 КЛАССИФИКАЦИЯ КИСЛОТ
КЛАССИФИКАЦИЯ КИСЛОТ
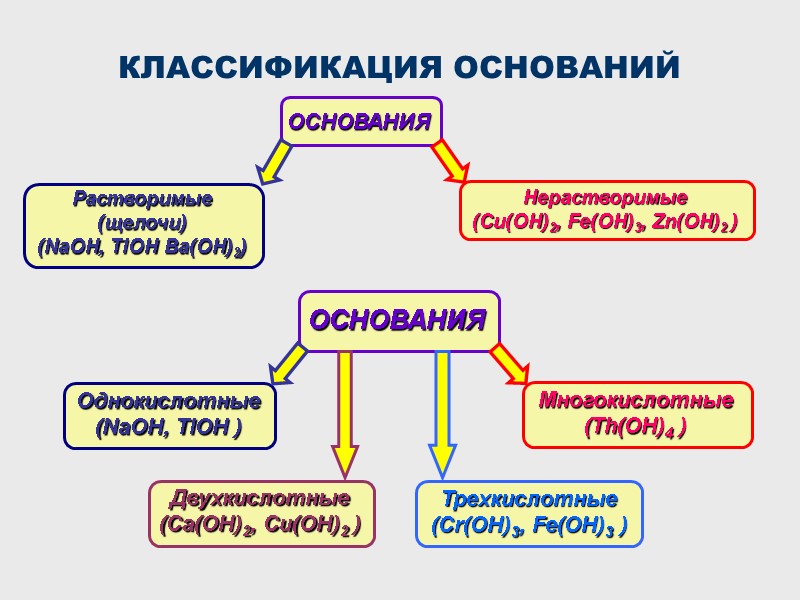
 КЛАССИФИКАЦИЯ ОСНОВАНИЙ
КЛАССИФИКАЦИЯ ОСНОВАНИЙ
![>КЛАССИФИКАЦИЯ СОЛЕЙ Комплексные ( [Cu(NH3)4][PtCl4] ) Смешанные (CaOCl2 (CaCl2Ca(OCl)2) Двойные (CaCO3MgCO3) >КЛАССИФИКАЦИЯ СОЛЕЙ Комплексные ( [Cu(NH3)4][PtCl4] ) Смешанные (CaOCl2 (CaCl2Ca(OCl)2) Двойные (CaCO3MgCO3)](https://present5.com/presentacii-2/20171213\38960-neorg_chem_basic_2.ppt\38960-neorg_chem_basic_2_19.jpg) КЛАССИФИКАЦИЯ СОЛЕЙ Комплексные ( [Cu(NH3)4][PtCl4] ) Смешанные (CaOCl2 (CaCl2Ca(OCl)2) Двойные (CaCO3MgCO3)
КЛАССИФИКАЦИЯ СОЛЕЙ Комплексные ( [Cu(NH3)4][PtCl4] ) Смешанные (CaOCl2 (CaCl2Ca(OCl)2) Двойные (CaCO3MgCO3)
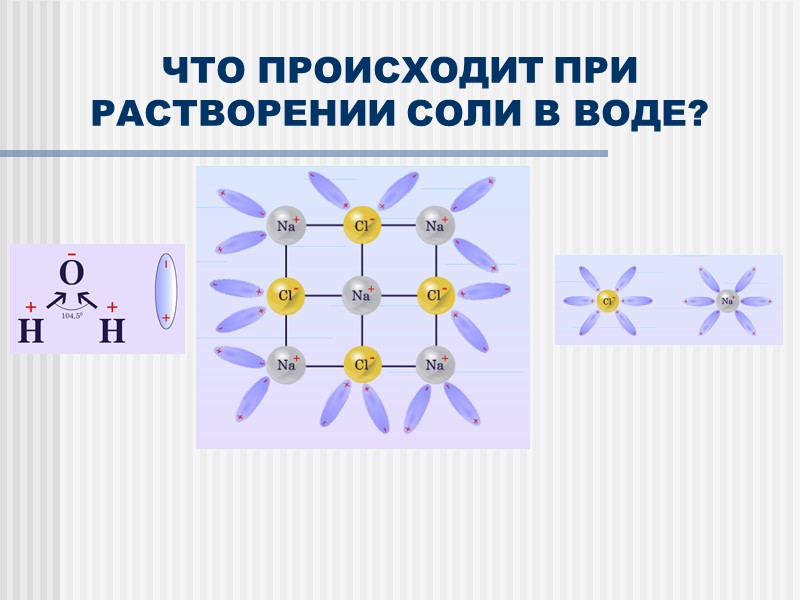
 ЧТО ПРОИСХОДИТ ПРИ РАСТВОРЕНИИ СОЛИ В ВОДЕ?
ЧТО ПРОИСХОДИТ ПРИ РАСТВОРЕНИИ СОЛИ В ВОДЕ?
 ОТ ЧЕГО ЗАВИСИТ ТЕПЛОВОЙ ЭФФЕКТ РАСТВОРЕНИЯ ИОННЫХ СОЕДИНЕНИЙ? растворяются в воде с понижением температуры: NaCl, KNO3, NH4NO3, CaCl26H2O ... растворяются в воде с повышением температуры: NaOH, Na2CO3, MgSO4, CaCl2 ... Hрастворения = Hгидратации + Hкрист. решетки процесс растворения: разрушение кристалла на ионы (Н > 0) гидратация ионов (Н < 0)
ОТ ЧЕГО ЗАВИСИТ ТЕПЛОВОЙ ЭФФЕКТ РАСТВОРЕНИЯ ИОННЫХ СОЕДИНЕНИЙ? растворяются в воде с понижением температуры: NaCl, KNO3, NH4NO3, CaCl26H2O ... растворяются в воде с повышением температуры: NaOH, Na2CO3, MgSO4, CaCl2 ... Hрастворения = Hгидратации + Hкрист. решетки процесс растворения: разрушение кристалла на ионы (Н > 0) гидратация ионов (Н < 0)
 КОЛЛИГАТИВНЫЕ СВОЙСТВА РАСТВОРОВ понижение давление пара (закон Рауля) осмотическое давление понижение температуры замерзания Tзамерзания = KС К – криоскопическая константа; С – моляльная концентрация (количество моль вещества в 1000 г растворителя) повышение температуры кипения Tкипения = EС E – эбулиоскопическая константа; С – моляльная концентрация (количество моль вещества в 1000 г растворителя) свойства растворов, зависящие только от числа частиц в растворе и не зависящие от их природы
КОЛЛИГАТИВНЫЕ СВОЙСТВА РАСТВОРОВ понижение давление пара (закон Рауля) осмотическое давление понижение температуры замерзания Tзамерзания = KС К – криоскопическая константа; С – моляльная концентрация (количество моль вещества в 1000 г растворителя) повышение температуры кипения Tкипения = EС E – эбулиоскопическая константа; С – моляльная концентрация (количество моль вещества в 1000 г растворителя) свойства растворов, зависящие только от числа частиц в растворе и не зависящие от их природы
 коллигативные свойства растворов можно использовать для расчета молярных масс растворенного нелетучего вещества, например: Тзамерзания раствора 0,1155 г (m1) белого фосфора в 19,03 г (m2) бензола равна 5,15С; Тплавления чистого бензола 5,4С; Кбензола = 5,1. Tзамерзания = KC = K1000m1 / Mm2 5,4 – 5,15 = 5,110000,1155 / М19,03 М = 123,8 г/моль т.е. состав белого фосфора 123,8 / 30,97 = 4 Р4
коллигативные свойства растворов можно использовать для расчета молярных масс растворенного нелетучего вещества, например: Тзамерзания раствора 0,1155 г (m1) белого фосфора в 19,03 г (m2) бензола равна 5,15С; Тплавления чистого бензола 5,4С; Кбензола = 5,1. Tзамерзания = KC = K1000m1 / Mm2 5,4 – 5,15 = 5,110000,1155 / М19,03 М = 123,8 г/моль т.е. состав белого фосфора 123,8 / 30,97 = 4 Р4
 «НЕСОВПАДЕНИЕ» РАСЧЕТНЫХ И ЭКСПЕРИМЕНТАЛЬНЫХ ЗНАЧЕНИЙ КОЛЛИГАТИВНЫХ СВОЙСТВ РАСТВОРОВ ЭЛЕКТРОЛИТОВ для раствора NaCl: в чём причина «несовпадений»? в растворах электролитов число частиц увеличивается за счет электролитической диссоциации! в растворах неэлектролитов таких «несовпадений» нет
«НЕСОВПАДЕНИЕ» РАСЧЕТНЫХ И ЭКСПЕРИМЕНТАЛЬНЫХ ЗНАЧЕНИЙ КОЛЛИГАТИВНЫХ СВОЙСТВ РАСТВОРОВ ЭЛЕКТРОЛИТОВ для раствора NaCl: в чём причина «несовпадений»? в растворах электролитов число частиц увеличивается за счет электролитической диссоциации! в растворах неэлектролитов таких «несовпадений» нет
 ЭЛЕКТРОПРОВОДНОСТЬ – НЕКОЛЛИГАТИВНОЕ СВОЙСТВО РАСТВОРОВ электропроводность – величина обратная сопротивлению: сименс удельная электропроводность () – это электрическая проводимость объема раствора, заключенного между двумя параллельными электродами, имеющими площадь по одному квадратному метру и расположенными на расстоянии одного метра друг от друга: См / м = Ом1 м1. мольная электропроводность () – электропроводность раствора, который помещен между двумя параллельными электродами, имеющими площадь по одному квадратному метру и расположенными на расстоянии одного метра друг от друга и содержит 1 моль электролита в единице объема. Ом1 см2 моль1 = См см2 моль1 С – концентрация, моль/см3 (моль/мл); - удельная электропроводность, Ом1 см1
ЭЛЕКТРОПРОВОДНОСТЬ – НЕКОЛЛИГАТИВНОЕ СВОЙСТВО РАСТВОРОВ электропроводность – величина обратная сопротивлению: сименс удельная электропроводность () – это электрическая проводимость объема раствора, заключенного между двумя параллельными электродами, имеющими площадь по одному квадратному метру и расположенными на расстоянии одного метра друг от друга: См / м = Ом1 м1. мольная электропроводность () – электропроводность раствора, который помещен между двумя параллельными электродами, имеющими площадь по одному квадратному метру и расположенными на расстоянии одного метра друг от друга и содержит 1 моль электролита в единице объема. Ом1 см2 моль1 = См см2 моль1 С – концентрация, моль/см3 (моль/мл); - удельная электропроводность, Ом1 см1
 ЭЛЕКТРОПРОВОДНОСТЬ – НЕКОЛЛИГАТИВНОЕ СВОЙСТВО РАСТВОРОВ прибор для измерения электропроводности растворов – кондуктометр электрод: две параллельные Pt пластины площадью 1 см2 на расстоянии 1 см концентрации; природы электролита; диэлектрической проницаемости растворителя; температуры; подвижности ионов; вязкости растворителя; др. факторы. электропроводность зависит от многих факторов: некоторые корреляции зависимости электропроводности и числа ионов в растворе
ЭЛЕКТРОПРОВОДНОСТЬ – НЕКОЛЛИГАТИВНОЕ СВОЙСТВО РАСТВОРОВ прибор для измерения электропроводности растворов – кондуктометр электрод: две параллельные Pt пластины площадью 1 см2 на расстоянии 1 см концентрации; природы электролита; диэлектрической проницаемости растворителя; температуры; подвижности ионов; вязкости растворителя; др. факторы. электропроводность зависит от многих факторов: некоторые корреляции зависимости электропроводности и числа ионов в растворе
 НОМЕНКЛАТУРА НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
НОМЕНКЛАТУРА НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
 ПРАВИЛА ДЛЯ СОСТАВЛЕНИЯ НАЗВАНИЙ НЕОРГАНИЧЕСКИХ ВЕЩЕСТВ СИСТЕМАТИЧЕСКАЯ НОМЕНКЛАТУРА (правила комиссии ИЮПАК) ТРАДИЦИОННАЯ НОМЕНКЛАТУРА «РУССКАЯ» НОМЕНКЛАТУРА НЕНОМЕНКЛАТУРНЫЕ НАЗВАНИЯ (тривиальные, минералогические и др.)
ПРАВИЛА ДЛЯ СОСТАВЛЕНИЯ НАЗВАНИЙ НЕОРГАНИЧЕСКИХ ВЕЩЕСТВ СИСТЕМАТИЧЕСКАЯ НОМЕНКЛАТУРА (правила комиссии ИЮПАК) ТРАДИЦИОННАЯ НОМЕНКЛАТУРА «РУССКАЯ» НОМЕНКЛАТУРА НЕНОМЕНКЛАТУРНЫЕ НАЗВАНИЯ (тривиальные, минералогические и др.)
 НАЗВАНИЯ И ОБОЗНАЧЕНИЯ ЭЛЕМЕНТОВ И ИЗОТОПОВ Элементы: символы и названия элементов приведены в ПС. Изотопы: обозначение изотопа: все названия изотопов элемента (кроме водорода) имеют одно название с указанием массового числа: 32S – изотоп серы-32 для водорода: 1Н – изотоп водорода-1, Н – протий; 2Н – изотоп водорода-2, D – дейтерий; 3Н – изотоп водорода-3, Т – тритий
НАЗВАНИЯ И ОБОЗНАЧЕНИЯ ЭЛЕМЕНТОВ И ИЗОТОПОВ Элементы: символы и названия элементов приведены в ПС. Изотопы: обозначение изотопа: все названия изотопов элемента (кроме водорода) имеют одно название с указанием массового числа: 32S – изотоп серы-32 для водорода: 1Н – изотоп водорода-1, Н – протий; 2Н – изотоп водорода-2, D – дейтерий; 3Н – изотоп водорода-3, Т – тритий
 ЗАПИСЬ СИМВОЛОВ ИОНОВ заряд иона – надстрочный индекс справа знак (+ или ) после цифры: SO42 (а не SO42) Fe3+ (а не Fe+3) знак (+ или ) до цифры – обозначение ст.окисления: Fe+2 или S2
ЗАПИСЬ СИМВОЛОВ ИОНОВ заряд иона – надстрочный индекс справа знак (+ или ) после цифры: SO42 (а не SO42) Fe3+ (а не Fe+3) знак (+ или ) до цифры – обозначение ст.окисления: Fe+2 или S2
 НАЗВАНИЯ КАТИОНОВ (правила ИЮПАК) одноэлементные одноатомные катионы: Cu+ – катион меди(I) Cu2+ – катион меди(II) Ba2+ – катион бария (вместо катион бария(II)) одноэлементные многоатомные катионы: указывают число атомов с помощью числовых приставок вместо ст.окисления – общий заряд катиона арабскими цифрами: Hg22+ – катион диртути(2+) I2+ – катион дииода(1+) S82+ – катион октасеры(2+) Se62+ – катион гексаселена(2+) О2+ – катион дикислорода(1+) или катион диоксигенила
НАЗВАНИЯ КАТИОНОВ (правила ИЮПАК) одноэлементные одноатомные катионы: Cu+ – катион меди(I) Cu2+ – катион меди(II) Ba2+ – катион бария (вместо катион бария(II)) одноэлементные многоатомные катионы: указывают число атомов с помощью числовых приставок вместо ст.окисления – общий заряд катиона арабскими цифрами: Hg22+ – катион диртути(2+) I2+ – катион дииода(1+) S82+ – катион октасеры(2+) Se62+ – катион гексаселена(2+) О2+ – катион дикислорода(1+) или катион диоксигенила
![>многоэлементные катионы: UO2+ – катион диоксоурана(V) (HgNO3)+ – катион нитратортути(II) [Ti(H2O)6]3+ – катион гексаакватитана(III) >многоэлементные катионы: UO2+ – катион диоксоурана(V) (HgNO3)+ – катион нитратортути(II) [Ti(H2O)6]3+ – катион гексаакватитана(III)](https://present5.com/presentacii-2/20171213\38960-neorg_chem_basic_2.ppt\38960-neorg_chem_basic_2_32.jpg) многоэлементные катионы: UO2+ – катион диоксоурана(V) (HgNO3)+ – катион нитратортути(II) [Ti(H2O)6]3+ – катион гексаакватитана(III) (H3SO4)+ – катион сульфатотриводорода(I) специальные названия катионов: в состав катиона (м.б. условного) входит кислород: -ил NO+ – катион нитрозила NO2+ – катион нитроила VO2+ – катион ванадила UO22+ – катион уранила SO2+ – катион тионила SO22+ – катион сульфурила РO3+ – катион фосфорила CrO22+ – катион хромила катион образован присоединением Н+ к водородному соединению: -оний (-иний) NН4+ – катион аммония РН4+ – катион фосфония AsH4+ – катион арсония Н3O+ – катион оксония N2H5+ – катион гидразиния(1+) N2H62+ – катион гидразиния(2+) NH3OH+ – катион гидроксиламиния "ониевые" катионы, образованные замещением атомов Н: NF4+ – катион тетрафтораммония As(C6Н5)4+ – катион тетрафениларсония
многоэлементные катионы: UO2+ – катион диоксоурана(V) (HgNO3)+ – катион нитратортути(II) [Ti(H2O)6]3+ – катион гексаакватитана(III) (H3SO4)+ – катион сульфатотриводорода(I) специальные названия катионов: в состав катиона (м.б. условного) входит кислород: -ил NO+ – катион нитрозила NO2+ – катион нитроила VO2+ – катион ванадила UO22+ – катион уранила SO2+ – катион тионила SO22+ – катион сульфурила РO3+ – катион фосфорила CrO22+ – катион хромила катион образован присоединением Н+ к водородному соединению: -оний (-иний) NН4+ – катион аммония РН4+ – катион фосфония AsH4+ – катион арсония Н3O+ – катион оксония N2H5+ – катион гидразиния(1+) N2H62+ – катион гидразиния(2+) NH3OH+ – катион гидроксиламиния "ониевые" катионы, образованные замещением атомов Н: NF4+ – катион тетрафтораммония As(C6Н5)4+ – катион тетрафениларсония
 одноэлементные одноатомные анионы: -ид + -ион Cl – хлорид-ион H – гидрид-ион S2 – сульфид-ион N3 – нитрид-ион одноэлементные многоатомные анионы: указывают число атомов с помощью числовых приставок вместо ст.окисления – общий заряд аниона арабскими цифрами: I3 – трииодид(1)-ион S22 – дисульфид(2)-ион Sn2 – полисульфид-ион распространенным анионам присвоены специальные названия: C22 – ацетиленид-ион (вместо дикарбид(2)-ион) O3 – озонид-ион (вместо триоксид(1)-ион) N3 – азид-ион (вместо тринитрид(1)-ион) O22 – пероксид-ион (вместо диоксид(2)-ион) O2 – надпероксид-ион (вместо диоксид(1)-ион) НАЗВАНИЯ АНИОНОВ (правила ИЮПАК)
одноэлементные одноатомные анионы: -ид + -ион Cl – хлорид-ион H – гидрид-ион S2 – сульфид-ион N3 – нитрид-ион одноэлементные многоатомные анионы: указывают число атомов с помощью числовых приставок вместо ст.окисления – общий заряд аниона арабскими цифрами: I3 – трииодид(1)-ион S22 – дисульфид(2)-ион Sn2 – полисульфид-ион распространенным анионам присвоены специальные названия: C22 – ацетиленид-ион (вместо дикарбид(2)-ион) O3 – озонид-ион (вместо триоксид(1)-ион) N3 – азид-ион (вместо тринитрид(1)-ион) O22 – пероксид-ион (вместо диоксид(2)-ион) O2 – надпероксид-ион (вместо диоксид(1)-ион) НАЗВАНИЯ АНИОНОВ (правила ИЮПАК)
 многоэлементные анионы: SO42 – тетраоксосульфат(VI)-ион NO3 – тринитрат(V)-ион РO43 – тетраоксофосфат(V)-ион RuO4 – тетраоксорутенат(VII)-ион специальные названия катионов: СN – цианид-ион СN2 – цианамид-ион NH2 – амид-ион NH2 – имид-ион NO – нитрозид-ион ОН – гидроксид-ион HS – гидросульфид-ион НO2 – гидропероксид-ион OCN – цианат-ион CNO – фульминат-ион NCS – тиоцианат-ион (роданид-ион)
многоэлементные анионы: SO42 – тетраоксосульфат(VI)-ион NO3 – тринитрат(V)-ион РO43 – тетраоксофосфат(V)-ион RuO4 – тетраоксорутенат(VII)-ион специальные названия катионов: СN – цианид-ион СN2 – цианамид-ион NH2 – амид-ион NH2 – имид-ион NO – нитрозид-ион ОН – гидроксид-ион HS – гидросульфид-ион НO2 – гидропероксид-ион OCN – цианат-ион CNO – фульминат-ион NCS – тиоцианат-ион (роданид-ион)
 НАЗВАНИЯ ПРОСТЫХ ВЕЩЕСТВ названия, как правило, происходят от названий соответствующих элементов для твердых аллотропных модификаций: -, -, - (начиная с -низкотемпературной), например: -Sn – -олово (серое олово); -Sn – -олово (белое олово); -Sn – -олово специальные (устоявшиеся) названия, например: графит, алмаз, фуллерен, карбин
НАЗВАНИЯ ПРОСТЫХ ВЕЩЕСТВ названия, как правило, происходят от названий соответствующих элементов для твердых аллотропных модификаций: -, -, - (начиная с -низкотемпературной), например: -Sn – -олово (серое олово); -Sn – -олово (белое олово); -Sn – -олово специальные (устоявшиеся) названия, например: графит, алмаз, фуллерен, карбин
 МНОГОЭЛЕМЕНТНЫЕ СОЕДИНЕНИЯ ИНТЕРМЕТАЛЛИДЫ запись формулы: первым (слева в формуле) записывают символ металла, который стоит левее в длиннопериодном варианте ПС название дают справа налево в одно слово: Mg2Sn – оловодимагний NaZn4 – тетрацинкнатрий Ag5Al3 – триалюминийпентасеребро Rb7Hg8 – октартутьгептарубидий NiCu3Al6 – гексаалюминийтримедьникель названия дают при чтении формулы справа налево
МНОГОЭЛЕМЕНТНЫЕ СОЕДИНЕНИЯ ИНТЕРМЕТАЛЛИДЫ запись формулы: первым (слева в формуле) записывают символ металла, который стоит левее в длиннопериодном варианте ПС название дают справа налево в одно слово: Mg2Sn – оловодимагний NaZn4 – тетрацинкнатрий Ag5Al3 – триалюминийпентасеребро Rb7Hg8 – октартутьгептарубидий NiCu3Al6 – гексаалюминийтримедьникель названия дают при чтении формулы справа налево
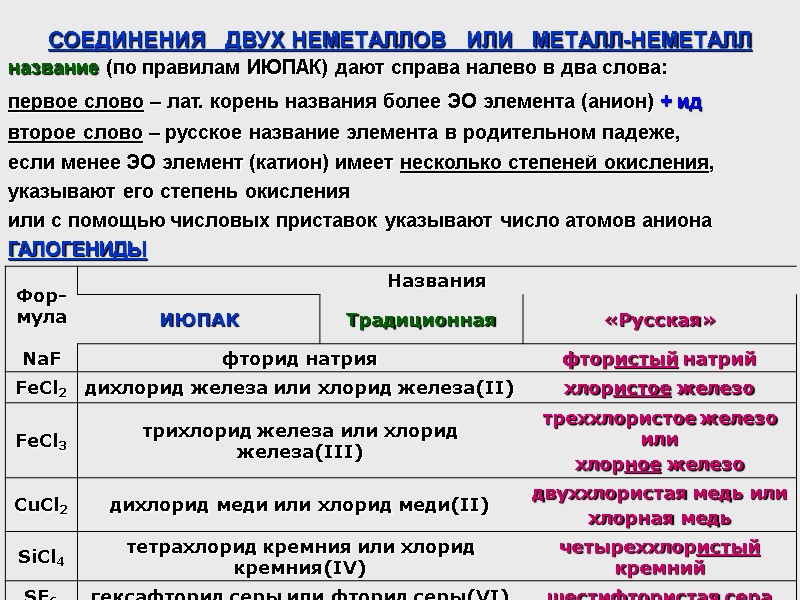
 СОЕДИНЕНИЯ ДВУХ НЕМЕТАЛЛОВ ИЛИ МЕТАЛЛ-НЕМЕТАЛЛ название (по правилам ИЮПАК) дают справа налево в два слова: первое слово – лат. корень названия более ЭО элемента (анион) + ид второе слово – русское название элемента в родительном падеже, если менее ЭО элемент (катион) имеет несколько степеней окисления, указывают его степень окисления или с помощью числовых приставок указывают число атомов аниона ГАЛОГЕНИДЫ
СОЕДИНЕНИЯ ДВУХ НЕМЕТАЛЛОВ ИЛИ МЕТАЛЛ-НЕМЕТАЛЛ название (по правилам ИЮПАК) дают справа налево в два слова: первое слово – лат. корень названия более ЭО элемента (анион) + ид второе слово – русское название элемента в родительном падеже, если менее ЭО элемент (катион) имеет несколько степеней окисления, указывают его степень окисления или с помощью числовых приставок указывают число атомов аниона ГАЛОГЕНИДЫ
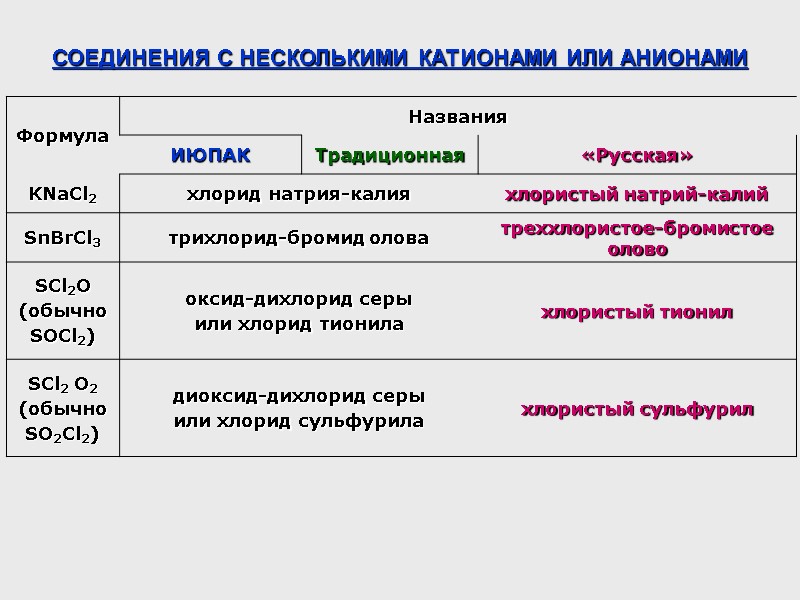
 СОЕДИНЕНИЯ С НЕСКОЛЬКИМИ КАТИОНАМИ ИЛИ АНИОНАМИ
СОЕДИНЕНИЯ С НЕСКОЛЬКИМИ КАТИОНАМИ ИЛИ АНИОНАМИ
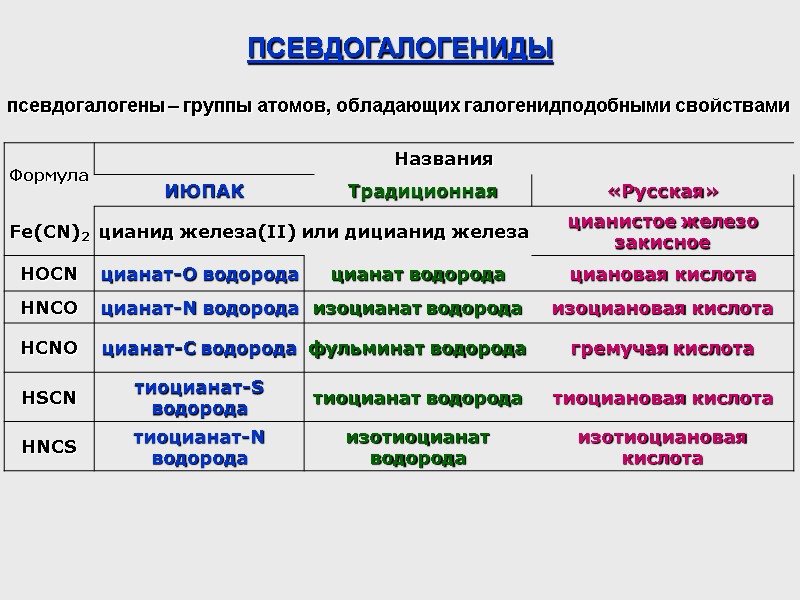
 ПСЕВДОГАЛОГЕНИДЫ псевдогалогены – группы атомов, обладающих галогенидподобными свойствами
ПСЕВДОГАЛОГЕНИДЫ псевдогалогены – группы атомов, обладающих галогенидподобными свойствами
 ОКСИДЫ (O2), ПЕРОКСИДЫ (O22), НАДПЕРОКСИДЫ (O2), ОЗОНИДЫ (O3): название (по правилам ИЮПАК): оксид + название элемента + (ст.окисления) или или с помощью числовых приставок указывают число атомов кислорода пероксид (надпероксид, озонид) + название элемента
ОКСИДЫ (O2), ПЕРОКСИДЫ (O22), НАДПЕРОКСИДЫ (O2), ОЗОНИДЫ (O3): название (по правилам ИЮПАК): оксид + название элемента + (ст.окисления) или или с помощью числовых приставок указывают число атомов кислорода пероксид (надпероксид, озонид) + название элемента
 ВОДОРОДНЫЕ СОЕДИНЕНИЯ: твердые соединения металл-водород: гидрид LiH – гидрид лития CaH2 – гидрид кальция (BeH2)n – поли(дигидрид бериллия) Li4RhH5 – пентагидрид родия-тетралития газообразные соединения Н (с одним атомом другого элемента), водные растворы которых проявляют кислотные свойства: о + водород HCl – хлороводород (по «Русской» номенклатуре – хлористый водород) H2S – сероводород (по «Русской» номенклатуре – сернистый водород) HCN – циановодород (по «Русской» номенклатуре – цианистый водород) HN3 – азидоводород (по «Русской» номенклатуре – азотистый водород) летучие соединения Н с одним атомом элементов 15 (V А) группы (кроме N): лат. корень + ин: РH3 – фосфин AsH3 – арсин SbH3 – стибин BiH3 – висмутин остальные летучие соединения Н (кроме N): лат. корень + ан SiH4 – силан P2H4 – дифосфан Si2H6 – дисилан B2H6 – диборан PbH4 – плюмбан H2S3 – трисульфан собственные названия некоторых соединений водорода: H2O – вода NH3 – аммиак N2H4 – гидразин
ВОДОРОДНЫЕ СОЕДИНЕНИЯ: твердые соединения металл-водород: гидрид LiH – гидрид лития CaH2 – гидрид кальция (BeH2)n – поли(дигидрид бериллия) Li4RhH5 – пентагидрид родия-тетралития газообразные соединения Н (с одним атомом другого элемента), водные растворы которых проявляют кислотные свойства: о + водород HCl – хлороводород (по «Русской» номенклатуре – хлористый водород) H2S – сероводород (по «Русской» номенклатуре – сернистый водород) HCN – циановодород (по «Русской» номенклатуре – цианистый водород) HN3 – азидоводород (по «Русской» номенклатуре – азотистый водород) летучие соединения Н с одним атомом элементов 15 (V А) группы (кроме N): лат. корень + ин: РH3 – фосфин AsH3 – арсин SbH3 – стибин BiH3 – висмутин остальные летучие соединения Н (кроме N): лат. корень + ан SiH4 – силан P2H4 – дифосфан Si2H6 – дисилан B2H6 – диборан PbH4 – плюмбан H2S3 – трисульфан собственные названия некоторых соединений водорода: H2O – вода NH3 – аммиак N2H4 – гидразин
 ГИДРОКСИДЫ (ОСНОВАНИЯ): название (по правилам ИЮПАК): гидроксид + название элемента + (ст.окисления) или или с помощью числовых приставок указывают число гидроксид-ионов
ГИДРОКСИДЫ (ОСНОВАНИЯ): название (по правилам ИЮПАК): гидроксид + название элемента + (ст.окисления) или или с помощью числовых приставок указывают число гидроксид-ионов
 КИСЛОТЫ: БЕСКИСЛОРОДНЫЕ КИСЛОТЫ (водные растворы газообразных водородных соединений): название (по правилам ИЮПАК): в два слова первое слово – название соответствующего водородного соединения + ная второе слово – кислота
КИСЛОТЫ: БЕСКИСЛОРОДНЫЕ КИСЛОТЫ (водные растворы газообразных водородных соединений): название (по правилам ИЮПАК): в два слова первое слово – название соответствующего водородного соединения + ная второе слово – кислота
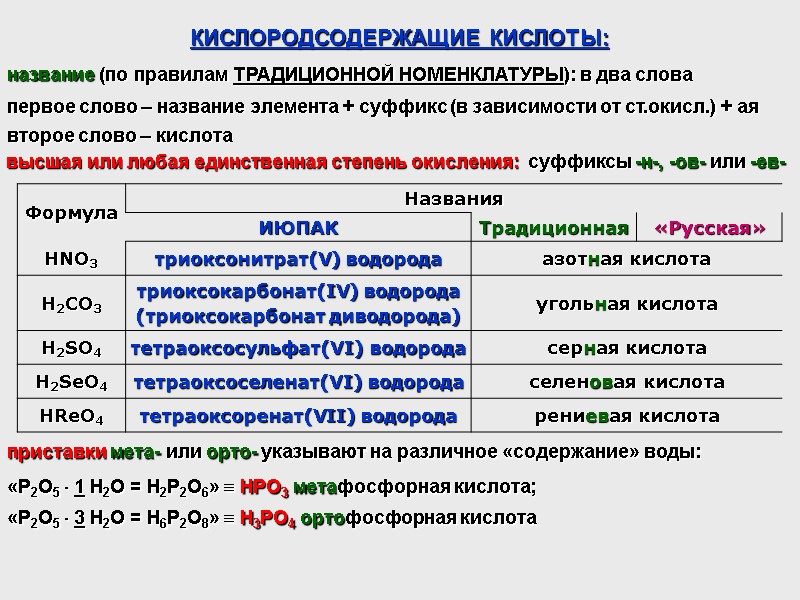
 КИСЛОРОДСОДЕРЖАЩИЕ КИСЛОТЫ: название (по правилам ТРАДИЦИОННОЙ НОМЕНКЛАТУРЫ): в два слова первое слово – название элемента + суффикс (в зависимости от ст.окисл.) + ая второе слово – кислота высшая или любая единственная степень окисления: суффиксы -н-, -ов- или -ев- приставки мета- или орто- указывают на различное «содержание» воды: «P2O5 1 H2O = H2P2O6» HPO3 метафосфорная кислота; «P2O5 3 H2O = H6P2O8» H3PO4 ортофосфорная кислота
КИСЛОРОДСОДЕРЖАЩИЕ КИСЛОТЫ: название (по правилам ТРАДИЦИОННОЙ НОМЕНКЛАТУРЫ): в два слова первое слово – название элемента + суффикс (в зависимости от ст.окисл.) + ая второе слово – кислота высшая или любая единственная степень окисления: суффиксы -н-, -ов- или -ев- приставки мета- или орто- указывают на различное «содержание» воды: «P2O5 1 H2O = H2P2O6» HPO3 метафосфорная кислота; «P2O5 3 H2O = H6P2O8» H3PO4 ортофосфорная кислота
 КИСЛОРОДСОДЕРЖАЩИЕ КИСЛОТЫ: название (по правилам ТРАДИЦИОННОЙ НОМЕНКЛАТУРЫ): для высшей степени окисления – как было описано на предыдущем слайде; для низшей степени окисления – суффиксы -ист- или -овист- если возможны две степени окисления:
КИСЛОРОДСОДЕРЖАЩИЕ КИСЛОТЫ: название (по правилам ТРАДИЦИОННОЙ НОМЕНКЛАТУРЫ): для высшей степени окисления – как было описано на предыдущем слайде; для низшей степени окисления – суффиксы -ист- или -овист- если возможны две степени окисления:
 КИСЛОРОДСОДЕРЖАЩИЕ КИСЛОТЫ: название (по правилам ТРАДИЦИОННОЙ НОМЕНКЛАТУРЫ): для высшей и средней степени окисления – как было описано ранее; для самой низшей степени окисления (обычно +1) – суффикс -новатист- если возможны три степени окисления:
КИСЛОРОДСОДЕРЖАЩИЕ КИСЛОТЫ: название (по правилам ТРАДИЦИОННОЙ НОМЕНКЛАТУРЫ): для высшей и средней степени окисления – как было описано ранее; для самой низшей степени окисления (обычно +1) – суффикс -новатист- если возможны три степени окисления:
 КИСЛОРОДСОДЕРЖАЩИЕ КИСЛОТЫ: название (по правилам ТРАДИЦИОННОЙ НОМЕНКЛАТУРЫ): суффиксы -н-, -новат-, -ист-, -новатист- уменьшение степени окисления «центрального атома» если возможны четыре степени окисления:
КИСЛОРОДСОДЕРЖАЩИЕ КИСЛОТЫ: название (по правилам ТРАДИЦИОННОЙ НОМЕНКЛАТУРЫ): суффиксы -н-, -новат-, -ист-, -новатист- уменьшение степени окисления «центрального атома» если возможны четыре степени окисления:
 КИСЛОРОДСОДЕРЖАЩИЕ КИСЛОТЫ: в названиях (по правилам ТРАДИЦИОННОЙ НОМЕНКЛАТУРЫ): используют числовые приставки если разное количество атомов кислотообразующего элемента в одной ст.окисл.:
КИСЛОРОДСОДЕРЖАЩИЕ КИСЛОТЫ: в названиях (по правилам ТРАДИЦИОННОЙ НОМЕНКЛАТУРЫ): используют числовые приставки если разное количество атомов кислотообразующего элемента в одной ст.окисл.:
 ЗАМЕЩЕННЫЕ КИСЛОТЫ на атомы серы: добавляют приставку тио и используют числовые приставки на пероксогруппу (-О-О-): добавляют приставку пероксо и используют числовые приставки если в молекуле оксокислоты атомы О замещены (частично или полностью): в названиях (по правилам ТРАДИЦИОННОЙ НОМЕНКЛАТУРЫ):
ЗАМЕЩЕННЫЕ КИСЛОТЫ на атомы серы: добавляют приставку тио и используют числовые приставки на пероксогруппу (-О-О-): добавляют приставку пероксо и используют числовые приставки если в молекуле оксокислоты атомы О замещены (частично или полностью): в названиях (по правилам ТРАДИЦИОННОЙ НОМЕНКЛАТУРЫ):
 ДРУГИЕ ЗАМЕЩЕННЫЕ КИСЛОТЫ замещается часть групп ОН или атомы О: специальные названия для замещенных серных кислот: сульфоновые кислоты (HSO3-)
ДРУГИЕ ЗАМЕЩЕННЫЕ КИСЛОТЫ замещается часть групп ОН или атомы О: специальные названия для замещенных серных кислот: сульфоновые кислоты (HSO3-)
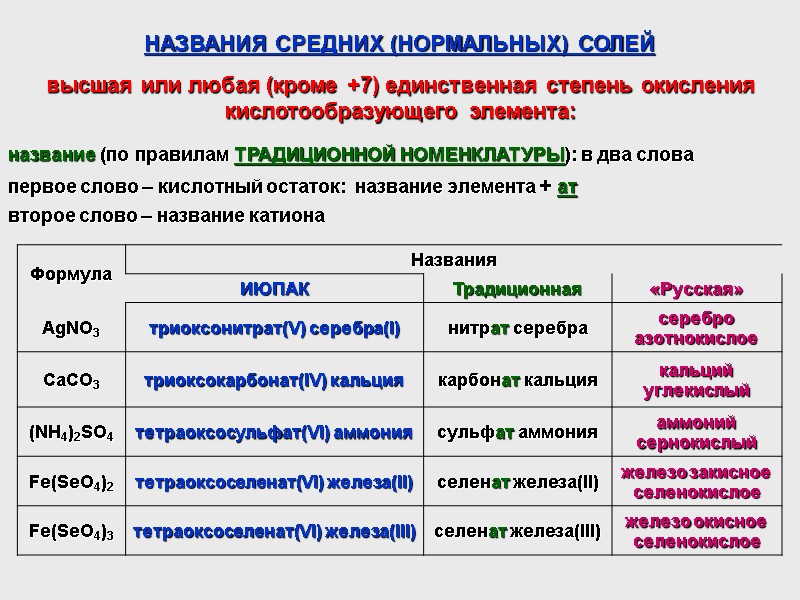
 НАЗВАНИЯ СРЕДНИХ (НОРМАЛЬНЫХ) СОЛЕЙ название (по правилам ТРАДИЦИОННОЙ НОМЕНКЛАТУРЫ): в два слова первое слово – кислотный остаток: название элемента + ат второе слово – название катиона высшая или любая (кроме +7) единственная степень окисления кислотообразующего элемента:
НАЗВАНИЯ СРЕДНИХ (НОРМАЛЬНЫХ) СОЛЕЙ название (по правилам ТРАДИЦИОННОЙ НОМЕНКЛАТУРЫ): в два слова первое слово – кислотный остаток: название элемента + ат второе слово – название катиона высшая или любая (кроме +7) единственная степень окисления кислотообразующего элемента:
 НАЗВАНИЯ СРЕДНИХ (НОРМАЛЬНЫХ) СОЛЕЙ название (по правилам ТРАДИЦИОННОЙ НОМЕНКЛАТУРЫ): в два слова первое слово – кислотный остаток: приставка пер + название элемента + ат второе слово – название катиона степень окисления кислотообразующего элемента +7:
НАЗВАНИЯ СРЕДНИХ (НОРМАЛЬНЫХ) СОЛЕЙ название (по правилам ТРАДИЦИОННОЙ НОМЕНКЛАТУРЫ): в два слова первое слово – кислотный остаток: приставка пер + название элемента + ат второе слово – название катиона степень окисления кислотообразующего элемента +7:
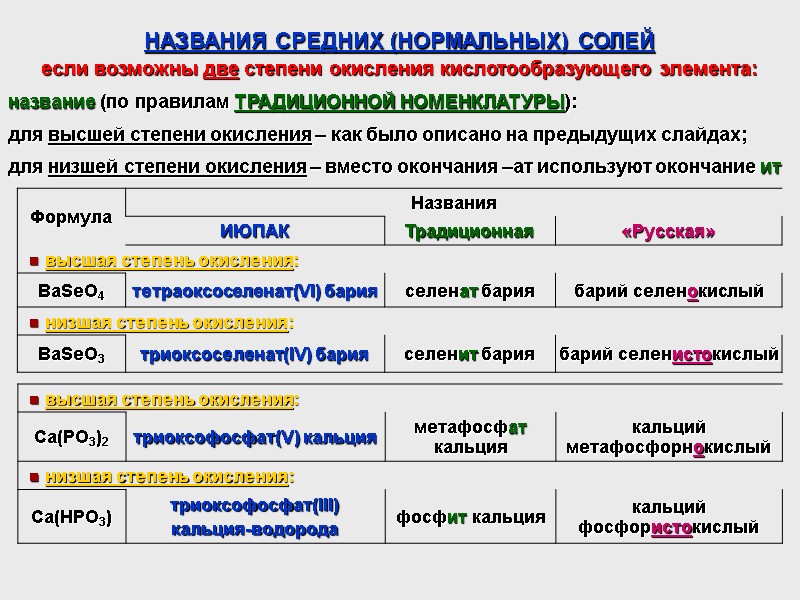
 НАЗВАНИЯ СРЕДНИХ (НОРМАЛЬНЫХ) СОЛЕЙ если возможны две степени окисления кислотообразующего элемента: название (по правилам ТРАДИЦИОННОЙ НОМЕНКЛАТУРЫ): для высшей степени окисления – как было описано на предыдущих слайдах; для низшей степени окисления – вместо окончания –ат используют окончание ит
НАЗВАНИЯ СРЕДНИХ (НОРМАЛЬНЫХ) СОЛЕЙ если возможны две степени окисления кислотообразующего элемента: название (по правилам ТРАДИЦИОННОЙ НОМЕНКЛАТУРЫ): для высшей степени окисления – как было описано на предыдущих слайдах; для низшей степени окисления – вместо окончания –ат используют окончание ит
 НАЗВАНИЯ СРЕДНИХ (НОРМАЛЬНЫХ) СОЛЕЙ если три степени окисления кислотообразующего элемента: название (по правилам ТРАДИЦИОННОЙ НОМЕНКЛАТУРЫ): для высшей степени окисления – как было описано ранее (-ат); для промежуточной степени окисления – как было описано ранее (-ит); для низшей степени окисления – приставка гипо + название элемента + ит
НАЗВАНИЯ СРЕДНИХ (НОРМАЛЬНЫХ) СОЛЕЙ если три степени окисления кислотообразующего элемента: название (по правилам ТРАДИЦИОННОЙ НОМЕНКЛАТУРЫ): для высшей степени окисления – как было описано ранее (-ат); для промежуточной степени окисления – как было описано ранее (-ит); для низшей степени окисления – приставка гипо + название элемента + ит
 НАЗВАНИЯ СРЕДНИХ (НОРМАЛЬНЫХ) СОЛЕЙ если четыре степени окисления кислотообразующего элемента: название (по правилам ТРАДИЦИОННОЙ НОМЕНКЛАТУРЫ): кислотные остатки пер…ат, …ат, …ит, гипо…ит уменьшение степени окисления «центрального атома»
НАЗВАНИЯ СРЕДНИХ (НОРМАЛЬНЫХ) СОЛЕЙ если четыре степени окисления кислотообразующего элемента: название (по правилам ТРАДИЦИОННОЙ НОМЕНКЛАТУРЫ): кислотные остатки пер…ат, …ат, …ит, гипо…ит уменьшение степени окисления «центрального атома»
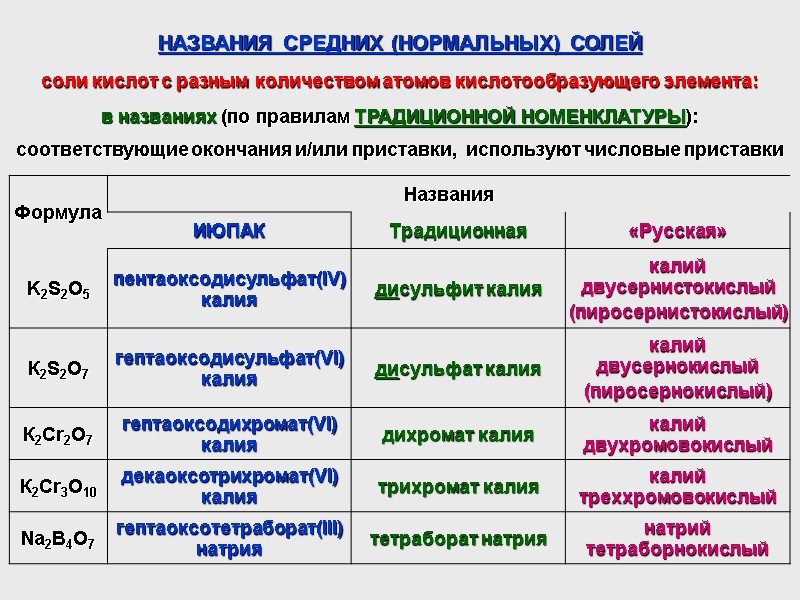
 НАЗВАНИЯ СРЕДНИХ (НОРМАЛЬНЫХ) СОЛЕЙ соли кислот с разным количеством атомов кислотообразующего элемента: в названиях (по правилам ТРАДИЦИОННОЙ НОМЕНКЛАТУРЫ): соответствующие окончания и/или приставки, используют числовые приставки
НАЗВАНИЯ СРЕДНИХ (НОРМАЛЬНЫХ) СОЛЕЙ соли кислот с разным количеством атомов кислотообразующего элемента: в названиях (по правилам ТРАДИЦИОННОЙ НОМЕНКЛАТУРЫ): соответствующие окончания и/или приставки, используют числовые приставки
 НАЗВАНИЯ СРЕДНИХ (НОРМАЛЬНЫХ) СОЛЕЙ ЗАМЕЩЕННЫХ КИСЛОТ соли тио- и пероксокислот: в названиях (по правилам ТРАДИЦИОННОЙ НОМЕНКЛАТУРЫ): соответствующие окончания и приставки, используют числовые приставки
НАЗВАНИЯ СРЕДНИХ (НОРМАЛЬНЫХ) СОЛЕЙ ЗАМЕЩЕННЫХ КИСЛОТ соли тио- и пероксокислот: в названиях (по правилам ТРАДИЦИОННОЙ НОМЕНКЛАТУРЫ): соответствующие окончания и приставки, используют числовые приставки
 НАЗВАНИЯ СРЕДНИХ (НОРМАЛЬНЫХ) СОЛЕЙ ЗАМЕЩЕННЫХ КИСЛОТ соли других замещенных кислот: в названиях (по правилам ТРАДИЦИОННОЙ НОМЕНКЛАТУРЫ): соответствующие окончания и приставки, используют числовые приставки
НАЗВАНИЯ СРЕДНИХ (НОРМАЛЬНЫХ) СОЛЕЙ ЗАМЕЩЕННЫХ КИСЛОТ соли других замещенных кислот: в названиях (по правилам ТРАДИЦИОННОЙ НОМЕНКЛАТУРЫ): соответствующие окончания и приставки, используют числовые приставки
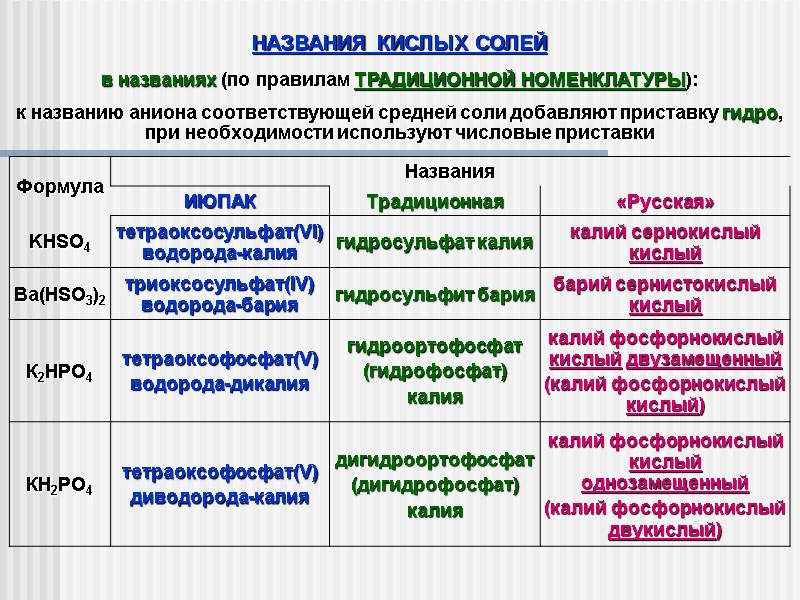
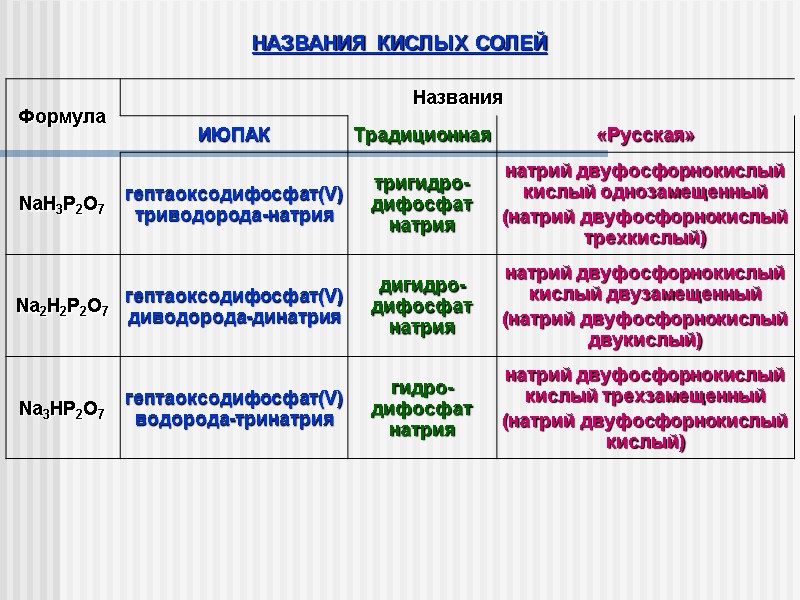
 НАЗВАНИЯ КИСЛЫХ СОЛЕЙ в названиях (по правилам ТРАДИЦИОННОЙ НОМЕНКЛАТУРЫ): к названию аниона соответствующей средней соли добавляют приставку гидро, при необходимости используют числовые приставки
НАЗВАНИЯ КИСЛЫХ СОЛЕЙ в названиях (по правилам ТРАДИЦИОННОЙ НОМЕНКЛАТУРЫ): к названию аниона соответствующей средней соли добавляют приставку гидро, при необходимости используют числовые приставки
 НАЗВАНИЯ КИСЛЫХ СОЛЕЙ
НАЗВАНИЯ КИСЛЫХ СОЛЕЙ
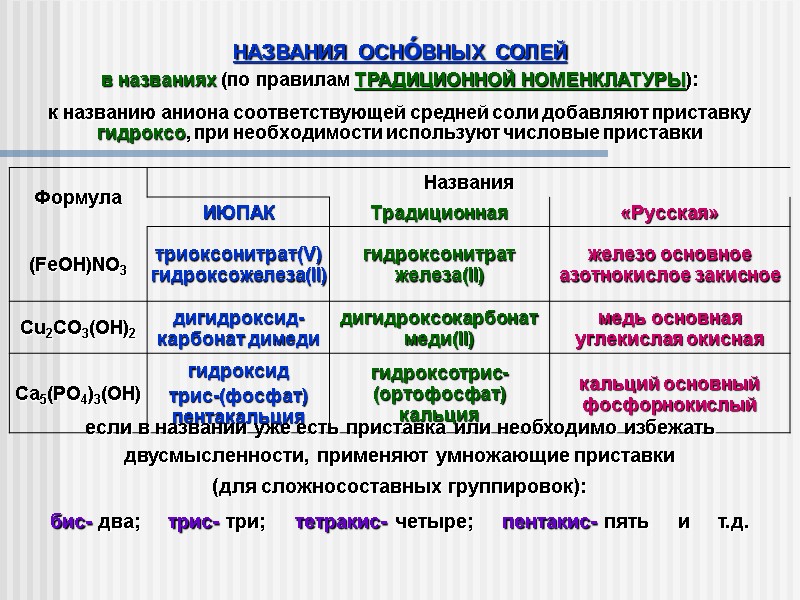
 НАЗВАНИЯ ОСНόВНЫХ СОЛЕЙ в названиях (по правилам ТРАДИЦИОННОЙ НОМЕНКЛАТУРЫ): к названию аниона соответствующей средней соли добавляют приставку гидроксо, при необходимости используют числовые приставки если в названии уже есть приставка или необходимо избежать двусмысленности, применяют умножающие приставки (для сложносоставных группировок): бис- два; трис- три; тетракис- четыре; пентакис- пять и т.д.
НАЗВАНИЯ ОСНόВНЫХ СОЛЕЙ в названиях (по правилам ТРАДИЦИОННОЙ НОМЕНКЛАТУРЫ): к названию аниона соответствующей средней соли добавляют приставку гидроксо, при необходимости используют числовые приставки если в названии уже есть приставка или необходимо избежать двусмысленности, применяют умножающие приставки (для сложносоставных группировок): бис- два; трис- три; тетракис- четыре; пентакис- пять и т.д.
 НАЗВАНИЯ КРИСТАЛЛОГИДРАТОВ названия (по правилам ИЮПАК и ТРАДИЦИОННОЙ НОМЕНКЛАТУРЫ) состоят из: гидрат (при необходимости используют числовые приставки) + систематическое или традиционное название
НАЗВАНИЯ КРИСТАЛЛОГИДРАТОВ названия (по правилам ИЮПАК и ТРАДИЦИОННОЙ НОМЕНКЛАТУРЫ) состоят из: гидрат (при необходимости используют числовые приставки) + систематическое или традиционное название
 КВАСЦЫ и ШЁНИТЫ квасцы: двойные сульфаты с общей формулой MI MIII (SO4)2 · 12H2O MI = Na+, K+, Rb+, Cs+, Tl+, NH4+; MIII = Al3+, Ga3+, In3+, Tl3+, Ti3+, V3+, Cr3+, Mn3+, Fe3+, Co3+, Rh3+, Ir3+. шёниты: двойные сульфаты с общей формулой M2I MII (SO4)2 · 6H2O MI = K+, Rb+, Cs+, Tl+, NH4+; MIII = Mg2+, V2+, Cr2+, Mn2+, Fe2+, Co2+, Ni2+, Cu2+, Zn2+, Cd2+. НЕКОТОРЫЕ ПРИМЕРЫ
КВАСЦЫ и ШЁНИТЫ квасцы: двойные сульфаты с общей формулой MI MIII (SO4)2 · 12H2O MI = Na+, K+, Rb+, Cs+, Tl+, NH4+; MIII = Al3+, Ga3+, In3+, Tl3+, Ti3+, V3+, Cr3+, Mn3+, Fe3+, Co3+, Rh3+, Ir3+. шёниты: двойные сульфаты с общей формулой M2I MII (SO4)2 · 6H2O MI = K+, Rb+, Cs+, Tl+, NH4+; MIII = Mg2+, V2+, Cr2+, Mn2+, Fe2+, Co2+, Ni2+, Cu2+, Zn2+, Cd2+. НЕКОТОРЫЕ ПРИМЕРЫ
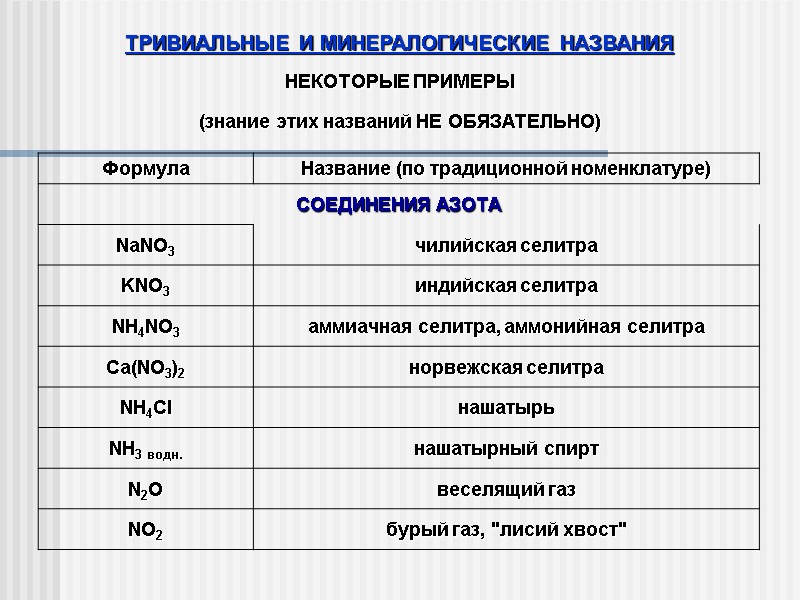
 ТРИВИАЛЬНЫЕ И МИНЕРАЛОГИЧЕСКИЕ НАЗВАНИЯ НЕКОТОРЫЕ ПРИМЕРЫ (знание этих названий НЕ ОБЯЗАТЕЛЬНО)
ТРИВИАЛЬНЫЕ И МИНЕРАЛОГИЧЕСКИЕ НАЗВАНИЯ НЕКОТОРЫЕ ПРИМЕРЫ (знание этих названий НЕ ОБЯЗАТЕЛЬНО)
 ТРИВИАЛЬНЫЕ И МИНЕРАЛОГИЧЕСКИЕ НАЗВАНИЯ НЕКОТОРЫЕ ПРИМЕРЫ (знание этих названий НЕ ОБЯЗАТЕЛЬНО)
ТРИВИАЛЬНЫЕ И МИНЕРАЛОГИЧЕСКИЕ НАЗВАНИЯ НЕКОТОРЫЕ ПРИМЕРЫ (знание этих названий НЕ ОБЯЗАТЕЛЬНО)
 ТРИВИАЛЬНЫЕ И МИНЕРАЛОГИЧЕСКИЕ НАЗВАНИЯ НЕКОТОРЫЕ ПРИМЕРЫ (знание этих названий НЕ ОБЯЗАТЕЛЬНО)
ТРИВИАЛЬНЫЕ И МИНЕРАЛОГИЧЕСКИЕ НАЗВАНИЯ НЕКОТОРЫЕ ПРИМЕРЫ (знание этих названий НЕ ОБЯЗАТЕЛЬНО)
