 Классификация и номенклатура неорганических веществ Лекция 5 по курсу «Общая химия»
Классификация и номенклатура неорганических веществ Лекция 5 по курсу «Общая химия»
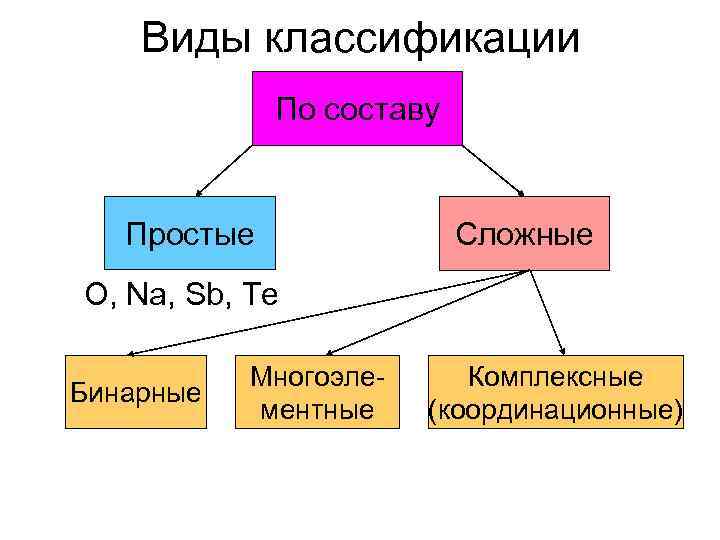 Виды классификации По составу Простые Сложные O, Na, Sb, Te Многоэле- Комплексные Бинарные ментные (координационные)
Виды классификации По составу Простые Сложные O, Na, Sb, Te Многоэле- Комплексные Бинарные ментные (координационные)
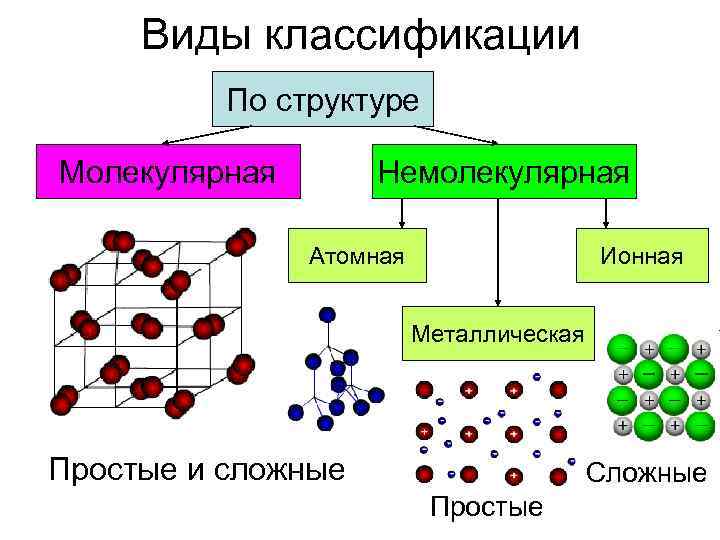 Виды классификации По структуре Молекулярная Немолекулярная Атомная Ионная Металлическая Простые и сложные Сложные Простые
Виды классификации По структуре Молекулярная Немолекулярная Атомная Ионная Металлическая Простые и сложные Сложные Простые
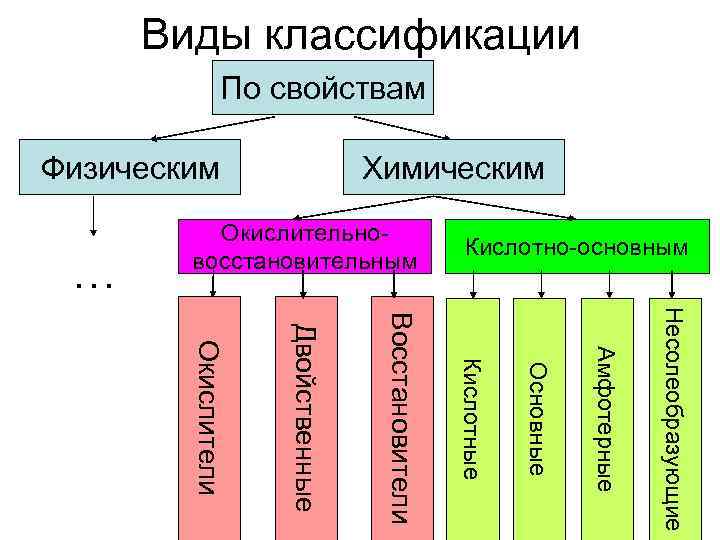 Виды классификации По свойствам Физическим Химическим Окислительно- Кислотно-основным восстановительным … Несолеобразующие Восстановители Двойственные Окислители Амфотерные Кислотные Основные
Виды классификации По свойствам Физическим Химическим Окислительно- Кислотно-основным восстановительным … Несолеобразующие Восстановители Двойственные Окислители Амфотерные Кислотные Основные
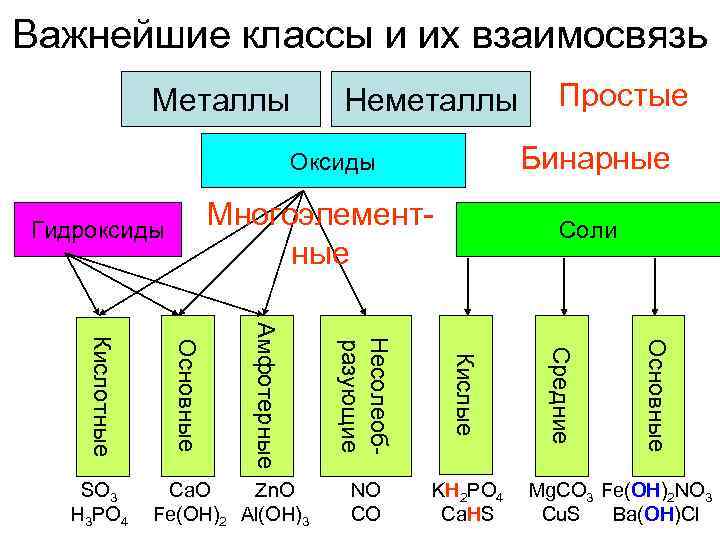 Важнейшие классы и их взаимосвязь Металлы Неметаллы Простые Оксиды Бинарные Гидроксиды Многоэлемент- Соли ные Амфотерные Кислотные Несолеоб- разующие Основные Средние Кислые SO 3 Ca. O Zn. O NO KH 2 PO 4 Mg. CO 3 Fe(OH)2 NO 3 H 3 PO 4 Fe(OH)2 Al(OH)3 CO Ca. HS Cu. S Ba(OH)Cl
Важнейшие классы и их взаимосвязь Металлы Неметаллы Простые Оксиды Бинарные Гидроксиды Многоэлемент- Соли ные Амфотерные Кислотные Несолеоб- разующие Основные Средние Кислые SO 3 Ca. O Zn. O NO KH 2 PO 4 Mg. CO 3 Fe(OH)2 NO 3 H 3 PO 4 Fe(OH)2 Al(OH)3 CO Ca. HS Cu. S Ba(OH)Cl
 Оксиды • Неметаллы: несолеобразующие (CO, N 2 O, NO, Ge. O…) или кислотные (все остальные); • Металлы: основные (+1 – +2), амфотерные (+2 – +4), кислотные (+4 – +7); • Для s-металлов – основные (кроме Be); • Для p-металлов – главным образом амфотерные; • Для d-металлов – основные (Cr. O), амфотерные (Cr 2 O 3), кислотные (Cr. O 3);
Оксиды • Неметаллы: несолеобразующие (CO, N 2 O, NO, Ge. O…) или кислотные (все остальные); • Металлы: основные (+1 – +2), амфотерные (+2 – +4), кислотные (+4 – +7); • Для s-металлов – основные (кроме Be); • Для p-металлов – главным образом амфотерные; • Для d-металлов – основные (Cr. O), амфотерные (Cr 2 O 3), кислотные (Cr. O 3);
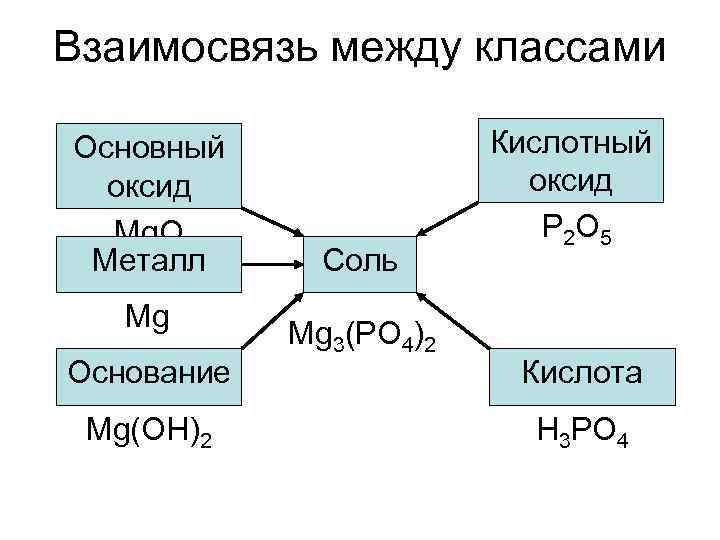 Взаимосвязь между классами Основный Кислотный оксид Mg. O P 2 O 5 Металл Соль Mg 3(PO 4)2 Основание Кислота Mg(OH)2 H 3 PO 4
Взаимосвязь между классами Основный Кислотный оксид Mg. O P 2 O 5 Металл Соль Mg 3(PO 4)2 Основание Кислота Mg(OH)2 H 3 PO 4
 Что такое кислотность и основность? Реакции в водном растворе: HCl + Ba(OH)2 = Ba. Cl 2 + HOH Na. H 2 PO 4 + 2 Na. OH = Na 3 PO 4 + 2 HOH H+ от кислоты, OH– от основания Реакции при сплавлении Zn. O + SO 3 = Zn 2+ SO 42– Zn. O + Ca(OH)2 = Ca 2+ Zn. O 22– + H 2 O Анион от кислоты, катион от основания
Что такое кислотность и основность? Реакции в водном растворе: HCl + Ba(OH)2 = Ba. Cl 2 + HOH Na. H 2 PO 4 + 2 Na. OH = Na 3 PO 4 + 2 HOH H+ от кислоты, OH– от основания Реакции при сплавлении Zn. O + SO 3 = Zn 2+ SO 42– Zn. O + Ca(OH)2 = Ca 2+ Zn. O 22– + H 2 O Анион от кислоты, катион от основания
 Амфотерные оксиды и гидроксиды: в растворе и при сплавлении Раствор Na. OH + Al(OH)3 = Na[Al(OH)4] Или: 3 Na. OH + Al(OH)3 = Na 3[Al(OH)6] (зависит от соотношения) K 2 O + Zn. O + H 2 O = K 2[Zn(OH)4] Расплав Na. OH + Al(OH)3 = Na. Al. O 2 + 2 H 2 O Или: 3 Na. OH + Al(OH)3 = Na 3 Al. O 3 + 3 H 2 O (зависит от соотношения) 2 KOH + Zn(OH)2 = K 2 Zn. O 2 + 2 H 2 O
Амфотерные оксиды и гидроксиды: в растворе и при сплавлении Раствор Na. OH + Al(OH)3 = Na[Al(OH)4] Или: 3 Na. OH + Al(OH)3 = Na 3[Al(OH)6] (зависит от соотношения) K 2 O + Zn. O + H 2 O = K 2[Zn(OH)4] Расплав Na. OH + Al(OH)3 = Na. Al. O 2 + 2 H 2 O Или: 3 Na. OH + Al(OH)3 = Na 3 Al. O 3 + 3 H 2 O (зависит от соотношения) 2 KOH + Zn(OH)2 = K 2 Zn. O 2 + 2 H 2 O
 Как составлять формулы солей a) Безводные формы Na 2 O + Sb 2 O 5 = ? 1. Найти основный (Na 2 O) и кислотный (Sb 2 O 5) 2. Записать по возрастающей ЭО: Na Sb O 3. Степени окисления: Na+1 Sb+5 O– 2 4. У элементов III-V периодов формула кислоты обычно Hx. ЭО 4: Na+1 Sb+5 O– 24 5. 1 x + 5 – 2· 4 = 0 x = 3 6. Na 3 Sb. O 4 7. 3 Na 2 O + Sb 2 O 5 = 2 Na 3 Sb. O 4
Как составлять формулы солей a) Безводные формы Na 2 O + Sb 2 O 5 = ? 1. Найти основный (Na 2 O) и кислотный (Sb 2 O 5) 2. Записать по возрастающей ЭО: Na Sb O 3. Степени окисления: Na+1 Sb+5 O– 2 4. У элементов III-V периодов формула кислоты обычно Hx. ЭО 4: Na+1 Sb+5 O– 24 5. 1 x + 5 – 2· 4 = 0 x = 3 6. Na 3 Sb. O 4 7. 3 Na 2 O + Sb 2 O 5 = 2 Na 3 Sb. O 4
 Как составлять формулы солей б) Гидроксокомплексы Na. OH + Cr(OH)3 = ? 1. Найти основание (Na. OН) и кислоту (Cr(OH)3) 2. Записать по убывающей ЭО: Na Cr OH 3. Заряды ионов: Na 1+ Cr 3+ OH– 4. Заряд +2 к. ч. = 4; Заряд +3 к. ч. = 4 или 6; 5. 1 x + 3 – 1· 4 = 0 x = 1 (Na[Cr(OH)4]) или: 1 x + 3 – 1· 6 = 0 x = 3 (Na 3[Cr(OH)6]) 6. Na. OH + Cr(OH)3 = Na[Cr(OH)4] или: 3 Na. OH + Cr(OH)3 = Na 3[Cr(OH)6]
Как составлять формулы солей б) Гидроксокомплексы Na. OH + Cr(OH)3 = ? 1. Найти основание (Na. OН) и кислоту (Cr(OH)3) 2. Записать по убывающей ЭО: Na Cr OH 3. Заряды ионов: Na 1+ Cr 3+ OH– 4. Заряд +2 к. ч. = 4; Заряд +3 к. ч. = 4 или 6; 5. 1 x + 3 – 1· 4 = 0 x = 1 (Na[Cr(OH)4]) или: 1 x + 3 – 1· 6 = 0 x = 3 (Na 3[Cr(OH)6]) 6. Na. OH + Cr(OH)3 = Na[Cr(OH)4] или: 3 Na. OH + Cr(OH)3 = Na 3[Cr(OH)6]
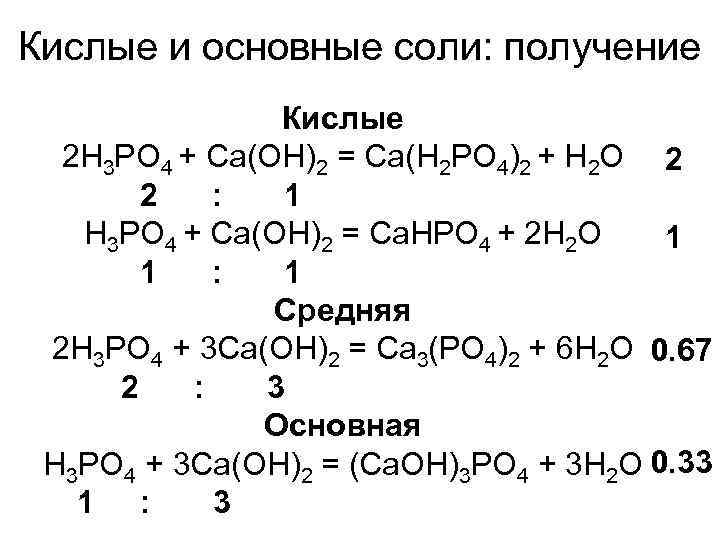 Кислые и основные соли: получение Кислые 2 H 3 PO 4 + Ca(OH)2 = Ca(H 2 PO 4)2 + H 2 O 2 2 : 1 H 3 PO 4 + Ca(OH)2 = Ca. HPO 4 + 2 H 2 O 1 1 : 1 Средняя 2 H 3 PO 4 + 3 Ca(OH)2 = Ca 3(PO 4)2 + 6 H 2 O 0. 67 2 : 3 Основная H 3 PO 4 + 3 Ca(OH)2 = (Ca. OH)3 PO 4 + 3 H 2 O 0. 33 1 : 3
Кислые и основные соли: получение Кислые 2 H 3 PO 4 + Ca(OH)2 = Ca(H 2 PO 4)2 + H 2 O 2 2 : 1 H 3 PO 4 + Ca(OH)2 = Ca. HPO 4 + 2 H 2 O 1 1 : 1 Средняя 2 H 3 PO 4 + 3 Ca(OH)2 = Ca 3(PO 4)2 + 6 H 2 O 0. 67 2 : 3 Основная H 3 PO 4 + 3 Ca(OH)2 = (Ca. OH)3 PO 4 + 3 H 2 O 0. 33 1 : 3























