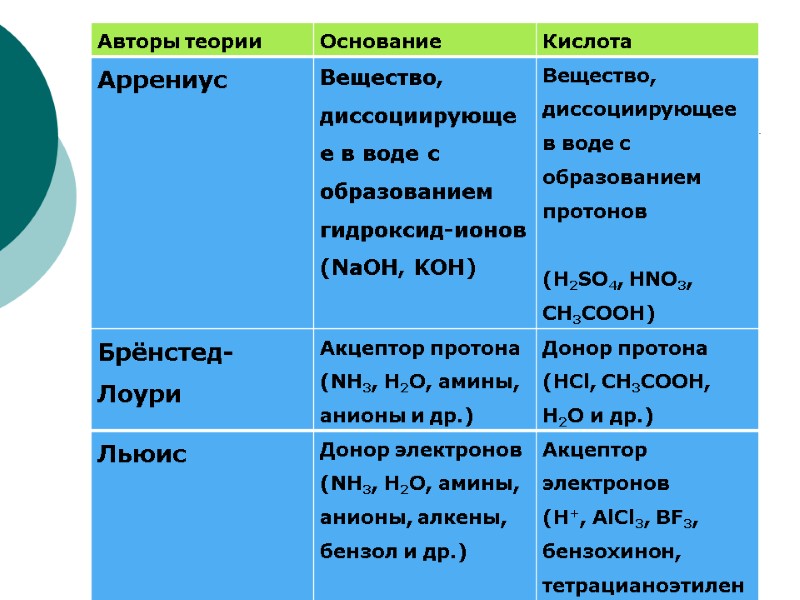
КИСЛОТНО-ОСНОВНЫЕ СВОЙСТВА ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ. Лекция № 4. Теория















9152-4_kisl_-osn_sv-va.ppt
- Количество слайдов: 60
 КИСЛОТНО-ОСНОВНЫЕ СВОЙСТВА ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ. Лекция № 4.
КИСЛОТНО-ОСНОВНЫЕ СВОЙСТВА ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ. Лекция № 4.

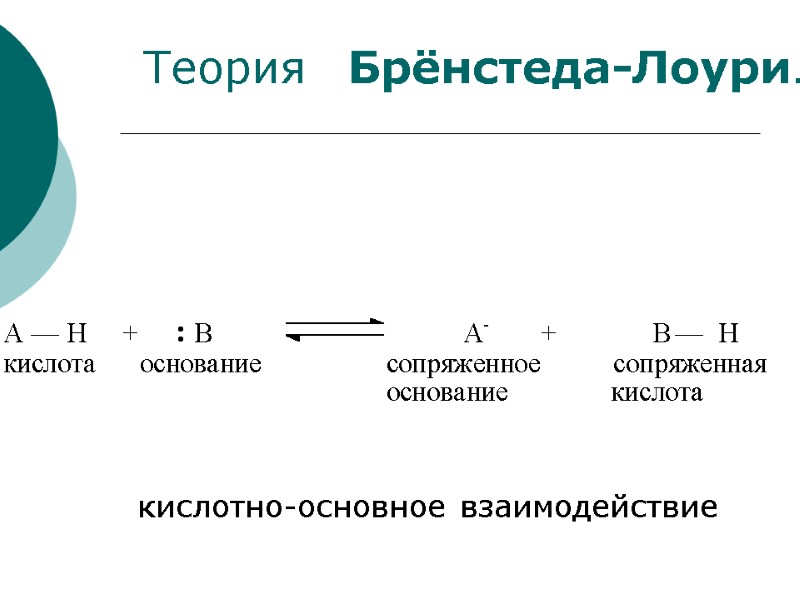
 Теория Брёнстеда-Лоури. кислотно-основное взаимодействие
Теория Брёнстеда-Лоури. кислотно-основное взаимодействие

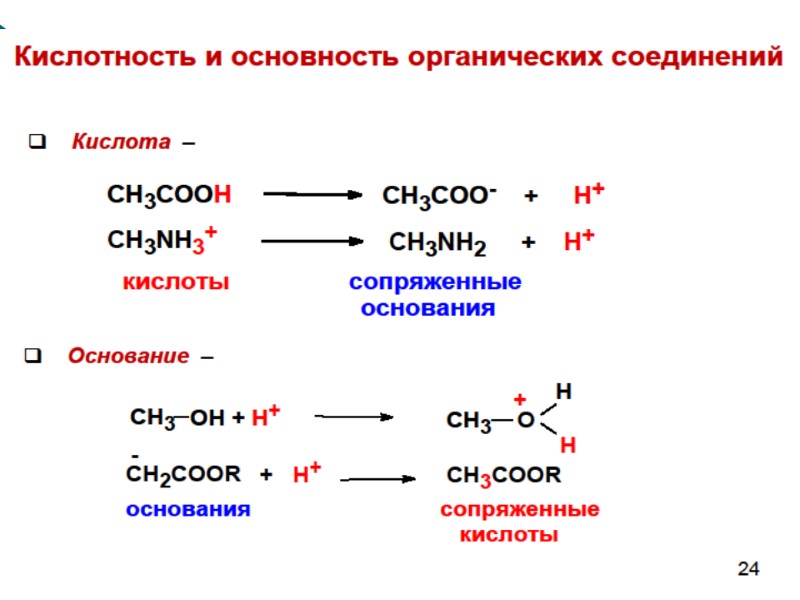
 Кислотность по Брёнстеду Органические кислоты классифицируют по природе кислотного центра: ОН-кислоты: спирты, фенолы, карбоновые кислоты, сульфокислоты, гидроксикислоты, аминокислоты; SH-кислоты: тиоспирты, SH-содержащие аминокислоты и др. соединения; NH-кислоты: амины, имины, гетероциклические соединения с атомом азота; СН-кислоты: углеводороды, радикалы гетерофункциональных соединений.
Кислотность по Брёнстеду Органические кислоты классифицируют по природе кислотного центра: ОН-кислоты: спирты, фенолы, карбоновые кислоты, сульфокислоты, гидроксикислоты, аминокислоты; SH-кислоты: тиоспирты, SH-содержащие аминокислоты и др. соединения; NH-кислоты: амины, имины, гетероциклические соединения с атомом азота; СН-кислоты: углеводороды, радикалы гетерофункциональных соединений.
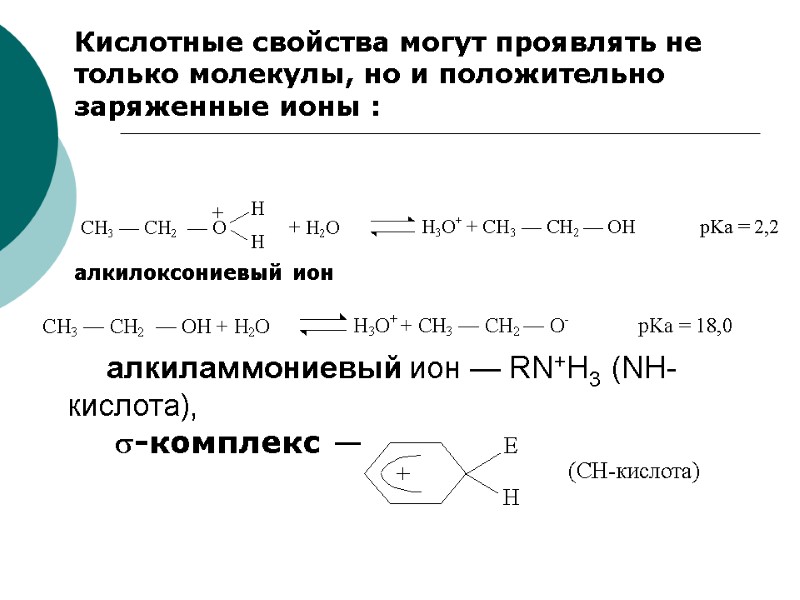
 алкилоксониевый ион Кислотные свойства могут проявлять не только молекулы, но и положительно заряженные ионы : алкиламмониевый ион — RN+H3 (NH-кислота), -комплекс —
алкилоксониевый ион Кислотные свойства могут проявлять не только молекулы, но и положительно заряженные ионы : алкиламмониевый ион — RN+H3 (NH-кислота), -комплекс —
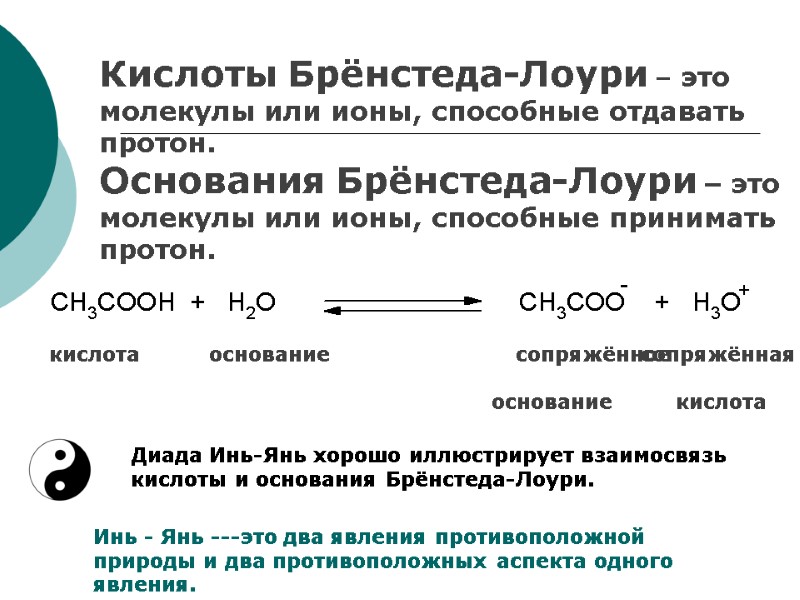
 Кислоты Брёнстеда-Лоури – это молекулы или ионы, способные отдавать протон. Основания Брёнстеда-Лоури – это молекулы или ионы, способные принимать протон. кислота основание сопряжённое основание кислота сопряжённая Диада Инь-Янь хорошо иллюстрирует взаимосвязь кислоты и основания Брёнстеда-Лоури. Инь - Янь ---это два явления противоположной природы и два противоположных аспекта одного явления.
Кислоты Брёнстеда-Лоури – это молекулы или ионы, способные отдавать протон. Основания Брёнстеда-Лоури – это молекулы или ионы, способные принимать протон. кислота основание сопряжённое основание кислота сопряжённая Диада Инь-Янь хорошо иллюстрирует взаимосвязь кислоты и основания Брёнстеда-Лоури. Инь - Янь ---это два явления противоположной природы и два противоположных аспекта одного явления.
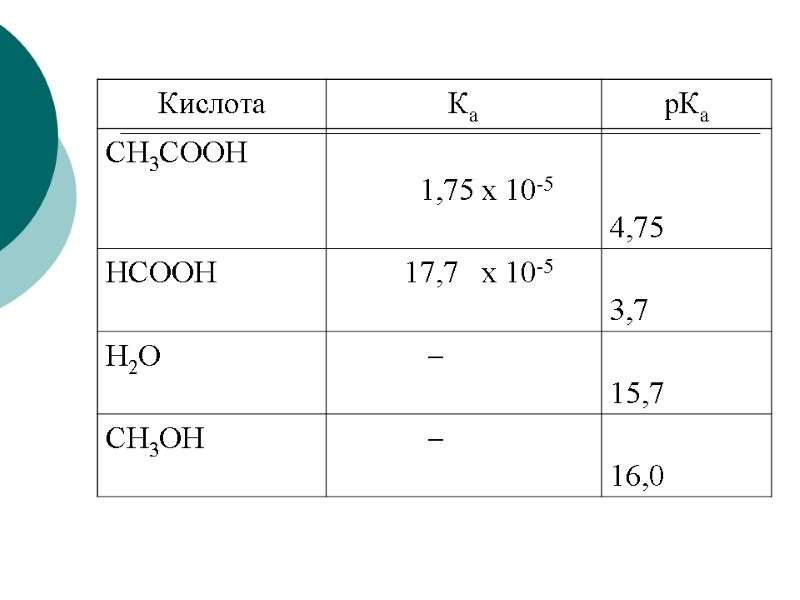
 СРАВНИТЕЛЬНАЯ ХАРАКТЕРИСТИКА КИСЛОТНЫХ СВОЙСТВ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ Ка – константа кислотности Константа равновесия (К) реакции переноса протона от кислоты к основанию в присутствии воды: pKa = - lg Ka. Чем меньше рКа, тем больше кислотность
СРАВНИТЕЛЬНАЯ ХАРАКТЕРИСТИКА КИСЛОТНЫХ СВОЙСТВ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ Ка – константа кислотности Константа равновесия (К) реакции переноса протона от кислоты к основанию в присутствии воды: pKa = - lg Ka. Чем меньше рКа, тем больше кислотность

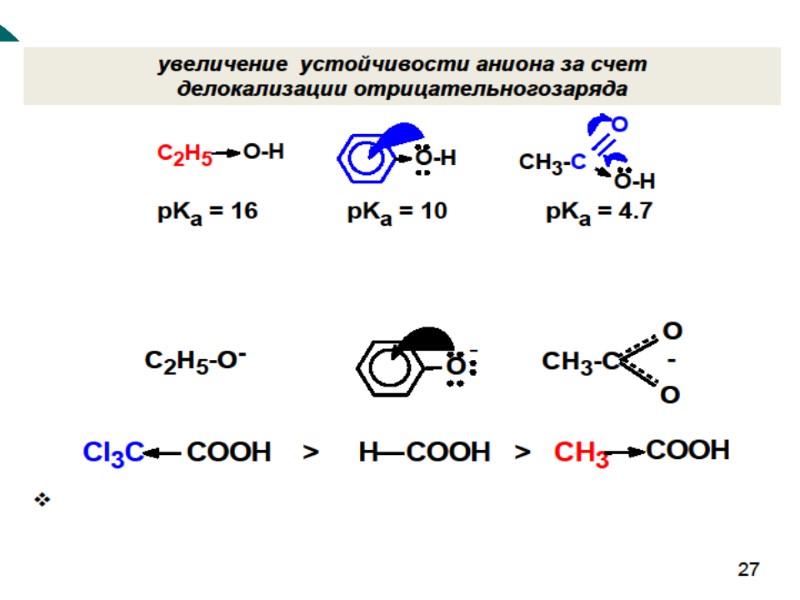
 Стабильность аниона определяется характером распределения отрицательного заряда аниона и зависит от ряда факторов: 1. природы атома в кислотном центре (электроотрицательности и поляризуемости элемента); характера связанного с кислотным центром органического радикала (электроноакцепторного или электронодонорного) 3. сольватационных эффектов. Качественной характеристикой кислотных свойств может служить стабильность образующегося аниона.
Стабильность аниона определяется характером распределения отрицательного заряда аниона и зависит от ряда факторов: 1. природы атома в кислотном центре (электроотрицательности и поляризуемости элемента); характера связанного с кислотным центром органического радикала (электроноакцепторного или электронодонорного) 3. сольватационных эффектов. Качественной характеристикой кислотных свойств может служить стабильность образующегося аниона.
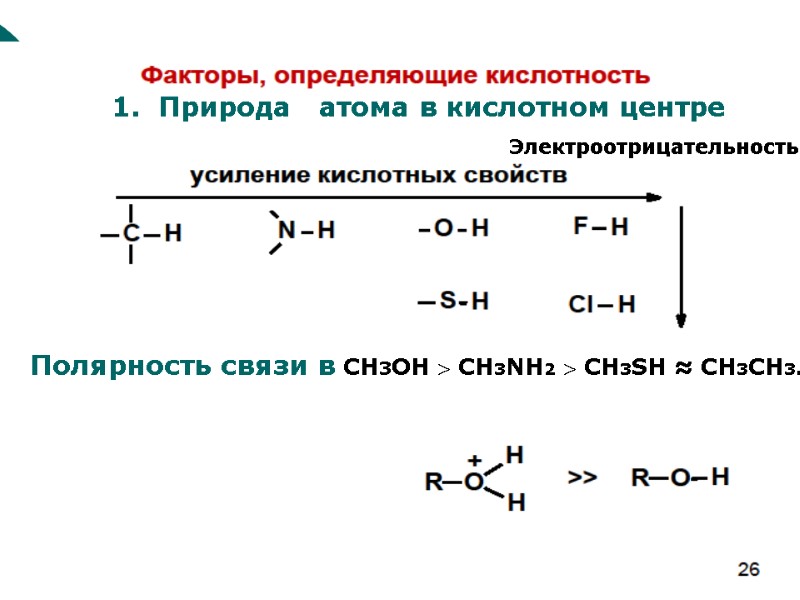
 1. Природа атома в кислотном центре Полярность связи в CH3OH CH3NH2 CH3SH ≈ СН3CH3. Электроотрицательность
1. Природа атома в кислотном центре Полярность связи в CH3OH CH3NH2 CH3SH ≈ СН3CH3. Электроотрицательность
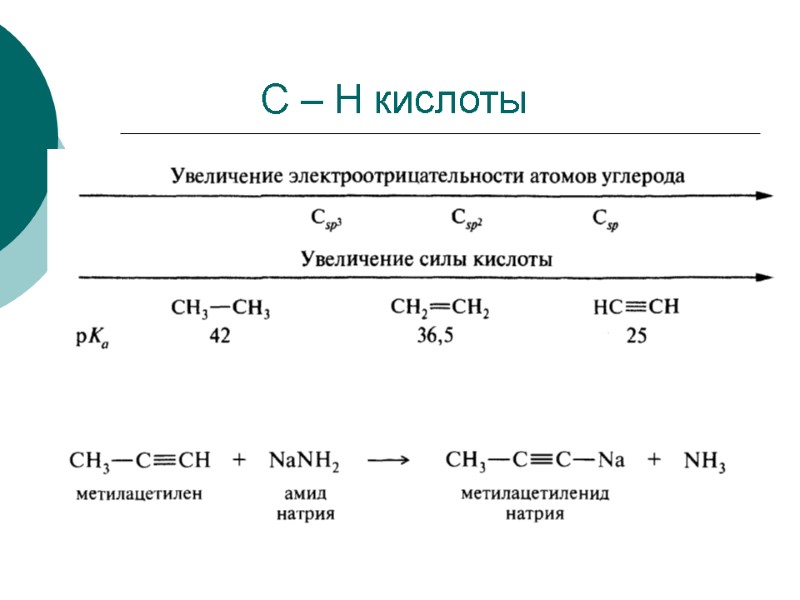
 С – Н кислоты
С – Н кислоты
 По группам При одинаковых радикалах кислотность уменьшается в ряду: SH >OH > NH > CH. (Поляризуемость)
По группам При одинаковых радикалах кислотность уменьшается в ряду: SH >OH > NH > CH. (Поляризуемость)
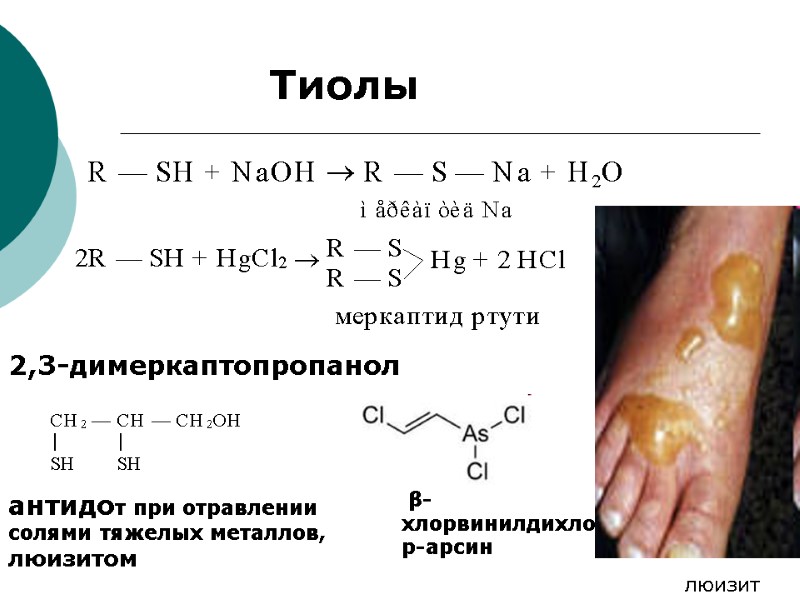
 Тиолы 2,3-димеркаптопропанол антидот при отравлении солями тяжелых металлов, люизитом β-хлорвинилдихлор-арсин люизит
Тиолы 2,3-димеркаптопропанол антидот при отравлении солями тяжелых металлов, люизитом β-хлорвинилдихлор-арсин люизит
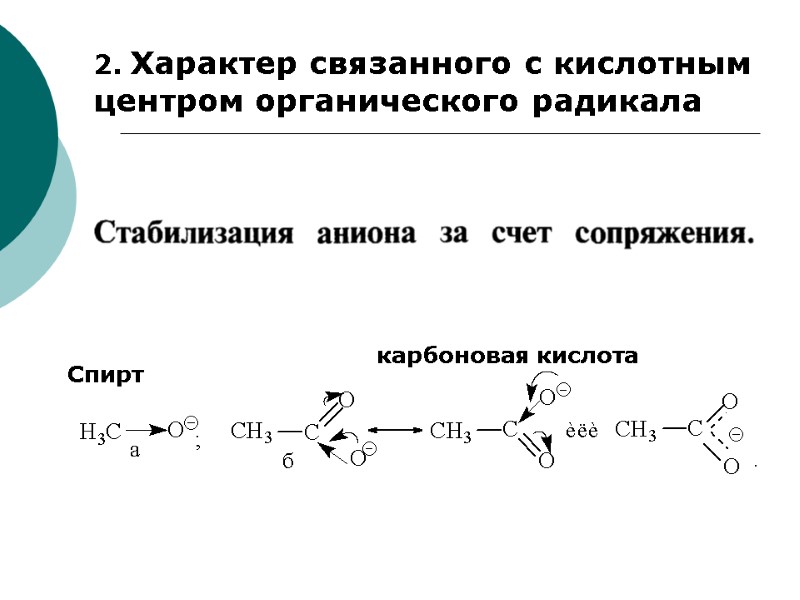
 2. Характер связанного с кислотным центром органического радикала Спирт карбоновая кислота
2. Характер связанного с кислотным центром органического радикала Спирт карбоновая кислота
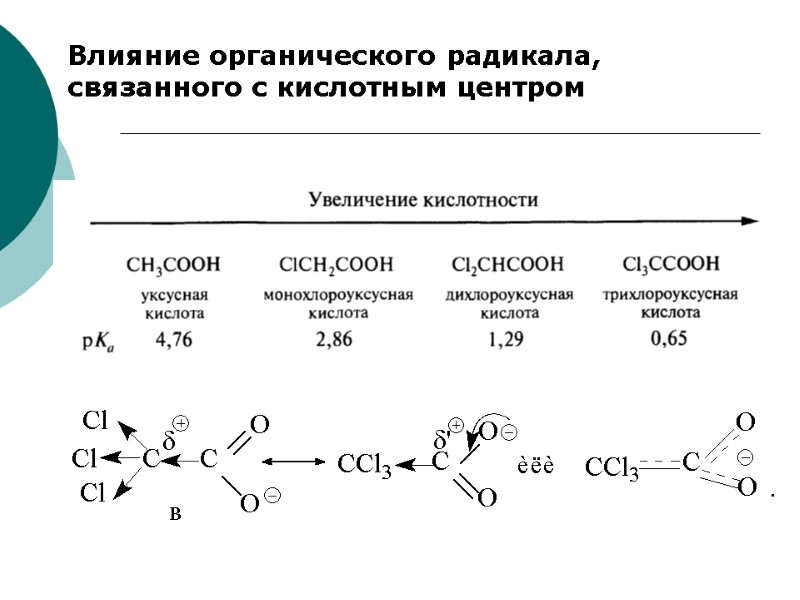
 Влияние органического радикала, связанного с кислотным центром
Влияние органического радикала, связанного с кислотным центром

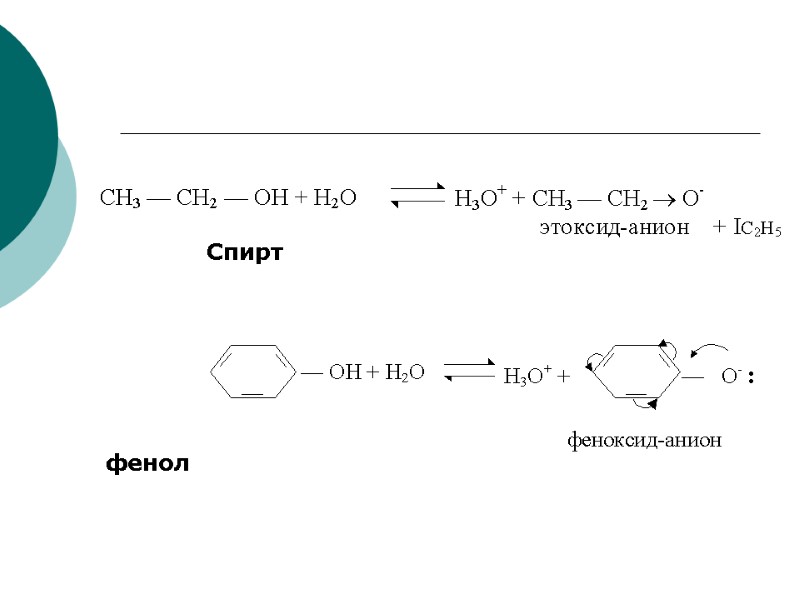
 Спирт фенол
Спирт фенол
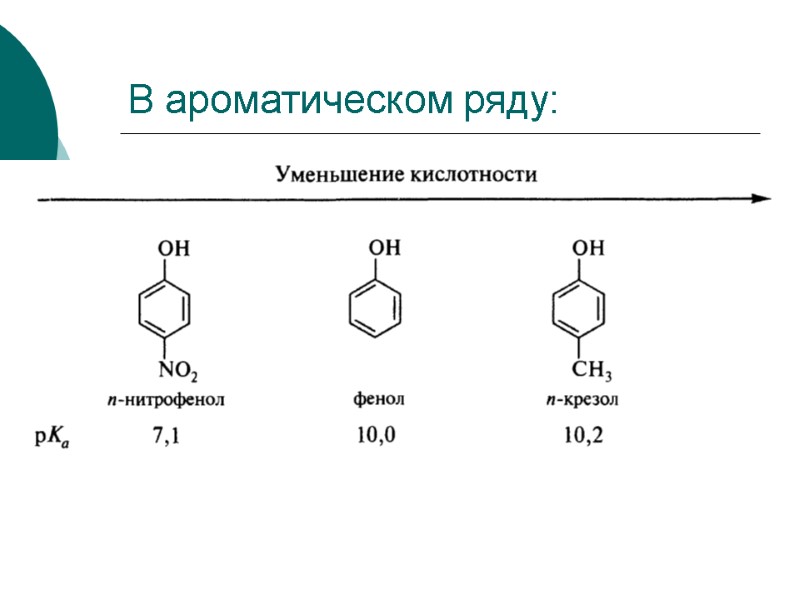
 В ароматическом ряду:
В ароматическом ряду:
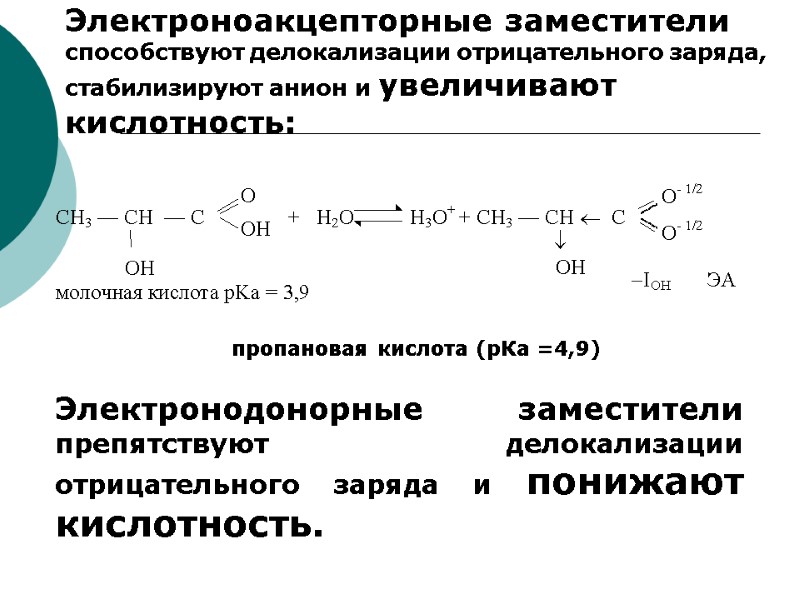
 Электроноакцепторные заместители способствуют делокализации отрицательного заряда, стабилизируют анион и увеличивают кислотность: пропановая кислота (рКа =4,9) Электронодонорные заместители препятствуют делокализации отрицательного заряда и понижают кислотность.
Электроноакцепторные заместители способствуют делокализации отрицательного заряда, стабилизируют анион и увеличивают кислотность: пропановая кислота (рКа =4,9) Электронодонорные заместители препятствуют делокализации отрицательного заряда и понижают кислотность.
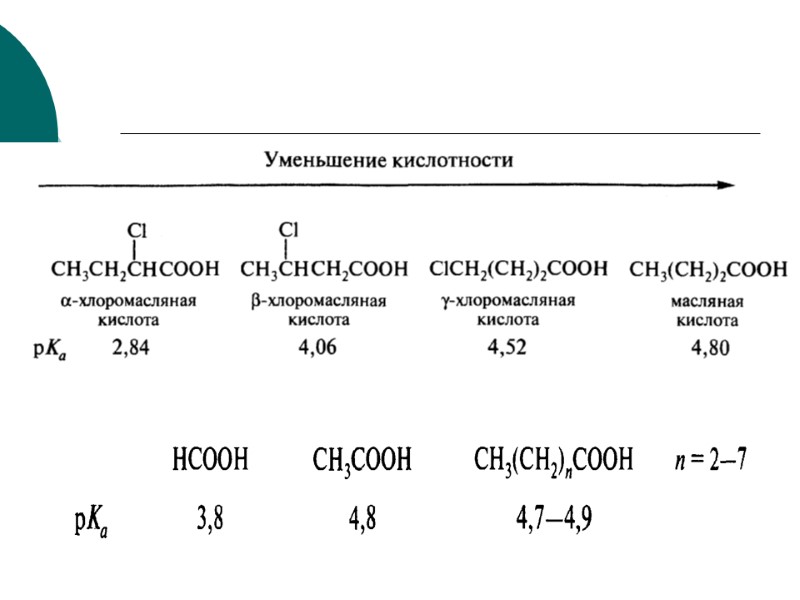
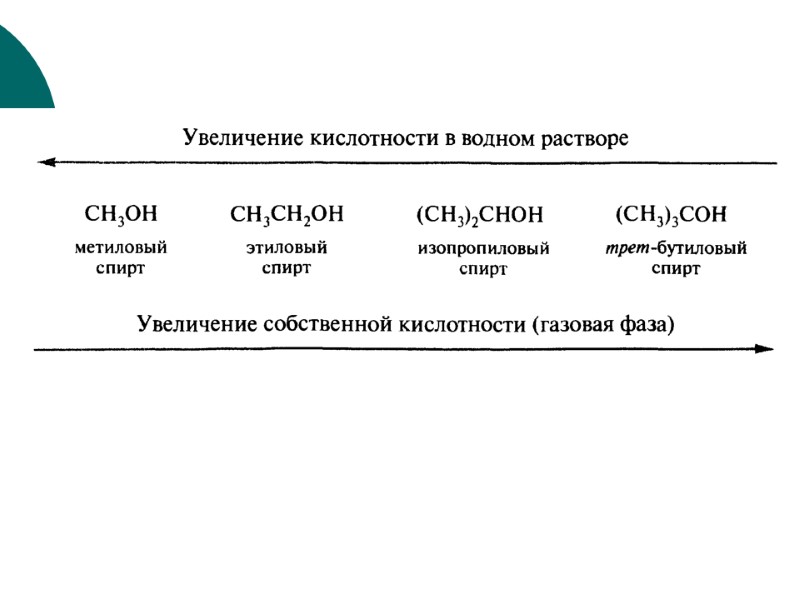
 3. Влияние растворителя. Эффект сольватации (гидратации). Как правило, лучше гидратируются небольшие по размеру ионы с низкой степенью делокализации заряда. с увеличением длины алифатического (гидрофобного) радикала кислотность уменьшается (лучшая гидратация небольших ионов)
3. Влияние растворителя. Эффект сольватации (гидратации). Как правило, лучше гидратируются небольшие по размеру ионы с низкой степенью делокализации заряда. с увеличением длины алифатического (гидрофобного) радикала кислотность уменьшается (лучшая гидратация небольших ионов)


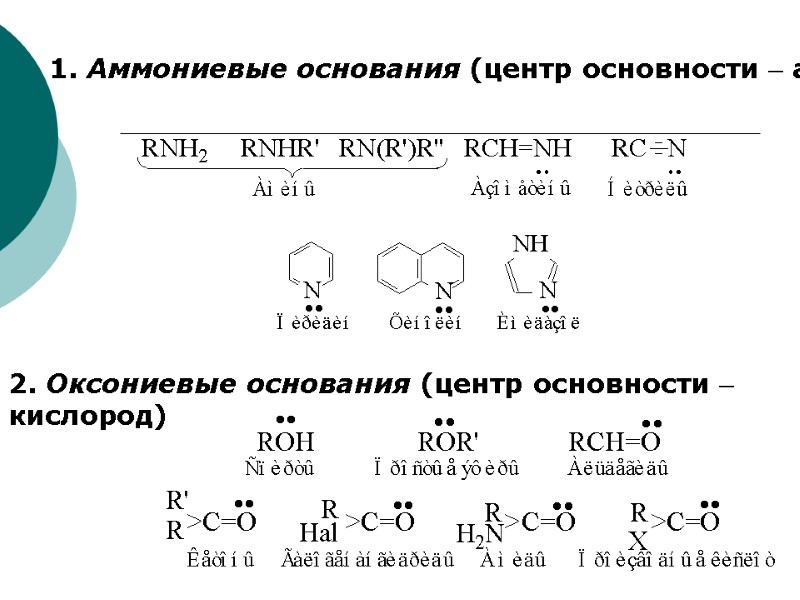
 Основность по Брёнстеду Органические основания, чтобы присоединить протон должны иметь либо неподелённую пару электронов у гетероатома , либо быть анионами. n-основания;
Основность по Брёнстеду Органические основания, чтобы присоединить протон должны иметь либо неподелённую пару электронов у гетероатома , либо быть анионами. n-основания;
 1. Аммониевые основания (центр основности азот) 2. Оксониевые основания (центр основности кислород)
1. Аммониевые основания (центр основности азот) 2. Оксониевые основания (центр основности кислород)
 3. Сульфониевые основания (центр основности сера) : Основность тем выше, чем выше концентрация отрицательного заряда на атоме, связывающемся с протоном.
3. Сульфониевые основания (центр основности сера) : Основность тем выше, чем выше концентрация отрицательного заряда на атоме, связывающемся с протоном.
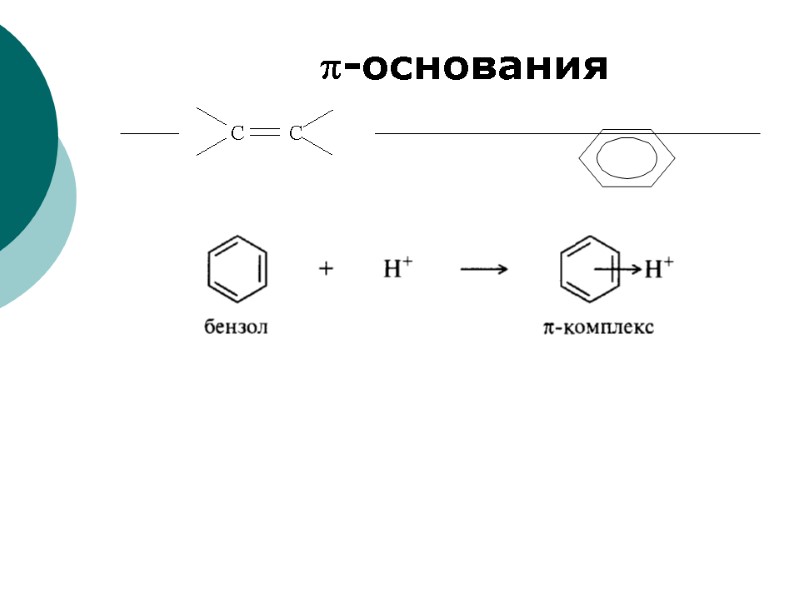
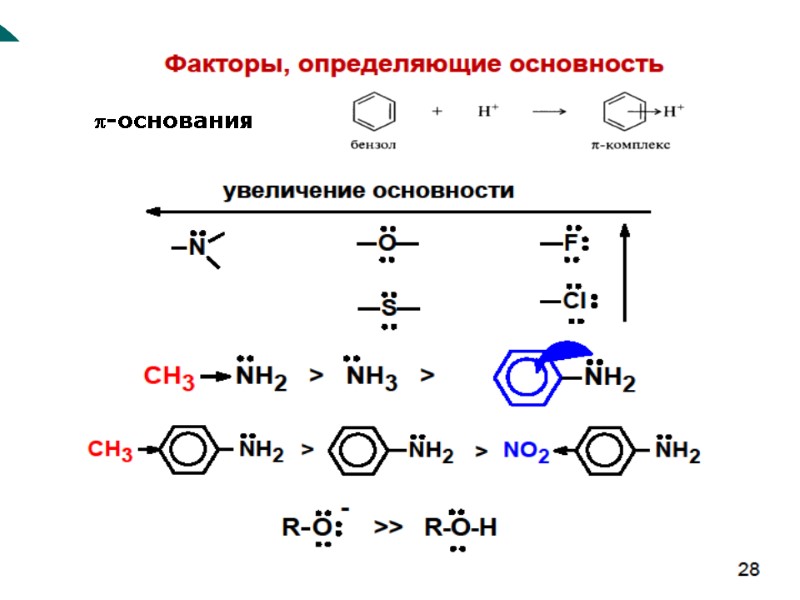
 -основания
-основания
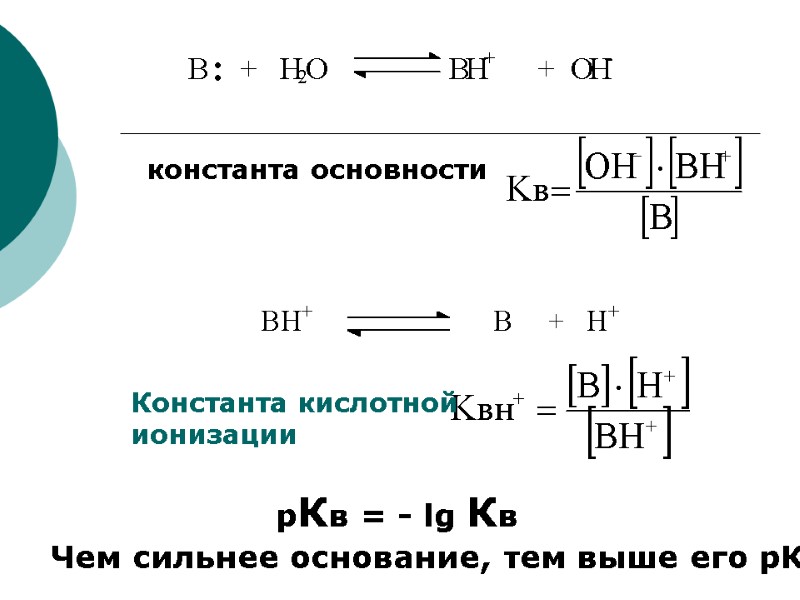
 Константа кислотной ионизации рКв = - lg Кв Чем сильнее основание, тем выше его рКвн+. константа основности
Константа кислотной ионизации рКв = - lg Кв Чем сильнее основание, тем выше его рКвн+. константа основности
 Сила n-оснований с одинаковыми радикалами уменьшается в ряду: N > O > S. В сульфониевых основаниях СН3 - S - СН3 электронная плотность атома серы рассредоточена в большем объёме (поляризуемость атома серы больше, чем кислорода), и плотность заряда значительно меньше.
Сила n-оснований с одинаковыми радикалами уменьшается в ряду: N > O > S. В сульфониевых основаниях СН3 - S - СН3 электронная плотность атома серы рассредоточена в большем объёме (поляризуемость атома серы больше, чем кислорода), и плотность заряда значительно меньше.
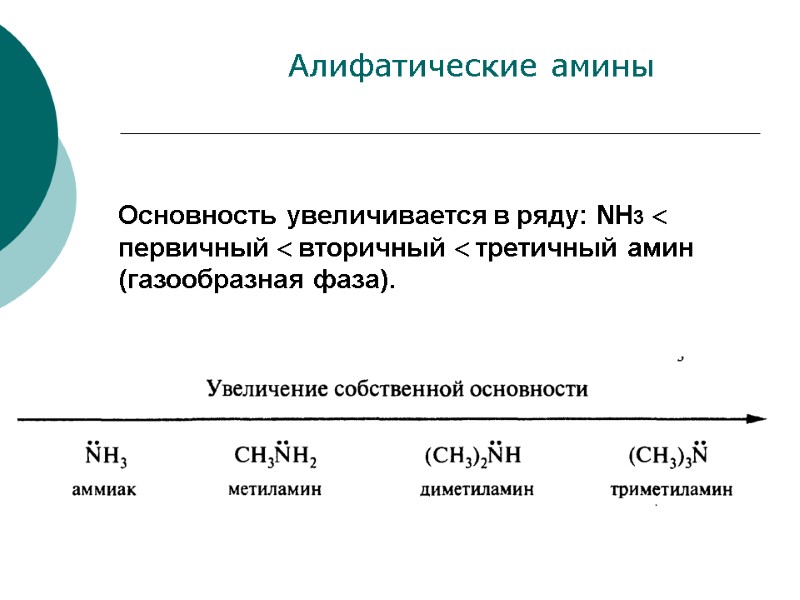
 Основность увеличивается в ряду: NH3 первичный вторичный третичный амин (газообразная фаза). Алифатические амины
Основность увеличивается в ряду: NH3 первичный вторичный третичный амин (газообразная фаза). Алифатические амины
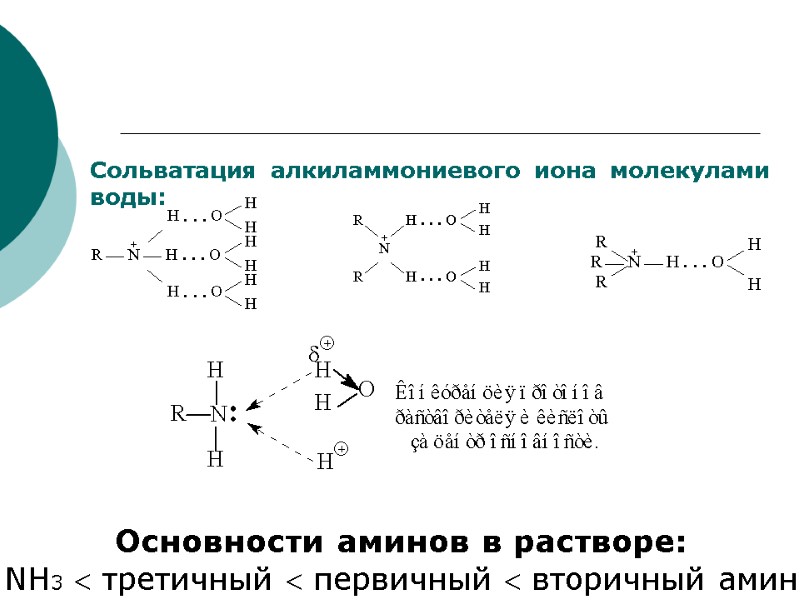
 Сольватация алкиламмониевого иона молекулами воды: Основности аминов в растворе: NH3 третичный первичный вторичный амин
Сольватация алкиламмониевого иона молекулами воды: Основности аминов в растворе: NH3 третичный первичный вторичный амин
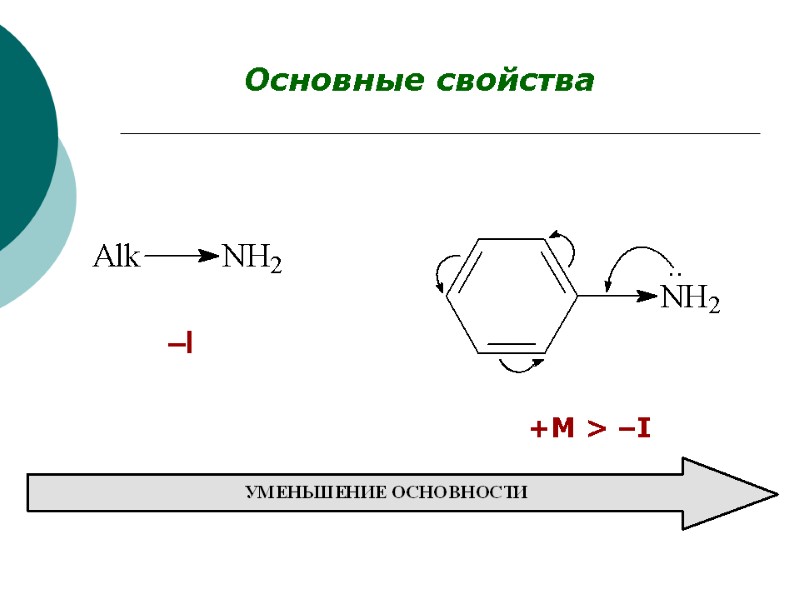
 Основные свойства –I +M > –I
Основные свойства –I +M > –I
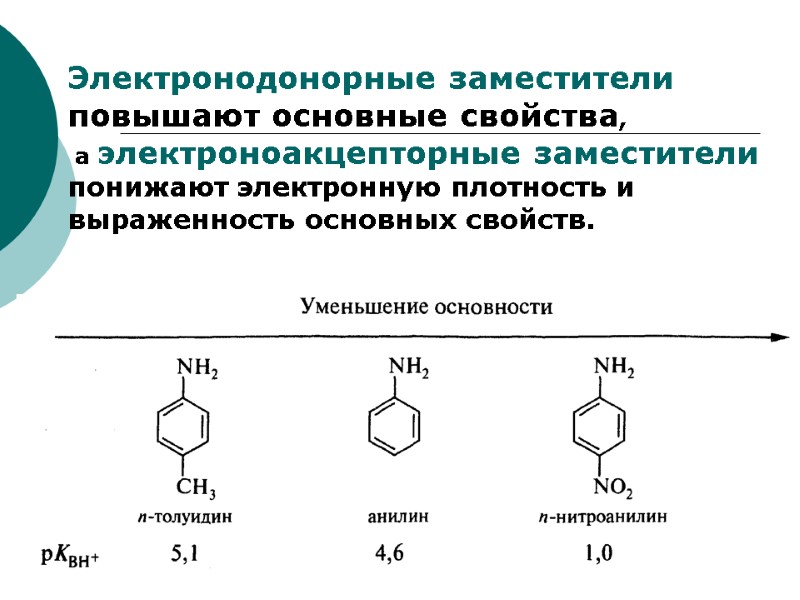
 Электронодонорные заместители повышают основные свойства, а электроноакцепторные заместители понижают электронную плотность и выраженность основных свойств.
Электронодонорные заместители повышают основные свойства, а электроноакцепторные заместители понижают электронную плотность и выраженность основных свойств.
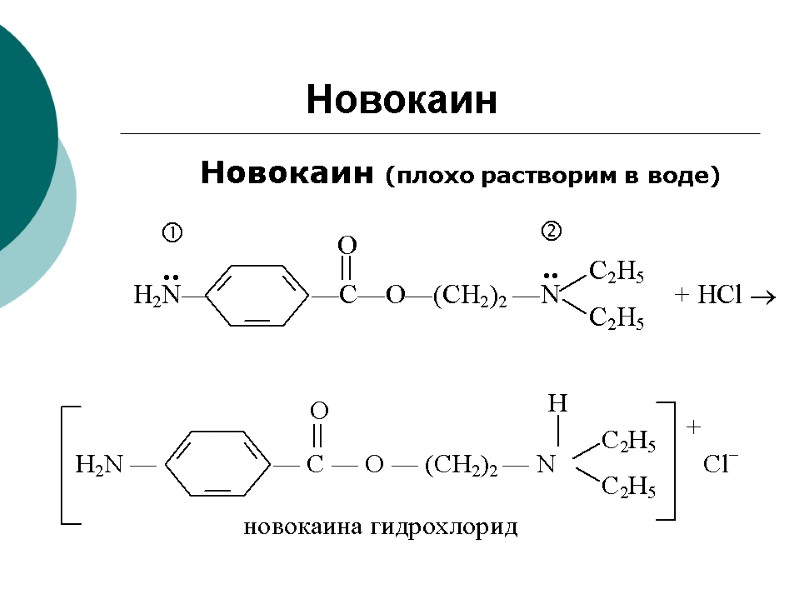
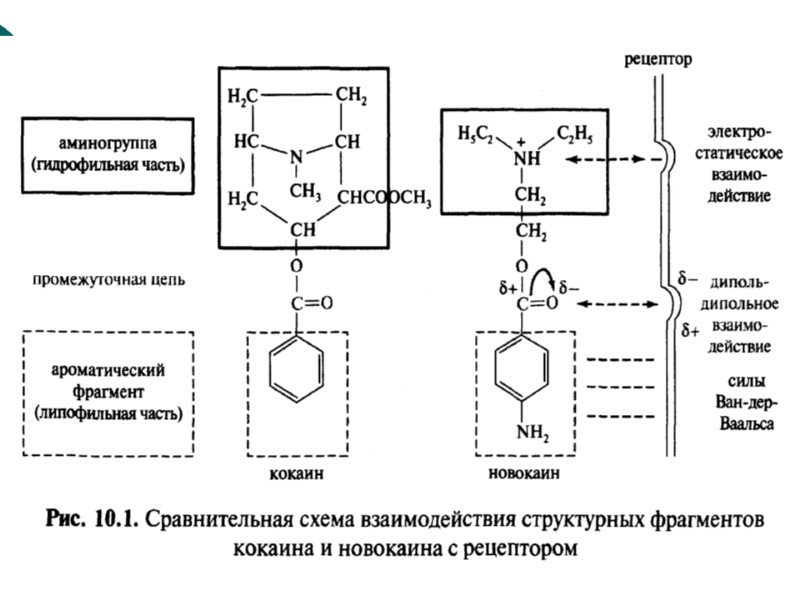
 Новокаин Новокаин (плохо растворим в воде)
Новокаин Новокаин (плохо растворим в воде)
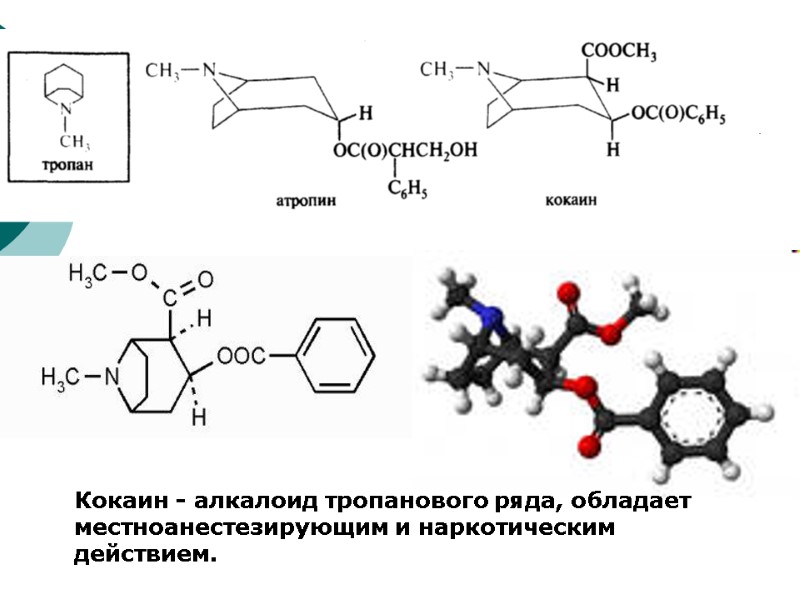
 Кокаин - алкалоид тропанового ряда, обладает местноанестезирующим и наркотическим действием.
Кокаин - алкалоид тропанового ряда, обладает местноанестезирующим и наркотическим действием.
 Кокаин Листья коки Eryhoxylum coca
Кокаин Листья коки Eryhoxylum coca

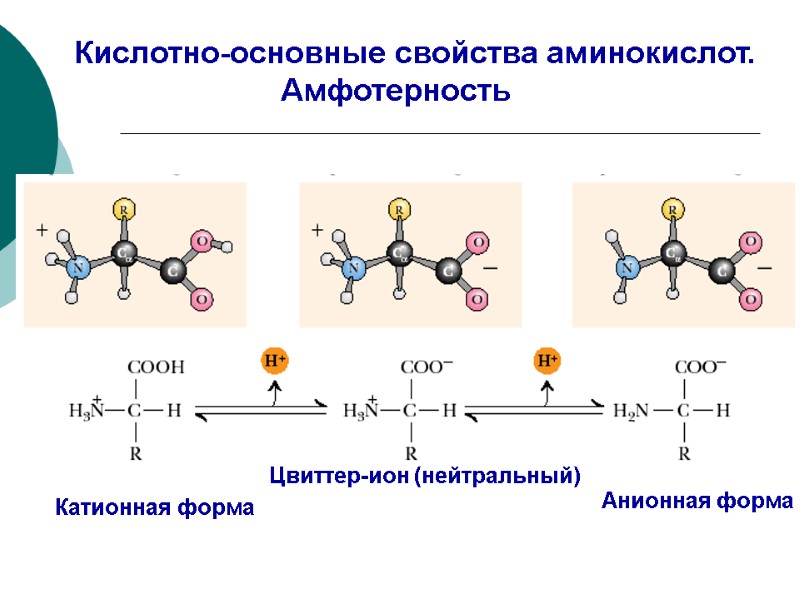
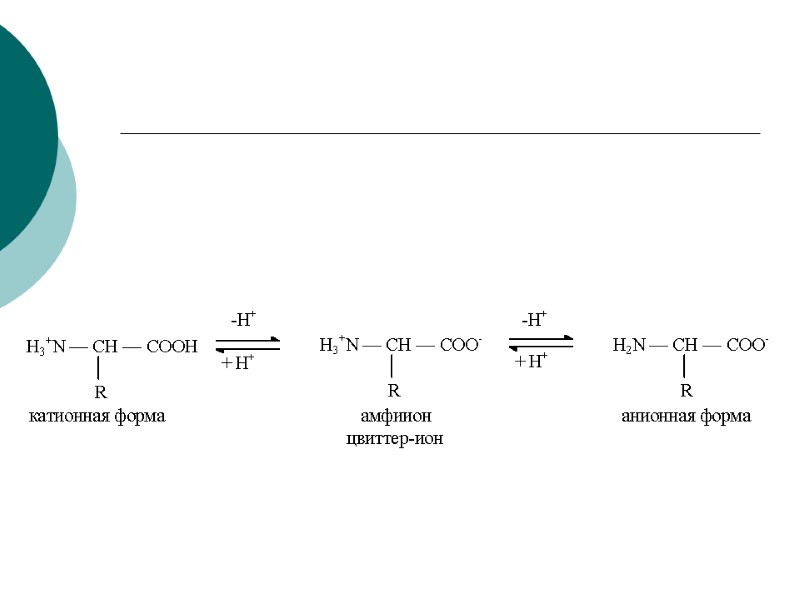
 Кислотно-основные свойства аминокислот. Амфотерность Катионная форма Цвиттер-ион (нейтральный) Анионная форма
Кислотно-основные свойства аминокислот. Амфотерность Катионная форма Цвиттер-ион (нейтральный) Анионная форма

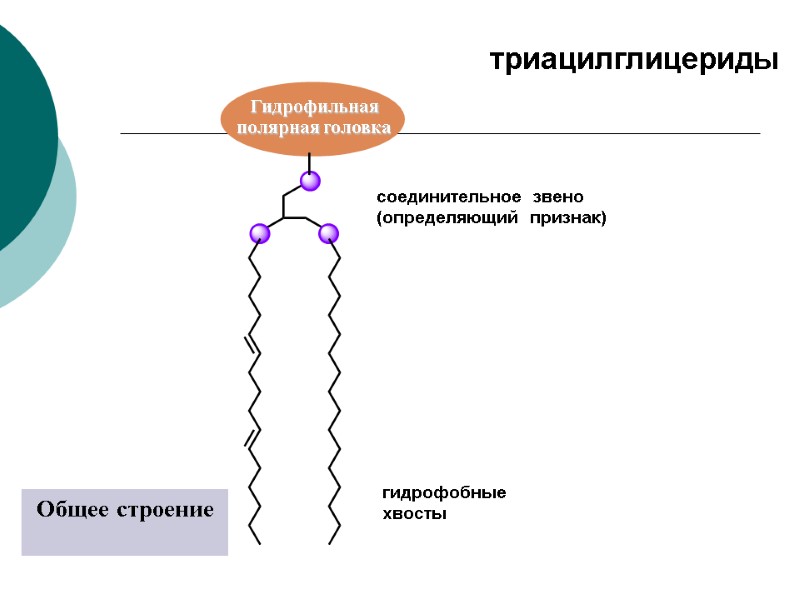
 соединительное звено (определяющий признак) гидрофобные хвосты Общее строение триацилглицериды
соединительное звено (определяющий признак) гидрофобные хвосты Общее строение триацилглицериды

 АМФОТЕРНЫЕ СВОЙСТВА СПИРТОВ Кислотные свойства убывают в ряду: первичный спирт > вторичный спирт > третичный спирт. Основные свойства в этом ряду возрастают, что обусловлено электронодонорными алифатическими радикалами. Многоатомные спирты являются более сильными кислотами, чем одноатомные
АМФОТЕРНЫЕ СВОЙСТВА СПИРТОВ Кислотные свойства убывают в ряду: первичный спирт > вторичный спирт > третичный спирт. Основные свойства в этом ряду возрастают, что обусловлено электронодонорными алифатическими радикалами. Многоатомные спирты являются более сильными кислотами, чем одноатомные
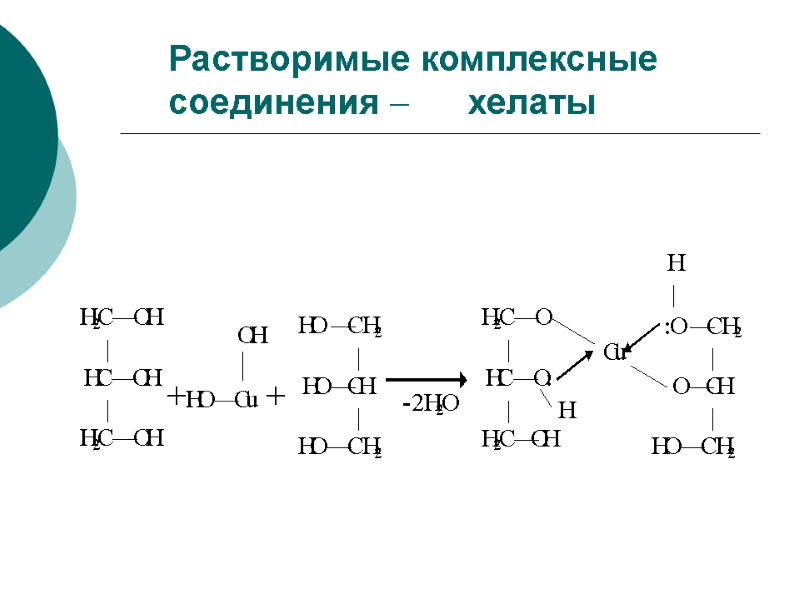
 Растворимые комплексные соединения хелаты
Растворимые комплексные соединения хелаты
 -основания
-основания
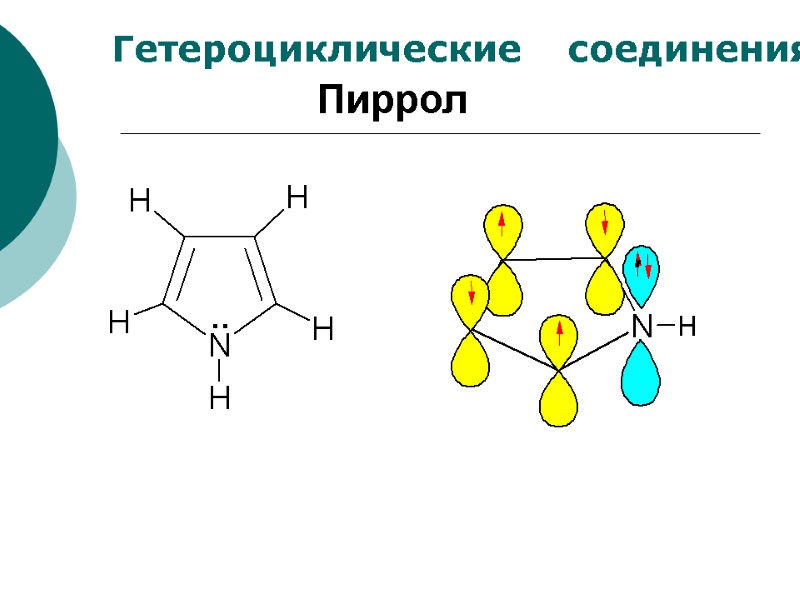
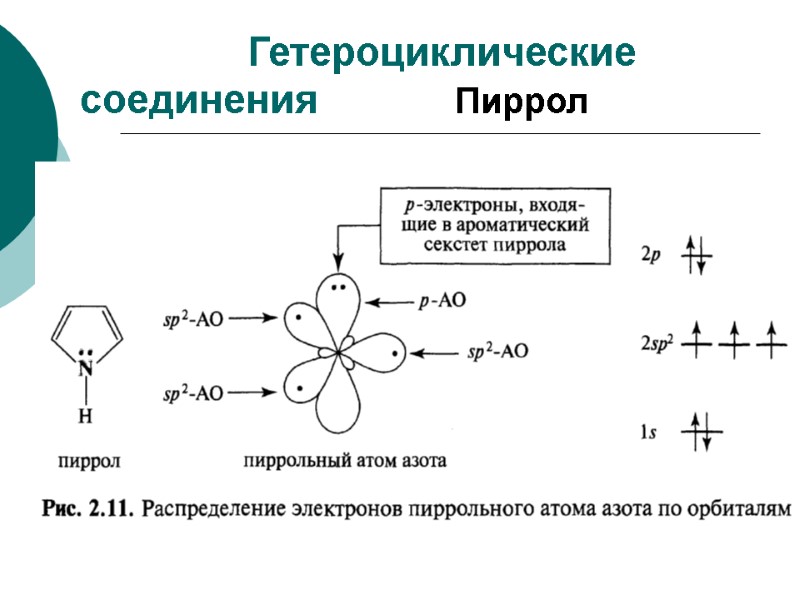
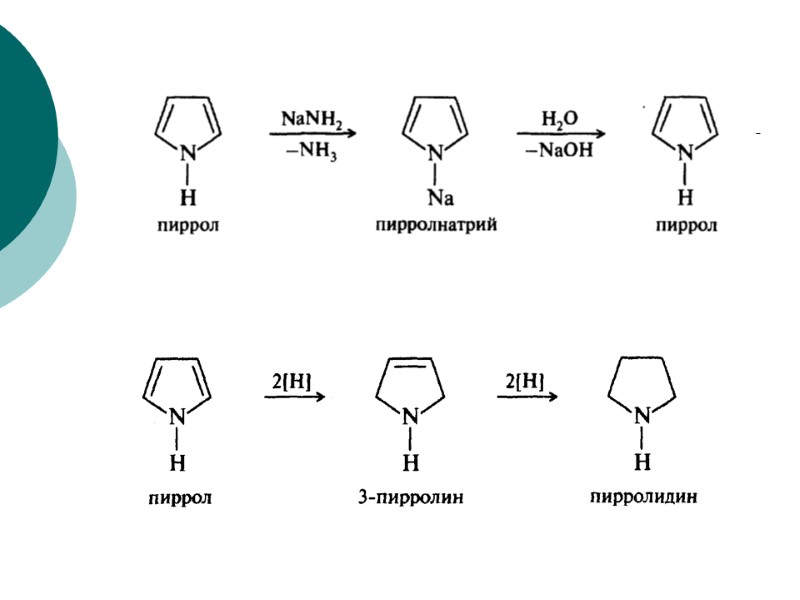
 Пиррол Гетероциклические соединения
Пиррол Гетероциклические соединения
 Гетероциклические соединения Пиррол
Гетероциклические соединения Пиррол

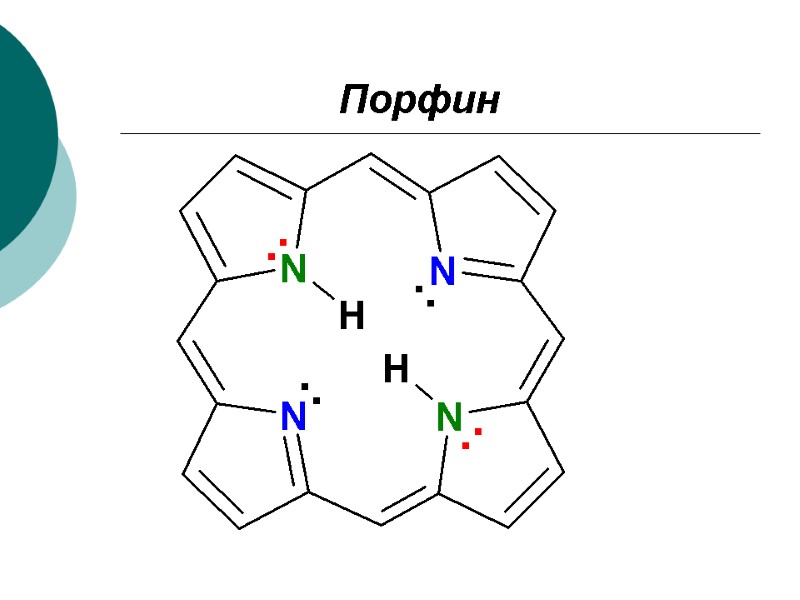
 Порфин
Порфин
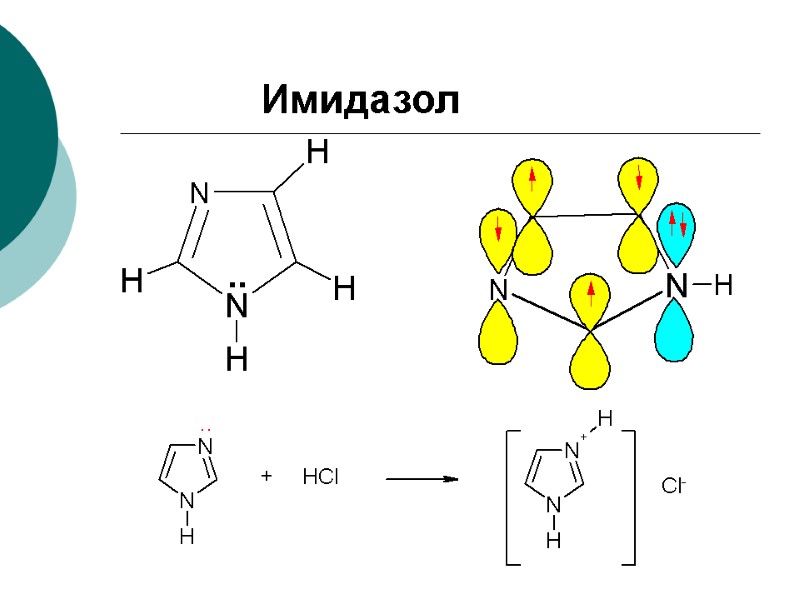
 Имидазол
Имидазол

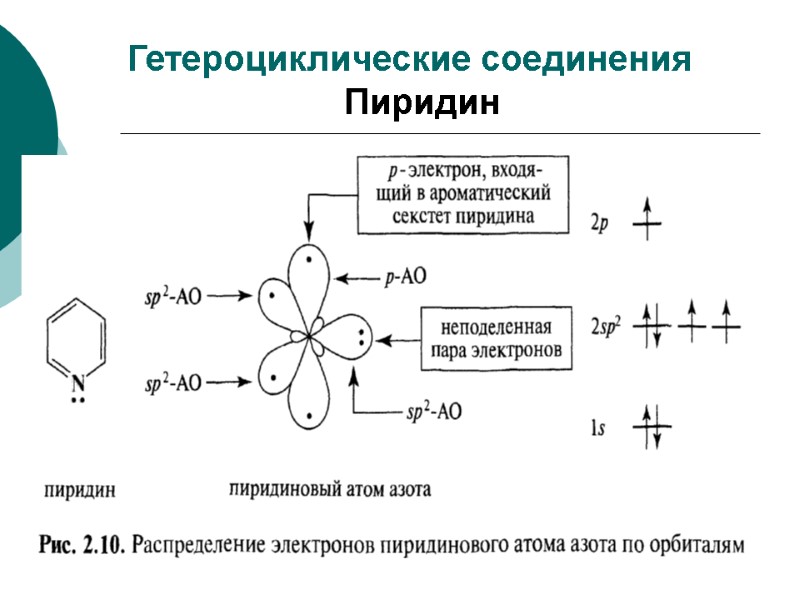
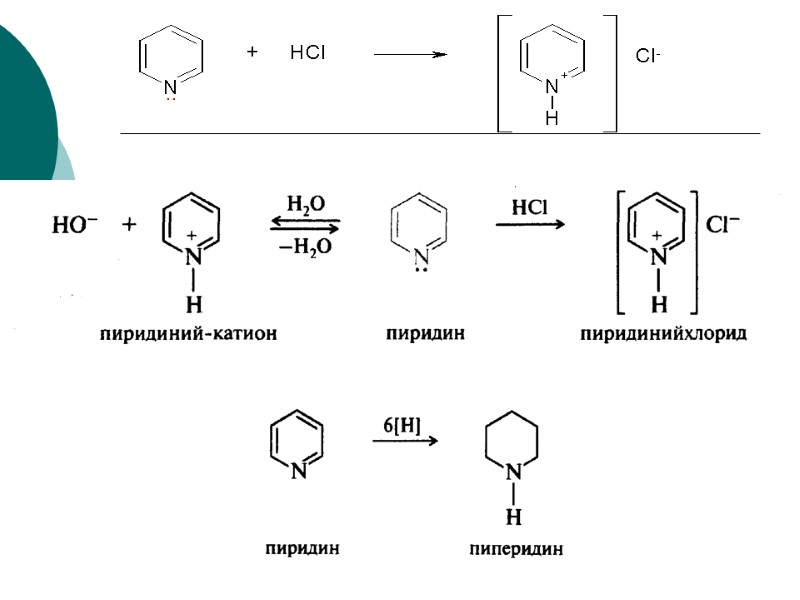
 Гетероциклические соединения Пиридин
Гетероциклические соединения Пиридин
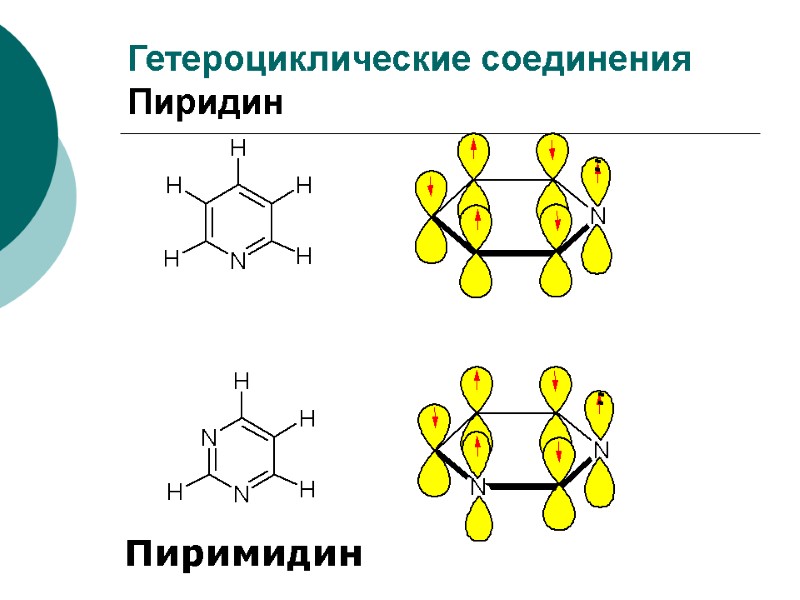
 Гетероциклические соединения Пиридин Пиримидин
Гетероциклические соединения Пиридин Пиримидин

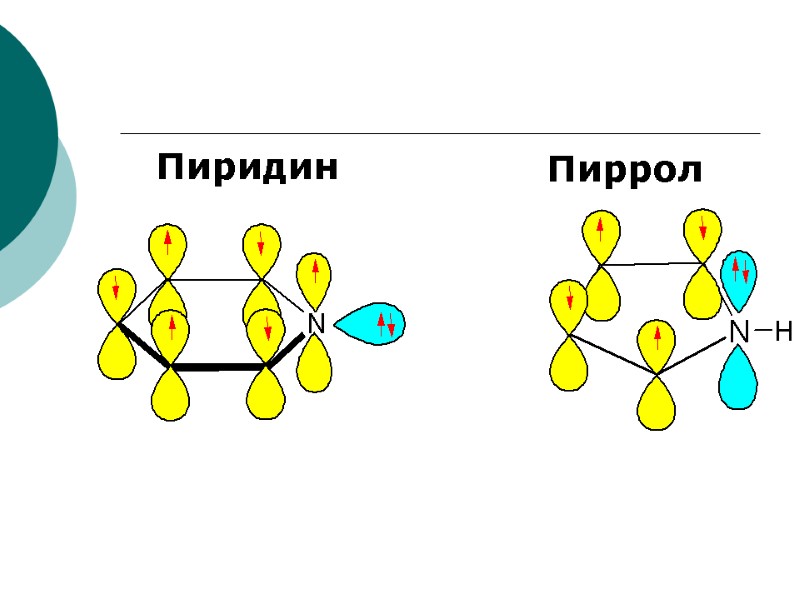
 Пиридин Пиррол
Пиридин Пиррол
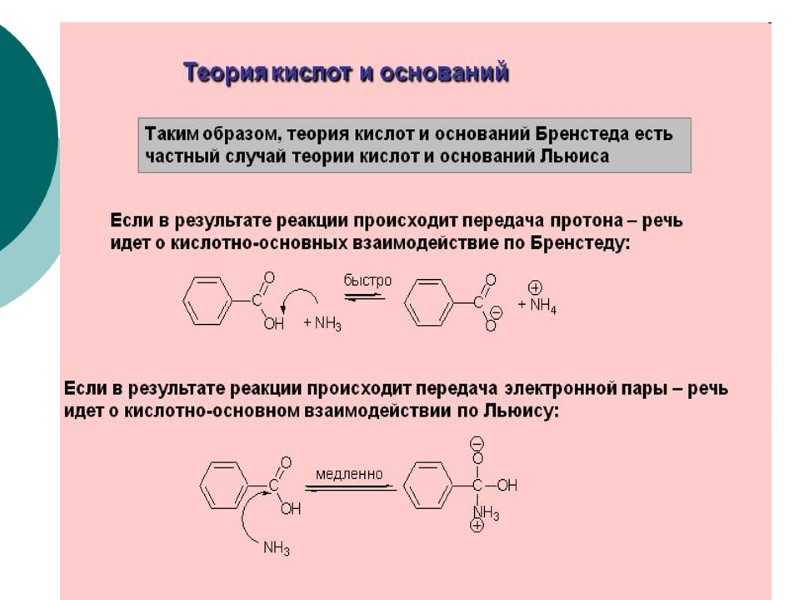
 Кислотами являются соединения, способные принимать электронную пару с образованием связи, а основаниями соединения, способные отдавать электронную пару с образованием связи. кислота это акцептор электронов, основание это донор электронной пары. Теория Льюиса
Кислотами являются соединения, способные принимать электронную пару с образованием связи, а основаниями соединения, способные отдавать электронную пару с образованием связи. кислота это акцептор электронов, основание это донор электронной пары. Теория Льюиса
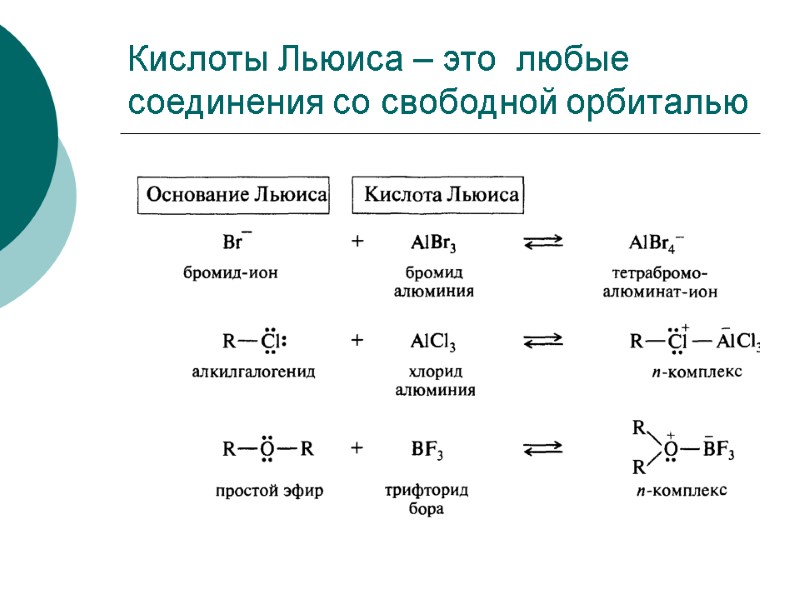
 Кислоты Льюиса – это любые соединения со свободной орбиталью
Кислоты Льюиса – это любые соединения со свободной орбиталью
 Теория Льюиса
Теория Льюиса



