FeSSal_Moland_&_Co.pptx
- Количество слайдов: 24
 КИЇВСЬКИЙ НАЦІОНАЛЬНИЙ УНІВЕРСИТЕТ ІМЕНІ ТАРАСА ШЕВЧЕНКА КАФЕДРА АНАЛІТИЧНОЇ ХІМІЇ Попередні дослідження в системі Ферум(ІІІ) – сульфосаліцилова кислота Виконали: студенти групи ХАМАЛ І курсу ОКР магістр 2012 р
КИЇВСЬКИЙ НАЦІОНАЛЬНИЙ УНІВЕРСИТЕТ ІМЕНІ ТАРАСА ШЕВЧЕНКА КАФЕДРА АНАЛІТИЧНОЇ ХІМІЇ Попередні дослідження в системі Ферум(ІІІ) – сульфосаліцилова кислота Виконали: студенти групи ХАМАЛ І курсу ОКР магістр 2012 р
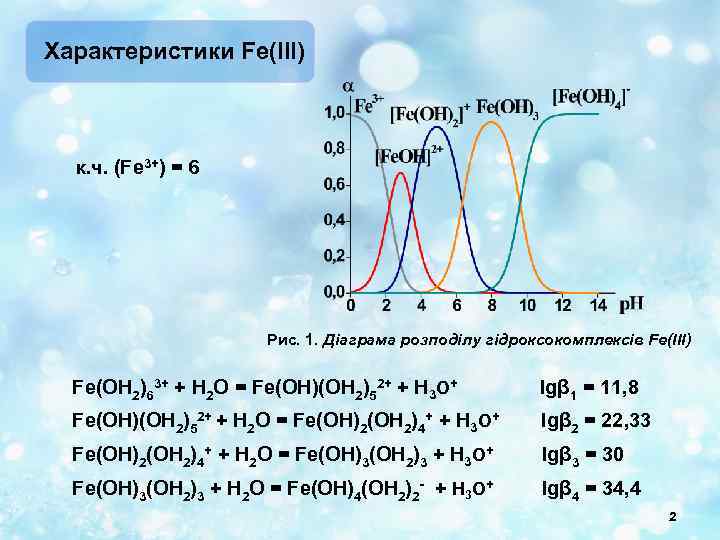 Характеристики Fe(ІІІ) к. ч. (Fe 3+) = 6 Рис. 1. Діаграма розподілу гідроксокомплексів Fe(ІІІ) Fe(OH 2)63+ + H 2 O = Fe(OH)(OH 2)52+ + H 3 O+ lgβ 1 = 11, 8 Fe(OH)(OH 2)52+ + H 2 O = Fe(OH)2(OH 2)4+ + H 3 O+ lgβ 2 = 22, 33 Fe(OH)2(OH 2)4+ + H 2 O = Fe(OH)3(OH 2)3 + H 3 O+ lgβ 3 = 30 Fe(OH)3(OH 2)3 + H 2 O = Fe(OH)4(OH 2)2 - + H 3 O+ lgβ 4 = 34, 4 2
Характеристики Fe(ІІІ) к. ч. (Fe 3+) = 6 Рис. 1. Діаграма розподілу гідроксокомплексів Fe(ІІІ) Fe(OH 2)63+ + H 2 O = Fe(OH)(OH 2)52+ + H 3 O+ lgβ 1 = 11, 8 Fe(OH)(OH 2)52+ + H 2 O = Fe(OH)2(OH 2)4+ + H 3 O+ lgβ 2 = 22, 33 Fe(OH)2(OH 2)4+ + H 2 O = Fe(OH)3(OH 2)3 + H 3 O+ lgβ 3 = 30 Fe(OH)3(OH 2)3 + H 2 O = Fe(OH)4(OH 2)2 - + H 3 O+ lgβ 4 = 34, 4 2
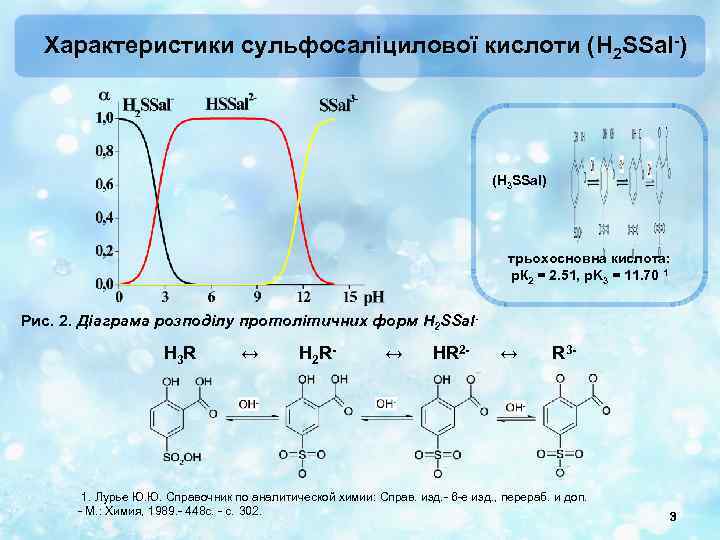 Характеристики сульфосаліцилової кислоти (H 2 SSal-) (H 3 SSal) трьохосновна кислота: р. К 2 = 2. 51, p. K 3 = 11. 70 1 Рис. 2. Діаграма розподілу протолітичних форм H 2 SSal- H 3 R ↔ H 2 R- ↔ HR 2 - ↔ R 3 - 1. Лурье Ю. Ю. Справочник по аналитической химии: Справ. изд. - 6 -е изд. , перераб. и доп. - М. : Химия, 1989. - 448 с. - с. 302. 3
Характеристики сульфосаліцилової кислоти (H 2 SSal-) (H 3 SSal) трьохосновна кислота: р. К 2 = 2. 51, p. K 3 = 11. 70 1 Рис. 2. Діаграма розподілу протолітичних форм H 2 SSal- H 3 R ↔ H 2 R- ↔ HR 2 - ↔ R 3 - 1. Лурье Ю. Ю. Справочник по аналитической химии: Справ. изд. - 6 -е изд. , перераб. и доп. - М. : Химия, 1989. - 448 с. - с. 302. 3
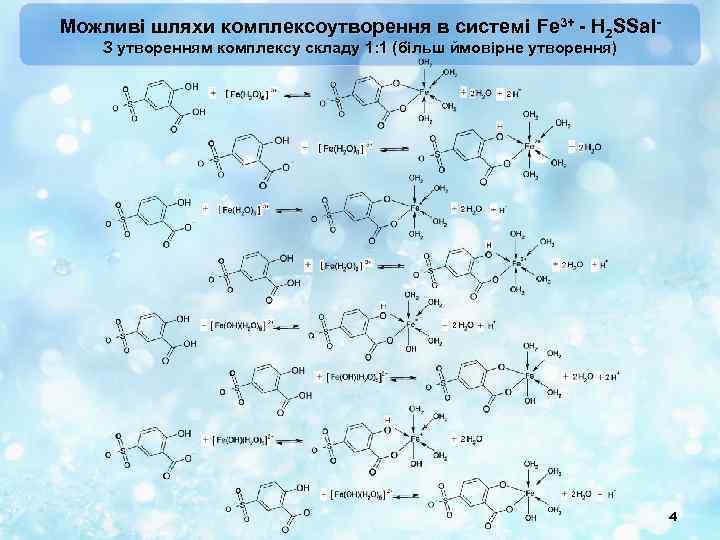 Можливі шляхи комплексоутворення в системі Fe 3+ - H 2 SSal. З утворенням комплексу складу 1: 1 (більш ймовірне утворення) 4
Можливі шляхи комплексоутворення в системі Fe 3+ - H 2 SSal. З утворенням комплексу складу 1: 1 (більш ймовірне утворення) 4
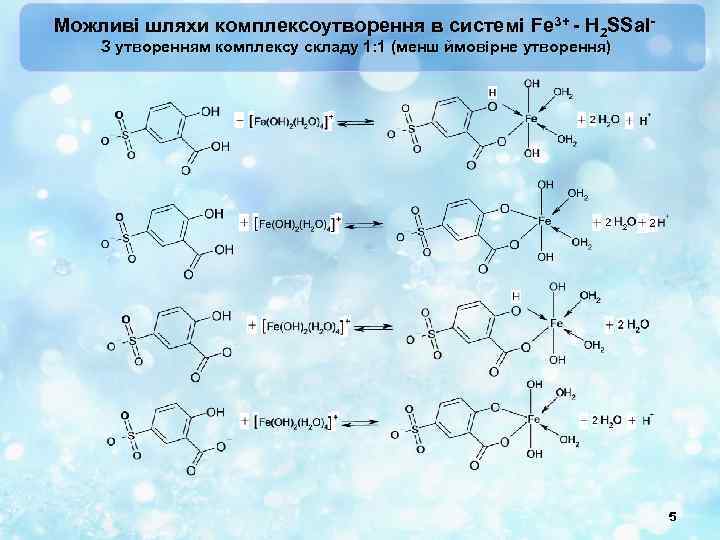 Можливі шляхи комплексоутворення в системі Fe 3+ - H 2 SSal. З утворенням комплексу складу 1: 1 (менш ймовірне утворення) 5
Можливі шляхи комплексоутворення в системі Fe 3+ - H 2 SSal. З утворенням комплексу складу 1: 1 (менш ймовірне утворення) 5
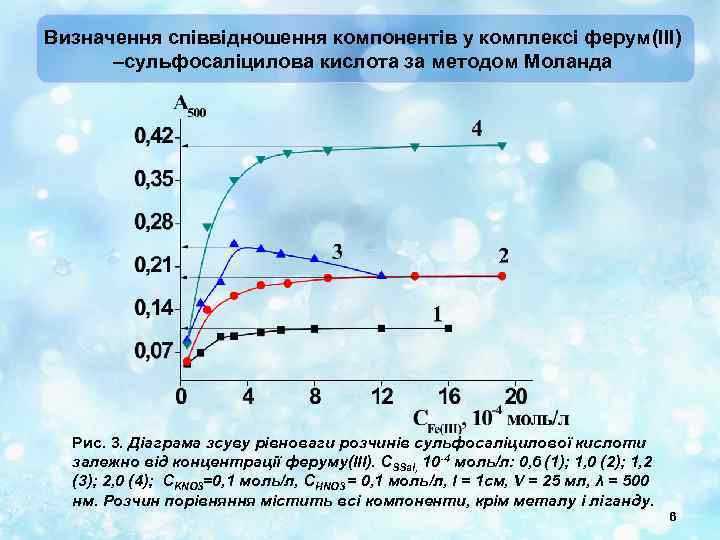 Визначення співвідношення компонентів у комплексі ферум(III) –сульфосаліцилова кислота за методом Моланда Рис. 3. Діаграма зсуву рівноваги розчинів сульфосаліцилової кислоти залежно від концентрації феруму(ІІІ). СSSal, 10 -4 моль/л: 0, 6 (1); 1, 0 (2); 1, 2 (3); 2, 0 (4); СKNO 3=0, 1 моль/л, СНNO 3 = 0, 1 моль/л, l = 1 см, V = 25 мл, λ = 500 нм. Розчин порівняння містить всі компоненти, крім металу і ліганду. 6
Визначення співвідношення компонентів у комплексі ферум(III) –сульфосаліцилова кислота за методом Моланда Рис. 3. Діаграма зсуву рівноваги розчинів сульфосаліцилової кислоти залежно від концентрації феруму(ІІІ). СSSal, 10 -4 моль/л: 0, 6 (1); 1, 0 (2); 1, 2 (3); 2, 0 (4); СKNO 3=0, 1 моль/л, СНNO 3 = 0, 1 моль/л, l = 1 см, V = 25 мл, λ = 500 нм. Розчин порівняння містить всі компоненти, крім металу і ліганду. 6
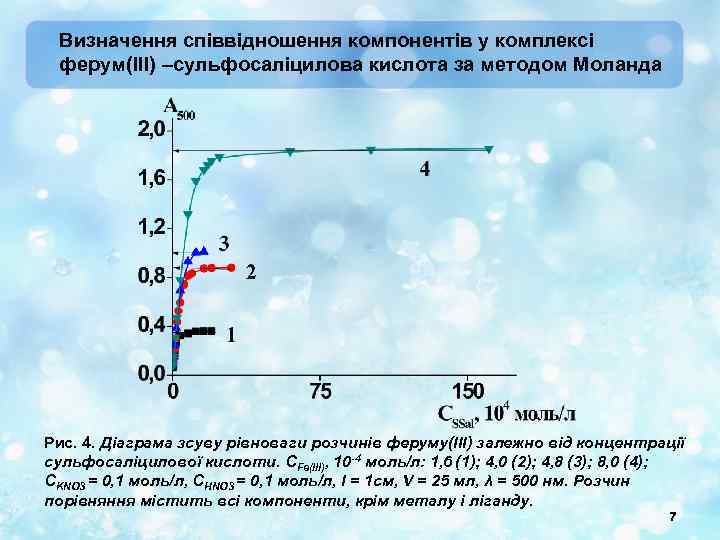 Визначення співвідношення компонентів у комплексі ферум(III) –сульфосаліцилова кислота за методом Моланда Рис. 4. Діаграма зсуву рівноваги розчинів феруму(ІІІ) залежно від концентрації сульфосаліцилової кислоти. СFe(III), 10 -4 моль/л: 1, 6 (1); 4, 0 (2); 4, 8 (3); 8, 0 (4); СKNO 3 = 0, 1 моль/л, СНNO 3 = 0, 1 моль/л, l = 1 см, V = 25 мл, λ = 500 нм. Розчин порівняння містить всі компоненти, крім металу і ліганду. 7
Визначення співвідношення компонентів у комплексі ферум(III) –сульфосаліцилова кислота за методом Моланда Рис. 4. Діаграма зсуву рівноваги розчинів феруму(ІІІ) залежно від концентрації сульфосаліцилової кислоти. СFe(III), 10 -4 моль/л: 1, 6 (1); 4, 0 (2); 4, 8 (3); 8, 0 (4); СKNO 3 = 0, 1 моль/л, СНNO 3 = 0, 1 моль/л, l = 1 см, V = 25 мл, λ = 500 нм. Розчин порівняння містить всі компоненти, крім металу і ліганду. 7
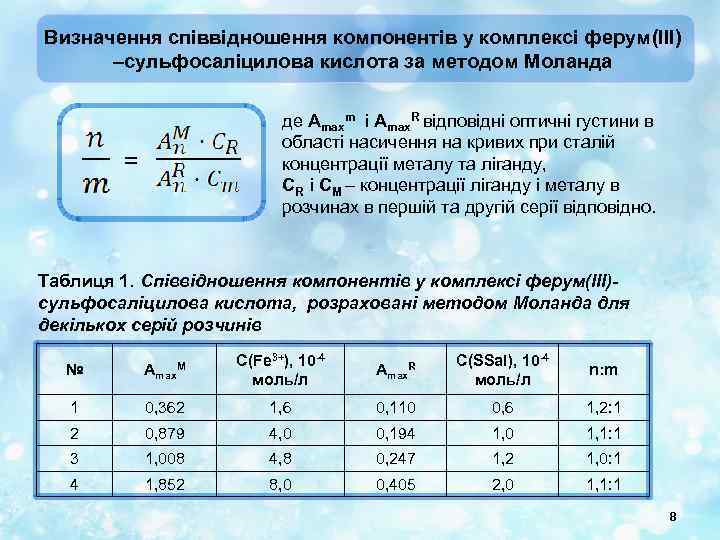 Визначення співвідношення компонентів у комплексі ферум(III) –сульфосаліцилова кислота за методом Моланда де Amaxm і Amax. R відповідні оптичні густини в області насичення на кривих при сталій концентрації металу та ліганду, CR і CM – концентрації ліганду і металу в розчинах в першій та другій серії відповідно. = Таблиця 1. Співвідношення компонентів у комплексі ферум(III)сульфосаліцилова кислота, розраховані методом Моланда для декількох серій розчинів № Amax. M C(Fe 3+), 10 -4 моль/л Amax. R C(SSal), 10 -4 моль/л n: m 1 0, 362 1, 6 0, 110 0, 6 1, 2: 1 2 0, 879 4, 0 0, 194 1, 0 1, 1: 1 3 1, 008 4, 8 0, 247 1, 2 1, 0: 1 4 1, 852 8, 0 0, 405 2, 0 1, 1: 1 8
Визначення співвідношення компонентів у комплексі ферум(III) –сульфосаліцилова кислота за методом Моланда де Amaxm і Amax. R відповідні оптичні густини в області насичення на кривих при сталій концентрації металу та ліганду, CR і CM – концентрації ліганду і металу в розчинах в першій та другій серії відповідно. = Таблиця 1. Співвідношення компонентів у комплексі ферум(III)сульфосаліцилова кислота, розраховані методом Моланда для декількох серій розчинів № Amax. M C(Fe 3+), 10 -4 моль/л Amax. R C(SSal), 10 -4 моль/л n: m 1 0, 362 1, 6 0, 110 0, 6 1, 2: 1 2 0, 879 4, 0 0, 194 1, 0 1, 1: 1 3 1, 008 4, 8 0, 247 1, 2 1, 0: 1 4 1, 852 8, 0 0, 405 2, 0 1, 1: 1 8
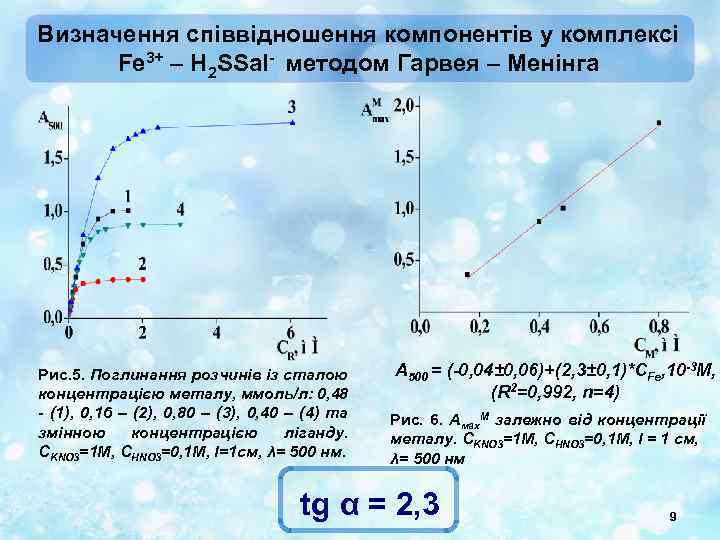 Визначення співвідношення компонентів у комплексі Fe 3+ – H 2 SSal- методом Гарвея – Менінга Рис. 5. Поглинання розчинів із сталою концентрацією металу, ммоль/л: 0, 48 - (1), 0, 16 – (2), 0, 80 – (3), 0, 40 – (4) та змінною концентрацією ліганду. СKNO 3=1 М, СHNO 3=0, 1 М, l=1 см, λ= 500 нм. A 500 = (-0, 04± 0, 06)+(2, 3± 0, 1)*CFe, 10 -3 M, (R 2=0, 992, n=4) Рис. 6. Амах. М залежно від концентрації металу. СKNO 3=1 М, СHNO 3=0, 1 М, l = 1 см, λ= 500 нм tg α = 2, 3 9
Визначення співвідношення компонентів у комплексі Fe 3+ – H 2 SSal- методом Гарвея – Менінга Рис. 5. Поглинання розчинів із сталою концентрацією металу, ммоль/л: 0, 48 - (1), 0, 16 – (2), 0, 80 – (3), 0, 40 – (4) та змінною концентрацією ліганду. СKNO 3=1 М, СHNO 3=0, 1 М, l=1 см, λ= 500 нм. A 500 = (-0, 04± 0, 06)+(2, 3± 0, 1)*CFe, 10 -3 M, (R 2=0, 992, n=4) Рис. 6. Амах. М залежно від концентрації металу. СKNO 3=1 М, СHNO 3=0, 1 М, l = 1 см, λ= 500 нм tg α = 2, 3 9
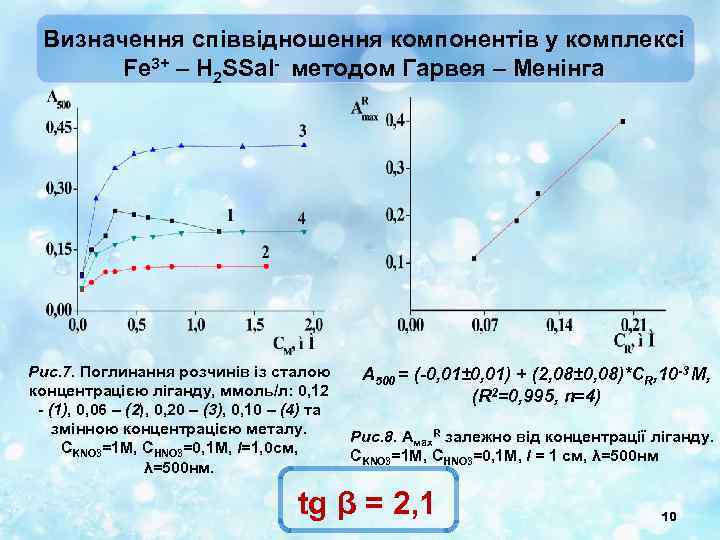 Визначення співвідношення компонентів у комплексі Fe 3+ – H 2 SSal- методом Гарвея – Менінга Рис. 7. Поглинання розчинів із сталою концентрацією ліганду, ммоль/л: 0, 12 - (1), 0, 06 – (2), 0, 20 – (3), 0, 10 – (4) та змінною концентрацією металу. СKNO 3=1 М, СHNO 3=0, 1 М, l=1, 0 см, λ=500 нм. A 500 = (-0, 01± 0, 01) + (2, 08± 0, 08)*CR, 10 -3 M, (R 2=0, 995, n=4) Рис. 8. Амах. R залежно від концентрації ліганду. СKNO 3=1 М, СHNO 3=0, 1 М, l = 1 см, λ=500 нм tg β = 2, 1 10
Визначення співвідношення компонентів у комплексі Fe 3+ – H 2 SSal- методом Гарвея – Менінга Рис. 7. Поглинання розчинів із сталою концентрацією ліганду, ммоль/л: 0, 12 - (1), 0, 06 – (2), 0, 20 – (3), 0, 10 – (4) та змінною концентрацією металу. СKNO 3=1 М, СHNO 3=0, 1 М, l=1, 0 см, λ=500 нм. A 500 = (-0, 01± 0, 01) + (2, 08± 0, 08)*CR, 10 -3 M, (R 2=0, 995, n=4) Рис. 8. Амах. R залежно від концентрації ліганду. СKNO 3=1 М, СHNO 3=0, 1 М, l = 1 см, λ=500 нм tg β = 2, 1 10
 Визначення співвідношення компонентів у комплексі Fe 3+ – H 2 SSal- методом Гарвея – Менінга m : n = 1, 0 : 1, 1 Fe 3+ : H 2 SSal- = 1 : 1 11
Визначення співвідношення компонентів у комплексі Fe 3+ – H 2 SSal- методом Гарвея – Менінга m : n = 1, 0 : 1, 1 Fe 3+ : H 2 SSal- = 1 : 1 11
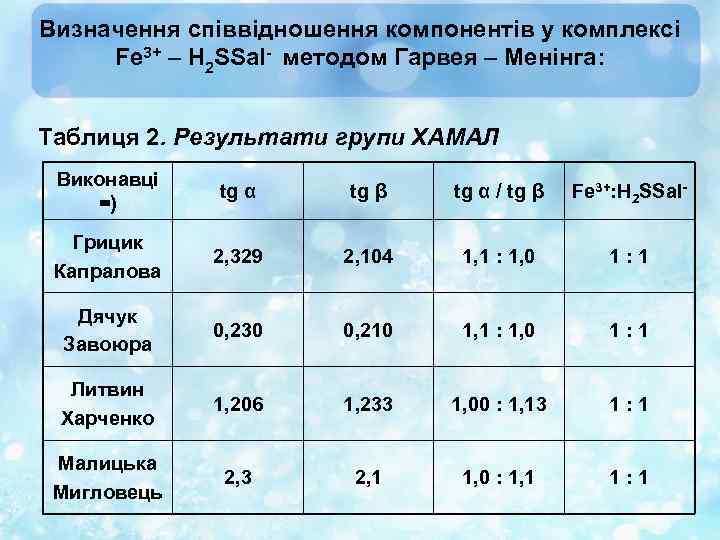 Визначення співвідношення компонентів у комплексі Fe 3+ – H 2 SSal- методом Гарвея – Менінга: Таблиця 2. Результати групи ХАМАЛ Виконавці =) tg α tg β tg α / tg β Fe 3+: H 2 SSal- Грицик Капралова 2, 329 2, 104 1, 1 : 1, 0 1: 1 Дячук Завоюра 0, 230 0, 210 1, 1 : 1, 0 1: 1 Литвин Харченко 1, 206 1, 233 1, 00 : 1, 13 1: 1 Малицька Мигловець 2, 3 2, 1 1, 0 : 1, 1 1: 1
Визначення співвідношення компонентів у комплексі Fe 3+ – H 2 SSal- методом Гарвея – Менінга: Таблиця 2. Результати групи ХАМАЛ Виконавці =) tg α tg β tg α / tg β Fe 3+: H 2 SSal- Грицик Капралова 2, 329 2, 104 1, 1 : 1, 0 1: 1 Дячук Завоюра 0, 230 0, 210 1, 1 : 1, 0 1: 1 Литвин Харченко 1, 206 1, 233 1, 00 : 1, 13 1: 1 Малицька Мигловець 2, 3 2, 1 1, 0 : 1, 1 1: 1
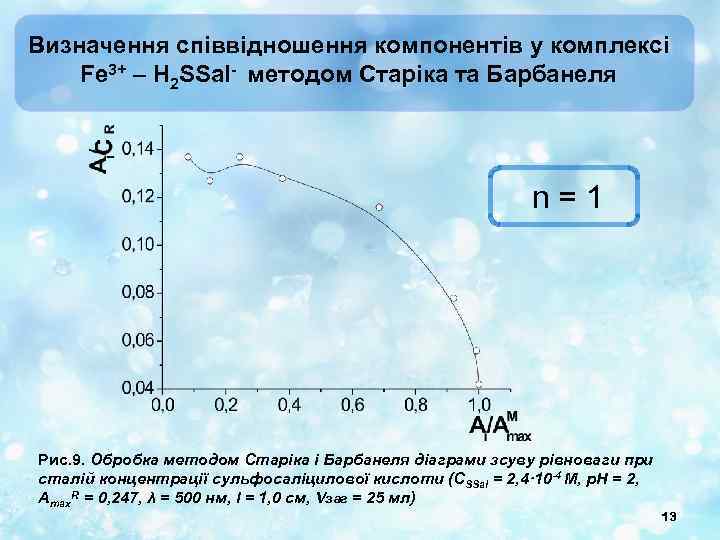 Визначення співвідношення компонентів у комплексі Fe 3+ – H 2 SSal- методом Старіка та Барбанеля n = 1 Рис. 9. Обробка методом Старіка і Барбанеля діаграми зсуву рівноваги при сталій концентрації сульфосаліцилової кислоти (СSSal = 2, 4· 10 -4 М, p. H = 2, Amax. R = 0, 247, λ = 500 нм, l = 1, 0 см, Vзаг = 25 мл) 13
Визначення співвідношення компонентів у комплексі Fe 3+ – H 2 SSal- методом Старіка та Барбанеля n = 1 Рис. 9. Обробка методом Старіка і Барбанеля діаграми зсуву рівноваги при сталій концентрації сульфосаліцилової кислоти (СSSal = 2, 4· 10 -4 М, p. H = 2, Amax. R = 0, 247, λ = 500 нм, l = 1, 0 см, Vзаг = 25 мл) 13
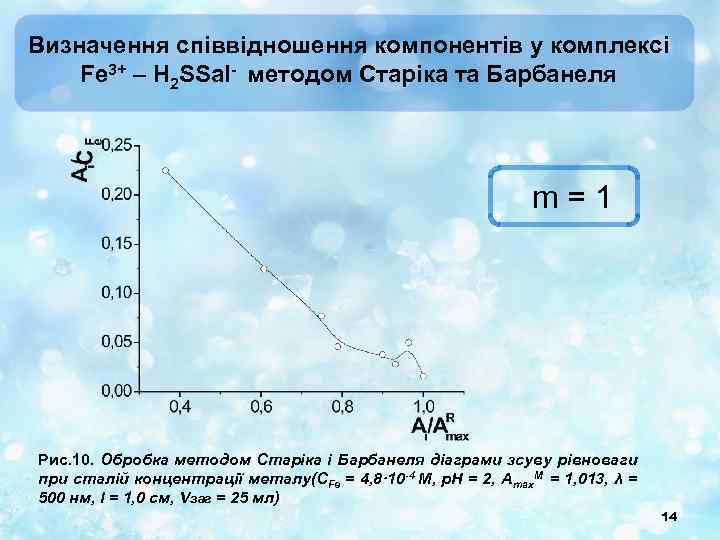 Визначення співвідношення компонентів у комплексі Fe 3+ – H 2 SSal- методом Старіка та Барбанеля m = 1 Рис. 10. Обробка методом Старіка і Барбанеля діаграми зсуву рівноваги при сталій концентрації металу(СFe = 4, 8· 10 -4 М, p. H = 2, Amax. M = 1, 013, λ = 500 нм, l = 1, 0 см, Vзаг = 25 мл) 14
Визначення співвідношення компонентів у комплексі Fe 3+ – H 2 SSal- методом Старіка та Барбанеля m = 1 Рис. 10. Обробка методом Старіка і Барбанеля діаграми зсуву рівноваги при сталій концентрації металу(СFe = 4, 8· 10 -4 М, p. H = 2, Amax. M = 1, 013, λ = 500 нм, l = 1, 0 см, Vзаг = 25 мл) 14
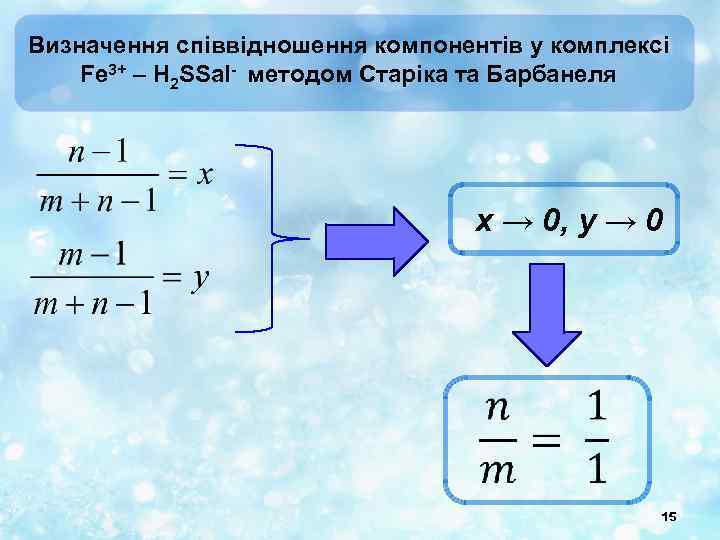 Визначення співвідношення компонентів у комплексі Fe 3+ – H 2 SSal- методом Старіка та Барбанеля x → 0, y → 0 15
Визначення співвідношення компонентів у комплексі Fe 3+ – H 2 SSal- методом Старіка та Барбанеля x → 0, y → 0 15
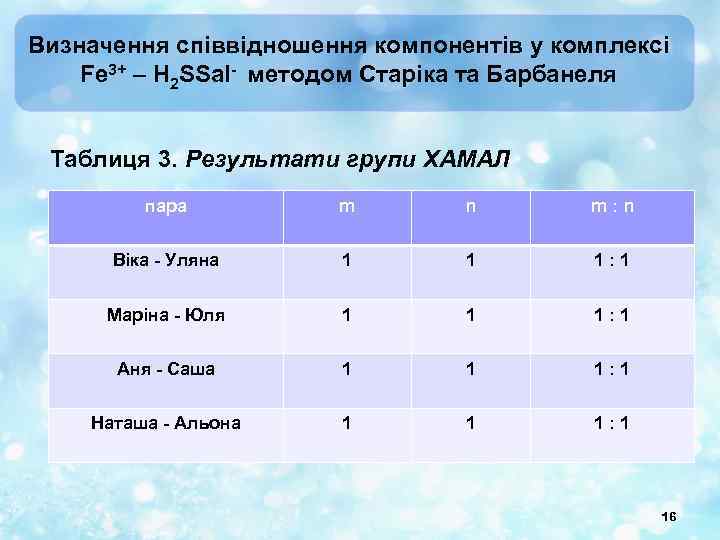 Визначення співвідношення компонентів у комплексі Fe 3+ – H 2 SSal- методом Старіка та Барбанеля Таблиця 3. Результати групи ХАМАЛ пара m n m: n Віка - Уляна 1 1 1: 1 Маріна - Юля 1 1 1: 1 Аня - Саша 1 1 1: 1 Наташа - Альона 1 1 1: 1 16
Визначення співвідношення компонентів у комплексі Fe 3+ – H 2 SSal- методом Старіка та Барбанеля Таблиця 3. Результати групи ХАМАЛ пара m n m: n Віка - Уляна 1 1 1: 1 Маріна - Юля 1 1 1: 1 Аня - Саша 1 1 1: 1 Наташа - Альона 1 1 1: 1 16
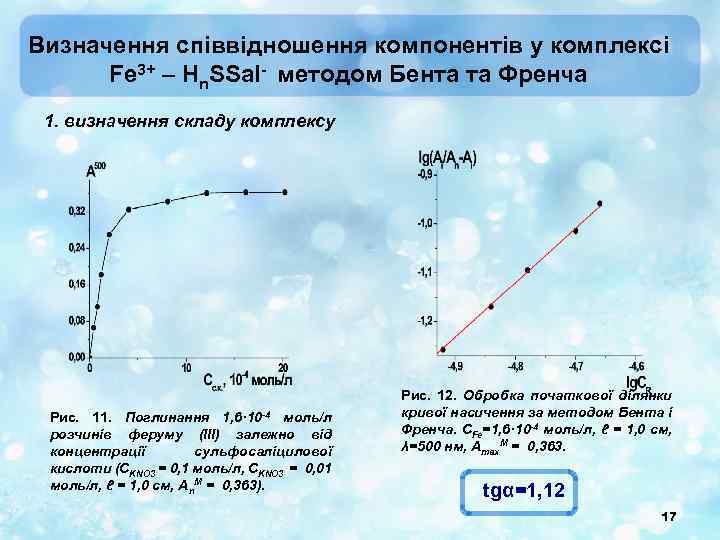 Визначення співвідношення компонентів у комплексі Fe 3+ – Hn. SSal- методом Бента та Френча 1. визначення складу комплексу Рис. 11. Поглинання 1, 6· 10 -4 моль/л розчинів феруму (ІІІ) залежно від концентрації сульфосаліцилової кислоти (СKNO 3 = 0, 1 моль/л, СKNO 3 = 0, 01 моль/л, ℓ = 1, 0 см, Аn. M = 0, 363). Рис. 12. Обробка початкової ділянки кривої насичення за методом Бента і Френча. СFe=1, 6· 10 -4 моль/л, ℓ = 1, 0 см, λ=500 нм, Аmax. М = 0, 363. tgα=1, 12 17
Визначення співвідношення компонентів у комплексі Fe 3+ – Hn. SSal- методом Бента та Френча 1. визначення складу комплексу Рис. 11. Поглинання 1, 6· 10 -4 моль/л розчинів феруму (ІІІ) залежно від концентрації сульфосаліцилової кислоти (СKNO 3 = 0, 1 моль/л, СKNO 3 = 0, 01 моль/л, ℓ = 1, 0 см, Аn. M = 0, 363). Рис. 12. Обробка початкової ділянки кривої насичення за методом Бента і Френча. СFe=1, 6· 10 -4 моль/л, ℓ = 1, 0 см, λ=500 нм, Аmax. М = 0, 363. tgα=1, 12 17
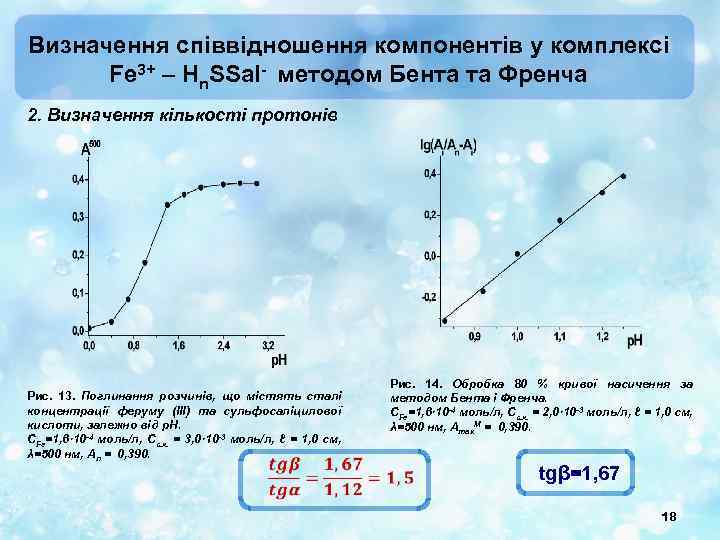 Визначення співвідношення компонентів у комплексі Fe 3+ – Hn. SSal- методом Бента та Френча 2. Визначення кількості протонів Рис. 13. Поглинання розчинів, що містять сталі концентрації феруму (ІІІ) та сульфосаліцилової кислоти, залежно від р. Н. СFe=1, 6· 10 -4 моль/л, Сс. к. = 3, 0· 10 -3 моль/л, ℓ = 1, 0 см, λ=500 нм, Аn = 0, 390. Рис. 14. Обробка 80 % кривої насичення за методом Бента і Френча. СFe=1, 6· 10 -4 моль/л, Сс. к. = 2, 0· 10 -3 моль/л, ℓ = 1, 0 см, λ=500 нм, Аmax. М = 0, 390. tgβ=1, 67 18
Визначення співвідношення компонентів у комплексі Fe 3+ – Hn. SSal- методом Бента та Френча 2. Визначення кількості протонів Рис. 13. Поглинання розчинів, що містять сталі концентрації феруму (ІІІ) та сульфосаліцилової кислоти, залежно від р. Н. СFe=1, 6· 10 -4 моль/л, Сс. к. = 3, 0· 10 -3 моль/л, ℓ = 1, 0 см, λ=500 нм, Аn = 0, 390. Рис. 14. Обробка 80 % кривої насичення за методом Бента і Френча. СFe=1, 6· 10 -4 моль/л, Сс. к. = 2, 0· 10 -3 моль/л, ℓ = 1, 0 см, λ=500 нм, Аmax. М = 0, 390. tgβ=1, 67 18
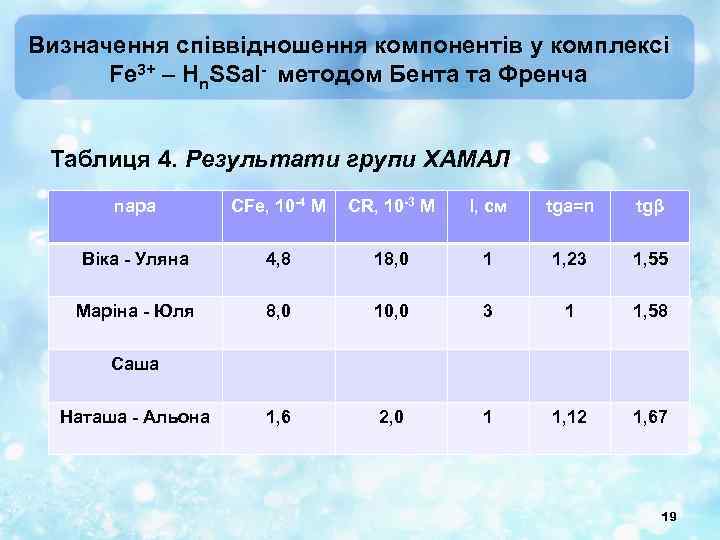 Визначення співвідношення компонентів у комплексі Fe 3+ – Hn. SSal- методом Бента та Френча Таблиця 4. Результати групи ХАМАЛ пара СFe, 10 -4 M CR, 10 -3 M l, см tga=n tgβ Віка - Уляна 4, 8 18, 0 1 1, 23 1, 55 Маріна - Юля 8, 0 10, 0 3 1 1, 58 1, 6 2, 0 1 1, 12 1, 67 Саша Наташа - Альона 19
Визначення співвідношення компонентів у комплексі Fe 3+ – Hn. SSal- методом Бента та Френча Таблиця 4. Результати групи ХАМАЛ пара СFe, 10 -4 M CR, 10 -3 M l, см tga=n tgβ Віка - Уляна 4, 8 18, 0 1 1, 23 1, 55 Маріна - Юля 8, 0 10, 0 3 1 1, 58 1, 6 2, 0 1 1, 12 1, 67 Саша Наташа - Альона 19
 Визначення співвідношення компонентів у комплексі Fe 3+ – Hn. SSal- методом Бента та Френча Можливі рівноваги Fe 3+ + H 2 SSal- → Fe(SSal) + 2 H+ Fe 3+ + H 2 SSal- → Fe(НSSal) + + H+ Fe 3+ + HSSal-2 → Fe(SSal) + H+ 20
Визначення співвідношення компонентів у комплексі Fe 3+ – Hn. SSal- методом Бента та Френча Можливі рівноваги Fe 3+ + H 2 SSal- → Fe(SSal) + 2 H+ Fe 3+ + H 2 SSal- → Fe(НSSal) + + H+ Fe 3+ + HSSal-2 → Fe(SSal) + H+ 20
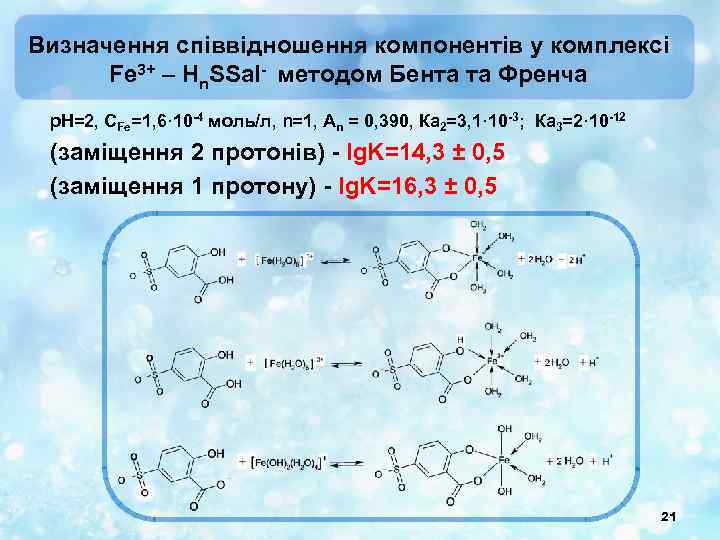 Визначення співвідношення компонентів у комплексі Fe 3+ – Hn. SSal- методом Бента та Френча р. Н=2, СFe=1, 6· 10 -4 моль/л, n=1, Аn = 0, 390, Ка 2=3, 1· 10 -3; Ка 3=2· 10 -12 (заміщення 2 протонів) - lg. K=14, 3 ± 0, 5 (заміщення 1 протону) - lg. K=16, 3 ± 0, 5 21
Визначення співвідношення компонентів у комплексі Fe 3+ – Hn. SSal- методом Бента та Френча р. Н=2, СFe=1, 6· 10 -4 моль/л, n=1, Аn = 0, 390, Ка 2=3, 1· 10 -3; Ка 3=2· 10 -12 (заміщення 2 протонів) - lg. K=14, 3 ± 0, 5 (заміщення 1 протону) - lg. K=16, 3 ± 0, 5 21
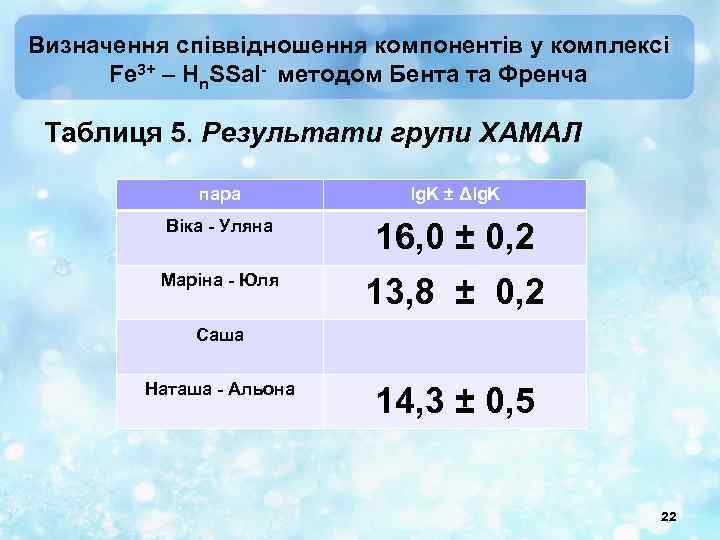 Визначення співвідношення компонентів у комплексі Fe 3+ – Hn. SSal- методом Бента та Френча Таблиця 5. Результати групи ХАМАЛ пара lg. K ± Δlg. K Віка - Уляна 16, 0 ± 0, 2 Маріна - Юля 13, 8 ± 0, 2 Саша Наташа - Альона 14, 3 ± 0, 5 22
Визначення співвідношення компонентів у комплексі Fe 3+ – Hn. SSal- методом Бента та Френча Таблиця 5. Результати групи ХАМАЛ пара lg. K ± Δlg. K Віка - Уляна 16, 0 ± 0, 2 Маріна - Юля 13, 8 ± 0, 2 Саша Наташа - Альона 14, 3 ± 0, 5 22
 Висновки: Для визначення складу комплексу, що утворюється в системі ферум(ІІІ) - сульфосаліцилова кислота при р. Н 2, були використані методи Моланда, Гарвея-Менінга та Старіка і Барбанеля. На основі експериментальних даних за методом Моланда отримано співвідношення n : m = 1, 1 : 1; за методом Гарвея. Меннінга n : m = 1, 1 : 1; за методом Старіка та Барбанеля m = 1; n = 1. Останній метод є найбільш інформативним, оскільки окремо розраховуються конкретні значення коефіцієнтів n і m, а не їх співвідношення; Таким чином, враховуючи вплив похибок експерименту, можна стверджувати про утворення моноядерного комплексу складу 1: 1 при р. Н 2 у системі ферум(ІІІ) – сульфосаліцилова кислота. 23
Висновки: Для визначення складу комплексу, що утворюється в системі ферум(ІІІ) - сульфосаліцилова кислота при р. Н 2, були використані методи Моланда, Гарвея-Менінга та Старіка і Барбанеля. На основі експериментальних даних за методом Моланда отримано співвідношення n : m = 1, 1 : 1; за методом Гарвея. Меннінга n : m = 1, 1 : 1; за методом Старіка та Барбанеля m = 1; n = 1. Останній метод є найбільш інформативним, оскільки окремо розраховуються конкретні значення коефіцієнтів n і m, а не їх співвідношення; Таким чином, враховуючи вплив похибок експерименту, можна стверджувати про утворення моноядерного комплексу складу 1: 1 при р. Н 2 у системі ферум(ІІІ) – сульфосаліцилова кислота. 23

