Скорость химических реакций ниш.ppt
- Количество слайдов: 25
 ? Как измерить скорость реакции?
? Как измерить скорость реакции?
 l Скорость химической реакции определяется изменением концентрации одного из реагирующих веществ в единицу времени 2
l Скорость химической реакции определяется изменением концентрации одного из реагирующих веществ в единицу времени 2
 (для гомогенных систем) V = C 2 – C 1 / t 2 -t 1 начальная концентрация оксида серы(IV) в реакции окисления его до оксида серы (VI) 2 моль/л, через 50 с. Стала 0, 5 моль/л. Скорость реакции равна (для гетерогенных систем)
(для гомогенных систем) V = C 2 – C 1 / t 2 -t 1 начальная концентрация оксида серы(IV) в реакции окисления его до оксида серы (VI) 2 моль/л, через 50 с. Стала 0, 5 моль/л. Скорость реакции равна (для гетерогенных систем)
 Классификация процессов по фазовому составу 1) гомогенные - протекающие по всему объему реагирующих веществ 2) гетерогенные - протекающие на границе фаз 3) топохимические c изменением структуры реагирующих твердых в-в Пример: разложение карбонатов при to Ca. CO 3 (кр)=Ca. O(кр)+CO 2 (газ)
Классификация процессов по фазовому составу 1) гомогенные - протекающие по всему объему реагирующих веществ 2) гетерогенные - протекающие на границе фаз 3) топохимические c изменением структуры реагирующих твердых в-в Пример: разложение карбонатов при to Ca. CO 3 (кр)=Ca. O(кр)+CO 2 (газ)
 задача № 1 l При гидролизе сахарозы в 1 л. Водного раствора за 10 мин. образовалось 18 г. глюкозы. Определите среднюю скорость гидролиза сахарозы 5
задача № 1 l При гидролизе сахарозы в 1 л. Водного раствора за 10 мин. образовалось 18 г. глюкозы. Определите среднюю скорость гидролиза сахарозы 5
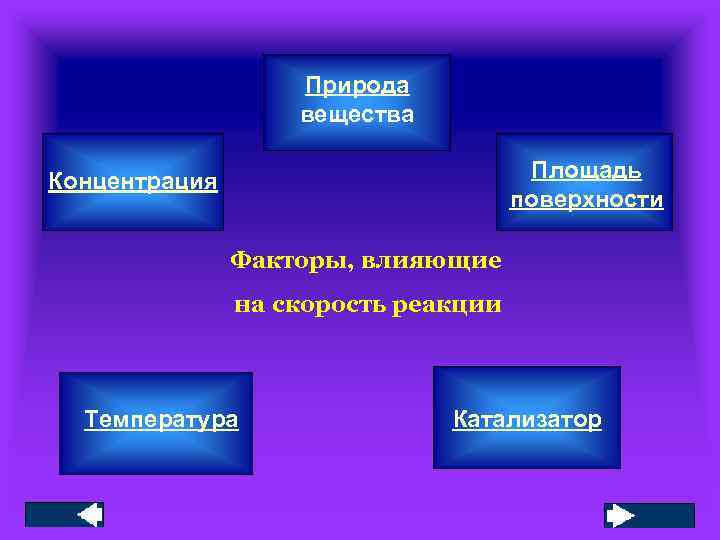 Природа вещества Площадь поверхности Концентрация Факторы, влияющие на скорость реакции Температура Катализатор
Природа вещества Площадь поверхности Концентрация Факторы, влияющие на скорость реакции Температура Катализатор
 Закон действующих масс с Скорость химической реакции прямо пропорционально произведению концентраций реагирующих веществ t
Закон действующих масс с Скорость химической реакции прямо пропорционально произведению концентраций реагирующих веществ t
 Кинетическое уравнение l Для простой реакции: а. А + b. В = с. С +d. D математическое выражение ЗДМ: a b V=k. C C A B l. V – скорость реакции lk – константа скорости реакции l. CA и CB – молярные конц-ции реагв lа и b – кинетический порядок реакции по веществу А и В соответственно
Кинетическое уравнение l Для простой реакции: а. А + b. В = с. С +d. D математическое выражение ЗДМ: a b V=k. C C A B l. V – скорость реакции lk – константа скорости реакции l. CA и CB – молярные конц-ции реагв lа и b – кинетический порядок реакции по веществу А и В соответственно
 Пример записи кинетического уравнения простой реакции 1) C 2 H 5 OH = C 2 H 4 + H 2 O V=k. С(C 2 H 5 OH) 2) 2 HI = H 2 + I 2 V = k С 2(HI) 3) 2 NO + Cl 2 = 2 NOCl V = k C 2(NO)C(Cl 2) l Общий кинетич-й порядок простой реакции равен ее молекулярности
Пример записи кинетического уравнения простой реакции 1) C 2 H 5 OH = C 2 H 4 + H 2 O V=k. С(C 2 H 5 OH) 2) 2 HI = H 2 + I 2 V = k С 2(HI) 3) 2 NO + Cl 2 = 2 NOCl V = k C 2(NO)C(Cl 2) l Общий кинетич-й порядок простой реакции равен ее молекулярности
 Пример№ 2 Как изменится скорость следующей химической реакции при увеличении концентрации водорода в 3 раза? l 2 H 2 + O 2= 2 H 2 O l 12
Пример№ 2 Как изменится скорость следующей химической реакции при увеличении концентрации водорода в 3 раза? l 2 H 2 + O 2= 2 H 2 O l 12
 l Для веществ в твердом состоянии скорость реакции напрямую зависит от степени измельчения вещества. Почему?
l Для веществ в твердом состоянии скорость реакции напрямую зависит от степени измельчения вещества. Почему?
 Правило Вант – Гоффа: С увеличением температуры на каждые 10 градусов скорость реакции возрастает в 2 - 4 раза. V 2 = V 1 * Т 2 -Т 1 /10
Правило Вант – Гоффа: С увеличением температуры на каждые 10 градусов скорость реакции возрастает в 2 - 4 раза. V 2 = V 1 * Т 2 -Т 1 /10
 Пример № 3 l Во сколько раз изменится скорость при повышение температуры с 50 до 100 С, если температурный коэффициент равен 3? 15
Пример № 3 l Во сколько раз изменится скорость при повышение температуры с 50 до 100 С, если температурный коэффициент равен 3? 15
 Катализ – процесс ускорения реакции под действием дополнительных реагентов l l l Катализатор ускоряет реакцию в десятки раз. Для чего нужно п р и м е н я т ь катализатор? Где вы встречались с действием катализатора?
Катализ – процесс ускорения реакции под действием дополнительных реагентов l l l Катализатор ускоряет реакцию в десятки раз. Для чего нужно п р и м е н я т ь катализатор? Где вы встречались с действием катализатора?
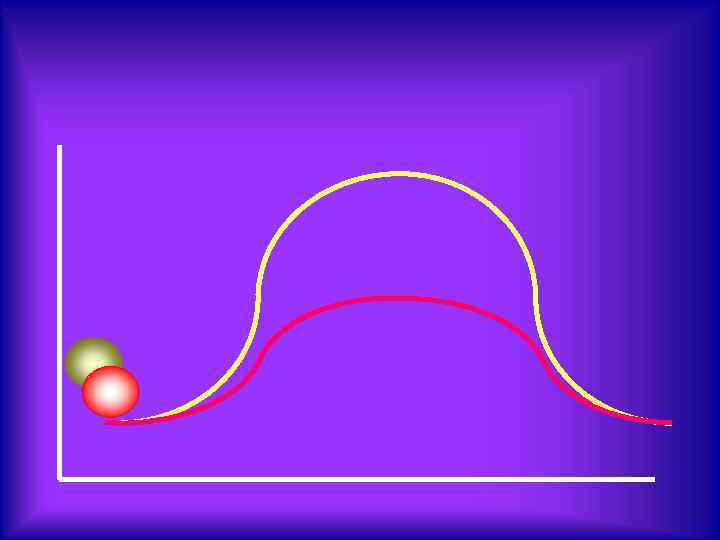
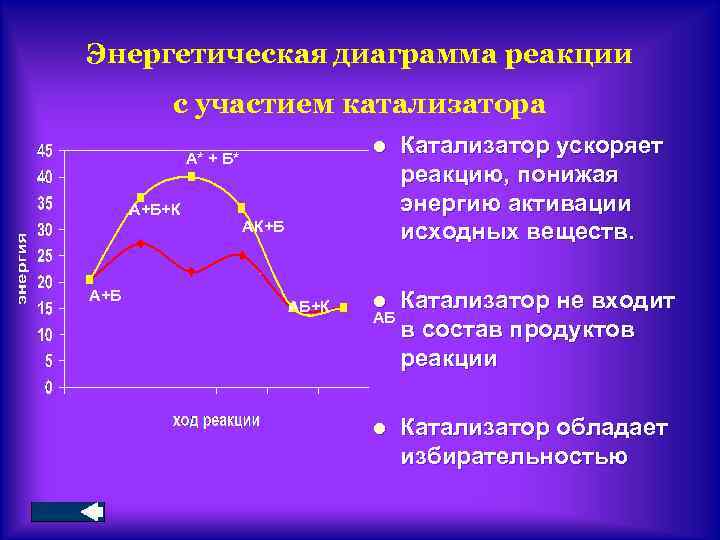 Энергетическая диаграмма реакции с участием катализатора l А* + Б* А+Б+К А+Б Катализатор ускоряет реакцию, понижая энергию активации исходных веществ. l Катализатор не входит в состав продуктов реакции l Катализатор обладает избирательностью АК+Б АБ+К АБ
Энергетическая диаграмма реакции с участием катализатора l А* + Б* А+Б+К А+Б Катализатор ускоряет реакцию, понижая энергию активации исходных веществ. l Катализатор не входит в состав продуктов реакции l Катализатор обладает избирательностью АК+Б АБ+К АБ
 тест Скорость химических реакций
тест Скорость химических реакций
 1. Концентрация 2. Число атомов 3. Скорость 4. Размеры пробирки
1. Концентрация 2. Число атомов 3. Скорость 4. Размеры пробирки
 1. л/моль 2. с/моль 3. Моль/мин 4. Моль/л*мин
1. л/моль 2. с/моль 3. Моль/мин 4. Моль/л*мин
 1. Временная 2. Температурная Т 2 -Т 1 / 3. Зависимость от концентрации 10 V 2 = V 1 * 4. Зависимость от давления
1. Временная 2. Температурная Т 2 -Т 1 / 3. Зависимость от концентрации 10 V 2 = V 1 * 4. Зависимость от давления
 1. Концентрация 2. Давление 3. Масса 4. Площадь поверхности
1. Концентрация 2. Давление 3. Масса 4. Площадь поверхности
 1. Энергия, необходимая для перехода веществ в состояние активированного комплекса 2. Разница между энергиями исходных веществ и продуктов реакции 3. Энергия, которая выделяется в ходе химической реакции
1. Энергия, необходимая для перехода веществ в состояние активированного комплекса 2. Разница между энергиями исходных веществ и продуктов реакции 3. Энергия, которая выделяется в ходе химической реакции
 1. Высокомолекулярные соединения 2. Вещества, которые увеличивают скорость химической реакции, но остаются неизменными по окончании реакции 3. Вещества, активно поглощающие радиоактивное излучение 4. Вещества, которые являются примесями
1. Высокомолекулярные соединения 2. Вещества, которые увеличивают скорость химической реакции, но остаются неизменными по окончании реакции 3. Вещества, активно поглощающие радиоактивное излучение 4. Вещества, которые являются примесями

