Лекция 2. Явления на поверхности.ppt
- Количество слайдов: 17
 Кафедра ВЭПТ «Основы физики поверхности и тонких пленок» Лекция 2 Тема: 2. Явления на поверхности твёрдого тела 2. 1 Поверхностная энергия, поверхностное натяжение. 2. 2 Кипение и испарение жидкости. 2. 3 Сублимация. 2. 4 Давление насыщенных паров. 2. 5 Конденсация. 1
Кафедра ВЭПТ «Основы физики поверхности и тонких пленок» Лекция 2 Тема: 2. Явления на поверхности твёрдого тела 2. 1 Поверхностная энергия, поверхностное натяжение. 2. 2 Кипение и испарение жидкости. 2. 3 Сублимация. 2. 4 Давление насыщенных паров. 2. 5 Конденсация. 1
 Поверхностная энергия, поверхностное натяжение Cредняя энергия gs частицы, находящейся на поверхности раздела фаз, отличается от средней энергии такой же частицы в объеме фазы gv (причем энергия частицы на поверхности может быть как больше, так и меньше энергии частицы в объеме). Поэтому важнейшей характеристикой поверхностной фазы является поверхностная энергия Gs – разность средней энергии частицы, находящейся на поверхности, и частицы, находящейся в объеме фазы, умноженная на число частиц на поверхности N: Очевидно, что общая величина поверхностной энергии фазы будет определяться величиной её поверхности S. Поэтому для характеристики поверхности раздела, отделяющей данную фазу от другой, вводится понятие поверхностное натяжение σ – отношение поверхностной энергии к площади поверхности раздела фаз; величина поверхностного натяжения зависит только от природы обеих фаз.
Поверхностная энергия, поверхностное натяжение Cредняя энергия gs частицы, находящейся на поверхности раздела фаз, отличается от средней энергии такой же частицы в объеме фазы gv (причем энергия частицы на поверхности может быть как больше, так и меньше энергии частицы в объеме). Поэтому важнейшей характеристикой поверхностной фазы является поверхностная энергия Gs – разность средней энергии частицы, находящейся на поверхности, и частицы, находящейся в объеме фазы, умноженная на число частиц на поверхности N: Очевидно, что общая величина поверхностной энергии фазы будет определяться величиной её поверхности S. Поэтому для характеристики поверхности раздела, отделяющей данную фазу от другой, вводится понятие поверхностное натяжение σ – отношение поверхностной энергии к площади поверхности раздела фаз; величина поверхностного натяжения зависит только от природы обеих фаз.
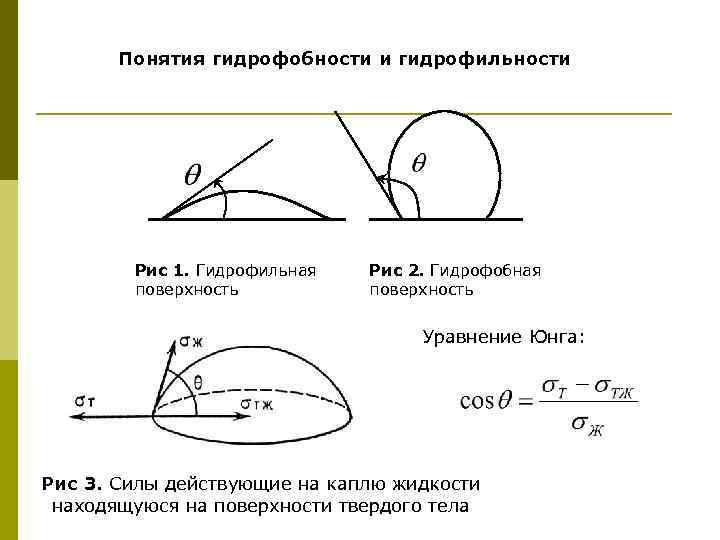 Понятия гидрофобности и гидрофильности Рис 1. Гидрофильная поверхность Рис 2. Гидрофобная поверхность Уравнение Юнга: Рис 3. Cилы действующие на каплю жидкости находящуюся на поверхности твердого тела
Понятия гидрофобности и гидрофильности Рис 1. Гидрофильная поверхность Рис 2. Гидрофобная поверхность Уравнение Юнга: Рис 3. Cилы действующие на каплю жидкости находящуюся на поверхности твердого тела
 Кипение и испарение жидкости.
Кипение и испарение жидкости.
 Испарение и конденсация Испарение – это парообразование, которое происходит только со свободной поверхности жидкости, граничащей с газообразной средой. Молекулы жидкости могут двигаться с разными скоростями. Наиболее быстрые из них обладают достаточной энергией, чтобы покинуть жидкость, преодолев силы притяжения со стороны молекул, расположенных в поверхностном слое жидкости. Очевидно, количество молекул, улетающих с единицы поверхности жидкости в единицу времени, тем больше, чем больше температура жидкости. Улетевшие молекулы уносят с собой энергию, поэтому при испарении происходит уменьшение температуры жидкости (охлаждение). Для поддержания неизменной температуры испаряющейся жидкости к ней необходимо подводить тепло. Количество тепла, которое необходимо сообщить жидкости для ее испарения при постоянной температуре, называется теплотой парообразования: Q = rm, где r – удельная теплота парообразования. Она показывает, какое количество тепла нужно затратить, чтобы обратить в пар 1 кг жидкости при неизменной температуре. Часть подводимой теплоты расходуется на совершение работы против сил притяжения между молекулами при выходе из жидкости и сообщение молекулам кинетической энергии, другая тратится на работу против сил внешнего давления при увеличении объема образовавшегося пара. Величина r уменьшается с увеличением температуры, так как меньше приходится затрачивать энергии на совершение работы выхода. Например, для воды r =2, 5· 106 Дж/кг при t = 0ºС, при t = 100ºС r =2, 26· 106 Дж/кг. В результате хаотического движения над поверхностью жидкости молекулы пара снова могут попасть на эту поверхность и вернуться в жидкость. Этот процесс называется конденсацией пара.
Испарение и конденсация Испарение – это парообразование, которое происходит только со свободной поверхности жидкости, граничащей с газообразной средой. Молекулы жидкости могут двигаться с разными скоростями. Наиболее быстрые из них обладают достаточной энергией, чтобы покинуть жидкость, преодолев силы притяжения со стороны молекул, расположенных в поверхностном слое жидкости. Очевидно, количество молекул, улетающих с единицы поверхности жидкости в единицу времени, тем больше, чем больше температура жидкости. Улетевшие молекулы уносят с собой энергию, поэтому при испарении происходит уменьшение температуры жидкости (охлаждение). Для поддержания неизменной температуры испаряющейся жидкости к ней необходимо подводить тепло. Количество тепла, которое необходимо сообщить жидкости для ее испарения при постоянной температуре, называется теплотой парообразования: Q = rm, где r – удельная теплота парообразования. Она показывает, какое количество тепла нужно затратить, чтобы обратить в пар 1 кг жидкости при неизменной температуре. Часть подводимой теплоты расходуется на совершение работы против сил притяжения между молекулами при выходе из жидкости и сообщение молекулам кинетической энергии, другая тратится на работу против сил внешнего давления при увеличении объема образовавшегося пара. Величина r уменьшается с увеличением температуры, так как меньше приходится затрачивать энергии на совершение работы выхода. Например, для воды r =2, 5· 106 Дж/кг при t = 0ºС, при t = 100ºС r =2, 26· 106 Дж/кг. В результате хаотического движения над поверхностью жидкости молекулы пара снова могут попасть на эту поверхность и вернуться в жидкость. Этот процесс называется конденсацией пара.
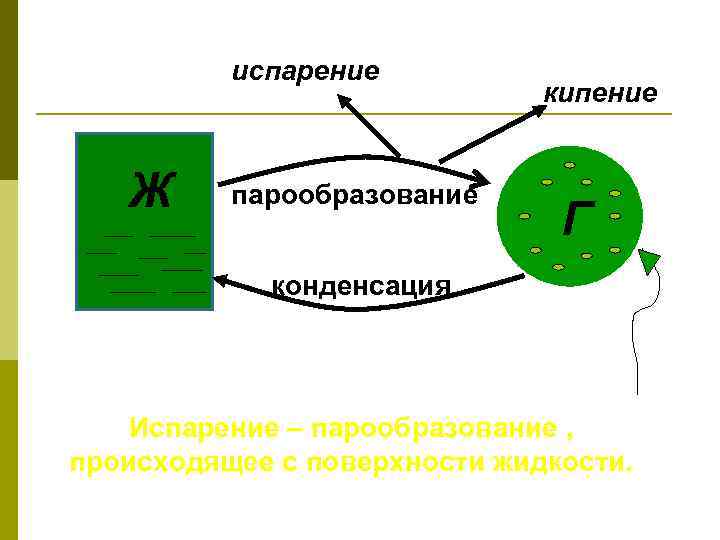 испарение Ж парообразование кипение Г конденсация Испарение – парообразование , происходящее с поверхности жидкости.
испарение Ж парообразование кипение Г конденсация Испарение – парообразование , происходящее с поверхности жидкости.
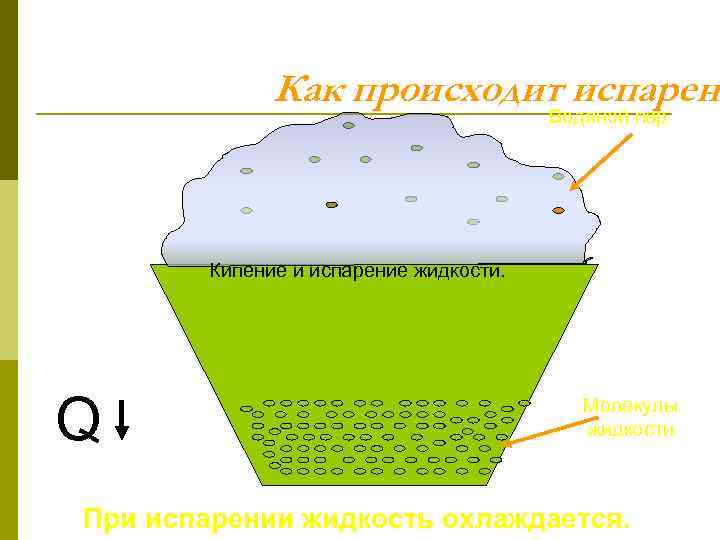 Как происходит испарени Водяной пар Кипение и испарение жидкости. Q Молекулы жидкости При испарении жидкость охлаждается.
Как происходит испарени Водяной пар Кипение и испарение жидкости. Q Молекулы жидкости При испарении жидкость охлаждается.
 Проверь себя : Всякая ли молекула может покинуть жидкость? p Почему при испарении температура жидкости понижается? p Почему испарение происходит при любой температуре? p
Проверь себя : Всякая ли молекула может покинуть жидкость? p Почему при испарении температура жидкости понижается? p Почему испарение происходит при любой температуре? p
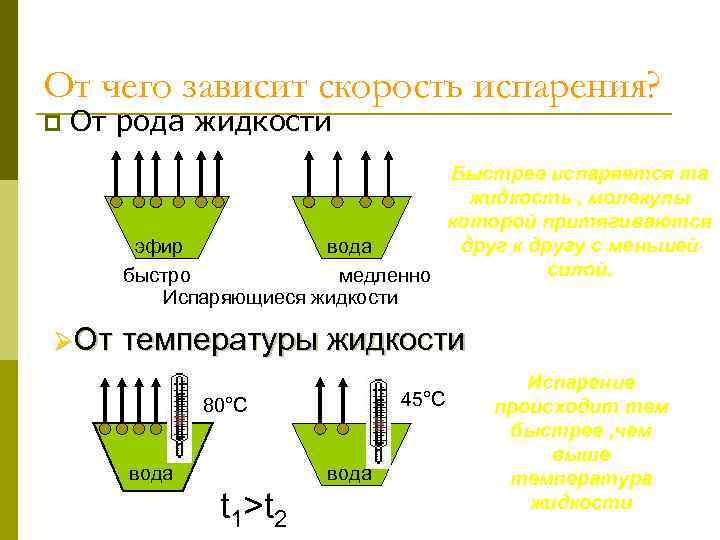 От чего зависит скорость испарения? p От рода жидкости Быстрее испаряется та жидкость , молекулы которой притягиваются друг к другу с меньшей эфир вода силой. быстро медленно Испаряющиеся жидкости ØОт температуры жидкости 45°С 80°С вода t 1>t 2 Испарение происходит тем быстрее , чем выше температура жидкости
От чего зависит скорость испарения? p От рода жидкости Быстрее испаряется та жидкость , молекулы которой притягиваются друг к другу с меньшей эфир вода силой. быстро медленно Испаряющиеся жидкости ØОт температуры жидкости 45°С 80°С вода t 1>t 2 Испарение происходит тем быстрее , чем выше температура жидкости
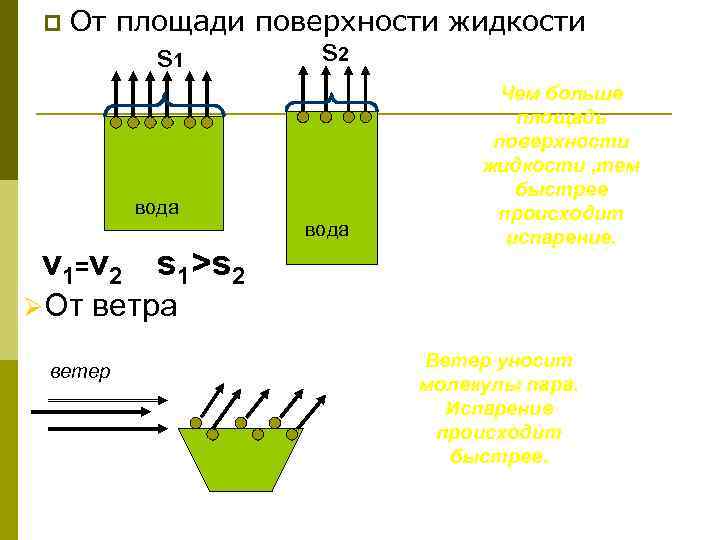 p От площади поверхности жидкости s 1 s 2 вода v 1=v 2 s 1>s 2 ØОт Чем больше площадь поверхности жидкости , тем быстрее происходит испарение. ветра ветер Ветер уносит молекулы пара. Испарение происходит быстрее.
p От площади поверхности жидкости s 1 s 2 вода v 1=v 2 s 1>s 2 ØОт Чем больше площадь поверхности жидкости , тем быстрее происходит испарение. ветра ветер Ветер уносит молекулы пара. Испарение происходит быстрее.
 В ясную или пасмурную погоду быстрее высохнет белье? В стакане или в чашке быстрее остынет чай? Каково назначение веера?
В ясную или пасмурную погоду быстрее высохнет белье? В стакане или в чашке быстрее остынет чай? Каково назначение веера?
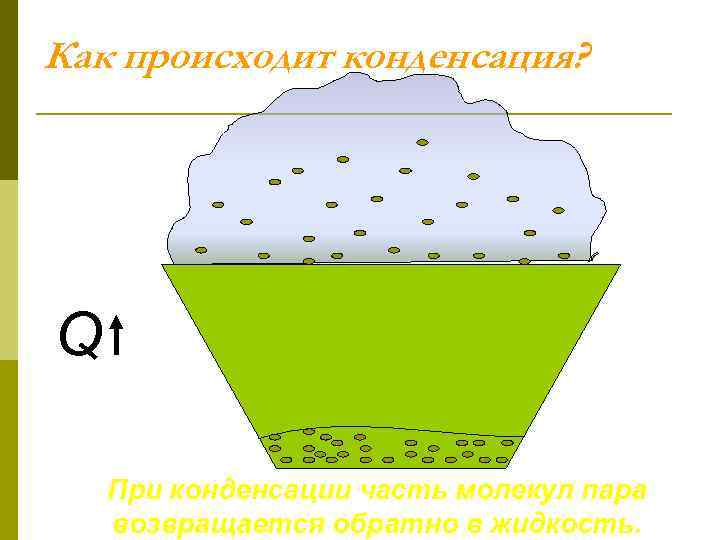 Как происходит конденсация? Q При конденсации часть молекул пара возвращается обратно в жидкость.
Как происходит конденсация? Q При конденсации часть молекул пара возвращается обратно в жидкость.
 Конденсация в природе: Р О О О Б Б С Р Л ы А З О Т У М а Н а А К О В В Д А О Н Ж И Д Я
Конденсация в природе: Р О О О Б Б С Р Л ы А З О Т У М а Н а А К О В В Д А О Н Ж И Д Я
 Насыщенный и ненасыщенный пар Если число молекул, вылетающих из жидкости, равно числу молекул, возвращающих обратно в жидкость, то наступает динамическое равновесие между жидкостью и паром Пар, находящийся в динамическом равновесии со своей жидкостью, называется насыщенным паром
Насыщенный и ненасыщенный пар Если число молекул, вылетающих из жидкости, равно числу молекул, возвращающих обратно в жидкость, то наступает динамическое равновесие между жидкостью и паром Пар, находящийся в динамическом равновесии со своей жидкостью, называется насыщенным паром
 рис. 4 Изотермы реального газа. Область I – жидкость, область II – двухфазная система «жидкость + насыщенный пар» , область III – газообразное вещество. K – критическая точка В атмосферном воздухе всегда присутствуют пары воды при некотором парциальном давлении p, которое, как правило, меньше давления насыщенного пара p 0. Отношение p / p 0, выраженное в процентах, называется относительной влажностью воздуха.
рис. 4 Изотермы реального газа. Область I – жидкость, область II – двухфазная система «жидкость + насыщенный пар» , область III – газообразное вещество. K – критическая точка В атмосферном воздухе всегда присутствуют пары воды при некотором парциальном давлении p, которое, как правило, меньше давления насыщенного пара p 0. Отношение p / p 0, выраженное в процентах, называется относительной влажностью воздуха.
 Фазовая диаграмма Типичная фазовая диаграмма вещества. K – критическая точка, T – тройная точка. Область I – твердое тело, область II – жидкость, область III – газообразное вещество. рис. 5 Кривая OT, соответствующая равновесию между твердой и газообразной фазами, называется кривой сублимации. Кривая TK равновесия между жидкостью и паром называется кривой испарения, она обрывается в критической точке K. Кривая TM равновесия между твердым телом и жидкостью называется кривой плавления. Кривые равновесия сходятся в точке T, в которой могут сосуществовать в равновесии все три фазы. Эта точка называется тройной точкой.
Фазовая диаграмма Типичная фазовая диаграмма вещества. K – критическая точка, T – тройная точка. Область I – твердое тело, область II – жидкость, область III – газообразное вещество. рис. 5 Кривая OT, соответствующая равновесию между твердой и газообразной фазами, называется кривой сублимации. Кривая TK равновесия между жидкостью и паром называется кривой испарения, она обрывается в критической точке K. Кривая TM равновесия между твердым телом и жидкостью называется кривой плавления. Кривые равновесия сходятся в точке T, в которой могут сосуществовать в равновесии все три фазы. Эта точка называется тройной точкой.
 Сублимация Есть и еще один тип фазового перехода — из твердого состояния вещества непосредственно в газообразное (минуя жидкость). Такое фазовое превращение называется возгонкой, или сублимацией. Самый бытовой пример: вывешенное сушиться на мороз сырое белье. Вода в нем сначала кристаллизуется в лед, а затем — под воздействием прямых солнечных лучей — микроскопические кристаллики льда попросту испаряются, минуя жидкую фазу. Другой пример: на рок -концертах «сухой лед» (замороженная двуокись углерода CO 2) используется для устройства дымовой завесы — она испаряется прямо в воздух, окутывая выступающих музыкантов и также минуя жидкую фазу. Соответственно, на преобразование твердого вещества непосредственно в газ затрачивается энергия сублимации. Примером обратного процесса образования кристаллов из паров является образование инея и снежинок из водяных паров воздуха.
Сублимация Есть и еще один тип фазового перехода — из твердого состояния вещества непосредственно в газообразное (минуя жидкость). Такое фазовое превращение называется возгонкой, или сублимацией. Самый бытовой пример: вывешенное сушиться на мороз сырое белье. Вода в нем сначала кристаллизуется в лед, а затем — под воздействием прямых солнечных лучей — микроскопические кристаллики льда попросту испаряются, минуя жидкую фазу. Другой пример: на рок -концертах «сухой лед» (замороженная двуокись углерода CO 2) используется для устройства дымовой завесы — она испаряется прямо в воздух, окутывая выступающих музыкантов и также минуя жидкую фазу. Соответственно, на преобразование твердого вещества непосредственно в газ затрачивается энергия сублимации. Примером обратного процесса образования кристаллов из паров является образование инея и снежинок из водяных паров воздуха.
