КАДМИЙ Распространенность в природе § Кадмий в




















лекция Кадмий.ppt
- Количество слайдов: 22
 КАДМИЙ
КАДМИЙ
 Распространенность в природе § Кадмий в периодической системе элементов находится в побочной подгруппе второй группы периодической таблицы вместе с цинком и ртутью. § В соответствии с этим местом в таблице его главная степень окисления Cd 2+, в этом состоянии он встречается в природных месторождениях. § Минералы кадмиевая обманка (гринокит) и карбонат кадмия (отавит) Cd. CO 3 являются постоянными спутниками цинковых руд, цинковой обманки Zn. S и смитсонита Zn. CO 3. Поэтому кадмий является побочным продуктом при промышленном производстве цинка. § Вследствие электронного строения и стандартного электрохимического потенциала - Е 0(Cd/Cd 2+) = -0. 40 v - кадмий не встречается в природе в виде чистого металла. § По распространенности в природе кадмий относится к редким и рассеянным элементам: среднее содержание его в земной коре - 1. 1*10 -4% (Исидоров, 1997). Относительно высоко (до 15 мкг/кг) его содержание в фосфатных осадочных породах.
Распространенность в природе § Кадмий в периодической системе элементов находится в побочной подгруппе второй группы периодической таблицы вместе с цинком и ртутью. § В соответствии с этим местом в таблице его главная степень окисления Cd 2+, в этом состоянии он встречается в природных месторождениях. § Минералы кадмиевая обманка (гринокит) и карбонат кадмия (отавит) Cd. CO 3 являются постоянными спутниками цинковых руд, цинковой обманки Zn. S и смитсонита Zn. CO 3. Поэтому кадмий является побочным продуктом при промышленном производстве цинка. § Вследствие электронного строения и стандартного электрохимического потенциала - Е 0(Cd/Cd 2+) = -0. 40 v - кадмий не встречается в природе в виде чистого металла. § По распространенности в природе кадмий относится к редким и рассеянным элементам: среднее содержание его в земной коре - 1. 1*10 -4% (Исидоров, 1997). Относительно высоко (до 15 мкг/кг) его содержание в фосфатных осадочных породах.
 Химические свойства (по Глинке, 1978) § Металлический кадмий получают из отходов цинкового производства путем обработки последних серной кислотой с последующим выделением кадмия цинком: Cd. SO 4 + Zn = Zn. SO 4 + Cd § Кадмий представляет собой серебристо-белый, мягкий, ковкий, тягучий металл. При сильном накаливании сгорает, превращаясь в бурый оксид кадмия Cd. O. § Гидроксид кадмия Cd(OH)2 в отличие от гидроксида цинка не обладает заметно выраженными кислотными свойствами и практически не растворяется в щелочах. § Из солей кадмия следует выделить сульфид кадмия Cd. S, выпадающий в виде желтого осадка из растворов солей кадмия при действии сероводорода. § Все растворимые в воде и в разбавленных кислотах соединения кадмия ядовиты. Весьма опасно также вдыхание воздуха, содержащего "дым" оксида кадмия.
Химические свойства (по Глинке, 1978) § Металлический кадмий получают из отходов цинкового производства путем обработки последних серной кислотой с последующим выделением кадмия цинком: Cd. SO 4 + Zn = Zn. SO 4 + Cd § Кадмий представляет собой серебристо-белый, мягкий, ковкий, тягучий металл. При сильном накаливании сгорает, превращаясь в бурый оксид кадмия Cd. O. § Гидроксид кадмия Cd(OH)2 в отличие от гидроксида цинка не обладает заметно выраженными кислотными свойствами и практически не растворяется в щелочах. § Из солей кадмия следует выделить сульфид кадмия Cd. S, выпадающий в виде желтого осадка из растворов солей кадмия при действии сероводорода. § Все растворимые в воде и в разбавленных кислотах соединения кадмия ядовиты. Весьма опасно также вдыхание воздуха, содержащего "дым" оксида кадмия.
 Промышленное применение кадмия (по Ф. Корте, 1997) § Металлический кадмий и его соединения применяются преимущественно для производства пигментом, нанесения защитных противокоррозионных покрытий, в качестве стабилизатора пластмасс (особенно поливинилхлорида - ПВХ), для изготовления аккумуляторов, сплавов. § Пигменты. Сульфид кадмия (Cd. S) и селенид кадмия (Cd. Se) представляют собой термически устойчивые красители соответственно желтого и красного цвета. Вместе с сульфатом бария (Ba. SO 4) они могут передавать любые оттенки цвета от желтого до красного и поэтому применяются в полиграфии, при производстве красок, лаков и резиновых изделий, а также для окраски кожи. Оксид кадмия (Cd. O) и карбонат кадмия (Cd. CO 3) находят применение для окраски стекла, эмалей и глазури на керамике.
Промышленное применение кадмия (по Ф. Корте, 1997) § Металлический кадмий и его соединения применяются преимущественно для производства пигментом, нанесения защитных противокоррозионных покрытий, в качестве стабилизатора пластмасс (особенно поливинилхлорида - ПВХ), для изготовления аккумуляторов, сплавов. § Пигменты. Сульфид кадмия (Cd. S) и селенид кадмия (Cd. Se) представляют собой термически устойчивые красители соответственно желтого и красного цвета. Вместе с сульфатом бария (Ba. SO 4) они могут передавать любые оттенки цвета от желтого до красного и поэтому применяются в полиграфии, при производстве красок, лаков и резиновых изделий, а также для окраски кожи. Оксид кадмия (Cd. O) и карбонат кадмия (Cd. CO 3) находят применение для окраски стекла, эмалей и глазури на керамике.
 Промышленное применение кадмия (по Ф. Корте, 1997) § Гальванические процессы. Кадмирование существенно снижает коррозию на поверхности металлов (применяется, например, в автомобилестроении). § Стабилизаторы. При переработке пластмасс, особенно ПВХ, важную роль играют кадмиевые соли жирных кислот. Термические нагрузки в этом процессе приводят к дегидро- хлорированию и автоокислению макромолекул под действием отщепленного хлороводорода. Добавка солей металлов - карбоксилатов кадмия или свинца - приводит к ингибированию дегидрохлорирования в макромолекуле и замедляет (стабилизирует) автоокисление. Изделия из ПВХ могут содержать до 0. 05 -0. 10 % кадмия.
Промышленное применение кадмия (по Ф. Корте, 1997) § Гальванические процессы. Кадмирование существенно снижает коррозию на поверхности металлов (применяется, например, в автомобилестроении). § Стабилизаторы. При переработке пластмасс, особенно ПВХ, важную роль играют кадмиевые соли жирных кислот. Термические нагрузки в этом процессе приводят к дегидро- хлорированию и автоокислению макромолекул под действием отщепленного хлороводорода. Добавка солей металлов - карбоксилатов кадмия или свинца - приводит к ингибированию дегидрохлорирования в макромолекуле и замедляет (стабилизирует) автоокисление. Изделия из ПВХ могут содержать до 0. 05 -0. 10 % кадмия.
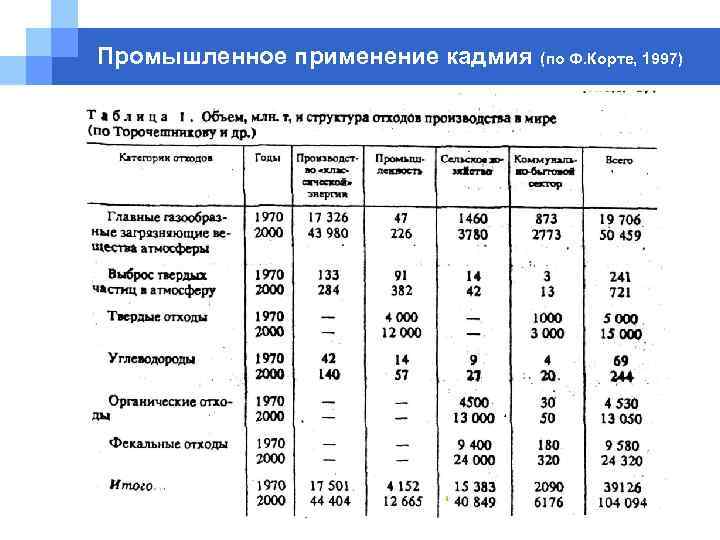
 Промышленное применение кадмия (по Ф. Корте, 1997) § Аккумуляторы. Никель-кадмиевые аккумуляторы и соответствующие батареи, составленные из них, находят широкое применение благодаря их высоким потребительским характеристикам: высокая удельная энергия, большой ресурс работы, высокая скорость подзарядки и возможность использования в широком температурном диапазоне. Используются в авиационных двигателях, телефонных системах, бытовой электронике. § Сплавы меди с кадмием (0. 3 -1. 0 % Cd) используются в электрических кабелях, автомобильных радиаторах и теплообменниках. Сводка различных применений кадмия приведены в табл. 1.
Промышленное применение кадмия (по Ф. Корте, 1997) § Аккумуляторы. Никель-кадмиевые аккумуляторы и соответствующие батареи, составленные из них, находят широкое применение благодаря их высоким потребительским характеристикам: высокая удельная энергия, большой ресурс работы, высокая скорость подзарядки и возможность использования в широком температурном диапазоне. Используются в авиационных двигателях, телефонных системах, бытовой электронике. § Сплавы меди с кадмием (0. 3 -1. 0 % Cd) используются в электрических кабелях, автомобильных радиаторах и теплообменниках. Сводка различных применений кадмия приведены в табл. 1.
 Промышленное применение кадмия (по Ф. Корте, 1997)
Промышленное применение кадмия (по Ф. Корте, 1997)
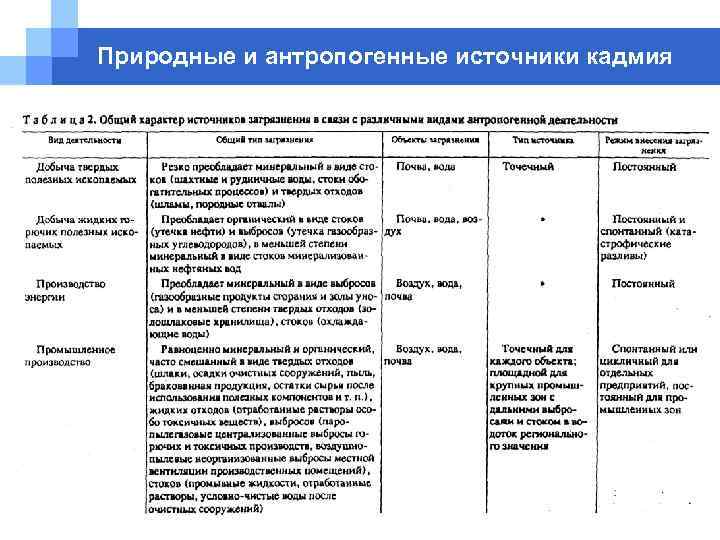
 Природные и антропогенные источники кадмия § Естественные источники эмиссии кадмия приводят к фоновому загрязнению окружающей среды в очень малой концентрации. Содержание кадмия в атмосфере составляет 1 нг/м 3 за счет естественного образования пыли при ветровой эрозии, извержениях вулканов, лесных пожарах, выноса аэрозолей морской воды. Незагрязненная морская вода содержит менее 0. 1 мкг Cd в литре, речная вода - < 0. 02 мкг/л, а незагрязненная почва - около 0. 1 мг на 1 кг сухой массы (Корте, 1997; Исидоров, 1997). § Антропогенные источники. Кадмий в атмосфере. Важнейшими антропогенными источниками эмиссии кадмия в атмосферу являются сжигание горючих ископаемых (угля и нефти), сжигание мусора, а также производство стали, предприятия по добыче цинка, гальваническое производство.
Природные и антропогенные источники кадмия § Естественные источники эмиссии кадмия приводят к фоновому загрязнению окружающей среды в очень малой концентрации. Содержание кадмия в атмосфере составляет 1 нг/м 3 за счет естественного образования пыли при ветровой эрозии, извержениях вулканов, лесных пожарах, выноса аэрозолей морской воды. Незагрязненная морская вода содержит менее 0. 1 мкг Cd в литре, речная вода - < 0. 02 мкг/л, а незагрязненная почва - около 0. 1 мг на 1 кг сухой массы (Корте, 1997; Исидоров, 1997). § Антропогенные источники. Кадмий в атмосфере. Важнейшими антропогенными источниками эмиссии кадмия в атмосферу являются сжигание горючих ископаемых (угля и нефти), сжигание мусора, а также производство стали, предприятия по добыче цинка, гальваническое производство.
 Природные и антропогенные источники кадмия § Кадмий в воде. Наряду с геохимическими источниками кадмия загрязнение вод вызывается атмосферными осадками, сточными водами промышленных предприятий, вымыванием кадмия из с/х угодий и просачивающихся вод из хранилищ отходов (свалок), а также водами из очистных сооружений. § Содержание кадмия в незагрязненных внутренних водах, как правило, составляет ~1 мкг/л, в то время как среднее содержание в озерной воде ~ в 10 раз меньше. В поверхностных водах кадмий содержится преимущественно в веществах, адсорбированных на взвешенных в воде частицах, и лишь 25 -30% его растворены в воде. При очистке воды ~5 -40% кадмия (1 -10 мкг/л) не улавливаются на очистных сооружениях. Осаждение из воздуха (1 -7 мкг/л), вымывание из с/х угодий (0. 1 -0. 5 мкг/л) и вод просачивающихся со свалок (<1 мкг/л), суммарно могут привести к появлению высоких локальных концентраций.
Природные и антропогенные источники кадмия § Кадмий в воде. Наряду с геохимическими источниками кадмия загрязнение вод вызывается атмосферными осадками, сточными водами промышленных предприятий, вымыванием кадмия из с/х угодий и просачивающихся вод из хранилищ отходов (свалок), а также водами из очистных сооружений. § Содержание кадмия в незагрязненных внутренних водах, как правило, составляет ~1 мкг/л, в то время как среднее содержание в озерной воде ~ в 10 раз меньше. В поверхностных водах кадмий содержится преимущественно в веществах, адсорбированных на взвешенных в воде частицах, и лишь 25 -30% его растворены в воде. При очистке воды ~5 -40% кадмия (1 -10 мкг/л) не улавливаются на очистных сооружениях. Осаждение из воздуха (1 -7 мкг/л), вымывание из с/х угодий (0. 1 -0. 5 мкг/л) и вод просачивающихся со свалок (<1 мкг/л), суммарно могут привести к появлению высоких локальных концентраций.
 Природные и антропогенные источники кадмия § Кадмий в воде. Поступающий в реки кадмий на 30 -40% осаждается в донном иле. При образовании ила из взвешенных в воде частиц кадмия отношение между количеством кадмия, накапливающимся в иле, к количеству кадмия, растворенному в воде, составляет 30000. На связывание кадмия с илистым осадком влияют р. Н воды и осадка, окислительно-восстановительный потенциал и ионная концентрация. В незагрязненных донных осадках содержание Cd равно 0. 3 -0. 7 мг/кг, а критическим считается значение 3 мг/кг. Такое количество кадмия, например, содержится в донных осадках Рейна, Везера, Эльбы (Корте, 1997). На 500 м ниже по течению реки от предприятий, перерабатывающих Cd, речные отложения могут содержать до 8*104 мкг Cd на 1 кг сухой массы, а вода - 4 мкг/л Cd (Корте, 1997). В основном связывание ТМ в речных водах происходит преимущественно на глинистых частицах размером <63 мкм.
Природные и антропогенные источники кадмия § Кадмий в воде. Поступающий в реки кадмий на 30 -40% осаждается в донном иле. При образовании ила из взвешенных в воде частиц кадмия отношение между количеством кадмия, накапливающимся в иле, к количеству кадмия, растворенному в воде, составляет 30000. На связывание кадмия с илистым осадком влияют р. Н воды и осадка, окислительно-восстановительный потенциал и ионная концентрация. В незагрязненных донных осадках содержание Cd равно 0. 3 -0. 7 мг/кг, а критическим считается значение 3 мг/кг. Такое количество кадмия, например, содержится в донных осадках Рейна, Везера, Эльбы (Корте, 1997). На 500 м ниже по течению реки от предприятий, перерабатывающих Cd, речные отложения могут содержать до 8*104 мкг Cd на 1 кг сухой массы, а вода - 4 мкг/л Cd (Корте, 1997). В основном связывание ТМ в речных водах происходит преимущественно на глинистых частицах размером <63 мкм.
 Природные и антропогенные источники кадмия § Кадмий в почве. Естественное содержание Cd в почве (в пахотном слое 20 см) составляет около 0. 1 мг/кг или 0. 3 кг/га (Корте, 1997). Вследствие усиленного внесения кадмия в почву за последние десятилетия к 1970 г. его содержание в землях стран ЕС составило от 0. 16 до 0. 32 мг/кг почвы, или 0. 48 -0. 96 кг/га (Корте, 1997). осаждение из воздуха ~3 -5 г/га в год Основные источники поступления из очистного поступления кадмия биологического ила в почву: ~ 1 г/га поступления из фосфорных удобрений ~5 -6 г/га
Природные и антропогенные источники кадмия § Кадмий в почве. Естественное содержание Cd в почве (в пахотном слое 20 см) составляет около 0. 1 мг/кг или 0. 3 кг/га (Корте, 1997). Вследствие усиленного внесения кадмия в почву за последние десятилетия к 1970 г. его содержание в землях стран ЕС составило от 0. 16 до 0. 32 мг/кг почвы, или 0. 48 -0. 96 кг/га (Корте, 1997). осаждение из воздуха ~3 -5 г/га в год Основные источники поступления из очистного поступления кадмия биологического ила в почву: ~ 1 г/га поступления из фосфорных удобрений ~5 -6 г/га
 Природные и антропогенные источники кадмия § Кадмий в почве. Другим важным источником загрязнения с/х угодий кадмием являются фосфорные удобрения, которые в зависимости от типа месторождения фосфатного сырья могут содержать Cd в количестве от 0. 1 до 90 мг/кг. Часть этого кадмия остается в удобрениях, а остальное его количество попадает в побочный продукт производства фосфорной кислоты - гипс (Ca. SO 4). В последнее время большое внимание стали уделять тому обстоятельству, что в биологическом иле, который вносится в почву для ее улучшения, обнаруживается повышенная концентрация кадмия. Около 90% Cd, имеющегося в сточных водах, переходит в биологический ил: 30% при первоначальном осаждении и 60 -70% при его дальнейшей обработке.
Природные и антропогенные источники кадмия § Кадмий в почве. Другим важным источником загрязнения с/х угодий кадмием являются фосфорные удобрения, которые в зависимости от типа месторождения фосфатного сырья могут содержать Cd в количестве от 0. 1 до 90 мг/кг. Часть этого кадмия остается в удобрениях, а остальное его количество попадает в побочный продукт производства фосфорной кислоты - гипс (Ca. SO 4). В последнее время большое внимание стали уделять тому обстоятельству, что в биологическом иле, который вносится в почву для ее улучшения, обнаруживается повышенная концентрация кадмия. Около 90% Cd, имеющегося в сточных водах, переходит в биологический ил: 30% при первоначальном осаждении и 60 -70% при его дальнейшей обработке.
 Природные и антропогенные источники кадмия
Природные и антропогенные источники кадмия
 Поведение кадмия в окружающей среде § Хотя кадмий является одним из наиболее изученных ТМ, имеется относительно мало информации о химической структуре его соединений и взаимодействиях антропогенного кадмия. В последнее время предпринимаются усилия для выявления в окружающей среде различных соединений кадмия. § Так, мало известно о путях связывания кадмия в атмосфере. Известно лишь, что Cd присоединяется в основном к частицам пыли, которые могут проникать в организм при дыхании. При сухом или влажном осаждении кадмия из атмосферы растения также загрязняются, причем часть Cd может проникать в листья через кутикулы.
Поведение кадмия в окружающей среде § Хотя кадмий является одним из наиболее изученных ТМ, имеется относительно мало информации о химической структуре его соединений и взаимодействиях антропогенного кадмия. В последнее время предпринимаются усилия для выявления в окружающей среде различных соединений кадмия. § Так, мало известно о путях связывания кадмия в атмосфере. Известно лишь, что Cd присоединяется в основном к частицам пыли, которые могут проникать в организм при дыхании. При сухом или влажном осаждении кадмия из атмосферы растения также загрязняются, причем часть Cd может проникать в листья через кутикулы.
 Поведение кадмия в окружающей среде § В водных системах часть кадмия находится в донных осадках и не оказывает токсического действия. Однако изменение физико-химических параметров системы в результате антропогенных и природных воздействий может высвободить Cd и сделать его биологически активным. На зависимость эффекта воздействия от дозы влияют различные факторы окружающей среды. Снижение жесткости воды, концентрации растворенного кислорода и р. Н вызывают снижение ЛК 50 (летальная концентрация - средняя концентрация вещества в воздухе или воде, при которой 50% организмов погибает за время испытания). Из всех испытанных водных организмов наиболее чувствительными к кадмию оказались лососевые. Очень чувствительны также дафнии. Токсический эффект у пресноводных наблюдается уже при концентрациях 1 -2 мкг/л, в то время как у морских организмов проявляется при концентрации 7 -100 мкг/л (Корте, 1997).
Поведение кадмия в окружающей среде § В водных системах часть кадмия находится в донных осадках и не оказывает токсического действия. Однако изменение физико-химических параметров системы в результате антропогенных и природных воздействий может высвободить Cd и сделать его биологически активным. На зависимость эффекта воздействия от дозы влияют различные факторы окружающей среды. Снижение жесткости воды, концентрации растворенного кислорода и р. Н вызывают снижение ЛК 50 (летальная концентрация - средняя концентрация вещества в воздухе или воде, при которой 50% организмов погибает за время испытания). Из всех испытанных водных организмов наиболее чувствительными к кадмию оказались лососевые. Очень чувствительны также дафнии. Токсический эффект у пресноводных наблюдается уже при концентрациях 1 -2 мкг/л, в то время как у морских организмов проявляется при концентрации 7 -100 мкг/л (Корте, 1997).
 Поведение кадмия в окружающей среде § Поведение кадмия в наземных системах определяется теми факторами, которые влияют на его подвижность и усвояемость биологическими объектами. Основными параметрами, определяющими содержание Cd в почвенных растворах или его сорбцию почвенными минералами и органическими компонентами, являются р. Н и вид почвы, а также присутствие других элементов, прежде всего Ca (могут происходить процессы замещения или обмена Ca на Cd и наоборот). В почвенных растворах концентрация кадмия может составлять от 0. 1 до 1. 0 мкг/л. В верхних слоях почвы, глубиной до 25 см, в зависимости от концентрации и типа почвы элемент может удерживаться в течение 25 -50 лет, а в отдельных случаях даже 200 -800 лет (Корте, 1997).
Поведение кадмия в окружающей среде § Поведение кадмия в наземных системах определяется теми факторами, которые влияют на его подвижность и усвояемость биологическими объектами. Основными параметрами, определяющими содержание Cd в почвенных растворах или его сорбцию почвенными минералами и органическими компонентами, являются р. Н и вид почвы, а также присутствие других элементов, прежде всего Ca (могут происходить процессы замещения или обмена Ca на Cd и наоборот). В почвенных растворах концентрация кадмия может составлять от 0. 1 до 1. 0 мкг/л. В верхних слоях почвы, глубиной до 25 см, в зависимости от концентрации и типа почвы элемент может удерживаться в течение 25 -50 лет, а в отдельных случаях даже 200 -800 лет (Корте, 1997).
 Поведение кадмия в окружающей среде § Отрицательное воздействие высоких концентраций микроэлементов (в том числе Cd) на растения зависит не только от общего содержания элементов, но и от типа почв и вида растений. Сильнее токсическое действие ТМ сказывается на кислых подзолистых почвах. Слабее оно проявляется на окультуренных подзолистых почвах, еще меньше - на черноземах. Вероятно, одной из причин этого действия является интенсивное поглощение металлов глинистыми минералами и гумусом почв. § Зависимость поглощения кадмия из почвы (перенос почва/растение) зависит от р. Н почвы, определяющего растворимость и сорбцию этого элемента. § Поглощение кадмия растениями из почвы зависит не только от вида растения, и длительности его роста, но и от содержания Cd в почве.
Поведение кадмия в окружающей среде § Отрицательное воздействие высоких концентраций микроэлементов (в том числе Cd) на растения зависит не только от общего содержания элементов, но и от типа почв и вида растений. Сильнее токсическое действие ТМ сказывается на кислых подзолистых почвах. Слабее оно проявляется на окультуренных подзолистых почвах, еще меньше - на черноземах. Вероятно, одной из причин этого действия является интенсивное поглощение металлов глинистыми минералами и гумусом почв. § Зависимость поглощения кадмия из почвы (перенос почва/растение) зависит от р. Н почвы, определяющего растворимость и сорбцию этого элемента. § Поглощение кадмия растениями из почвы зависит не только от вида растения, и длительности его роста, но и от содержания Cd в почве.
 Поведение кадмия в окружающей среде § Основное загрязнение кадмием организма животных происходит за счет поступления с пищей (пероральным путем). Поступлением металла через легкие (пульмональным путем) практически можно пренебречь. У животных ресорбция ( ресорбция - перенос вредного вещества с поверхности тела организма, например с кожи, легких, желудочно-кишечного тракта во внутренние ткани) кадмия из корма относительно невелика, что показано радиоизотопными методами. Она составляет всего несколько % или еще меньше. Однако, если кадмий поступает через дыхательные пути, степень удерживания, особенно у млекопитающих, составляет 10 -40% от всего количества вдыхаемого металла, из которых около 40% ресорбируется организмом. "Время полураспада" процесса выведения кадмия из организма у высших млекопитающих составляет несколько лет (Корте, 1997).
Поведение кадмия в окружающей среде § Основное загрязнение кадмием организма животных происходит за счет поступления с пищей (пероральным путем). Поступлением металла через легкие (пульмональным путем) практически можно пренебречь. У животных ресорбция ( ресорбция - перенос вредного вещества с поверхности тела организма, например с кожи, легких, желудочно-кишечного тракта во внутренние ткани) кадмия из корма относительно невелика, что показано радиоизотопными методами. Она составляет всего несколько % или еще меньше. Однако, если кадмий поступает через дыхательные пути, степень удерживания, особенно у млекопитающих, составляет 10 -40% от всего количества вдыхаемого металла, из которых около 40% ресорбируется организмом. "Время полураспада" процесса выведения кадмия из организма у высших млекопитающих составляет несколько лет (Корте, 1997).
 Поведение кадмия в окружающей среде § На ресорбцию Cd влияют также экзогенные (внешние) факторы. Она зависит, например, от снабжения организма кальцием: при снижении поступления кальция кадмий ресорбируется в большем объеме (т. е удерживается в организме в больших количествах). Так как потребность в кальции больше у молодых растущих животных, чем у взрослых, можно считать, что молодые животные ресорбируют Cd в большем объеме, а следовательно, в большей степени загрязнены этим металлом. § Принимая во внимание различные пути проникновения кадмия в организм человека и степень ресорбции, среднее загрязнение населения кадмием (для развитых стран) составляет (на одного человека в сутки) от 1. 947 до 5. 221 мкг для сельской местности, от 1. 958 до 5. 236 мкг для городов и от 4. 231 до 6. 440 мкг для загрязненных территорий.
Поведение кадмия в окружающей среде § На ресорбцию Cd влияют также экзогенные (внешние) факторы. Она зависит, например, от снабжения организма кальцием: при снижении поступления кальция кадмий ресорбируется в большем объеме (т. е удерживается в организме в больших количествах). Так как потребность в кальции больше у молодых растущих животных, чем у взрослых, можно считать, что молодые животные ресорбируют Cd в большем объеме, а следовательно, в большей степени загрязнены этим металлом. § Принимая во внимание различные пути проникновения кадмия в организм человека и степень ресорбции, среднее загрязнение населения кадмием (для развитых стран) составляет (на одного человека в сутки) от 1. 947 до 5. 221 мкг для сельской местности, от 1. 958 до 5. 236 мкг для городов и от 4. 231 до 6. 440 мкг для загрязненных территорий.
 Поведение кадмия в окружающей среде § Как пример токсического действия кадмия на человека является история возникновения болезни итаи-итаи. Первые случаи заболевания были зарегестрированы в Японии в 1947 г. ; к 1965 от нее погибло около 100 человек и еще большее число людей стало инвалидами. Болезнь начиналась с болей в спине и ногах, приводила к деформации скелета и множественным переломам костей. Возникла она у жителей, длительное время потреблявших рис с содержанием Cd 1 мг/кг, выращиваемый на полях, в оросительные воды которых попадали загрязненные кадмием стоки промышленного предприятия. В условиях дефицита Сa при этом происходило его замещение на Cd в белке, нарушение обмена кальция и фосфора в почках и последующее вымывание их из костей (Исидоров, 1997).
Поведение кадмия в окружающей среде § Как пример токсического действия кадмия на человека является история возникновения болезни итаи-итаи. Первые случаи заболевания были зарегестрированы в Японии в 1947 г. ; к 1965 от нее погибло около 100 человек и еще большее число людей стало инвалидами. Болезнь начиналась с болей в спине и ногах, приводила к деформации скелета и множественным переломам костей. Возникла она у жителей, длительное время потреблявших рис с содержанием Cd 1 мг/кг, выращиваемый на полях, в оросительные воды которых попадали загрязненные кадмием стоки промышленного предприятия. В условиях дефицита Сa при этом происходило его замещение на Cd в белке, нарушение обмена кальция и фосфора в почках и последующее вымывание их из костей (Исидоров, 1997).
 Поведение кадмия в окружающей среде § Приведенный материал демонстрирует опасность кадмия для природных экосистем и человека. При оценке риска следует учитывать, что поглощение этого элемента из объектов окружающей среды определяется, в первую очередь, наличием доступных форм, а не валовым содержанием Cd. Переменные параметры среды, такие как р. Н, химический состав воды или почвы, сильно влияют на степень его поглощения живыми организмами.
Поведение кадмия в окружающей среде § Приведенный материал демонстрирует опасность кадмия для природных экосистем и человека. При оценке риска следует учитывать, что поглощение этого элемента из объектов окружающей среды определяется, в первую очередь, наличием доступных форм, а не валовым содержанием Cd. Переменные параметры среды, такие как р. Н, химический состав воды или почвы, сильно влияют на степень его поглощения живыми организмами.
 Благодарю за внимание!
Благодарю за внимание!
