Иммунопатология Лекция Иммунопатология Иммунодефициты Кафедра патофизиологии Уфа 2017





































































immunopatologia_2017g_2_var.ppt
- Размер: 8.8 Мб
- Автор:
- Количество слайдов: 103
Описание презентации Иммунопатология Лекция Иммунопатология Иммунодефициты Кафедра патофизиологии Уфа 2017 по слайдам
 Иммунопатология Лекция Иммунопатология Иммунодефициты Кафедра патофизиологии Уфа 2017 ФЕДЕРАЛЬНОЕ ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ ВЫСШЕГО ОБРАЗОВАНИЯ «БАШКИРСКИЙ ГОСУДАРСТВЕННЫЙ МЕДИЦИНСКИЙ УНИВЕРСИТЕТ» МИНИСТЕРСТВА ЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
Иммунопатология Лекция Иммунопатология Иммунодефициты Кафедра патофизиологии Уфа 2017 ФЕДЕРАЛЬНОЕ ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ ВЫСШЕГО ОБРАЗОВАНИЯ «БАШКИРСКИЙ ГОСУДАРСТВЕННЫЙ МЕДИЦИНСКИЙ УНИВЕРСИТЕТ» МИНИСТЕРСТВА ЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
 • Организм человека имеет множество механизмов защиты от различных вредных агентов: от неживых веществ, таких, как токсины, химикалии или инородные частицы, и от живых организмов, в том числе (и в первую очередь) от возбудителей инфекционных болезней — вирусов, бактерий, грибов, простейших и гельминтов. Защиту осуществляют две системы: • неспецифическая (сопротивляемость организма) и • специфическая (иммунная система)
• Организм человека имеет множество механизмов защиты от различных вредных агентов: от неживых веществ, таких, как токсины, химикалии или инородные частицы, и от живых организмов, в том числе (и в первую очередь) от возбудителей инфекционных болезней — вирусов, бактерий, грибов, простейших и гельминтов. Защиту осуществляют две системы: • неспецифическая (сопротивляемость организма) и • специфическая (иммунная система)
 • НЕСПЕЦИФИЧЕСКАЯ ЗАЩИТА ОРГАНИЗМА • Линии защиты. Сопротивляемость организма складывается из двух линий защиты. Поверхностные анатомические барьеры (эпителий кожи и слизистых оболочек), находящиеся на границе внутренней и внешней среды, — первая линия неспецифической защиты. Физико-химические и биологические свойства эпителия, а также выделяемые на поверхность эпителия секреторные вещества и клетки не позволяют патогенам попасть во внутреннюю среду организма. • Если же патоген преодолевает этот поверхностный барьер и оказывается во внутренней среде организма, его встречает комплекс клеточных и гуморальных неспецифических факторов. Это вторая линия неспецифической защиты, к которой относятся фагоцитирующие клетки, комплемент, интерфероны, кинины и некоторые другие вещества, а также естественные антитела (антигеннезависимые) и естественные киллеры. В совокупности обе линии защиты составляют врождённые, естественно присущие организму, т. е. конституциональные факторы.
• НЕСПЕЦИФИЧЕСКАЯ ЗАЩИТА ОРГАНИЗМА • Линии защиты. Сопротивляемость организма складывается из двух линий защиты. Поверхностные анатомические барьеры (эпителий кожи и слизистых оболочек), находящиеся на границе внутренней и внешней среды, — первая линия неспецифической защиты. Физико-химические и биологические свойства эпителия, а также выделяемые на поверхность эпителия секреторные вещества и клетки не позволяют патогенам попасть во внутреннюю среду организма. • Если же патоген преодолевает этот поверхностный барьер и оказывается во внутренней среде организма, его встречает комплекс клеточных и гуморальных неспецифических факторов. Это вторая линия неспецифической защиты, к которой относятся фагоцитирующие клетки, комплемент, интерфероны, кинины и некоторые другие вещества, а также естественные антитела (антигеннезависимые) и естественные киллеры. В совокупности обе линии защиты составляют врождённые, естественно присущие организму, т. е. конституциональные факторы.
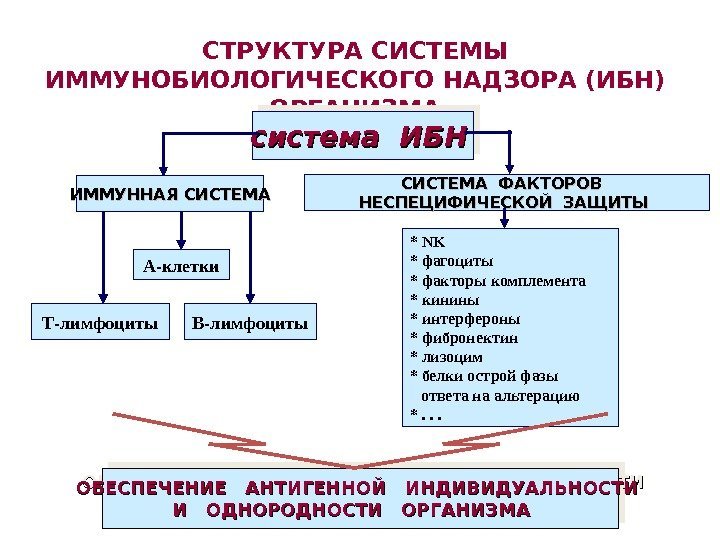
 СТРУКТУРА СИСТЕМЫ ИММУНОБИОЛОГИЧЕСКОГО НАДЗОРА (ИБН) ОРГАНИЗМА система ИБНсистема ИБН ОБЕСПЕЧЕНИЕ АНТИГЕННОЙ ИНДИВИДУАЛЬНОСТИ И ОДНОРОДНОСТИ ОРГАНИЗМАИ ОДНОРОДНОСТИ ОРГАНИЗМА А-клетки Т-лимфоциты В-лимфоциты. ИММУННАЯ СИСТЕМА ФАКТОРОВ НЕСПЕЦИФИЧЕСКОЙ ЗАЩИТЫ * NK * фагоциты * факторы комплемента * кинины * интерфероны * фибронектин * лизоцим * белки острой фазы ответа на альтерацию *. . .
СТРУКТУРА СИСТЕМЫ ИММУНОБИОЛОГИЧЕСКОГО НАДЗОРА (ИБН) ОРГАНИЗМА система ИБНсистема ИБН ОБЕСПЕЧЕНИЕ АНТИГЕННОЙ ИНДИВИДУАЛЬНОСТИ И ОДНОРОДНОСТИ ОРГАНИЗМАИ ОДНОРОДНОСТИ ОРГАНИЗМА А-клетки Т-лимфоциты В-лимфоциты. ИММУННАЯ СИСТЕМА ФАКТОРОВ НЕСПЕЦИФИЧЕСКОЙ ЗАЩИТЫ * NK * фагоциты * факторы комплемента * кинины * интерфероны * фибронектин * лизоцим * белки острой фазы ответа на альтерацию *. . .
 Специфическая и неспецифическая иммунная защита • Неспецифические факторы иммунитета, такие как фагоциты, естественные киллерные клетки и комплемент (особые ферменты) могут бороться с инфекцией как самостоятельно, так и в кооперации со специфической защитой. • Под специфической защитой понимаются специализированные • лимфоциты, которые • могут бороться только • с одним антигеном.
Специфическая и неспецифическая иммунная защита • Неспецифические факторы иммунитета, такие как фагоциты, естественные киллерные клетки и комплемент (особые ферменты) могут бороться с инфекцией как самостоятельно, так и в кооперации со специфической защитой. • Под специфической защитой понимаются специализированные • лимфоциты, которые • могут бороться только • с одним антигеном.
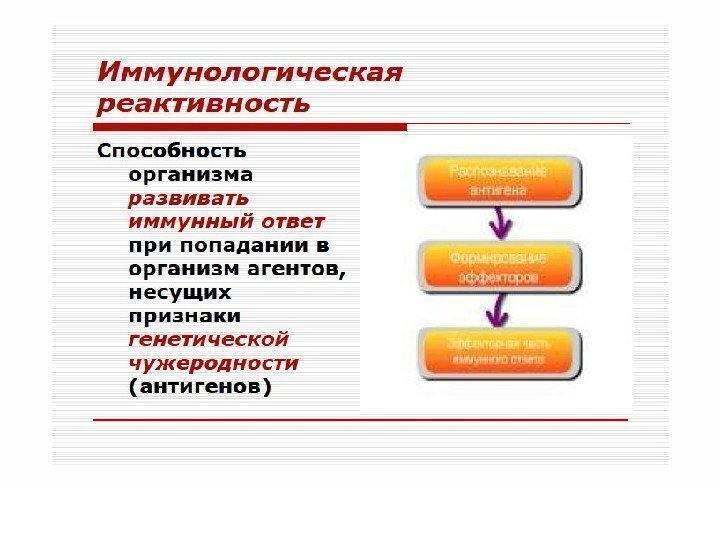
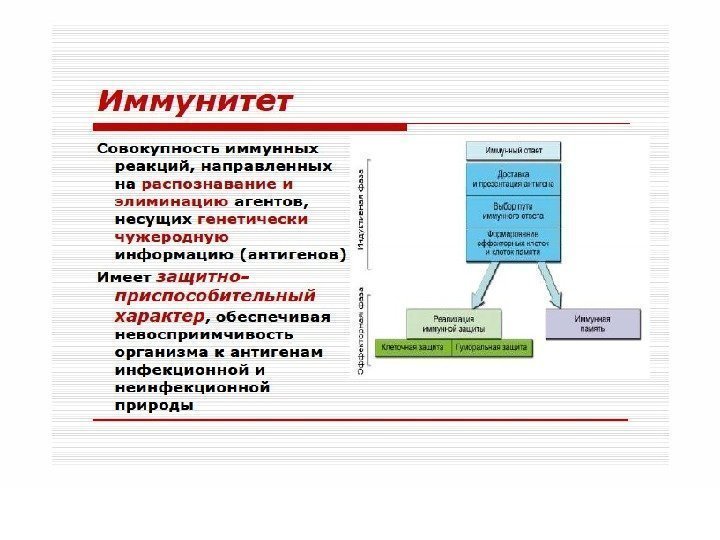
 И М М У Н И Т Е Т • * Физиологическая форма иммуногенной реактивности. • * Формируется в результате реализации наследуемой генетической программы и/или при контакте клеток иммунной системы с чужеродным ей антигеном. • * Обеспечивает постоянный и однородный антигенный состав организма. • * Реализуется путем обнаружения, как правило, деструкции, инактивации и элиминации чужеродного антигена. • * Характеризуется повышенной резистентностью организма к нему.
И М М У Н И Т Е Т • * Физиологическая форма иммуногенной реактивности. • * Формируется в результате реализации наследуемой генетической программы и/или при контакте клеток иммунной системы с чужеродным ей антигеном. • * Обеспечивает постоянный и однородный антигенный состав организма. • * Реализуется путем обнаружения, как правило, деструкции, инактивации и элиминации чужеродного антигена. • * Характеризуется повышенной резистентностью организма к нему.
 А Н Т И Г Е Н (греч. anti — против, genes — порождающий, создающий, вызывающий) * вещество экзо- или эндогенного происхождения, * как правило, вызывающее иммунную реакцию.
А Н Т И Г Е Н (греч. anti — против, genes — порождающий, создающий, вызывающий) * вещество экзо- или эндогенного происхождения, * как правило, вызывающее иммунную реакцию.
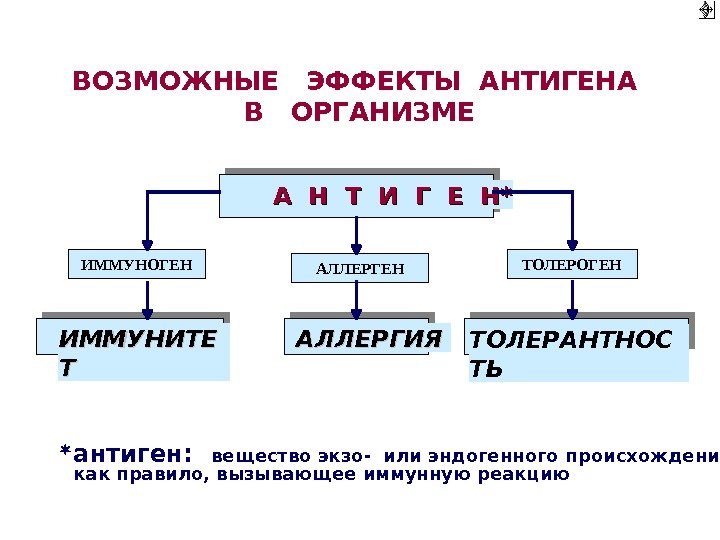
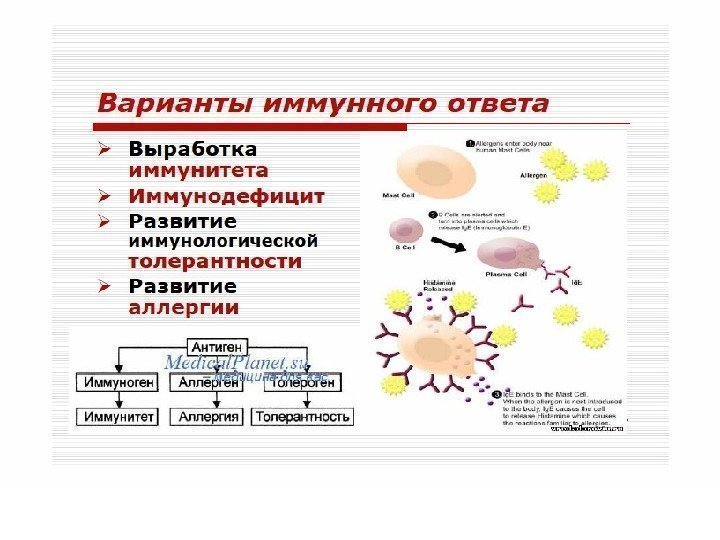
 ВОЗМОЖНЫЕ ЭФФЕКТЫ АНТИГЕНА В ОРГАНИЗМЕ А Н Т И Г Е Н ** ИММУНОГЕН АЛЛЕРГЕН ТОЛЕРОГЕН ИММУНИТЕ Т Т АЛЛЕРГИЯ ТОЛЕРАНТНОС ТЬ антиген: вещество экзо- или эндогенного происхождения, как правило, вызывающее иммунную реакцию
ВОЗМОЖНЫЕ ЭФФЕКТЫ АНТИГЕНА В ОРГАНИЗМЕ А Н Т И Г Е Н ** ИММУНОГЕН АЛЛЕРГЕН ТОЛЕРОГЕН ИММУНИТЕ Т Т АЛЛЕРГИЯ ТОЛЕРАНТНОС ТЬ антиген: вещество экзо- или эндогенного происхождения, как правило, вызывающее иммунную реакцию
 Антитела — это иммуноглобулины, связывающиеся с поверхностными антигенами микроорганизмов и с продуктами их жизнедеятельности (например, с токсинами). Ig. A — препятствует адгезии и проникновению микроорганизмов и токсинов в подслизистую и систему кровообращения. Связанные с Ig. A микробы и токсины удаляются за счет механического клиренса. Ig. A реакция на инфекцию не сопровождается болезнью. Ig. G связываются с микробами и токсинами в глубине тканей или в циркуляторном русле. Они активируют систему комплемента и фагоциты (нейтрофилы), таким образом, уничтожая бактерии и токсины. Ig. G ответ сопровождается болезнью. Ig. E связываются с базофилами и тучными клетками. При встрече с паразитом они вызывают выброс гистамина и других биологически активных веществ из этих клеток. Гистамин привлекает эозинофилы, которые оказывают повреждающее действие на паразитов. При нарушенном иммунном ответе, Ig. E может вырабатываться против непаразитарных антигенов, что приводит к аллергии.
Антитела — это иммуноглобулины, связывающиеся с поверхностными антигенами микроорганизмов и с продуктами их жизнедеятельности (например, с токсинами). Ig. A — препятствует адгезии и проникновению микроорганизмов и токсинов в подслизистую и систему кровообращения. Связанные с Ig. A микробы и токсины удаляются за счет механического клиренса. Ig. A реакция на инфекцию не сопровождается болезнью. Ig. G связываются с микробами и токсинами в глубине тканей или в циркуляторном русле. Они активируют систему комплемента и фагоциты (нейтрофилы), таким образом, уничтожая бактерии и токсины. Ig. G ответ сопровождается болезнью. Ig. E связываются с базофилами и тучными клетками. При встрече с паразитом они вызывают выброс гистамина и других биологически активных веществ из этих клеток. Гистамин привлекает эозинофилы, которые оказывают повреждающее действие на паразитов. При нарушенном иммунном ответе, Ig. E может вырабатываться против непаразитарных антигенов, что приводит к аллергии.
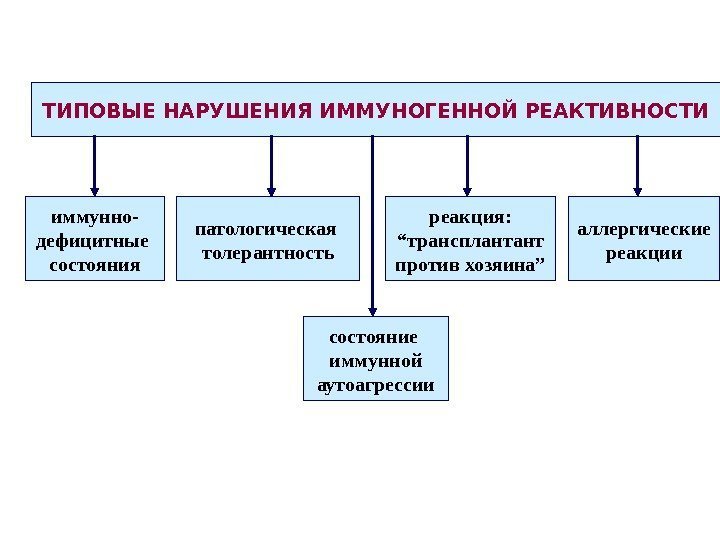
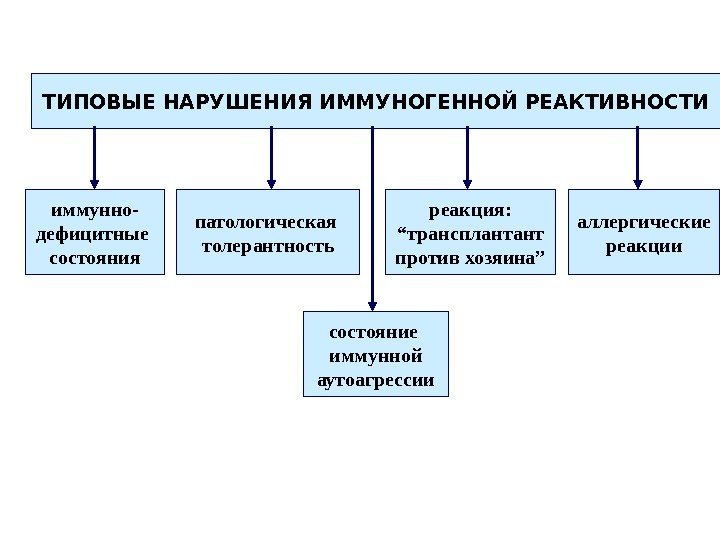
 ТИПОВЫЕ НАРУШЕНИЯ ИММУНОГЕННОЙ РЕАКТИВНОСТИ иммунно- дефицитные состояния реакция: “ трансплантант против хозяина” состояние иммунной аутоагрессиипатологическая толерантность аллергические реакции
ТИПОВЫЕ НАРУШЕНИЯ ИММУНОГЕННОЙ РЕАКТИВНОСТИ иммунно- дефицитные состояния реакция: “ трансплантант против хозяина” состояние иммунной аутоагрессиипатологическая толерантность аллергические реакции
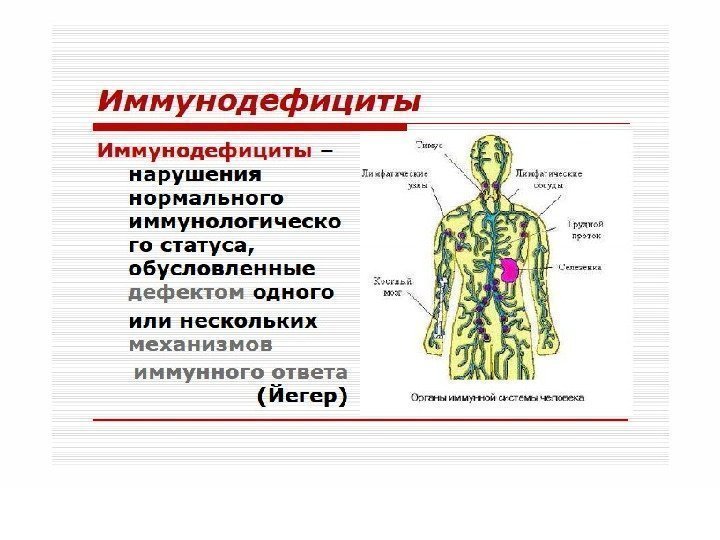
 ИММУНОДЕФИЦИТНЫЕ СОСТОЯНИЯ (ИДС) * Характеризуется снижением эффективности или полной неспособностью её осуществлять реакции обнаружения, деструкции и элиминации чужеродного антигена. * Типовая форма патологии системы иммуно-биологического надзора.
ИММУНОДЕФИЦИТНЫЕ СОСТОЯНИЯ (ИДС) * Характеризуется снижением эффективности или полной неспособностью её осуществлять реакции обнаружения, деструкции и элиминации чужеродного антигена. * Типовая форма патологии системы иммуно-биологического надзора.






































 ТИПОВЫЕ НАРУШЕНИЯ ИММУНОГЕННОЙ РЕАКТИВНОСТИ иммунно- дефицитные состояния реакция: “ трансплантант против хозяина” состояние иммунной аутоагрессиипатологическая толерантность аллергические реакции
ТИПОВЫЕ НАРУШЕНИЯ ИММУНОГЕННОЙ РЕАКТИВНОСТИ иммунно- дефицитные состояния реакция: “ трансплантант против хозяина” состояние иммунной аутоагрессиипатологическая толерантность аллергические реакции
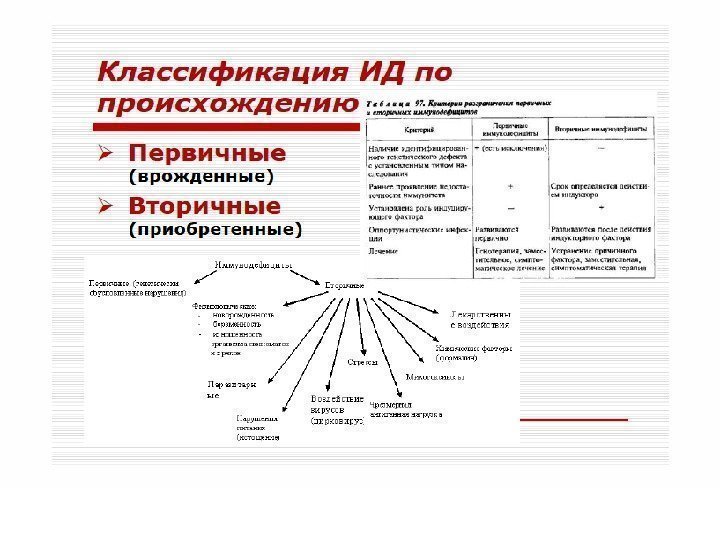
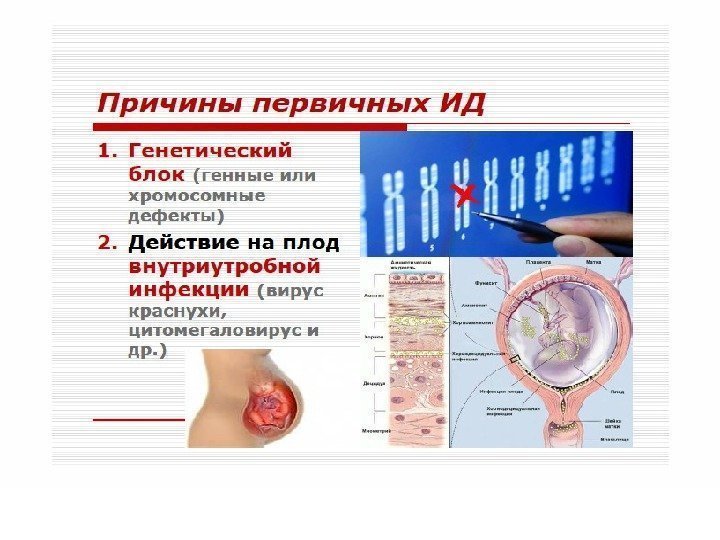
 Различают первичные (наследственные) и вторичные (приобретенные) иммунодефициты. В основе патогенеза первичных лежит, как правило, генетически обусловленный блок развития или выпадение иммунных процессов вследствие дефекта ферментов или мембранных структур.
Различают первичные (наследственные) и вторичные (приобретенные) иммунодефициты. В основе патогенеза первичных лежит, как правило, генетически обусловленный блок развития или выпадение иммунных процессов вследствие дефекта ферментов или мембранных структур.
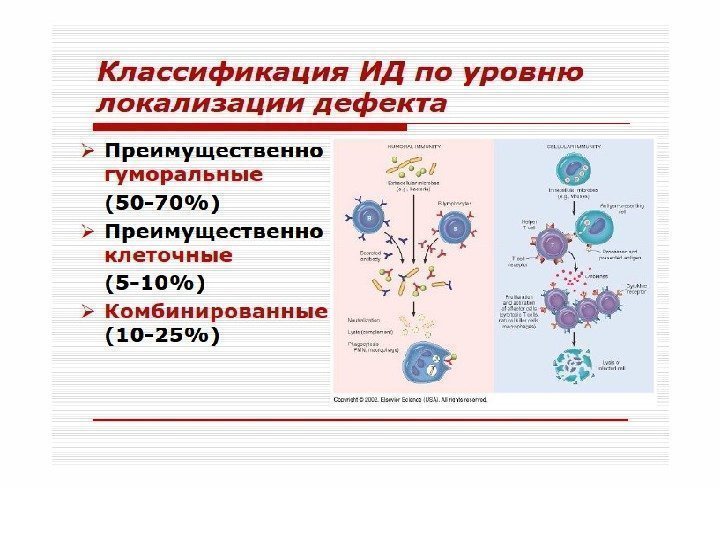
 Согласно классификации, предложенной ВОЗ, в зависимости от преобладающего типа поражений звеньев иммунной системы, различают следующие: 1. комбинированные иммунодефициты с повреждением гуморального (В) и клеточного (Т) звеньев иммунной системы 2. с преимущественным повреждением клеточного (Т) звена иммунной системы 3. с преимущественным повреждением гуморального (В) звена иммунной системы
Согласно классификации, предложенной ВОЗ, в зависимости от преобладающего типа поражений звеньев иммунной системы, различают следующие: 1. комбинированные иммунодефициты с повреждением гуморального (В) и клеточного (Т) звеньев иммунной системы 2. с преимущественным повреждением клеточного (Т) звена иммунной системы 3. с преимущественным повреждением гуморального (В) звена иммунной системы
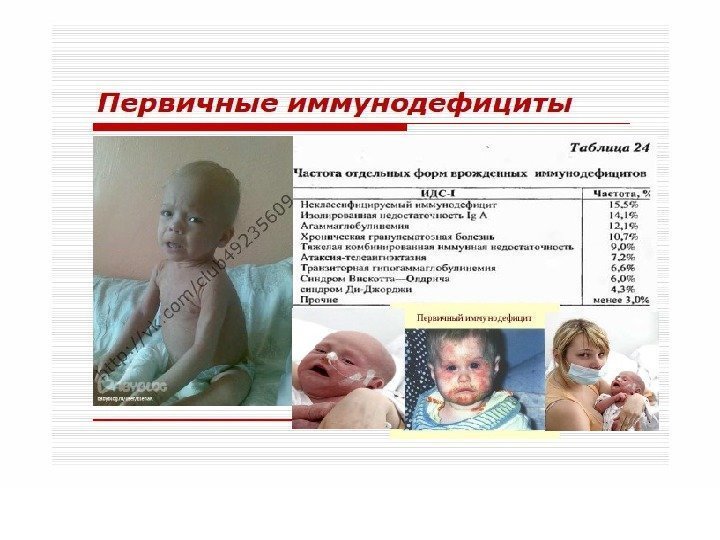
 Первичные иммунодефициты – очень редкие состояния (1 на 1 млн. чел). Являются уделом детского возраста, так как большая часть больных не доживает до 20 лет, а при более легких формах дефекты со временем компенсируются.
Первичные иммунодефициты – очень редкие состояния (1 на 1 млн. чел). Являются уделом детского возраста, так как большая часть больных не доживает до 20 лет, а при более легких формах дефекты со временем компенсируются.

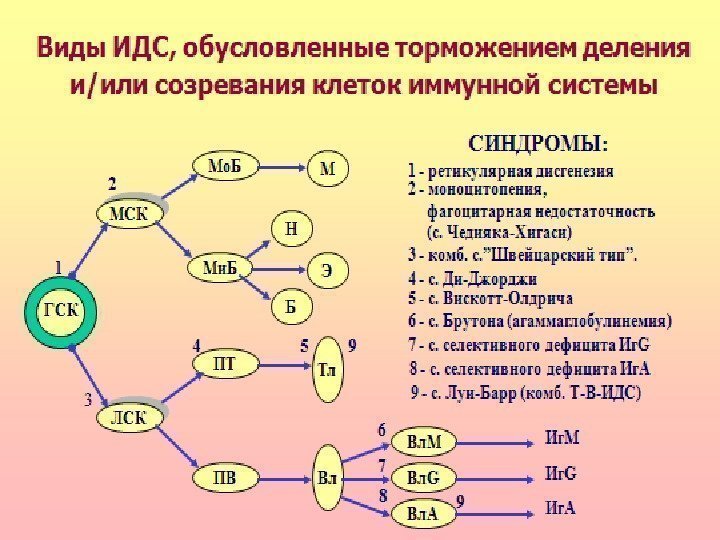
 Комбинированные иммунодефициты Наиболее тяжелая разновидность ИДС – синдром ретикулярной дисгенезии, связанный с нарушением дифференцировки и пролиферации гемопоэтической стволовой клетки. Характеризуется значительным уменьшением в костном мозге стволовых клеток и блоком созревания лимфоцитов и моноцитов всех субсистем. Пациенты погибают, как правило, вскоре после рождения от инфекций (часто от сепсиса) или злокачественных новообразований.
Комбинированные иммунодефициты Наиболее тяжелая разновидность ИДС – синдром ретикулярной дисгенезии, связанный с нарушением дифференцировки и пролиферации гемопоэтической стволовой клетки. Характеризуется значительным уменьшением в костном мозге стволовых клеток и блоком созревания лимфоцитов и моноцитов всех субсистем. Пациенты погибают, как правило, вскоре после рождения от инфекций (часто от сепсиса) или злокачественных новообразований.
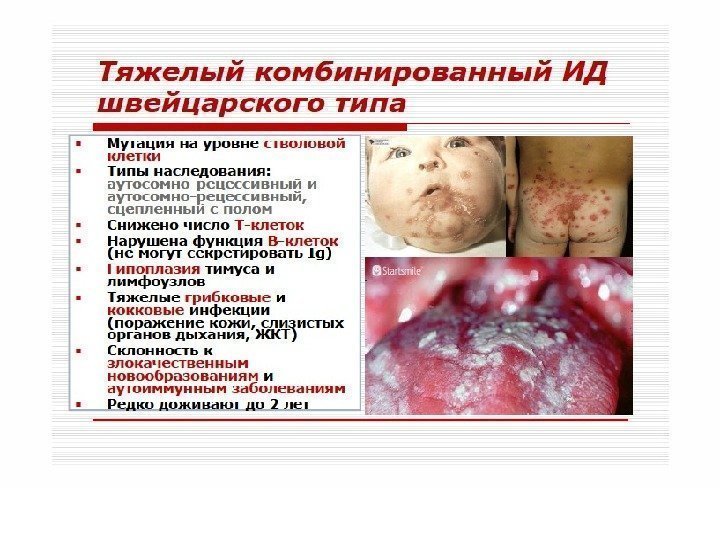
 «Швейцарский тип» агаммаглобулинемии развивается по аутосомно-рецессивному типу. Дефект развития на уровне лимфоидной стволовой клетки – нарушение дифференцировки стволовых клеток, блок созревания Т- и В-лимфоцитов. Количество В-лимфоцитов может быть в пределах нормы, но они не способны синтезировать иммуноглобулины (гипогаммаглобулинемия). Больные погибают в течение первого года жизни от бактериальных, паразитарных, вирусных, грибковых инфекций.
«Швейцарский тип» агаммаглобулинемии развивается по аутосомно-рецессивному типу. Дефект развития на уровне лимфоидной стволовой клетки – нарушение дифференцировки стволовых клеток, блок созревания Т- и В-лимфоцитов. Количество В-лимфоцитов может быть в пределах нормы, но они не способны синтезировать иммуноглобулины (гипогаммаглобулинемия). Больные погибают в течение первого года жизни от бактериальных, паразитарных, вирусных, грибковых инфекций.
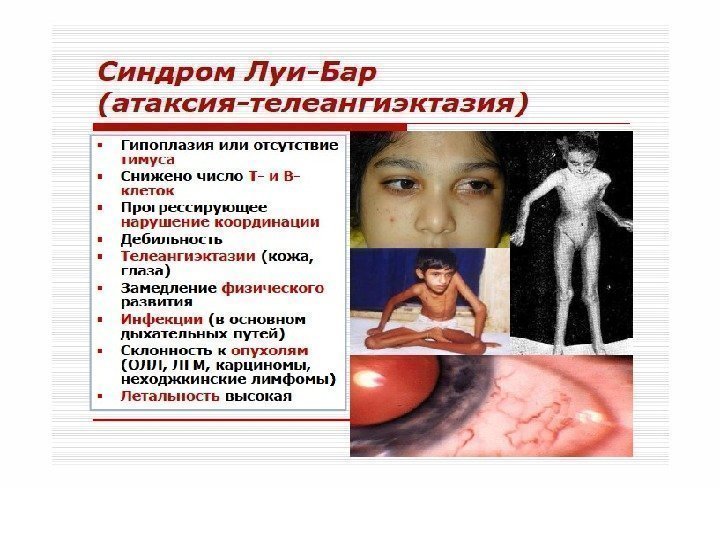
 Синдром Луи-Бар описан в 1941 году. Дефект созревания Т- и В-лимфоцитов (особенно Т-хелперов), резкое снижение их содержания в крови и дефицит иммуноглобулинов классов А, Е, реже G. Пациенты погибают, от инфекций и опухолей.
Синдром Луи-Бар описан в 1941 году. Дефект созревания Т- и В-лимфоцитов (особенно Т-хелперов), резкое снижение их содержания в крови и дефицит иммуноглобулинов классов А, Е, реже G. Пациенты погибают, от инфекций и опухолей.
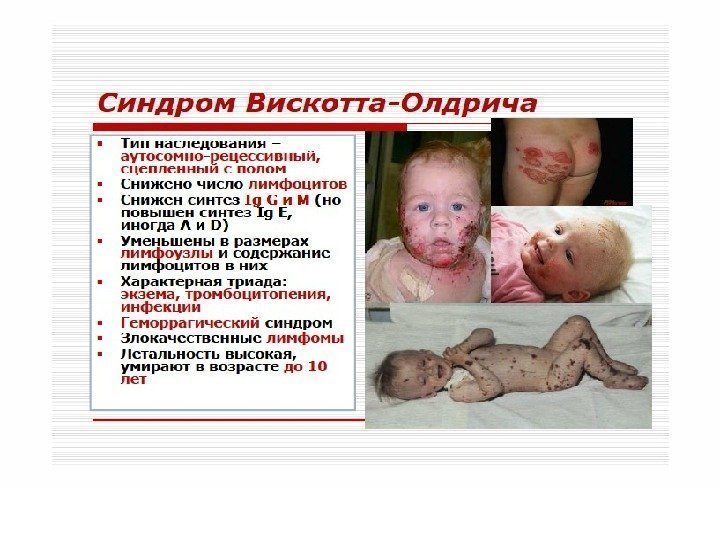
 Синдром Вискотта-Олдрича. Нарушение структуры и физико-химических свойств мембран Т-лимфоцитов. Дефицит Т-лимфоцитов сочетается с гипогаммаглобулинемией дисрегуляторного генеза, тромбоцитопенией с геморрагическим синдромом. Частые вирусные и бактериальные инфекции, аллергические реакции, экзема.
Синдром Вискотта-Олдрича. Нарушение структуры и физико-химических свойств мембран Т-лимфоцитов. Дефицит Т-лимфоцитов сочетается с гипогаммаглобулинемией дисрегуляторного генеза, тромбоцитопенией с геморрагическим синдромом. Частые вирусные и бактериальные инфекции, аллергические реакции, экзема.
 Атаксия-телеангиэктазия. Комбинированный иммунодефицит: недоразвитие вилочковой железы, дефицит Т-клеток и Ig. G 2, Ig. G 4, Ig. E , Ig. A. Неврологическая симптоматика, поражение сосудистой стенки, нарушение пигментации. Это обусловлено нарушением процессов репарации ДНК, дефектами клеточного цикла
Атаксия-телеангиэктазия. Комбинированный иммунодефицит: недоразвитие вилочковой железы, дефицит Т-клеток и Ig. G 2, Ig. G 4, Ig. E , Ig. A. Неврологическая симптоматика, поражение сосудистой стенки, нарушение пигментации. Это обусловлено нарушением процессов репарации ДНК, дефектами клеточного цикла
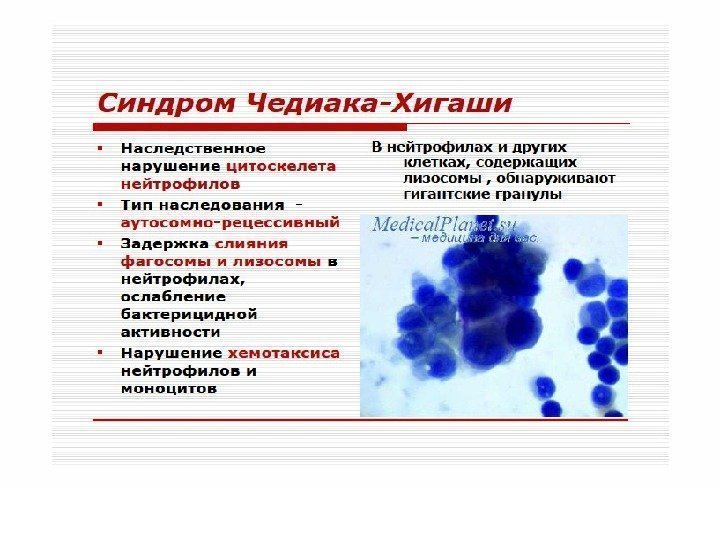
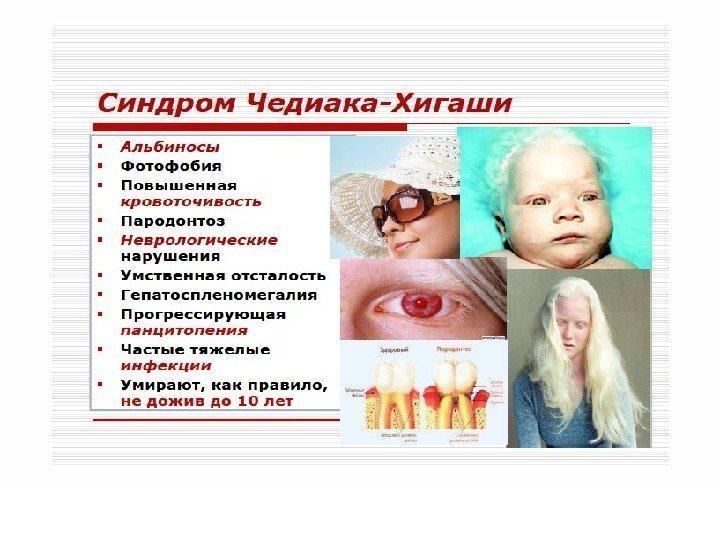
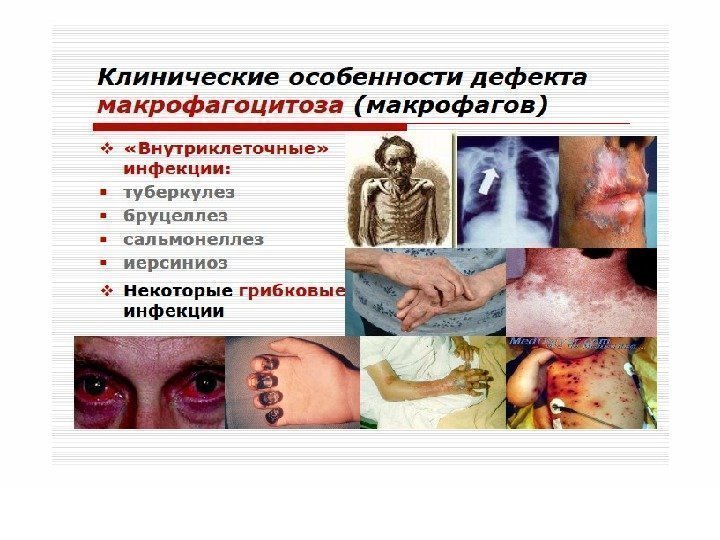
 Клеточные иммунодефициты Синдром Чедиака-Хигаси обусловлен блокадой пролиферации миелостволовых клеток, созревания миело- и монобластов. Сопровождается моноцитопенией, нейтропенией и фагоцитарной недостаточностью, что клинически проявляется частыми хроническими бактериальными инфекциями. Нарушения в субсистеме А-клеток (моноциты, нейтрофилы, эозинофилы, базофилы, т. е. все клетки, способные к фагоцитозу) проявляются фагоцитарной недостаточностью
Клеточные иммунодефициты Синдром Чедиака-Хигаси обусловлен блокадой пролиферации миелостволовых клеток, созревания миело- и монобластов. Сопровождается моноцитопенией, нейтропенией и фагоцитарной недостаточностью, что клинически проявляется частыми хроническими бактериальными инфекциями. Нарушения в субсистеме А-клеток (моноциты, нейтрофилы, эозинофилы, базофилы, т. е. все клетки, способные к фагоцитозу) проявляются фагоцитарной недостаточностью
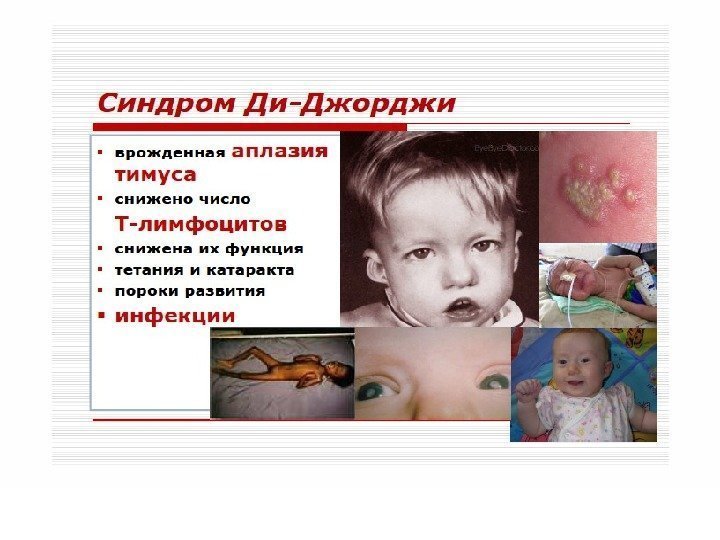
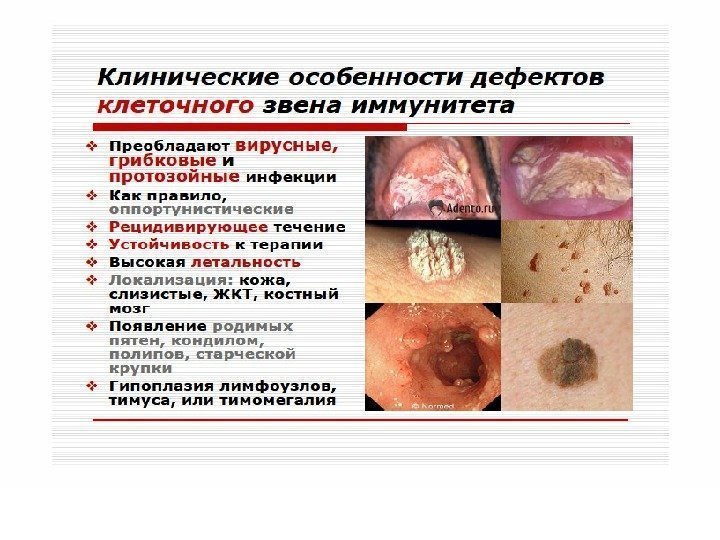
 ИД с преимущественным поражением Т-системы лимфоцитов. Проявляются развитием инфекций с внутриклеточным паразитированием возбудителя (туберкулез, лепра, микозы, вирусные инфекции). Клиническим проявлением является синдром Ди-Джорджи. В основе лежит гипо- или аплазия стромальных элементов вилочковой и паращитовидной желез. Значительный дефицит Т-лимфоцитов. Чаще болеют девочки. Заболевание характеризуется гипокальциемией, судорогами, рецидивирующими инфекциями дыхательных и мочевыводящих путей.
ИД с преимущественным поражением Т-системы лимфоцитов. Проявляются развитием инфекций с внутриклеточным паразитированием возбудителя (туберкулез, лепра, микозы, вирусные инфекции). Клиническим проявлением является синдром Ди-Джорджи. В основе лежит гипо- или аплазия стромальных элементов вилочковой и паращитовидной желез. Значительный дефицит Т-лимфоцитов. Чаще болеют девочки. Заболевание характеризуется гипокальциемией, судорогами, рецидивирующими инфекциями дыхательных и мочевыводящих путей.
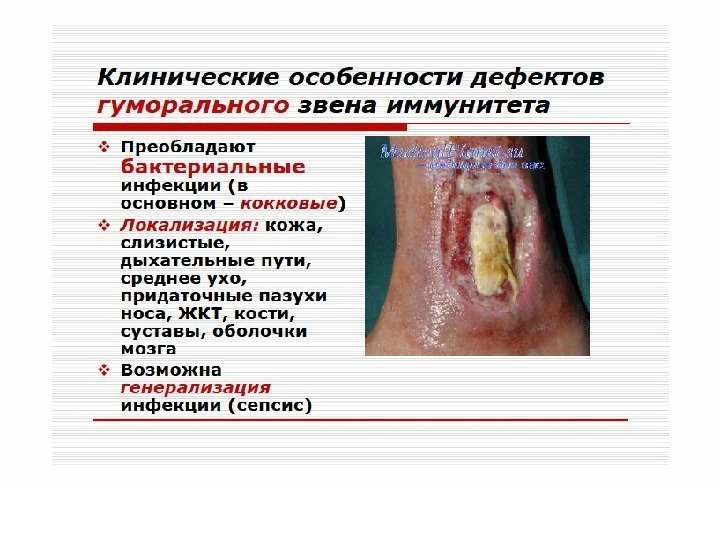
 Гуморальные иммунодефициты — характеризуются нормальным уровнем Вл, но пониженной их функциональной активностью. Клеточный иммунитет сохранен. У больных отмечается частое развитие гнойных инфекций (стрептококовых, пневмококковых), аутоиммунных процессов, диареи
Гуморальные иммунодефициты — характеризуются нормальным уровнем Вл, но пониженной их функциональной активностью. Клеточный иммунитет сохранен. У больных отмечается частое развитие гнойных инфекций (стрептококовых, пневмококковых), аутоиммунных процессов, диареи
 Синдром Брутона. Описан в 1952 году. Наследственный дефект дифференцировки В-лимфоцитов, сцепленный с Х-хромосомой сопровождающийся гипо- или агаммаглобулинемией. В основе патогенеза лежит мутация гена, контролирующего синтез фермента тирозинкиназы. Отсутствие этого фермента нарушает образование антигенраспознающих рецепторов Вл.
Синдром Брутона. Описан в 1952 году. Наследственный дефект дифференцировки В-лимфоцитов, сцепленный с Х-хромосомой сопровождающийся гипо- или агаммаглобулинемией. В основе патогенеза лежит мутация гена, контролирующего синтез фермента тирозинкиназы. Отсутствие этого фермента нарушает образование антигенраспознающих рецепторов Вл.
 Снижена резистентность организма к стафилококку, стрептококку, пневмококку, кишечной палочке, сальмонеллам, протею, вирусным инфекциям, особенно к вирусу полиомиелита. Селективные дефициты Ig. A , Ig. G – гипогаммаглобулинемии. Частые рецидивирующие инфекции верхних дыхательных путей, желудочно-кишечного тракта, конъюнктивы.
Снижена резистентность организма к стафилококку, стрептококку, пневмококку, кишечной палочке, сальмонеллам, протею, вирусным инфекциям, особенно к вирусу полиомиелита. Селективные дефициты Ig. A , Ig. G – гипогаммаглобулинемии. Частые рецидивирующие инфекции верхних дыхательных путей, желудочно-кишечного тракта, конъюнктивы.
 Приобретенные (вторичные) иммунодефициты Они развиваются под влиянием различных повреждающих факторов физического, химического или биологического характера. К развитию гуморального вторичного ИДС часто приводят заболевания, сопровождающиеся потерей белков или нарушением их синтеза: ожоговая болезнь, хроническая почечная и печеночная недостаточность.
Приобретенные (вторичные) иммунодефициты Они развиваются под влиянием различных повреждающих факторов физического, химического или биологического характера. К развитию гуморального вторичного ИДС часто приводят заболевания, сопровождающиеся потерей белков или нарушением их синтеза: ожоговая болезнь, хроническая почечная и печеночная недостаточность.
 К развитию клеточного вторичного ИДС приводят тяжелые вирусные инфекции, т. к. вирусы часто имеют тропность к Т-лимфоцитам, грибковые заболевания. Вторичные ИДС могут быть следствием действия повреждающих факторов (радиация, цитостатики, глюкокортикоиды, антибиотики и пр. ). В то же время, известны физиологические иммунодефициты, свойственные раннему постнатальному и старческому возрастам, связанные с беременностью.
К развитию клеточного вторичного ИДС приводят тяжелые вирусные инфекции, т. к. вирусы часто имеют тропность к Т-лимфоцитам, грибковые заболевания. Вторичные ИДС могут быть следствием действия повреждающих факторов (радиация, цитостатики, глюкокортикоиды, антибиотики и пр. ). В то же время, известны физиологические иммунодефициты, свойственные раннему постнатальному и старческому возрастам, связанные с беременностью.
 Физиологический иммунодефицит новорожденных. Он характеризуется неполноценностью клеточного и гуморального звеньев ИО, а также факторов неспецифической резистентности. Большое количество лимфоцитов в периферической крови сочетается со снижением функциональной активности Т- и В-лимфоцитов. В основном образуются Ig. М, а содержание Ig. G и Ig. А снижено и достигает уровня взрослых только к 11 -14 летнему возрасту.
Физиологический иммунодефицит новорожденных. Он характеризуется неполноценностью клеточного и гуморального звеньев ИО, а также факторов неспецифической резистентности. Большое количество лимфоцитов в периферической крови сочетается со снижением функциональной активности Т- и В-лимфоцитов. В основном образуются Ig. М, а содержание Ig. G и Ig. А снижено и достигает уровня взрослых только к 11 -14 летнему возрасту.
 Отмечается низкая фагоцитарная активность и опсонизирующая способность крови. Уровень комплемента снижен и нормализуется к 3 -6 месяцу жизни. Иммунный статус беременных женщин отличается снижением числа и функций Т- и В-лимфоцитов, что, по-видимому, связано с увеличением содержания и активности Т-супрессоров. Это необходимо для подавления иммунного ответа на антигены плода.
Отмечается низкая фагоцитарная активность и опсонизирующая способность крови. Уровень комплемента снижен и нормализуется к 3 -6 месяцу жизни. Иммунный статус беременных женщин отличается снижением числа и функций Т- и В-лимфоцитов, что, по-видимому, связано с увеличением содержания и активности Т-супрессоров. Это необходимо для подавления иммунного ответа на антигены плода.
 При старении снижается активность как гуморального, так и клеточного звеньев иммунитета. Снижаются уровни нормальных антител в крови и способность к их синтезу. Значительно уменьшается выработка антител Ig. G, Ig. А, а также активность неспецифических механизмов защиты. Угнетается синтез Ig. Е, поэтому аллергические реакции протекают не так остро. С возрастом учащаются и становятся более активными аутоиммунные болезни
При старении снижается активность как гуморального, так и клеточного звеньев иммунитета. Снижаются уровни нормальных антител в крови и способность к их синтезу. Значительно уменьшается выработка антител Ig. G, Ig. А, а также активность неспецифических механизмов защиты. Угнетается синтез Ig. Е, поэтому аллергические реакции протекают не так остро. С возрастом учащаются и становятся более активными аутоиммунные болезни
 Синдром приобретенного иммунодефицита СПИД – тяжелое, с летальным исходом заболевание вирусной этиологии, которое поражает иммунную систему организма человека, передается при половом контакте, через кровь, при повреждении кожи и слизистых и проявляется генерализованной лимфаденопатией, оппортунистическими инфекциями (протозойными, грибковыми, бактериальными, вирусными) и онкогенными поражениями.
Синдром приобретенного иммунодефицита СПИД – тяжелое, с летальным исходом заболевание вирусной этиологии, которое поражает иммунную систему организма человека, передается при половом контакте, через кровь, при повреждении кожи и слизистых и проявляется генерализованной лимфаденопатией, оппортунистическими инфекциями (протозойными, грибковыми, бактериальными, вирусными) и онкогенными поражениями.
 Первые случаи заболевания были зарегистрированы в 1981 г. в США. Наиболее высокая инфицированность наблюдается в странах Центральной и Восточной Африки (от 4 до 12 -20%). На втором месте по распространенности заболевания находятся страны американского континента.
Первые случаи заболевания были зарегистрированы в 1981 г. в США. Наиболее высокая инфицированность наблюдается в странах Центральной и Восточной Африки (от 4 до 12 -20%). На втором месте по распространенности заболевания находятся страны американского континента.
 Этиология. Возбудитель СПИДа (AIDS — Acquired Immune Deficiency Syndrome) относится к ретровирусам подсемейства лентивирусов (ВИЧ — HIV от англ. Human immunodeficiency virus). ВИЧ способен к значительной антигенной изменчивости. Мутационная активность его в 5 раз выше, чем вируса гриппа. В организм вирус проникает с кровью и ее дериватами, с клетками при пересадке тканей, со спермой и слюной через поврежденную слизистую.
Этиология. Возбудитель СПИДа (AIDS — Acquired Immune Deficiency Syndrome) относится к ретровирусам подсемейства лентивирусов (ВИЧ — HIV от англ. Human immunodeficiency virus). ВИЧ способен к значительной антигенной изменчивости. Мутационная активность его в 5 раз выше, чем вируса гриппа. В организм вирус проникает с кровью и ее дериватами, с клетками при пересадке тканей, со спермой и слюной через поврежденную слизистую.
 Попав в организм, возбудитель СПИДа внедряется в клетки, богатые рецепторами CD -4, к которым гликопротеиды вирусной оболочки имеют высокий аффинитет. Наиболее богаты этими рецепторами Т-хелперы, но вирус может проникать и в моноциты, клетки глии, нейроны.
Попав в организм, возбудитель СПИДа внедряется в клетки, богатые рецепторами CD -4, к которым гликопротеиды вирусной оболочки имеют высокий аффинитет. Наиболее богаты этими рецепторами Т-хелперы, но вирус может проникать и в моноциты, клетки глии, нейроны.
 Патогенез СПИДа. ВИЧ, инкорпорированный в геноме клеток в форме ДНК провируса, способен стимулировать транскрипцию РНК вируса с помощью ДНК-зависимой РНК-синтетазы клетки. На основе этой РНК синтезируются белковые компоненты вируса, которые затем интегрируют с его нуклеиновой кислотой. После завершения сборки вирусные частицы отторгаются от клетки, попадают в жидкие среды организма и атакуют новые клетки, имеющие рецепторы CD -4, приводя к их гибели.
Патогенез СПИДа. ВИЧ, инкорпорированный в геноме клеток в форме ДНК провируса, способен стимулировать транскрипцию РНК вируса с помощью ДНК-зависимой РНК-синтетазы клетки. На основе этой РНК синтезируются белковые компоненты вируса, которые затем интегрируют с его нуклеиновой кислотой. После завершения сборки вирусные частицы отторгаются от клетки, попадают в жидкие среды организма и атакуют новые клетки, имеющие рецепторы CD -4, приводя к их гибели.


 Массовая гибель Т-хелперов происходит в связи с взаимодействием вирусного белка на поверхности зараженной клетки с рецептором CD -4 на поверхности незараженных клеток. Одна зараженная клетка может присоединить к себе до 500 незараженных. Образуется гигантская нежизнеспособная структура. Инфицированные клетки впоследствии лизируются.
Массовая гибель Т-хелперов происходит в связи с взаимодействием вирусного белка на поверхности зараженной клетки с рецептором CD -4 на поверхности незараженных клеток. Одна зараженная клетка может присоединить к себе до 500 незараженных. Образуется гигантская нежизнеспособная структура. Инфицированные клетки впоследствии лизируются.
 Существует несколько версий о механизмах лизиса клеток, пораженных ВИЧ: 1 — мембраны клеток разрушаются при отпочковывании вируса от клетки. Вероятность гибели клетки пропорциональна количеству рецепторов CD -4 на их поверхности, поэтому количество Т h значительно уменьшается. 2 — рассматривается возможность встраивания белков вирусной оболочки в клеточные мембраны и эти клетки распознаются ИКС как чужеродные и уничтожаются
Существует несколько версий о механизмах лизиса клеток, пораженных ВИЧ: 1 — мембраны клеток разрушаются при отпочковывании вируса от клетки. Вероятность гибели клетки пропорциональна количеству рецепторов CD -4 на их поверхности, поэтому количество Т h значительно уменьшается. 2 — рассматривается возможность встраивания белков вирусной оболочки в клеточные мембраны и эти клетки распознаются ИКС как чужеродные и уничтожаются
 Считают, что встраивание ДНК вируса в геном Т-хелпера лишает их способности к трансформации, созреванию и реагированию на стимулы, в том числе на ИЛ-2. Это вызывает их инактивацию и лизис, особенно Т-хелперов. Именно поэтому развивается лимфопения. Кроме того, снижается количество и функциональная активность естественных NK. Указанные изменения создают предрасположенность больных к инфекциям, опухолям, а также к неспособности к развитию аллергических реакций клеточного типа.
Считают, что встраивание ДНК вируса в геном Т-хелпера лишает их способности к трансформации, созреванию и реагированию на стимулы, в том числе на ИЛ-2. Это вызывает их инактивацию и лизис, особенно Т-хелперов. Именно поэтому развивается лимфопения. Кроме того, снижается количество и функциональная активность естественных NK. Указанные изменения создают предрасположенность больных к инфекциям, опухолям, а также к неспособности к развитию аллергических реакций клеточного типа.
 Клиника (стадии болезни). 1. Инкубационный период длится от 3 -7 нед. до 3 -5 лет и более, он более короток при гомосексуальном и парентеральном путях заражения и у детей, родившихся от больных матерей. После попадания в организм здорового человека вирус начинает интенсивно размножаться. Антитела к ВИЧ могут быть обнаружены уже через 4 -8 нед. после заражения.
Клиника (стадии болезни). 1. Инкубационный период длится от 3 -7 нед. до 3 -5 лет и более, он более короток при гомосексуальном и парентеральном путях заражения и у детей, родившихся от больных матерей. После попадания в организм здорового человека вирус начинает интенсивно размножаться. Антитела к ВИЧ могут быть обнаружены уже через 4 -8 нед. после заражения.
 2. Продромальный период. Характеризуется -перемежающейся или непрерывной лихорадкой (38 -40ºС) неясной этиологии (проливные поты, снижение физической активности). — немотивированной потерей массы тела более 10%, непропорционально уровню питания и физической нагрузке — перемежающейся или непрерывной диареей (не всегда)
2. Продромальный период. Характеризуется -перемежающейся или непрерывной лихорадкой (38 -40ºС) неясной этиологии (проливные поты, снижение физической активности). — немотивированной потерей массы тела более 10%, непропорционально уровню питания и физической нагрузке — перемежающейся или непрерывной диареей (не всегда)
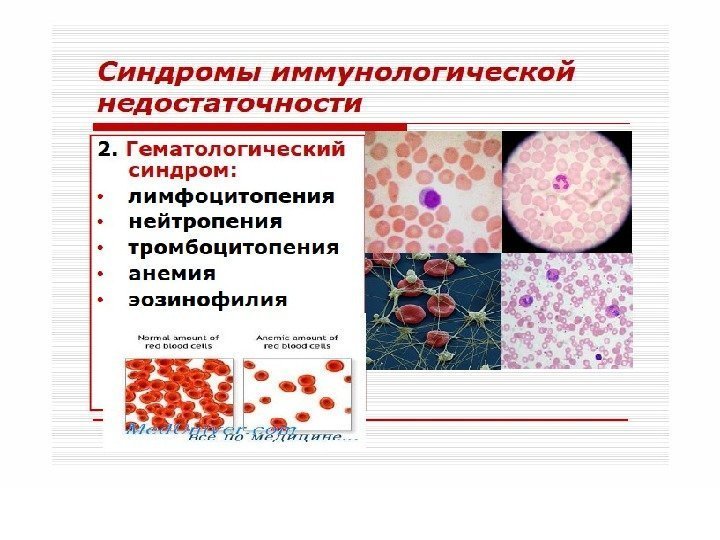
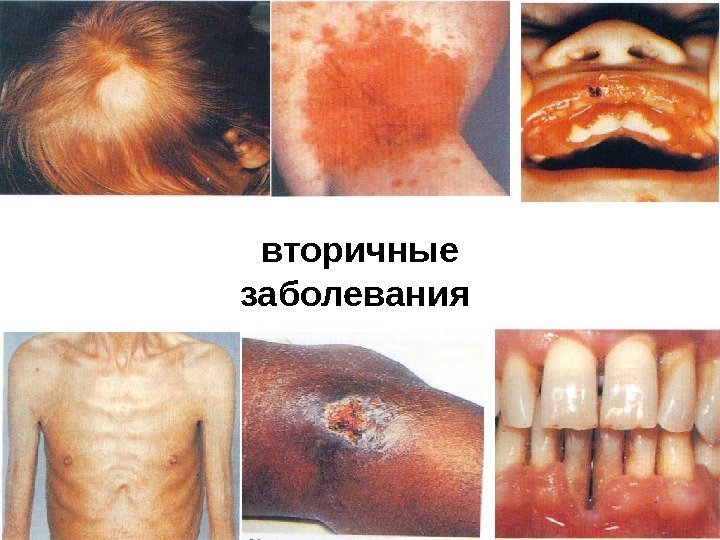
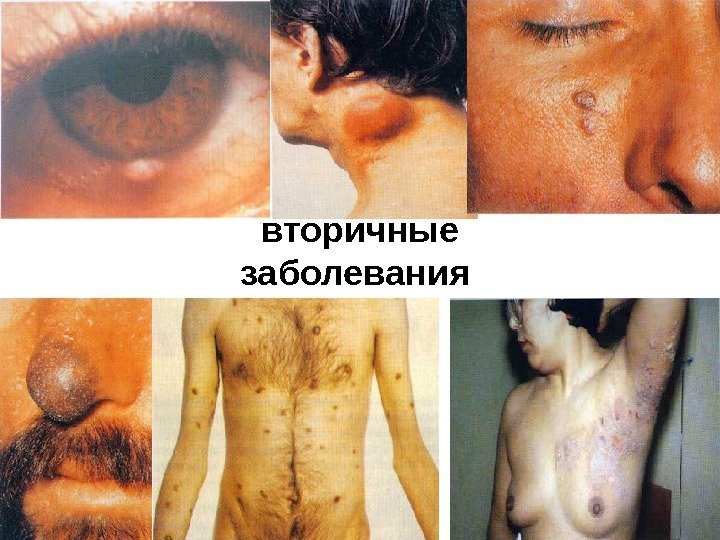
 При этом у больного развиваются персистирующая (постоянная) генерализованная лимфаденопатия и умеренный иммунодефицит, который может сохраняться длительное время (до 10 лет и более) — так называемый период скрытого течения инфекции. 3. Стадия вторичных заболеваний характеризуется нарушениями иммунитета (лимфопения, резкое снижение Т-хелперов, подавление функции В-лимфоцитов). Организм поражается прогрессирующими оппортунистическими инфекциями:
При этом у больного развиваются персистирующая (постоянная) генерализованная лимфаденопатия и умеренный иммунодефицит, который может сохраняться длительное время (до 10 лет и более) — так называемый период скрытого течения инфекции. 3. Стадия вторичных заболеваний характеризуется нарушениями иммунитета (лимфопения, резкое снижение Т-хелперов, подавление функции В-лимфоцитов). Организм поражается прогрессирующими оппортунистическими инфекциями:
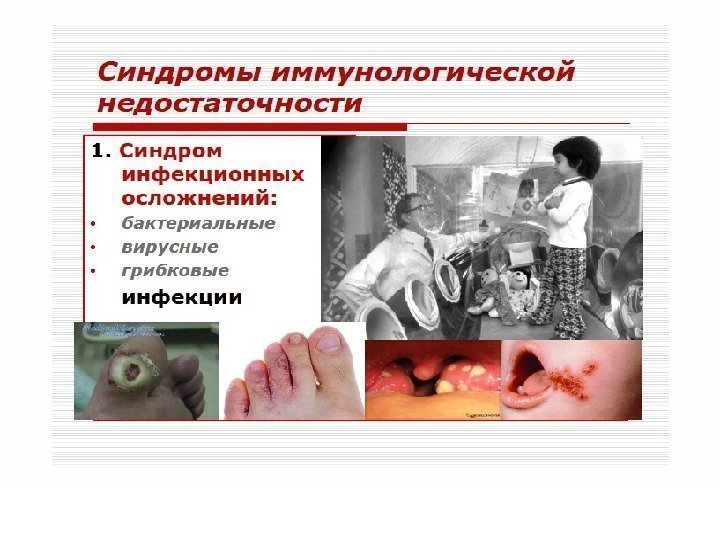
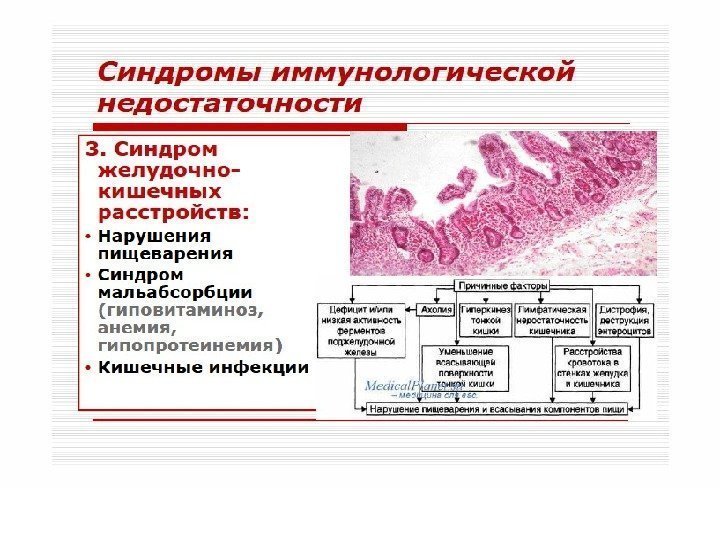
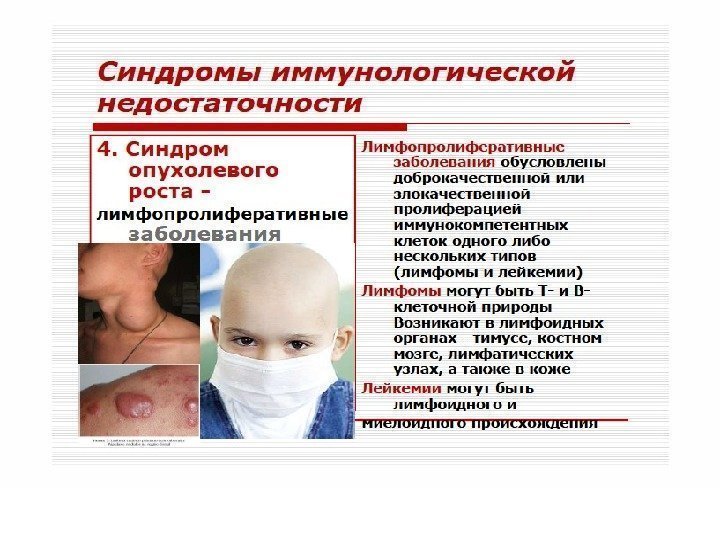
 вторичные заболевания
вторичные заболевания
 вторичные заболевания
вторичные заболевания
 повторные и стойкие, часто генерализованные грибковые, вирусные, бактериальные и протозойные поражения кожи, слизистых и внутренних органов, туберкулез легких и внелегочный, пневмоцистная пневмония, повторный или диссеминированный опоясывающий лишай, кахексия, диссеминированная саркома Капоши, поражения ЦНС различной этиологии (наиболее близко стадия Зв соответствует стадии СПИДа по критериям ВОЗ). 4. Терминальная стадия –заканчивается летально.
повторные и стойкие, часто генерализованные грибковые, вирусные, бактериальные и протозойные поражения кожи, слизистых и внутренних органов, туберкулез легких и внелегочный, пневмоцистная пневмония, повторный или диссеминированный опоясывающий лишай, кахексия, диссеминированная саркома Капоши, поражения ЦНС различной этиологии (наиболее близко стадия Зв соответствует стадии СПИДа по критериям ВОЗ). 4. Терминальная стадия –заканчивается летально.
 Принципы лечения основаны на политерапии: 1. Средства, нейтрализующие вирус СПИДа 2. Предотвращение проникновения вируса в клетки организма 3. Средства, ингибирующие ранние этапы интеграции ДНК-вируса в геном клетки-хозяина и др.
Принципы лечения основаны на политерапии: 1. Средства, нейтрализующие вирус СПИДа 2. Предотвращение проникновения вируса в клетки организма 3. Средства, ингибирующие ранние этапы интеграции ДНК-вируса в геном клетки-хозяина и др.
 Патология неспецифических факторов защиты Дефекты системы комплемента. Комплемент – это система, состоящая из 9 белковых компонентов, являющихся, как правило, неактивными ферментами и регуляторными белками. Регуляторные белки контролируют процессы активации ферментов, не допуская неконтролируемой активации комплемента.
Патология неспецифических факторов защиты Дефекты системы комплемента. Комплемент – это система, состоящая из 9 белковых компонентов, являющихся, как правило, неактивными ферментами и регуляторными белками. Регуляторные белки контролируют процессы активации ферментов, не допуская неконтролируемой активации комплемента.
 Генетический дефект может затронуть любой из компонентов как классического, так и альтернативного путей активации системы Иммунологические реакции будут протекать с отклонениями от нормы, особенно воспалительные процессы, в которых система комплемента играет очень важную роль.
Генетический дефект может затронуть любой из компонентов как классического, так и альтернативного путей активации системы Иммунологические реакции будут протекать с отклонениями от нормы, особенно воспалительные процессы, в которых система комплемента играет очень важную роль.
 Приобретенная недостаточность комплемента отмечена при развитии у человека эндокардита, сепсиса, малярии, некоторых вирусных инфекций. Все эти заболевания могут приводить к развитию гломерулонефрита, возможно, вследствие накопления неразрушенных в отсутствие комплемента комплексов АГ-АТ. Активность комплемента снижается также при СКВ, ревматоидном артрите и некоторых других заболеваниях.
Приобретенная недостаточность комплемента отмечена при развитии у человека эндокардита, сепсиса, малярии, некоторых вирусных инфекций. Все эти заболевания могут приводить к развитию гломерулонефрита, возможно, вследствие накопления неразрушенных в отсутствие комплемента комплексов АГ-АТ. Активность комплемента снижается также при СКВ, ревматоидном артрите и некоторых других заболеваниях.
 Врожденный дефицит фактора С 1 – наиболее частая патология системы комплемента, наследуется по аутосомному признаку. Невозможна активация комплемента по классическому пути, нарушается фагоцитоз и лизис микробов, наблюдаются повторные и тяжелые гнойные процессы. При врожденном дефиците ингибитора С 1 (эстеразы) облегчается активация комплемента и развивается ангионевротический отек Квинке. Резистентность к инфекциям при дефиците ингибитора С 1 -эстеразы не изменена.
Врожденный дефицит фактора С 1 – наиболее частая патология системы комплемента, наследуется по аутосомному признаку. Невозможна активация комплемента по классическому пути, нарушается фагоцитоз и лизис микробов, наблюдаются повторные и тяжелые гнойные процессы. При врожденном дефиците ингибитора С 1 (эстеразы) облегчается активация комплемента и развивается ангионевротический отек Квинке. Резистентность к инфекциям при дефиците ингибитора С 1 -эстеразы не изменена.
 Дефицит С 2 – снижение бактерицидности сыворотки, предрасположенность к вирусным инфекциям, диффузным заболеваниям соединительной ткани, гломерулонефриту и тромбоцитопении. Компонент С 3 является ключевым в формировании регуляторных и ферментных свойств комплемента, при его дефиците наблюдается высокая смертность. При дефиците ингибитора С 3 постоянно активируется С 3 , снижается поэтому его содержание в крови.
Дефицит С 2 – снижение бактерицидности сыворотки, предрасположенность к вирусным инфекциям, диффузным заболеваниям соединительной ткани, гломерулонефриту и тромбоцитопении. Компонент С 3 является ключевым в формировании регуляторных и ферментных свойств комплемента, при его дефиците наблюдается высокая смертность. При дефиците ингибитора С 3 постоянно активируется С 3 , снижается поэтому его содержание в крови.
 Нарушаются процессы фагоцитоза и лизиса микробов, снижается сопротивляемость организма к инфекциям – склонность к повторным микробно-воспалительным заболеваниям, лихорадка, кожные сыпи, артралгии. При дефиците ингибитора С 4 фактора симптомокомплекс, сходный с системной красной волчанкой.
Нарушаются процессы фагоцитоза и лизиса микробов, снижается сопротивляемость организма к инфекциям – склонность к повторным микробно-воспалительным заболеваниям, лихорадка, кожные сыпи, артралгии. При дефиците ингибитора С 4 фактора симптомокомплекс, сходный с системной красной волчанкой.
 Дефицит С 5 фактора – нарушения фагоцитоза и лизиса из-за невозможности образования соответствующих компонентов комплемента. Тяжелые кишечные инфекции, вызванные грамотрицательной флорой, поражение кожи. При наследственной недостаточности С 5 с раннего детства дерматиты и диарея, нарушение развития ребенка.
Дефицит С 5 фактора – нарушения фагоцитоза и лизиса из-за невозможности образования соответствующих компонентов комплемента. Тяжелые кишечные инфекции, вызванные грамотрицательной флорой, поражение кожи. При наследственной недостаточности С 5 с раннего детства дерматиты и диарея, нарушение развития ребенка.
 Дефицит С 6 – заболевания суставов. Дефицит ингибитора С 6 – эпизодические лихорадочные состояния, частые повторные инфекции С 7 – диффузные заболевания соединительной ткани: склеродермии, телеангиэктазии. С 8 – клинически может не проявляться.
Дефицит С 6 – заболевания суставов. Дефицит ингибитора С 6 – эпизодические лихорадочные состояния, частые повторные инфекции С 7 – диффузные заболевания соединительной ткани: склеродермии, телеангиэктазии. С 8 – клинически может не проявляться.
 Патология пропердиновой системы. Пропердин – белок крови, нормальное антитело, появляющееся в ответ на иммунизацию веществами полисахаридной природы. Соединяясь с полисахаридами микробной клетки, активирует систему комплемента по альтернативному пути. Его защитное действие проявляется в бактерицидном, вируснейтрализующем эффекте. Снижение уровня пропердина в крови, а, следовательно, и его защитных свойств отмечается при тяжелых патологических процессах (шок, лейкозы, хронические инфекции).
Патология пропердиновой системы. Пропердин – белок крови, нормальное антитело, появляющееся в ответ на иммунизацию веществами полисахаридной природы. Соединяясь с полисахаридами микробной клетки, активирует систему комплемента по альтернативному пути. Его защитное действие проявляется в бактерицидном, вируснейтрализующем эффекте. Снижение уровня пропердина в крови, а, следовательно, и его защитных свойств отмечается при тяжелых патологических процессах (шок, лейкозы, хронические инфекции).
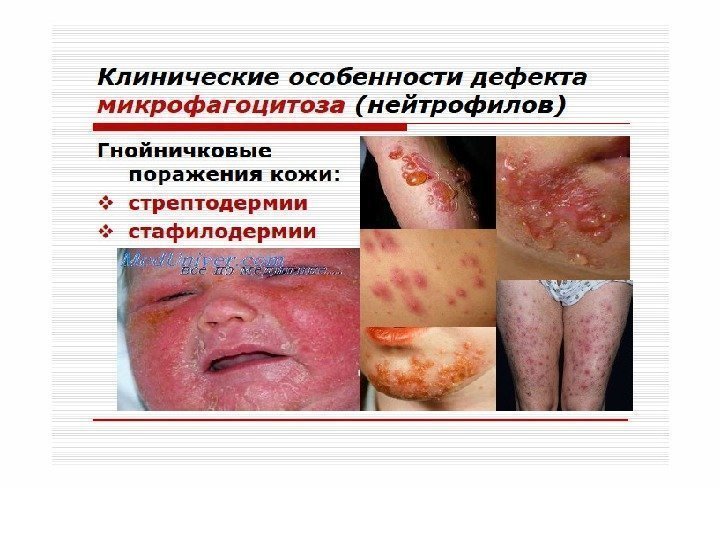
 Патология фагоцитоза. Фагоцитарная недостаточность делится на следующие виды. По происхождению Первичная (наследственная) – большинство форм передается по аутосомно-рецессивному типу, реже сцеплено с полом (Х-хромосомой) Вторичная (приобретенная) – как результат инфекционно-токсических заболеваний, нарушений функций печени и почек, системных болезней соединительной ткани, опухолевой трансформации мононуклеарных клеток при миелолейкозе.
Патология фагоцитоза. Фагоцитарная недостаточность делится на следующие виды. По происхождению Первичная (наследственная) – большинство форм передается по аутосомно-рецессивному типу, реже сцеплено с полом (Х-хромосомой) Вторичная (приобретенная) – как результат инфекционно-токсических заболеваний, нарушений функций печени и почек, системных болезней соединительной ткани, опухолевой трансформации мононуклеарных клеток при миелолейкозе.
 По механизму развития Лейкопеническая. Приобретенные формы развиваются при подавлении процессов пролиферации и созревания моноцитов, в частности при воздействии радиации, токсинов, цитостатиков. Например, действие гликолитического яда монойодацетата, микробных токсинов нарушает в лейкоцитах выработку АТФ, что приводит к незавершенному фагоцитозу.
По механизму развития Лейкопеническая. Приобретенные формы развиваются при подавлении процессов пролиферации и созревания моноцитов, в частности при воздействии радиации, токсинов, цитостатиков. Например, действие гликолитического яда монойодацетата, микробных токсинов нарушает в лейкоцитах выработку АТФ, что приводит к незавершенному фагоцитозу.
 Наследственные формы возникают в результате наследственной блокады деления и дифференцировки миелоидной стволовой клетки. Дисфункциональная фагоцитарная недостаточность. Характеризуется парциальными или комбинированными расстройствами различных этапов фагоцитоза и презентации антигена.
Наследственные формы возникают в результате наследственной блокады деления и дифференцировки миелоидной стволовой клетки. Дисфункциональная фагоцитарная недостаточность. Характеризуется парциальными или комбинированными расстройствами различных этапов фагоцитоза и презентации антигена.
 В основе лежат наследственные или приобретенные дефекты структуры актина фагоцитов, ферментопатии глюкозомонофосфатного шунта, гликолиза, гидролаз лизосом (чаще всего миелопероксидазы). Дисглобулинемии (чаще с избытком Ig. E или недостатком Ig. G ), сочетающиеся с нарушением процесса опсонизации и адгезивных свойств фагоцитов. Недостаточность кислороднезависимых факторов лизиса объектов фагоцитоза (лизоцима, лактоферрина, катионных белков).
В основе лежат наследственные или приобретенные дефекты структуры актина фагоцитов, ферментопатии глюкозомонофосфатного шунта, гликолиза, гидролаз лизосом (чаще всего миелопероксидазы). Дисглобулинемии (чаще с избытком Ig. E или недостатком Ig. G ), сочетающиеся с нарушением процесса опсонизации и адгезивных свойств фагоцитов. Недостаточность кислороднезависимых факторов лизиса объектов фагоцитоза (лизоцима, лактоферрина, катионных белков).
 Дисрегуляторная. Обычно это приобретенная форма, развивается вследствие нарушения регуляции различных этапов фагоцитоза биологически активными веществами. Нейромедиаторы (катехоламины, ацетилхолин) – избыток или недостаток понижают активность фагоцитоза.
Дисрегуляторная. Обычно это приобретенная форма, развивается вследствие нарушения регуляции различных этапов фагоцитоза биологически активными веществами. Нейромедиаторы (катехоламины, ацетилхолин) – избыток или недостаток понижают активность фагоцитоза.
 Гормоны. Увеличение концентрации глюкокортикоидов сопровождается нарушением процессов деления и созревания моноцитов, повышением жесткости их мембран и снижением в связи с этим их подвижности и адгезивных свойств.
Гормоны. Увеличение концентрации глюкокортикоидов сопровождается нарушением процессов деления и созревания моноцитов, повышением жесткости их мембран и снижением в связи с этим их подвижности и адгезивных свойств.
 Лейкокины, простагландины, кинины, пептиды. Значительное отклонение их концентрации от нормального диапазона изменяют характер и интенсивность метаболизма фагоцитов, состояние их мембран, активность их ферментов, влияя на реализацию процессов фагоцитоза, делая их мало- или неэффективными.
Лейкокины, простагландины, кинины, пептиды. Значительное отклонение их концентрации от нормального диапазона изменяют характер и интенсивность метаболизма фагоцитов, состояние их мембран, активность их ферментов, влияя на реализацию процессов фагоцитоза, делая их мало- или неэффективными.

