http: //www. kgasu. ru/images/material -images/10%20 Elektrokhimiya. ppt
















10_elektrokhimiya.ppt
- Размер: 2.3 Мб
- Автор:
- Количество слайдов: 23
Описание презентации http: //www. kgasu. ru/images/material -images/10%20 Elektrokhimiya. ppt по слайдам
 http: //www. kgasu. ru/images/material -images/10%20 Elektrokhimiya. ppt
http: //www. kgasu. ru/images/material -images/10%20 Elektrokhimiya. ppt
 Электрохимические процессы
Электрохимические процессы
 Электрохимия — это наука, которая изучает процессы, либо протекающие с возникновением электрического тока, либо вызванные электрическим током.
Электрохимия — это наука, которая изучает процессы, либо протекающие с возникновением электрического тока, либо вызванные электрическим током.


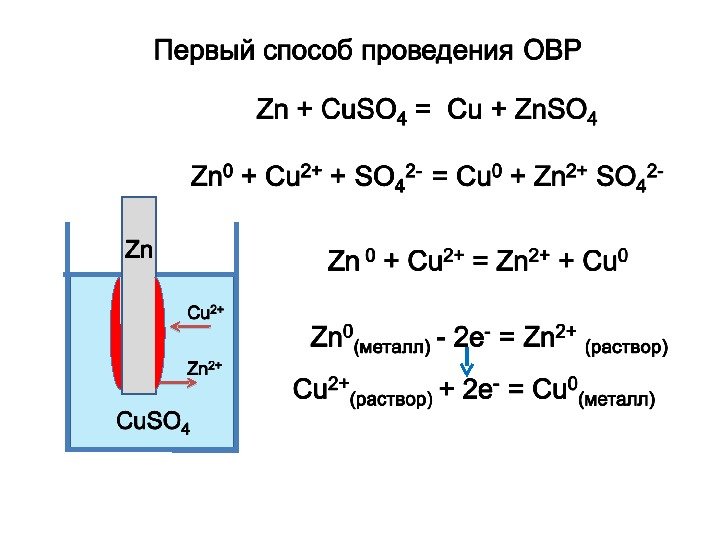
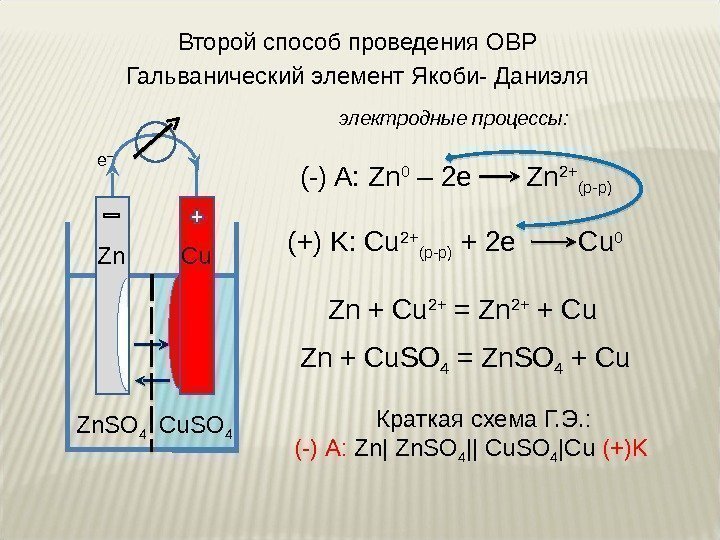
 Zn. SO 4 Cu. SO 4 Гальванический элемент Якоби- Даниэля Zn Cu (-) A: Zn 0 – 2 e Zn 2+ (р-р) (+) K: Cu 2+ (р-р) + 2 e Cu 0 Zn + Cu. SO 4 = Zn. SO 4 + Cuэлектродные процессы: Краткая схема Г. Э. : (-) А: Zn| Zn. SO 4 || Cu. SO 4 |Cu (+)KZn + Cu 2+ = Zn 2+ + Cu. Второй способ проведения ОВР e _
Zn. SO 4 Cu. SO 4 Гальванический элемент Якоби- Даниэля Zn Cu (-) A: Zn 0 – 2 e Zn 2+ (р-р) (+) K: Cu 2+ (р-р) + 2 e Cu 0 Zn + Cu. SO 4 = Zn. SO 4 + Cuэлектродные процессы: Краткая схема Г. Э. : (-) А: Zn| Zn. SO 4 || Cu. SO 4 |Cu (+)KZn + Cu 2+ = Zn 2+ + Cu. Второй способ проведения ОВР e _

 Электродвижущая сила (ЭДС) львльок.
Электродвижущая сила (ЭДС) львльок.
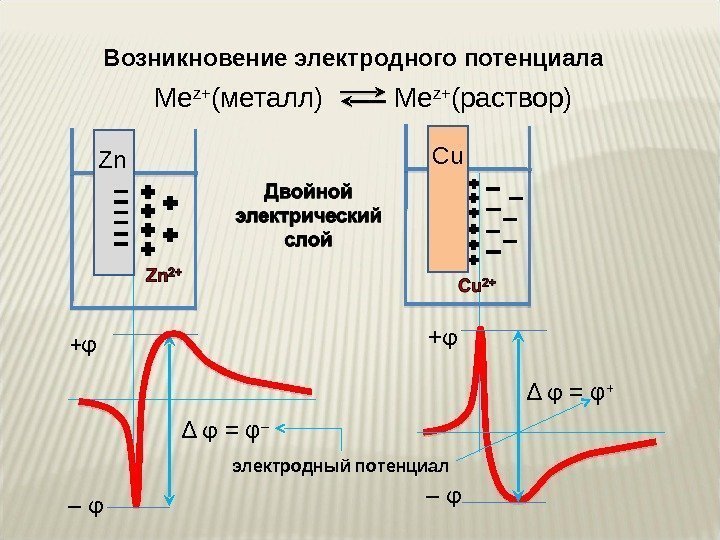
 Возникновение электродного потенциала Me z+ ( металл) Me z+ ( раствор) + φ – φ ∆ φ = φ – + φ – φ ∆ φ = φ + электродный потенциал. Zn Cu
Возникновение электродного потенциала Me z+ ( металл) Me z+ ( раствор) + φ – φ ∆ φ = φ – + φ – φ ∆ φ = φ + электродный потенциал. Zn Cu
 d. Re Ox lg n. FRT , 320 d. Re Ox lg n , 0590 0 n Men. Me Melg n ,
d. Re Ox lg n. FRT , 320 d. Re Ox lg n , 0590 0 n Men. Me Melg n ,
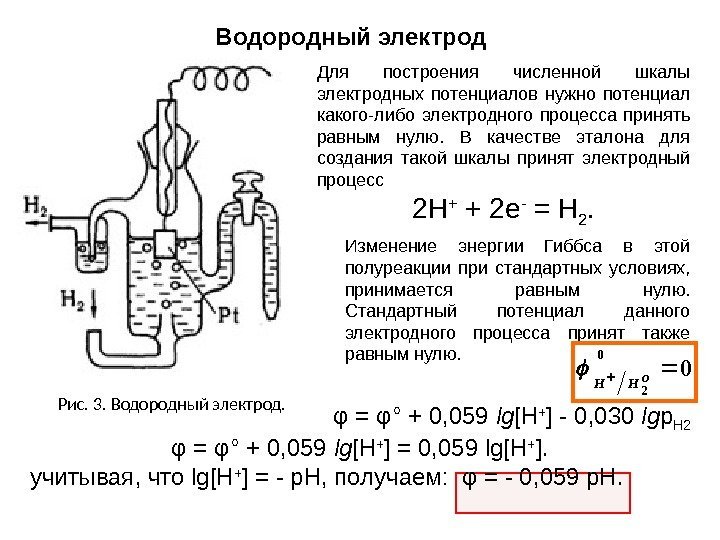
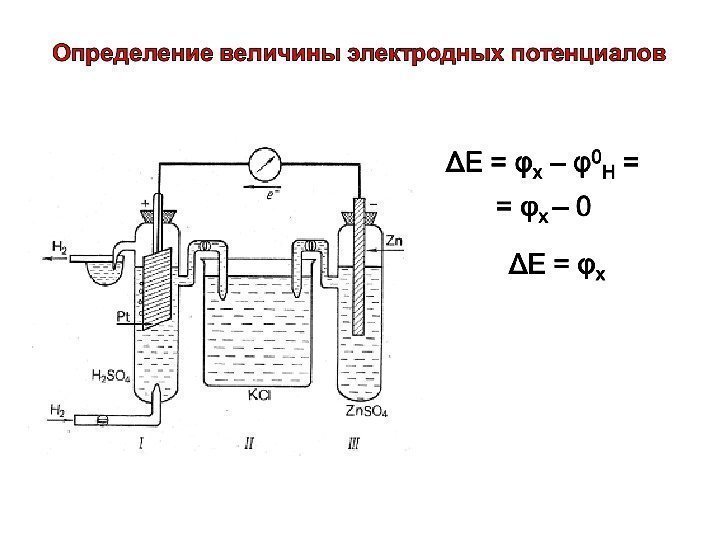
 Водородный электрод Рис. 3. Водородный электрод. Для построения численной шкалы электродных потенциалов нужно потенциал какого-либо электродного процесса принять равным нулю. В качестве эталона для создания такой шкалы принят электродный процесс 2 Н + + 2 е — = Н 2. Изменение энергии Гиббса в этой полуреакции при стандартных условиях, принимается равным нулю. Стандартный потенциал данного электродного процесса принят также равным нулю. φ = φ° + 0, 059 lg [H + ] — 0, 030 lg p H 2 φ = φ° + 0, 059 lg [H + ] = 0, 059 lg[H + ]. учитывая, что lg[H + ] = — р. Н, получаем: φ = — 0, 059 р. Н. 00 2 o HH
Водородный электрод Рис. 3. Водородный электрод. Для построения численной шкалы электродных потенциалов нужно потенциал какого-либо электродного процесса принять равным нулю. В качестве эталона для создания такой шкалы принят электродный процесс 2 Н + + 2 е — = Н 2. Изменение энергии Гиббса в этой полуреакции при стандартных условиях, принимается равным нулю. Стандартный потенциал данного электродного процесса принят также равным нулю. φ = φ° + 0, 059 lg [H + ] — 0, 030 lg p H 2 φ = φ° + 0, 059 lg [H + ] = 0, 059 lg[H + ]. учитывая, что lg[H + ] = — р. Н, получаем: φ = — 0, 059 р. Н. 00 2 o HH

 Pt , H 2 | H 2 SO 4 || H 2 SO 4 | H 2 , Pt φ 2 = — 0, 059 р. Н 2φ 1 = — 0, 059 р. Н 1 p. H,
Pt , H 2 | H 2 SO 4 || H 2 SO 4 | H 2 , Pt φ 2 = — 0, 059 р. Н 2φ 1 = — 0, 059 р. Н 1 p. H,
 Задача 1. Определить знаки электродов в гальван. эл-те Co | Co. CI 2 || AICI 3 | AI , указать анод и катод, объяснить механизм возникновения тока в данном элементе. B 27, 0 0 Co/Co 02 B 66, 1 0 Al/Al 03 Решение: Возникновение эл. тока в данном ГЭ связано с разной поляризацией электродов и протеканием ОВР. е –
Задача 1. Определить знаки электродов в гальван. эл-те Co | Co. CI 2 || AICI 3 | AI , указать анод и катод, объяснить механизм возникновения тока в данном элементе. B 27, 0 0 Co/Co 02 B 66, 1 0 Al/Al 03 Решение: Возникновение эл. тока в данном ГЭ связано с разной поляризацией электродов и протеканием ОВР. е –
 • С. Б. Бурухин, О. А. Ананьева • «Введение в электрохимию»
• С. Б. Бурухин, О. А. Ананьева • «Введение в электрохимию»
 Физические типы кристаллических решеток • В зависимости от природы частиц, находящихся в узлах кристаллической решетки, и от характера сил взаимодействия между частицами различают четыре типа кристаллических решеток и соответственно четыре типа кристаллов: ионные, атомные, металлические и молекулярные.
Физические типы кристаллических решеток • В зависимости от природы частиц, находящихся в узлах кристаллической решетки, и от характера сил взаимодействия между частицами различают четыре типа кристаллических решеток и соответственно четыре типа кристаллов: ионные, атомные, металлические и молекулярные.
 Типы кристаллов • Ионные кристаллы В узлах кристаллической решетки располагаются ионы разных знаков. Силы взаимодействия между ними являются в основном электростатическими — кулоновского происхождения.
Типы кристаллов • Ионные кристаллы В узлах кристаллической решетки располагаются ионы разных знаков. Силы взаимодействия между ними являются в основном электростатическими — кулоновского происхождения.
 Типы кристаллов • Атомные кристаллы • В узлах кристаллической решетки размещаются нейтральные атомы. Связь, объединяющая в кристалле (а также и в молекуле) нейтральные атомы, ковалентн ая.
Типы кристаллов • Атомные кристаллы • В узлах кристаллической решетки размещаются нейтральные атомы. Связь, объединяющая в кристалле (а также и в молекуле) нейтральные атомы, ковалентн ая.
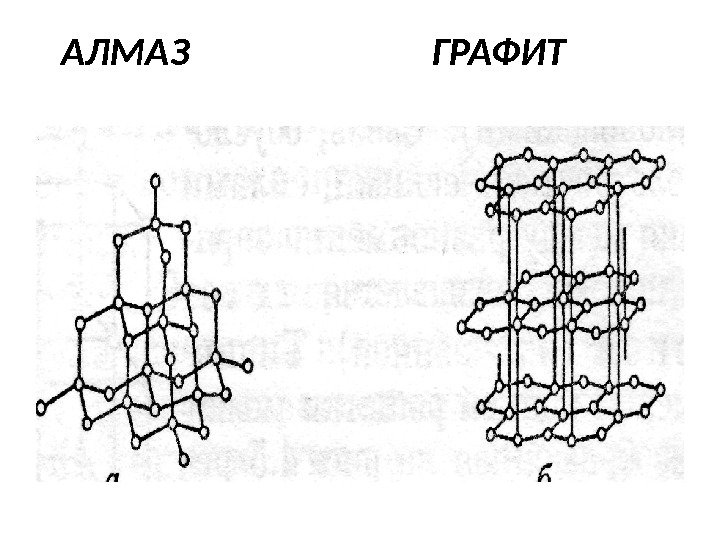
 Типы кристаллов • Характерные примеры атомных кристаллов – алмаз и графит. • Абсолютно идентичные по химической природе (элемент С из 6 группы), они совершенно различаются кристаллическим строением:
Типы кристаллов • Характерные примеры атомных кристаллов – алмаз и графит. • Абсолютно идентичные по химической природе (элемент С из 6 группы), они совершенно различаются кристаллическим строением:
 АЛМАЗ ГРАФИТ
АЛМАЗ ГРАФИТ
 Типы кристаллов • Металлические кристаллы • Во всех узлах кристаллической решетки расположены положительные ионы металла. Между ними беспорядочно, подобно молекулам газа, движутся электроны – электронный газ.
Типы кристаллов • Металлические кристаллы • Во всех узлах кристаллической решетки расположены положительные ионы металла. Между ними беспорядочно, подобно молекулам газа, движутся электроны – электронный газ.
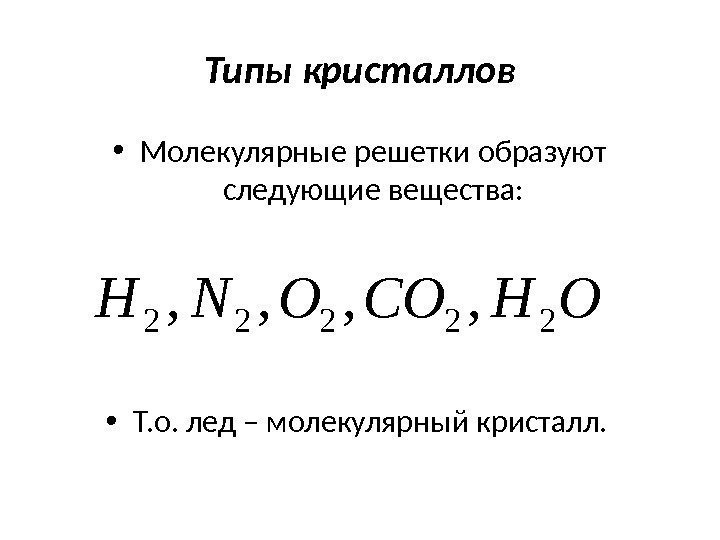
 Типы кристаллов • Молекулярные кристаллы • В узлах кристаллической решетки помещаются определенным образом ориентированные молекулы. Силы связи между молекулами в кристалле имеют ту же природу, что и силы притяжения между молекулами • Ван-дер-Ваальса – или водородная связь.
Типы кристаллов • Молекулярные кристаллы • В узлах кристаллической решетки помещаются определенным образом ориентированные молекулы. Силы связи между молекулами в кристалле имеют ту же природу, что и силы притяжения между молекулами • Ван-дер-Ваальса – или водородная связь.
 Типы кристаллов • Молекулярные решетки образуют следующие вещества: • Т. о. лед – молекулярный кристалл. OHCOONH 22222, ,
Типы кристаллов • Молекулярные решетки образуют следующие вещества: • Т. о. лед – молекулярный кристалл. OHCOONH 22222, ,
