2012Гомеоп прод.+ органика 1+ спирты.ppt
- Количество слайдов: 120
 Гомеопатические лекарственные средства (продолжение) 28. 11. 2012 1
Гомеопатические лекарственные средства (продолжение) 28. 11. 2012 1
 При изготовлении ЛП для получения последующего разведения, массу расчитывают по формулам: А=Б: 100 В=Б-А А-масса предыдущего разведения Б-масса изготовленного ЛП В- масса вспомогательного в-ва 2
При изготовлении ЛП для получения последующего разведения, массу расчитывают по формулам: А=Б: 100 В=Б-А А-масса предыдущего разведения Б-масса изготовленного ЛП В- масса вспомогательного в-ва 2
 ЗАДАЧИ Студент изготовил вручную 300 г внутриаптечной заготовки Baruta carbonica C 3, взяв 3, 0 г бария карбоната в разведении С 2 и 297 г сахара молочного. Правильно ли взяты навески? p А-масса предыдущего разведения =3 г p Б-масса изготовленного ЛП = 300 г p Ответ: Да, правильно, т. к. : p Baruta carbonica C 2 = 300: 100=3 г p 3
ЗАДАЧИ Студент изготовил вручную 300 г внутриаптечной заготовки Baruta carbonica C 3, взяв 3, 0 г бария карбоната в разведении С 2 и 297 г сахара молочного. Правильно ли взяты навески? p А-масса предыдущего разведения =3 г p Б-масса изготовленного ЛП = 300 г p Ответ: Да, правильно, т. к. : p Baruta carbonica C 2 = 300: 100=3 г p 3
 p p p p Студент изготовил с помощью механического смесителя внутриаптечную заготовку тритурацию Cuprum metallicum D 3, взяв 0, 2 г меди металлической в разведении D 2 и 199, 8 г сахара молочного. Правильно ли взяты навески, если нужно было получить 200 г тритурации Cuprum metallicum. А-масса предыдущего разведения =0, 2 г Б-масса изготовленного ЛП = 200 г Ответ: неправильно, т. к. : А-масса предыдущего разведения Cuprum metallicum (D 2) = 200: 10=20 г 20 г 0, 2 г Нужно было взять 20 г + 180, 0 г сахара молочного 4
p p p p Студент изготовил с помощью механического смесителя внутриаптечную заготовку тритурацию Cuprum metallicum D 3, взяв 0, 2 г меди металлической в разведении D 2 и 199, 8 г сахара молочного. Правильно ли взяты навески, если нужно было получить 200 г тритурации Cuprum metallicum. А-масса предыдущего разведения =0, 2 г Б-масса изготовленного ЛП = 200 г Ответ: неправильно, т. к. : А-масса предыдущего разведения Cuprum metallicum (D 2) = 200: 10=20 г 20 г 0, 2 г Нужно было взять 20 г + 180, 0 г сахара молочного 4
 p Студент приготовил внутриаптечную заготовку Bismuthum subnitricum (Висмута нитрат основной) C 6, используя висмута нитрат основной в качестве основного компонента и сахар молочный, как вспомогательное вещество. Определите сколько молекул висмута нитрата основного содержится в 10 г данной тритурации. Известно, что для приготовления тритурации С 1 взяли 0, 1 г висмута нитрата основного и 9, 9 г сахара молочного. 5
p Студент приготовил внутриаптечную заготовку Bismuthum subnitricum (Висмута нитрат основной) C 6, используя висмута нитрат основной в качестве основного компонента и сахар молочный, как вспомогательное вещество. Определите сколько молекул висмута нитрата основного содержится в 10 г данной тритурации. Известно, что для приготовления тритурации С 1 взяли 0, 1 г висмута нитрата основного и 9, 9 г сахара молочного. 5
 Приготовление 1 -ой сотенной тритурации С 1: 0, 1 г вещества растирают с 9, 9 г молочного сахара. p М м Bi. ONO 3 = 209+64+14=277 1 М – 277 г Х - 0, 1 г Х=3, 6 х10 -4 М p В С 1= 10 -2 Bismuthum subnitricum содержится = 3, 6 х10 -4 М вещества. p Разведение С 6 соответствует 10 -12. Содержание исходного вещества в С 6 тритурации составит 3, 6 х10 -4 х10 -12: 10 -2=3, 6 х 10 -14 моль. p 1 моль содержит 6, 02 х1023 молекул. Следовательно, в 6 -ом сотенном растирании будет содержаться: p 6, 02 х1023 х 3, 6 х 10 -14=2, 167 х1010 молекул. p 6
Приготовление 1 -ой сотенной тритурации С 1: 0, 1 г вещества растирают с 9, 9 г молочного сахара. p М м Bi. ONO 3 = 209+64+14=277 1 М – 277 г Х - 0, 1 г Х=3, 6 х10 -4 М p В С 1= 10 -2 Bismuthum subnitricum содержится = 3, 6 х10 -4 М вещества. p Разведение С 6 соответствует 10 -12. Содержание исходного вещества в С 6 тритурации составит 3, 6 х10 -4 х10 -12: 10 -2=3, 6 х 10 -14 моль. p 1 моль содержит 6, 02 х1023 молекул. Следовательно, в 6 -ом сотенном растирании будет содержаться: p 6, 02 х1023 х 3, 6 х 10 -14=2, 167 х1010 молекул. p 6
 Контроль качества лекарственных средств, используемых в гомеопатии в различных лекарственных формах p Специфическая черта контроля качества ГЛС - постадийность. 1. ЛС, содержащие БАВ в разведениях до С 2 (10 -4), контролируют по тем же показателям, что и аллопатические лекарственные средства. p 2. ЛС, содержащие БАВ в С 3 (10 -6), контролируют, после проведения концентрирования БАВ в пробах. 7
Контроль качества лекарственных средств, используемых в гомеопатии в различных лекарственных формах p Специфическая черта контроля качества ГЛС - постадийность. 1. ЛС, содержащие БАВ в разведениях до С 2 (10 -4), контролируют по тем же показателям, что и аллопатические лекарственные средства. p 2. ЛС, содержащие БАВ в С 3 (10 -6), контролируют, после проведения концентрирования БАВ в пробах. 7
 p 3. ЛС, содержащие БАВ в разведениях от С 4 (10 -8) до С 6 (10 -12), контролируют путем установления подлинности БАВ в пробе, адекватной суточному приему, а в отдельных случаях – прописанной на курс лечения. p 4. ЛС, содержащие БАВ в разведениях свыше С 6 (10 -12) контролируют путем строгого соблюдения технологии и составления акта загрузки всех ингредиентов при получении лекарственной формы. 8
p 3. ЛС, содержащие БАВ в разведениях от С 4 (10 -8) до С 6 (10 -12), контролируют путем установления подлинности БАВ в пробе, адекватной суточному приему, а в отдельных случаях – прописанной на курс лечения. p 4. ЛС, содержащие БАВ в разведениях свыше С 6 (10 -12) контролируют путем строгого соблюдения технологии и составления акта загрузки всех ингредиентов при получении лекарственной формы. 8
 ЛЕКАРСТВЕННЫЕ ФОРМЫ, ИСПОЛЬЗУЕМЫЕ В ГОМЕОПАТИИ 1. Жидкие гомеопатические лекарственные формы. Ø Настойки матричные гомеопатические 9
ЛЕКАРСТВЕННЫЕ ФОРМЫ, ИСПОЛЬЗУЕМЫЕ В ГОМЕОПАТИИ 1. Жидкие гомеопатические лекарственные формы. Ø Настойки матричные гомеопатические 9
 Настойки матричные гомеопатические это жидкие спиртовые или водно-спиртовые, извлечения из сырья растительного или животного происхождения, получаемые без нагревания и удаления экстрагента. p Изготавливают: - смешиванием равных количеств сока свежих растений с 90 о этиловым спиртом, - или экстракцией спиртом различной концентрации свежего или сухого растительного или животного сырья или продуктов их жизнедеятельности (секретов). p p Изготовливаются из свежесобранного сырья, которое должно быть переработано в течение суток. 10
Настойки матричные гомеопатические это жидкие спиртовые или водно-спиртовые, извлечения из сырья растительного или животного происхождения, получаемые без нагревания и удаления экстрагента. p Изготавливают: - смешиванием равных количеств сока свежих растений с 90 о этиловым спиртом, - или экстракцией спиртом различной концентрации свежего или сухого растительного или животного сырья или продуктов их жизнедеятельности (секретов). p p Изготовливаются из свежесобранного сырья, которое должно быть переработано в течение суток. 10
 При приготовлении настойки арники: p 1 часть измельченного растения заливают 10 весовыми частями 90 о спирта оставляют при температуре 16 о. С, при ежедневном взбалтывании (метод мацерации). p Через 8 дней спирт сливают, массу отжимают прессом и обе жидкости смешивают и оставляют отстаиваться. p Через 8 дней жидкость фильтруют. Содержание вещества при этом в тинктуре (спиртовой настойке) соответствует 1 десятичному разведению. p 2 -е и 3 -е десятичное разведения готовят с 90 о спиртом p 4 -е десятичное – с 60 о p более высокие разведения – с 45 о спиртом. 11
При приготовлении настойки арники: p 1 часть измельченного растения заливают 10 весовыми частями 90 о спирта оставляют при температуре 16 о. С, при ежедневном взбалтывании (метод мацерации). p Через 8 дней спирт сливают, массу отжимают прессом и обе жидкости смешивают и оставляют отстаиваться. p Через 8 дней жидкость фильтруют. Содержание вещества при этом в тинктуре (спиртовой настойке) соответствует 1 десятичному разведению. p 2 -е и 3 -е десятичное разведения готовят с 90 о спиртом p 4 -е десятичное – с 60 о p более высокие разведения – с 45 о спиртом. 11
 p Качество настоек оценивают по с показателям: внешний вид, цвет, запах, прозрачность (ГФ Х 1 изд. , вып. 2). p Концентрацию извлеченных веществ контролируют по содержанию сухого остатка или БАВ. при 100 -105 о. С(ГФ Х 1 изд. , вып. 2). p определяют плотность или содержание спирта микробиологическая чистота, номинальный объем (ОСТ 64 -492 -85). p Подлинность настоек устанавливают по присутствию БАВ (в соответствии с частной НД) с помощью цветных качественных реакций или реакций осаждения, УФ-спектрофотометрии и различных видов хроматографии. 12
p Качество настоек оценивают по с показателям: внешний вид, цвет, запах, прозрачность (ГФ Х 1 изд. , вып. 2). p Концентрацию извлеченных веществ контролируют по содержанию сухого остатка или БАВ. при 100 -105 о. С(ГФ Х 1 изд. , вып. 2). p определяют плотность или содержание спирта микробиологическая чистота, номинальный объем (ОСТ 64 -492 -85). p Подлинность настоек устанавливают по присутствию БАВ (в соответствии с частной НД) с помощью цветных качественных реакций или реакций осаждения, УФ-спектрофотометрии и различных видов хроматографии. 12
 2. Твердые лекарственные формы Ø Тритурации гомеопатические Ø Дозированные порошки Ø Таблетки Ø Гранулы гомеопатические Ø Карамель гомеопатическая Ø Кристаллы гомеопатические 3. Мягкие лекарственные формы Ø Мази Ø Оподельдоки Ø Суппозитории гомеопатические Ø Пластыри гомеопатические 4. Смеси гомеопатические 13 5. Газообразные лекарственные формы
2. Твердые лекарственные формы Ø Тритурации гомеопатические Ø Дозированные порошки Ø Таблетки Ø Гранулы гомеопатические Ø Карамель гомеопатическая Ø Кристаллы гомеопатические 3. Мягкие лекарственные формы Ø Мази Ø Оподельдоки Ø Суппозитории гомеопатические Ø Пластыри гомеопатические 4. Смеси гомеопатические 13 5. Газообразные лекарственные формы
 Тритурации гомеопатические p p p Тритурация (растирание) –смесь ЛВ с молочным сахаром или другими вспомогательными веществами, разрешенными к медицинскому применению (1: 10 или 1: 100) (ГФ Х 1 изд. , вып. 2). Для приготовления гомеопатических тритураций по десятичной шкале 1 г лекарственного вещества растирают с 9 г молочного сахара, который делят на три равные части. Первую часть помещают в фарфоровую чашку и перемешивают, чтобы закрыть случайные поры ступки, затем добавляют исходное вещество и растирают в течение 6 мин. , затем в течение 4 мин соскабливают, повторяют растирание и соскабливание еще раз. 14
Тритурации гомеопатические p p p Тритурация (растирание) –смесь ЛВ с молочным сахаром или другими вспомогательными веществами, разрешенными к медицинскому применению (1: 10 или 1: 100) (ГФ Х 1 изд. , вып. 2). Для приготовления гомеопатических тритураций по десятичной шкале 1 г лекарственного вещества растирают с 9 г молочного сахара, который делят на три равные части. Первую часть помещают в фарфоровую чашку и перемешивают, чтобы закрыть случайные поры ступки, затем добавляют исходное вещество и растирают в течение 6 мин. , затем в течение 4 мин соскабливают, повторяют растирание и соскабливание еще раз. 14
 p Добавляют вторую треть молочного сахара и повторяют дважды все операции по растиранию и соскабливанию, приведенные выше. p Добавляют оставшуюся часть молочного сахара и поступают, как указано выше. Таким образом приготовление 10 г тритураций требует 1 часа времени. p При приготовлении С 1 тритурации берут 0, 1 г лекарственного вещества и 9, 9 г молочного сахара и поступают аналогичным образом.
p Добавляют вторую треть молочного сахара и повторяют дважды все операции по растиранию и соскабливанию, приведенные выше. p Добавляют оставшуюся часть молочного сахара и поступают, как указано выше. Таким образом приготовление 10 г тритураций требует 1 часа времени. p При приготовлении С 1 тритурации берут 0, 1 г лекарственного вещества и 9, 9 г молочного сахара и поступают аналогичным образом.
 p Качество тритураций определяют по внешнему виду, цвету, однородности. p Подлинность и количественное содержание ЛВ определяют в тритурациях 1 -го, 2 -го и 3 -го десятичных разведений в соответствии с требованиями частных ФС. p Тритурации, содержащие ядовитые или сильнодействующие лекарственные вещества, должны быть проанализированы в 4 D разведении по методам, приведенным в частных ФС. p Тритурации проверяют на микробиологическую чистоту. (ГФ Х 1 изд. ) p Размеры частиц определяют с помощью микроскопа (ВФС 42 - 2800 -96) или по величине внешней удельной поверхности (МУ 64 - 012 -89). Величина внешней удельной поверхности тритурации, изготовленной с лактозой, должна быть не менее 0, 65 м 2/г. 16
p Качество тритураций определяют по внешнему виду, цвету, однородности. p Подлинность и количественное содержание ЛВ определяют в тритурациях 1 -го, 2 -го и 3 -го десятичных разведений в соответствии с требованиями частных ФС. p Тритурации, содержащие ядовитые или сильнодействующие лекарственные вещества, должны быть проанализированы в 4 D разведении по методам, приведенным в частных ФС. p Тритурации проверяют на микробиологическую чистоту. (ГФ Х 1 изд. ) p Размеры частиц определяют с помощью микроскопа (ВФС 42 - 2800 -96) или по величине внешней удельной поверхности (МУ 64 - 012 -89). Величина внешней удельной поверхности тритурации, изготовленной с лактозой, должна быть не менее 0, 65 м 2/г. 16
 Комплексные гомеопатические препараты p Комплексные гомеопатические препараты – это сложные смеси гомеопатических лекарственных средств. p 1. Препараты, содержащие один активный ингредиент в нескольких потенциях. Это препараты – Injeel (от injection + HEEL-название фирмы). Например, «Belladona- Injeel» содержит Belladona D 10, D 30, D 200 и D 1000. p Изготавливают в двух вариантах интенсивности: Injeel и Injeel-Forte. Препараты Forte содержат дополнительно низкие потенции средства. p Препараты Injeel применяются при острых патологических процессах, препараты Injeel-Forte – при хронических патологических процессах 17
Комплексные гомеопатические препараты p Комплексные гомеопатические препараты – это сложные смеси гомеопатических лекарственных средств. p 1. Препараты, содержащие один активный ингредиент в нескольких потенциях. Это препараты – Injeel (от injection + HEEL-название фирмы). Например, «Belladona- Injeel» содержит Belladona D 10, D 30, D 200 и D 1000. p Изготавливают в двух вариантах интенсивности: Injeel и Injeel-Forte. Препараты Forte содержат дополнительно низкие потенции средства. p Препараты Injeel применяются при острых патологических процессах, препараты Injeel-Forte – при хронических патологических процессах 17
 2. Препараты, содержащие не менее двух активных ингредиентов в одной и той же потенции. «Авиа. Море» ( «Avia – Mori» ) : Veratrum album (Чемерица белая) C 200 Cocculus (Анамирта коккулюс, рыбьи ягоды)C 200 Borax (Венецианская бура) C 200 p p 3. Препараты, содержащие не менее двух активных ингредиентов в нескольких потенциях. «Афлубина» ( «Aflubin» ) : Gentiana (Горечавка желтая) D 1 Aconitum (Борец ядовитый) D 6 Bryonia (Переступень белый) D 6 Ferrum phospharicum D 12 Acidum sarcolacticum D 12 18
2. Препараты, содержащие не менее двух активных ингредиентов в одной и той же потенции. «Авиа. Море» ( «Avia – Mori» ) : Veratrum album (Чемерица белая) C 200 Cocculus (Анамирта коккулюс, рыбьи ягоды)C 200 Borax (Венецианская бура) C 200 p p 3. Препараты, содержащие не менее двух активных ингредиентов в нескольких потенциях. «Афлубина» ( «Aflubin» ) : Gentiana (Горечавка желтая) D 1 Aconitum (Борец ядовитый) D 6 Bryonia (Переступень белый) D 6 Ferrum phospharicum D 12 Acidum sarcolacticum D 12 18
 ОЦИЛЛОКОКЦИНУМ Активные компоненты: p Экстракт печени и сердца дикой утки 200 К -0, 01 мл Вспомогательные компоненты: p Сахарозы, лактозы – до 1000 мг 19
ОЦИЛЛОКОКЦИНУМ Активные компоненты: p Экстракт печени и сердца дикой утки 200 К -0, 01 мл Вспомогательные компоненты: p Сахарозы, лактозы – до 1000 мг 19
 ХРАНЕНИЕ ГОМЕОПАТИЧЕСКИХ ЛЕКАРСТВЕННЫХ СРЕДСТВ p p p наилучшим температурным режимом является диапазон от+15 до +20 о С картонные коробочки не соответствуют требованию Ганемана к герметичности упаковки. Хранение лекарств в стеклянных контейнерах гарантирует их высокую стабильность в течение многих лет. Пластиковые контейнеры могут быть использованы только для краткосрочного хранения. Хранение лекарств в темном месте 20
ХРАНЕНИЕ ГОМЕОПАТИЧЕСКИХ ЛЕКАРСТВЕННЫХ СРЕДСТВ p p p наилучшим температурным режимом является диапазон от+15 до +20 о С картонные коробочки не соответствуют требованию Ганемана к герметичности упаковки. Хранение лекарств в стеклянных контейнерах гарантирует их высокую стабильность в течение многих лет. Пластиковые контейнеры могут быть использованы только для краткосрочного хранения. Хранение лекарств в темном месте 20
 ЛЕКАРСТВЕННЫЕ ВЕЩЕСТВА ОРГАНИЧЕСКОЙ ПРИРОДЫ. 21
ЛЕКАРСТВЕННЫЕ ВЕЩЕСТВА ОРГАНИЧЕСКОЙ ПРИРОДЫ. 21
 Причины роста ассортимента ЛС: 1. Недостаточная эффективность уже имеющихся лекарственных препаратов. 2. Нежелательные побочные действия некоторых хорошо известных лекарственных препаратов. 3. Ограниченные сроки годности самих препаратов или их лекарственных форм. 4. Приобретение устойчивости патогенных микроорганизмов к химиотерапевтическим препаратам. 5. Развитие новых областей медицины: нейрохирургии, грудной хирургии, реаниматологии, трансплантации потребовало создание новых препаратов для наркоза, иммунодепресантов, 22 ганглиоблокаторов и др. специфических ЛС.
Причины роста ассортимента ЛС: 1. Недостаточная эффективность уже имеющихся лекарственных препаратов. 2. Нежелательные побочные действия некоторых хорошо известных лекарственных препаратов. 3. Ограниченные сроки годности самих препаратов или их лекарственных форм. 4. Приобретение устойчивости патогенных микроорганизмов к химиотерапевтическим препаратам. 5. Развитие новых областей медицины: нейрохирургии, грудной хирургии, реаниматологии, трансплантации потребовало создание новых препаратов для наркоза, иммунодепресантов, 22 ганглиоблокаторов и др. специфических ЛС.
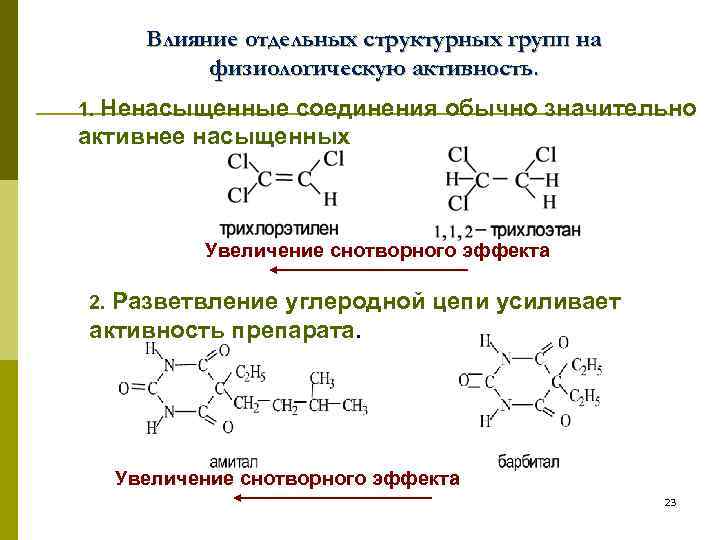 Влияние отдельных структурных групп на физиологическую активность. 1. Ненасыщенные соединения обычно значительно активнее насыщенных Увеличение снотворного эффекта 2. Разветвление углеродной цепи усиливает активность препарата. Увеличение снотворного эффекта 23
Влияние отдельных структурных групп на физиологическую активность. 1. Ненасыщенные соединения обычно значительно активнее насыщенных Увеличение снотворного эффекта 2. Разветвление углеродной цепи усиливает активность препарата. Увеличение снотворного эффекта 23
 Влияние отдельных структурных групп на физиологическую активность. 3. Введение галогена усиливает фармакологическую активность органических ЛС. СН 4 СН 3 Cl CHCl 3 Метан Хлористый метил Хлороформ Увеличение снотворного действия 4. Введение атома галогена в ароматические углеводороды изменяет токсичность препарата. C H 5 Cl С 6 Н 4 Cl 2 C 6 H 3 Cl 3 6 Хлорбензол Дихлорбензол Трихлорбензол Уменьшение токсичности Уменьшение фармакологической активности 24
Влияние отдельных структурных групп на физиологическую активность. 3. Введение галогена усиливает фармакологическую активность органических ЛС. СН 4 СН 3 Cl CHCl 3 Метан Хлористый метил Хлороформ Увеличение снотворного действия 4. Введение атома галогена в ароматические углеводороды изменяет токсичность препарата. C H 5 Cl С 6 Н 4 Cl 2 C 6 H 3 Cl 3 6 Хлорбензол Дихлорбензол Трихлорбензол Уменьшение токсичности Уменьшение фармакологической активности 24
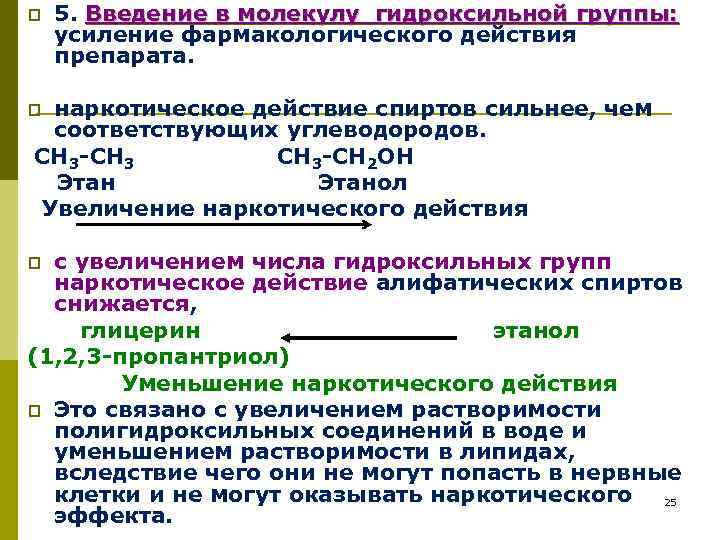 p 5. Введение в молекулу гидроксильной группы: усиление фармакологического действия препарата. наркотическое действие спиртов сильнее, чем соответствующих углеводородов. СН 3 -СН 3 СН 3 -СН 2 ОН Этан Этанол Увеличение наркотического действия p с увеличением числа гидроксильных групп наркотическое действие алифатических спиртов снижается, глицерин этанол (1, 2, 3 -пропантриол) Уменьшение наркотического действия p Это связано с увеличением растворимости полигидроксильных соединений в воде и уменьшением растворимости в липидах, вследствие чего они не могут попасть в нервные клетки и не могут оказывать наркотического 25 эффекта. p
p 5. Введение в молекулу гидроксильной группы: усиление фармакологического действия препарата. наркотическое действие спиртов сильнее, чем соответствующих углеводородов. СН 3 -СН 3 СН 3 -СН 2 ОН Этан Этанол Увеличение наркотического действия p с увеличением числа гидроксильных групп наркотическое действие алифатических спиртов снижается, глицерин этанол (1, 2, 3 -пропантриол) Уменьшение наркотического действия p Это связано с увеличением растворимости полигидроксильных соединений в воде и уменьшением растворимости в липидах, вследствие чего они не могут попасть в нервные клетки и не могут оказывать наркотического 25 эффекта. p
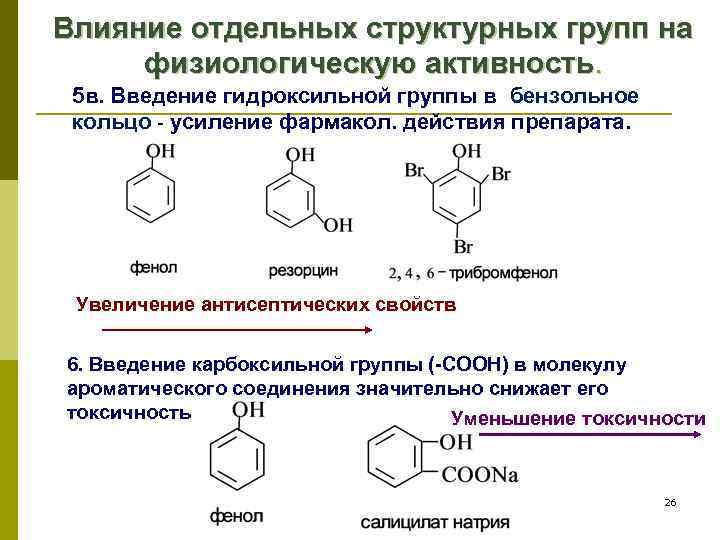 Влияние отдельных структурных групп на физиологическую активность. 5 в. Введение гидроксильной группы в бензольное кольцо - усиление фармакол. действия препарата. Увеличение антисептических свойств 6. Введение карбоксильной группы (-СООН) в молекулу ароматического соединения значительно снижает его токсичность Уменьшение токсичности 26
Влияние отдельных структурных групп на физиологическую активность. 5 в. Введение гидроксильной группы в бензольное кольцо - усиление фармакол. действия препарата. Увеличение антисептических свойств 6. Введение карбоксильной группы (-СООН) в молекулу ароматического соединения значительно снижает его токсичность Уменьшение токсичности 26
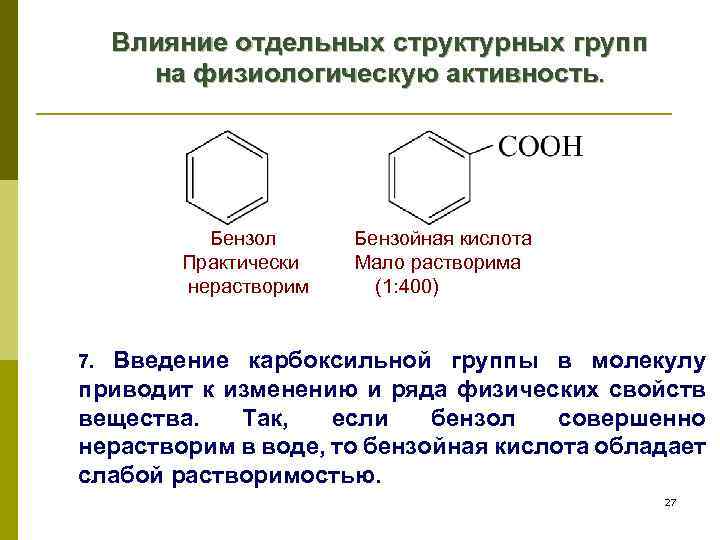 Влияние отдельных структурных групп на физиологическую активность. Бензол Бензойная кислота Практически Мало растворима нерастворим (1: 400) Введение карбоксильной группы в молекулу приводит к изменению и ряда физических свойств вещества. Так, если бензол совершенно нерастворим в воде, то бензойная кислота обладает слабой растворимостью. 7. 27
Влияние отдельных структурных групп на физиологическую активность. Бензол Бензойная кислота Практически Мало растворима нерастворим (1: 400) Введение карбоксильной группы в молекулу приводит к изменению и ряда физических свойств вещества. Так, если бензол совершенно нерастворим в воде, то бензойная кислота обладает слабой растворимостью. 7. 27
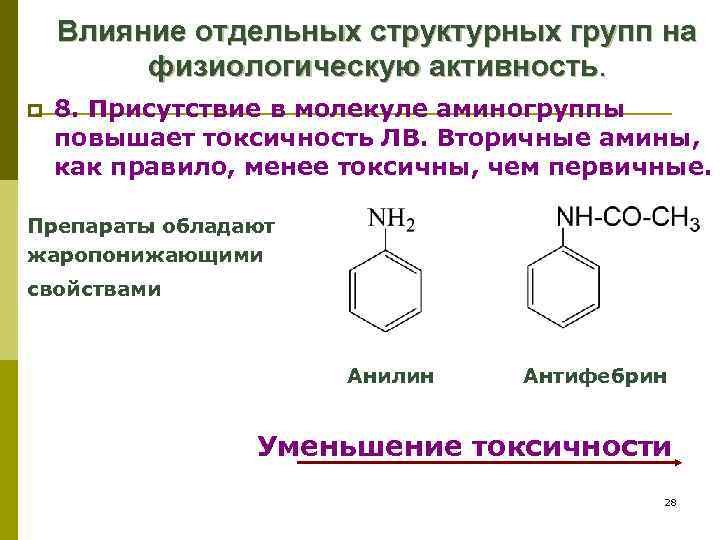 Влияние отдельных структурных групп на физиологическую активность. p 8. Присутствие в молекуле аминогруппы повышает токсичность ЛВ. Вторичные амины, как правило, менее токсичны, чем первичные. Препараты обладают жаропонижающими свойствами Анилин Антифебрин Уменьшение токсичности 28
Влияние отдельных структурных групп на физиологическую активность. p 8. Присутствие в молекуле аминогруппы повышает токсичность ЛВ. Вторичные амины, как правило, менее токсичны, чем первичные. Препараты обладают жаропонижающими свойствами Анилин Антифебрин Уменьшение токсичности 28
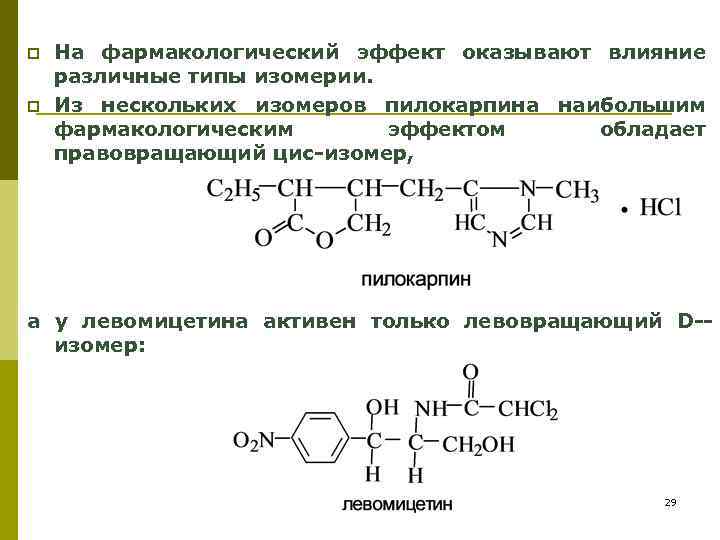 p p На фармакологический эффект оказывают влияние различные типы изомерии. Из нескольких изомеров пилокарпина наибольшим фармакологическим эффектом обладает правовращающий цис-изомер, а у левомицетина активен только левовращающий D-изомер: 29
p p На фармакологический эффект оказывают влияние различные типы изомерии. Из нескольких изомеров пилокарпина наибольшим фармакологическим эффектом обладает правовращающий цис-изомер, а у левомицетина активен только левовращающий D-изомер: 29
 Анализ лекарственных веществ органической природы 1. Отношение лекарственных веществ к прокаливанию. 1 А. Лекарственные вещества неорганической природы: вещества неорганической природы а) не горят и не обугливаются, практически не изменяются; б) при прокаливании можно наблюдать некоторые изменения (кристаллогидраты и гигроскопичные вещества) – вещества плавятся, расплав может кипеть, выделяя пар; tо Na 2 S 2 O 3 . 5 H 2 O плавится горит синим пламенем (SO 2). в)- вещество при нагревании может менять цвет: tо охл. Zn. O желтый белый желтый Bi. NO 3 Bi 2 O 3 (желто-оранжевый). желто-оранжевый p 30
Анализ лекарственных веществ органической природы 1. Отношение лекарственных веществ к прокаливанию. 1 А. Лекарственные вещества неорганической природы: вещества неорганической природы а) не горят и не обугливаются, практически не изменяются; б) при прокаливании можно наблюдать некоторые изменения (кристаллогидраты и гигроскопичные вещества) – вещества плавятся, расплав может кипеть, выделяя пар; tо Na 2 S 2 O 3 . 5 H 2 O плавится горит синим пламенем (SO 2). в)- вещество при нагревании может менять цвет: tо охл. Zn. O желтый белый желтый Bi. NO 3 Bi 2 O 3 (желто-оранжевый). желто-оранжевый p 30
 1 В. Лекарственные вещества органической природы, обычно, обугливаются при прокаливании или сгорают полностью, без остатка (спирт). p 1 С. Лекарственные вещества смешанной природы обугливаются и горят, образуя остаток К остатку добавляют минимальное количество воды и проверяют р. Н : · сильно-щелочные р. Н– это соли натрия и калия; · слабощелочные р. Н– соли кальция и магния, · почти нейтральные – соли тяжелых металлов. p p 2. Большинство органических соединений не являются электролитами, поэтому для их анализа не могут быть применены реакции 31 ионного типа.
1 В. Лекарственные вещества органической природы, обычно, обугливаются при прокаливании или сгорают полностью, без остатка (спирт). p 1 С. Лекарственные вещества смешанной природы обугливаются и горят, образуя остаток К остатку добавляют минимальное количество воды и проверяют р. Н : · сильно-щелочные р. Н– это соли натрия и калия; · слабощелочные р. Н– соли кальция и магния, · почти нейтральные – соли тяжелых металлов. p p 2. Большинство органических соединений не являются электролитами, поэтому для их анализа не могут быть применены реакции 31 ионного типа.
 Ø 3. Реакции органических веществ, как правило, Ø 4. Очень многие органические соединения имеют высокую молекулярную массу и сложное строение. идут медленно и часто их можно остановить на стадии образования промежуточных продуктов. 5. В исследовании органических лекарственных веществ большое значение имеет определение физических констант и химических свойств. · Для твердых веществ - температура плавления. · Для жидких веществ - температура кипения, плотность и показатель преломления. · Для масел и жиров - химические константы: кислородное число, число омыления, йодное число, перекисное число и др. Ø 32
Ø 3. Реакции органических веществ, как правило, Ø 4. Очень многие органические соединения имеют высокую молекулярную массу и сложное строение. идут медленно и часто их можно остановить на стадии образования промежуточных продуктов. 5. В исследовании органических лекарственных веществ большое значение имеет определение физических констант и химических свойств. · Для твердых веществ - температура плавления. · Для жидких веществ - температура кипения, плотность и показатель преломления. · Для масел и жиров - химические константы: кислородное число, число омыления, йодное число, перекисное число и др. Ø 32
 6. Присутствие в молекулах определенных функциональных групп обусловливает свойства органических соединений: · гидроксильная. · аминогруппа, · нитрогруппа, · альдегидная, · кетонная, · карбоксильная, · имидная группы, · непредельные связи и др. 7. Многие органические соединения содержат гетероатомы: серу, азот, фосфор, галогены и т. д. 33
6. Присутствие в молекулах определенных функциональных групп обусловливает свойства органических соединений: · гидроксильная. · аминогруппа, · нитрогруппа, · альдегидная, · кетонная, · карбоксильная, · имидная группы, · непредельные связи и др. 7. Многие органические соединения содержат гетероатомы: серу, азот, фосфор, галогены и т. д. 33
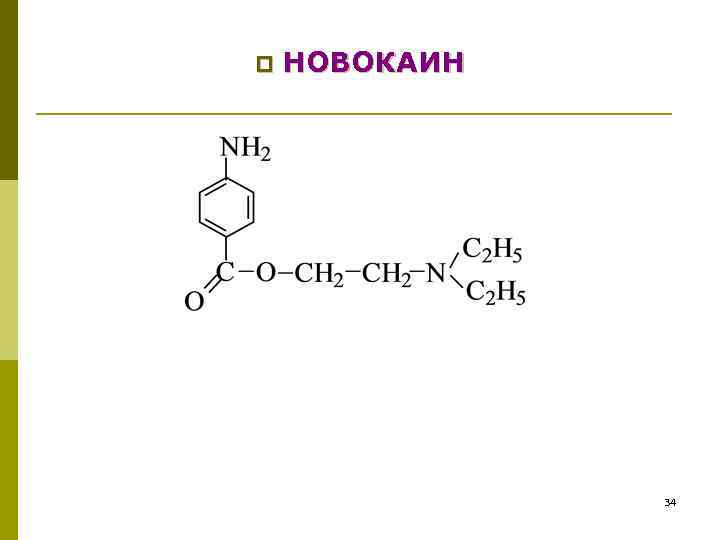 p НОВОКАИН 34
p НОВОКАИН 34
 Физико-химические методы p 1. Абсорбционные методы, или методы, основанные на поглощении излучения (спектроскопия в УФ (200 -400 нм) (для прозрачных растворов)- и видимой областях (для окрашенных растворов). p 2. ИК-спектрометрия позволяет идентифицировать вещество по характеристическим частотам. p 3. Методы, основанные на использовании магнитного поля (ЭПР-, ЯМР-спектроскопия и масс-спектроскопия); 4. Методы, основанные на поглощении и 35 дифракции рентгеновского излучения и т. д. p
Физико-химические методы p 1. Абсорбционные методы, или методы, основанные на поглощении излучения (спектроскопия в УФ (200 -400 нм) (для прозрачных растворов)- и видимой областях (для окрашенных растворов). p 2. ИК-спектрометрия позволяет идентифицировать вещество по характеристическим частотам. p 3. Методы, основанные на использовании магнитного поля (ЭПР-, ЯМР-спектроскопия и масс-спектроскопия); 4. Методы, основанные на поглощении и 35 дифракции рентгеновского излучения и т. д. p
 Классификация органических соединений Фармакологическая классификация. отражает принципы преимущественного действия препарата на ту или иную физиологическую систему (сердечнососудистую, центральную нервную систему и т. д. ). p Фармакотерапевтическая классификация. лекарственные препараты группируются в зависимости от применения для лечения определенного заболевания. p Классификации органических препаратов по строению их углеродного скелета 36
Классификация органических соединений Фармакологическая классификация. отражает принципы преимущественного действия препарата на ту или иную физиологическую систему (сердечнососудистую, центральную нервную систему и т. д. ). p Фармакотерапевтическая классификация. лекарственные препараты группируются в зависимости от применения для лечения определенного заболевания. p Классификации органических препаратов по строению их углеродного скелета 36
 Классификация органических соединений Ø Ø Ø Ø 1. Алифатические (ациклические) соединения, молекулы которых состоят из открытой, прямой или разветвленной цепи атомов углерода: - углеводороды (предельные и непредельные); - галогенпроизводные углеводородов; - спирты; - альдегиды и кетоны; - карбоновые кислоты и их производные; - эфиры простые и сложные; - амидированные производные угольной кислоты. 37
Классификация органических соединений Ø Ø Ø Ø 1. Алифатические (ациклические) соединения, молекулы которых состоят из открытой, прямой или разветвленной цепи атомов углерода: - углеводороды (предельные и непредельные); - галогенпроизводные углеводородов; - спирты; - альдегиды и кетоны; - карбоновые кислоты и их производные; - эфиры простые и сложные; - амидированные производные угольной кислоты. 37
 2. Карбоциклические соединения, в молекуле которых находится одно или замкнутых колец атомов углерода: несколько - Ароматические соединения (производные бензола); - фенолы, хиноны, ароматические кислоты и их соли и др. - Алициклические углеводороды: насыщенные (циклоалканы, например циклопропан) и ненасыщенные (циклоалкены – с одной двойной связью, циклоалкадиены – сдвумя двойными связями и т. д. ). 3. Гетероциклические соединения кольцо содержит не только атомы углерода, но и атомы других элементов (например: S, N, O). Производные фурана, пиразола, имидазола, пиридина и другие 38
2. Карбоциклические соединения, в молекуле которых находится одно или замкнутых колец атомов углерода: несколько - Ароматические соединения (производные бензола); - фенолы, хиноны, ароматические кислоты и их соли и др. - Алициклические углеводороды: насыщенные (циклоалканы, например циклопропан) и ненасыщенные (циклоалкены – с одной двойной связью, циклоалкадиены – сдвумя двойными связями и т. д. ). 3. Гетероциклические соединения кольцо содержит не только атомы углерода, но и атомы других элементов (например: S, N, O). Производные фурана, пиразола, имидазола, пиридина и другие 38
 ЛС ГАЛОГЕНОПРОИЗВОДНЫХ АЦИКЛИЧЕСКИХ АЛКАНОВ p Алканы: Сn. H 2 n+2 p Физические свойства галагеноуглеводородов зависят от природы и числа атомов галогена в молекуле. Ткип. о. С Плотность p фторометан СН 3 F – «-78 о» . 0, 877 (-79 о) p хлорометан СН 3 Cl – «-24 о» . 0, 991 (-25 о) бромометан СН 3 Br – «+4 о» . 1, 732 (0 о) p иодометан СН 3 I – «+42 о» . 2, 279 (20 о) 39
ЛС ГАЛОГЕНОПРОИЗВОДНЫХ АЦИКЛИЧЕСКИХ АЛКАНОВ p Алканы: Сn. H 2 n+2 p Физические свойства галагеноуглеводородов зависят от природы и числа атомов галогена в молекуле. Ткип. о. С Плотность p фторометан СН 3 F – «-78 о» . 0, 877 (-79 о) p хлорометан СН 3 Cl – «-24 о» . 0, 991 (-25 о) бромометан СН 3 Br – «+4 о» . 1, 732 (0 о) p иодометан СН 3 I – «+42 о» . 2, 279 (20 о) 39
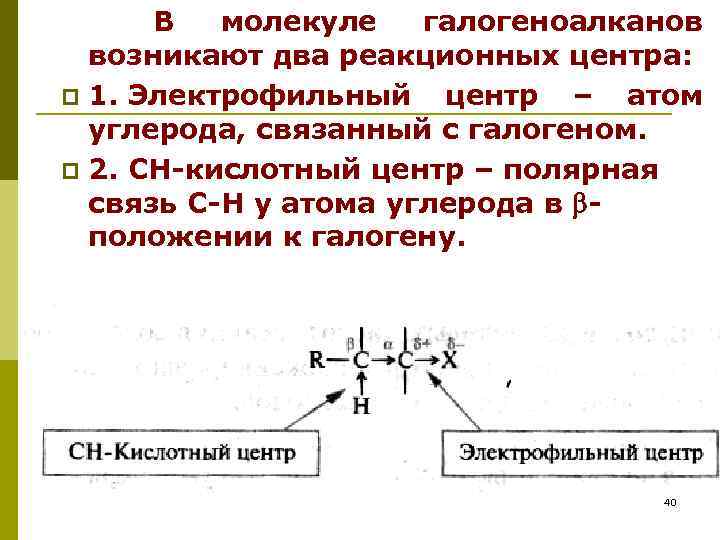 В молекуле галогеноалканов возникают два реакционных центра: p 1. Электрофильный центр – атом углерода, связанный с галогеном. p 2. СН-кислотный центр – полярная связь С-Н у атома углерода в положении к галогену. 40
В молекуле галогеноалканов возникают два реакционных центра: p 1. Электрофильный центр – атом углерода, связанный с галогеном. p 2. СН-кислотный центр – полярная связь С-Н у атома углерода в положении к галогену. 40
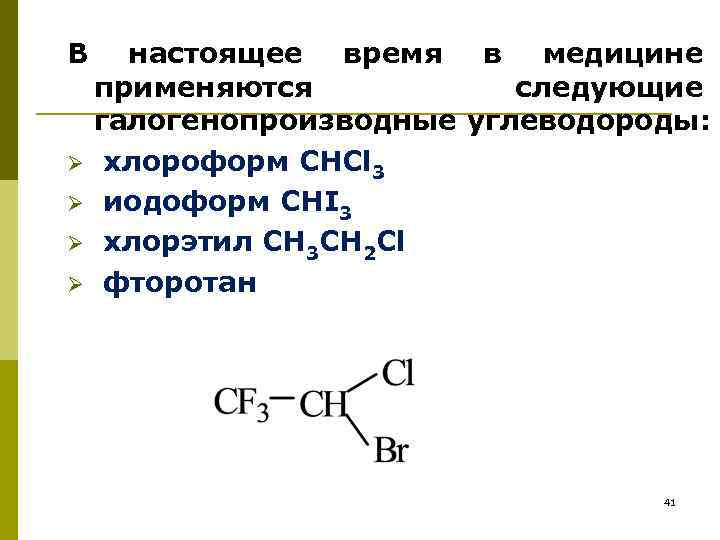 В настоящее время в медицине применяются следующие галогенопроизводные углеводороды: Ø хлороформ СНCl 3 Ø иодоформ CHI 3 Ø хлорэтил CH 3 CH 2 Cl Ø фторотан 41
В настоящее время в медицине применяются следующие галогенопроизводные углеводороды: Ø хлороформ СНCl 3 Ø иодоформ CHI 3 Ø хлорэтил CH 3 CH 2 Cl Ø фторотан 41
 ЛС ГАЛОГЕНОПРОИЗВОДНЫХ АЦИКЛИЧЕСКИХ АЛКАНОВ Хлорэтил Aethylii chloridum C 2 H 5 Cl М. r. 64, 51 Синонимы: Этилхлорид, Ethyl Chloride (ЕР). ОПИСАНИЕ. Хлористый этил представляет собой прозрачную бесцветную жидкость, легко летучую, со своеобразным фруктовым запахом. Ø Температура кипения 12 -130 С. Ø Огнеопасен. Горит, окрашивая пламя в зеленый цвет. Ø Трудно растворим в воде (1: 50). Смешивается в 42 любых соотношениях со спиртом и эфиром.
ЛС ГАЛОГЕНОПРОИЗВОДНЫХ АЦИКЛИЧЕСКИХ АЛКАНОВ Хлорэтил Aethylii chloridum C 2 H 5 Cl М. r. 64, 51 Синонимы: Этилхлорид, Ethyl Chloride (ЕР). ОПИСАНИЕ. Хлористый этил представляет собой прозрачную бесцветную жидкость, легко летучую, со своеобразным фруктовым запахом. Ø Температура кипения 12 -130 С. Ø Огнеопасен. Горит, окрашивая пламя в зеленый цвет. Ø Трудно растворим в воде (1: 50). Смешивается в 42 любых соотношениях со спиртом и эфиром.
 ПОЛУЧЕНИЕ ХЛОРЭТИЛА 1. Пропусканием смеси этилена с HCl над безводным Fe. Cl 3 при 150 – 2000 С. СН 2 = СН 2 + HCl СН 3 СН 2 Cl p 2. HCl при нагревании до 110 - 1200 С пропускают в абсолютный этиловый спирт в присутствии серная кислота, СН 3 СН 2 ОН + HCl СН 3 СН 2 Cl p 3. Хлорированием этана в газовой среде: СН 3 + Сl 2 C 2 H 5 Cl + HCl p 43
ПОЛУЧЕНИЕ ХЛОРЭТИЛА 1. Пропусканием смеси этилена с HCl над безводным Fe. Cl 3 при 150 – 2000 С. СН 2 = СН 2 + HCl СН 3 СН 2 Cl p 2. HCl при нагревании до 110 - 1200 С пропускают в абсолютный этиловый спирт в присутствии серная кислота, СН 3 СН 2 ОН + HCl СН 3 СН 2 Cl p 3. Хлорированием этана в газовой среде: СН 3 + Сl 2 C 2 H 5 Cl + HCl p 43
 Определение подлинности. p 1. (ГФ): C 2 H 5 Cl + KOH (спиртовой раствор) нагревание KCl + C 2 H 5 OH KCl + Ag. NO 3 Ag. Cl + KNO 3 2. (ГФ) Определение температуры кипения – Ткип. = 12 -130 С 3. (ГФ) Плотность: 0, 919 -0, 923 (при температуре 00 С). 44
Определение подлинности. p 1. (ГФ): C 2 H 5 Cl + KOH (спиртовой раствор) нагревание KCl + C 2 H 5 OH KCl + Ag. NO 3 Ag. Cl + KNO 3 2. (ГФ) Определение температуры кипения – Ткип. = 12 -130 С 3. (ГФ) Плотность: 0, 919 -0, 923 (при температуре 00 С). 44
 ПОДЛИННОСТЬ (ЕР): 1. ИК-абсорбционный спектр 2. Хлорэтил горит люминесцентным пламенем с образованием кислотного газа. . 3. Температура кипения 1212, 5 о. С 4. Плотность 0, 921 -0, 926 при 0 о. С 45
ПОДЛИННОСТЬ (ЕР): 1. ИК-абсорбционный спектр 2. Хлорэтил горит люминесцентным пламенем с образованием кислотного газа. . 3. Температура кипения 1212, 5 о. С 4. Плотность 0, 921 -0, 926 при 0 о. С 45
 Испытания на чистоту. 1. Не допускается примесь спирта, который определяется йодоформенной пробой (ГФ, ЕР): Не должно появляться мути. C 2 H 5 OH + 4 I 2 + 6 KOH CHI 3 + 5 KI + HCOOK + 5 H 2 O p p 2. Не допускается примесь этилена и других органических примесей (ГФ): по побурению р-ра с серной к-той 46
Испытания на чистоту. 1. Не допускается примесь спирта, который определяется йодоформенной пробой (ГФ, ЕР): Не должно появляться мути. C 2 H 5 OH + 4 I 2 + 6 KOH CHI 3 + 5 KI + HCOOK + 5 H 2 O p p 2. Не допускается примесь этилена и других органических примесей (ГФ): по побурению р-ра с серной к-той 46
 3. Устанавливается предел кислотности. p 4. Не допускаются органические примеси (ЕР). Определяют при испарении этилхлорида: во время испарения не должно быть никаких посторонних запахов! 5. Остаток при испарении (ГФ, ЕР): не должен превышать одной сотой процента и не должен иметь постороннего запаха. p 47
3. Устанавливается предел кислотности. p 4. Не допускаются органические примеси (ЕР). Определяют при испарении этилхлорида: во время испарения не должно быть никаких посторонних запахов! 5. Остаток при испарении (ГФ, ЕР): не должен превышать одной сотой процента и не должен иметь постороннего запаха. p 47
 ПРИМЕНЕНИЕ ХЛОРЭТИЛА редко как средство для ингаляционного (кратковременного) наркоза; p Ø Ø как местноанестезирующее средство для обезболивания поверхности ткани; Ø для уменьшения кожного зуда, Ø Ø для лечения рожистого воспаления и т. д. Противопоказанием к применению является нарушение целостности кожного покрова, заболевание сосудов. 48
ПРИМЕНЕНИЕ ХЛОРЭТИЛА редко как средство для ингаляционного (кратковременного) наркоза; p Ø Ø как местноанестезирующее средство для обезболивания поверхности ткани; Ø для уменьшения кожного зуда, Ø Ø для лечения рожистого воспаления и т. д. Противопоказанием к применению является нарушение целостности кожного покрова, заболевание сосудов. 48
 ХРАНЕНИЕ. Ø Ø Ø Хранить препарат следует в прохладном, защищенном от света месте. Огнеопасен и требует осторожного обращения с ним. Выпускается в ампулах по 30 мл или склянках со специальным затвором. 49
ХРАНЕНИЕ. Ø Ø Ø Хранить препарат следует в прохладном, защищенном от света месте. Огнеопасен и требует осторожного обращения с ним. Выпускается в ампулах по 30 мл или склянках со специальным затвором. 49
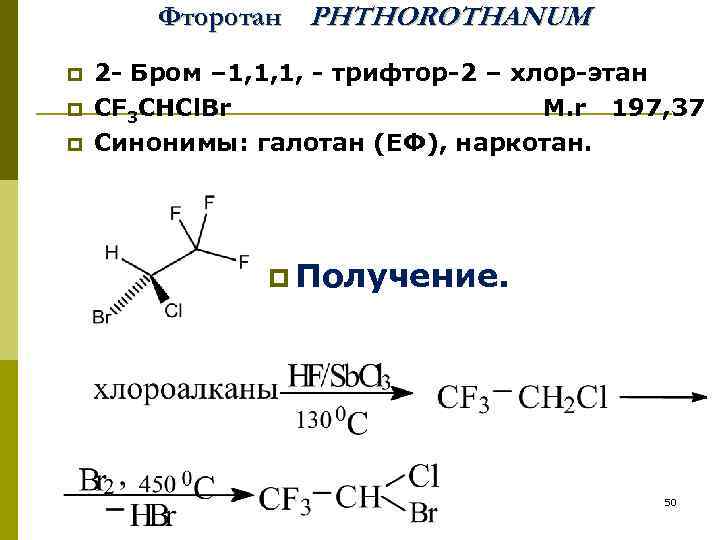 Фторотан PHTHOROTHANUM p p p 2 - Бром – 1, 1, 1, - трифтор-2 – хлор-этан CF 3 CHCl. Br М. r 197, 37 Синонимы: галотан (ЕФ), наркотан. p Получение. 50
Фторотан PHTHOROTHANUM p p p 2 - Бром – 1, 1, 1, - трифтор-2 – хлор-этан CF 3 CHCl. Br М. r 197, 37 Синонимы: галотан (ЕФ), наркотан. p Получение. 50
 p Описание. Прозрачная бесцветная, тяжелая подвижная, легко летучая жидкость, со жгучим сладковатым запахом и вкусом, напоминающим хлороформ. Не горит и не воспламеняется. p Мало растворим в воде (0. 345 %), смешивается со спиртом, эфиром, трихлорэтиленом, хлороформом и с летучими и нелетучими маслами. p Под действием света медленно разлагается, поэтому для стабилизации добавляют тимол (0. 01 %) ТИМОЛ 51
p Описание. Прозрачная бесцветная, тяжелая подвижная, легко летучая жидкость, со жгучим сладковатым запахом и вкусом, напоминающим хлороформ. Не горит и не воспламеняется. p Мало растворим в воде (0. 345 %), смешивается со спиртом, эфиром, трихлорэтиленом, хлороформом и с летучими и нелетучими маслами. p Под действием света медленно разлагается, поэтому для стабилизации добавляют тимол (0. 01 %) ТИМОЛ 51
 Определение подлинности p p Плотность фторотана больше, чем плотность серной кислоты (1, 83 -1, 835), поэтому после прибавления фторотана к концентрированной серной кислоте, препарат должен находиться в нижнем слое. Это испытание помогает отличить фторотан от хлороформа, имеющего плотность 1, 474 -1, 483. 52
Определение подлинности p p Плотность фторотана больше, чем плотность серной кислоты (1, 83 -1, 835), поэтому после прибавления фторотана к концентрированной серной кислоте, препарат должен находиться в нижнем слое. Это испытание помогает отличить фторотан от хлороформа, имеющего плотность 1, 474 -1, 483. 52
 2. По идентичности ИК-спектров препарата и стандартного образца (ГФ и ЕФ). 3. (ГФ) Для подтверждения присутствия фтора в молекуле, фторотан нагревают с расплавленным металлическим натрием: CF 3 -CHCl. Br + Na Na. F p 53
2. По идентичности ИК-спектров препарата и стандартного образца (ГФ и ЕФ). 3. (ГФ) Для подтверждения присутствия фтора в молекуле, фторотан нагревают с расплавленным металлическим натрием: CF 3 -CHCl. Br + Na Na. F p 53
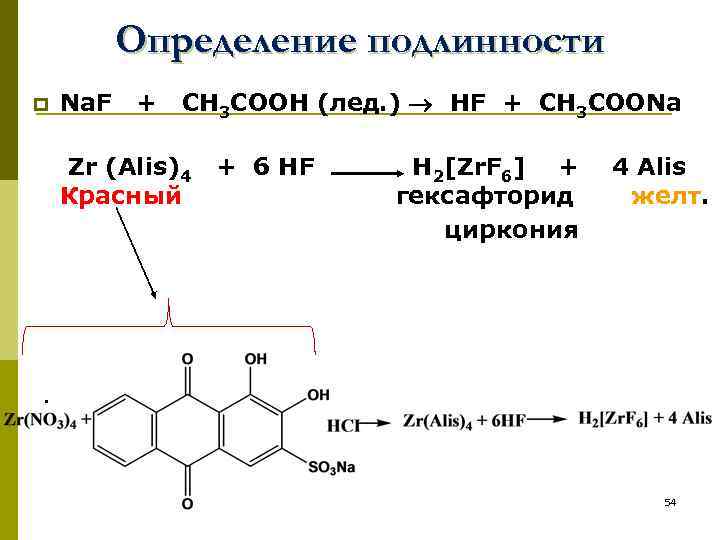 Определение подлинности p Na. F + CH 3 COOH (лед. ) HF + CH 3 COONa Zr (Alis)4 + 6 HF H 2[Zr. F 6] + 4 Alis Красный гексафторид желт. циркония . 54
Определение подлинности p Na. F + CH 3 COOH (лед. ) HF + CH 3 COONa Zr (Alis)4 + 6 HF H 2[Zr. F 6] + 4 Alis Красный гексафторид желт. циркония . 54
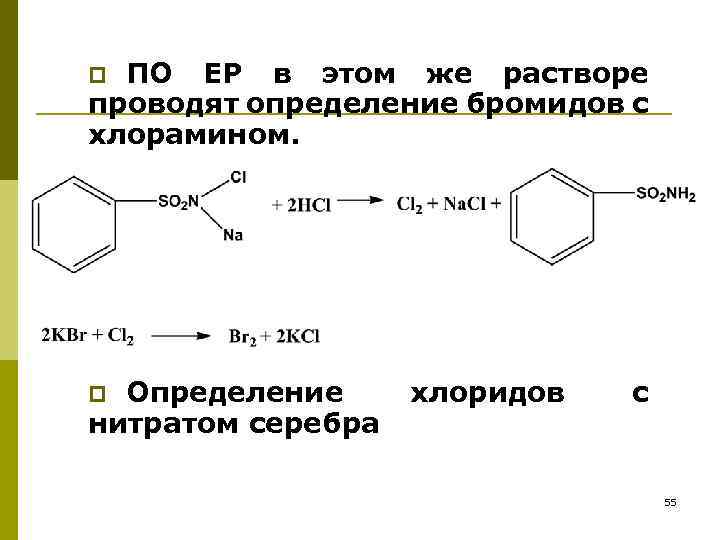 ПО ЕР в этом же растворе проводят определение бромидов с хлорамином. p Определение нитратом серебра p хлоридов с 55
ПО ЕР в этом же растворе проводят определение бромидов с хлорамином. p Определение нитратом серебра p хлоридов с 55
 Испытание на чистоту 1. Хлориды и бромиды (Недопустимая примесь): препарат встряхивают с водой, к водному слою добавляют азотную кислоту и нитрат серебра – не должно быть опалесценции p 2. Сводобный хлор и бром (Недопустимая примесь): к водному слою добавляют иодид калия и раствор крахмала – не должно быть синего окрашивания: Cl 2 + 2 KI I 2 + 2 KCl p 56
Испытание на чистоту 1. Хлориды и бромиды (Недопустимая примесь): препарат встряхивают с водой, к водному слою добавляют азотную кислоту и нитрат серебра – не должно быть опалесценции p 2. Сводобный хлор и бром (Недопустимая примесь): к водному слою добавляют иодид калия и раствор крахмала – не должно быть синего окрашивания: Cl 2 + 2 KI I 2 + 2 KCl p 56
 Тимол: Берут 3 сухих цилиндра с притертыми пробкамии 1. Фторотан (0, 225 г растворяют в CCl 4 и доводят до метки 100 мл. 2. Раствор N 1 (станд р-р тимола 0, 012%в CCl 4) 3. Раствор N 2 ((станд р-р тимола 6, 7%в CCl 4) В цилиндры добавляют Ti. O 2: желто-бурая окраска Содержание тимола 0, 008 -0, 012%. p № 1 Фторотан № 2 p ЕР: Газ. Хромат 57
Тимол: Берут 3 сухих цилиндра с притертыми пробкамии 1. Фторотан (0, 225 г растворяют в CCl 4 и доводят до метки 100 мл. 2. Раствор N 1 (станд р-р тимола 0, 012%в CCl 4) 3. Раствор N 2 ((станд р-р тимола 6, 7%в CCl 4) В цилиндры добавляют Ti. O 2: желто-бурая окраска Содержание тимола 0, 008 -0, 012%. p № 1 Фторотан № 2 p ЕР: Газ. Хромат 57
 p Хранение. Под действием света фторотан медленно разлагается, поэтому хранят его в хорошо закрытых склянках оранжевого стекла по 50 мл, в прохладном, защищенном от света месте. Через 6 месяцев проводят контрольный анализ. 58
p Хранение. Под действием света фторотан медленно разлагается, поэтому хранят его в хорошо закрытых склянках оранжевого стекла по 50 мл, в прохладном, защищенном от света месте. Через 6 месяцев проводят контрольный анализ. 58
 p Применение. Средство для ингаляционного наркоза при различных хирургических операциях, особенно на органах грудной полости, не вызывает раздражения слизистых оболочек дыхательных путей и слабо влияет на функцию почек. p Фторотан не следует применять при повышенном содержании адреналина в крови, осторожно применять у больных с нарушением ритма сердца. p Применяют фторотан в смеси с кислородом или закисью азота и кислородом, а также в виде смеси из 2 ч. фторотана и 1 ч. эфира. 59
p Применение. Средство для ингаляционного наркоза при различных хирургических операциях, особенно на органах грудной полости, не вызывает раздражения слизистых оболочек дыхательных путей и слабо влияет на функцию почек. p Фторотан не следует применять при повышенном содержании адреналина в крови, осторожно применять у больных с нарушением ритма сердца. p Применяют фторотан в смеси с кислородом или закисью азота и кислородом, а также в виде смеси из 2 ч. фторотана и 1 ч. эфира. 59
 p ЛС НА ОСНОВЕ СПИРТОВ, ПРОСТЫХ И СЛОЖНЫХ ЭФИРОВ
p ЛС НА ОСНОВЕ СПИРТОВ, ПРОСТЫХ И СЛОЖНЫХ ЭФИРОВ
 Спиртами называются производные углеводородов, в молекулах которых содержится одна или несколько гидроксильных групп (ОН), связанных с атомами углерода. • По числу гидроксильных групп, содержащихся в молекуле, спирты делятся на одно-, двух-, трех- и многоатомные. • СН 3 СН 2 ОН НОСН 2 ОН НОСН 2 СНСН 2 ОН ОН • ЭТАНОЛ ЭТАНДИОЛ-1, 2 ПРОПАНТРИОЛ 1, 2, 3 (ЭТИЛЕНГЛИКОЛЬ) (ГЛИЦЕРИН)
Спиртами называются производные углеводородов, в молекулах которых содержится одна или несколько гидроксильных групп (ОН), связанных с атомами углерода. • По числу гидроксильных групп, содержащихся в молекуле, спирты делятся на одно-, двух-, трех- и многоатомные. • СН 3 СН 2 ОН НОСН 2 ОН НОСН 2 СНСН 2 ОН ОН • ЭТАНОЛ ЭТАНДИОЛ-1, 2 ПРОПАНТРИОЛ 1, 2, 3 (ЭТИЛЕНГЛИКОЛЬ) (ГЛИЦЕРИН)
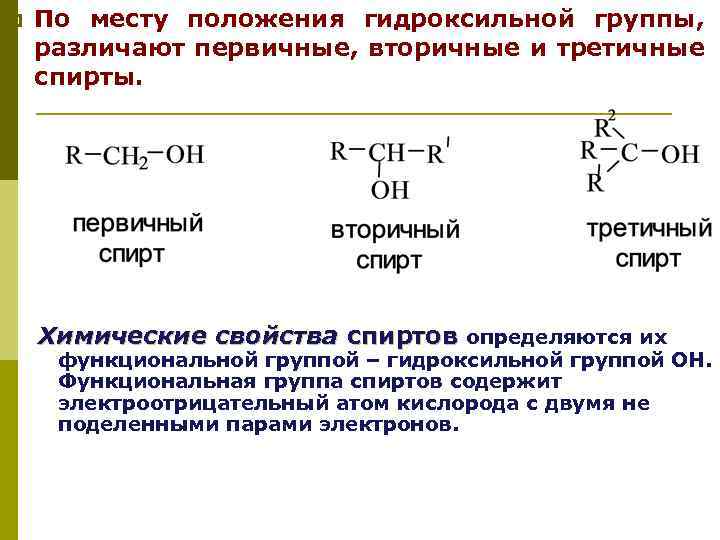 p По месту положения гидроксильной группы, различают первичные, вторичные и третичные спирты. Химические свойства спиртов определяются их функциональной группой – гидроксильной группой ОН. Функциональная группа спиртов содержит электроотрицательный атом кислорода с двумя не поделенными парами электронов.
p По месту положения гидроксильной группы, различают первичные, вторичные и третичные спирты. Химические свойства спиртов определяются их функциональной группой – гидроксильной группой ОН. Функциональная группа спиртов содержит электроотрицательный атом кислорода с двумя не поделенными парами электронов.
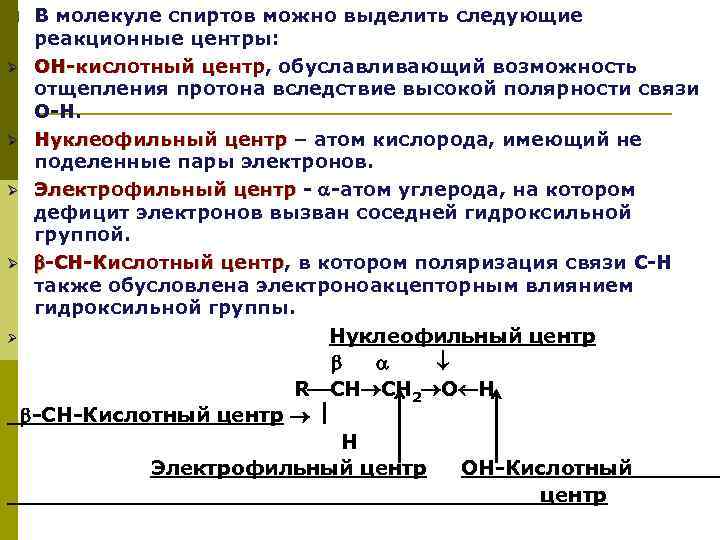 p Ø Ø Ø В молекуле спиртов можно выделить следующие реакционные центры: ОН-кислотный центр, обуславливающий возможность ОН-кислотный центр отщепления протона вследствие высокой полярности связи О-Н. Нуклеофильный центр – атом кислорода, имеющий не Нуклеофильный центр поделенные пары электронов. Электрофильный центр - -атом углерода, на котором Электрофильный центр дефицит электронов вызван соседней гидроксильной группой. -СН-Кислотный центр, в котором поляризация связи С-Н -СН-Кислотный центр также обусловлена электроноакцепторным влиянием гидроксильной группы. Нуклеофильный центр R СН СН 2 О Н -СН-Кислотный центр Н Электрофильный центр ОН-Кислотный центр
p Ø Ø Ø В молекуле спиртов можно выделить следующие реакционные центры: ОН-кислотный центр, обуславливающий возможность ОН-кислотный центр отщепления протона вследствие высокой полярности связи О-Н. Нуклеофильный центр – атом кислорода, имеющий не Нуклеофильный центр поделенные пары электронов. Электрофильный центр - -атом углерода, на котором Электрофильный центр дефицит электронов вызван соседней гидроксильной группой. -СН-Кислотный центр, в котором поляризация связи С-Н -СН-Кислотный центр также обусловлена электроноакцепторным влиянием гидроксильной группы. Нуклеофильный центр R СН СН 2 О Н -СН-Кислотный центр Н Электрофильный центр ОН-Кислотный центр
 Реакции, характерные для спиртов p p 1. Реакции ОН-кислотного центра: Спирты - это амфотерные соединения с очень слабыми кислотными и слабыми основными свойствами. Поэтому разрыв связи происходит под действием активных металлов (K, Na, Al, Mg) с образованием солей (алкоголятов или алкоксидов): 2 С 2 Н 5 ОН + 2 Na 2 С 2 Н 5 ONa + Н 2 этоксид (алкоголят) натрия p Этиловый спирт – абсолютный, а не ректификат. Реакция идет бурно с выделением водорода. В конце реакции образуется белый осадок этилата натрия, растворимый в спиртах и гидрализуемый водой: С 2 Н 5 ОNa + H 2 О C 2 H 5 OH + Na. OH.
Реакции, характерные для спиртов p p 1. Реакции ОН-кислотного центра: Спирты - это амфотерные соединения с очень слабыми кислотными и слабыми основными свойствами. Поэтому разрыв связи происходит под действием активных металлов (K, Na, Al, Mg) с образованием солей (алкоголятов или алкоксидов): 2 С 2 Н 5 ОН + 2 Na 2 С 2 Н 5 ONa + Н 2 этоксид (алкоголят) натрия p Этиловый спирт – абсолютный, а не ректификат. Реакция идет бурно с выделением водорода. В конце реакции образуется белый осадок этилата натрия, растворимый в спиртах и гидрализуемый водой: С 2 Н 5 ОNa + H 2 О C 2 H 5 OH + Na. OH.
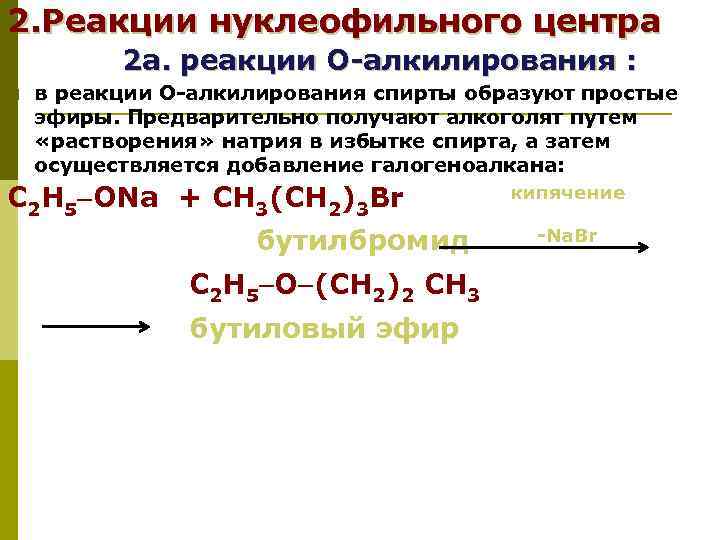 2. Реакции нуклеофильного центра 2 а. реакции О-алкилирования : p в реакции О-алкилирования спирты образуют простые эфиры. Предварительно получают алкоголят путем «растворения» натрия в избытке спирта, а затем осуществляется добавление галогеноалкана: С 2 Н 5 ONa + СН 3(СН 2)3 Br кипячение бутилбромид -Na. Br С 2 Н 5 O (СН 2)2 СН 3 бутиловый эфир
2. Реакции нуклеофильного центра 2 а. реакции О-алкилирования : p в реакции О-алкилирования спирты образуют простые эфиры. Предварительно получают алкоголят путем «растворения» натрия в избытке спирта, а затем осуществляется добавление галогеноалкана: С 2 Н 5 ONa + СН 3(СН 2)3 Br кипячение бутилбромид -Na. Br С 2 Н 5 O (СН 2)2 СН 3 бутиловый эфир
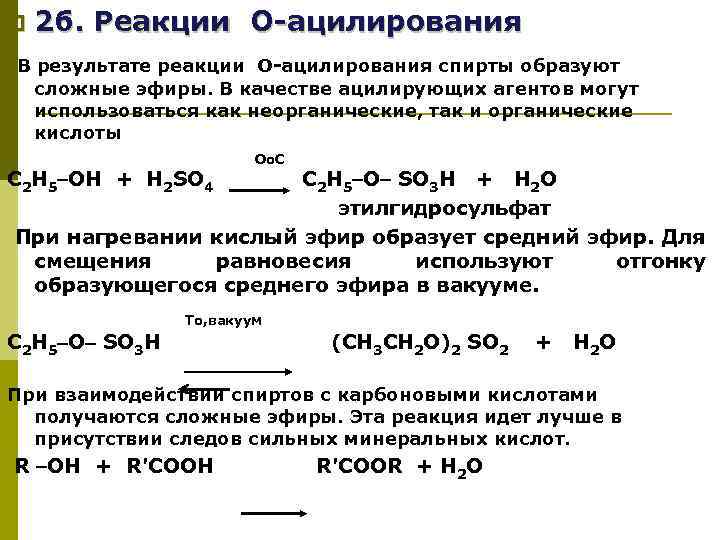 p 2 б. Реакции О-ацилирования В результате реакции О-ацилирования спирты образуют сложные эфиры. В качестве ацилирующих агентов могут использоваться как неорганические, так и органические кислоты о. С О С 2 Н 5 OН + Н 2 SO 4 С 2 Н 5 O SO 3 Н + H 2 O этилгидросульфат При нагревании кислый эфир образует средний эфир. Для смещения равновесия используют отгонку образующегося среднего эфира в вакууме. To, вакуум С 2 Н 5 O SO 3 Н (СН 3 СН 2 О)2 SO 2 + H 2 O При взаимодействии спиртов с карбоновыми кислотами получаются сложные эфиры. Эта реакция идет лучше в присутствии следов сильных минеральных кислот. R ОН + R'COOH R'COOR + Н 2 О
p 2 б. Реакции О-ацилирования В результате реакции О-ацилирования спирты образуют сложные эфиры. В качестве ацилирующих агентов могут использоваться как неорганические, так и органические кислоты о. С О С 2 Н 5 OН + Н 2 SO 4 С 2 Н 5 O SO 3 Н + H 2 O этилгидросульфат При нагревании кислый эфир образует средний эфир. Для смещения равновесия используют отгонку образующегося среднего эфира в вакууме. To, вакуум С 2 Н 5 O SO 3 Н (СН 3 СН 2 О)2 SO 2 + H 2 O При взаимодействии спиртов с карбоновыми кислотами получаются сложные эфиры. Эта реакция идет лучше в присутствии следов сильных минеральных кислот. R ОН + R'COOH R'COOR + Н 2 О
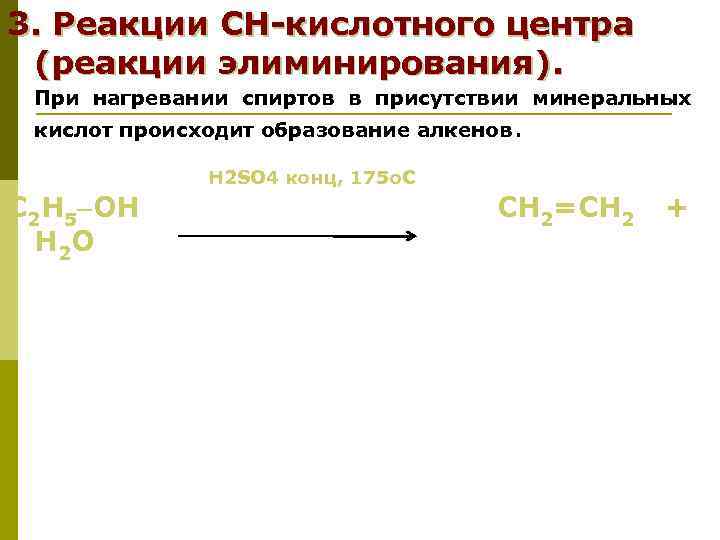 3. Реакции СН-кислотного центра (реакции элиминирования). При нагревании спиртов в присутствии минеральных кислот происходит образование алкенов. Н 2 SO 4 конц, 175 о. С С 2 Н 5 OН СН 2=СН 2 + Н 2 О
3. Реакции СН-кислотного центра (реакции элиминирования). При нагревании спиртов в присутствии минеральных кислот происходит образование алкенов. Н 2 SO 4 конц, 175 о. С С 2 Н 5 OН СН 2=СН 2 + Н 2 О
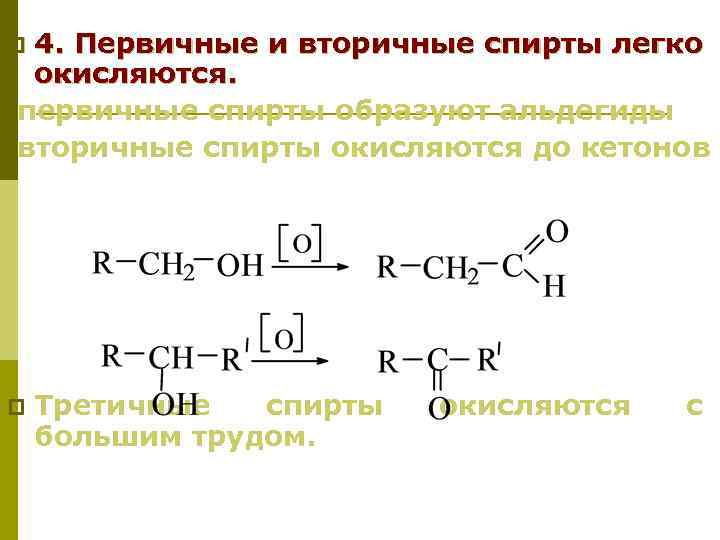 4. Первичные и вторичные спирты легко окисляются. первичные спирты образуют альдегиды вторичные спирты окисляются до кетонов p Третичные спирты большим трудом. окисляются с
4. Первичные и вторичные спирты легко окисляются. первичные спирты образуют альдегиды вторичные спирты окисляются до кетонов p Третичные спирты большим трудом. окисляются с
 Лекарственные средства на основе спиртов. ЛС: одноатомный спирт– этиловый спирт трехатомный спирт – глицерин. p p Спирт этиловый 95% Spiritus aethylicus (ГФ: 90%, 70% и 40% спирт). p C 2 H 5 OH М. r. 46, 07 p Синонимы: спирт винный, этанол
Лекарственные средства на основе спиртов. ЛС: одноатомный спирт– этиловый спирт трехатомный спирт – глицерин. p p Спирт этиловый 95% Spiritus aethylicus (ГФ: 90%, 70% и 40% спирт). p C 2 H 5 OH М. r. 46, 07 p Синонимы: спирт винный, этанол
 ПОЛУЧЕНИЕ ЭТИЛОВОГО СПИРТА 1. Этиловый спирт получают из этилена: p А. Сернокислотный способ гидратации этилена основан на взаимодействии этилена с серной кислотой с образованием кислого этилсульфата, который при гидролизе разлагается на этанол и серную кислоту: H 2 C=CH 2 + H 2 SO 4 CH 3 CH 2 OSO 3 H + Н 2 О CH 3 CH 2 OН + H 2 SO 4 p Б. Прямая гидратация этилена (280 -300 о. С, 70 -80 атм. ) H 2 C=CH 2 + Н 2 О CH 3 CH 2 OН 2. Этиловый спирт получают спиртовым брожением сахаристых веществ: С 6 Н 12 О 6 ФЕРМЕНТ ДРОЖЖЕЙ 2 С 2 Н 5 ОН + 2 СО 2 p Концентрация спирта выражается в весовых или объемных процентах (в градусах 1° =1 об %).
ПОЛУЧЕНИЕ ЭТИЛОВОГО СПИРТА 1. Этиловый спирт получают из этилена: p А. Сернокислотный способ гидратации этилена основан на взаимодействии этилена с серной кислотой с образованием кислого этилсульфата, который при гидролизе разлагается на этанол и серную кислоту: H 2 C=CH 2 + H 2 SO 4 CH 3 CH 2 OSO 3 H + Н 2 О CH 3 CH 2 OН + H 2 SO 4 p Б. Прямая гидратация этилена (280 -300 о. С, 70 -80 атм. ) H 2 C=CH 2 + Н 2 О CH 3 CH 2 OН 2. Этиловый спирт получают спиртовым брожением сахаристых веществ: С 6 Н 12 О 6 ФЕРМЕНТ ДРОЖЖЕЙ 2 С 2 Н 5 ОН + 2 СО 2 p Концентрация спирта выражается в весовых или объемных процентах (в градусах 1° =1 об %).
 ОПИСАНИЕ. Этиловый спирт—прозрачная жидкость. Летуч, легко воспламеняется, имеет характерный запах, жгучий вкус; Горит синеватым, слабо светящимся бездымным пламенем. Смешивается во всех отношениях с водой, эфиром, хлороформом, ацетоном и глицерином. Температура кипения 78 о С. Смесь с воздухом 3 -19 % взрывоопасна. p
ОПИСАНИЕ. Этиловый спирт—прозрачная жидкость. Летуч, легко воспламеняется, имеет характерный запах, жгучий вкус; Горит синеватым, слабо светящимся бездымным пламенем. Смешивается во всех отношениях с водой, эфиром, хлороформом, ацетоном и глицерином. Температура кипения 78 о С. Смесь с воздухом 3 -19 % взрывоопасна. p
 p ПОДЛИННОСТЬ 1. йодоформенная проба: При нагревании спирта с йодом в щелочной среде ощущается запах йодоформа: C 2 H 5 OH + 4 I 2 + 6 KOH CHI 3 + 5 KI + HCOOK + 5 H 2 O желтый йодоформную пробу могут давать соединения, имеющие этоксильную группу — OC 2 H 5, некоторые кетоны, оксикислоты и т. д. 2. Реакция этерификации. В присутствии концентрированной серной кислоты Образуется уксусноэтиловый эфир (этил-ацетат), обладающий своеобразным запахом: CH 3 CH 2 OН + CH 3 COOH H 2 SO 4 CH 3 CH 2 O – CO - CH 3
p ПОДЛИННОСТЬ 1. йодоформенная проба: При нагревании спирта с йодом в щелочной среде ощущается запах йодоформа: C 2 H 5 OH + 4 I 2 + 6 KOH CHI 3 + 5 KI + HCOOK + 5 H 2 O желтый йодоформную пробу могут давать соединения, имеющие этоксильную группу — OC 2 H 5, некоторые кетоны, оксикислоты и т. д. 2. Реакция этерификации. В присутствии концентрированной серной кислоты Образуется уксусноэтиловый эфир (этил-ацетат), обладающий своеобразным запахом: CH 3 CH 2 OН + CH 3 COOH H 2 SO 4 CH 3 CH 2 O – CO - CH 3
 3. Реакция окисления (не фармакопейная). Ощущается запах уксусного альдегида, напоминающий запах прелых яблок: 3 CH 2 OН + K 2 Cr 2 O 7 + 4 H 2 SO 4 Cr 2(SO 4)3 +3 + K 2 SO 4 + 7 H 2 O Цвет изменяется зеленого. от оранжево-красного до
3. Реакция окисления (не фармакопейная). Ощущается запах уксусного альдегида, напоминающий запах прелых яблок: 3 CH 2 OН + K 2 Cr 2 O 7 + 4 H 2 SO 4 Cr 2(SO 4)3 +3 + K 2 SO 4 + 7 H 2 O Цвет изменяется зеленого. от оранжево-красного до
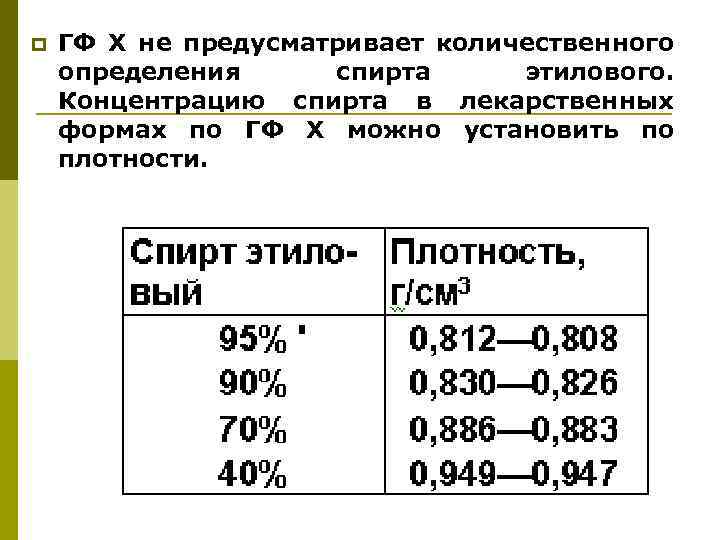 p ГФ Х не предусматривает количественного определения спирта этилового. Концентрацию спирта в лекарственных формах по ГФ Х можно установить по плотности.
p ГФ Х не предусматривает количественного определения спирта этилового. Концентрацию спирта в лекарственных формах по ГФ Х можно установить по плотности.
 ЕР (ETHANOL (96 PER CENT): p 1. Плотность: 0. 805 - 0. 812. p 2. ИК -спектрометрия. 3. К спирту добавляют калия и разведенную серную кту, пробирку закрывают фильтровальной бумагой, смоченной водным раствором натрия нитропруссида и пиперазина гидрата. Через несколько минут появляется голубое окрашивание бумаги, через 10 -15 мин. окраска бледнеет. окрашивание бумаги p p 4. Йодоформенная реакция
ЕР (ETHANOL (96 PER CENT): p 1. Плотность: 0. 805 - 0. 812. p 2. ИК -спектрометрия. 3. К спирту добавляют калия и разведенную серную кту, пробирку закрывают фильтровальной бумагой, смоченной водным раствором натрия нитропруссида и пиперазина гидрата. Через несколько минут появляется голубое окрашивание бумаги, через 10 -15 мин. окраска бледнеет. окрашивание бумаги p p 4. Йодоформенная реакция
 Определение примесей в ЛС «Этиловый спирт» 1. Недопустимая примесь - альдегиды (можно обнаружить по реакции образования серебряного зеркала). R CН=O + 2 Ag(NH 3)2+ +3 OH- 2 Ag + R COO- + 4 NH 3 + 2 H 2 O
Определение примесей в ЛС «Этиловый спирт» 1. Недопустимая примесь - альдегиды (можно обнаружить по реакции образования серебряного зеркала). R CН=O + 2 Ag(NH 3)2+ +3 OH- 2 Ag + R COO- + 4 NH 3 + 2 H 2 O
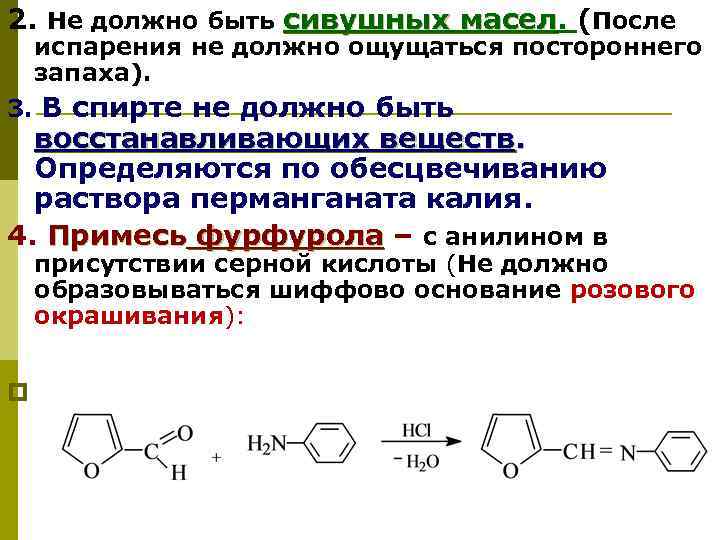 2. Не должно быть сивушных масел. (После сивушных масел испарения не должно ощущаться постороннего запаха). 3. В спирте не должно быть восстанавливающих веществ. Определяются по обесцвечиванию раствора перманганата калия. 4. Примесь фурфурола – с анилином в присутствии серной кислоты (Не должно образовываться шиффово основание розового окрашивания): p
2. Не должно быть сивушных масел. (После сивушных масел испарения не должно ощущаться постороннего запаха). 3. В спирте не должно быть восстанавливающих веществ. Определяются по обесцвечиванию раствора перманганата калия. 4. Примесь фурфурола – с анилином в присутствии серной кислоты (Не должно образовываться шиффово основание розового окрашивания): p
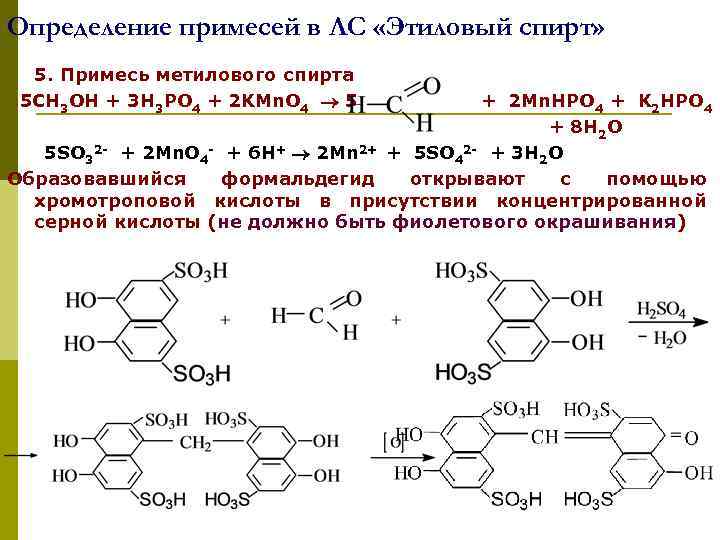 Определение примесей в ЛС «Этиловый спирт» 5. Примесь метилового спирта 5 CH 3 OH + 3 H 3 PO 4 + 2 KMn. O 4 5 + 2 Mn. HPO 4 + K 2 HPO 4 + 8 H 2 O 5 SO 32 - + 2 Mn. O 4 - + 6 H+ 2 Mn 2+ + 5 SO 42 - + 3 H 2 O Образовавшийся формальдегид открывают с помощью хромотроповой кислоты в присутствии концентрированной серной кислоты (не должно быть фиолетового окрашивания) p
Определение примесей в ЛС «Этиловый спирт» 5. Примесь метилового спирта 5 CH 3 OH + 3 H 3 PO 4 + 2 KMn. O 4 5 + 2 Mn. HPO 4 + K 2 HPO 4 + 8 H 2 O 5 SO 32 - + 2 Mn. O 4 - + 6 H+ 2 Mn 2+ + 5 SO 42 - + 3 H 2 O Образовавшийся формальдегид открывают с помощью хромотроповой кислоты в присутствии концентрированной серной кислоты (не должно быть фиолетового окрашивания) p
 6. Дубильные вещества: к этиловому спирту прибавляют Дубильные вещества раствор аммиака: не должно быть окрашивания. p 7. Не должно быть органических оснований. к этиловому оснований спирту прибавляют серную кислоту, выпаривают. К остатку – Na. OH. Не должен ощущаться запах аммиака. p 8. Не должно быть хлоридов, сульфатов и тяжелых металлов (характерные реакции на эти ионы). металлов p 9. Испытание спирта на кислотность (устанавливает допустимый предел). p 10. Сивушные масла и другие органические вещества. Нагревают спирт с конц. серной кислотой, охлаждают, жидкость должна быть бесцветной p
6. Дубильные вещества: к этиловому спирту прибавляют Дубильные вещества раствор аммиака: не должно быть окрашивания. p 7. Не должно быть органических оснований. к этиловому оснований спирту прибавляют серную кислоту, выпаривают. К остатку – Na. OH. Не должен ощущаться запах аммиака. p 8. Не должно быть хлоридов, сульфатов и тяжелых металлов (характерные реакции на эти ионы). металлов p 9. Испытание спирта на кислотность (устанавливает допустимый предел). p 10. Сивушные масла и другие органические вещества. Нагревают спирт с конц. серной кислотой, охлаждают, жидкость должна быть бесцветной p
 ЕР (ETHANOL (96 PER CENT): 1. Спектрометрия в УФ –области: 1. 1 max= 0. 40 при 240 nm, 1. 2 А = 0. 30 – между 250 nm и 260 nm 1. 3 А= 0. 10 – между 270 nm и 340 nm. 2. Методом газовой хроматографии определяют родственные органические примеси. p
ЕР (ETHANOL (96 PER CENT): 1. Спектрометрия в УФ –области: 1. 1 max= 0. 40 при 240 nm, 1. 2 А = 0. 30 – между 250 nm и 260 nm 1. 3 А= 0. 10 – между 270 nm и 340 nm. 2. Методом газовой хроматографии определяют родственные органические примеси. p
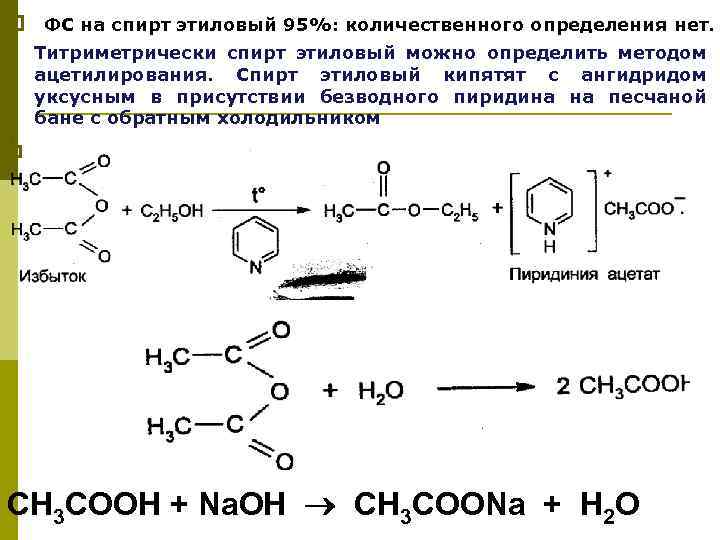 p ФС на спирт этиловый 95%: количественного определения нет. p p Титриметрически спирт этиловый можно определить методом ацетилирования. Cпирт этиловый кипятят с ангидридом уксусным в присутствии безводного пиридина на песчаной бане с обратным холодильником СН 3 СООН + Na. OH СН 3 СООNa + Н 2 О
p ФС на спирт этиловый 95%: количественного определения нет. p p Титриметрически спирт этиловый можно определить методом ацетилирования. Cпирт этиловый кипятят с ангидридом уксусным в присутствии безводного пиридина на песчаной бане с обратным холодильником СН 3 СООН + Na. OH СН 3 СООNa + Н 2 О
 Применение. Для приготовления настоек, экстрактов, лекарственных форм для наружного применения. Наружно как антисептическое средство и раздражающее средство для обтираний, компрессов и т. д. Раньше этиловый спирт вводили внутривенно: при гангрене и абцессе легкого. Хранение. Учитывая летучесть, спирт этиловый хранят в хорошо закрытой таре, в прохладном месте.
Применение. Для приготовления настоек, экстрактов, лекарственных форм для наружного применения. Наружно как антисептическое средство и раздражающее средство для обтираний, компрессов и т. д. Раньше этиловый спирт вводили внутривенно: при гангрене и абцессе легкого. Хранение. Учитывая летучесть, спирт этиловый хранят в хорошо закрытой таре, в прохладном месте.
 Форма выпуска: спирт этиловый 95% (смесь спирта с водой, содержащая 9596% по объему этилового спирта). Спирт этиловый 90%. Смесь спирта этилового 95% (92, 7 части) и воды (7, 3 части). Спирт этиловый 70%. Смесь спирта этилового 95% (67, 5 части) и воды (32, 5 части). Спирт этиловый 40%. Смесь спирта этилового 95% (36 частей) и воды (64 части).
Форма выпуска: спирт этиловый 95% (смесь спирта с водой, содержащая 9596% по объему этилового спирта). Спирт этиловый 90%. Смесь спирта этилового 95% (92, 7 части) и воды (7, 3 части). Спирт этиловый 70%. Смесь спирта этилового 95% (67, 5 части) и воды (32, 5 части). Спирт этиловый 40%. Смесь спирта этилового 95% (36 частей) и воды (64 части).
 Глицерин – Glycerinum C 3 H 8 O 3 (1, 2, 3 -пропантриол) М. r. 92. 09 Синонимы: Glycerol (ЕФ) p Описание. Глицерин – сиропообразная, вязкая, бесцветную жидкость тяжелее воды ( = 1. 20 г/ мл), с едва заметным своеобразным запахом, сладкая на вкус, нейтральной реакции. Глицерин гигроскопичен. p Глицерин хорошо смешивается с водой, спиртом. Нерастворим в жирных маслах, почти нерастворим в чистом эфире. p
Глицерин – Glycerinum C 3 H 8 O 3 (1, 2, 3 -пропантриол) М. r. 92. 09 Синонимы: Glycerol (ЕФ) p Описание. Глицерин – сиропообразная, вязкая, бесцветную жидкость тяжелее воды ( = 1. 20 г/ мл), с едва заметным своеобразным запахом, сладкая на вкус, нейтральной реакции. Глицерин гигроскопичен. p Глицерин хорошо смешивается с водой, спиртом. Нерастворим в жирных маслах, почти нерастворим в чистом эфире. p
 p Основную массу гидролизом жиров: глицерина получают R – COO- - остаток высших жирных кислот p Процесс протекает в присутствии катализаторов (липаз и др. ). Сначала получается глицерин водный, его упаривают, затем освобождают от возможных примесей низкомолекулярных кислот, пропуская через него пар при температуре 100 - 110°. p Cобирают чистый глицерин 95 – 98 % крепости. Такой глицерин является хорошим водоотнимающим средством, но в медицине применяться не может, так как он очень сушит кожу и может вызвать ожоги. Для медицинских целей глицерин обязательно разводят водой до 84— 88 % концентрации. p В настоящее время глицерин получают главным образом синтетическим путем
p Основную массу гидролизом жиров: глицерина получают R – COO- - остаток высших жирных кислот p Процесс протекает в присутствии катализаторов (липаз и др. ). Сначала получается глицерин водный, его упаривают, затем освобождают от возможных примесей низкомолекулярных кислот, пропуская через него пар при температуре 100 - 110°. p Cобирают чистый глицерин 95 – 98 % крепости. Такой глицерин является хорошим водоотнимающим средством, но в медицине применяться не может, так как он очень сушит кожу и может вызвать ожоги. Для медицинских целей глицерин обязательно разводят водой до 84— 88 % концентрации. p В настоящее время глицерин получают главным образом синтетическим путем
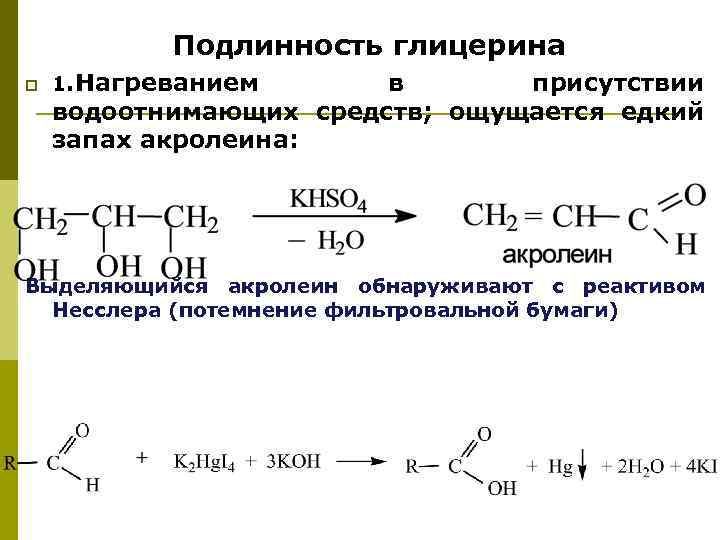 Подлинность глицерина p 1. Нагреванием в присутствии водоотнимающих средств; ощущается едкий запах акролеина: Выделяющийся акролеин обнаруживают с реактивом Несслера (потемнение фильтровальной бумаги)
Подлинность глицерина p 1. Нагреванием в присутствии водоотнимающих средств; ощущается едкий запах акролеина: Выделяющийся акролеин обнаруживают с реактивом Несслера (потемнение фильтровальной бумаги)
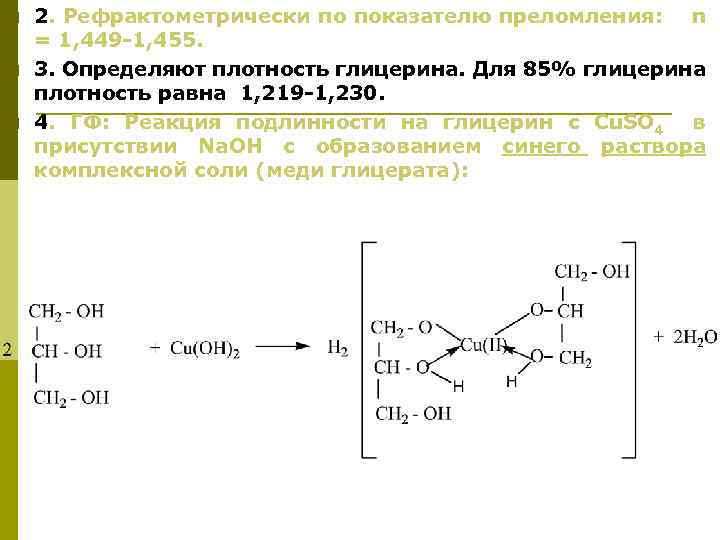 p p p 2. Рефрактометрически по показателю преломления: n = 1, 449 -1, 455. 3. Определяют плотность глицерина. Для 85% глицерина плотность равна 1, 219 -1, 230. 4. ГФ: Реакция подлинности на глицерин с Cu. SO 4 в присутствии Na. OH с образованием синего раствора комплексной соли (меди глицерата):
p p p 2. Рефрактометрически по показателю преломления: n = 1, 449 -1, 455. 3. Определяют плотность глицерина. Для 85% глицерина плотность равна 1, 219 -1, 230. 4. ГФ: Реакция подлинности на глицерин с Cu. SO 4 в присутствии Na. OH с образованием синего раствора комплексной соли (меди глицерата):
 p В соответствии с требованиями Европейской фармакопеи подлинность глицерина устанавливают следующими реакциями: p 1. По выделению акролеина при нагревании глицерина с гидросульфатом калия (как и по ГФ). p 2. По ВФ: Смешивают 1 мл испытуемого вещества с 0, 5 мл азотной кислоты и осторожно наслаивают 0, 5 мл раствора бихромата калия. На границе двух жидкостей образуется голубое кольцо. Оставляют на 10 минут; голубое окрашивание не дифундирует в нижний слой. p 3. Показатель преломления 1. 449 - 1. 455. 4. ПО сравнению абсорбционных спектров ИКспектрофотометрии глицерина со стандартными спектрами. p
p В соответствии с требованиями Европейской фармакопеи подлинность глицерина устанавливают следующими реакциями: p 1. По выделению акролеина при нагревании глицерина с гидросульфатом калия (как и по ГФ). p 2. По ВФ: Смешивают 1 мл испытуемого вещества с 0, 5 мл азотной кислоты и осторожно наслаивают 0, 5 мл раствора бихромата калия. На границе двух жидкостей образуется голубое кольцо. Оставляют на 10 минут; голубое окрашивание не дифундирует в нижний слой. p 3. Показатель преломления 1. 449 - 1. 455. 4. ПО сравнению абсорбционных спектров ИКспектрофотометрии глицерина со стандартными спектрами. p
 p p p ЧИСТОТА. (ЕФ): 1. Альдегиды-допустимая примесь. Определение альдегидов проводят по абсорбционным спектрам при длине волны 552 нм 2. Эфиры. По изменению окраски фенолфталеина после кипячения препарата с 10 мл натрия гидроксида и добавлении не менее 8 мл кислоты хлороводородной. 3. Допускаются примеси: галогенсодержащих соединений, хлоридов, тяжелых металлов. 4. Сахара – недопустимая примесь. К ЛП добавляют серную к-ту, нагревают на водяной бане. После добавления натрия гидроксида и меди сульфатам смесь, раствор остается голубым. Не должно образовываться осадка. 5. Вода: 12. 0 % - 16. 0 %. 6. Газовая хроматография – родственные примеси
p p p ЧИСТОТА. (ЕФ): 1. Альдегиды-допустимая примесь. Определение альдегидов проводят по абсорбционным спектрам при длине волны 552 нм 2. Эфиры. По изменению окраски фенолфталеина после кипячения препарата с 10 мл натрия гидроксида и добавлении не менее 8 мл кислоты хлороводородной. 3. Допускаются примеси: галогенсодержащих соединений, хлоридов, тяжелых металлов. 4. Сахара – недопустимая примесь. К ЛП добавляют серную к-ту, нагревают на водяной бане. После добавления натрия гидроксида и меди сульфатам смесь, раствор остается голубым. Не должно образовываться осадка. 5. Вода: 12. 0 % - 16. 0 %. 6. Газовая хроматография – родственные примеси
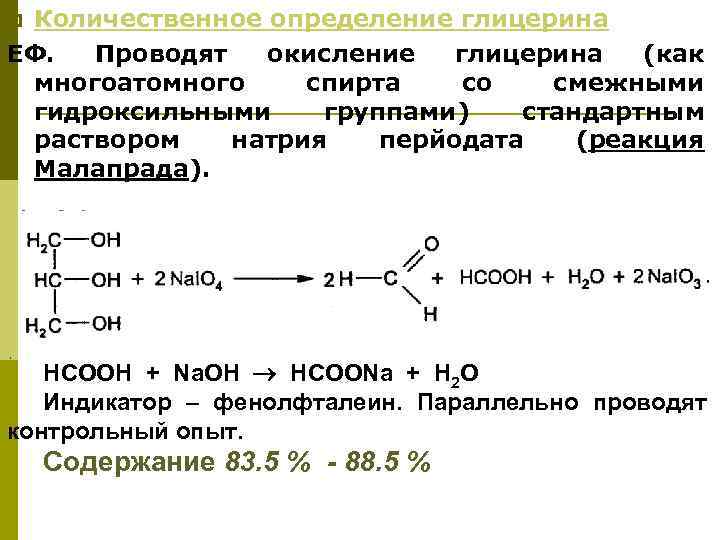 Количественное определение глицерина ЕФ. Проводят окисление глицерина (как многоатомного спирта со смежными гидроксильными группами) стандартным раствором натрия перйодата (реакция Малапрада). p НСООН + Na. OH HCOONa + Н 2 О Индикатор – фенолфталеин. Параллельно проводят контрольный опыт. Содержание 83. 5 % - 88. 5 %
Количественное определение глицерина ЕФ. Проводят окисление глицерина (как многоатомного спирта со смежными гидроксильными группами) стандартным раствором натрия перйодата (реакция Малапрада). p НСООН + Na. OH HCOONa + Н 2 О Индикатор – фенолфталеин. Параллельно проводят контрольный опыт. Содержание 83. 5 % - 88. 5 %
 Фармакологическое действие: p Слабительное p Дегидратирующее p Дерматопротективное p Применение. p ректально в качестве слабительного средства для наружнего применения: p оказывает смягчающее, дерматопротекторное действие. p Обладает гигроскопичным и смазывающим действием. p Активирует обменные процессы кожи. p Как основу для приготовления мазей и других ЛФ.
Фармакологическое действие: p Слабительное p Дегидратирующее p Дерматопротективное p Применение. p ректально в качестве слабительного средства для наружнего применения: p оказывает смягчающее, дерматопротекторное действие. p Обладает гигроскопичным и смазывающим действием. p Активирует обменные процессы кожи. p Как основу для приготовления мазей и других ЛФ.
 p Глицерол: Понижает внутричерепное и Глицерол внутриглазное давление (при перроральном или парентеральном введении). При отеке мозга, при острых приступах глаукомы. p Хранение. Глицерин из-за его большой гигроскопичности следует хранить в плотно закрытой таре.
p Глицерол: Понижает внутричерепное и Глицерол внутриглазное давление (при перроральном или парентеральном введении). При отеке мозга, при острых приступах глаукомы. p Хранение. Глицерин из-за его большой гигроскопичности следует хранить в плотно закрытой таре.
 Лекарственные средства, на основе эфиров. Эфиры - кислородсодержащие органические соединения общей формулы R-OR 1. Различают три типа эфиров: 1)простые эфиры, R 1 – углеводородный радикал. 2) сложные эфиры неорганических кислот, R 1 – остаток неорганической кислородсодержащей кислоты 3) сложные эфиры карбоновых кислот, R 1 – остаток карбоновой кислоты
Лекарственные средства, на основе эфиров. Эфиры - кислородсодержащие органические соединения общей формулы R-OR 1. Различают три типа эфиров: 1)простые эфиры, R 1 – углеводородный радикал. 2) сложные эфиры неорганических кислот, R 1 – остаток неорганической кислородсодержащей кислоты 3) сложные эфиры карбоновых кислот, R 1 – остаток карбоновой кислоты
 Простые эфиры p p По физическим свойствам– легко летучие соединения, обладающие характерным запахом. Температуры кипения близки к температурам кипения соответствующих алканов, но ниже, чем у спиртов. Плотность эфиров меньше, чем соответствующих спиртов. Простые эфиры не смешиваются с водой, но несколько в ней растворимы, легко растворимы в органических растворителях и сами растворяют многие органические вещества и не растворяют неорганические.
Простые эфиры p p По физическим свойствам– легко летучие соединения, обладающие характерным запахом. Температуры кипения близки к температурам кипения соответствующих алканов, но ниже, чем у спиртов. Плотность эфиров меньше, чем соответствующих спиртов. Простые эфиры не смешиваются с водой, но несколько в ней растворимы, легко растворимы в органических растворителях и сами растворяют многие органические вещества и не растворяют неорганические.
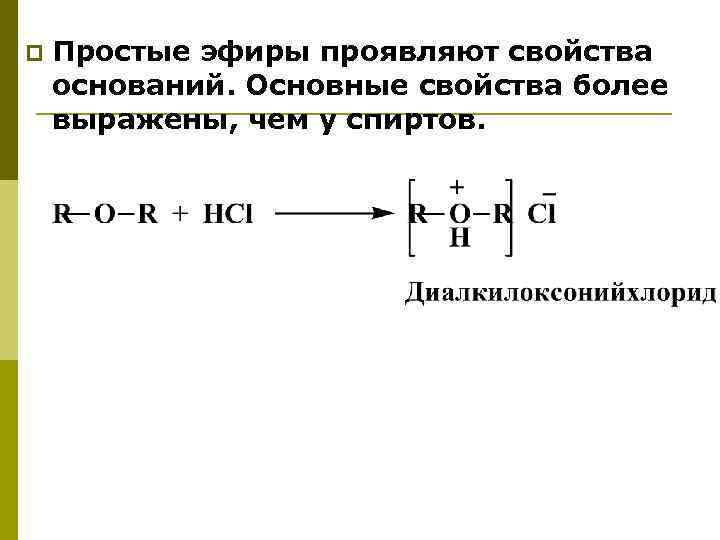 p Простые эфиры проявляют свойства оснований. Основные свойства более выражены, чем у спиртов.
p Простые эфиры проявляют свойства оснований. Основные свойства более выражены, чем у спиртов.
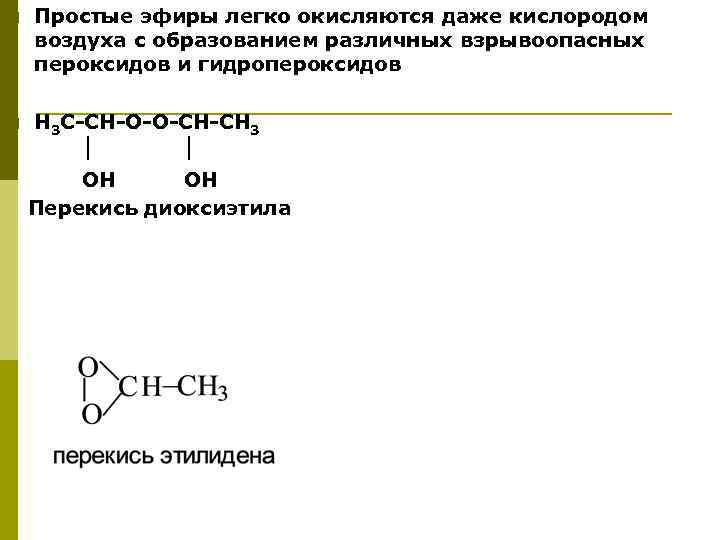 Простые эфиры легко окисляются даже кислородом воздуха с образованием различных взрывоопасных пероксидов и гидропероксидов p Н 3 С-СН-О-О-СН-СН 3 ОН Перекись диоксиэтила p
Простые эфиры легко окисляются даже кислородом воздуха с образованием различных взрывоопасных пероксидов и гидропероксидов p Н 3 С-СН-О-О-СН-СН 3 ОН Перекись диоксиэтила p
 p Проба на наличие пероксидных соединений проводится с раствором калия йодида. Если в эфире содержатся перекисные соединения, то выделившийся свободный йод окрашивает и эфирный и водный слои в желтый цвет: p С 2 Н 5 -О-О- С 2 Н 5 + 2 КI + 2 H 2 O С 2 Н 5 -О- С 2 Н 5 + I 2 + 2 КОН
p Проба на наличие пероксидных соединений проводится с раствором калия йодида. Если в эфире содержатся перекисные соединения, то выделившийся свободный йод окрашивает и эфирный и водный слои в желтый цвет: p С 2 Н 5 -О-О- С 2 Н 5 + 2 КI + 2 H 2 O С 2 Н 5 -О- С 2 Н 5 + I 2 + 2 КОН
 Лекарственные средства на основе простых алифатических эфиров Эфир медицинский Aether medicinalis С 2 Н 5 -О-С 2 Н 5 С 4 Н 10 О М. м 74, 12 ГФ Х: эфир медицинский (Aether medicinalis) и эфир для наркоза ( Aether pro narcosi). эфир для наркоза стабилизированный (Aether pro narcosi stabilisolum). Синонимы: Аnaesthetyic Ether (ЕФ);
Лекарственные средства на основе простых алифатических эфиров Эфир медицинский Aether medicinalis С 2 Н 5 -О-С 2 Н 5 С 4 Н 10 О М. м 74, 12 ГФ Х: эфир медицинский (Aether medicinalis) и эфир для наркоза ( Aether pro narcosi). эфир для наркоза стабилизированный (Aether pro narcosi stabilisolum). Синонимы: Аnaesthetyic Ether (ЕФ);
 Получение диэтилового эфира Дегидратацией этилового спирта в присутствии концентрированной серной или ортофосфорной кислот: С 2 Н 5 OН + Н 2 SO 4 С 2 Н 5 O SO 3 Н + H 2 O этилгидросульфат 140 о. С С 2 Н 5 OН + С 2 Н 5 O S O 3 Н СН 3 СН 2 ОСН 2 СН 3 + Н 2 SO 4 В специальные аппараты –эфиризаторы – загружают 96 о спирт и серную к-ту. Смесь нагревают до 130 -140 о. С. Образующийся эфир и воду отгоняют в нейтрализатор, отмывают от кислых продуктов путем взбалтывания смеси с содой или известковым молоком. . При температуре ниже 130 о. С , вместе со спиртом и водой будет отгоняться непрореагировавший спирт. При температуре выше 140 о. С, процесс может пойти в сторону образования этилена, ацетаальдегида, перекисных соединений и т. д.
Получение диэтилового эфира Дегидратацией этилового спирта в присутствии концентрированной серной или ортофосфорной кислот: С 2 Н 5 OН + Н 2 SO 4 С 2 Н 5 O SO 3 Н + H 2 O этилгидросульфат 140 о. С С 2 Н 5 OН + С 2 Н 5 O S O 3 Н СН 3 СН 2 ОСН 2 СН 3 + Н 2 SO 4 В специальные аппараты –эфиризаторы – загружают 96 о спирт и серную к-ту. Смесь нагревают до 130 -140 о. С. Образующийся эфир и воду отгоняют в нейтрализатор, отмывают от кислых продуктов путем взбалтывания смеси с содой или известковым молоком. . При температуре ниже 130 о. С , вместе со спиртом и водой будет отгоняться непрореагировавший спирт. При температуре выше 140 о. С, процесс может пойти в сторону образования этилена, ацетаальдегида, перекисных соединений и т. д.
 • Полученный эфир содержит ряд вредных примесей и может употребляться для наружных целей и как растворитель. • При получении эфира для наркоза его эфира для наркоза подвергают дополнительной очистке: промывают водой для удаления следов кислоты, затем обрабатывают щелочным раствором перманганата калия, чтобы освободить эфир от восстанавливающих веществ. Затем эфир перегоняют и собирают отгон при 34 -35 о. С. • 2. Эфир можно получать каталитическим способом, при котором смесь уксусного альдегида и водорода пропускают над нагретым до 170 о. С катализатором (водород восстанавливает ацетоальдегид).
• Полученный эфир содержит ряд вредных примесей и может употребляться для наружных целей и как растворитель. • При получении эфира для наркоза его эфира для наркоза подвергают дополнительной очистке: промывают водой для удаления следов кислоты, затем обрабатывают щелочным раствором перманганата калия, чтобы освободить эфир от восстанавливающих веществ. Затем эфир перегоняют и собирают отгон при 34 -35 о. С. • 2. Эфир можно получать каталитическим способом, при котором смесь уксусного альдегида и водорода пропускают над нагретым до 170 о. С катализатором (водород восстанавливает ацетоальдегид).
 ОПИСАНИЕ. Эфир - бесцветная прозрачная, весьма подвижная, легко воспламеняющаяся летучая жидкость жгучего вкуса со своеобразным запахом. Пары эфира с воздухом, кислородом и закисью азота образуют в определенных концентрациях взрывчатую смесь. p РАСТВОРИМОСТЬ ДИЭТИЛОВОГО ЭФИРА. Эфир растворим в 12 частях воды, смешивается во всех отношениях со спиртом, бензолом, хлороформом, петролейным эфиром p
ОПИСАНИЕ. Эфир - бесцветная прозрачная, весьма подвижная, легко воспламеняющаяся летучая жидкость жгучего вкуса со своеобразным запахом. Пары эфира с воздухом, кислородом и закисью азота образуют в определенных концентрациях взрывчатую смесь. p РАСТВОРИМОСТЬ ДИЭТИЛОВОГО ЭФИРА. Эфир растворим в 12 частях воды, смешивается во всех отношениях со спиртом, бензолом, хлороформом, петролейным эфиром p
 ОПРЕДЕЛЕНИЕ ПОДЛИННОСТИ ДИЭТИЛОВОГО ЭФИРА 1. По физическим константам. - эфир медицинский - Т. кип = 34 -36 о. С; = 0. 714 – 0. 717 г/см 3; ЕР: 0. 714 - 0. 716 - эфир для наркоза – Т. кип. = 34 -35 о. С; = 0. 713 – 0. 714 г/см 3; эфир для наркоза стабилизированный - Т. кип. = 34 -35 о. С; = 0. 713 – 0. 715 г/см 3. 2. Тест на нелетучий остаток (ЕФ). При 34 -35 о. С препарат должен перегнаться полностью, остатка быть не должно.
ОПРЕДЕЛЕНИЕ ПОДЛИННОСТИ ДИЭТИЛОВОГО ЭФИРА 1. По физическим константам. - эфир медицинский - Т. кип = 34 -36 о. С; = 0. 714 – 0. 717 г/см 3; ЕР: 0. 714 - 0. 716 - эфир для наркоза – Т. кип. = 34 -35 о. С; = 0. 713 – 0. 714 г/см 3; эфир для наркоза стабилизированный - Т. кип. = 34 -35 о. С; = 0. 713 – 0. 715 г/см 3. 2. Тест на нелетучий остаток (ЕФ). При 34 -35 о. С препарат должен перегнаться полностью, остатка быть не должно.
 ВАЖНО! - При проведении анализа эфира, поблизости не должно находиться источников огня - При определении температуры кипения и нелетучего остатка, эфир необходимо предварительно проверить на содержание перекисей. При наличии перекисей испытания проводить нельзя.
ВАЖНО! - При проведении анализа эфира, поблизости не должно находиться источников огня - При определении температуры кипения и нелетучего остатка, эфир необходимо предварительно проверить на содержание перекисей. При наличии перекисей испытания проводить нельзя.
 Испытания на чистоту 1. Пероксиды (недопустимая примесь: Н 5 С 2 -О-О-С 2 Н 5 + 2 KI + H 2 O = (C 2 H 5) 2 O + I 2 +2 KOH (ЕР: крахмал) 2. Определение кислотности 3. Примесь посторонних пахучих органических веществ устанавливают органолептически 4. Нелетучие примеси определяют по массе остатка, полученного после выпаривания и высушивания (при 100 – 1050 С) 50 мл препарата (0, 001 г)
Испытания на чистоту 1. Пероксиды (недопустимая примесь: Н 5 С 2 -О-О-С 2 Н 5 + 2 KI + H 2 O = (C 2 H 5) 2 O + I 2 +2 KOH (ЕР: крахмал) 2. Определение кислотности 3. Примесь посторонних пахучих органических веществ устанавливают органолептически 4. Нелетучие примеси определяют по массе остатка, полученного после выпаривания и высушивания (при 100 – 1050 С) 50 мл препарата (0, 001 г)
![5. Примесь альдегидов CH 3 CНO + K 2[Hg. I 4] + 3 KOH 5. Примесь альдегидов CH 3 CНO + K 2[Hg. I 4] + 3 KOH](https://present5.com/presentation/124905931_135978327/image-105.jpg) 5. Примесь альдегидов CH 3 CНO + K 2[Hg. I 4] + 3 KOH CH 3 COOK + Hg + 4 KI + 2 H 2 O Допускается появление в течение 1 мин желто-бурой окраски, переходящей в серовато-мутную. Не допускается образования осадка. p
5. Примесь альдегидов CH 3 CНO + K 2[Hg. I 4] + 3 KOH CH 3 COOK + Hg + 4 KI + 2 H 2 O Допускается появление в течение 1 мин желто-бурой окраски, переходящей в серовато-мутную. Не допускается образования осадка. p
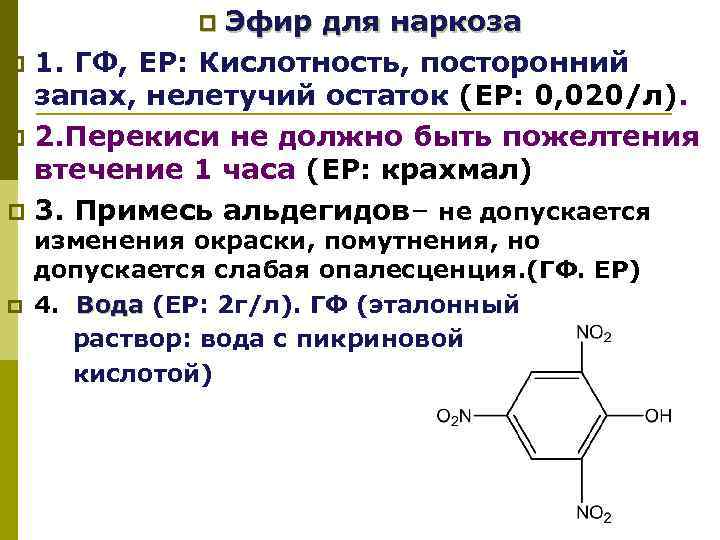 Эфир для наркоза p 1. ГФ, ЕР: Кислотность, посторонний запах, нелетучий остаток (ЕР: 0, 020/л). p 2. Перекиси не должно быть пожелтения втечение 1 часа (ЕР: крахмал) p 3. Примесь альдегидов– не допускается p изменения окраски, помутнения, но допускается слабая опалесценция. (ГФ. ЕР) p 4. Вода (ЕР: 2 г/л). ГФ (эталонный Вода раствор: вода с пикриновой кислотой)
Эфир для наркоза p 1. ГФ, ЕР: Кислотность, посторонний запах, нелетучий остаток (ЕР: 0, 020/л). p 2. Перекиси не должно быть пожелтения втечение 1 часа (ЕР: крахмал) p 3. Примесь альдегидов– не допускается p изменения окраски, помутнения, но допускается слабая опалесценция. (ГФ. ЕР) p 4. Вода (ЕР: 2 г/л). ГФ (эталонный Вода раствор: вода с пикриновой кислотой)
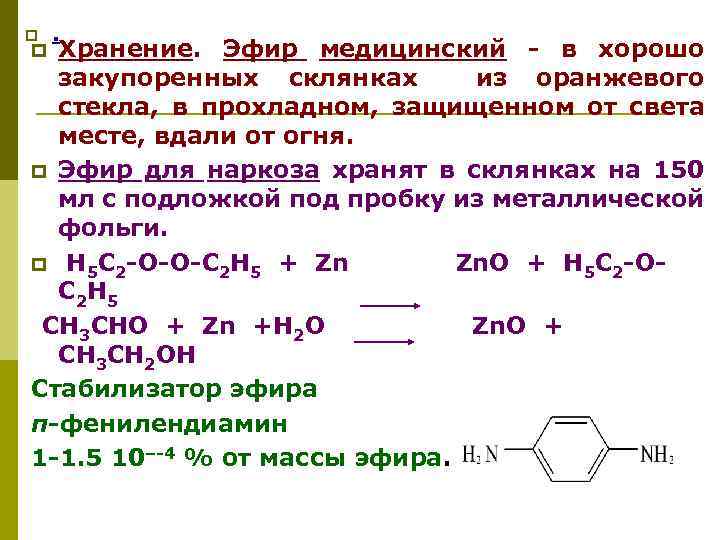 p . Хранение. Эфир медицинский - в хорошо закупоренных склянках из оранжевого стекла, в прохладном, защищенном от света месте, вдали от огня. p Эфир для наркоза хранят в склянках на 150 мл с подложкой под пробку из металлической фольги. p Н 5 С 2 -О-О-С 2 Н 5 + Zn Zn. O + Н 5 С 2 -ОС 2 Н 5 CH 3 CНO + Zn +H 2 O Zn. O + CH 3 CH 2 OH Стабилизатор эфира п-фенилендиамин 1 -1. 5 10–-4 % от массы эфира. p
p . Хранение. Эфир медицинский - в хорошо закупоренных склянках из оранжевого стекла, в прохладном, защищенном от света месте, вдали от огня. p Эфир для наркоза хранят в склянках на 150 мл с подложкой под пробку из металлической фольги. p Н 5 С 2 -О-О-С 2 Н 5 + Zn Zn. O + Н 5 С 2 -ОС 2 Н 5 CH 3 CНO + Zn +H 2 O Zn. O + CH 3 CH 2 OH Стабилизатор эфира п-фенилендиамин 1 -1. 5 10–-4 % от массы эфира. p
 Применение. Эфир медицинский применяют наружно для растираний, а также для изготовления настоек, экстрактов и др. ; (для наркоза непригоден). Иногда назначают внутрь при рвоте. p Эфир для наркоза применяют как средство для ингаляционного наркоза.
Применение. Эфир медицинский применяют наружно для растираний, а также для изготовления настоек, экстрактов и др. ; (для наркоза непригоден). Иногда назначают внутрь при рвоте. p Эфир для наркоза применяют как средство для ингаляционного наркоза.
 Препараты сложных эфиров Нитроглицерин Nitroglycerinum C 3 H 5 N 3 O 9 М. r 227, 09 Синонимы: Nitroglycerol, Glyceryl trinitrate. ЕР: GLYCERYL TRINITRATE SOLUTION Для купирования острых приступов стенокардии: p 1) таблетки нитроглицерина (0, 5 мг нитроглицерина) (Tabulettae Nytroglycerini); p 2) спиртовый раствор нитроглицерина 1% (Solutio Nitroglycerini 1%). p 3) раствор нитроглицерина 1% в масле в капсулах (Solutio Nitroglycerini 1% oleosa in capsules).
Препараты сложных эфиров Нитроглицерин Nitroglycerinum C 3 H 5 N 3 O 9 М. r 227, 09 Синонимы: Nitroglycerol, Glyceryl trinitrate. ЕР: GLYCERYL TRINITRATE SOLUTION Для купирования острых приступов стенокардии: p 1) таблетки нитроглицерина (0, 5 мг нитроглицерина) (Tabulettae Nytroglycerini); p 2) спиртовый раствор нитроглицерина 1% (Solutio Nitroglycerini 1%). p 3) раствор нитроглицерина 1% в масле в капсулах (Solutio Nitroglycerini 1% oleosa in capsules).
 ФС: p ЕР: 1 % -10 % раствор нитроглицерина p ГФ: 1% раствор нитроглицерина
ФС: p ЕР: 1 % -10 % раствор нитроглицерина p ГФ: 1% раствор нитроглицерина
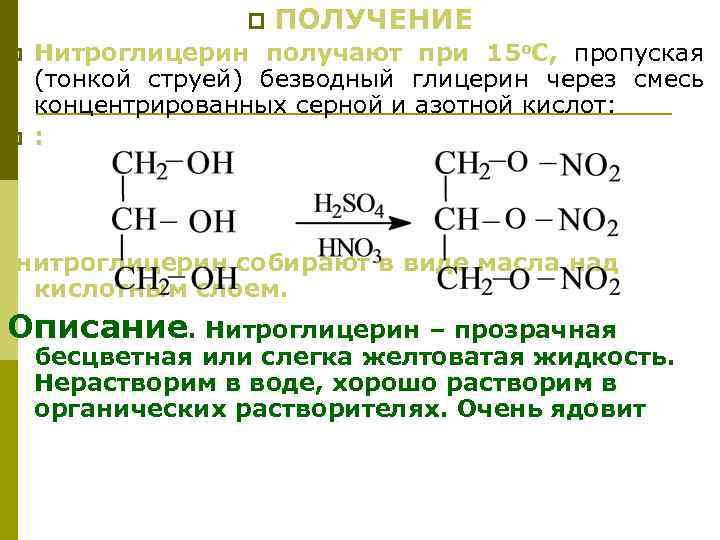 p p p ПОЛУЧЕНИЕ Нитроглицерин получают при 15 о. С, пропуская (тонкой струей) безводный глицерин через смесь концентрированных серной и азотной кислот: : нитроглицерин собирают в виде масла над кислотным слоем. Описание. Нитроглицерин – прозрачная бесцветная или слегка желтоватая жидкость. Нерастворим в воде, хорошо растворим в органических растворителях. Очень ядовит
p p p ПОЛУЧЕНИЕ Нитроглицерин получают при 15 о. С, пропуская (тонкой струей) безводный глицерин через смесь концентрированных серной и азотной кислот: : нитроглицерин собирают в виде масла над кислотным слоем. Описание. Нитроглицерин – прозрачная бесцветная или слегка желтоватая жидкость. Нерастворим в воде, хорошо растворим в органических растворителях. Очень ядовит
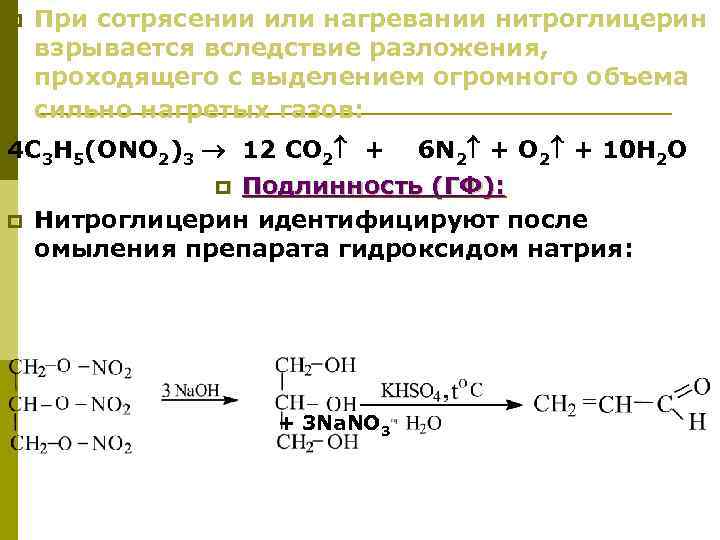 p При сотрясении или нагревании нитроглицерин взрываeтся вследствие разложения, проходящего с выделением огромного объема сильно нагретых газов: 4 C 3 H 5(ONO 2)3 12 CO 2 + 6 N 2 + O 2 + 10 H 2 O p Подлинность (ГФ): p Нитроглицерин идентифицируют после омыления препарата гидроксидом натрия: + 3 Na. NO 3
p При сотрясении или нагревании нитроглицерин взрываeтся вследствие разложения, проходящего с выделением огромного объема сильно нагретых газов: 4 C 3 H 5(ONO 2)3 12 CO 2 + 6 N 2 + O 2 + 10 H 2 O p Подлинность (ГФ): p Нитроглицерин идентифицируют после омыления препарата гидроксидом натрия: + 3 Na. NO 3
 дифенилдифенохинондиимин бензидин (сернокислая соль)
дифенилдифенохинондиимин бензидин (сернокислая соль)
 Подлинность (ЕР): 1. ИК-спектрофотометрия 2. ТСХ
Подлинность (ЕР): 1. ИК-спектрофотометрия 2. ТСХ
 Чистота (ГФ): p Плотность 1% р-ра 0, 829 p Предельное содержание спирта: 5 мл ЛП + 5, 5 мл воды Р-р прозрачный + 1, 0 мл воды Муть
Чистота (ГФ): p Плотность 1% р-ра 0, 829 p Предельное содержание спирта: 5 мл ЛП + 5, 5 мл воды Р-р прозрачный + 1, 0 мл воды Муть
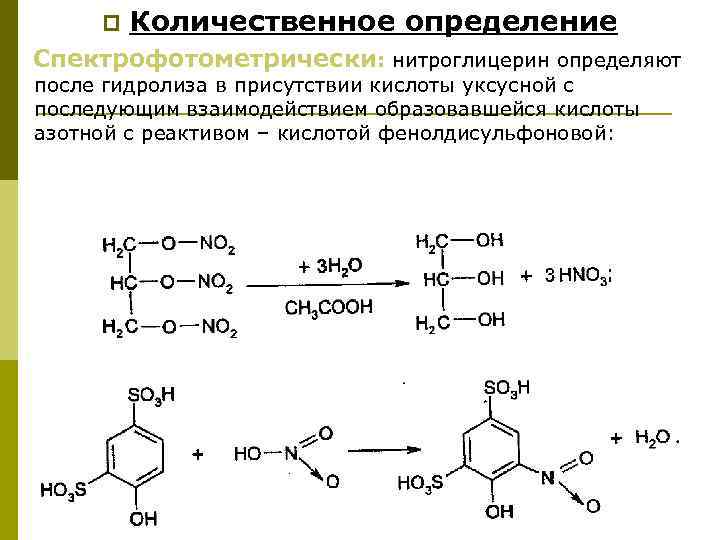 p Количественное определение Спектрофотометрически: нитроглицерин определяют после гидролиза в присутствии кислоты уксусной с последующим взаимодействием образовавшейся кислоты азотной с реактивом – кислотой фенолдисульфоновой:
p Количественное определение Спектрофотометрически: нитроглицерин определяют после гидролиза в присутствии кислоты уксусной с последующим взаимодействием образовавшейся кислоты азотной с реактивом – кислотой фенолдисульфоновой:
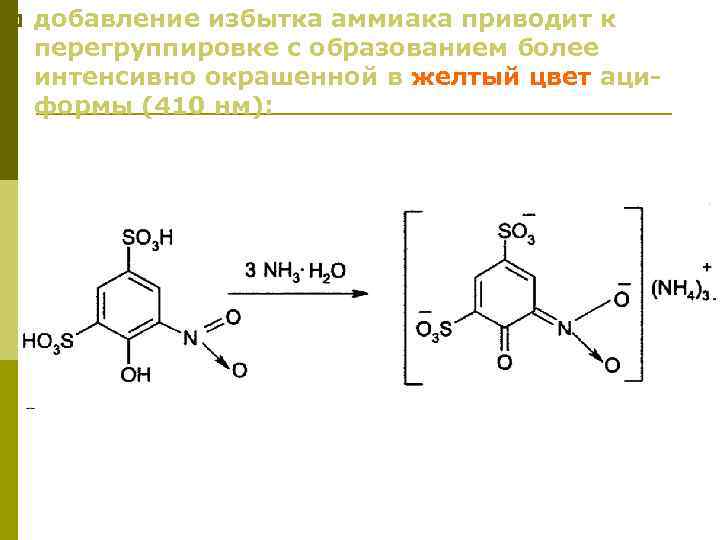 p добавление избытка аммиака приводит к перегруппировке с образованием более интенсивно окрашенной в желтый цвет ациформы (410 нм):
p добавление избытка аммиака приводит к перегруппировке с образованием более интенсивно окрашенной в желтый цвет ациформы (410 нм):
 Применение Нитрат-ионы восстанавливаются гемоглобином крови и железосодержащими ферментами в монооксид азота, расслабляет гладкие мышцы сосудов, снижая кровяное давление, снимая ишемические боли сердца: NO 3 - + 3 Fe 2+ + 4 H+ NO + 3 Fe 3+ + 2 H 2 O
Применение Нитрат-ионы восстанавливаются гемоглобином крови и железосодержащими ферментами в монооксид азота, расслабляет гладкие мышцы сосудов, снижая кровяное давление, снимая ишемические боли сердца: NO 3 - + 3 Fe 2+ + 4 H+ NO + 3 Fe 3+ + 2 H 2 O
 Способы применения: p 1. Внутривенно в концентрации 50 -100 мкг/мл в 5% растворе глюкозы p 2. Сублингвально: таблетку или дозу аэрозоля под язык p 3. Трансдермально: мазь «Нитро» или пластырь «Нитродерм» p 4. Внутрь: таблетки или капсулы p 5. Суббукально: таблетку держат за щекой до полного рассасывания p
Способы применения: p 1. Внутривенно в концентрации 50 -100 мкг/мл в 5% растворе глюкозы p 2. Сублингвально: таблетку или дозу аэрозоля под язык p 3. Трансдермально: мазь «Нитро» или пластырь «Нитродерм» p 4. Внутрь: таблетки или капсулы p 5. Суббукально: таблетку держат за щекой до полного рассасывания p
 Лекарственные формы нитроглицерина p p p Перлинганит Нитро 5 мг/мл ДЛЯ ИНЪЕКЦИЙ Нитро-мак Нитро-поль ПРОЛОНГИРОВАННЫЕ ЛФ НИТРОГЛИЦЕРИНА Таблетки нитрогранулонга (содержат целлюлозу) Нитрокор (табл. ) Тринитролонг (полимерные пленки – апликация на слизистую оболочку полости рта) Сустак (сустак-мите 2, 6 мг и сустак –форте 6, 4 мг) Сустонит (табл) Нитронг табл. ) Мази и пластыри
Лекарственные формы нитроглицерина p p p Перлинганит Нитро 5 мг/мл ДЛЯ ИНЪЕКЦИЙ Нитро-мак Нитро-поль ПРОЛОНГИРОВАННЫЕ ЛФ НИТРОГЛИЦЕРИНА Таблетки нитрогранулонга (содержат целлюлозу) Нитрокор (табл. ) Тринитролонг (полимерные пленки – апликация на слизистую оболочку полости рта) Сустак (сустак-мите 2, 6 мг и сустак –форте 6, 4 мг) Сустонит (табл) Нитронг табл. ) Мази и пластыри
