Гетогенный катализ.ppt
- Количество слайдов: 16
 Гетерогенный катализ
Гетерогенный катализ
 Гетерогенный катализ частный случай гетерогенных реакций. Чаще всего гетерогенные реакции протекают на границе раздела двух фаз: газ твердое тело, жидкость твердое тело. Отличительной способностью всех гетерогенных реакций является их сложность и многостадийность. Они состоят, по крайней мере, из трех стадий: 1 стадия - доставка реагента из какой либо фазы к поверхности раздела, т. е. диффузия; 2 стадия - собственно химическая реакция на поверхности; 3 стадия - обратная диффузия, т. е. отвод продуктов реакции с поверхности. первой гетерогенно каталитической реакцией является реакция: С 2 H 5 OH С 2 H 4 + H 2 O Особенности гетерогенных каталитических процессов При изучении гетерогенных каталитических процессов были обнаружены следующие характерные особенности: а) Сродство реагирующих веществ к катализатору Сродство катализатора к реагенту обеспечивает образование промежуточного соединения, распад которого приводит к образованию продуктов и регенерации катализатора.
Гетерогенный катализ частный случай гетерогенных реакций. Чаще всего гетерогенные реакции протекают на границе раздела двух фаз: газ твердое тело, жидкость твердое тело. Отличительной способностью всех гетерогенных реакций является их сложность и многостадийность. Они состоят, по крайней мере, из трех стадий: 1 стадия - доставка реагента из какой либо фазы к поверхности раздела, т. е. диффузия; 2 стадия - собственно химическая реакция на поверхности; 3 стадия - обратная диффузия, т. е. отвод продуктов реакции с поверхности. первой гетерогенно каталитической реакцией является реакция: С 2 H 5 OH С 2 H 4 + H 2 O Особенности гетерогенных каталитических процессов При изучении гетерогенных каталитических процессов были обнаружены следующие характерные особенности: а) Сродство реагирующих веществ к катализатору Сродство катализатора к реагенту обеспечивает образование промежуточного соединения, распад которого приводит к образованию продуктов и регенерации катализатора.
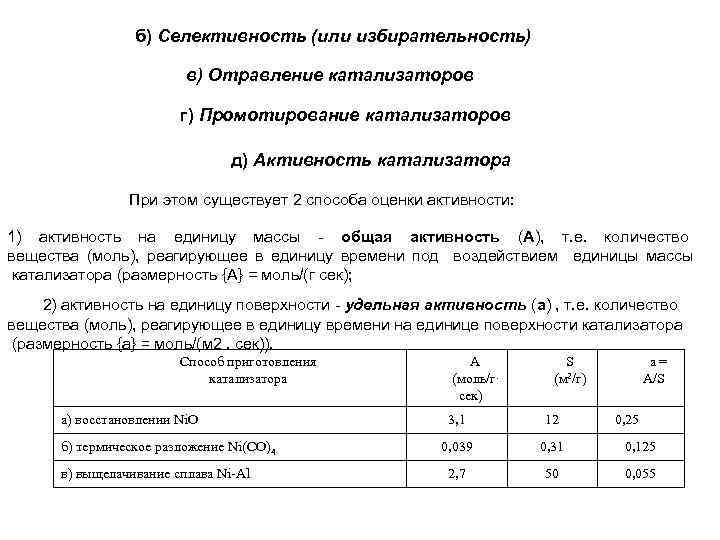 б) Селективность (или избирательность) в) Отравление катализаторов г) Промотирование катализаторов д) Активность катализатора При этом существует 2 способа оценки активности: 1) активность на единицу массы общая активность (А), т. е. количество вещества (моль), реагирующее в единицу времени под воздействием единицы массы катализатора (размерность {А} = моль/(г сек); 2) активность на единицу поверхности удельная активность (а) , т. е. количество вещества (моль), реагирующее в единицу времени на единице поверхности катализатора (размерность {а} = моль/(м 2. сек)). Способ приготовления катализатора а) восстановлении Ni. O б) термическое разложение Ni(CO)4 в) выщелачивание сплава Ni-Al A (моль/г. сек) S (м 2/г) а= А/S 3, 1 12 0, 25 0, 039 0, 31 0, 125 2, 7 50 0, 055
б) Селективность (или избирательность) в) Отравление катализаторов г) Промотирование катализаторов д) Активность катализатора При этом существует 2 способа оценки активности: 1) активность на единицу массы общая активность (А), т. е. количество вещества (моль), реагирующее в единицу времени под воздействием единицы массы катализатора (размерность {А} = моль/(г сек); 2) активность на единицу поверхности удельная активность (а) , т. е. количество вещества (моль), реагирующее в единицу времени на единице поверхности катализатора (размерность {а} = моль/(м 2. сек)). Способ приготовления катализатора а) восстановлении Ni. O б) термическое разложение Ni(CO)4 в) выщелачивание сплава Ni-Al A (моль/г. сек) S (м 2/г) а= А/S 3, 1 12 0, 25 0, 039 0, 31 0, 125 2, 7 50 0, 055
 Как видно из таблицы, активность катализатора и удельная поверхность S зависят от способа приготовления, т. е. число активных центров, их формирование зависит от способа приготовления и влияет на предэкспоненциальный множитель (С) в формуле Аррениуса для константы скорости е) Катализаторы на носителях У таких катализаторов активное вещество нанесено на поверхность какого либо твердого тела с хорошо развитой поверхностью (силикагель. активированный уголь, асбест, пемза и другие). Кинетическая и диффузионная области протекания гетерогенных каталитических реакций 1) транспорт реагирующих веществ к поверхности катализатора (диффузия); 2) адсорбция поглощение поверхностью катализатора реагентов, в результате чего молекула реагента может активироваться; при этом устанавливается равновесие между адсорбированным реагентом и реагентом в объёме Аадс А ; 3) химическая реакция на поверхности, именно на этой стадии проявляется каталитическое воздействие; 4) десорбция продуктов реакции с освобождением поверхности катализатора; 5) диффузия продуктов реакции в объём (обратная диффузия)
Как видно из таблицы, активность катализатора и удельная поверхность S зависят от способа приготовления, т. е. число активных центров, их формирование зависит от способа приготовления и влияет на предэкспоненциальный множитель (С) в формуле Аррениуса для константы скорости е) Катализаторы на носителях У таких катализаторов активное вещество нанесено на поверхность какого либо твердого тела с хорошо развитой поверхностью (силикагель. активированный уголь, асбест, пемза и другие). Кинетическая и диффузионная области протекания гетерогенных каталитических реакций 1) транспорт реагирующих веществ к поверхности катализатора (диффузия); 2) адсорбция поглощение поверхностью катализатора реагентов, в результате чего молекула реагента может активироваться; при этом устанавливается равновесие между адсорбированным реагентом и реагентом в объёме Аадс А ; 3) химическая реакция на поверхности, именно на этой стадии проявляется каталитическое воздействие; 4) десорбция продуктов реакции с освобождением поверхности катализатора; 5) диффузия продуктов реакции в объём (обратная диффузия)
 Гетерогенный каталитический процесс начинается с диффузии и заканчивается ею. Диффузия это перемещение молекул вещества в какой либо среде под действием градиента концентрации. р >> диф, Скорость диффузии определяется 1 законом Фика для одномерного потока где dn количество вещества, продиффундировавшего за время dt через фиксированную поверхность S в сторону возрастания l ; D коэффициент диффузии, т. е. количество вещества, продиффундировавшего за 1 сек через площадь S = 1 см 2 , при градиенте концентрации d. С/d 1 = 1.
Гетерогенный каталитический процесс начинается с диффузии и заканчивается ею. Диффузия это перемещение молекул вещества в какой либо среде под действием градиента концентрации. р >> диф, Скорость диффузии определяется 1 законом Фика для одномерного потока где dn количество вещества, продиффундировавшего за время dt через фиксированную поверхность S в сторону возрастания l ; D коэффициент диффузии, т. е. количество вещества, продиффундировавшего за 1 сек через площадь S = 1 см 2 , при градиенте концентрации d. С/d 1 = 1.
 Соб Скат Минус в правой части уравнения постав лен потому, что D >0, a grad С < 0. Диффузия происходит в сторону убывания концентрации, поэтому d. C / dl < 0. Если рассмотреть очень тонкий диффузионный слой толщиной , то можно записать так как Скат 0. А скорость диффузии
Соб Скат Минус в правой части уравнения постав лен потому, что D >0, a grad С < 0. Диффузия происходит в сторону убывания концентрации, поэтому d. C / dl < 0. Если рассмотреть очень тонкий диффузионный слой толщиной , то можно записать так как Скат 0. А скорость диффузии
 При постоянных условиях, т. е. постоянных S, V, , можно обозначить DS/V = . И тогда диф = диф С, т. е. получили линейную зависимость скорости от концентрации. Во всех случаях диффузионного режима будем иметь: а) первый порядок по концентрации реагента; б) слабую температурную зависимость скорости реакции Когда скорость диффузии велика, т. е. диф >> реак, лимитирующей стадией гетерогенного процесса будет являться сама химическая реакция на поверхности катализатора. Это, так называемый, кинетический режим гетерогенного катализа. Согласно закону действующих масс скорость реак = f(Cs) = k. CASn 1. CBSn 2, (7. 23) где CA, S, CB, S – поверхностные концентрации реагентов А и В.
При постоянных условиях, т. е. постоянных S, V, , можно обозначить DS/V = . И тогда диф = диф С, т. е. получили линейную зависимость скорости от концентрации. Во всех случаях диффузионного режима будем иметь: а) первый порядок по концентрации реагента; б) слабую температурную зависимость скорости реакции Когда скорость диффузии велика, т. е. диф >> реак, лимитирующей стадией гетерогенного процесса будет являться сама химическая реакция на поверхности катализатора. Это, так называемый, кинетический режим гетерогенного катализа. Согласно закону действующих масс скорость реак = f(Cs) = k. CASn 1. CBSn 2, (7. 23) где CA, S, CB, S – поверхностные концентрации реагентов А и В.
 Рассмотримдляпримераслучай, когданаповерхностикатализаторапротекает реакция первого порядка, тогда: р = k ·Cs, Скорость диффузии где Cs поверхностная концентрация реагента д = (C – Cs) где С = Соб , т. е. объемная концентрация реагента В стационарных условиях протекания гетерогенного каталитического процесса реак. = диф, т. е. Перейдем в выражении для скорости реакции от CS к С, т. е. Обозначим через (7. 24) kэфф = k /(k + ) Тогда реак = kэфф. С, т. е. линейная зависимость скорости гетерогенного процесса от концентрации реагента. Для kэфф получается соотношение 1/ kэфф = 1/k + 1/. а) k >> , процесс будет протекать в диффузионном режиме kэфф , при этом CS = С · /k , а так как k , то CS << С. б) k , процесс протекает в кинетическом режиме; kэфф k и CS С, т. е. в кинетической области наблюдается равенство объемной и поверхностной концентрации
Рассмотримдляпримераслучай, когданаповерхностикатализаторапротекает реакция первого порядка, тогда: р = k ·Cs, Скорость диффузии где Cs поверхностная концентрация реагента д = (C – Cs) где С = Соб , т. е. объемная концентрация реагента В стационарных условиях протекания гетерогенного каталитического процесса реак. = диф, т. е. Перейдем в выражении для скорости реакции от CS к С, т. е. Обозначим через (7. 24) kэфф = k /(k + ) Тогда реак = kэфф. С, т. е. линейная зависимость скорости гетерогенного процесса от концентрации реагента. Для kэфф получается соотношение 1/ kэфф = 1/k + 1/. а) k >> , процесс будет протекать в диффузионном режиме kэфф , при этом CS = С · /k , а так как k , то CS << С. б) k , процесс протекает в кинетическом режиме; kэфф k и CS С, т. е. в кинетической области наблюдается равенство объемной и поверхностной концентрации
 Когда порядок n 1 соотношения между константами будут более сложными k. CSn = (C – CS) При проведения 4 предельные области: реакции на неравнодоступной поверхности возможны 1) Внешняя диффузионная область Соб >> CS > Спор. 2) Внутренняя диффузионная область Соб Cs > Спор. 3) Внешняя кинетическая область Соб CS, Cпop 0 4) Внутренняя кинетическая область Соб CS Cпop. Активация в гетерогенном катализе. По аналогии с формулой Аррениуса k = Ае–E/RT для гетерогенной реакции можно записать (7. 25)
Когда порядок n 1 соотношения между константами будут более сложными k. CSn = (C – CS) При проведения 4 предельные области: реакции на неравнодоступной поверхности возможны 1) Внешняя диффузионная область Соб >> CS > Спор. 2) Внутренняя диффузионная область Соб Cs > Спор. 3) Внешняя кинетическая область Соб CS, Cпop 0 4) Внутренняя кинетическая область Соб CS Cпop. Активация в гетерогенном катализе. По аналогии с формулой Аррениуса k = Ае–E/RT для гетерогенной реакции можно записать (7. 25)
 Если под действием катализатора не происходит изменения направления реакции, т. е. одинаковые исходные вещества дают одинаковые продукты, то можно сравнивать kгет и kнекат. (7. 26) Величину Екат называют кажущейся энергией активации. Рассмотрим бимолекулярную реакцию А + В (АВ) продукты Пусть в присутствии катализатора образуются те же продукты А + В + К (АВК)* продукты + К Е – Екат = Е > 0.
Если под действием катализатора не происходит изменения направления реакции, т. е. одинаковые исходные вещества дают одинаковые продукты, то можно сравнивать kгет и kнекат. (7. 26) Величину Екат называют кажущейся энергией активации. Рассмотрим бимолекулярную реакцию А + В (АВ) продукты Пусть в присутствии катализатора образуются те же продукты А + В + К (АВК)* продукты + К Е – Екат = Е > 0.
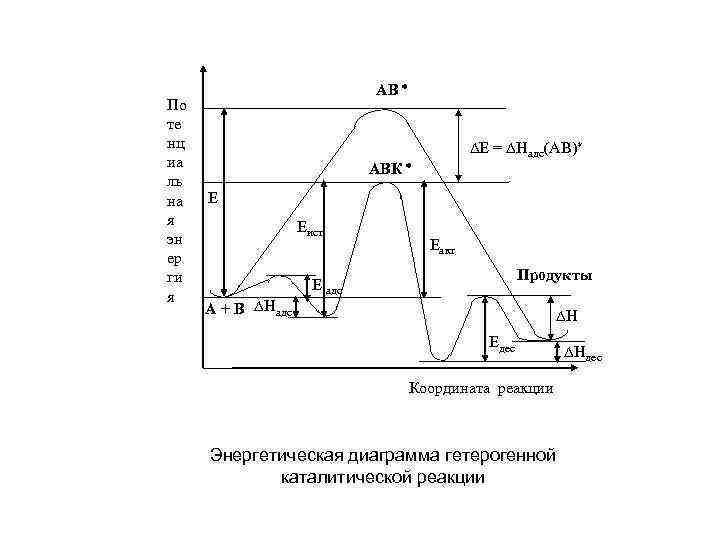 По те нц иа ль на я эн ер ги я АВ Е = Надс(АВ) АВК Е Еист А + В Надс Еакт Продукты Е адс Н Едес Координата реакции Энергетическая диаграмма гетерогенной каталитической реакции Ндес
По те нц иа ль на я эн ер ги я АВ Е = Надс(АВ) АВК Е Еист А + В Надс Еакт Продукты Е адс Н Едес Координата реакции Энергетическая диаграмма гетерогенной каталитической реакции Ндес
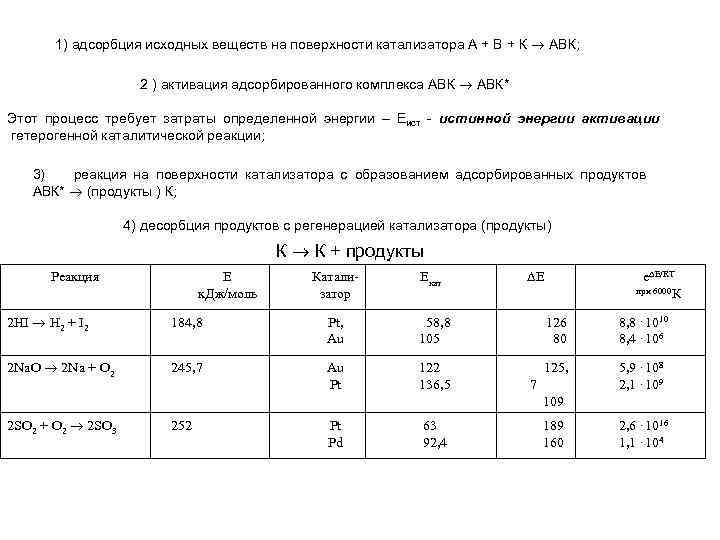 1) адсорбция исходных веществ на поверхности катализатора А + В + К АВК; 2 ) активация адсорбированного комплекса АВК* Этот процесс требует затраты определенной энергии – Eист истинной энергии активации гетерогенной каталитической реакции; 3) реакция на поверхности катализатора с образованием адсорбированных продуктов АВК* (продукты ) К; 4) десорбция продуктов с регенерацией катализатора (продукты) К К + продукты Реакция E к. Дж/моль Катализатор Екат Е е Е/RT при 6000 К 2 HI H 2 + I 2 184, 8 Pt, Au 58, 8 105 126 80 8, 8. 1010 8, 4. 106 2 Na. O 2 Na + O 2 245, 7 Au Pt 122 136, 5 125, 5, 9. 108 2, 1. 109 7 109 2 SO 2 + O 2 2 SO 3 252 Pt Pd 63 92, 4 189 160 2, 6. 1016 1, 1. 104
1) адсорбция исходных веществ на поверхности катализатора А + В + К АВК; 2 ) активация адсорбированного комплекса АВК* Этот процесс требует затраты определенной энергии – Eист истинной энергии активации гетерогенной каталитической реакции; 3) реакция на поверхности катализатора с образованием адсорбированных продуктов АВК* (продукты ) К; 4) десорбция продуктов с регенерацией катализатора (продукты) К К + продукты Реакция E к. Дж/моль Катализатор Екат Е е Е/RT при 6000 К 2 HI H 2 + I 2 184, 8 Pt, Au 58, 8 105 126 80 8, 8. 1010 8, 4. 106 2 Na. O 2 Na + O 2 245, 7 Au Pt 122 136, 5 125, 5, 9. 108 2, 1. 109 7 109 2 SO 2 + O 2 2 SO 3 252 Pt Pd 63 92, 4 189 160 2, 6. 1016 1, 1. 104
 Адсорбция - есть поглощение вещества поверхностью твердого тела. формула Леннарда Джонса: где r расстояние между взаимодействующими частицами, а и некоторые постоянные, зависящие от природы вещества. Любой процесс адсорбции экзотермический, при физической адсорбции выделяется 8 – 10 к. Дж/моль, а при хемосорбции 50 – 250 к. Дж/моль. Теоретические представления гетерогенного и металлокомплексного катализа Мультиплетная теория, предложенная А. А. Баландиным (1929), предполагает, что роль каталитически активного центра играют несколько атомов или ионов катализатора, расположенные на его поверхности в соответствии со строением кристаллической решетки. Рассмотрим реакцию дегидрирования этилового спирта C 2 H 5 OH == СН 3 СНО + Н 2
Адсорбция - есть поглощение вещества поверхностью твердого тела. формула Леннарда Джонса: где r расстояние между взаимодействующими частицами, а и некоторые постоянные, зависящие от природы вещества. Любой процесс адсорбции экзотермический, при физической адсорбции выделяется 8 – 10 к. Дж/моль, а при хемосорбции 50 – 250 к. Дж/моль. Теоретические представления гетерогенного и металлокомплексного катализа Мультиплетная теория, предложенная А. А. Баландиным (1929), предполагает, что роль каталитически активного центра играют несколько атомов или ионов катализатора, расположенные на его поверхности в соответствии со строением кристаллической решетки. Рассмотрим реакцию дегидрирования этилового спирта C 2 H 5 OH == СН 3 СНО + Н 2
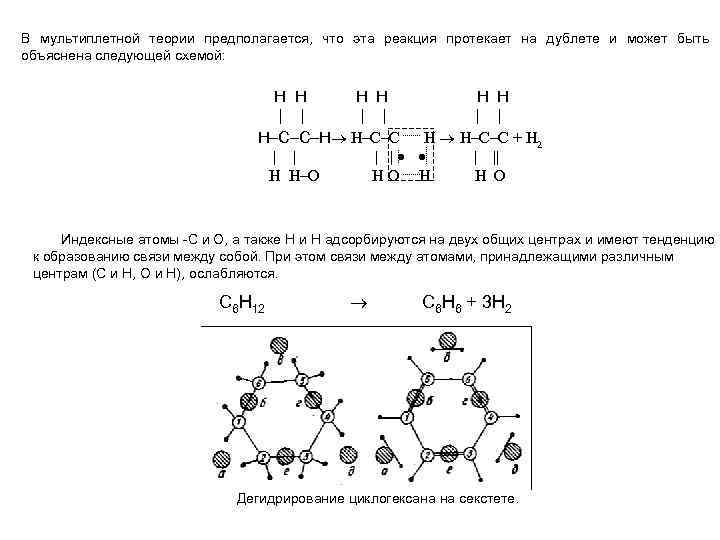 В мультиплетной теории предполагается, что эта реакция протекает на дублете и может быть объяснена следующей схемой: H H H | | | H–C–C–H H–C–C H H–C–C + H 2 | || H H–O HO H H O Индексные атомы С и О, а также Н и Н адсорбируются на двух общих центрax и имеют тенденцию к образованию связи между собой. При этом связи между атомами, принадлежащими различным центрам (С и Н, О и Н), ослабляются. С 6 H 12 C 6 H 6 + 3 H 2 Дегидрирование циклогексана на секстете.
В мультиплетной теории предполагается, что эта реакция протекает на дублете и может быть объяснена следующей схемой: H H H | | | H–C–C–H H–C–C H H–C–C + H 2 | || H H–O HO H H O Индексные атомы С и О, а также Н и Н адсорбируются на двух общих центрax и имеют тенденцию к образованию связи между собой. При этом связи между атомами, принадлежащими различным центрам (С и Н, О и Н), ослабляются. С 6 H 12 C 6 H 6 + 3 H 2 Дегидрирование циклогексана на секстете.
 Другим положением мультиплетной теории является принцип энергетического соответствия, согласно которому в каталитической реакции должно быть соответствие энергий связи атомов в молекулах реагентов, и в мультиплетном комплексе. Рассмотрим реакцию AB + CD = AC + BD AB + CD АК + ВК + СК + DK AC + BD, Обозначим энергию связи двух атомов через H с соответствующими индексами ( HAB, HAK, HBK и т. д. ), через s = HAB + HCD + HAC + HBD (7. 27) сумму энергий разрывающихся и образующихся связей и через q == HAK + HBK + HCK + HDK (7. 28) Для стадий образования и разрушения мультиплетного комплекса имеем соответственно: H 1 = HAB + HCD – q H 2 = q – HAC – HBD (7. 29) (7. 30)
Другим положением мультиплетной теории является принцип энергетического соответствия, согласно которому в каталитической реакции должно быть соответствие энергий связи атомов в молекулах реагентов, и в мультиплетном комплексе. Рассмотрим реакцию AB + CD = AC + BD AB + CD АК + ВК + СК + DK AC + BD, Обозначим энергию связи двух атомов через H с соответствующими индексами ( HAB, HAK, HBK и т. д. ), через s = HAB + HCD + HAC + HBD (7. 27) сумму энергий разрывающихся и образующихся связей и через q == HAK + HBK + HCK + HDK (7. 28) Для стадий образования и разрушения мультиплетного комплекса имеем соответственно: H 1 = HAB + HCD – q H 2 = q – HAC – HBD (7. 29) (7. 30)
 По теории активных ансамблей, предложенной Н. И. Кобозевым (1939), каталитически активным центром является совокупность (ансамбль) свободных атомов катализатора, находящихся на отдельном участке (блоке) поверхности твердого тела Созданию электронной теории катализа на полупроводниках посвящены работы Ф. Ф. Волькенштейна. В этой теории рассматривается полупроводниковый катализатор, представляющий собой идеальный кристалл, образованный ионами с оболочкой инертного газа. Возможны три типа связи. 1) слабая гомеополярная связь, обеспечиваемая валентным электроном одного из адсорбирующихся атомов, затягиваемым в зону проводимости кристалла; 2) прочная гомеополярная связь, в которой кроме этого электрона участвует электрон кристалла, переходящий на локальный энергетический уровень, возникающий в запрещенной зоне кристалла в результате адсорбции; 3) ионная связь, образующаяся при переходе валентного электрона адсорбированного атома в решетку кристалла. Наиболее реакционноспособны состояния со слабой связью, так как они обладают ненасыщенными валентностями.
По теории активных ансамблей, предложенной Н. И. Кобозевым (1939), каталитически активным центром является совокупность (ансамбль) свободных атомов катализатора, находящихся на отдельном участке (блоке) поверхности твердого тела Созданию электронной теории катализа на полупроводниках посвящены работы Ф. Ф. Волькенштейна. В этой теории рассматривается полупроводниковый катализатор, представляющий собой идеальный кристалл, образованный ионами с оболочкой инертного газа. Возможны три типа связи. 1) слабая гомеополярная связь, обеспечиваемая валентным электроном одного из адсорбирующихся атомов, затягиваемым в зону проводимости кристалла; 2) прочная гомеополярная связь, в которой кроме этого электрона участвует электрон кристалла, переходящий на локальный энергетический уровень, возникающий в запрещенной зоне кристалла в результате адсорбции; 3) ионная связь, образующаяся при переходе валентного электрона адсорбированного атома в решетку кристалла. Наиболее реакционноспособны состояния со слабой связью, так как они обладают ненасыщенными валентностями.
