ГАЛОГЕНИ FF Cl. Cl Br. Br JJ



![Na. Na 33 [Al[Al FF 66 ] – кріоліт Основні запаси цього Na. Na 33 [Al[Al FF 66 ] – кріоліт Основні запаси цього](http://present5.com/presentbyword/20161215/4-galogeni-1_images/4-galogeni-1_5.jpg)


































4-galogeni-1.ppt
- Размер: 2.3 Мб
- Автор:
- Количество слайдов: 48
Описание презентации ГАЛОГЕНИ FF Cl. Cl Br. Br JJ по слайдам
 ГАЛОГЕНИ
ГАЛОГЕНИ
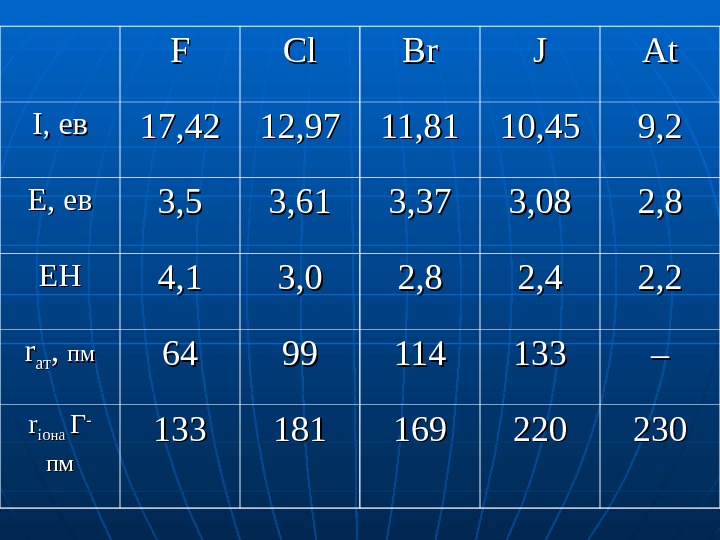
 FF Cl. Cl Br. Br JJ At. At І, ев 17, 42 12, 97 11, 81 10, 45 9, 2 Е, ев 3, 5 3, 61 3, 37 3, 08 2, 8 ЕНЕН 4, 1 3, 0 2, 8 2, 4 2, 2 rr атат , , пмпм 6464 9999 114114 133133 – – rr іона ГГ — пмпм
FF Cl. Cl Br. Br JJ At. At І, ев 17, 42 12, 97 11, 81 10, 45 9, 2 Е, ев 3, 5 3, 61 3, 37 3, 08 2, 8 ЕНЕН 4, 1 3, 0 2, 8 2, 4 2, 2 rr атат , , пмпм 6464 9999 114114 133133 – – rr іона ГГ — пмпм
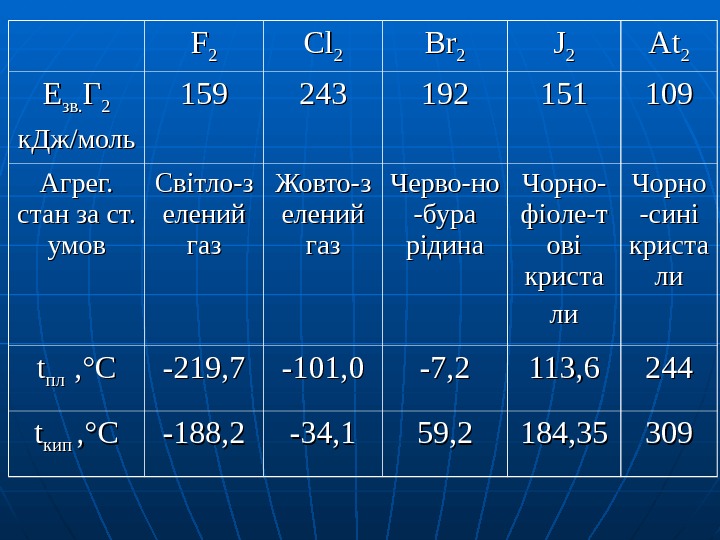
 FF 22 Cl. Cl 22 Br. Br 22 JJ 22 At. At 22 ЕЕ зв. ГГ 22 к. Дж // моль 159159 243243 192192 151151 109109 Агрег. стан за ст. умов Світло-з елений газгаз Жовто-з елений газгаз Че. Че рр вово — ноно -бура рідина Чорно- фіоле — тт ові криста лили Чорно -сині криста лили tt плпл , , °° СС -219, 7 -101, 0 -7, 2 113, 6 244244 tt кипкип , , °° СС -188, 2 -34, 1 59, 2 184,
FF 22 Cl. Cl 22 Br. Br 22 JJ 22 At. At 22 ЕЕ зв. ГГ 22 к. Дж // моль 159159 243243 192192 151151 109109 Агрег. стан за ст. умов Світло-з елений газгаз Жовто-з елений газгаз Че. Че рр вово — ноно -бура рідина Чорно- фіоле — тт ові криста лили Чорно -сині криста лили tt плпл , , °° СС -219, 7 -101, 0 -7, 2 113, 6 244244 tt кипкип , , °° СС -188, 2 -34, 1 59, 2 184,

 Знаходження в природі FF Cl. Cl Br. Br JJ At. At ат. % 2, 8 ·· 1010 -2 -2 2, 6 ·· 1010 -2 11 , 5, 5 ·· 1010 -5 -5 44 ·· 1010 -6 -6 — — Ca. Ca FF 22 – – флюорит (плавиковий шпат) 3 Ca 33 (PO(PO 44 )) 22 ·· Ca. Ca FF 22 – – апатит
Знаходження в природі FF Cl. Cl Br. Br JJ At. At ат. % 2, 8 ·· 1010 -2 -2 2, 6 ·· 1010 -2 11 , 5, 5 ·· 1010 -5 -5 44 ·· 1010 -6 -6 — — Ca. Ca FF 22 – – флюорит (плавиковий шпат) 3 Ca 33 (PO(PO 44 )) 22 ·· Ca. Ca FF 22 – – апатит
![Na. Na 33 [Al[Al FF 66 ] – кріоліт Основні запаси цього Na. Na 33 [Al[Al FF 66 ] – кріоліт Основні запаси цього](http://present5.com/presentbyword/20161215/4-galogeni-1_images/4-galogeni-1_5.jpg) Na. Na 33 [Al[Al FF 66 ] – кріоліт Основні запаси цього мінералу в Гренландії майже повністю вичерпані Склад емалі зубів наближується до Ca. Ca 55 FF (PO(PO 44 )) 33 Добова потреба організму у FF становить 1 мг, оптимальна концентрація у питній воді 1 мг // лл
Na. Na 33 [Al[Al FF 66 ] – кріоліт Основні запаси цього мінералу в Гренландії майже повністю вичерпані Склад емалі зубів наближується до Ca. Ca 55 FF (PO(PO 44 )) 33 Добова потреба організму у FF становить 1 мг, оптимальна концентрація у питній воді 1 мг // лл
 Na. Na Cl. Cl — — камяна сіль (галіт) KK Cl. Cl — — сильвін Na. Na Cl. Cl ·K·K Cl. Cl — — сильвініт KK Cl. Cl ·Mg·Mg Cl. Cl 22 · 6 H 22 O -O — карналіт Mg. Mg Cl. Cl 22 · 6 H 22 O –O – бішофіт Хлоридів(особливо Na. Na Cl. Cl ) багато в соляних озерах, соляних відкладеннях. НН Cl. Cl – шлунковий сік Na. Na Cl. Cl – клітинна рідина
Na. Na Cl. Cl — — камяна сіль (галіт) KK Cl. Cl — — сильвін Na. Na Cl. Cl ·K·K Cl. Cl — — сильвініт KK Cl. Cl ·Mg·Mg Cl. Cl 22 · 6 H 22 O -O — карналіт Mg. Mg Cl. Cl 22 · 6 H 22 O –O – бішофіт Хлоридів(особливо Na. Na Cl. Cl ) багато в соляних озерах, соляних відкладеннях. НН Cl. Cl – шлунковий сік Na. Na Cl. Cl – клітинна рідина
 Бром та йод досить поширені, але власних покладів мінералів вони не мають, а супроводжують хлор. Морська вода м ii стить ~~ 7 7 ·· 1010 -3 -3 % % Br. Br і і ~ 5· 10 -6 -6 % % JJ. . Деякі морські водорості накопичують йод. Попіл ламінаріі містить до 0, 5% йоду. KK JJ OO 33 (в покладах селітри в Чілі та Болівії)
Бром та йод досить поширені, але власних покладів мінералів вони не мають, а супроводжують хлор. Морська вода м ii стить ~~ 7 7 ·· 1010 -3 -3 % % Br. Br і і ~ 5· 10 -6 -6 % % JJ. . Деякі морські водорості накопичують йод. Попіл ламінаріі містить до 0, 5% йоду. KK JJ OO 33 (в покладах селітри в Чілі та Болівії)
 Найбільше йоду в бурових водах (до 33 ·· 1010 -3 -3 % % )) Організм людини містить близько 35 мг йоду, з них – 15 мг в щитовидній залозі. At. At (в(в ід грецького astatos – нестійкий) радіоактивний елемент, відомо понад 20 ізотопів, жодного стабільного. Загальний вміст в земній корі товщиною 1, 6 км ~~ 70 мг. (Максимальна маса At. At , з якою мали справу дослідники — 2 ·· 1010 -9 -9 г) г)
Найбільше йоду в бурових водах (до 33 ·· 1010 -3 -3 % % )) Організм людини містить близько 35 мг йоду, з них – 15 мг в щитовидній залозі. At. At (в(в ід грецького astatos – нестійкий) радіоактивний елемент, відомо понад 20 ізотопів, жодного стабільного. Загальний вміст в земній корі товщиною 1, 6 км ~~ 70 мг. (Максимальна маса At. At , з якою мали справу дослідники — 2 ·· 1010 -9 -9 г) г)
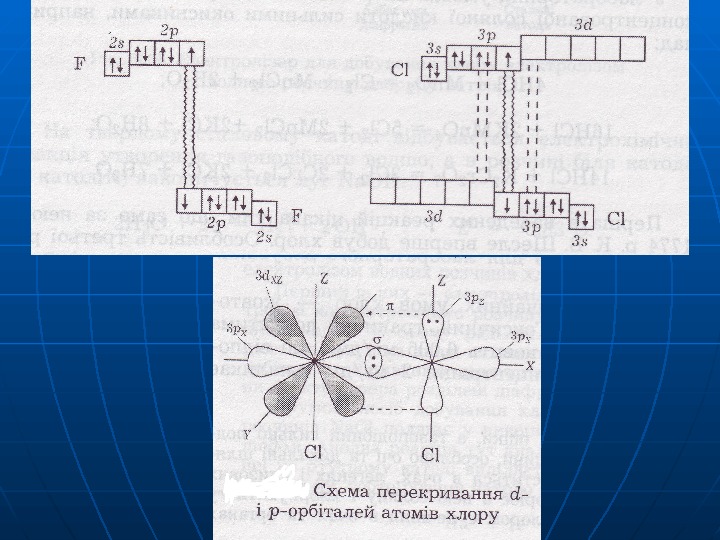
 Головна підгрупа VII гр. nsns 22 npnp 55 F 2 s 22 2 p 2 p 55 валентність == 11 ст. ок. 0 , , -1 -1 ЕНЕН = 4 , 1, 1 СС l l 33 ss 22 33 pp 55 33 dd 00 валетність == 11 , , 33 , , 55 , , 77 ст. ок. -1 0 0 +1+1 +3 +3 +4 +4 +5 +5 +6 +6 +7+
Головна підгрупа VII гр. nsns 22 npnp 55 F 2 s 22 2 p 2 p 55 валентність == 11 ст. ок. 0 , , -1 -1 ЕНЕН = 4 , 1, 1 СС l l 33 ss 22 33 pp 55 33 dd 00 валетність == 11 , , 33 , , 55 , , 77 ст. ок. -1 0 0 +1+1 +3 +3 +4 +4 +5 +5 +6 +6 +7+
 Добування У всіх випадках це процес окислення FF 22 – добувають електролізом розплаву KFKF ·· 2 HF K(-) A (+) 2 H 2 H + + + 2 e → H 22 ↑ ↑ 2 F 2 F — 2 e →
Добування У всіх випадках це процес окислення FF 22 – добувають електролізом розплаву KFKF ·· 2 HF K(-) A (+) 2 H 2 H + + + 2 e → H 22 ↑ ↑ 2 F 2 F — 2 e →
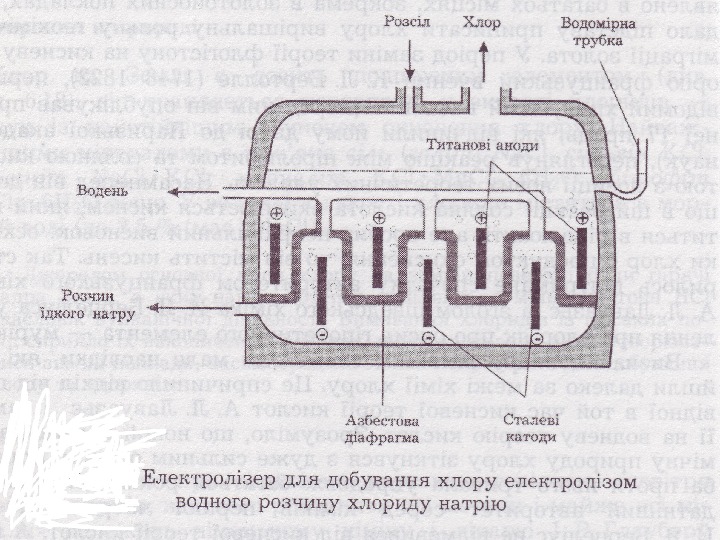
 Cl. Cl 22 добувають електролізом розчину Na. Cl KK (-) Na. Na + + 2 H 2 H 22 OO + 2 e → H 22 + 2 OH — , Е, Е 00 = -0, 41 В . . A (+) 2 Cl — — 2 e → Cl 22 , , Е Е 00 = 1, 36 В 2 H 2 H 22 OO — 44 e → ОО 22 + + 44 HH ++ , Е, Е 00 = 1, 23 В Рівновагу в бік виділення Cl. Cl 22 зміщують 1) підвищуючи [Cl — ]] 2) створюючи перенапругу виділенню ОО
Cl. Cl 22 добувають електролізом розчину Na. Cl KK (-) Na. Na + + 2 H 2 H 22 OO + 2 e → H 22 + 2 OH — , Е, Е 00 = -0, 41 В . . A (+) 2 Cl — — 2 e → Cl 22 , , Е Е 00 = 1, 36 В 2 H 2 H 22 OO — 44 e → ОО 22 + + 44 HH ++ , Е, Е 00 = 1, 23 В Рівновагу в бік виділення Cl. Cl 22 зміщують 1) підвищуючи [Cl — ]] 2) створюючи перенапругу виділенню ОО

 22 Br. Br — — + Cl 22 → Br 22 + + 22 Cl. Cl — Br. Br 22 відганяють струменем водяної пари та повітря 2 J 2 J — + Cl 22 → J 22 + 2 Cl — з бурових вод 2 Na. J+2 Na. NO 22 +2 H+2 H 22 SOSO 44 →J→J 22 +2 NO+Na 22 SOSO 44 +2 H+2 H 22 OO з селітри Na. JO 33 + 3 Na. HSO 33 → Na. J + 3 Na. HSO 44 JJ 22 адсорбують активованим вугіллям або екстрагують
22 Br. Br — — + Cl 22 → Br 22 + + 22 Cl. Cl — Br. Br 22 відганяють струменем водяної пари та повітря 2 J 2 J — + Cl 22 → J 22 + 2 Cl — з бурових вод 2 Na. J+2 Na. NO 22 +2 H+2 H 22 SOSO 44 →J→J 22 +2 NO+Na 22 SOSO 44 +2 H+2 H 22 OO з селітри Na. JO 33 + 3 Na. HSO 33 → Na. J + 3 Na. HSO 44 JJ 22 адсорбують активованим вугіллям або екстрагують

 Лабораторні способи добування Дія окисників на HCl або на Na. Cl 1616 HCl+ 22 KMn. O 44 → 5→ 5 Cl. Cl 22 +2 Mn. Cl 22 +2 KCl+8 H 22 OO 44 HCl + Mn. O 22 →→ Cl. Cl 2 2 + Mn. Cl 2 2 + 2 H 22 OO 1414 HCl+K 22 Cr. Cr 22 OO 77 →→ 33 Cl. Cl 22 +2 Cr. Cl 33 +2 KCl+7 H 22 OO
Лабораторні способи добування Дія окисників на HCl або на Na. Cl 1616 HCl+ 22 KMn. O 44 → 5→ 5 Cl. Cl 22 +2 Mn. Cl 22 +2 KCl+8 H 22 OO 44 HCl + Mn. O 22 →→ Cl. Cl 2 2 + Mn. Cl 2 2 + 2 H 22 OO 1414 HCl+K 22 Cr. Cr 22 OO 77 →→ 33 Cl. Cl 22 +2 Cr. Cl 33 +2 KCl+7 H 22 OO
 10 Na. Cl+2 KMn. O 44 +8 H+8 H 22 SOSO 44 → 5 Cl 22 +2 Mn. SO 44 ++ KK 22 SOSO 44 ++ 55 Na. Na 22 SOSO 44 +8 H+8 H 22 OO Br. Br 22 i J 22 отримують із солей 2 KBr + Cl 22 → Br 22 + 2 KCl 2 KJ + Cl 22 → J 22 + 2 KCl 6 KBr + K 22 Cr. Cr 22 OO 7 7 + 7 H 22 SOSO 44 → 5 Br 2 2 + Cr 22 (SO(SO 44 )) 3 3 + + KK 22 SOSO 4 4 + 8 H 22 OO 10 KJ + 2 KMn. O 4 4 + 8 H 22 SOSO 44 → 5 J 22 + 2 Mn. SO 44 + + KK 22 SOSO 4 4 + 8 H 22 OO
10 Na. Cl+2 KMn. O 44 +8 H+8 H 22 SOSO 44 → 5 Cl 22 +2 Mn. SO 44 ++ KK 22 SOSO 44 ++ 55 Na. Na 22 SOSO 44 +8 H+8 H 22 OO Br. Br 22 i J 22 отримують із солей 2 KBr + Cl 22 → Br 22 + 2 KCl 2 KJ + Cl 22 → J 22 + 2 KCl 6 KBr + K 22 Cr. Cr 22 OO 7 7 + 7 H 22 SOSO 44 → 5 Br 2 2 + Cr 22 (SO(SO 44 )) 3 3 + + KK 22 SOSO 4 4 + 8 H 22 OO 10 KJ + 2 KMn. O 4 4 + 8 H 22 SOSO 44 → 5 J 22 + 2 Mn. SO 44 + + KK 22 SOSO 4 4 + 8 H 22 OO


 Властивості FF 22 Cl. Cl 22 Br. Br 2 JJ 22 Енергія дисперсійної взаємодії ТТ кипіння pp озчинність у воді нн айвища у Br. Br 22 JJ 22 розчиняється погано, але в присутності К JJ – розчинність JJ 22 зростає
Властивості FF 22 Cl. Cl 22 Br. Br 2 JJ 22 Енергія дисперсійної взаємодії ТТ кипіння pp озчинність у воді нн айвища у Br. Br 22 JJ 22 розчиняється погано, але в присутності К JJ – розчинність JJ 22 зростає
 KJ + J 22 → → KJKJ 33 JJ — — + J+ J 22 →→ J J 33 — JJ → ← JJ — → ←→ ← JJ 0, 5 (J (J : : J) J) —
KJ + J 22 → → KJKJ 33 JJ — — + J+ J 22 →→ J J 33 — JJ → ← JJ — → ←→ ← JJ 0, 5 (J (J : : J) J) —
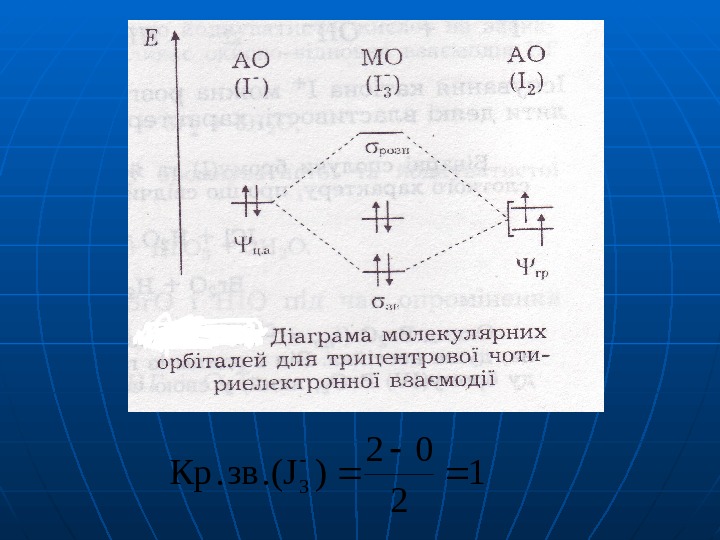
 1 2 02 ). (Jзв. Кр
1 2 02 ). (Jзв. Кр
 Галогени – типові окисники nsns 22 npnp 55 Самий сильний — FF 22 + 2 e → 2 F — ЕЕ 0 0 = 2, 85 В 22 HH 22 O + 2 F 22 → 4 HF + O 22 , , ΔΔ Н Н << 0 0 пісок, асбест спалахують в атмосфері фтору Si. O 22 + 2 F 22 → Si. F 44 + O 22 Kr + F 22 → Kr.
Галогени – типові окисники nsns 22 npnp 55 Самий сильний — FF 22 + 2 e → 2 F — ЕЕ 0 0 = 2, 85 В 22 HH 22 O + 2 F 22 → 4 HF + O 22 , , ΔΔ Н Н << 0 0 пісок, асбест спалахують в атмосфері фтору Si. O 22 + 2 F 22 → Si. F 44 + O 22 Kr + F 22 → Kr.
 Xe + F 22 → Xe. F 22 Xe + 22 FF 22 → Xe. F 4 4 Xe + 33 FF 22 → Xe. F 6 6 S + 3 F 22 → SF 66 , , ΔΔ НН = -1207 к. Дж 2 P + 5 F 22 → 2 PF 55 , , ΔΔ НН = -1 385385 к. Дж ці реакції протікають навіть за t <t < 0 0 00 СС 2 NH 33 + 6 F 22 → 6 HF + 2 NF 33 (( за низьких t)t) 2 NH 33 + 3 F 22 → 6 HF + N 22 (( за високих t)t)
Xe + F 22 → Xe. F 22 Xe + 22 FF 22 → Xe. F 4 4 Xe + 33 FF 22 → Xe. F 6 6 S + 3 F 22 → SF 66 , , ΔΔ НН = -1207 к. Дж 2 P + 5 F 22 → 2 PF 55 , , ΔΔ НН = -1 385385 к. Дж ці реакції протікають навіть за t <t < 0 0 00 СС 2 NH 33 + 6 F 22 → 6 HF + 2 NF 33 (( за низьких t)t) 2 NH 33 + 3 F 22 → 6 HF + N 22 (( за високих t)t)
 Cl. Cl 22 + 2 e → 2 Cl — E E 0 0 = = 1, 36 ВВ 2 Sb + 3 Cl 22 → 2 Sb. Cl 33 2 P + 3 Cl 22 → 2 PCl 33 2 P + 5 Cl 22 → 2 PCl 55 2 Fe + 3 Cl 22 → 2 Fe. Cl 33 J J 22 + 2 e → 2 J — — E E 0 0 = = 0, 53 В В Zn + J 2 2 →→ Zn. J 22 3 J 3 J 22 + 10 HNO 33 → 6 HJO 33 + 10 NO + 2 H 22 O O
Cl. Cl 22 + 2 e → 2 Cl — E E 0 0 = = 1, 36 ВВ 2 Sb + 3 Cl 22 → 2 Sb. Cl 33 2 P + 3 Cl 22 → 2 PCl 33 2 P + 5 Cl 22 → 2 PCl 55 2 Fe + 3 Cl 22 → 2 Fe. Cl 33 J J 22 + 2 e → 2 J — — E E 0 0 = = 0, 53 В В Zn + J 2 2 →→ Zn. J 22 3 J 3 J 22 + 10 HNO 33 → 6 HJO 33 + 10 NO + 2 H 22 O O






 FF 22 Cl 2 Br. Br 2 JJ 22 EE °° , , B 2, 87 1, 36 1, 06 0, 53 окислювальні властивості зменшуються HH 22 + F 22 → 2 HF HH 22 + Cl 22 2 HCl HH 22 + Br 22 2 HBr HH 22 + J 22 2 HJ h t t
FF 22 Cl 2 Br. Br 2 JJ 22 EE °° , , B 2, 87 1, 36 1, 06 0, 53 окислювальні властивості зменшуються HH 22 + F 22 → 2 HF HH 22 + Cl 22 2 HCl HH 22 + Br 22 2 HBr HH 22 + J 22 2 HJ h t t
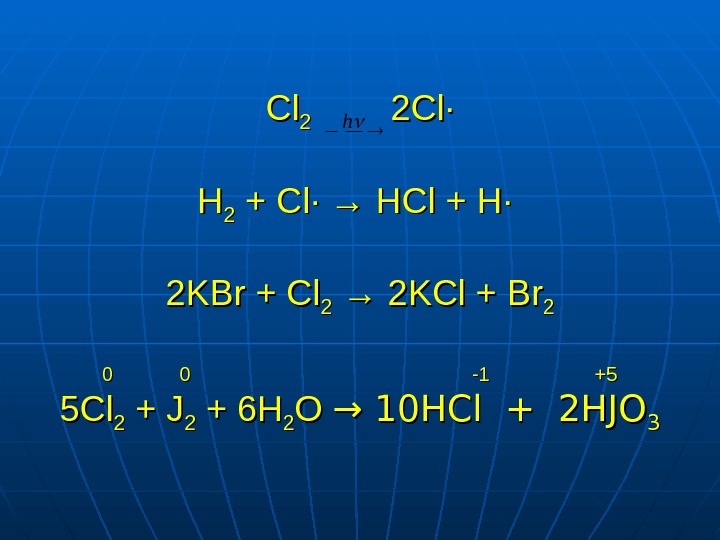
 Cl. Cl 22 2 Cl· HH 22 + Cl ·· → HCl + H· 2 KBr + Cl 22 → 2 KCl + Br. Br 22 0 0 -1 +5 5 Cl 22 + J 22 + 6 H 22 O O → 10 HCl + 2 HJO 33 h
Cl. Cl 22 2 Cl· HH 22 + Cl ·· → HCl + H· 2 KBr + Cl 22 → 2 KCl + Br. Br 22 0 0 -1 +5 5 Cl 22 + J 22 + 6 H 22 O O → 10 HCl + 2 HJO 33 h
 Галогеноводні Добування HFHF HH 22 + F 22 → 2 HF для добування не використовують Ca. F 22 + H 22 SOSO 44 (р)(р) → Ca. SO 44 ↓ + 2 HF (розчин) Ca. F 22 + H 22 SOSO 44 (к)(к) → Ca. SO 44 ↓ + 2 HF ↑↑
Галогеноводні Добування HFHF HH 22 + F 22 → 2 HF для добування не використовують Ca. F 22 + H 22 SOSO 44 (р)(р) → Ca. SO 44 ↓ + 2 HF (розчин) Ca. F 22 + H 22 SOSO 44 (к)(к) → Ca. SO 44 ↓ + 2 HF ↑↑
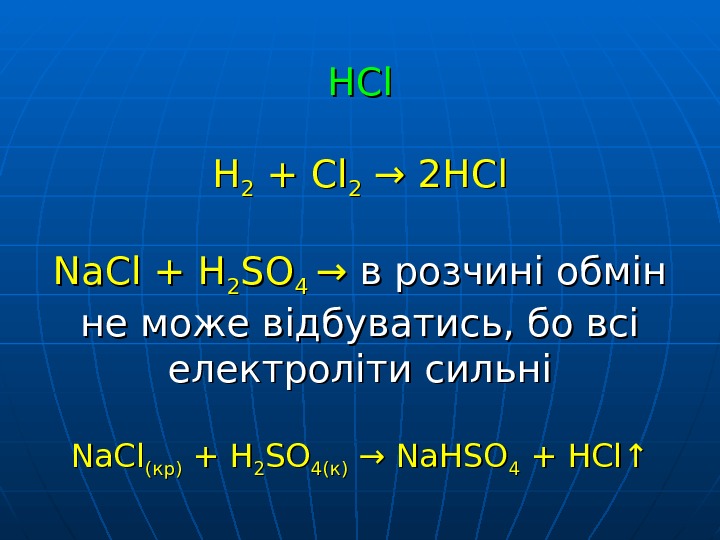
 HCl HH 22 + Cl 22 → 2 HCl Na. Cl + H 22 SOSO 4 4 → → в розчині обмін не може відбуватись, бо всі електроліти сильні Na. Cl (кр) + H 22 SOSO 44 (к)(к) → Na. HSO 44 + HCl↑
HCl HH 22 + Cl 22 → 2 HCl Na. Cl + H 22 SOSO 4 4 → → в розчині обмін не може відбуватись, бо всі електроліти сильні Na. Cl (кр) + H 22 SOSO 44 (к)(к) → Na. HSO 44 + HCl↑

 HBr KBr (к(к pp )) + H 22 SOSO 44 (к)(к) → KHSO 44 + HBr 2 HBr + H 22 SOSO 44 →→ Br Br 22 +SO 22 + 2 H 22 OO сумарна реакція 2 KBr (к(к pp )) +2 H+2 H 22 SOSO 4(K) →Br→Br 22 +SO+SO 22 +K+K 22 SOSO 44 +2 H+2 H 22 OO PBr 33 + 3 H 22 O → H 33 POPO 3 3 + 3 HBr Ba. S +4 Br 22 +4 H+4 H 22 O→Ba. SO 44 ↓+ 8 HBr
HBr KBr (к(к pp )) + H 22 SOSO 44 (к)(к) → KHSO 44 + HBr 2 HBr + H 22 SOSO 44 →→ Br Br 22 +SO 22 + 2 H 22 OO сумарна реакція 2 KBr (к(к pp )) +2 H+2 H 22 SOSO 4(K) →Br→Br 22 +SO+SO 22 +K+K 22 SOSO 44 +2 H+2 H 22 OO PBr 33 + 3 H 22 O → H 33 POPO 3 3 + 3 HBr Ba. S +4 Br 22 +4 H+4 H 22 O→Ba. SO 44 ↓+ 8 HBr
 Аналогічно для HJHJ 88 KJ + 55 HH 22 SOSO 44 →→ 4 4 JJ 22 +H +H 22 SS +4+4 KK 22 SOSO 44 +4 H+4 H 22 OO PJPJ 33 + 3 H 22 O → H 33 POPO 3 3 + 3 HJ JJ 22 + H 22 S → S↓ + 2 HJ
Аналогічно для HJHJ 88 KJ + 55 HH 22 SOSO 44 →→ 4 4 JJ 22 +H +H 22 SS +4+4 KK 22 SOSO 44 +4 H+4 H 22 OO PJPJ 33 + 3 H 22 O → H 33 POPO 3 3 + 3 HJ JJ 22 + H 22 S → S↓ + 2 HJ
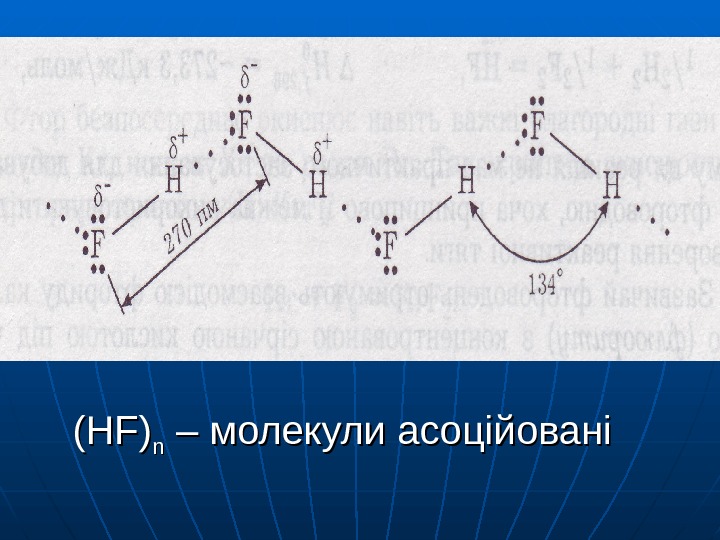
 HF HCl HBr HJ tt кипкип , , °° С С 19, 5 -85 -67 -35 Е ММВз зростає В В HFHF – водневий зв ’’ зокзок H-FH-F ······
HF HCl HBr HJ tt кипкип , , °° С С 19, 5 -85 -67 -35 Е ММВз зростає В В HFHF – водневий зв ’’ зокзок H-FH-F ······
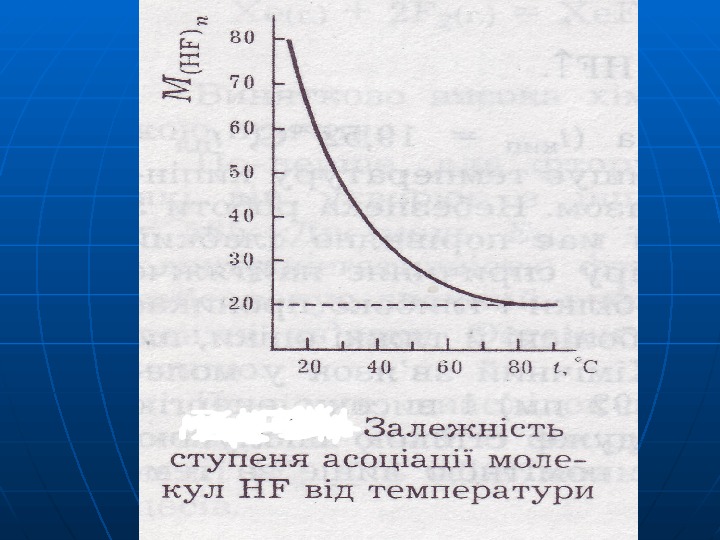
 (HF) nn – – молекули асоційовані
(HF) nn – – молекули асоційовані

 ВВ водних розчинах HFHF ++ HH 22 OO ↔ Н 33 OO ++ + + FF — — KK 11 =7, 2 · 10 -4 -4 HFHF + + FF — ↔ Н↔ Н FF 22 — KK 22 =5, 1 В розчинах плавикої кислоти йонів НН FF 22 — найбільше Відомі кислі солі KHFKHF 22 (KF ·HF·HF ), ), KHKH 22 FF 3 3 (KF(KF · 2 HF ))
ВВ водних розчинах HFHF ++ HH 22 OO ↔ Н 33 OO ++ + + FF — — KK 11 =7, 2 · 10 -4 -4 HFHF + + FF — ↔ Н↔ Н FF 22 — KK 22 =5, 1 В розчинах плавикої кислоти йонів НН FF 22 — найбільше Відомі кислі солі KHFKHF 22 (KF ·HF·HF ), ), KHKH 22 FF 3 3 (KF(KF · 2 HF ))
 HCl HBr HJ сила кислот сильні одноосновні кислоти НГ НГ → Н→ Н ++ + Г — Радіус атома галогену збільшується, збільшується довжина зв’язку, зменшується Е звзв ’’ язку , , збільшується здатність зв’язку до поляризації і під дією HH 22 OO звзв ’’ язки легше розриваються
HCl HBr HJ сила кислот сильні одноосновні кислоти НГ НГ → Н→ Н ++ + Г — Радіус атома галогену збільшується, збільшується довжина зв’язку, зменшується Е звзв ’’ язку , , збільшується здатність зв’язку до поляризації і під дією HH 22 OO звзв ’’ язки легше розриваються
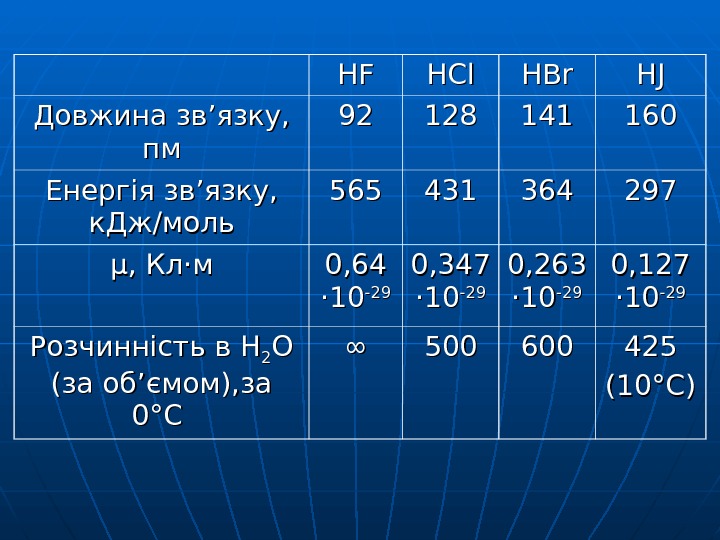
 HFHF HCl HBr HJHJ Довжина зв ’’ язку, пмпм 9292 128128 141141 160160 Енергія зв ’’ язку, к. Дж/моль 565565 431431 364364 297297 μμ , Кл ·· мм 0, 64 ·· 1010 -29 -29 0, 347 ·· 1010 -29 -29 0, 263 ·· 1010 -29 -29 0, 127 ·· 1010 -29 -29 Розчинність в HH 22 OO (за об ’’ ємом), за 00 °° СС ∞∞ 500500 600600 425425 (10(10 °° С)С)
HFHF HCl HBr HJHJ Довжина зв ’’ язку, пмпм 9292 128128 141141 160160 Енергія зв ’’ язку, к. Дж/моль 565565 431431 364364 297297 μμ , Кл ·· мм 0, 64 ·· 1010 -29 -29 0, 347 ·· 1010 -29 -29 0, 263 ·· 1010 -29 -29 0, 127 ·· 1010 -29 -29 Розчинність в HH 22 OO (за об ’’ ємом), за 00 °° СС ∞∞ 500500 600600 425425 (10(10 °° С)С)

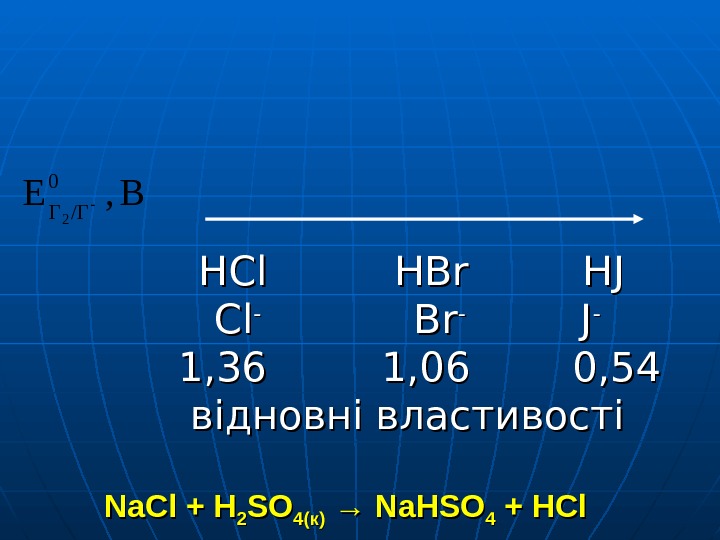
 HCl HBr HJ HJ Cl. Cl — Br Br — J J — 1, 36 1, 06 0, 54 відновні властивості Na. Cl + H 22 SOSO 44 (к)(к) → Na. HSO 44 + HCl 2 KBr (к(к pp )) + 2 H 22 SOSO 4(K) →→ Br. Br 22 + SO 22 + K+ K 22 SOSO 44 +2 H+2 H 22 OO 88 KJ + 55 HH 22 SOSO 44 →→ 44 JJ 22 + H 22 SS + 4 KK 22 SOSO 44 + 4 H 22 OOВ, Ε 0 /ГГ
HCl HBr HJ HJ Cl. Cl — Br Br — J J — 1, 36 1, 06 0, 54 відновні властивості Na. Cl + H 22 SOSO 44 (к)(к) → Na. HSO 44 + HCl 2 KBr (к(к pp )) + 2 H 22 SOSO 4(K) →→ Br. Br 22 + SO 22 + K+ K 22 SOSO 44 +2 H+2 H 22 OO 88 KJ + 55 HH 22 SOSO 44 →→ 44 JJ 22 + H 22 SS + 4 KK 22 SOSO 44 + 4 H 22 OOВ, Ε 0 /ГГ
 Якісні реакції на галогенід-йони Ag. Ag ++ + Cl — → Ag. Cl↓
Якісні реакції на галогенід-йони Ag. Ag ++ + Cl — → Ag. Cl↓


