ФОТОСИНТЕЗ Оксигенная фотоавтотрофия растений. Краткая история изучения фотосинтеза















































1333918_presentation.ppt
- Количество слайдов: 134
 ФОТОСИНТЕЗ Оксигенная фотоавтотрофия растений
ФОТОСИНТЕЗ Оксигенная фотоавтотрофия растений
 Краткая история изучения фотосинтеза растений Джозеф Пристли (1771) – растения делают воздух пригодным для горения и дыхания (выделяют кислород) Ян Ингенхауз (1779) – процесс происходит только на свету Жан Сенебье (1782) – кислород выделяют только зеленые части растения при наличии в воздухе углекислого газа Н.Соссюр (1804) – объем поглощаемого на свету СО2 равен объему выделяемого О2. Поглощение СО2 – углеродное питание растений. В процессе принимает участие вода.
Краткая история изучения фотосинтеза растений Джозеф Пристли (1771) – растения делают воздух пригодным для горения и дыхания (выделяют кислород) Ян Ингенхауз (1779) – процесс происходит только на свету Жан Сенебье (1782) – кислород выделяют только зеленые части растения при наличии в воздухе углекислого газа Н.Соссюр (1804) – объем поглощаемого на свету СО2 равен объему выделяемого О2. Поглощение СО2 – углеродное питание растений. В процессе принимает участие вода.
 Пельтье и Каванту (1817) – открыли зеленый пигмент листьев – хлорофилл. Жан-Батист Буссенго (1840) – составил уравнение: 6СО2+:Н2О=С6Н12О6+6О2 Р.Майр (1842) – растения превращают энергию света в химическую энергию. У.Сакс (1864) – основной продукт синтеза на свету в листьях – крахмал. К.А.Тимирязев (1869) – экспериментально обосновал аккумуляцию и превращение энергии зеленым листом. Доказал, что для этого нужен красный свет. В.Пфеффер (1877) – ввел термин «фотосинтез».
Пельтье и Каванту (1817) – открыли зеленый пигмент листьев – хлорофилл. Жан-Батист Буссенго (1840) – составил уравнение: 6СО2+:Н2О=С6Н12О6+6О2 Р.Майр (1842) – растения превращают энергию света в химическую энергию. У.Сакс (1864) – основной продукт синтеза на свету в листьях – крахмал. К.А.Тимирязев (1869) – экспериментально обосновал аккумуляцию и превращение энергии зеленым листом. Доказал, что для этого нужен красный свет. В.Пфеффер (1877) – ввел термин «фотосинтез».
 Ф.Блэкман (1905) – двухфазный характер фотосинтеза. Р.Эмерсон, А.Арнольд (1932) – быстрые фотохимические и медленные биохимические реакции фотосинтеза; (1942-1957) – наличие 2 фотосистем. Р.Хилл (1937) – нециклический поток электронов, источник электронов – вода, акцепторы – окисленные соединения. Для выделения О2 необходима вода. К.Ван-Ниль, А.П.Виноградов, Р.В.Тейс, С.Рубен, М.Камен (1935-1941) – кислород при фотосинтезе имеет водное происхождение. М.Кальвин, Бенсон, Бассем (1947-1954) – метаболизм углерода при фотосинтезе.
Ф.Блэкман (1905) – двухфазный характер фотосинтеза. Р.Эмерсон, А.Арнольд (1932) – быстрые фотохимические и медленные биохимические реакции фотосинтеза; (1942-1957) – наличие 2 фотосистем. Р.Хилл (1937) – нециклический поток электронов, источник электронов – вода, акцепторы – окисленные соединения. Для выделения О2 необходима вода. К.Ван-Ниль, А.П.Виноградов, Р.В.Тейс, С.Рубен, М.Камен (1935-1941) – кислород при фотосинтезе имеет водное происхождение. М.Кальвин, Бенсон, Бассем (1947-1954) – метаболизм углерода при фотосинтезе.
 Д.Арнон (1954-1957) – циклическое и нециклическое фотофосфорилирование – фотоэнергетические реакции хлоропластов. Л.Дюйзенс (1951-1952) – перенос энергии возбужденного состояния от антеннных пигментов в реакционный центр, модель фотосинтетической единицы. Р.Хилл, Ф.Бендалл, Б.Кок и др. (1961) – Z-схема фотосинтеза. Ю.Карпилов, Х.Корчак, М.Хэч, К.Слэк (1957-1964) – С4 тип фотосинтетического метаболизма. О.Варбург (1920), Н.Воскресенская, В.Джексон, Н.Толберт, И.Зелитч (1968-1974) – фотодыхание, гликолатный путь фотосинтеза.
Д.Арнон (1954-1957) – циклическое и нециклическое фотофосфорилирование – фотоэнергетические реакции хлоропластов. Л.Дюйзенс (1951-1952) – перенос энергии возбужденного состояния от антеннных пигментов в реакционный центр, модель фотосинтетической единицы. Р.Хилл, Ф.Бендалл, Б.Кок и др. (1961) – Z-схема фотосинтеза. Ю.Карпилов, Х.Корчак, М.Хэч, К.Слэк (1957-1964) – С4 тип фотосинтетического метаболизма. О.Варбург (1920), Н.Воскресенская, В.Джексон, Н.Толберт, И.Зелитч (1968-1974) – фотодыхание, гликолатный путь фотосинтеза.
 Расшифрована генетическая система хлоропластов, известны гены, ответственные за фотосинтетические процессы. Изучена структура фотосистем I и II. Сформулированы представления о механизмах выделения кислорода (окисления воды). Определена роль фотосинтеза в донорно-акцепторных связях в растении. Активно исследуются экологические аспекты фотосинтеза. Разрабатываются прикладные исследования фотосинтеза. Современный этап в исследовании фотосинтеза:
Расшифрована генетическая система хлоропластов, известны гены, ответственные за фотосинтетические процессы. Изучена структура фотосистем I и II. Сформулированы представления о механизмах выделения кислорода (окисления воды). Определена роль фотосинтеза в донорно-акцепторных связях в растении. Активно исследуются экологические аспекты фотосинтеза. Разрабатываются прикладные исследования фотосинтеза. Современный этап в исследовании фотосинтеза:
 Глобальная роль фотосинтеза («Космическая роль зеленого растения» К.А.Тимирязев) 1) Создание первичной биопродуктивности (100-170 млрд.тонн/год на суше и 60-70 млрд.тонн/год в океане). В ходе фотосинтеза создано: Живое вещество биосферы (2400 млрд.тонн растений, 23 млрд.тонн гетеротрофов) Гумус, торф, подстилка Уголь, газ, нефть Вещество осадочных пород
Глобальная роль фотосинтеза («Космическая роль зеленого растения» К.А.Тимирязев) 1) Создание первичной биопродуктивности (100-170 млрд.тонн/год на суше и 60-70 млрд.тонн/год в океане). В ходе фотосинтеза создано: Живое вещество биосферы (2400 млрд.тонн растений, 23 млрд.тонн гетеротрофов) Гумус, торф, подстилка Уголь, газ, нефть Вещество осадочных пород
 2) Трансформация энергии солнца в энергию химических связей органических соединений 80-85% ФАР и около 25% ИК лучей поглощается листьями растений; пропускается, соответственно, 5% и 30%, отражается – 10% и 45%. Из поглощенной энергии эффективно тратится в процессе фотосинтеза 0,5-2% ФАР. Остальная энергия используется преимущественно для испарения воды.
2) Трансформация энергии солнца в энергию химических связей органических соединений 80-85% ФАР и около 25% ИК лучей поглощается листьями растений; пропускается, соответственно, 5% и 30%, отражается – 10% и 45%. Из поглощенной энергии эффективно тратится в процессе фотосинтеза 0,5-2% ФАР. Остальная энергия используется преимущественно для испарения воды.
 3) Продукция кислорода (70-120 млрд.тонн/год) Обеспечение жизнедеятельности всех аэробов и производственных нужд человечества 4) Создание и поддержание озонового экрана Защита от жесткого космического излучения, фактор выхода жизни из океана на сушу около 400-500 тыс. лет назад
3) Продукция кислорода (70-120 млрд.тонн/год) Обеспечение жизнедеятельности всех аэробов и производственных нужд человечества 4) Создание и поддержание озонового экрана Защита от жесткого космического излучения, фактор выхода жизни из океана на сушу около 400-500 тыс. лет назад
 5) Поддержание концентрации углекислого газа в атмосфере Баланс поступления: - дыхание живых организмов (37 млрд.тонн/год) - Производство ( 5 млрд.тонн/год) - геохимичекие процессы (0,5 млрд.тонн/год) и поглощения (фотосинтез). 6) Предотвращение парникового эффекта 7) Формирование и поддержание газового состава атмосферы
5) Поддержание концентрации углекислого газа в атмосфере Баланс поступления: - дыхание живых организмов (37 млрд.тонн/год) - Производство ( 5 млрд.тонн/год) - геохимичекие процессы (0,5 млрд.тонн/год) и поглощения (фотосинтез). 6) Предотвращение парникового эффекта 7) Формирование и поддержание газового состава атмосферы
 Уровни организации фотосинтетического аппарата Фотосинтетический аппарат – материальная основа фотосинтеза, совокупность структур, обеспечивающих фотосинтез: Растительность Земного шара Растительность биомов Фитоценоз Растение Лист Фототрофные ткани Клетка мезофилла хлоропласт
Уровни организации фотосинтетического аппарата Фотосинтетический аппарат – материальная основа фотосинтеза, совокупность структур, обеспечивающих фотосинтез: Растительность Земного шара Растительность биомов Фитоценоз Растение Лист Фототрофные ткани Клетка мезофилла хлоропласт
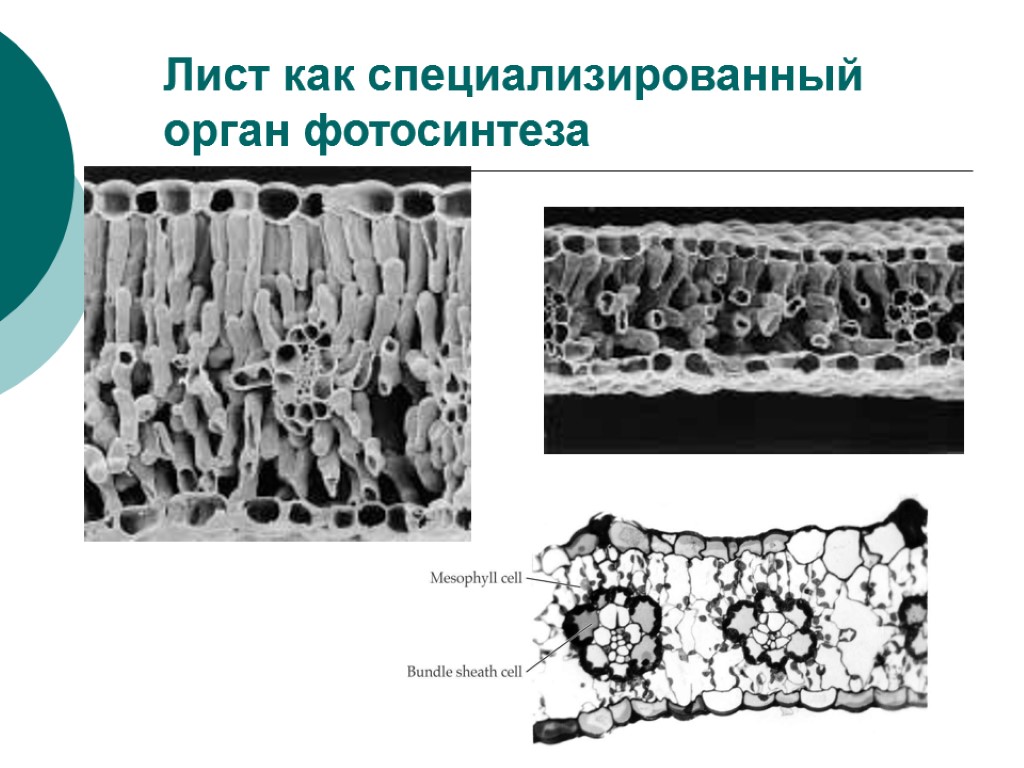
 Лист как специализированный орган фотосинтеза
Лист как специализированный орган фотосинтеза
 Хлоропласт Хлоропласты эукариотных фотосинтетических клеток имеют наиболее сложную структурную организацию внутренних мембран по сравнению с другими органоидами клеток. В этом отношении с ними сравнимы только рецепторные клетки сетчатки глаза, также выполняющие функцию преобразования световой энергии, но для информационных целей. Впервые специализированные органеллы хлоропласты появились у криптофитов. У них по 2 хлоропласта на клетку с одним или несколькими тилакоидами. Наиболее развиты мембраны хлоропластов высших растений с многослойной упорядоченной системой гран.
Хлоропласт Хлоропласты эукариотных фотосинтетических клеток имеют наиболее сложную структурную организацию внутренних мембран по сравнению с другими органоидами клеток. В этом отношении с ними сравнимы только рецепторные клетки сетчатки глаза, также выполняющие функцию преобразования световой энергии, но для информационных целей. Впервые специализированные органеллы хлоропласты появились у криптофитов. У них по 2 хлоропласта на клетку с одним или несколькими тилакоидами. Наиболее развиты мембраны хлоропластов высших растений с многослойной упорядоченной системой гран.
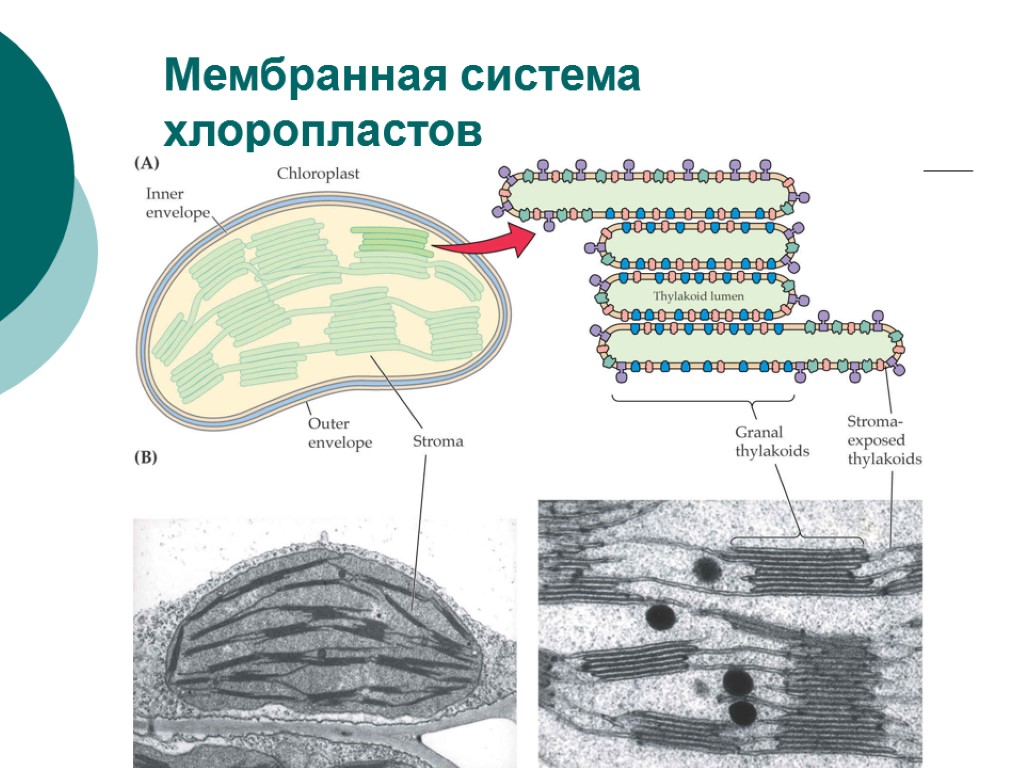
 Основные компоненты хлоропластов высших растений: 1) двойная мембрана – внешняя более простая 7 нм и внутренняя ~ 10 нм, образующая впячивания внутрь хлоропласта, из которых возникает система внутренних мембран; 2) строма – внутренняя растворимая фаза хлоропласта с ферментами С-цикла, синтеза белка (ДНК, РНК, рибосомы) и др. растворимыми компонентами; 3) собственно фотосинтетические мембраны - стопки гран (диаметр 0.5 мкм) и стромальных ламелл (диаметр 5-7 мкм), пронизывающих весь хлоропласт и связывающих граны. Среднее число хлоропластов в клетке палисадной ткани листа ~ 60-80, в клетках губчатой ткани ~ 15-40. У некоторых видов в клетках более 400 хлоропластов. Средний объем хлоропласта 30-60 мкм3. Суммарный объем составляет 10-20% объема клеток, а у древесных растений до 35-70%. В одном хлоропласте (1-2) · 109 молекул Хл, у тенелюбивых до (5-10) · 109.
Основные компоненты хлоропластов высших растений: 1) двойная мембрана – внешняя более простая 7 нм и внутренняя ~ 10 нм, образующая впячивания внутрь хлоропласта, из которых возникает система внутренних мембран; 2) строма – внутренняя растворимая фаза хлоропласта с ферментами С-цикла, синтеза белка (ДНК, РНК, рибосомы) и др. растворимыми компонентами; 3) собственно фотосинтетические мембраны - стопки гран (диаметр 0.5 мкм) и стромальных ламелл (диаметр 5-7 мкм), пронизывающих весь хлоропласт и связывающих граны. Среднее число хлоропластов в клетке палисадной ткани листа ~ 60-80, в клетках губчатой ткани ~ 15-40. У некоторых видов в клетках более 400 хлоропластов. Средний объем хлоропласта 30-60 мкм3. Суммарный объем составляет 10-20% объема клеток, а у древесных растений до 35-70%. В одном хлоропласте (1-2) · 109 молекул Хл, у тенелюбивых до (5-10) · 109.
 Положение хлоропластов в клетке
Положение хлоропластов в клетке
 Мембранная система хлоропластов
Мембранная система хлоропластов
 3-мерная модель организации внутренних мембран хлоропластов
3-мерная модель организации внутренних мембран хлоропластов
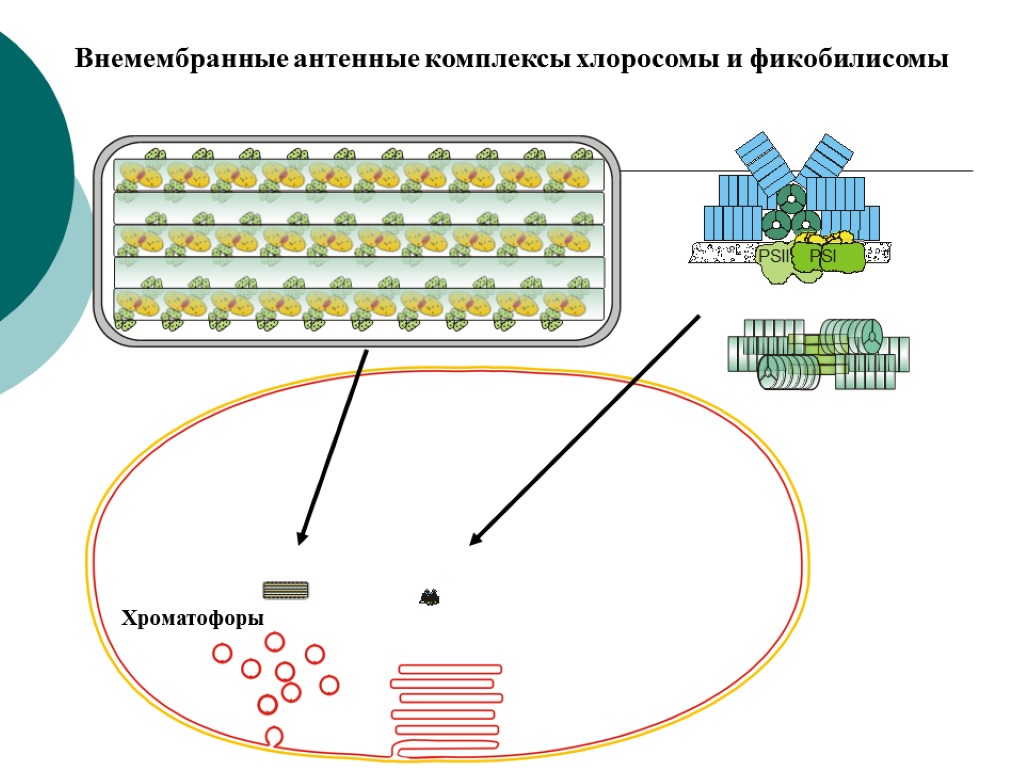
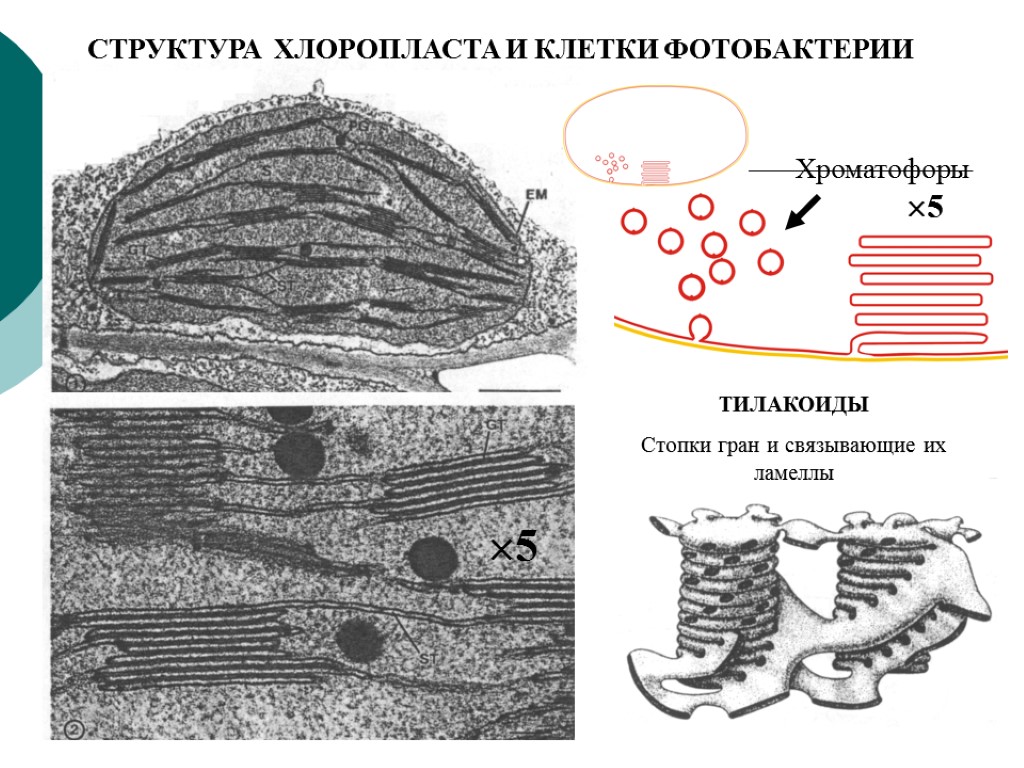
 Особенности фотосинтетических мембран прокариот Все фотосинтетические мембраны прокариот – производные от цитоплазматической мембраны (ЦПМ), возникшие в результате ее разрастания и глубокого впячивания (инвагинации) в цитоплазму. У пурпурных бактерий мембраны сохраняют тесную связь с ЦПМ, а у цианобактерий эта связь не очевидна и они могут быть автономными структурами. Фотосинтетические мембраны имеют вид трубочек, пузырьков (хроматофоров), уплощенных замкнутых дисков (тилакоидов), образованных тесно сближенными мембранами (ламеллами). У пурпурных бактерий мембранные структуры в виде стопок тесно упакованных ламелл расположены на периферии клеток и связаны с ЦПМ. У некоторых видов есть везикулярные мембранные структуры. Средний размер хроматофора Rhodopseudomonas sphaeroides по диаметру ~ 50 нм и в нем 3000 Бхл и ~40 РЦ. В одной клетке ~550 хроматофоров, (1.6–2) · 106 молекул Бхл. Однако есть фототрофы без специализированных внутриклеточных фотосинтетических мембран – галофильные архебактерии, родопсинсодержащие эубактерии, гелиобактерии, зеленые бактерии и один уникальный вид цианобактерий Gloeobacter violaceus. У всех этих видов фотосинтетические комплексы локализованы в ЦПМ, а светособирающие пигменты – в особых комплексах хлоросом (зеленые бактерии) и фикобилисом (Gloeobacter violaceus).
Особенности фотосинтетических мембран прокариот Все фотосинтетические мембраны прокариот – производные от цитоплазматической мембраны (ЦПМ), возникшие в результате ее разрастания и глубокого впячивания (инвагинации) в цитоплазму. У пурпурных бактерий мембраны сохраняют тесную связь с ЦПМ, а у цианобактерий эта связь не очевидна и они могут быть автономными структурами. Фотосинтетические мембраны имеют вид трубочек, пузырьков (хроматофоров), уплощенных замкнутых дисков (тилакоидов), образованных тесно сближенными мембранами (ламеллами). У пурпурных бактерий мембранные структуры в виде стопок тесно упакованных ламелл расположены на периферии клеток и связаны с ЦПМ. У некоторых видов есть везикулярные мембранные структуры. Средний размер хроматофора Rhodopseudomonas sphaeroides по диаметру ~ 50 нм и в нем 3000 Бхл и ~40 РЦ. В одной клетке ~550 хроматофоров, (1.6–2) · 106 молекул Бхл. Однако есть фототрофы без специализированных внутриклеточных фотосинтетических мембран – галофильные архебактерии, родопсинсодержащие эубактерии, гелиобактерии, зеленые бактерии и один уникальный вид цианобактерий Gloeobacter violaceus. У всех этих видов фотосинтетические комплексы локализованы в ЦПМ, а светособирающие пигменты – в особых комплексах хлоросом (зеленые бактерии) и фикобилисом (Gloeobacter violaceus).
 Внемембранные антенные комплексы хлоросомы и фикобилисомы Хроматофоры
Внемембранные антенные комплексы хлоросомы и фикобилисомы Хроматофоры
 СТРУКТУРА ХЛОРОПЛАСТА И КЛЕТКИ ФОТОБАКТЕРИИ ТИЛАКОИДЫ Стопки гран и связывающие их ламеллы Хроматофоры 5 5
СТРУКТУРА ХЛОРОПЛАСТА И КЛЕТКИ ФОТОБАКТЕРИИ ТИЛАКОИДЫ Стопки гран и связывающие их ламеллы Хроматофоры 5 5
 СВОЙСТВА ХЛОРОПЛАСТНЫХ МЕМБРАН 1) отрицательный поверхностный потенциал, связанный с карбоксильными остатками Асп и Глу интегральных белков. Этот поверхностный заряд важен для формирования гран. Катионы среды, экранируя отрицательные заряды поверхности мембран снижают их отталкивание и способствуют слипанию стопок гран.
СВОЙСТВА ХЛОРОПЛАСТНЫХ МЕМБРАН 1) отрицательный поверхностный потенциал, связанный с карбоксильными остатками Асп и Глу интегральных белков. Этот поверхностный заряд важен для формирования гран. Катионы среды, экранируя отрицательные заряды поверхности мембран снижают их отталкивание и способствуют слипанию стопок гран.
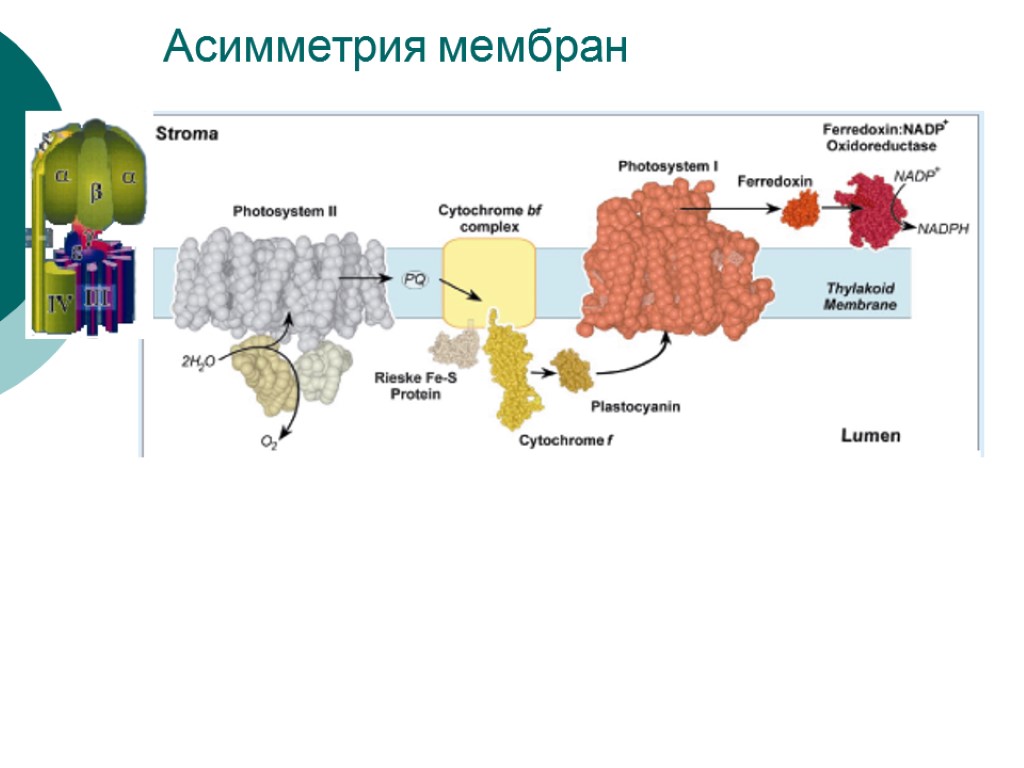
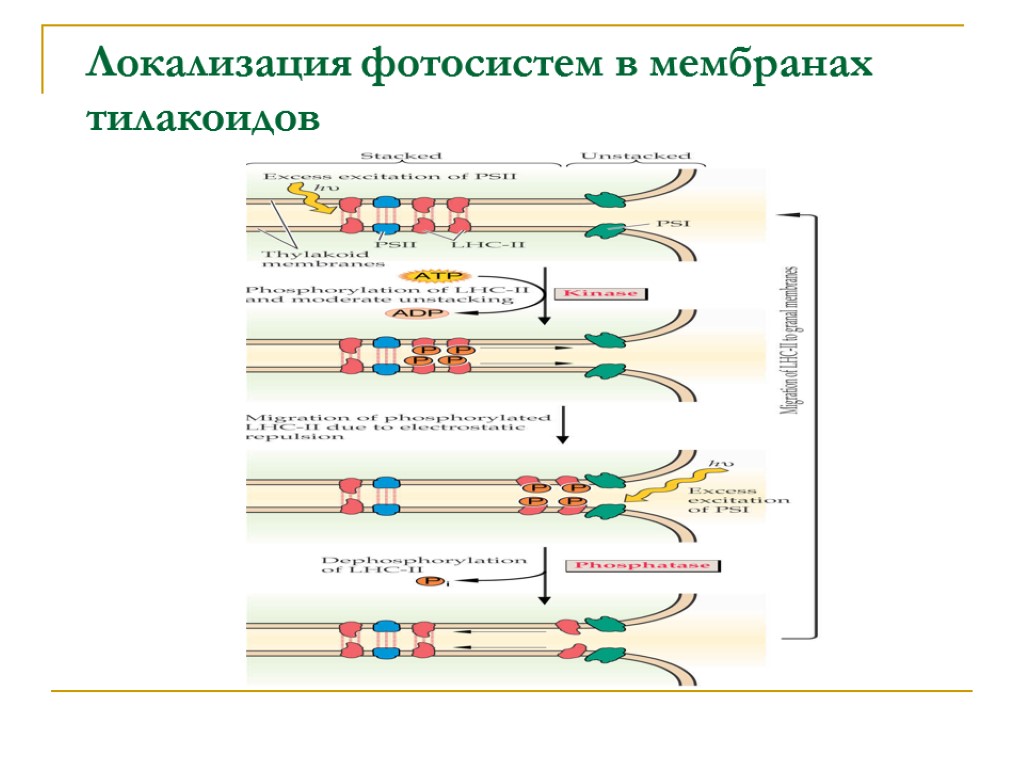
 2) Трансмембранная и латеральная асимметрия. Трансмембранная асимметрия выражается в строгой ориентации белковых комплексов, что создает структурную основу направленного фотоиндуцированного потока электронов и сопряженного транспорта протонов. Липиды наружного слоя обогащены фосфатидилглицеролом, а внутренний слой содержит больше моногалактозилдиглицерида и сульфолипида. Латеральная асимметрия проявляется в распределении белковых комплексов между стромальными и гранальными тилакоидами. Различие поверхностных потенциалов комплексов ФС1 (больший) и ФС2 (меньший) вызывает их сегрегацию. При формировании гран ФС1 вытесняются из области межмембранных контактов под действием электростатического отталкивания.
2) Трансмембранная и латеральная асимметрия. Трансмембранная асимметрия выражается в строгой ориентации белковых комплексов, что создает структурную основу направленного фотоиндуцированного потока электронов и сопряженного транспорта протонов. Липиды наружного слоя обогащены фосфатидилглицеролом, а внутренний слой содержит больше моногалактозилдиглицерида и сульфолипида. Латеральная асимметрия проявляется в распределении белковых комплексов между стромальными и гранальными тилакоидами. Различие поверхностных потенциалов комплексов ФС1 (больший) и ФС2 (меньший) вызывает их сегрегацию. При формировании гран ФС1 вытесняются из области межмембранных контактов под действием электростатического отталкивания.
 Асимметрия мембран
Асимметрия мембран
 Химическая организация мембран хлоропластов Липиды и белки – основные компоненты мембран хлоропластов
Химическая организация мембран хлоропластов Липиды и белки – основные компоненты мембран хлоропластов
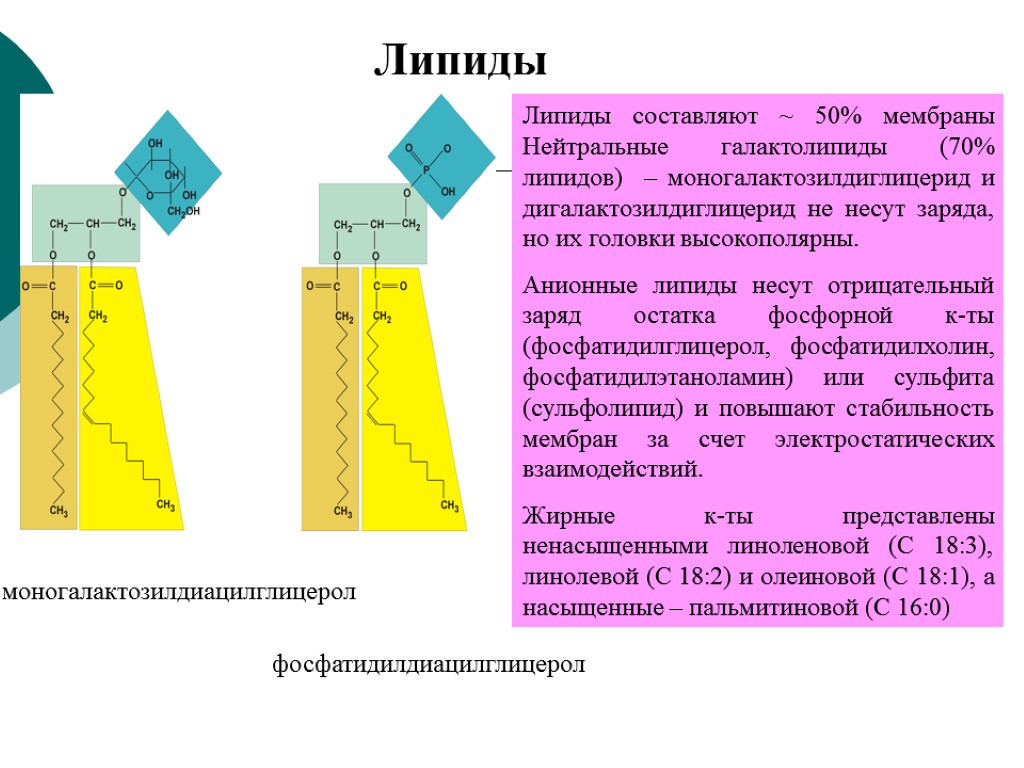
 Липиды моногалактозилдиацилглицерол фосфатидилдиацилглицерол Липиды составляют ~ 50% мембраны Нейтральные галактолипиды (70% липидов) – моногалактозилдиглицерид и дигалактозилдиглицерид не несут заряда, но их головки высокополярны. Анионные липиды несут отрицательный заряд остатка фосфорной к-ты (фосфатидилглицерол, фосфатидилхолин, фосфатидилэтаноламин) или сульфита (сульфолипид) и повышают стабильность мембран за счет электростатических взаимодействий. Жирные к-ты представлены ненасыщенными линоленовой (С 18:3), линолевой (С 18:2) и олеиновой (С 18:1), а насыщенные – пальмитиновой (С 16:0)
Липиды моногалактозилдиацилглицерол фосфатидилдиацилглицерол Липиды составляют ~ 50% мембраны Нейтральные галактолипиды (70% липидов) – моногалактозилдиглицерид и дигалактозилдиглицерид не несут заряда, но их головки высокополярны. Анионные липиды несут отрицательный заряд остатка фосфорной к-ты (фосфатидилглицерол, фосфатидилхолин, фосфатидилэтаноламин) или сульфита (сульфолипид) и повышают стабильность мембран за счет электростатических взаимодействий. Жирные к-ты представлены ненасыщенными линоленовой (С 18:3), линолевой (С 18:2) и олеиновой (С 18:1), а насыщенные – пальмитиновой (С 16:0)
 Роль липидов в фотосинтезе Липопротеиновые мембраны как структурная основа энергетических процессов возникли на самых ранних этапах эволюции. Основные липидные компоненты мембран – фосфолипиды образовались в пребиотических условиях. Формирование липидных комплексов обусловило возможность включения в них различных соединений с первичными каталитическими функциями. Ограничение липидной мембраной определенных участков с набором ферментов позволило скооперировать отдельные группы каталитических систем, что легло в основу первичных клеточных образований. Липиды поддерживают механическую стабильность мембраны и придают ей гидрофобные свойства. Благодаря липидам обеспечиваются подвижность и динамические свойства мембран, возможность молекулярного взаимодействия отдельных функциональных комплексов. Ненасыщенные кислоты необходимы для ассоциации ССК II с ФС2. Специфическая связь гликолипидов с интегральными белками обеспечивает их стабильность и необходимую конформацию в мембране. Конусовидная форма молекул моногалактозилдиглицерида может стабилизировать участки мембран с большой кривизной.
Роль липидов в фотосинтезе Липопротеиновые мембраны как структурная основа энергетических процессов возникли на самых ранних этапах эволюции. Основные липидные компоненты мембран – фосфолипиды образовались в пребиотических условиях. Формирование липидных комплексов обусловило возможность включения в них различных соединений с первичными каталитическими функциями. Ограничение липидной мембраной определенных участков с набором ферментов позволило скооперировать отдельные группы каталитических систем, что легло в основу первичных клеточных образований. Липиды поддерживают механическую стабильность мембраны и придают ей гидрофобные свойства. Благодаря липидам обеспечиваются подвижность и динамические свойства мембран, возможность молекулярного взаимодействия отдельных функциональных комплексов. Ненасыщенные кислоты необходимы для ассоциации ССК II с ФС2. Специфическая связь гликолипидов с интегральными белками обеспечивает их стабильность и необходимую конформацию в мембране. Конусовидная форма молекул моногалактозилдиглицерида может стабилизировать участки мембран с большой кривизной.
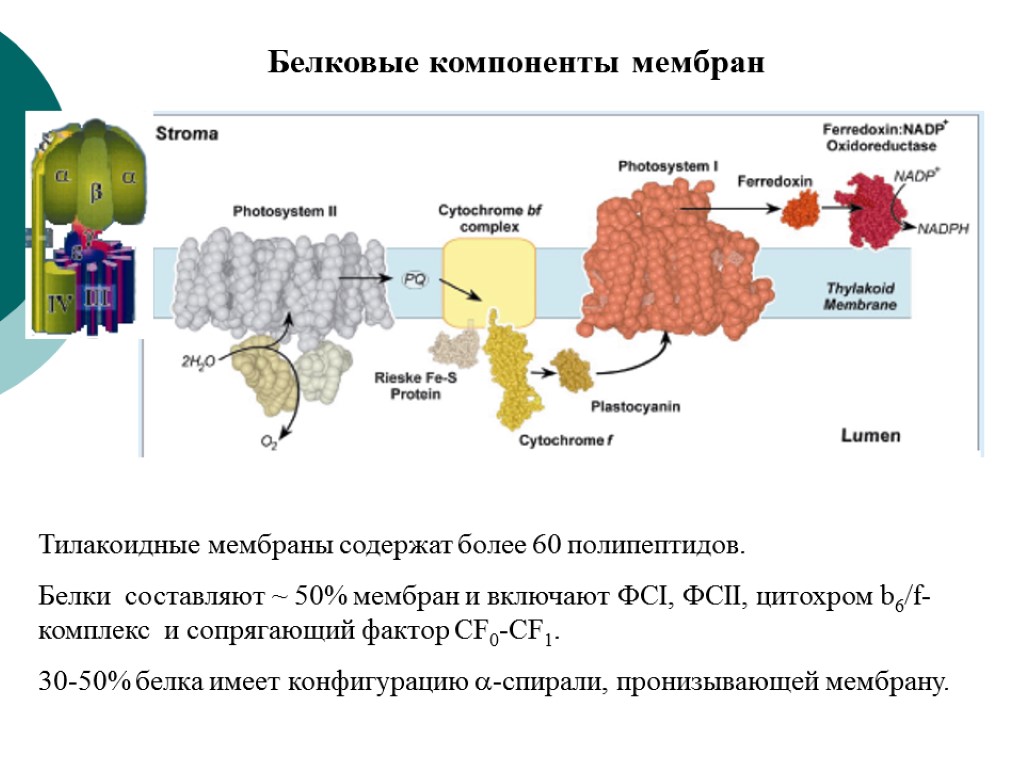
 Тилакоидные мембраны содержат более 60 полипептидов. Белки составляют ~ 50% мембран и включают ФСI, ФСII, цитохром b6/f-комплекс и сопрягающий фактор CF0-CF1. 30-50% белка имеет конфигурацию -спирали, пронизывающей мембрану. Белковые компоненты мембран
Тилакоидные мембраны содержат более 60 полипептидов. Белки составляют ~ 50% мембран и включают ФСI, ФСII, цитохром b6/f-комплекс и сопрягающий фактор CF0-CF1. 30-50% белка имеет конфигурацию -спирали, пронизывающей мембрану. Белковые компоненты мембран


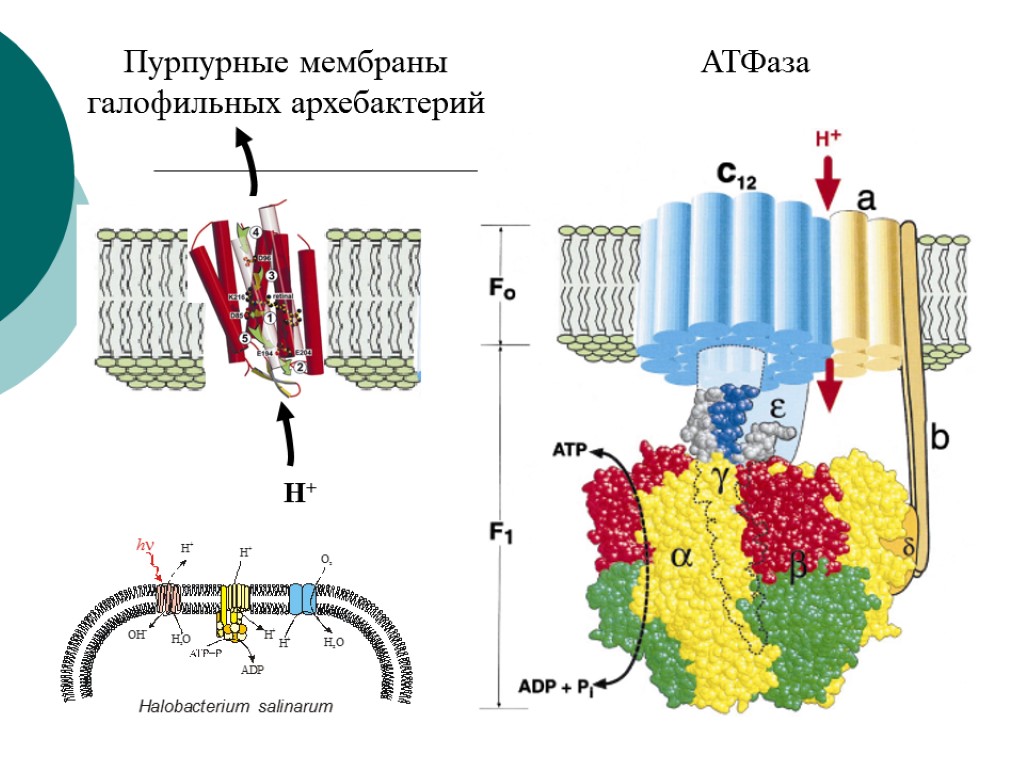
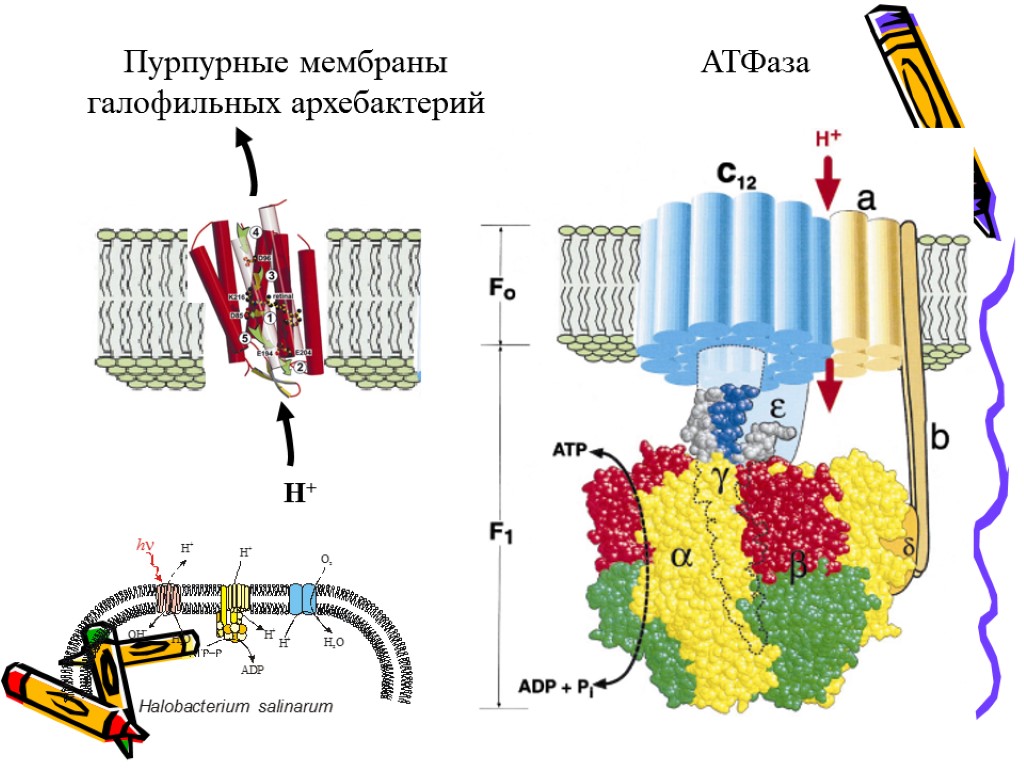
 Пурпурные мембраны галофильных архебактерий АТФаза
Пурпурные мембраны галофильных архебактерий АТФаза
 Пигментные системы фотосинтеза
Пигментные системы фотосинтеза
 Фотосинтетические пигменты - фотосенсибилизаторы В мембранах хлоропластов высших растений – 2 группы фотосинтетических пигментов: Хлорофиллы Каротиноиды В фотосинтетических мембранах низших растений и цианобактерий – 3 группы фотосинтетических пигментов: Хлорофиллы Каротиноиды Фикобилипротеины
Фотосинтетические пигменты - фотосенсибилизаторы В мембранах хлоропластов высших растений – 2 группы фотосинтетических пигментов: Хлорофиллы Каротиноиды В фотосинтетических мембранах низших растений и цианобактерий – 3 группы фотосинтетических пигментов: Хлорофиллы Каротиноиды Фикобилипротеины
 Хлорофиллы Важнейшие фотосенсибилизаторы - молекулы чувствительные к свету, поглощающие свет, возбуждающиеся под действием света В мембранах тилакоидов – в виде липопротеидных комплексов Функции: 1) поглощение света; 2) передача энергии возбуждения с одних молекул на другие; 3) первичное разделение зарядов на мембране
Хлорофиллы Важнейшие фотосенсибилизаторы - молекулы чувствительные к свету, поглощающие свет, возбуждающиеся под действием света В мембранах тилакоидов – в виде липопротеидных комплексов Функции: 1) поглощение света; 2) передача энергии возбуждения с одних молекул на другие; 3) первичное разделение зарядов на мембране
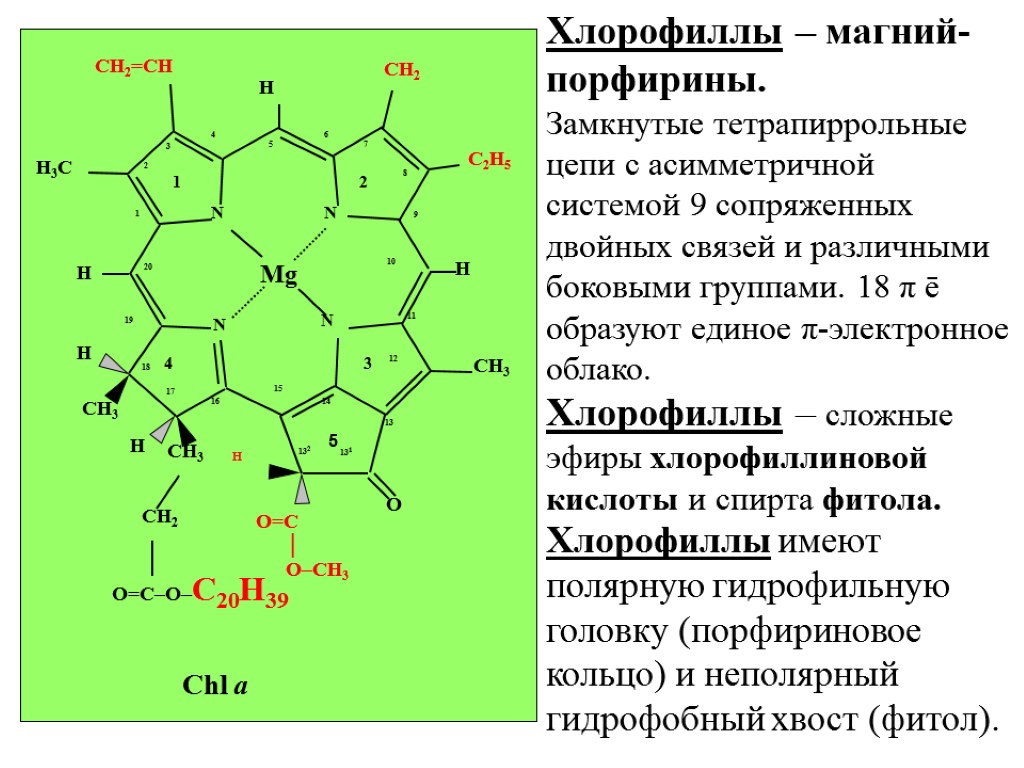
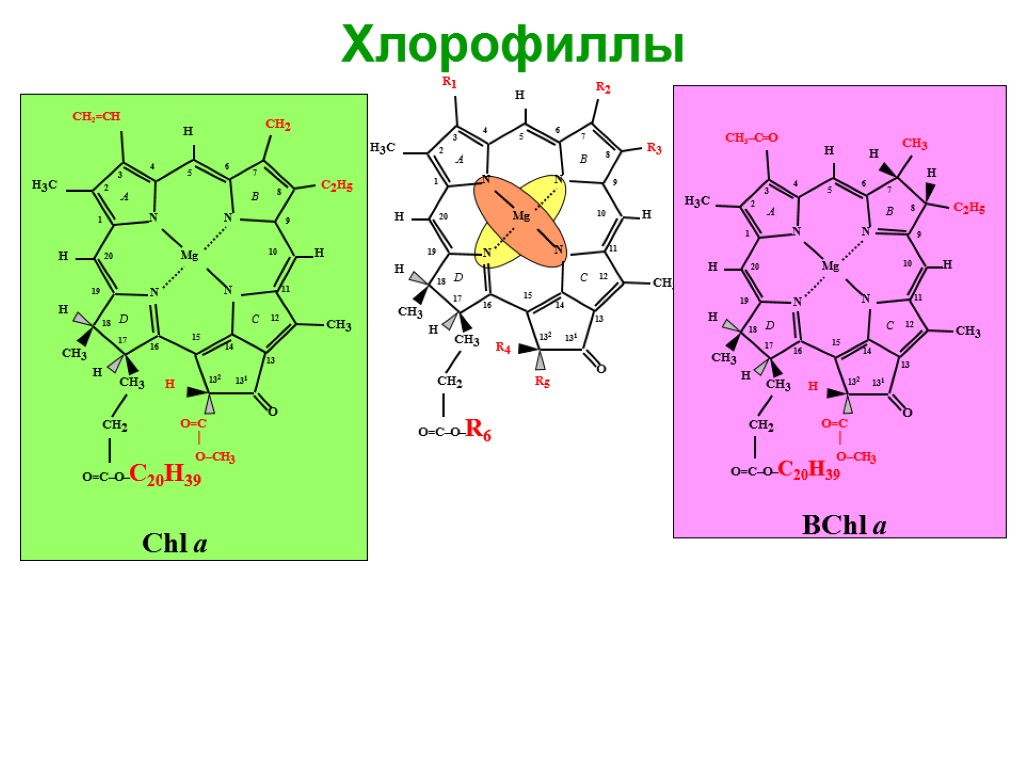
 Хлорофиллы – магний-порфирины. Замкнутые тетрапиррольные цепи с асимметричной системой 9 сопряженных двойных связей и различными боковыми группами. 18 π ē образуют единое π-электронное облако. Хлорофиллы – сложные эфиры хлорофиллиновой кислоты и спирта фитола. Хлорофиллы имеют полярную гидрофильную головку (порфириновое кольцо) и неполярный гидрофобный хвост (фитол). 5
Хлорофиллы – магний-порфирины. Замкнутые тетрапиррольные цепи с асимметричной системой 9 сопряженных двойных связей и различными боковыми группами. 18 π ē образуют единое π-электронное облако. Хлорофиллы – сложные эфиры хлорофиллиновой кислоты и спирта фитола. Хлорофиллы имеют полярную гидрофильную головку (порфириновое кольцо) и неполярный гидрофобный хвост (фитол). 5
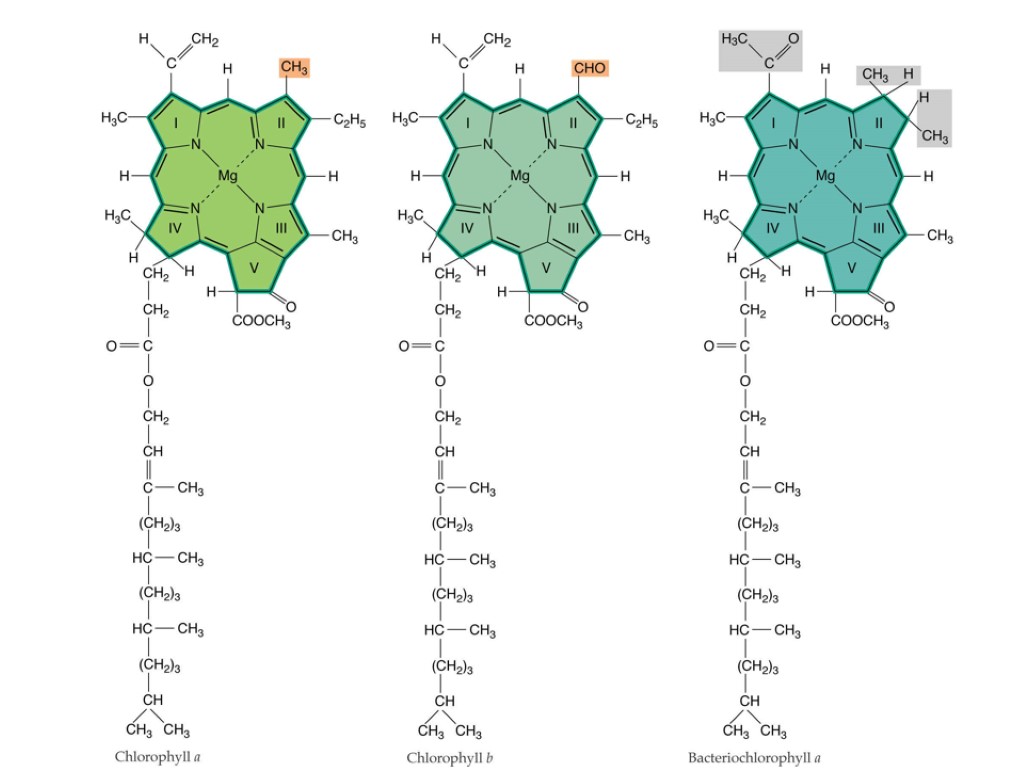
 Хлорофиллы
Хлорофиллы

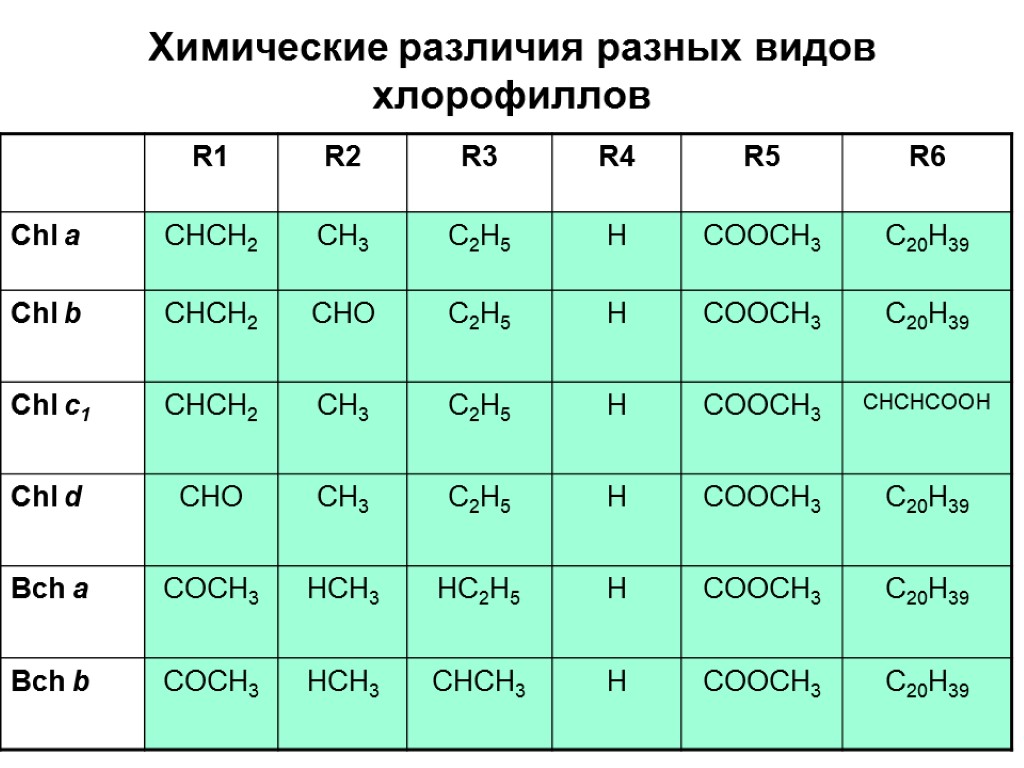
 Химические различия разных видов хлорофиллов
Химические различия разных видов хлорофиллов
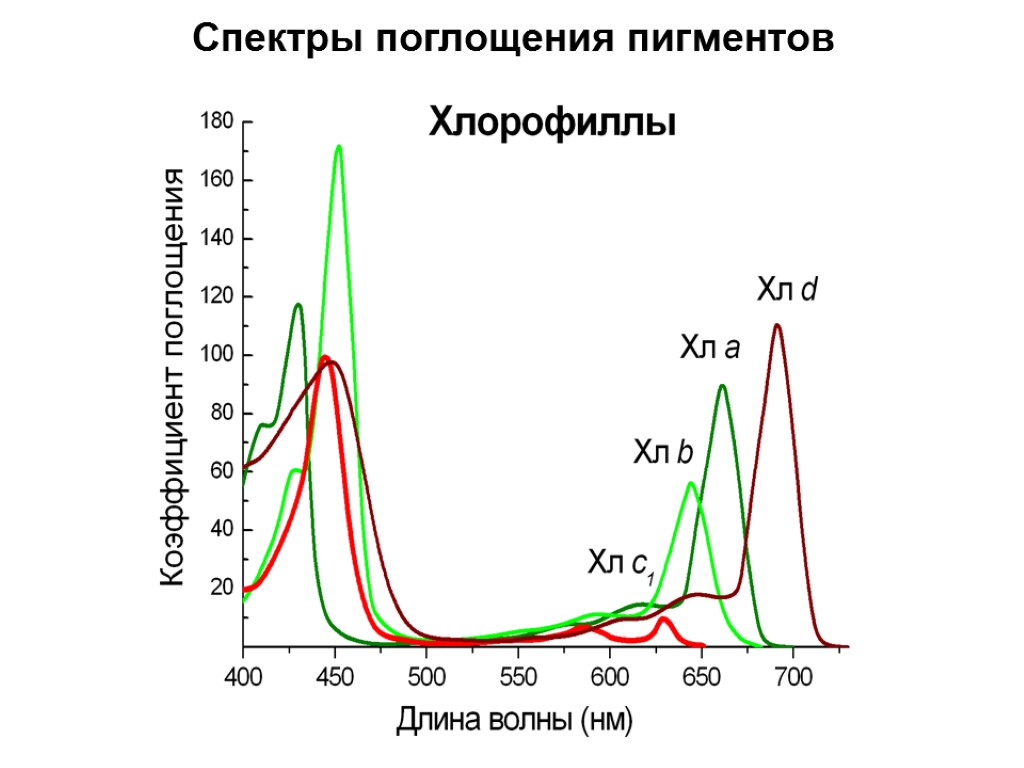
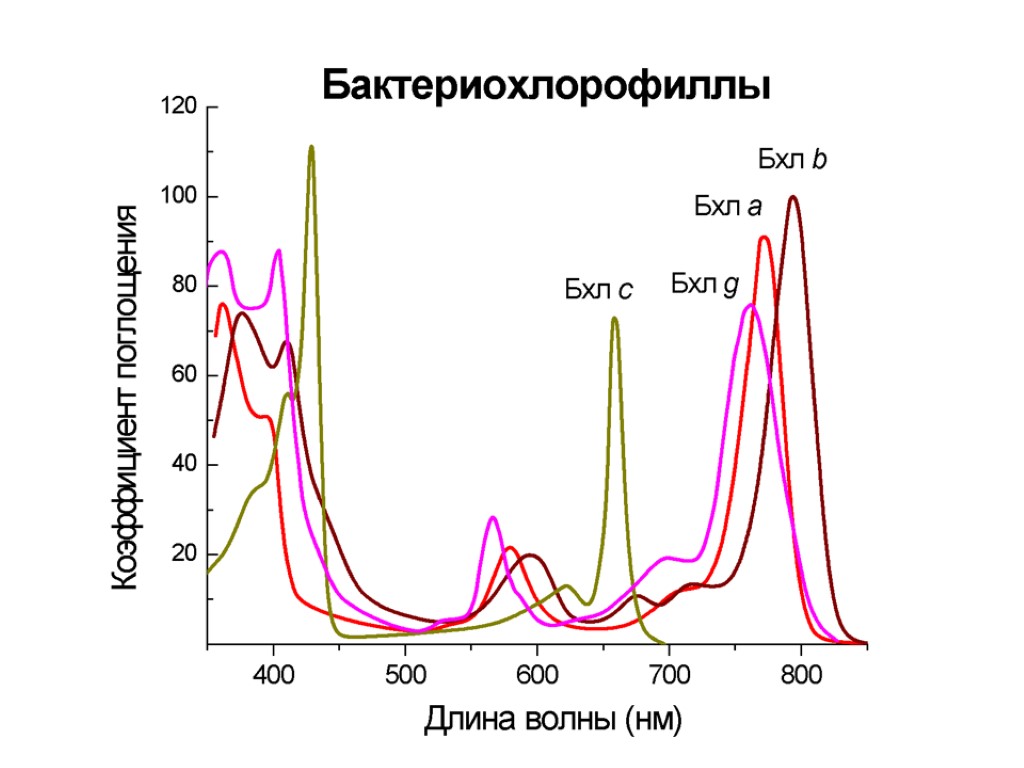
 Спектры поглощения пигментов
Спектры поглощения пигментов

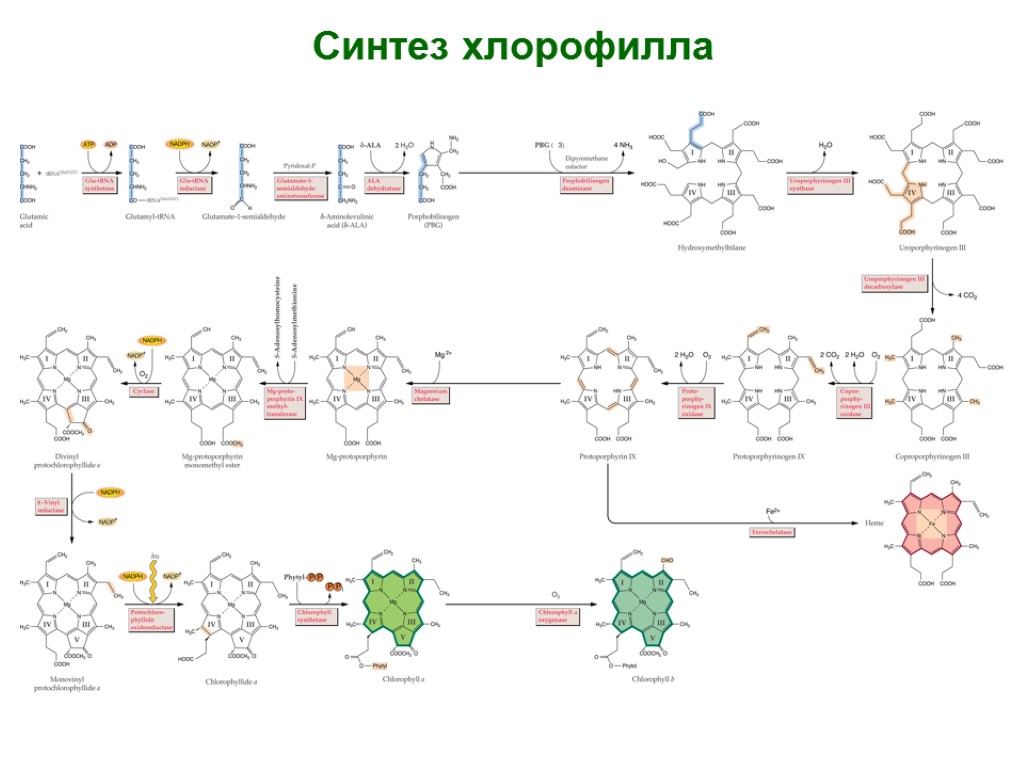
 Синтез хлорофилла
Синтез хлорофилла
 Каротиноиды – добавочные фотосинтетические пигменты Пигменты желтого, оранжевого и красного цвета. Встречаются у всех фотосинтезирующих организмов. По химической природе – дитерпены. Полиизопреноидная цепочка замыкается в β-иононовые кольца. 9 сопряженных двойных связей в центральной части молекулы. Существуют цис- (изогнутая) и транс- (линейная) конфигурация. Большая часть каротиноидов в ССК – транс-изомеры. Липофильные соединения. Локализованы в липидной фазе мембран тилакоидов. 2 группы каротиноидов: Каротины – не содержат кислорода (С40Н56) Ксантофиллы – содержат атомы кислорода.
Каротиноиды – добавочные фотосинтетические пигменты Пигменты желтого, оранжевого и красного цвета. Встречаются у всех фотосинтезирующих организмов. По химической природе – дитерпены. Полиизопреноидная цепочка замыкается в β-иононовые кольца. 9 сопряженных двойных связей в центральной части молекулы. Существуют цис- (изогнутая) и транс- (линейная) конфигурация. Большая часть каротиноидов в ССК – транс-изомеры. Липофильные соединения. Локализованы в липидной фазе мембран тилакоидов. 2 группы каротиноидов: Каротины – не содержат кислорода (С40Н56) Ксантофиллы – содержат атомы кислорода.
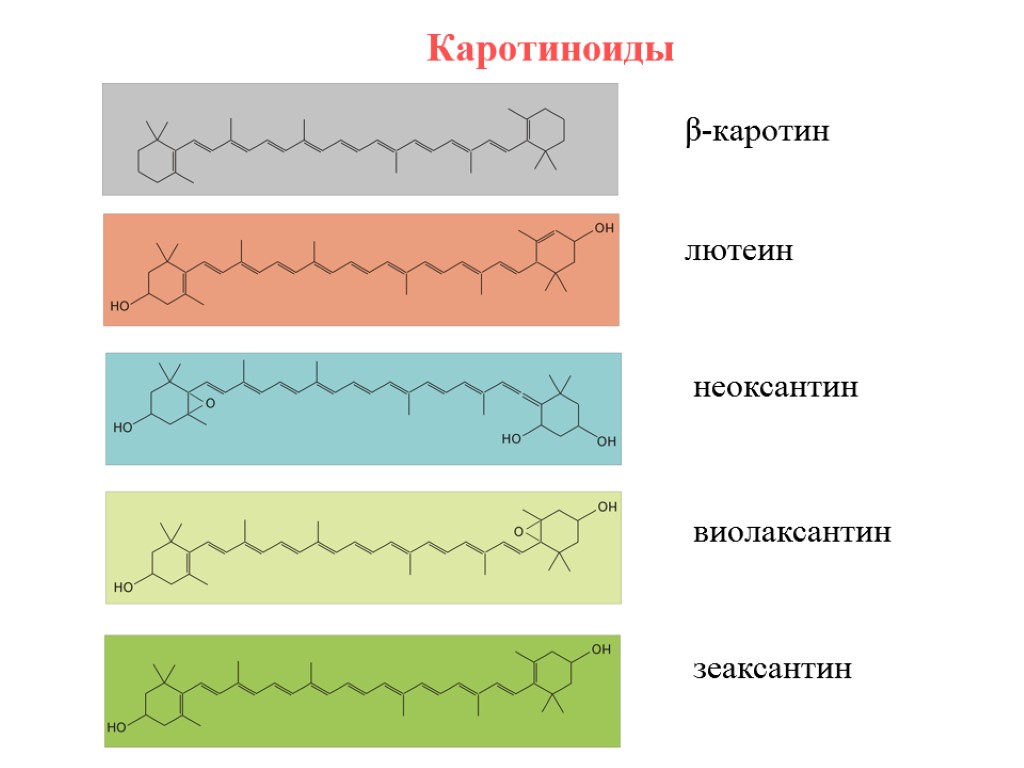
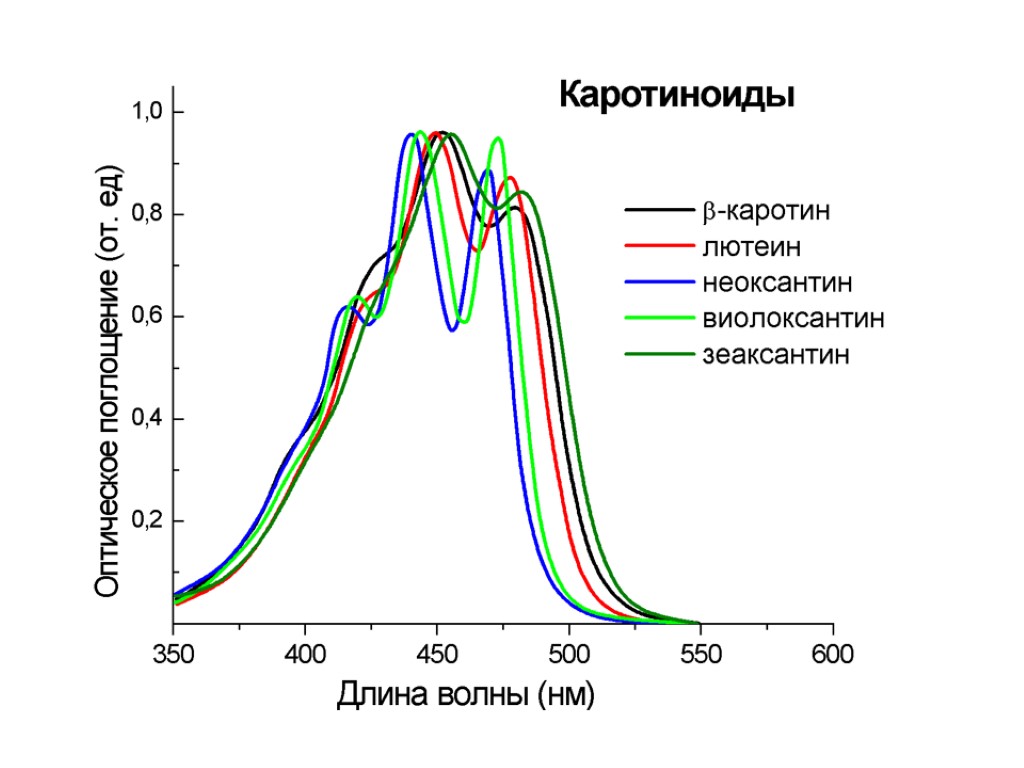
 Каротиноиды неоксантин лютеин β-каротин виолаксантин зеаксантин
Каротиноиды неоксантин лютеин β-каротин виолаксантин зеаксантин

 Функции каротиноидов Компоненты ССК (антенная функция) - поглощение света в синей части спектра Передача энергии возбужденного состояния на хлорофиллы 1Car + hν 1Car* 1Car* + 1Хл 1Car + 1Хл* 3) Образование и удаление синглетного кислорода 1Хл + hν 1Хл* 1О2* + 1Car 3О2 + 3Car* 1Хл* 3Хл* 3Car* 1Car + тепло 3Хл* + 3О2 1Хл + 1О2* 4) Тушение триплетного хлорофилла 3Хл* + 1Car 1Хл + 3Car* 3Car* 1Car + тепло 5) Фотопротекторная функция – ксантофилльный (виолоксантиновый) цикл – регуляция светового потока. деэпоксидаза Виолоксантин Антераксантин Зеаксантин эпоксидаза (+О2+ НАДФН)
Функции каротиноидов Компоненты ССК (антенная функция) - поглощение света в синей части спектра Передача энергии возбужденного состояния на хлорофиллы 1Car + hν 1Car* 1Car* + 1Хл 1Car + 1Хл* 3) Образование и удаление синглетного кислорода 1Хл + hν 1Хл* 1О2* + 1Car 3О2 + 3Car* 1Хл* 3Хл* 3Car* 1Car + тепло 3Хл* + 3О2 1Хл + 1О2* 4) Тушение триплетного хлорофилла 3Хл* + 1Car 1Хл + 3Car* 3Car* 1Car + тепло 5) Фотопротекторная функция – ксантофилльный (виолоксантиновый) цикл – регуляция светового потока. деэпоксидаза Виолоксантин Антераксантин Зеаксантин эпоксидаза (+О2+ НАДФН)
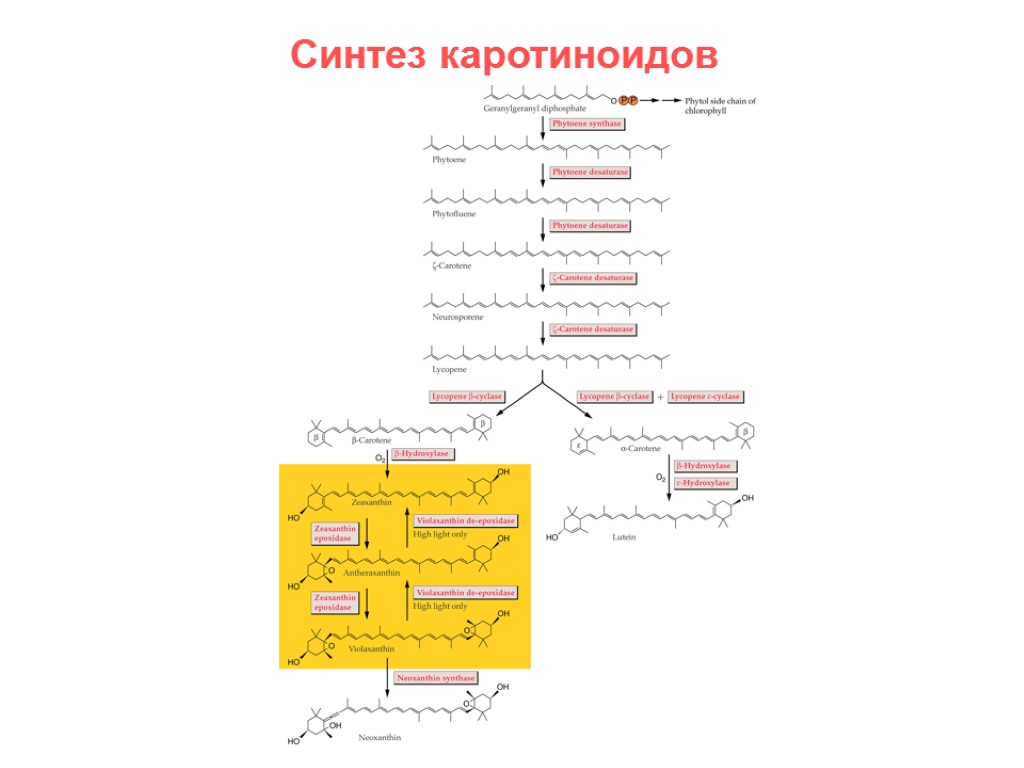
 Синтез каротиноидов
Синтез каротиноидов
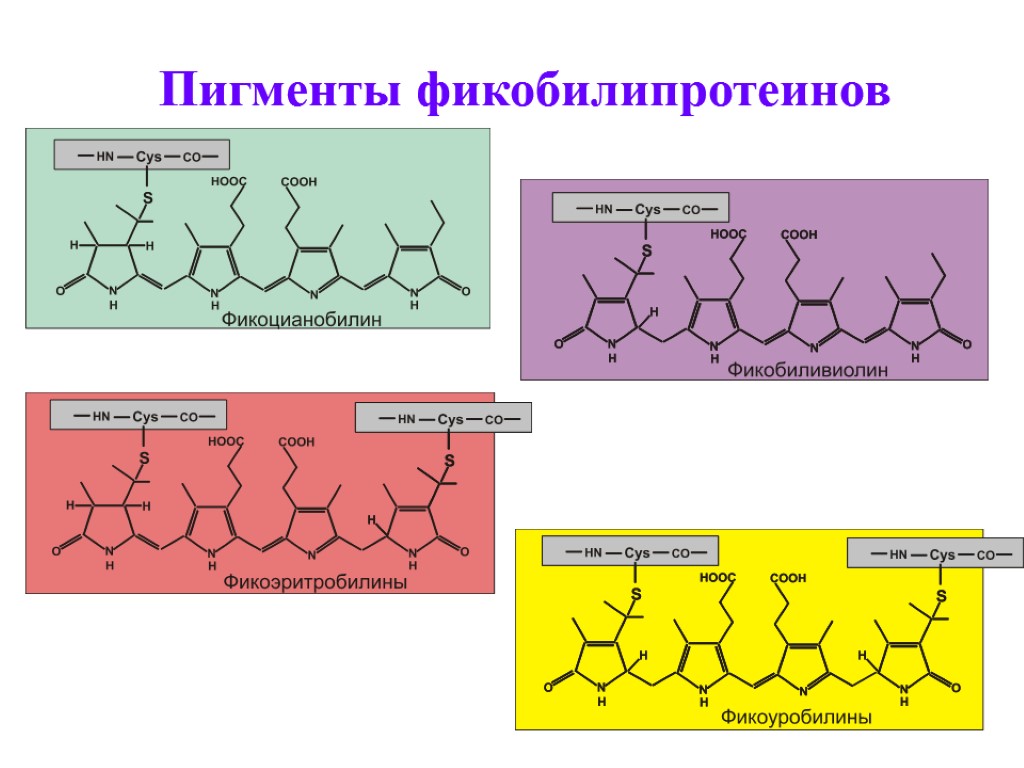
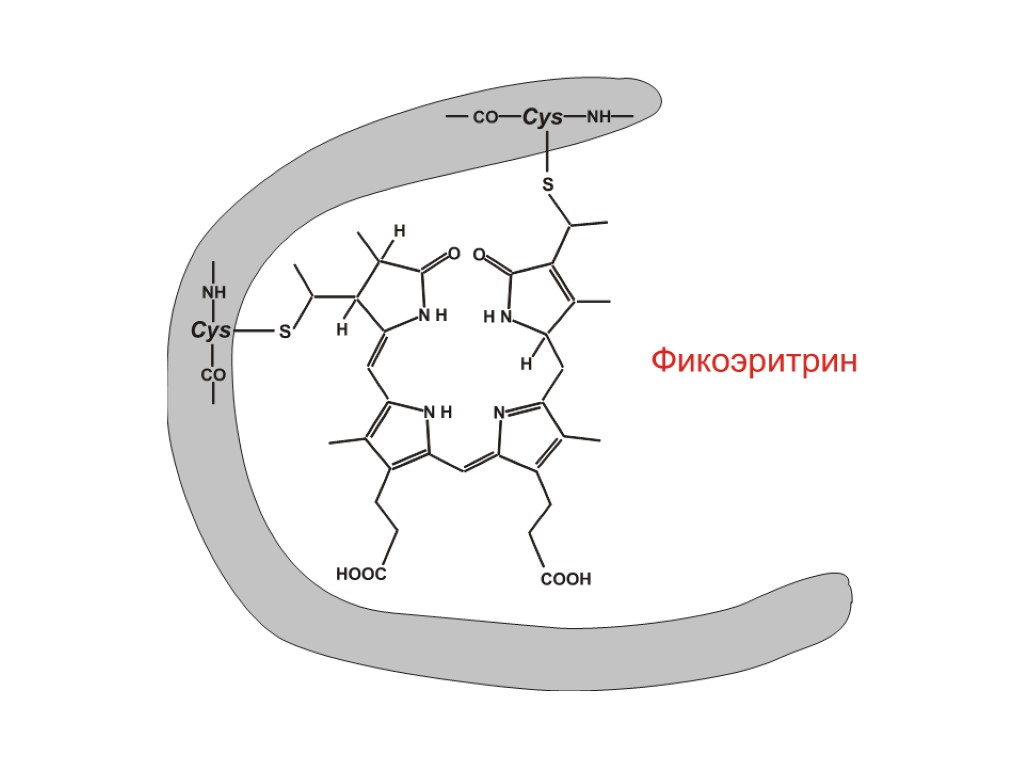
 Фикобилипротеины – добавочные пигменты цианобактерий и красных водорослей Пигменты красного и синего цвета. По химической природе – хромопротеины, хромофорная группа которых – фикобилины (тетрапирролы с открытой цепью). Связь хромофора с белком – ковалентная. Пиррольные кольца соединены метиновыми и метиленовыми мостиками. Имеют 2 остатка пропионовой кислоты, метильные, этильные и винильные радикалы.
Фикобилипротеины – добавочные пигменты цианобактерий и красных водорослей Пигменты красного и синего цвета. По химической природе – хромопротеины, хромофорная группа которых – фикобилины (тетрапирролы с открытой цепью). Связь хромофора с белком – ковалентная. Пиррольные кольца соединены метиновыми и метиленовыми мостиками. Имеют 2 остатка пропионовой кислоты, метильные, этильные и винильные радикалы.
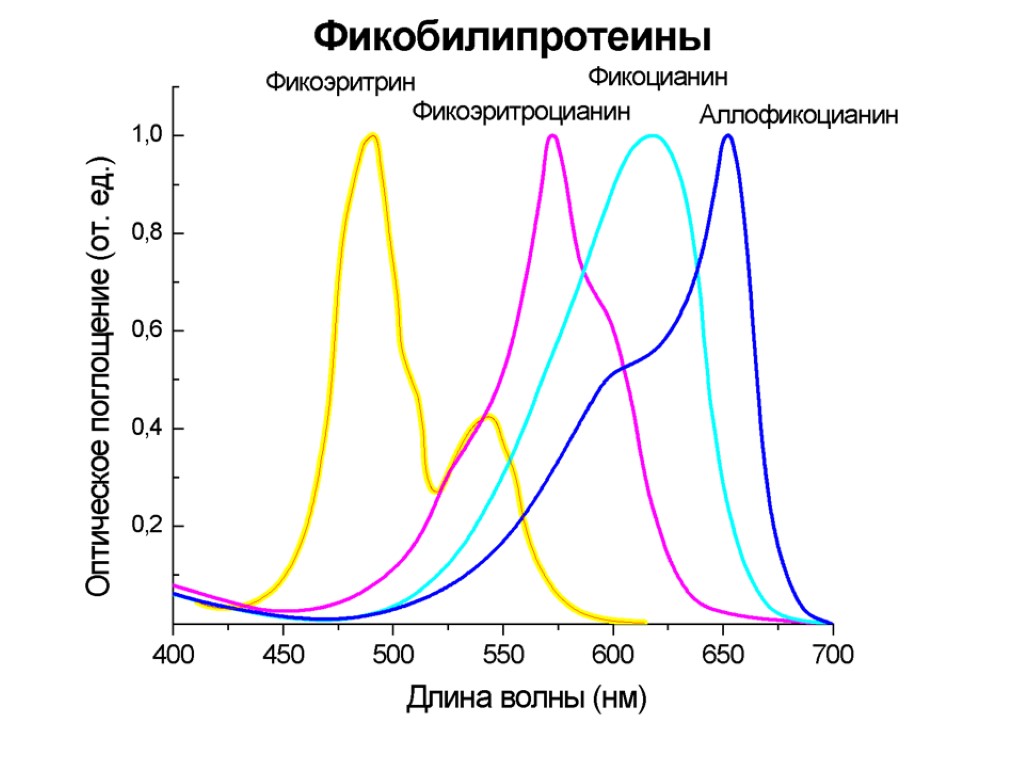
 Пигменты фикобилипротеинов
Пигменты фикобилипротеинов

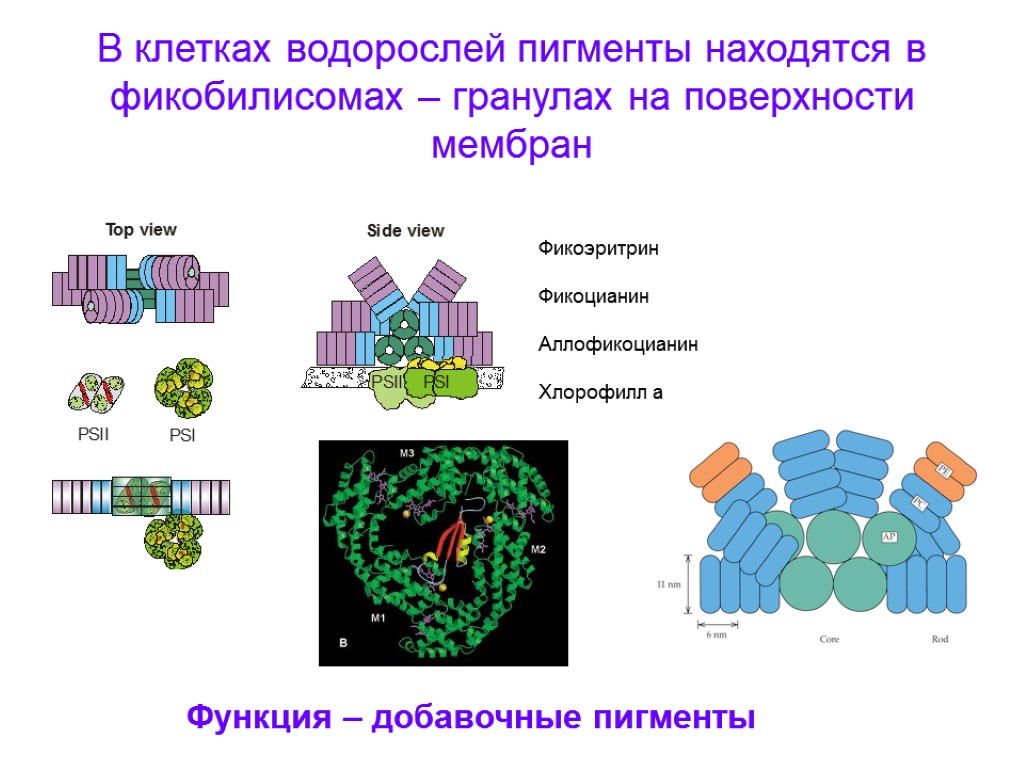
 В клетках водорослей пигменты находятся в фикобилисомах – гранулах на поверхности мембран Фикоэритрин Фикоцианин Аллофикоцианин Хлорофилл а Функция – добавочные пигменты
В клетках водорослей пигменты находятся в фикобилисомах – гранулах на поверхности мембран Фикоэритрин Фикоцианин Аллофикоцианин Хлорофилл а Функция – добавочные пигменты

 Пигментные системы Действуют кооперативно, образуя антенну, с которой энергия возбуждения переносится на реакционные центры. Между молекулами пигментов в реакционных центрах происходит первичное разделение зарядов.
Пигментные системы Действуют кооперативно, образуя антенну, с которой энергия возбуждения переносится на реакционные центры. Между молекулами пигментов в реакционных центрах происходит первичное разделение зарядов.
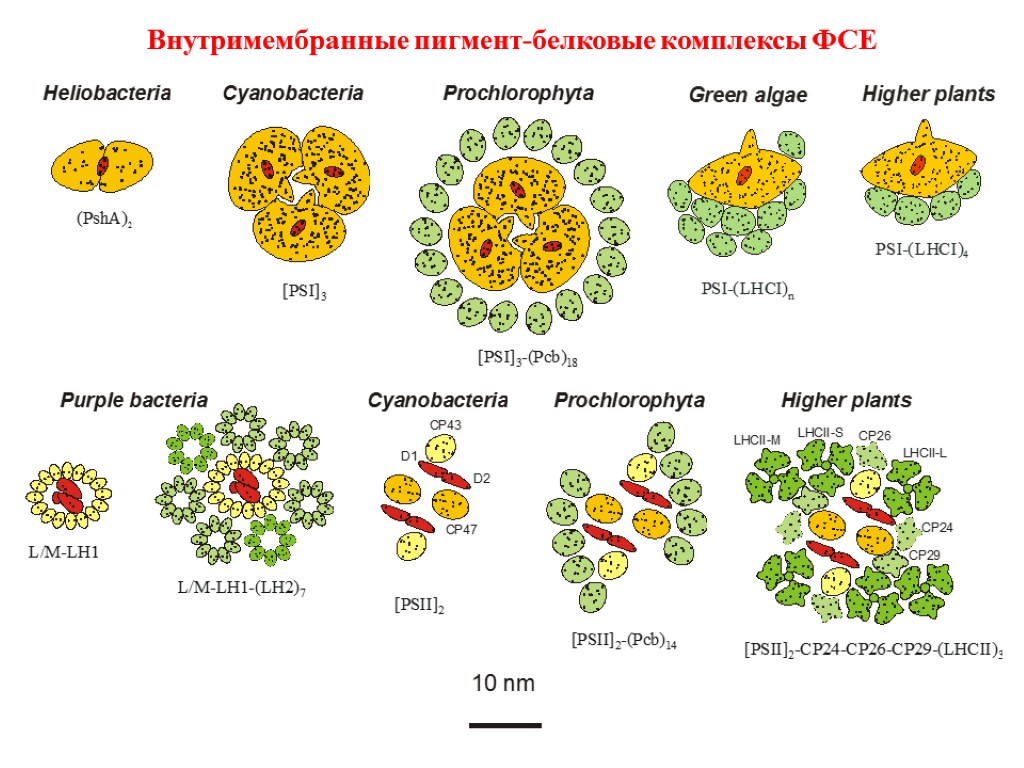
 Внутримембранные пигмент-белковые комплексы ФСЕ
Внутримембранные пигмент-белковые комплексы ФСЕ


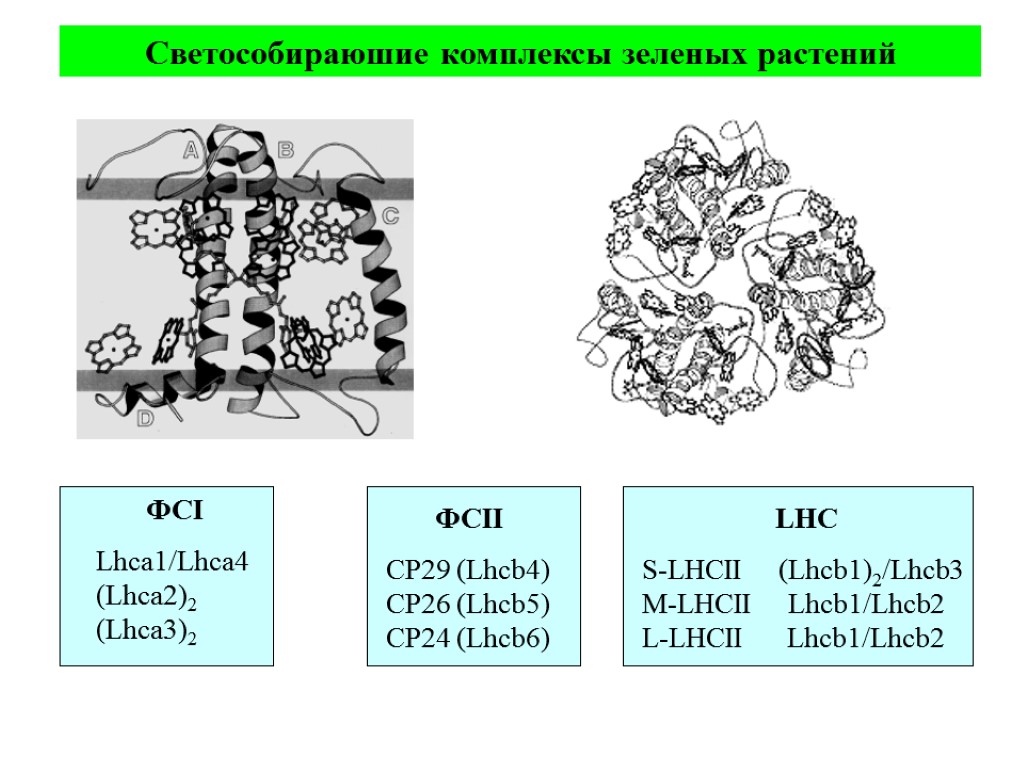
 ФСI Lhca1/Lhca4 (Lhca2)2 (Lhca3)2 ФСII CP29 (Lhcb4) CP26 (Lhcb5) CP24 (Lhcb6) LHC S-LHCII (Lhcb1)2/Lhcb3 M-LHCII Lhcb1/Lhcb2 L-LHCII Lhcb1/Lhcb2 Светособираюшие комплексы зеленых растений
ФСI Lhca1/Lhca4 (Lhca2)2 (Lhca3)2 ФСII CP29 (Lhcb4) CP26 (Lhcb5) CP24 (Lhcb6) LHC S-LHCII (Lhcb1)2/Lhcb3 M-LHCII Lhcb1/Lhcb2 L-LHCII Lhcb1/Lhcb2 Светособираюшие комплексы зеленых растений
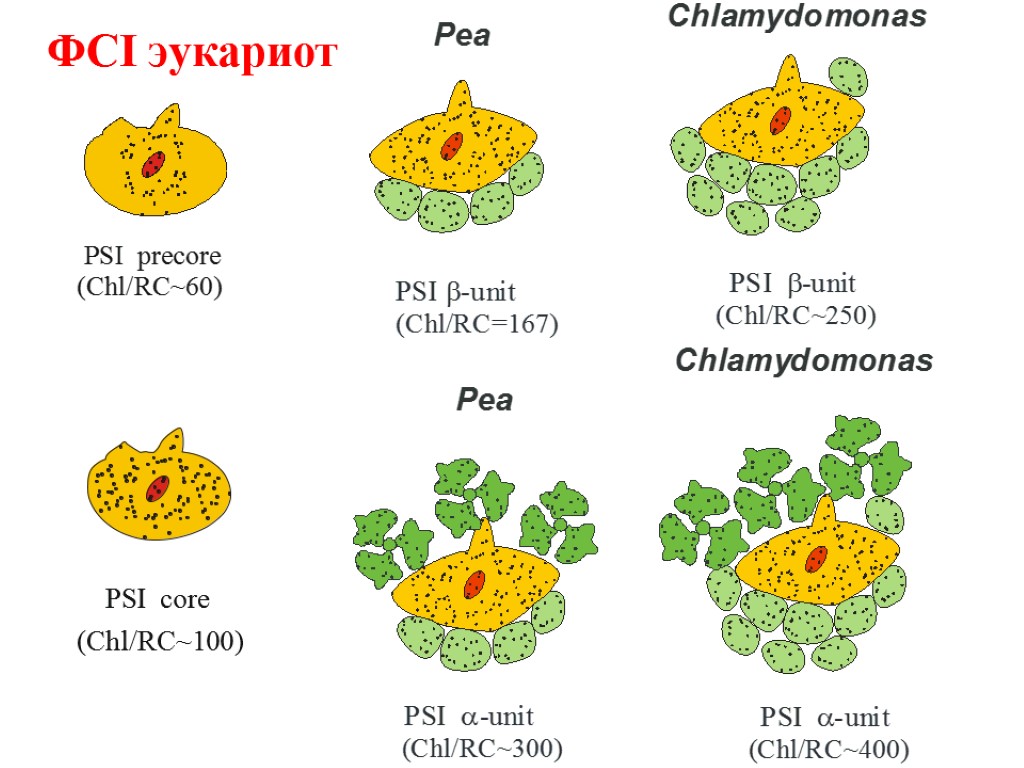
 ФСI эукариот
ФСI эукариот
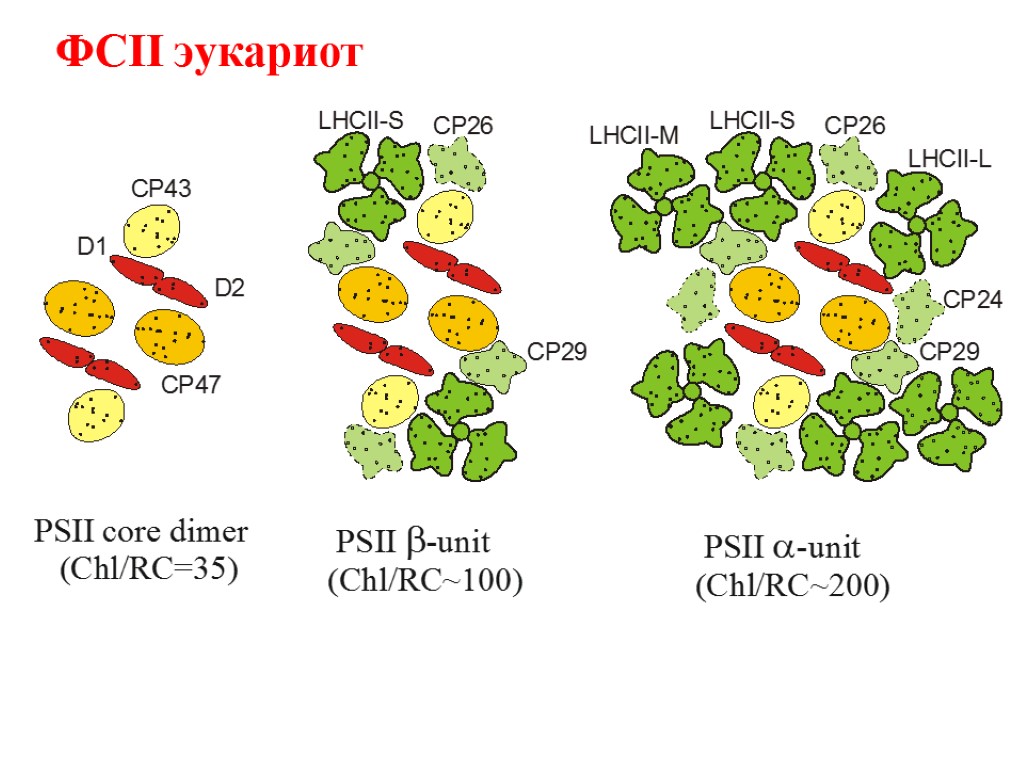
 ФСII эукариот
ФСII эукариот
 Структура и функционирование фотосистем. ЭТЦ хлоропластов
Структура и функционирование фотосистем. ЭТЦ хлоропластов
 Структурная основа первичных процессов фотосинтеза – фотосинтетическая единица (ФСЕ). ФСЕ = ССК+РЦ Идея ФСЕ – Х.Гаффрон, К.Воль (1936), Дюйзенс (1952) В ФСЕ пигменты функционально гетерогенны (В.Н. Любименко, 1930) и взаимодействуют между собой (Р.Эмерсон и В.Арнольд, 1943), что обеспечивает высокую эффективность поглощения и преобразования световой энергии в первичных процессах. Для ФСЕ характерна высокая структурно-функциональная упорядоченность.
Структурная основа первичных процессов фотосинтеза – фотосинтетическая единица (ФСЕ). ФСЕ = ССК+РЦ Идея ФСЕ – Х.Гаффрон, К.Воль (1936), Дюйзенс (1952) В ФСЕ пигменты функционально гетерогенны (В.Н. Любименко, 1930) и взаимодействуют между собой (Р.Эмерсон и В.Арнольд, 1943), что обеспечивает высокую эффективность поглощения и преобразования световой энергии в первичных процессах. Для ФСЕ характерна высокая структурно-функциональная упорядоченность.
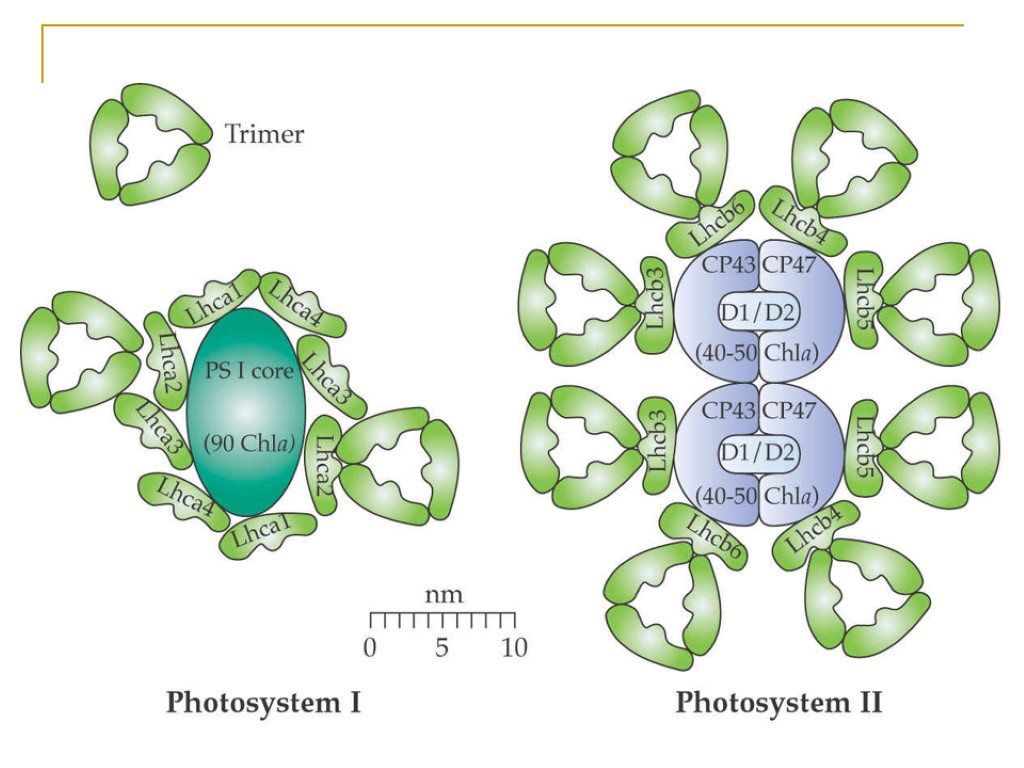
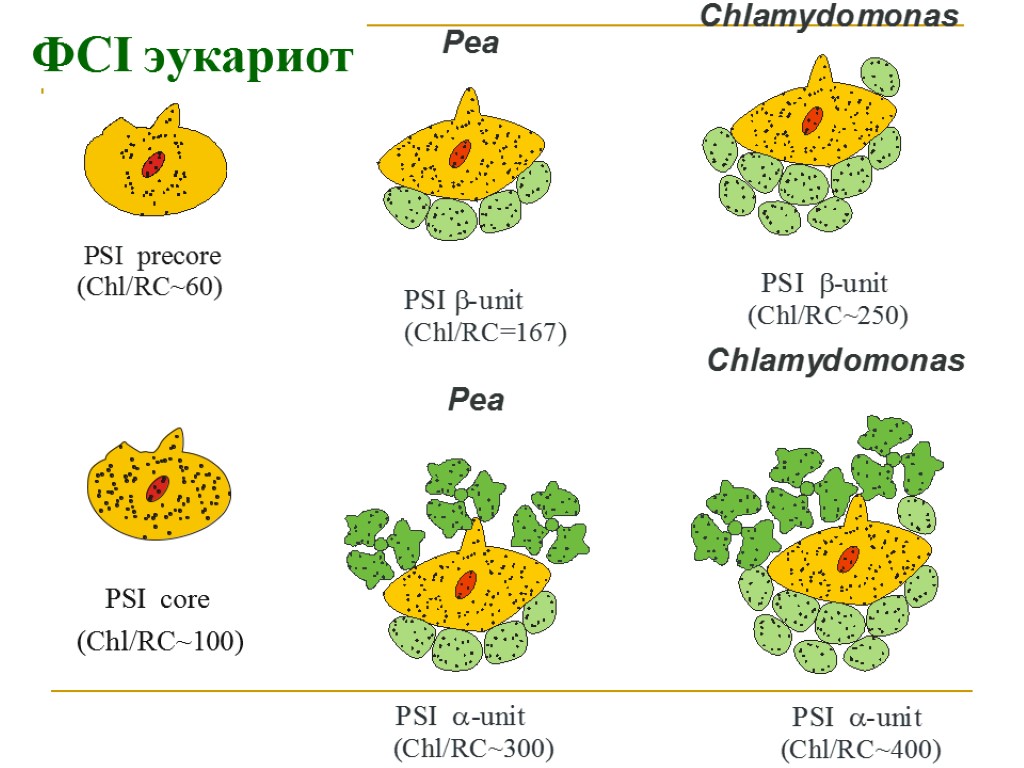
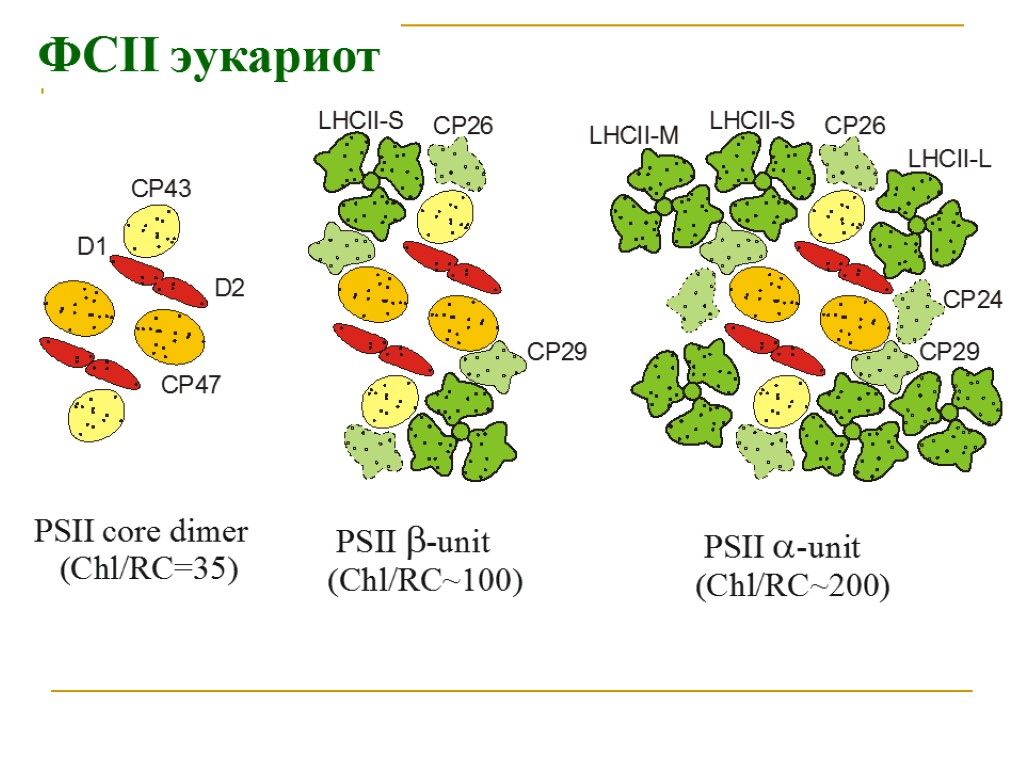
 Основные типы пигмент белковых комплексов высших растений: РЦ ФСI – ядро (core): димер П700, 2 β-каротина, ≈100 молекул хл «a» (внутренняя антенна) ССК I (LHC I): 80-120 молекул хл «а» и «b», каротиноиды Состоит из 4 типов субъединиц LHCa1, LHCa2, LHCa3, LHCa4, которые образуют комплексы Lhca1/Lhca4 (Lhca2)2 (Lhca3)2 РЦ ФСII – ядро (core): димер П680, хлорофилл «а»- содержащие белки CP43 и CP47 (внутренняя антенна), связанные с белками D1/D2, цитохром b 559 ССК II (LHC II): Хлорофиллы «а», «b», каротиноиды, S-LHCII (Lhcb1)2/Lhcb3 M-LHCII Lhcb1/Lhcb2 L-LHCII Lhcb1/Lhcb2 3 минорных типа ССК (расположены между РЦ и ССК II) – CP29 (LHCb4), CP26 (LHCb5), CP24 (LHCb6),
Основные типы пигмент белковых комплексов высших растений: РЦ ФСI – ядро (core): димер П700, 2 β-каротина, ≈100 молекул хл «a» (внутренняя антенна) ССК I (LHC I): 80-120 молекул хл «а» и «b», каротиноиды Состоит из 4 типов субъединиц LHCa1, LHCa2, LHCa3, LHCa4, которые образуют комплексы Lhca1/Lhca4 (Lhca2)2 (Lhca3)2 РЦ ФСII – ядро (core): димер П680, хлорофилл «а»- содержащие белки CP43 и CP47 (внутренняя антенна), связанные с белками D1/D2, цитохром b 559 ССК II (LHC II): Хлорофиллы «а», «b», каротиноиды, S-LHCII (Lhcb1)2/Lhcb3 M-LHCII Lhcb1/Lhcb2 L-LHCII Lhcb1/Lhcb2 3 минорных типа ССК (расположены между РЦ и ССК II) – CP29 (LHCb4), CP26 (LHCb5), CP24 (LHCb6),

 ФСI эукариот
ФСI эукариот
 ФСII эукариот
ФСII эукариот
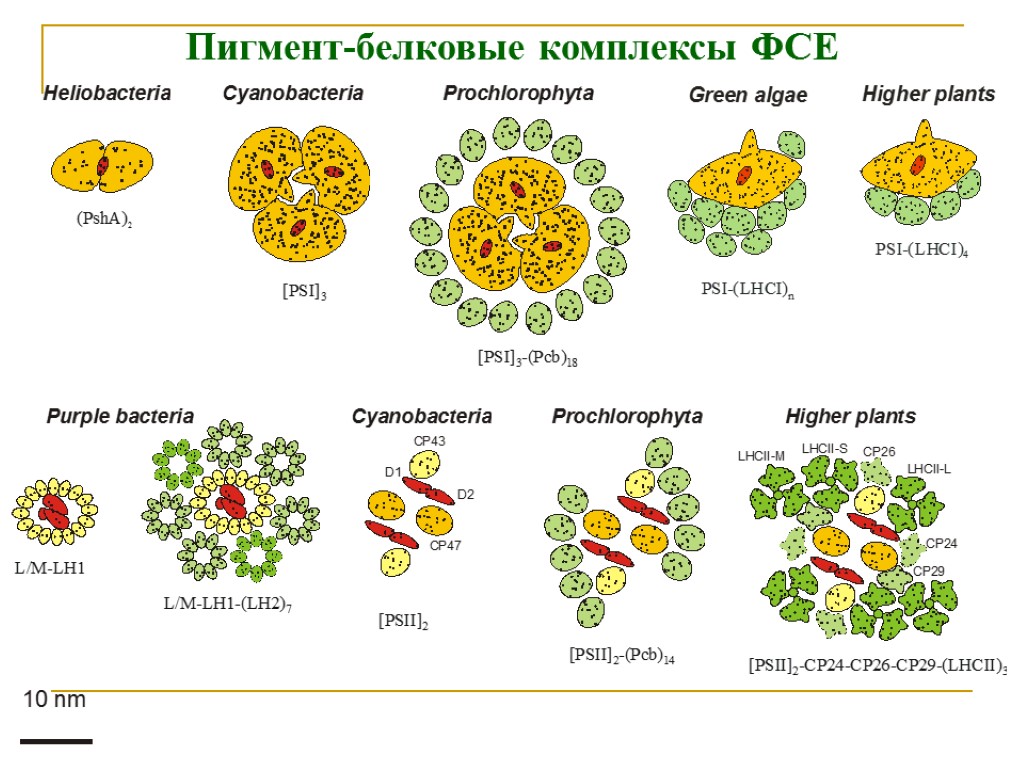
 Пигмент-белковые комплексы ФСЕ
Пигмент-белковые комплексы ФСЕ
 Локализация фотосистем в мембранах тилакоидов
Локализация фотосистем в мембранах тилакоидов
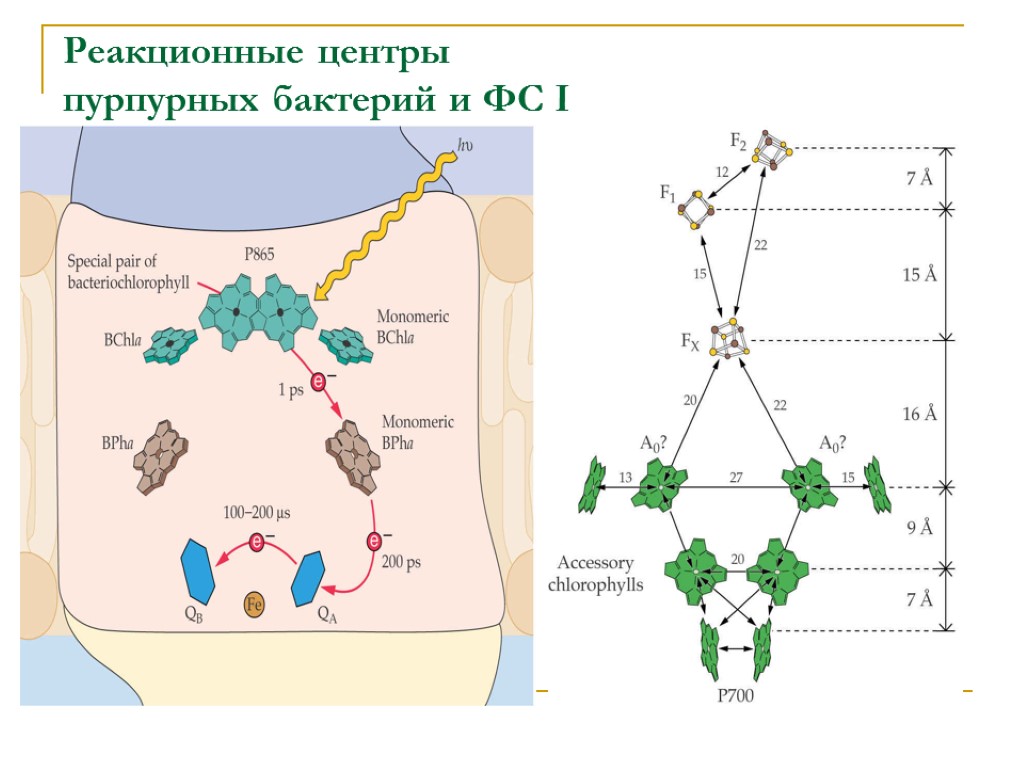
 Реакционные центры пурпурных бактерий и ФС I
Реакционные центры пурпурных бактерий и ФС I
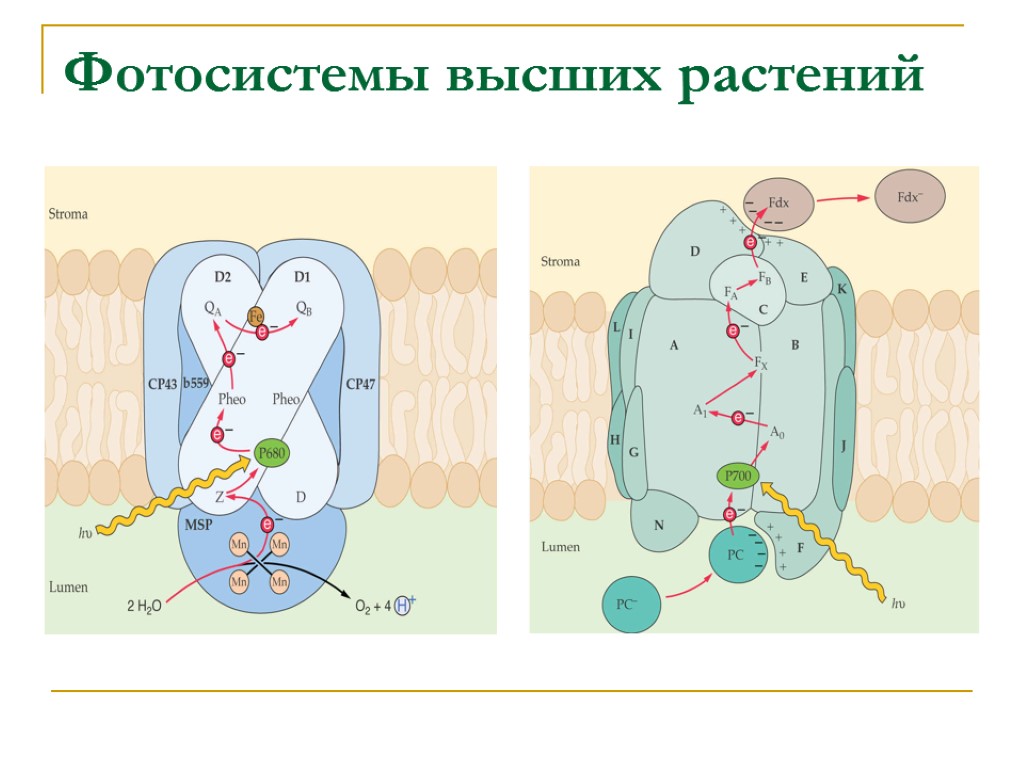
 Фотосистемы высших растений
Фотосистемы высших растений
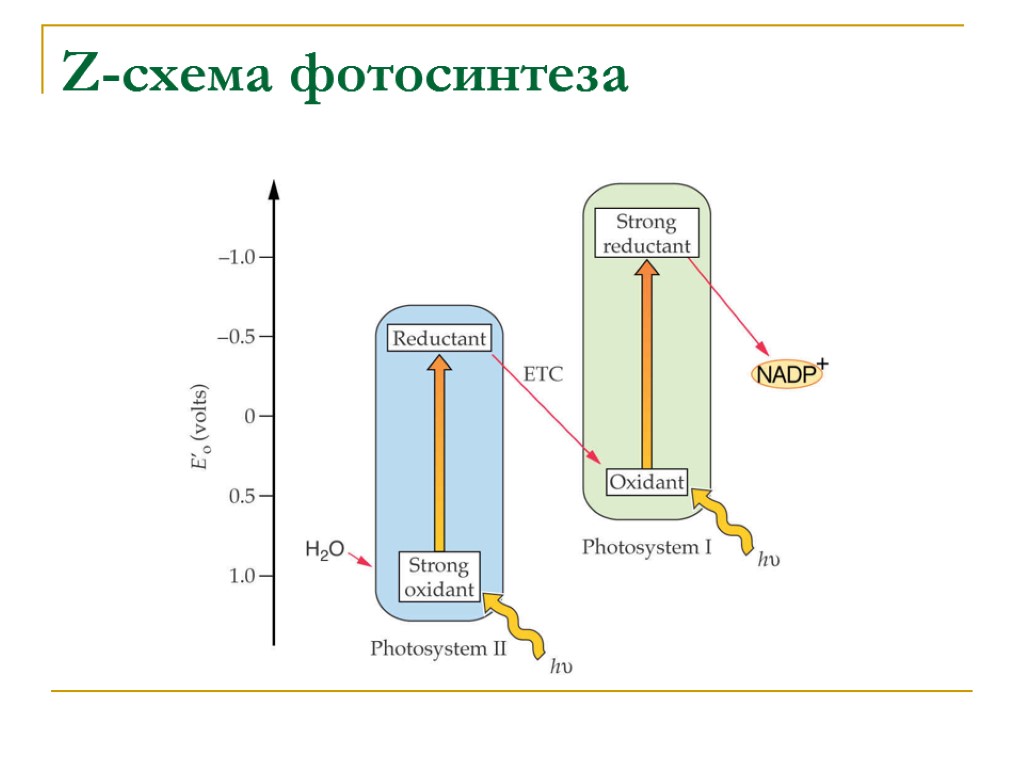
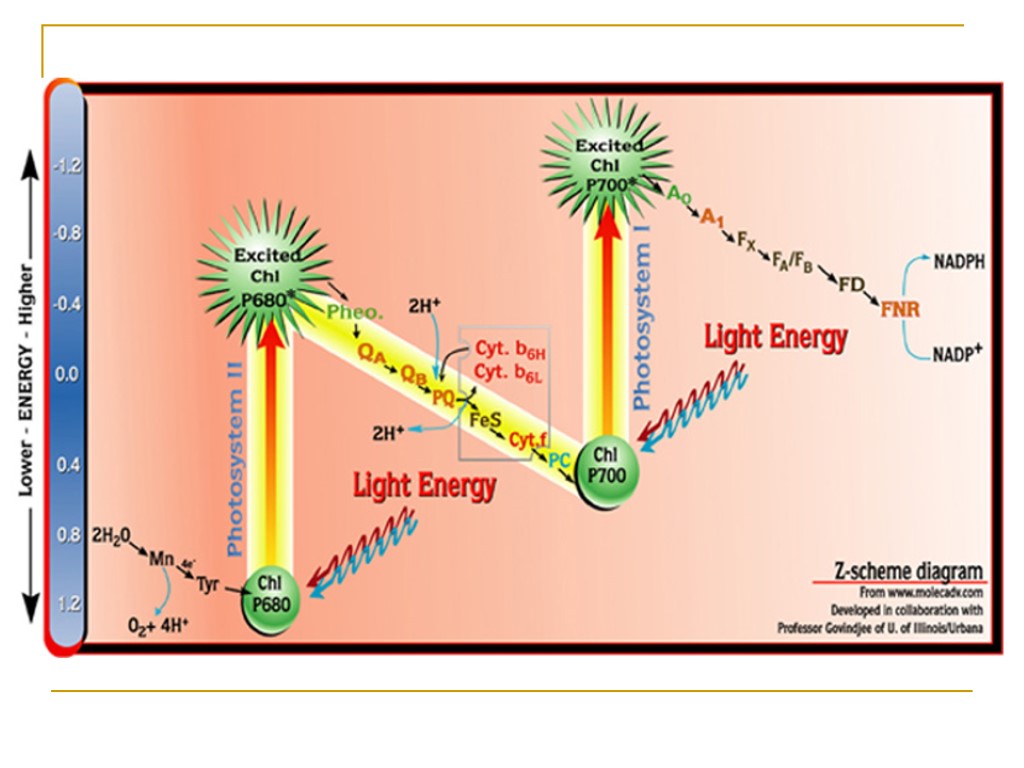
 Z-схема фотосинтеза
Z-схема фотосинтеза


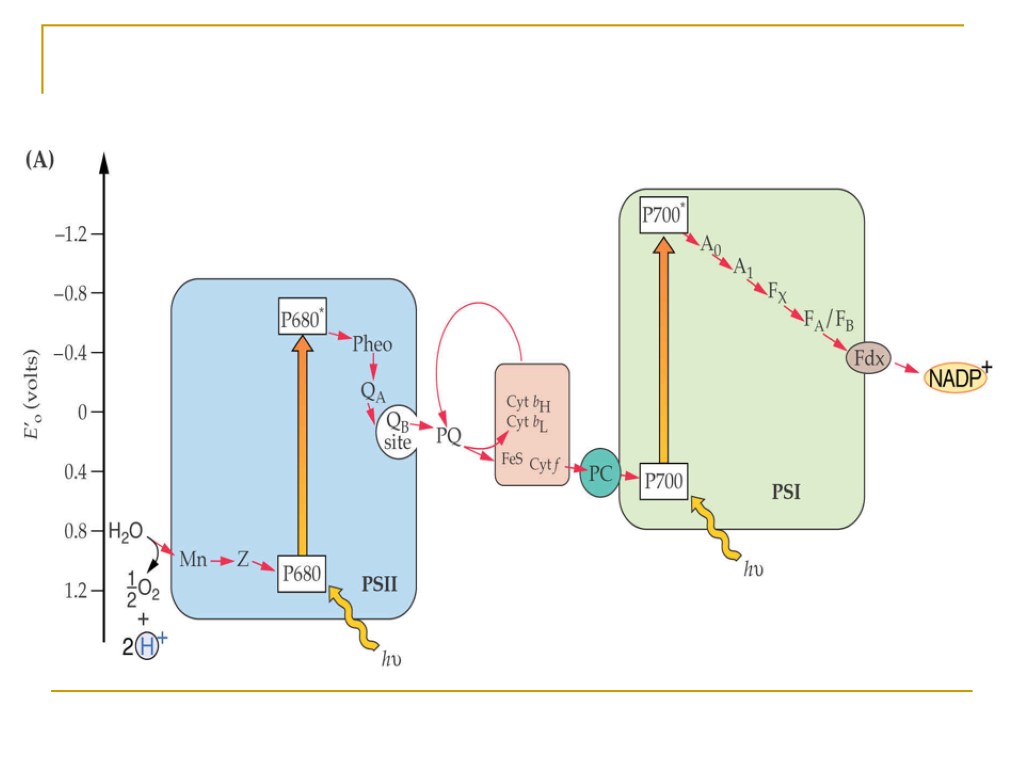
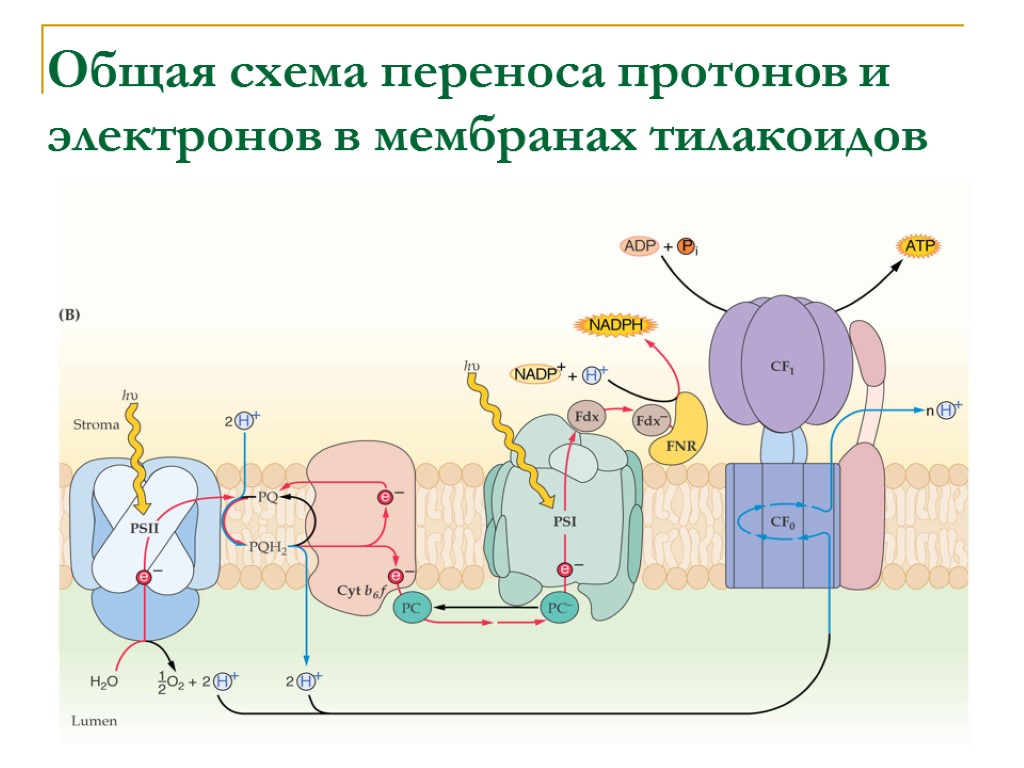
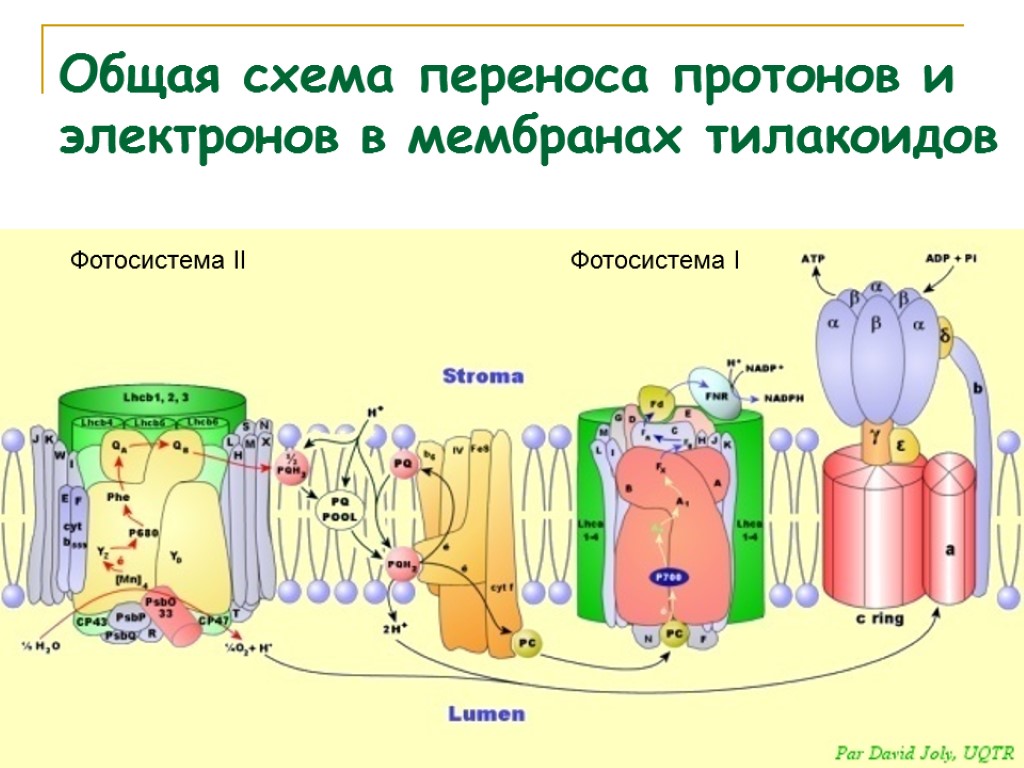
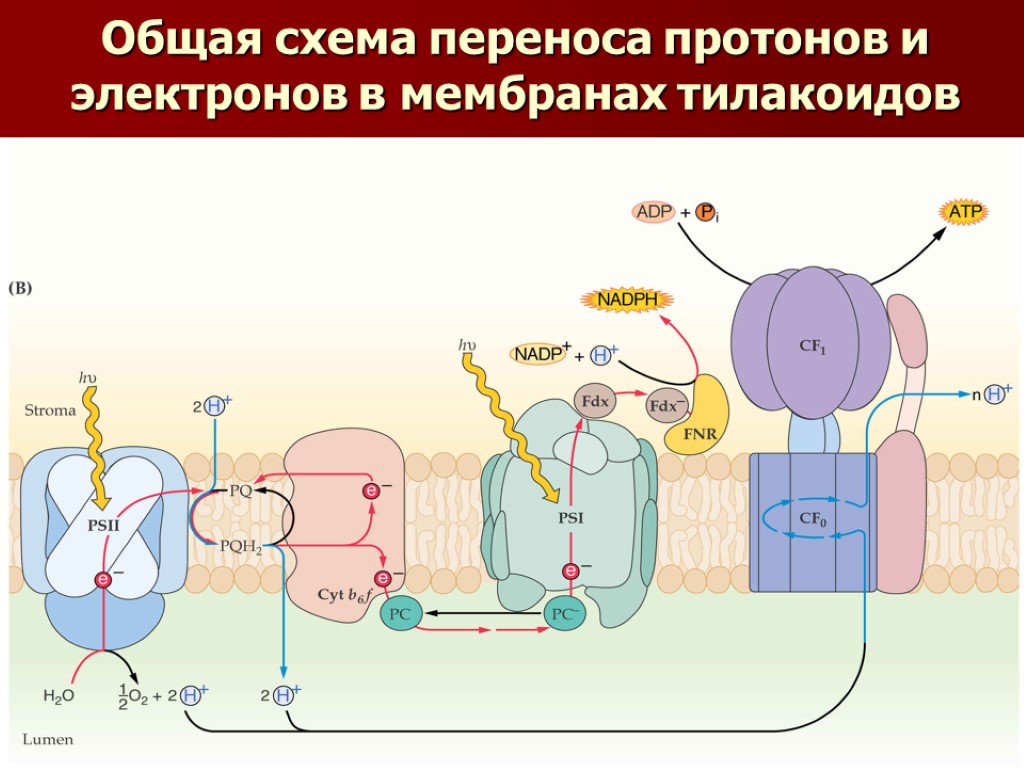
 Общая схема переноса протонов и электронов в мембранах тилакоидов
Общая схема переноса протонов и электронов в мембранах тилакоидов
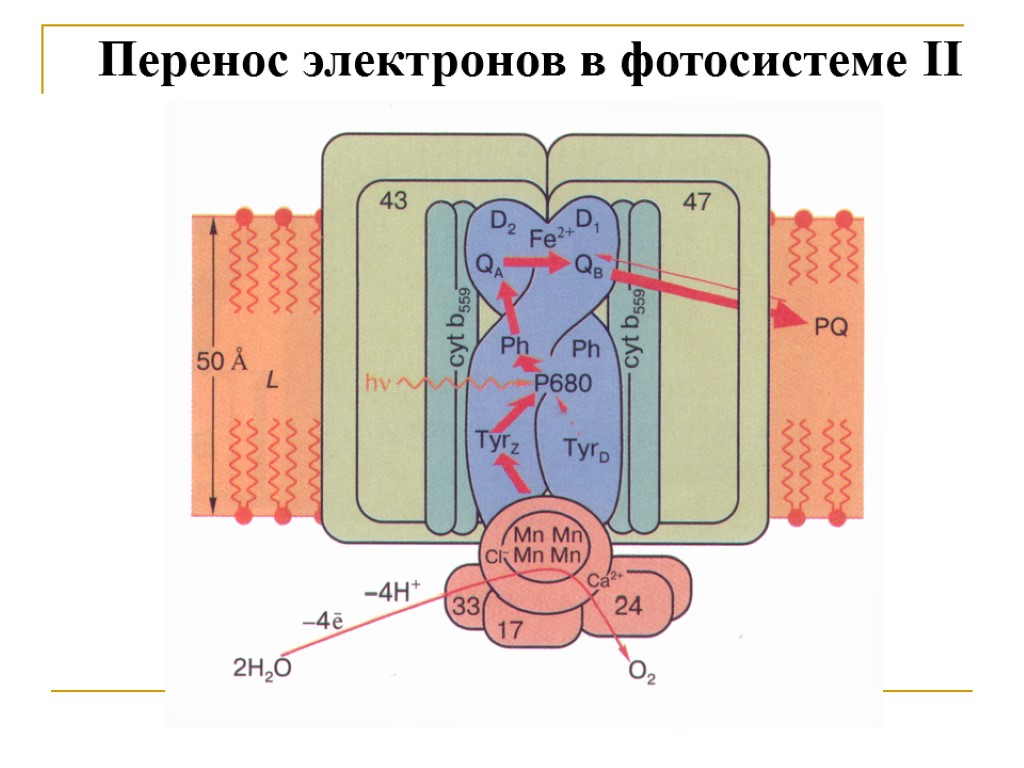
 Перенос электронов в фотосистеме II
Перенос электронов в фотосистеме II
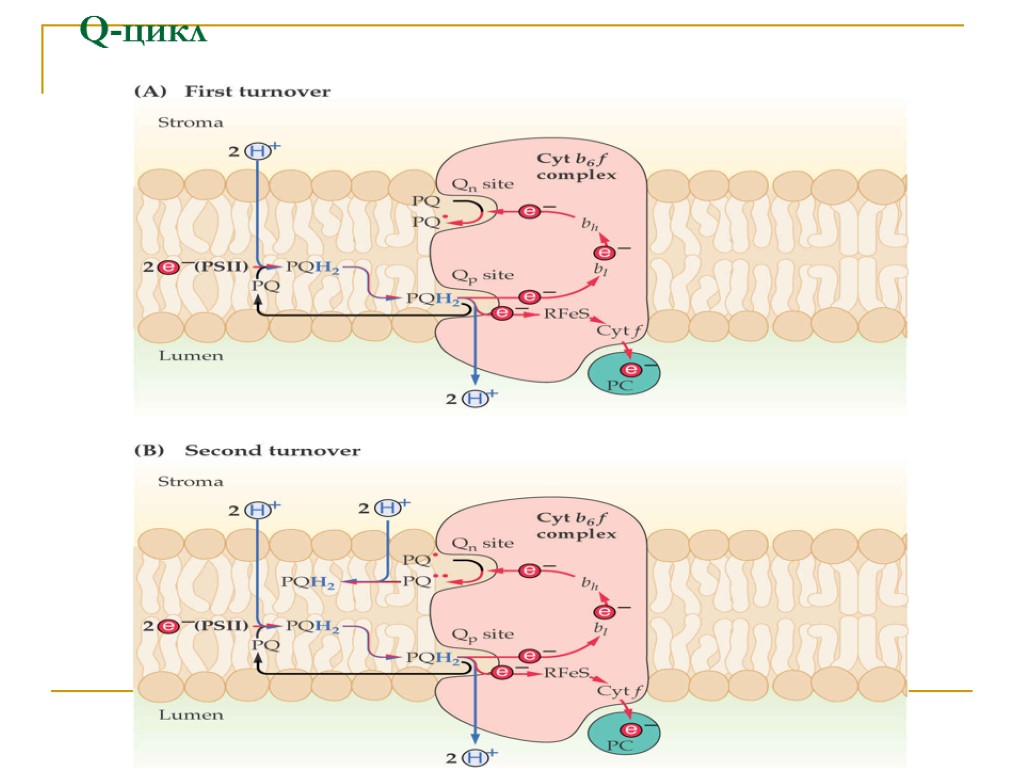
 Q-цикл
Q-цикл
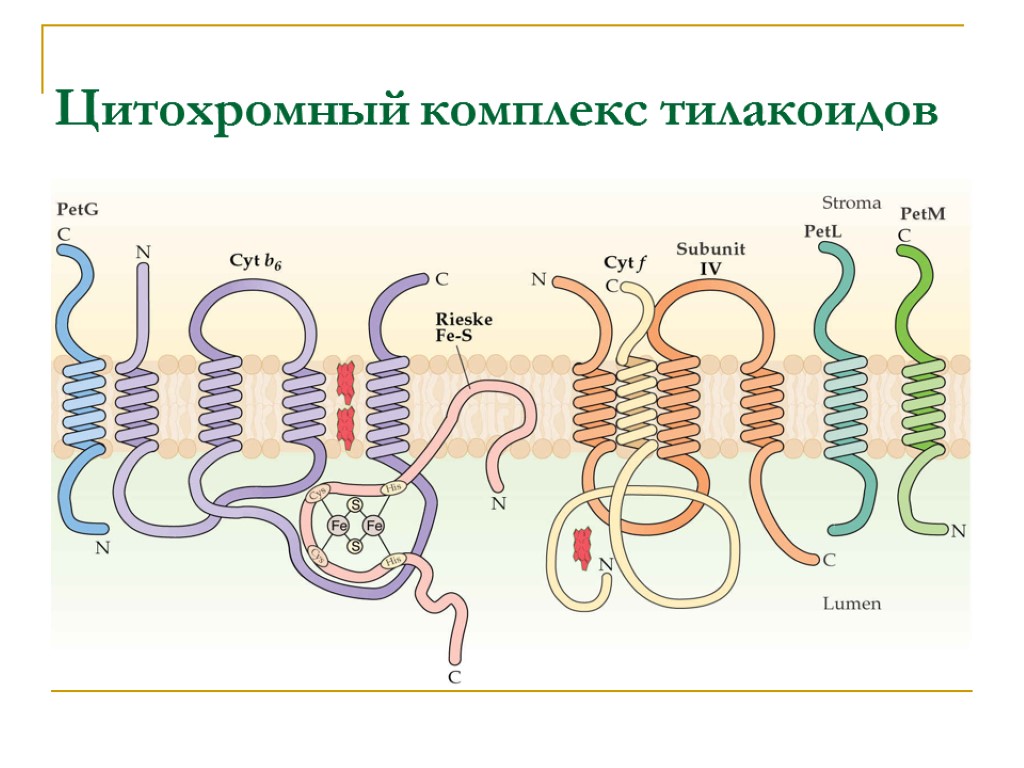
 Цитохромный комплекс тилакоидов
Цитохромный комплекс тилакоидов
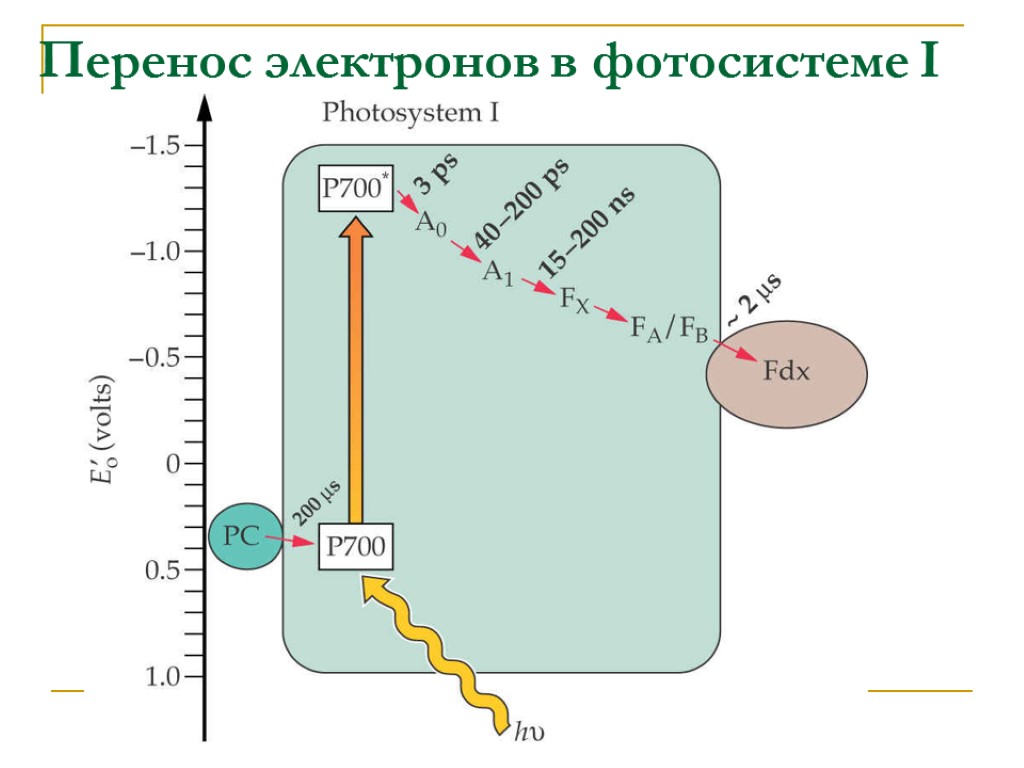
 Перенос электронов в фотосистеме I
Перенос электронов в фотосистеме I
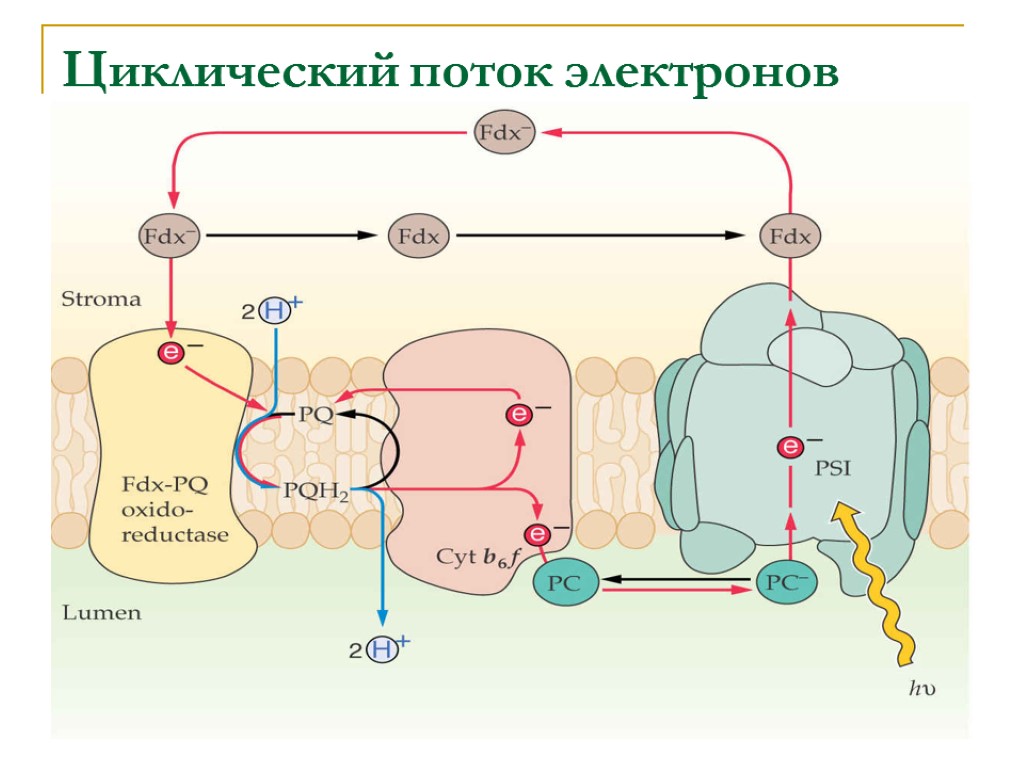
 Циклический поток электронов
Циклический поток электронов
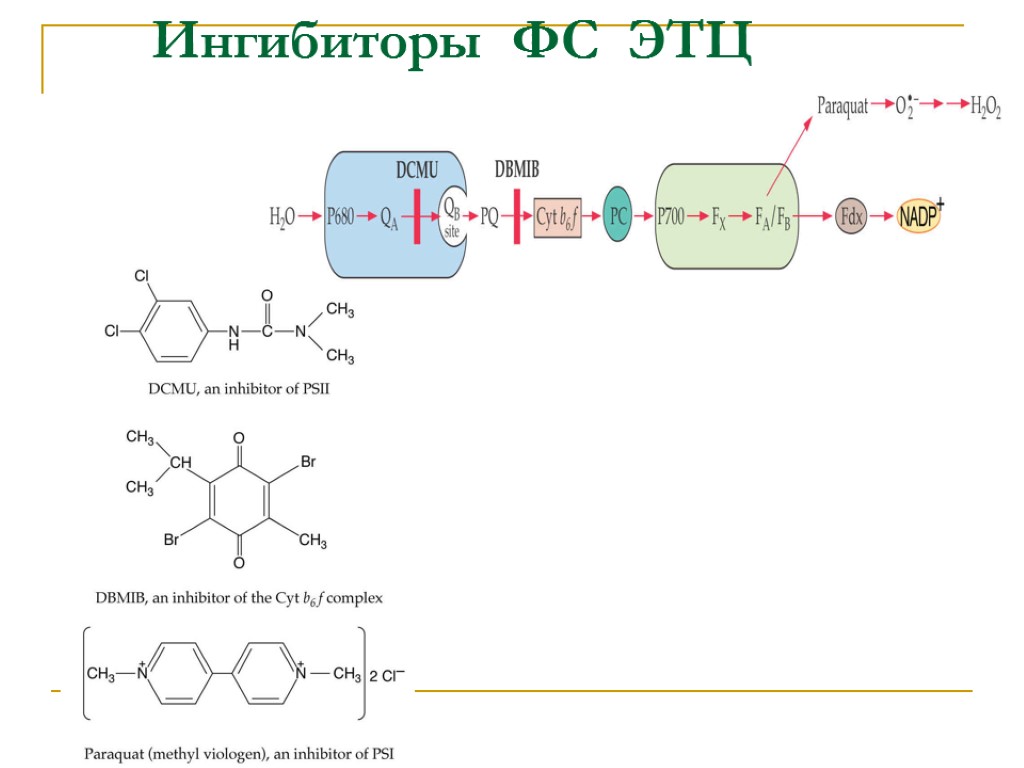
 Ингибиторы ФС ЭТЦ
Ингибиторы ФС ЭТЦ
 Фотосистема II Фотосистема I Общая схема переноса протонов и электронов в мембранах тилакоидов
Фотосистема II Фотосистема I Общая схема переноса протонов и электронов в мембранах тилакоидов
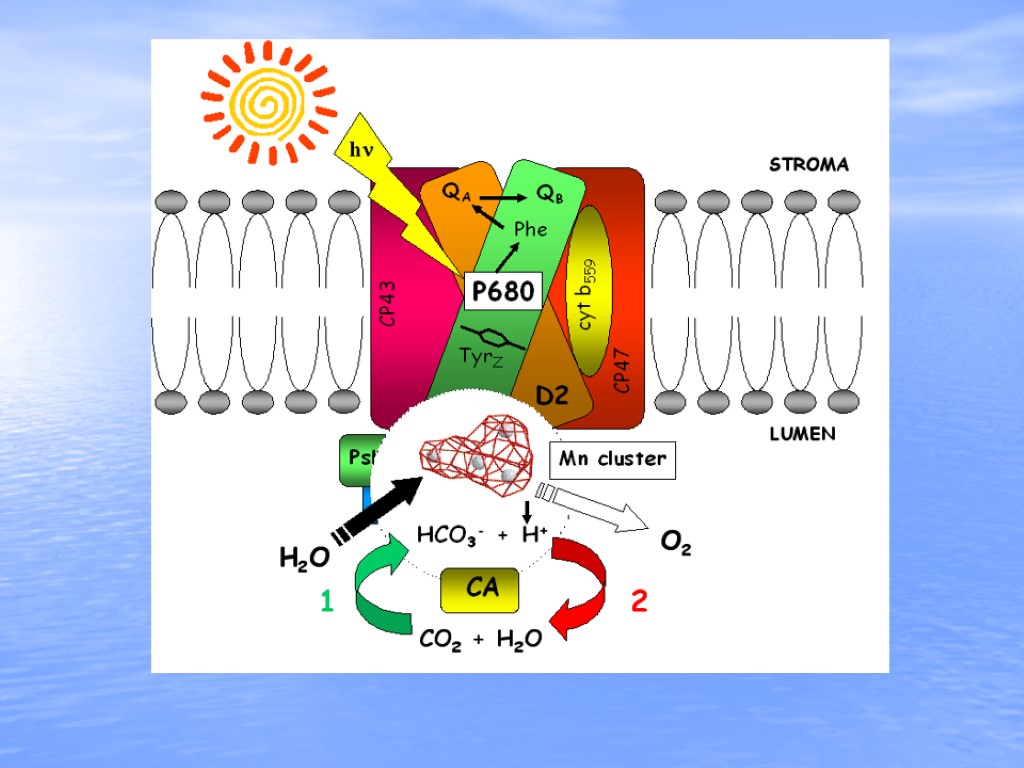
 Фотосинтетическое окисление воды
Фотосинтетическое окисление воды
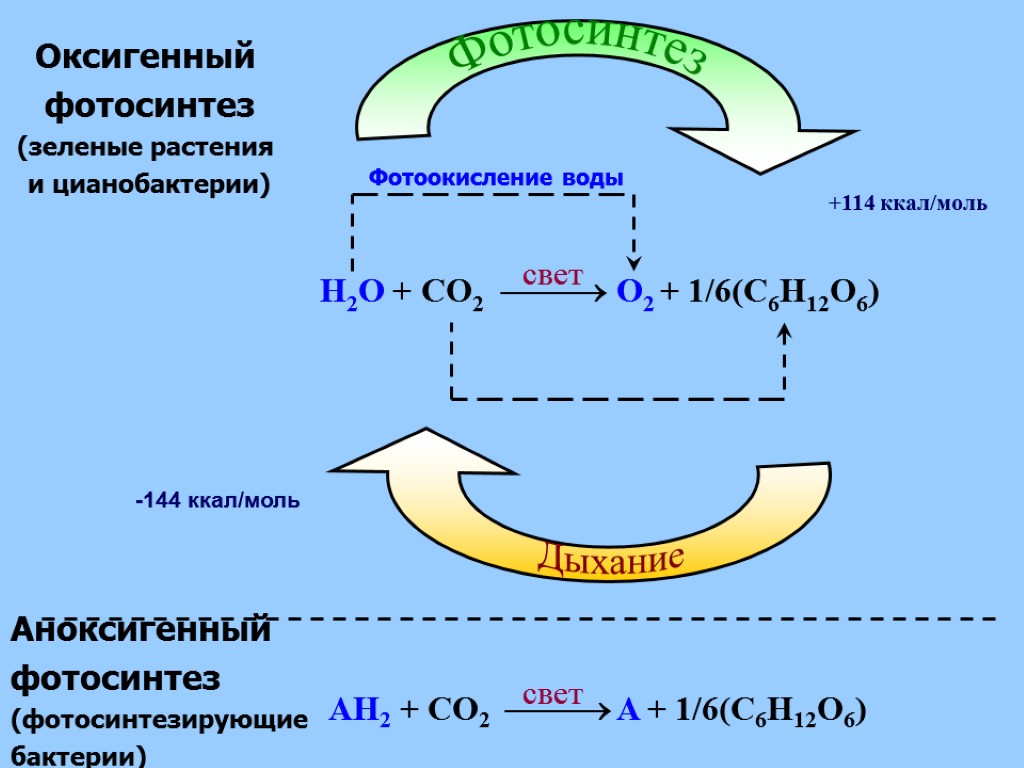
 -144 ккал/моль Оксигенный фотосинтез (зеленые растения и цианобактерии) Фотоокисление воды AH2 + CO2 A + 1/6(C6H12O6) свет свет Аноксигенный фотосинтез (фотосинтезирующие бактерии) +114 ккал/моль
-144 ккал/моль Оксигенный фотосинтез (зеленые растения и цианобактерии) Фотоокисление воды AH2 + CO2 A + 1/6(C6H12O6) свет свет Аноксигенный фотосинтез (фотосинтезирующие бактерии) +114 ккал/моль
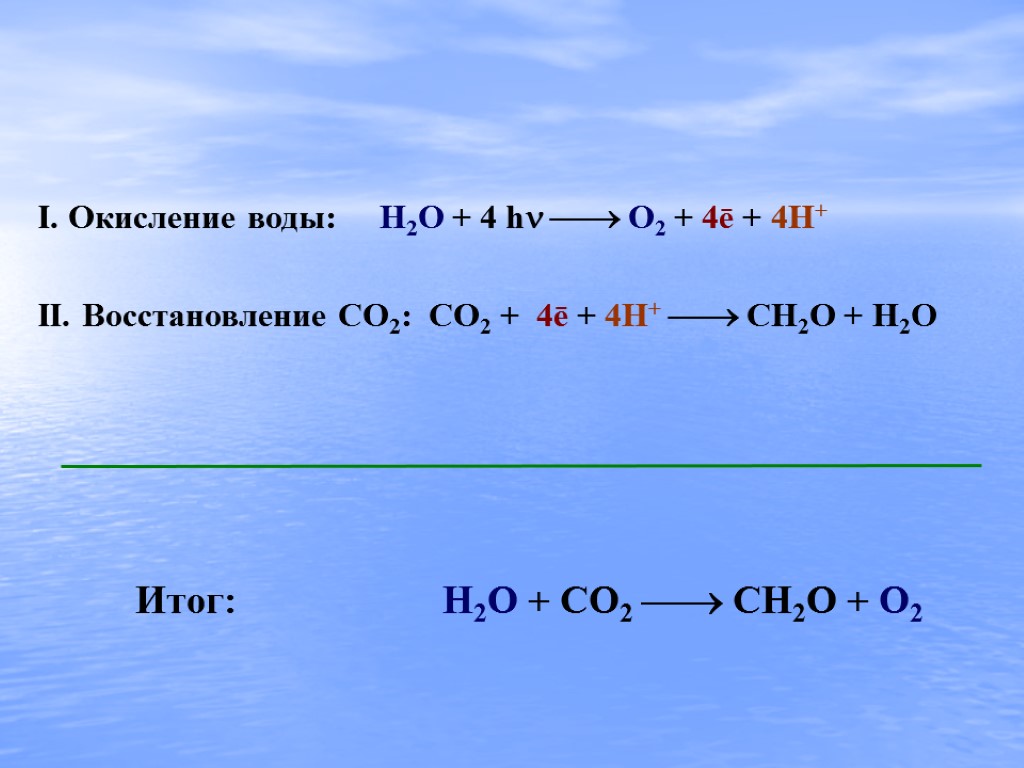
 I. Окисление воды: H2O + 4 h O2 + 4ē + 4H+ II. Восстановление CO2: CO2 + 4ē + 4H+ CH2O + H2O Итог: H2O + CO2 CH2O + O2
I. Окисление воды: H2O + 4 h O2 + 4ē + 4H+ II. Восстановление CO2: CO2 + 4ē + 4H+ CH2O + H2O Итог: H2O + CO2 CH2O + O2
 “ … не знаю другого, более удивительного процесса, который бы смог так преобразовать Землю.” академик А.П. Виноградов (1973)
“ … не знаю другого, более удивительного процесса, который бы смог так преобразовать Землю.” академик А.П. Виноградов (1973)
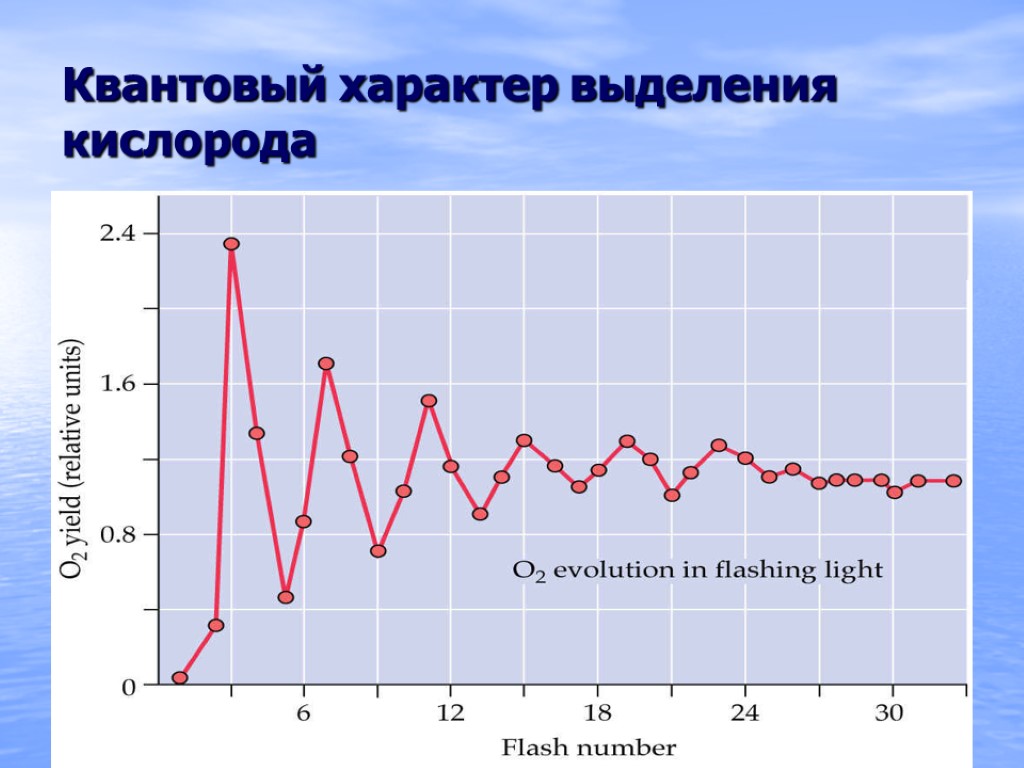
 Квантовый характер выделения кислорода
Квантовый характер выделения кислорода
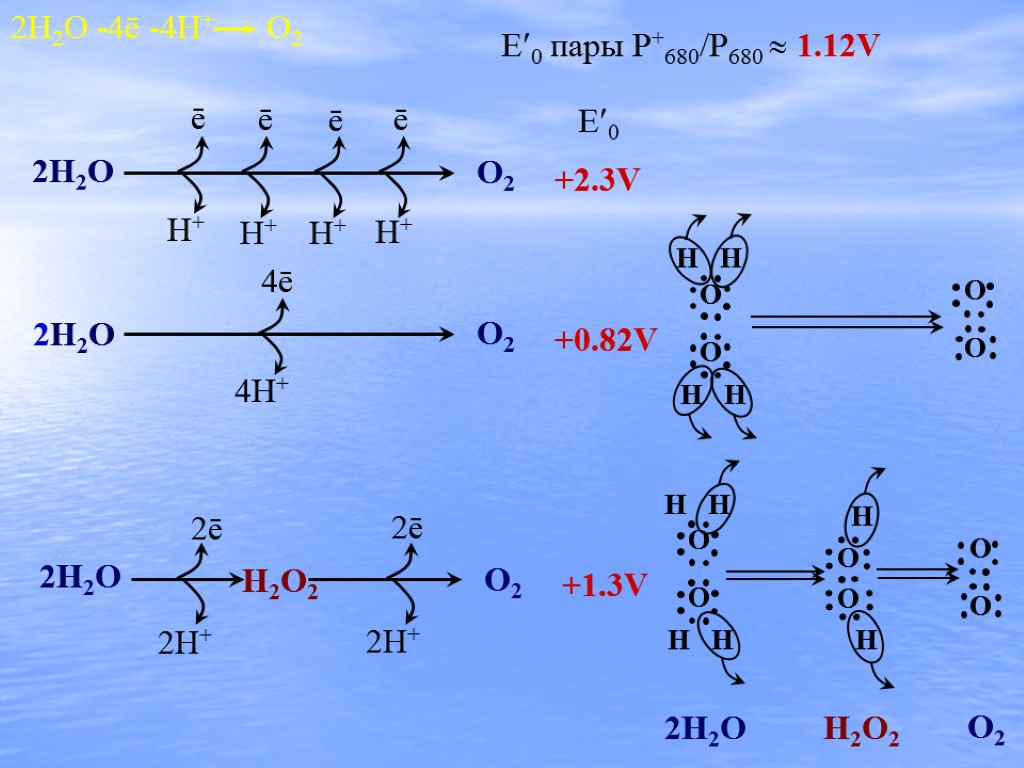
 O2 +1.3V E0 пары P+680/P680 1.12V H H O O H H H H O O H H H H 2H2O H2O2 O2
O2 +1.3V E0 пары P+680/P680 1.12V H H O O H H H H O O H H H H 2H2O H2O2 O2
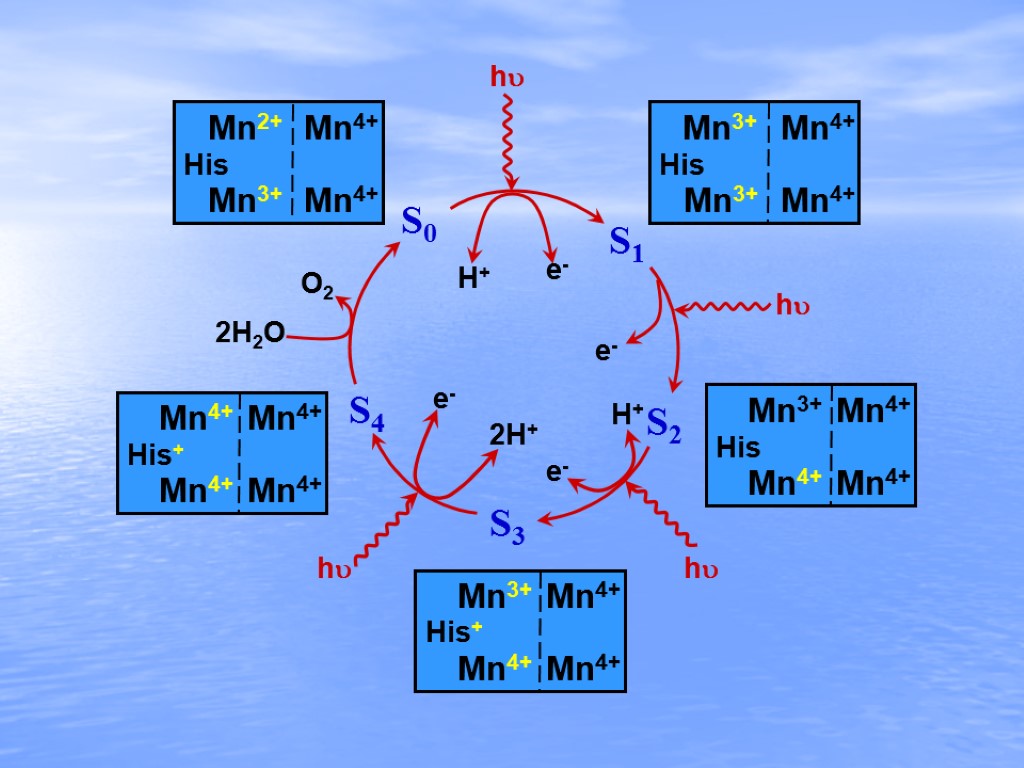
 h h h h S0 S1 S2 S3 S4 2H2O O2 H+ e- e- e- e- H+ 2H+ Mn2+ Mn3+ Mn3+ Mn3+ Mn4+ Mn4+ Mn4+ Mn4+ Mn3+ Mn4+ Mn4+ Mn4+ His+ Mn4+ Mn4+ Mn4+ His+ Mn4+ His His Mn3+ Mn4+ Mn4+ Mn4+ His
h h h h S0 S1 S2 S3 S4 2H2O O2 H+ e- e- e- e- H+ 2H+ Mn2+ Mn3+ Mn3+ Mn3+ Mn4+ Mn4+ Mn4+ Mn4+ Mn3+ Mn4+ Mn4+ Mn4+ His+ Mn4+ Mn4+ Mn4+ His+ Mn4+ His His Mn3+ Mn4+ Mn4+ Mn4+ His


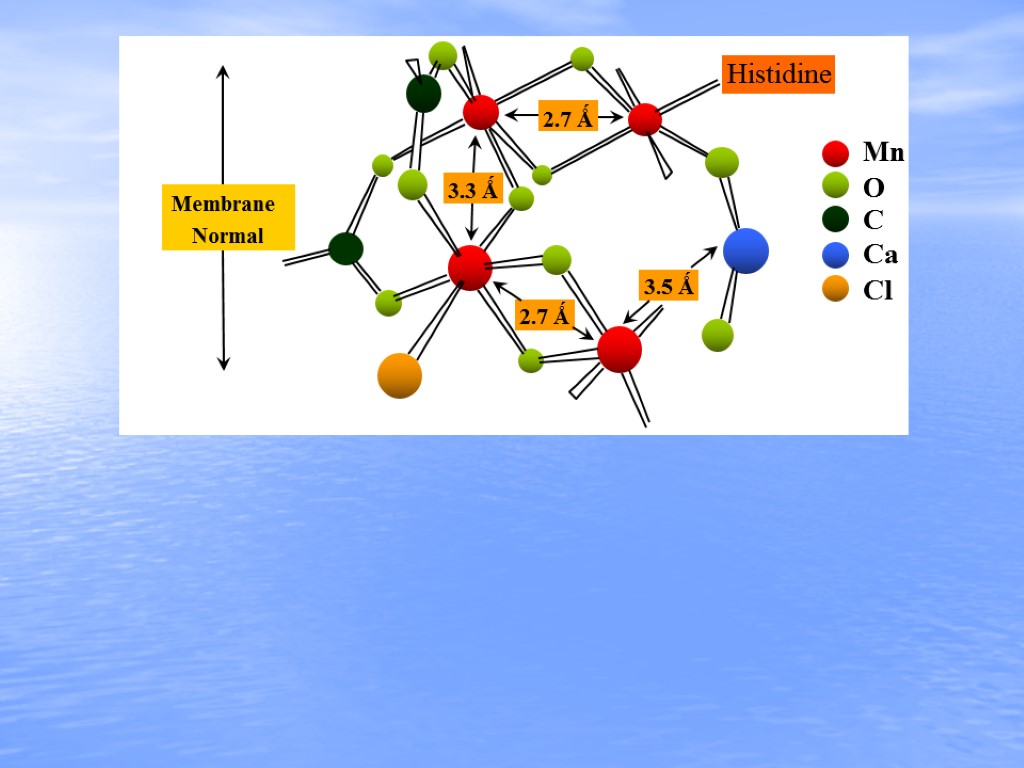
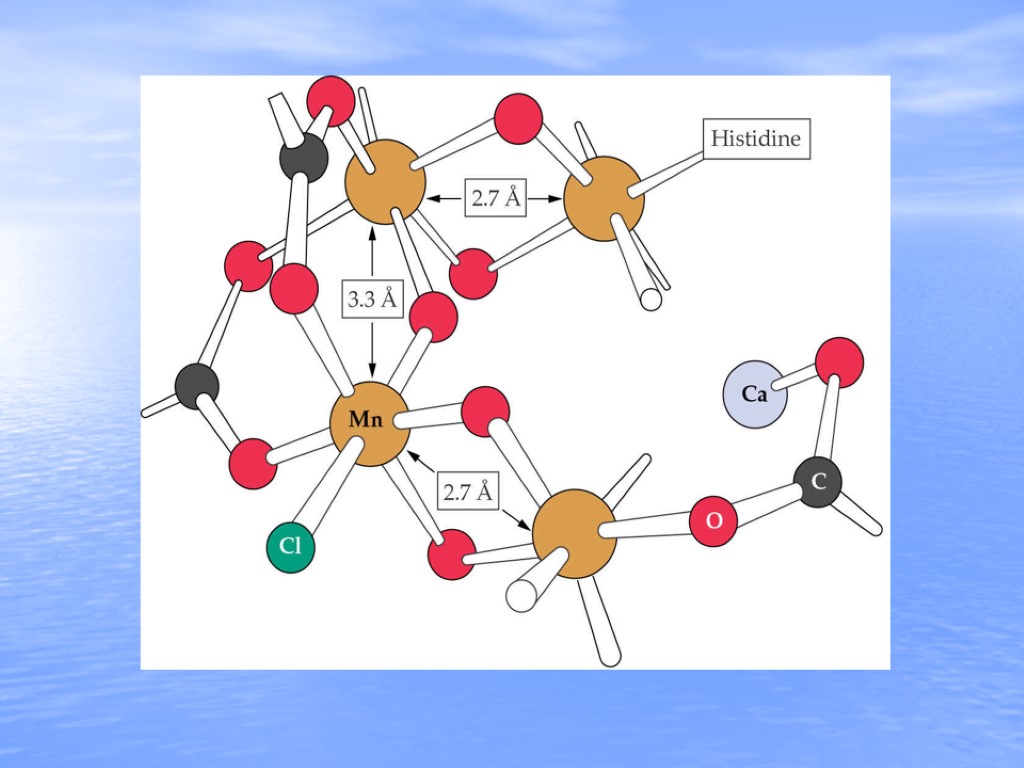
 3.3 Ǻ 3.5 Ǻ 2.7 Ǻ 2.7 Ǻ Membrane Normal Histidine Mn Ca O C Cl
3.3 Ǻ 3.5 Ǻ 2.7 Ǻ 2.7 Ǻ Membrane Normal Histidine Mn Ca O C Cl
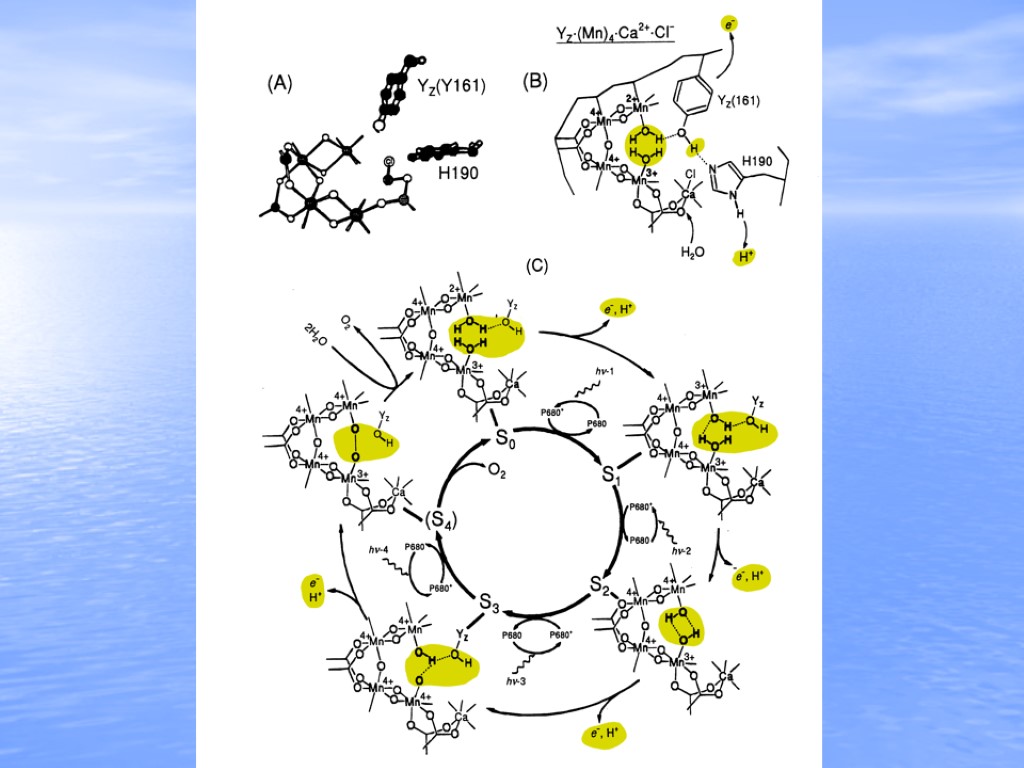
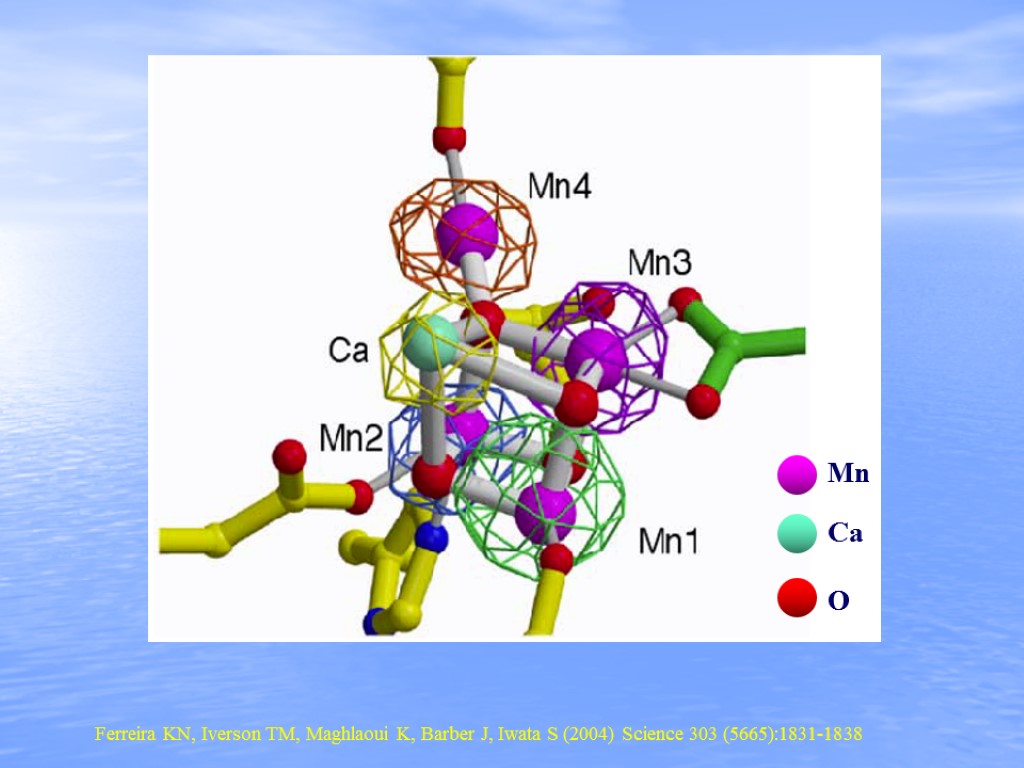
 Ferreira KN, Iverson TM, Maghlaoui K, Barber J, Iwata S (2004) Science 303 (5665):1831-1838 Mn Ca O
Ferreira KN, Iverson TM, Maghlaoui K, Barber J, Iwata S (2004) Science 303 (5665):1831-1838 Mn Ca O


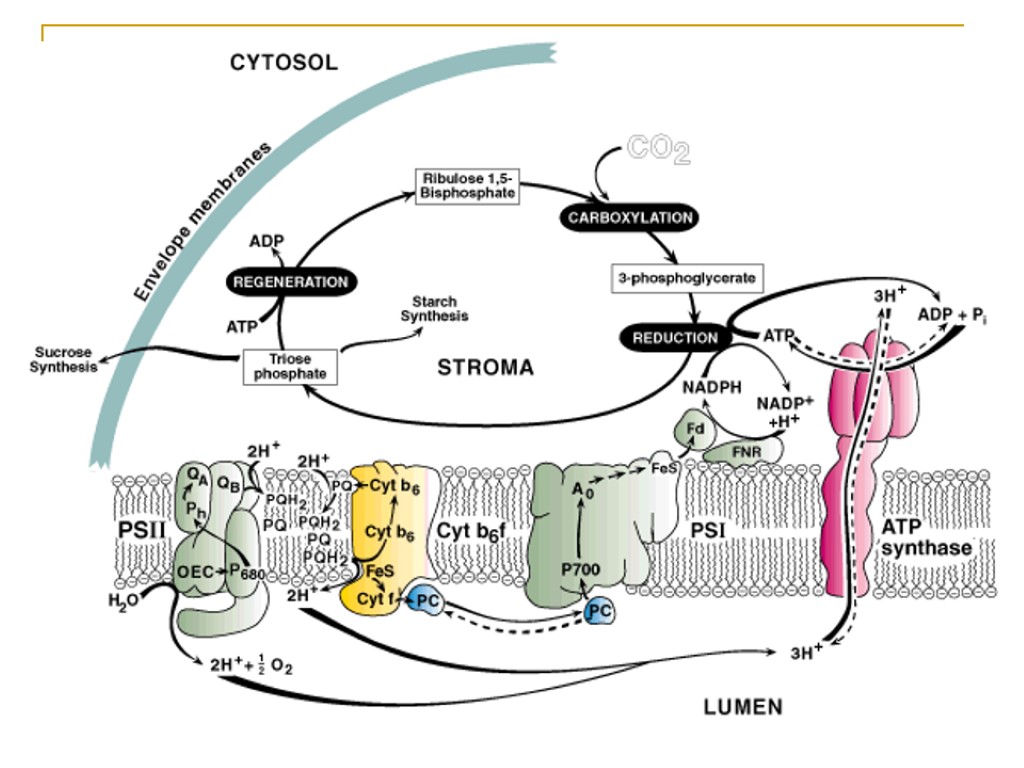
 Фотоэнергетические реакции хлоропластов
Фотоэнергетические реакции хлоропластов
 Общая схема переноса протонов и электронов в мембранах тилакоидов
Общая схема переноса протонов и электронов в мембранах тилакоидов
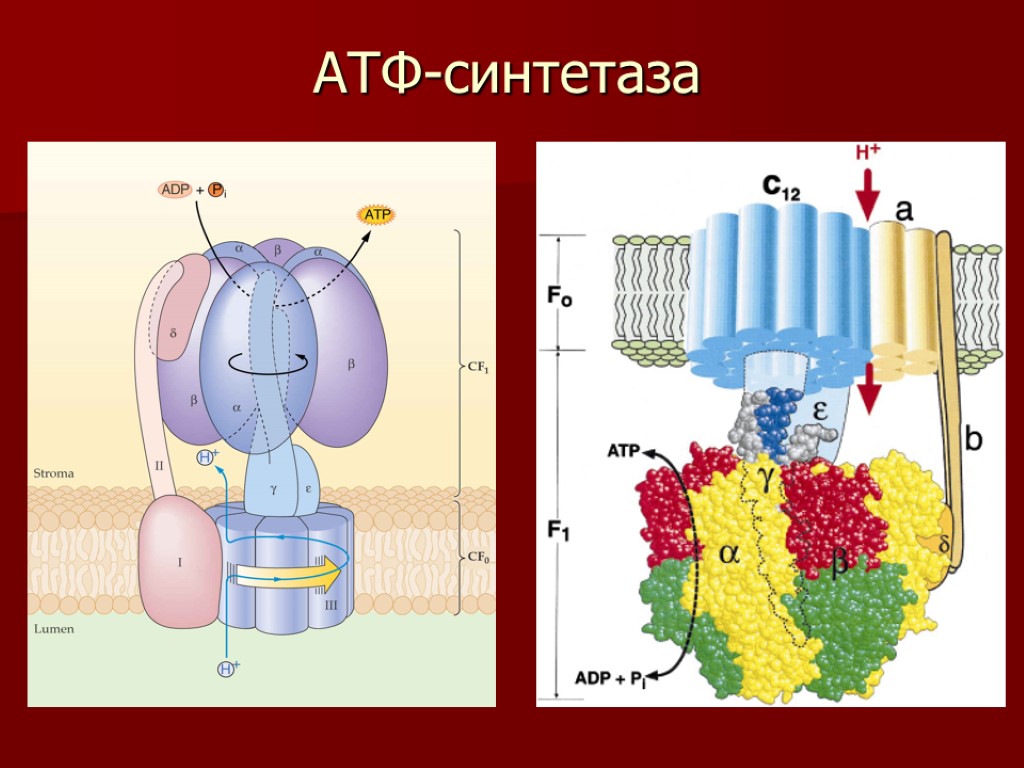
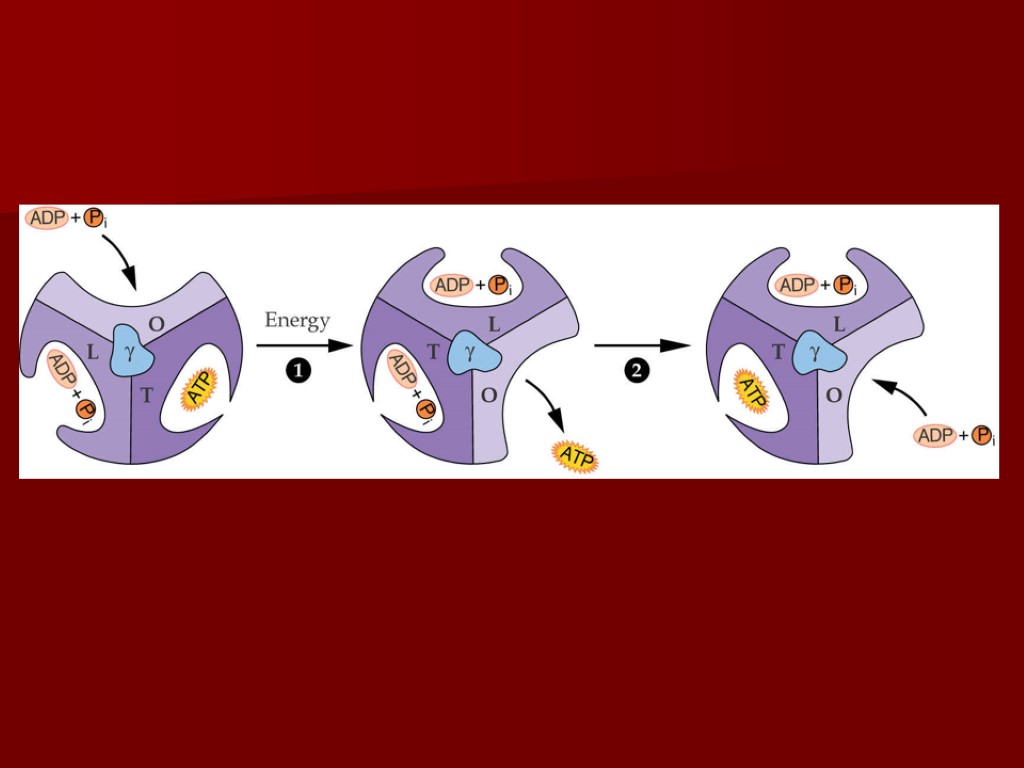
 АТФ-синтетаза
АТФ-синтетаза


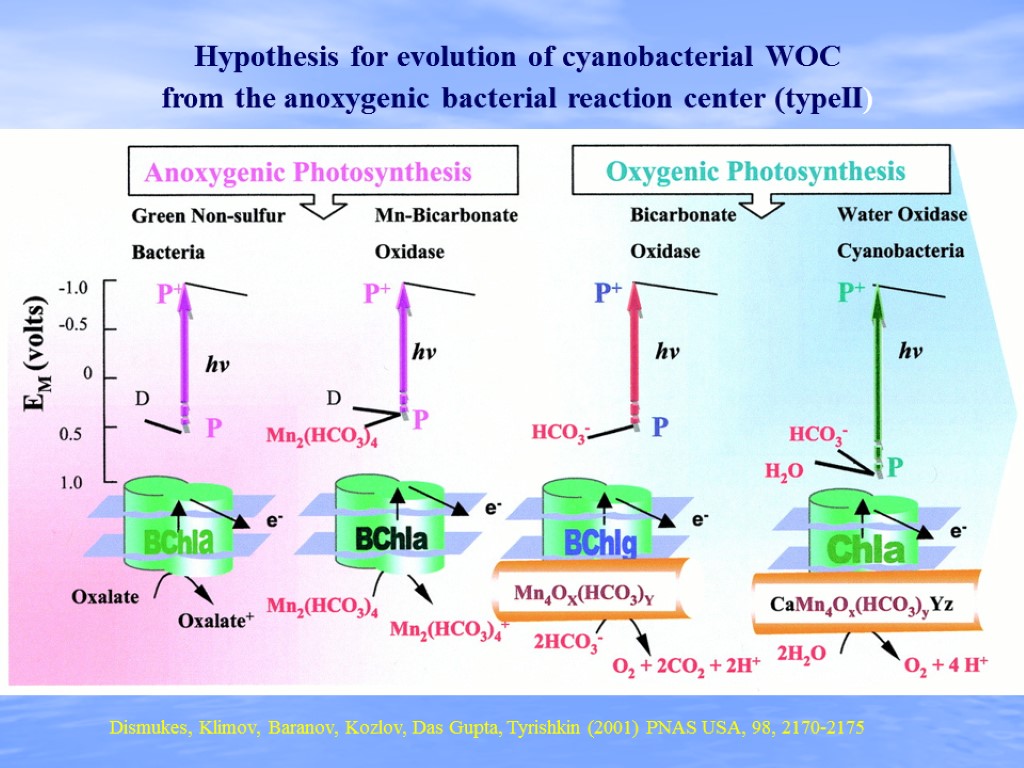
 Hypothesis for evolution of cyanobacterial WOC from the anoxygenic bacterial reaction center (typeII) Dismukes, Klimov, Baranov, Kozlov, Das Gupta, Tyrishkin (2001) PNAS USA, 98, 2170-2175
Hypothesis for evolution of cyanobacterial WOC from the anoxygenic bacterial reaction center (typeII) Dismukes, Klimov, Baranov, Kozlov, Das Gupta, Tyrishkin (2001) PNAS USA, 98, 2170-2175
 Пурпурные мембраны галофильных архебактерий АТФаза
Пурпурные мембраны галофильных архебактерий АТФаза
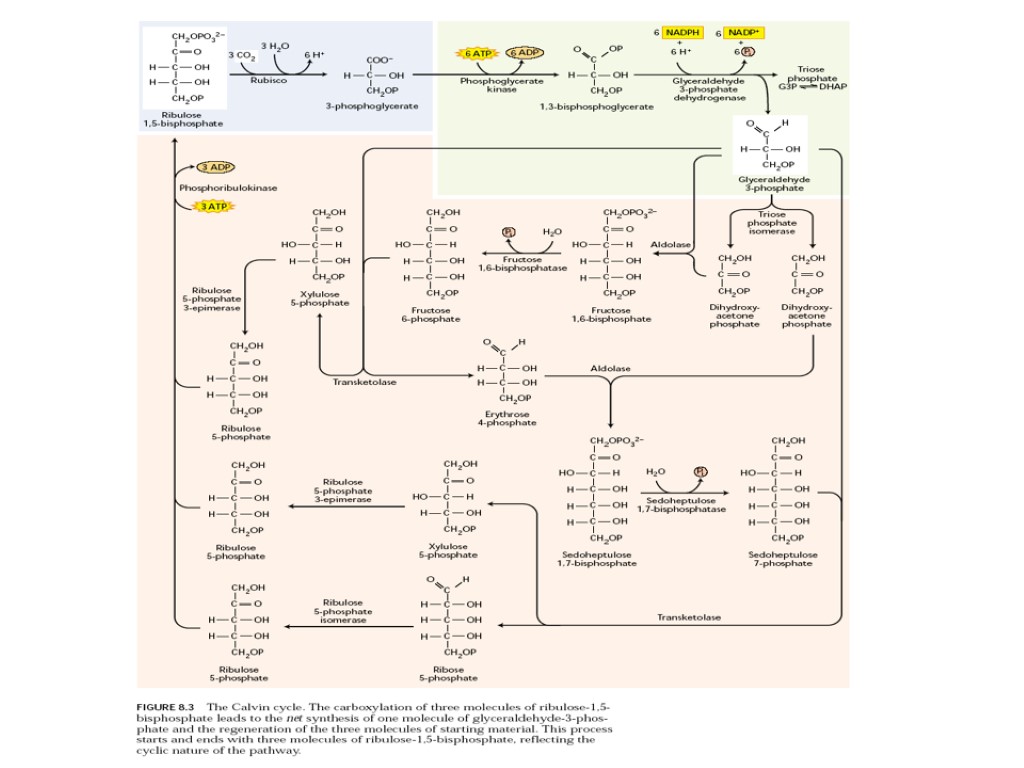
 Фотосинтетический метаболизм углерода (ВПФЦ, цикл Кальвина-Бенсона)
Фотосинтетический метаболизм углерода (ВПФЦ, цикл Кальвина-Бенсона)


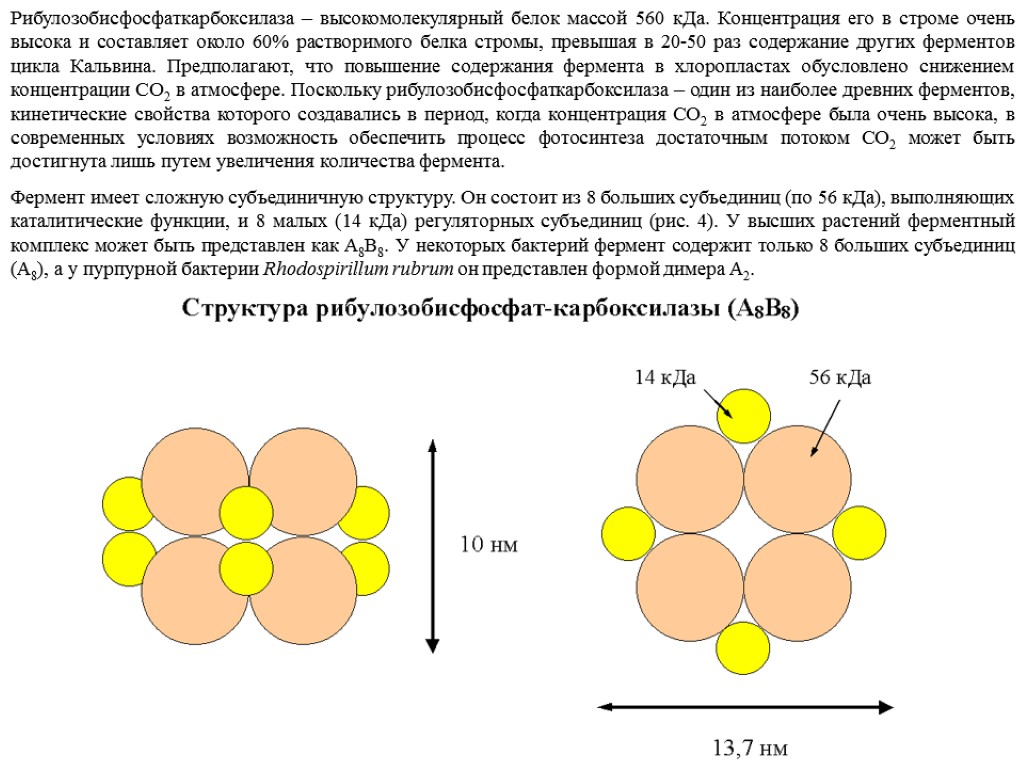
 Рибулозобисфосфаткарбоксилаза – высокомолекулярный белок массой 560 кДа. Концентрация его в строме очень высока и составляет около 60% растворимого белка стромы, превышая в 20-50 раз содержание других ферментов цикла Кальвина. Предполагают, что повышение содержания фермента в хлоропластах обусловлено снижением концентрации СО2 в атмосфере. Поскольку рибулозобисфосфаткарбоксилаза – один из наиболее древних ферментов, кинетические свойства которого создавались в период, когда концентрация СО2 в атмосфере была очень высока, в современных условиях возможность обеспечить процесс фотосинтеза достаточным потоком СО2 может быть достигнута лишь путем увеличения количества фермента. Фермент имеет сложную субъединичную структуру. Он состоит из 8 больших субъединиц (по 56 кДа), выполняющих каталитические функции, и 8 малых (14 кДа) регуляторных субъединиц (рис. 4). У высших растений ферментный комплекс может быть представлен как A8B8. У некоторых бактерий фермент содержит только 8 больших субъединиц (А8), а у пурпурной бактерии Rhodospirillum rubrum он представлен формой димера А2.
Рибулозобисфосфаткарбоксилаза – высокомолекулярный белок массой 560 кДа. Концентрация его в строме очень высока и составляет около 60% растворимого белка стромы, превышая в 20-50 раз содержание других ферментов цикла Кальвина. Предполагают, что повышение содержания фермента в хлоропластах обусловлено снижением концентрации СО2 в атмосфере. Поскольку рибулозобисфосфаткарбоксилаза – один из наиболее древних ферментов, кинетические свойства которого создавались в период, когда концентрация СО2 в атмосфере была очень высока, в современных условиях возможность обеспечить процесс фотосинтеза достаточным потоком СО2 может быть достигнута лишь путем увеличения количества фермента. Фермент имеет сложную субъединичную структуру. Он состоит из 8 больших субъединиц (по 56 кДа), выполняющих каталитические функции, и 8 малых (14 кДа) регуляторных субъединиц (рис. 4). У высших растений ферментный комплекс может быть представлен как A8B8. У некоторых бактерий фермент содержит только 8 больших субъединиц (А8), а у пурпурной бактерии Rhodospirillum rubrum он представлен формой димера А2.
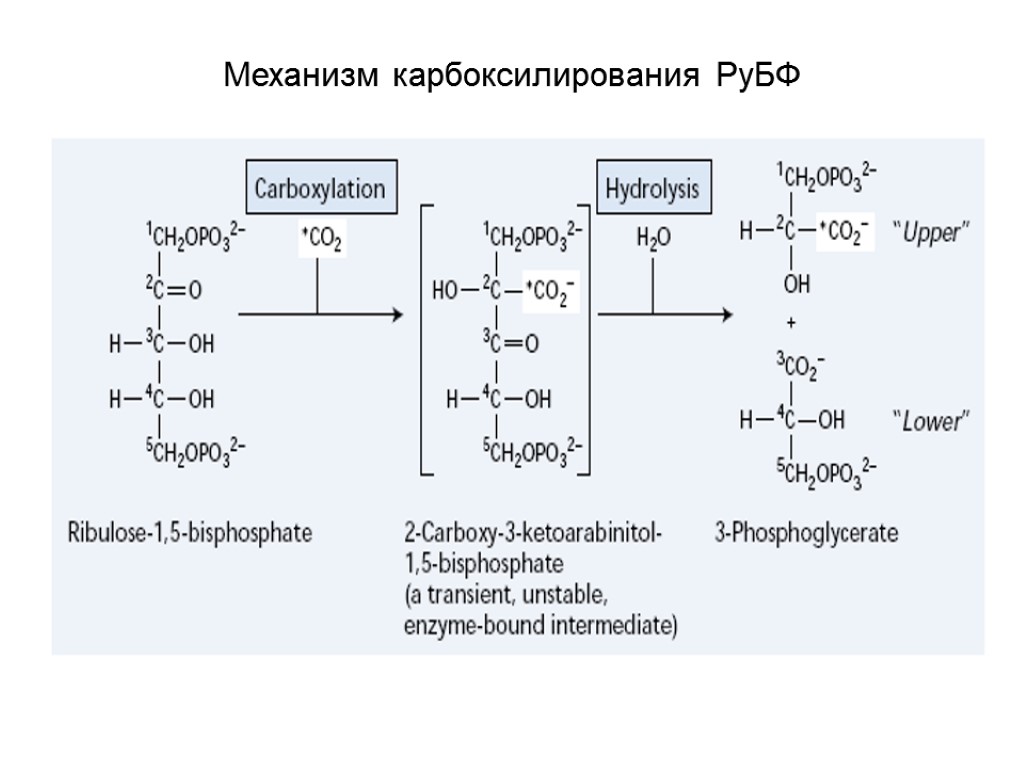
 Механизм карбоксилирования РуБФ
Механизм карбоксилирования РуБФ
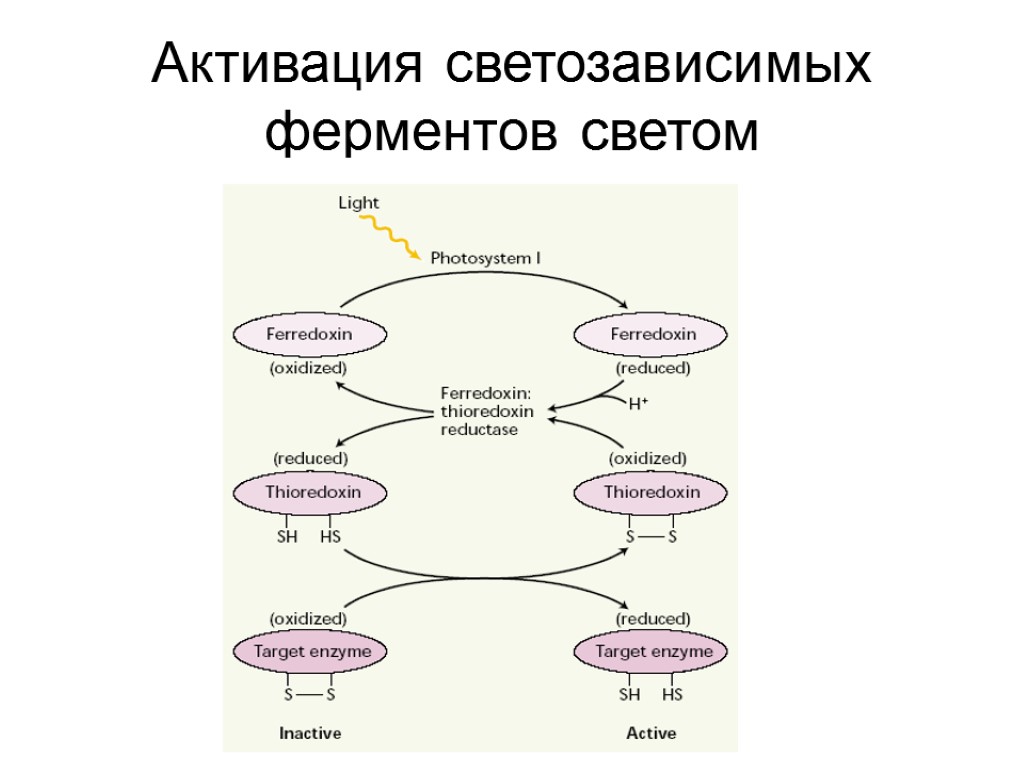
 Активация светозависимых ферментов регулирует цикл Кальвина
Активация светозависимых ферментов регулирует цикл Кальвина
 Активация светозависимых ферментов светом
Активация светозависимых ферментов светом

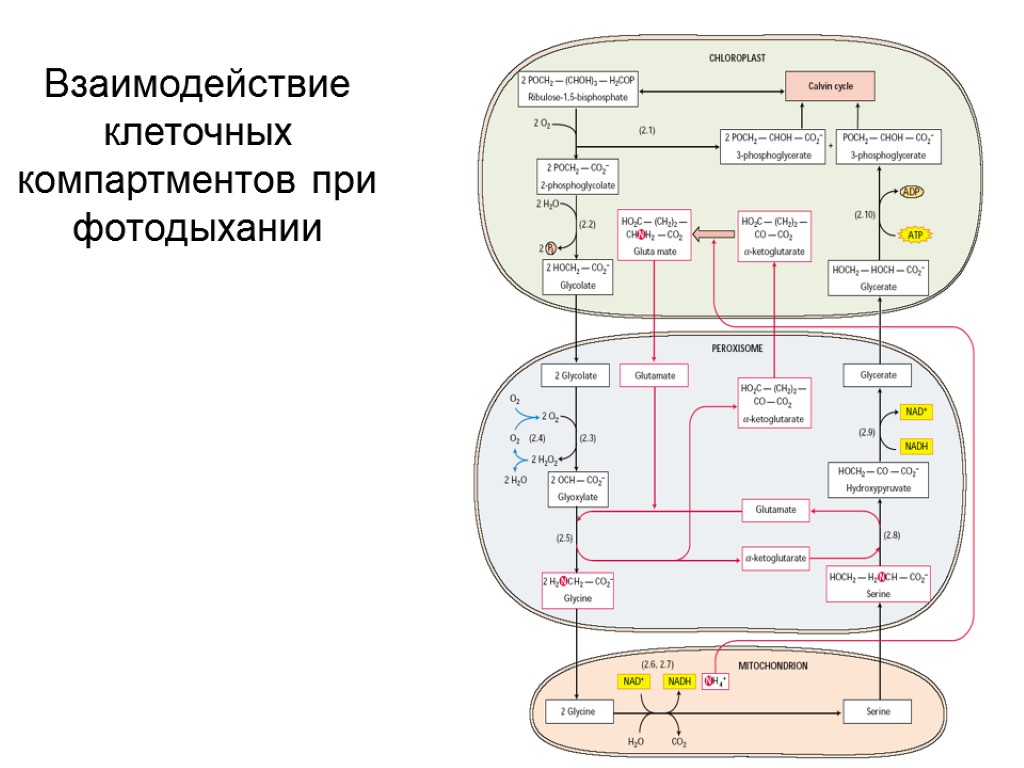
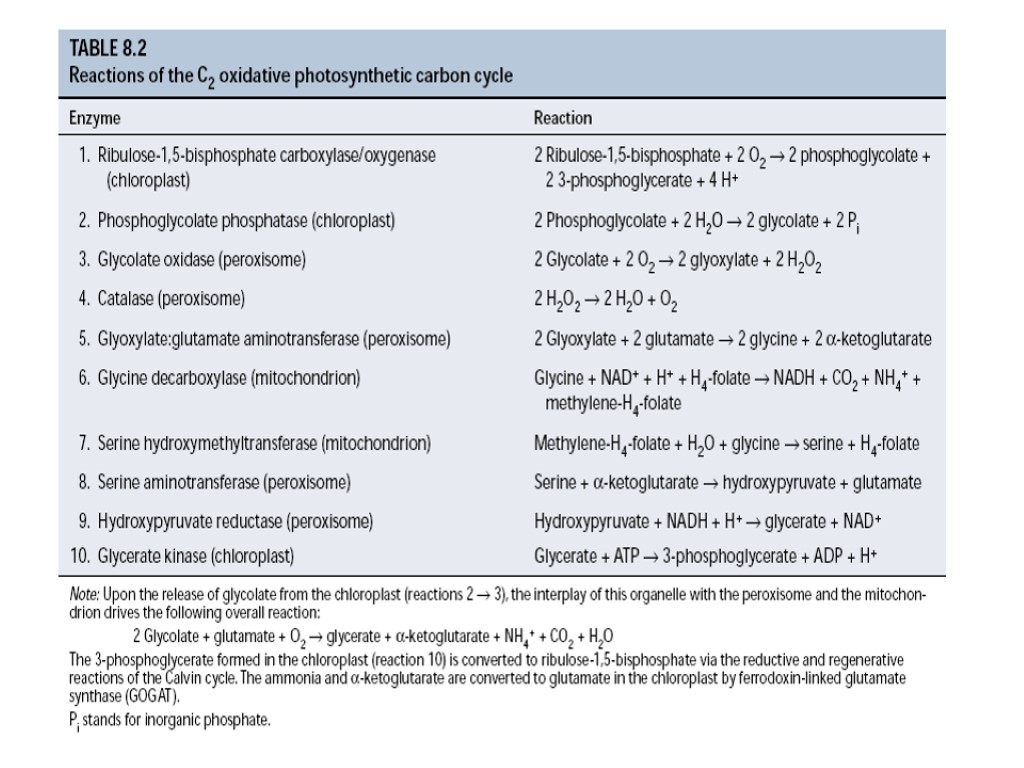
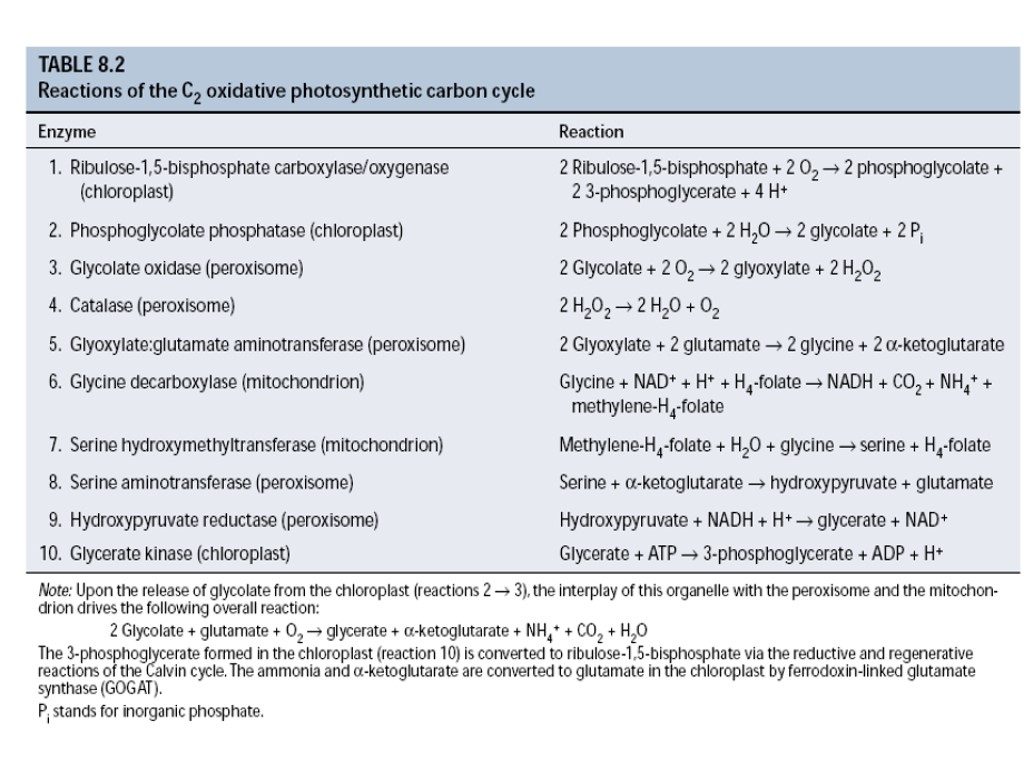
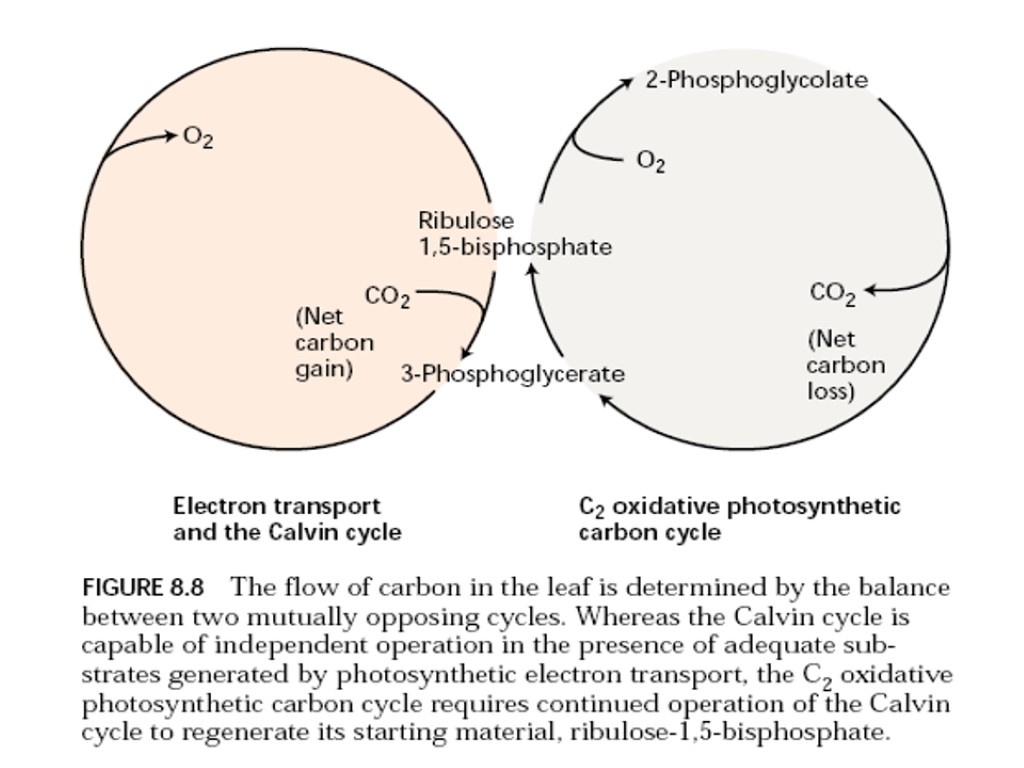
 Взаимодействие клеточных компартментов при фотодыхании
Взаимодействие клеточных компартментов при фотодыхании

 Метаболизм углерода при фотосинтезе Фотодыхание С-4 САМ
Метаболизм углерода при фотосинтезе Фотодыхание С-4 САМ
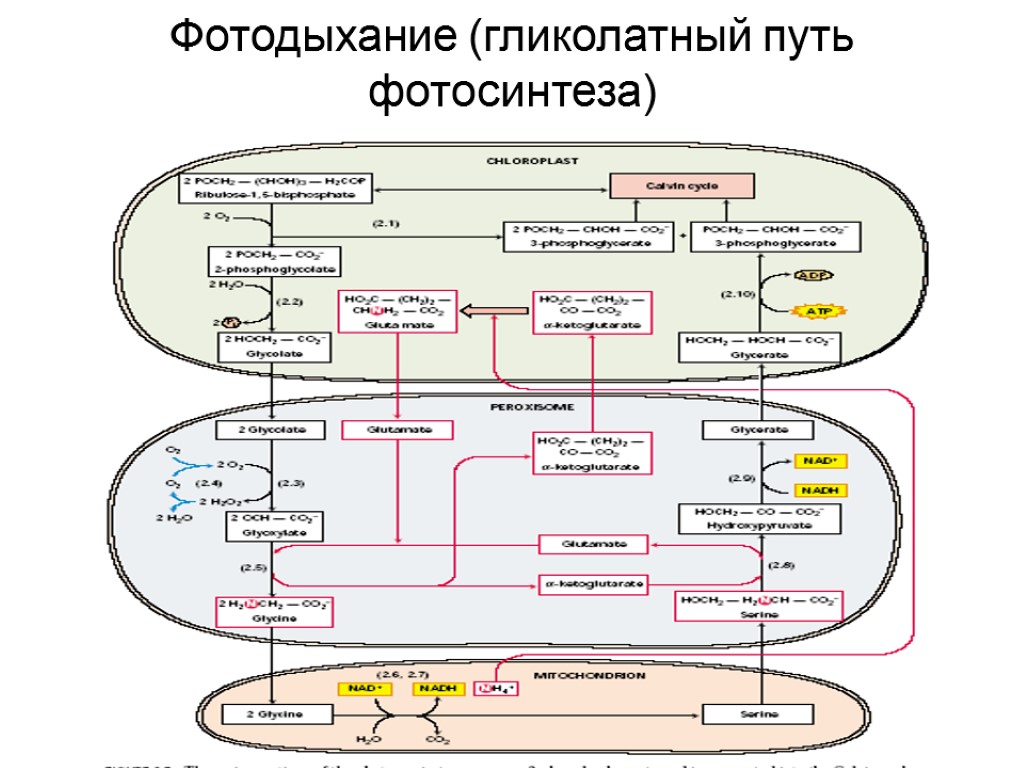
 Фотодыхание (гликолатный путь фотосинтеза)
Фотодыхание (гликолатный путь фотосинтеза)


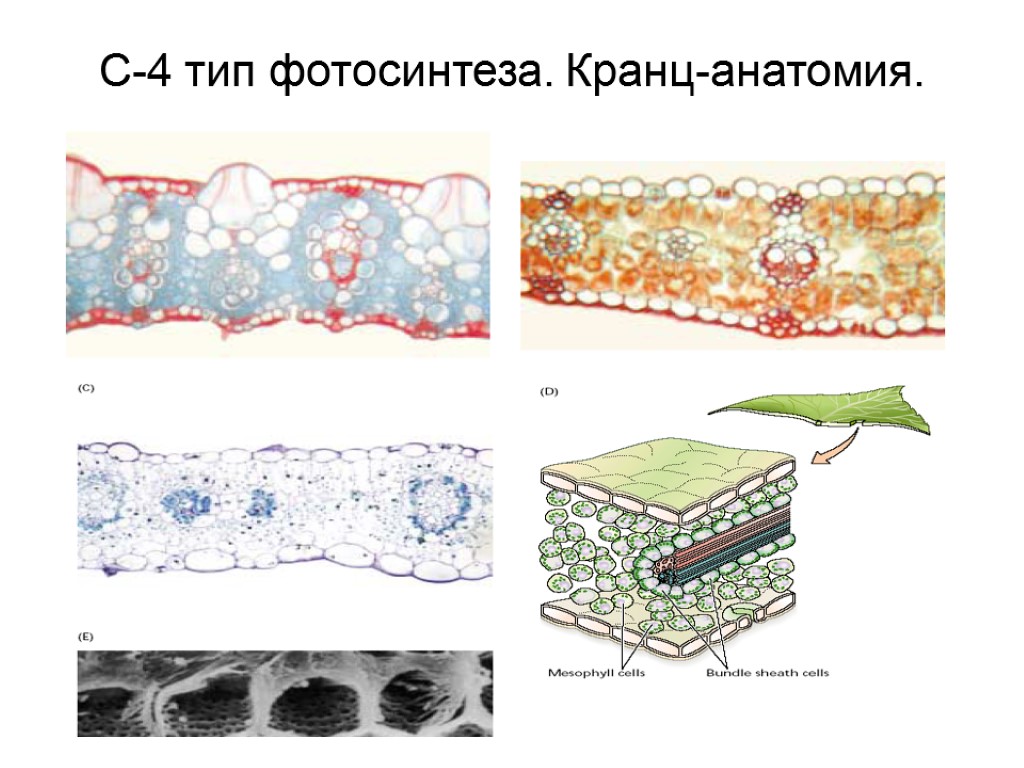
 С-4 тип фотосинтеза. Кранц-анатомия.
С-4 тип фотосинтеза. Кранц-анатомия.
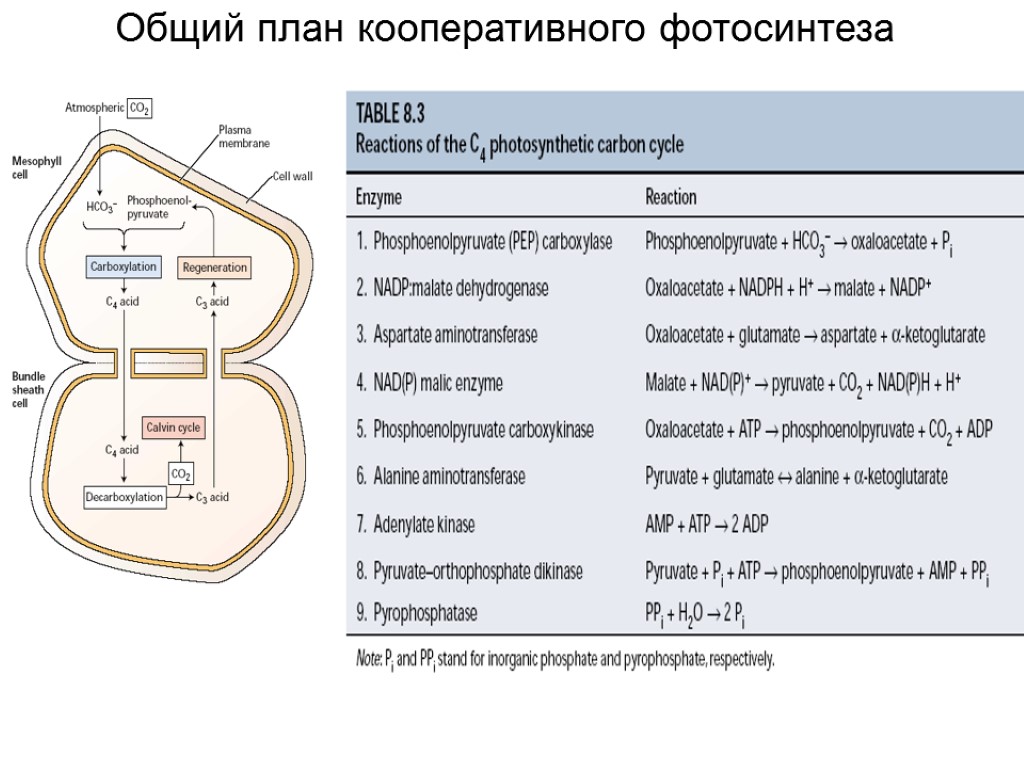
 Общий план кооперативного фотосинтеза
Общий план кооперативного фотосинтеза
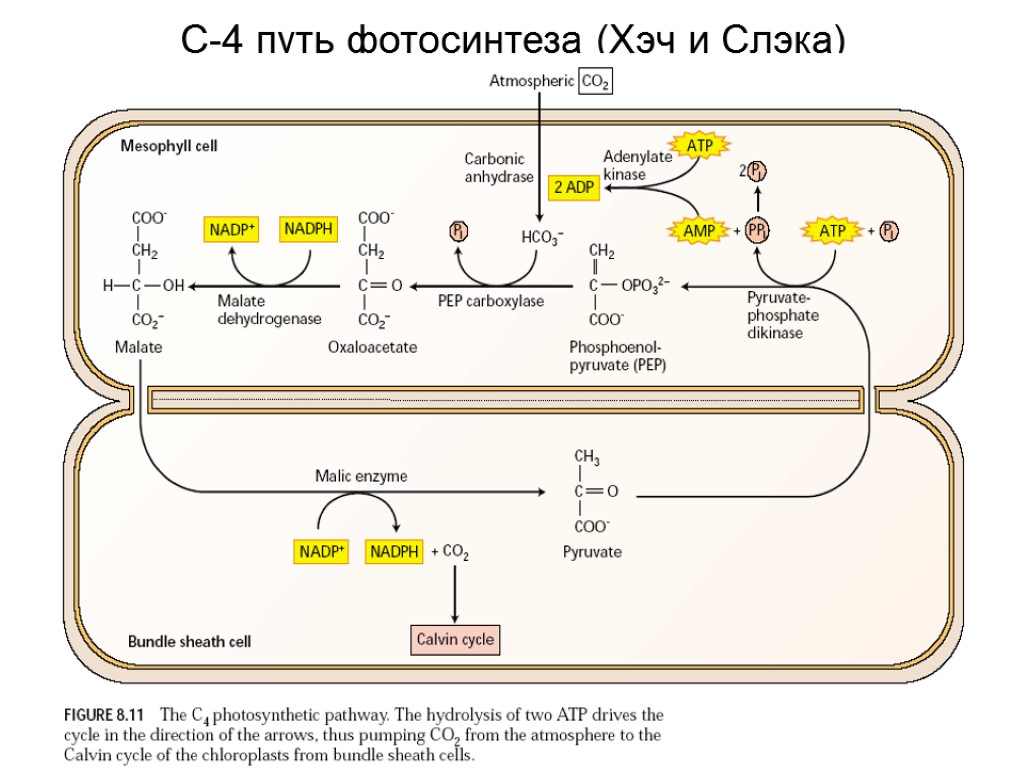
 С-4 путь фотосинтеза (Хэч и Слэка)
С-4 путь фотосинтеза (Хэч и Слэка)

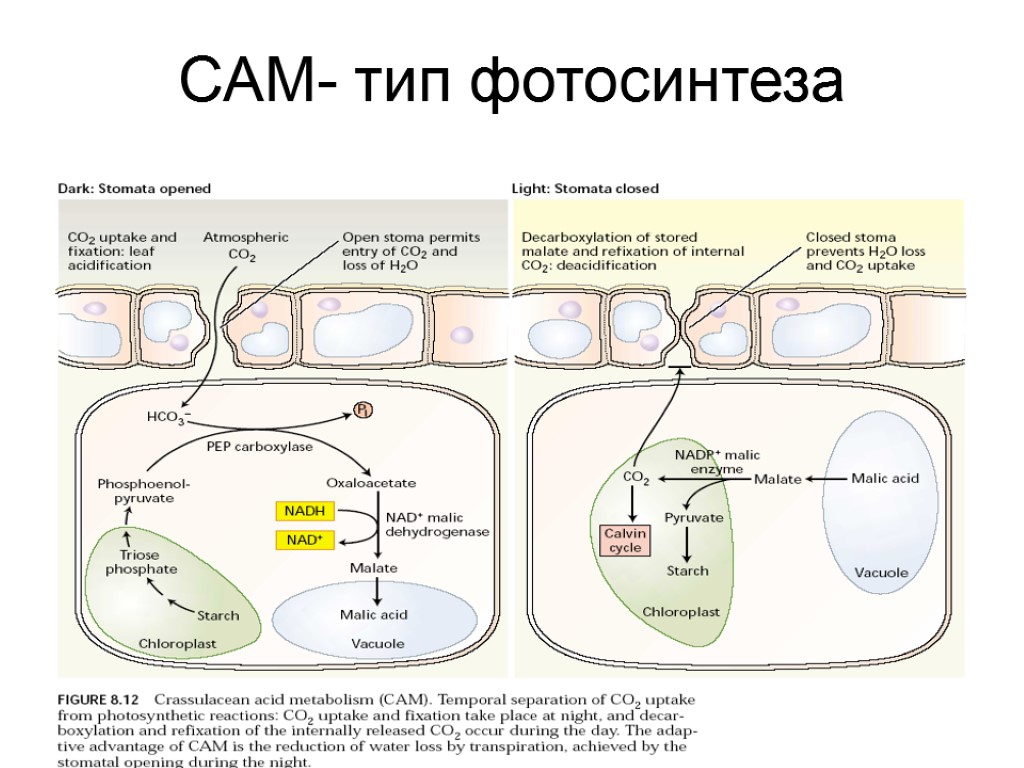
 САМ- тип фотосинтеза
САМ- тип фотосинтеза
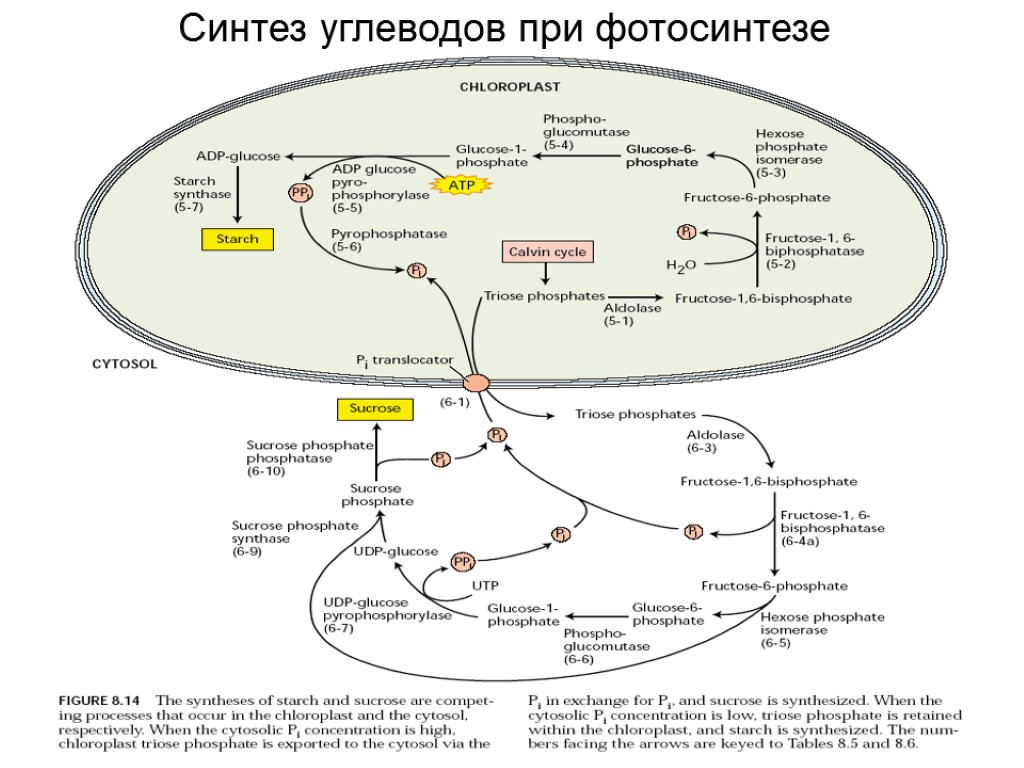
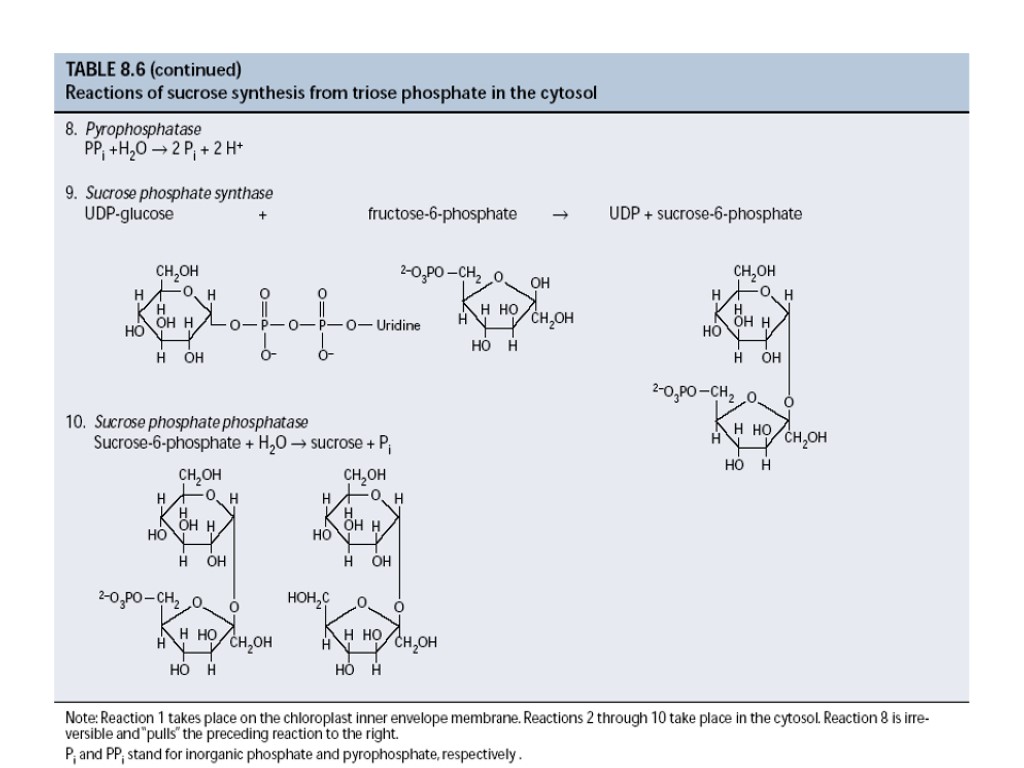
 Синтез углеводов при фотосинтезе
Синтез углеводов при фотосинтезе



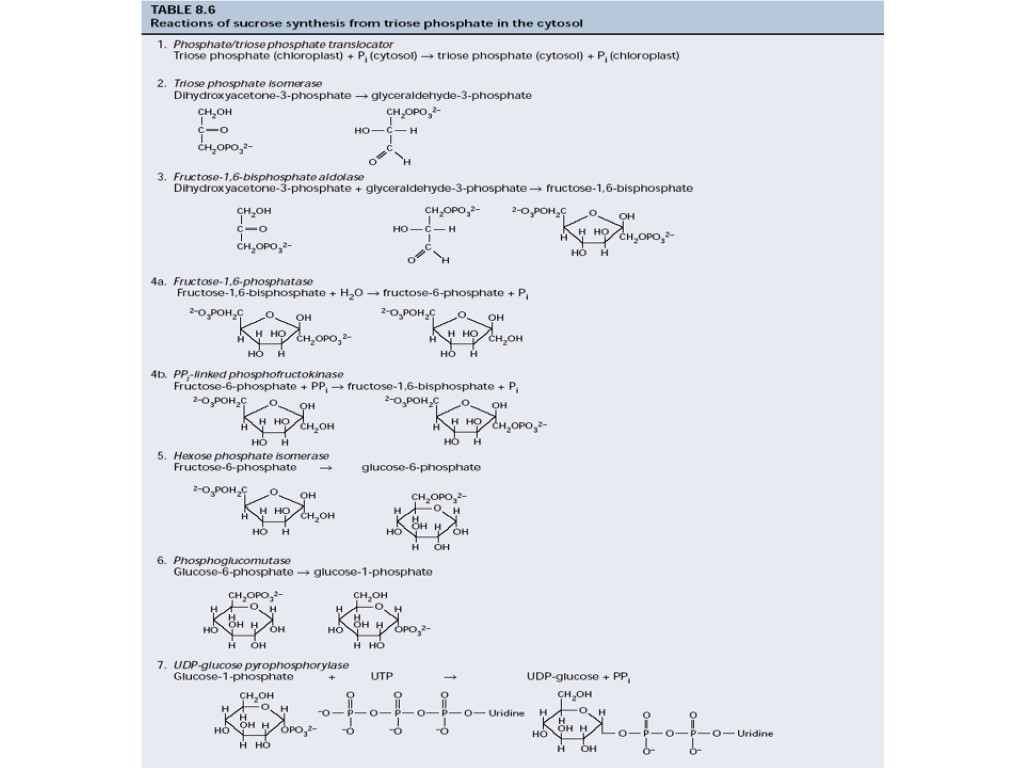
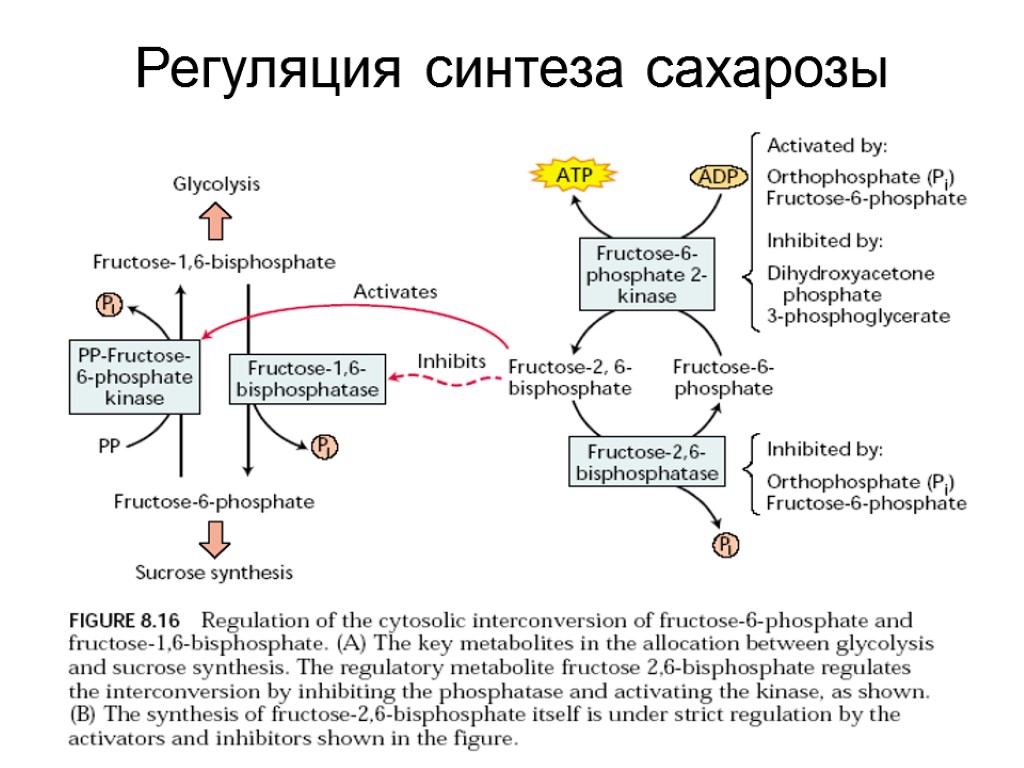
 Регуляция синтеза сахарозы
Регуляция синтеза сахарозы
 Экология фотосинтеза
Экология фотосинтеза
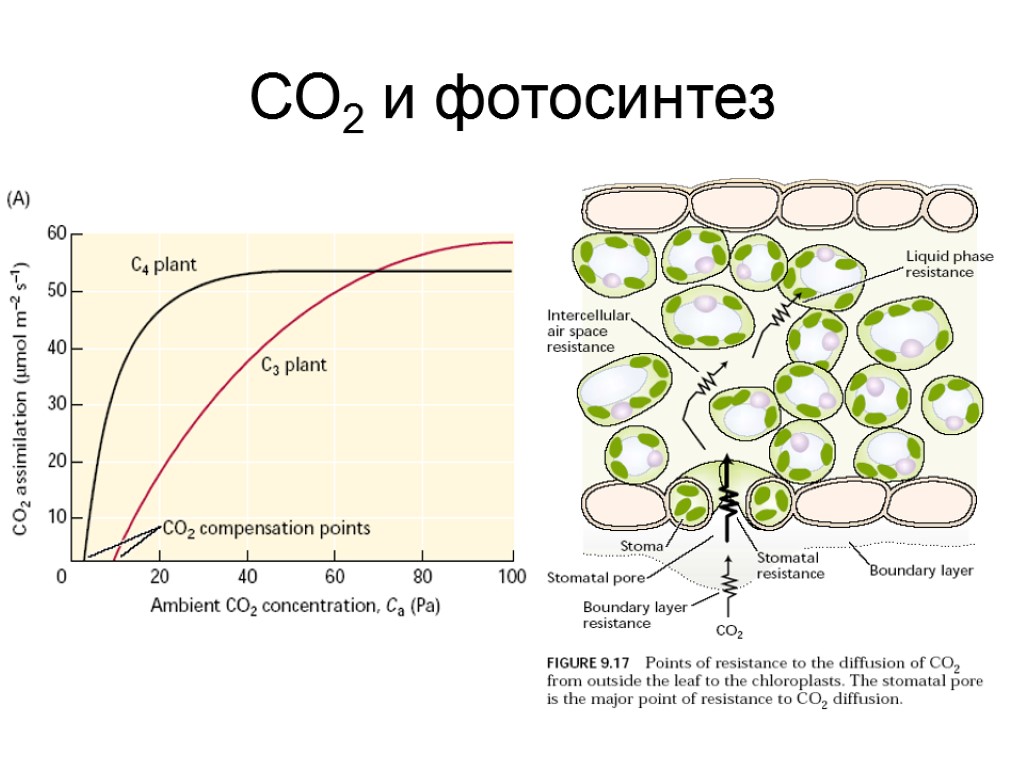
 СО2 и фотосинтез
СО2 и фотосинтез
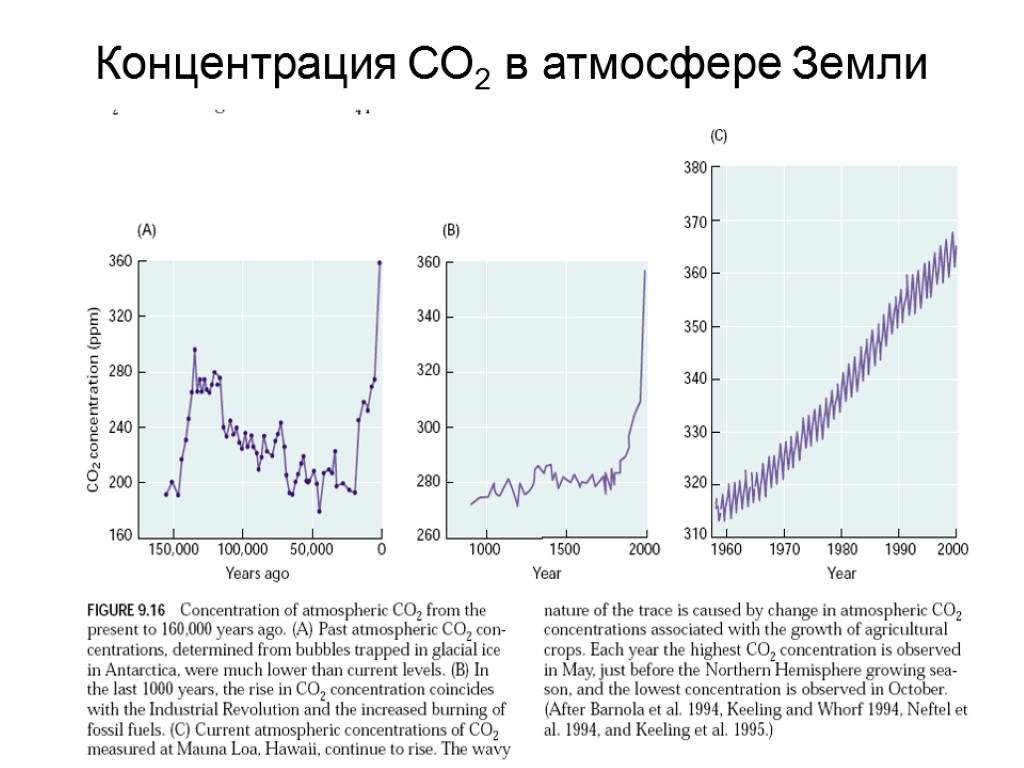
 Концентрация СО2 в атмосфере Земли
Концентрация СО2 в атмосфере Земли
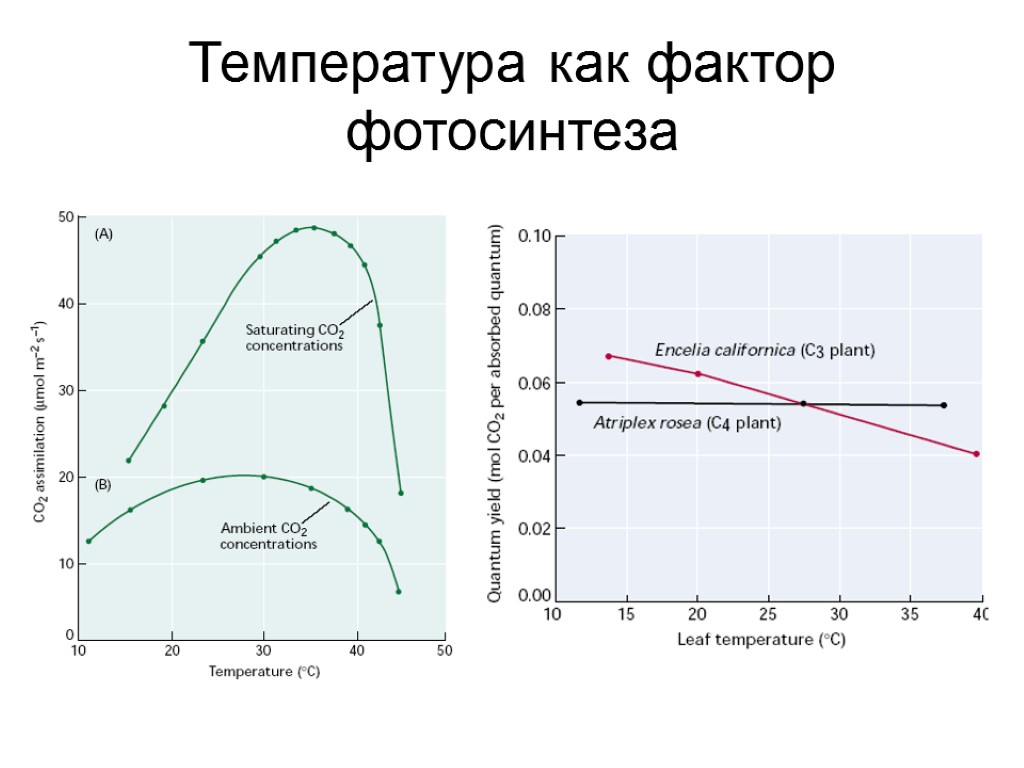
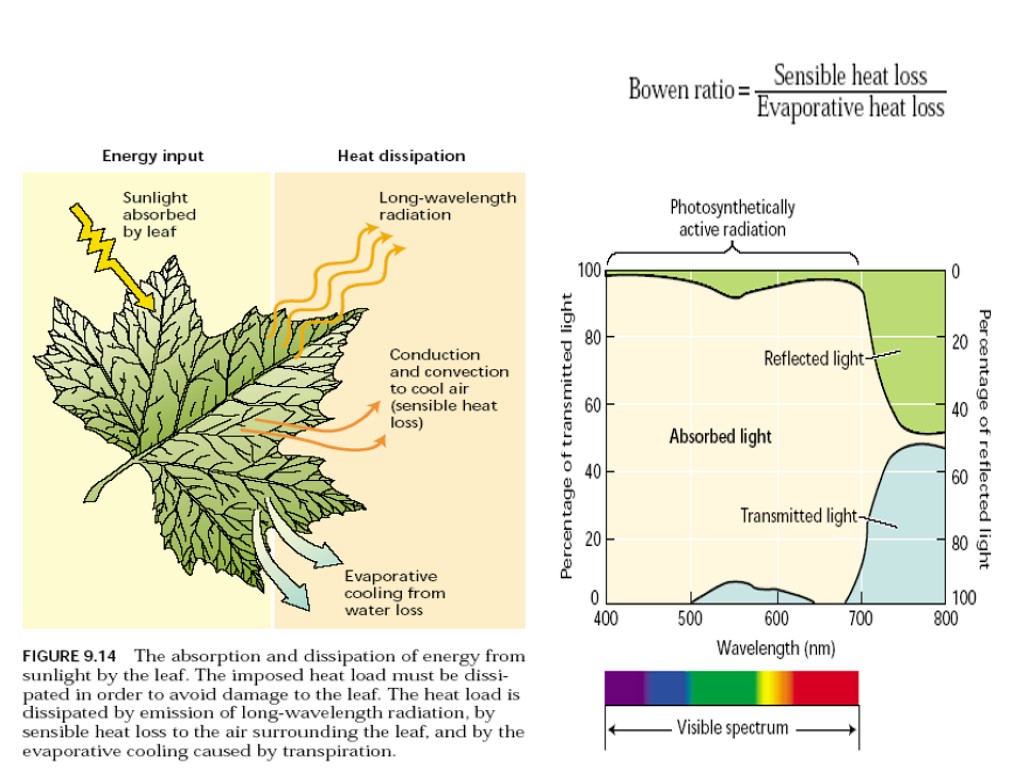
 Температура как фактор фотосинтеза
Температура как фактор фотосинтеза
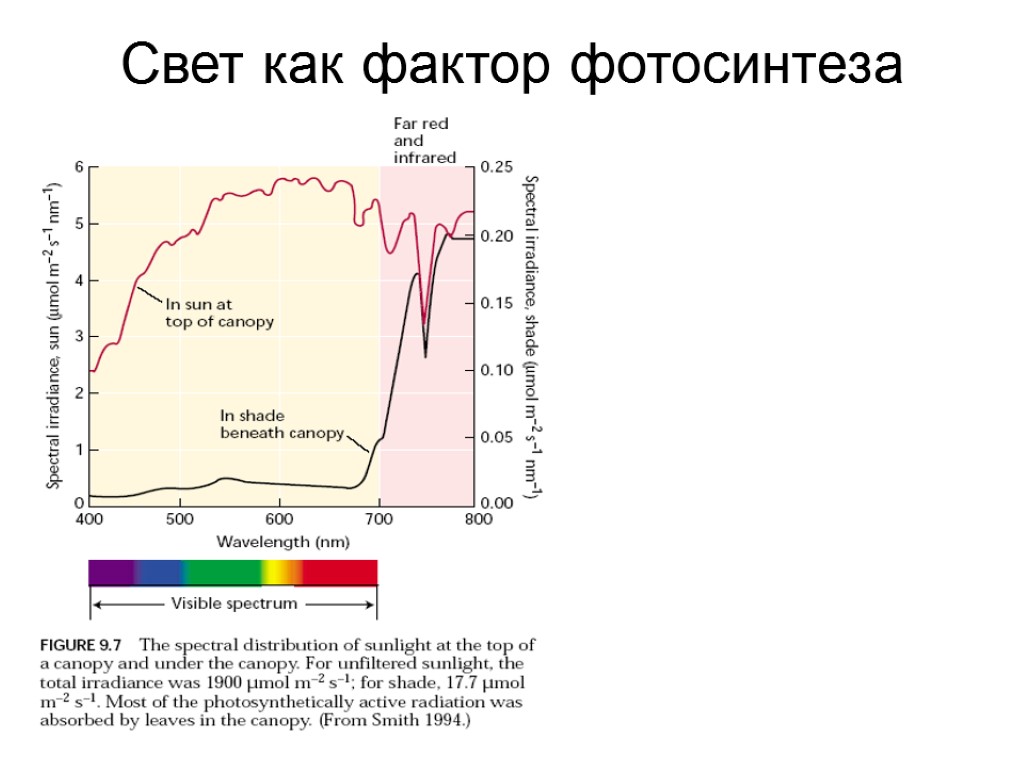
 Свет как фактор фотосинтеза
Свет как фактор фотосинтеза
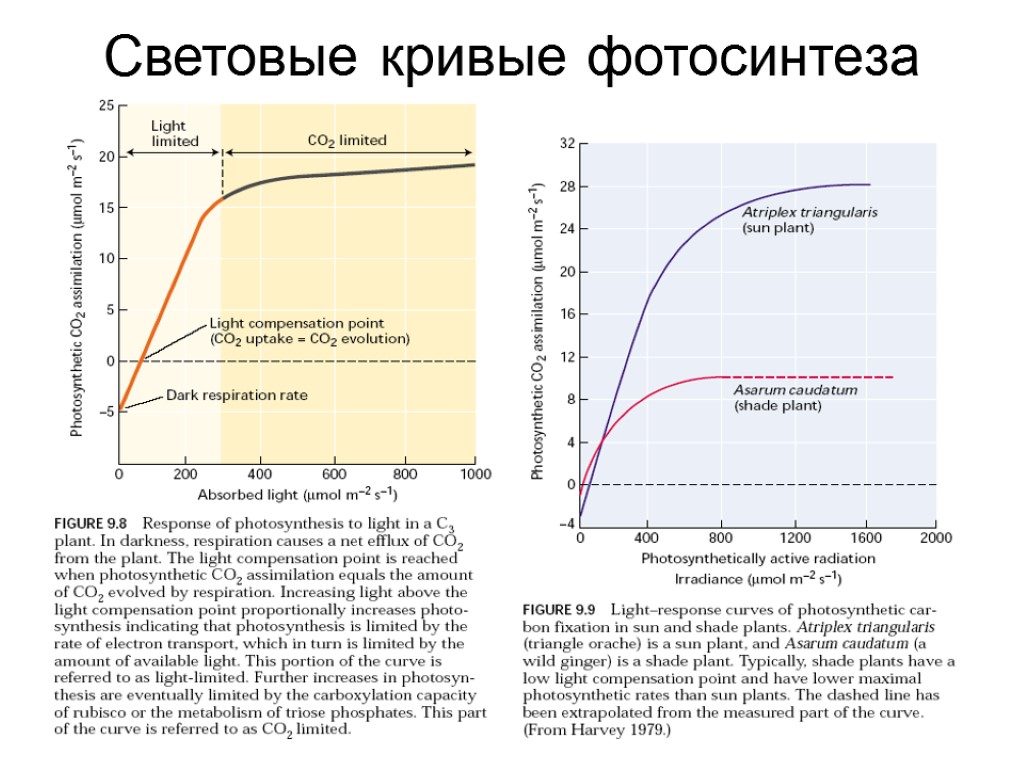
 Световые кривые фотосинтеза
Световые кривые фотосинтеза
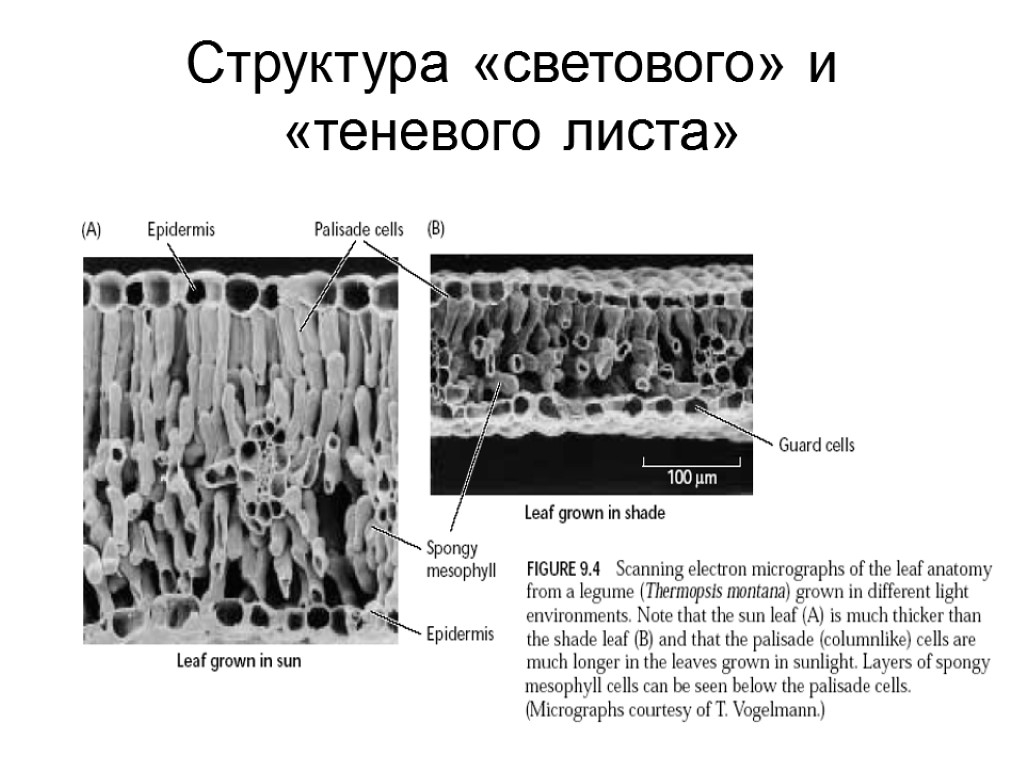
 Структура «светового» и «теневого листа»
Структура «светового» и «теневого листа»
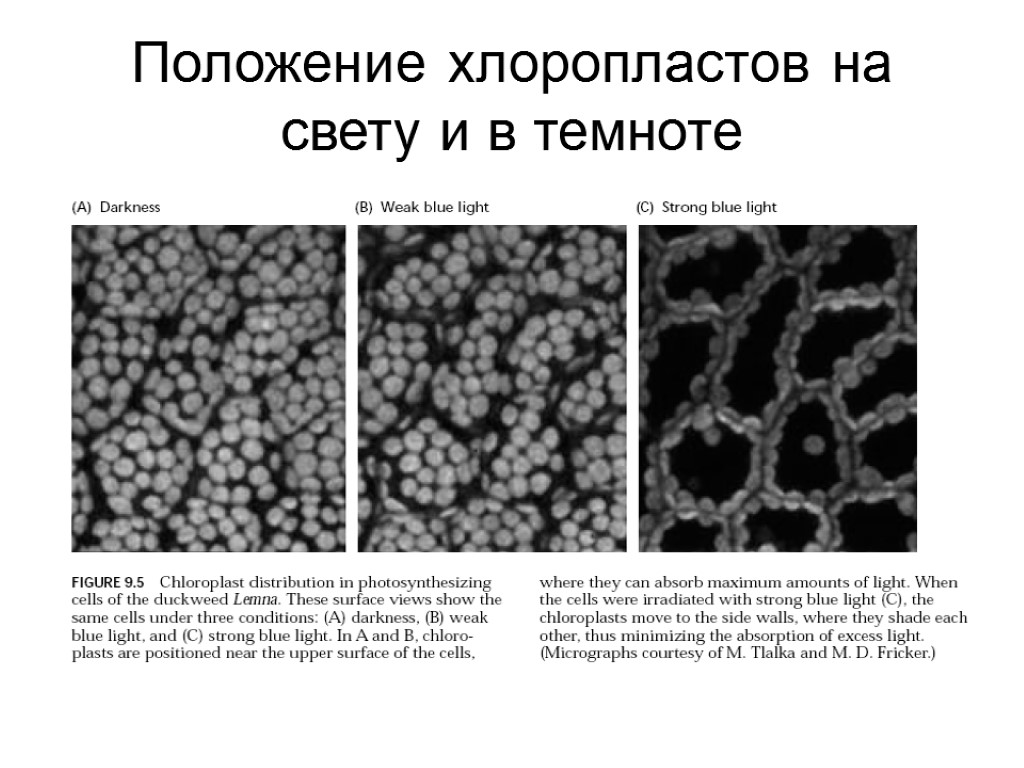
 Положение хлоропластов на свету и в темноте
Положение хлоропластов на свету и в темноте
 Ориентация листьев по отношению к свету
Ориентация листьев по отношению к свету
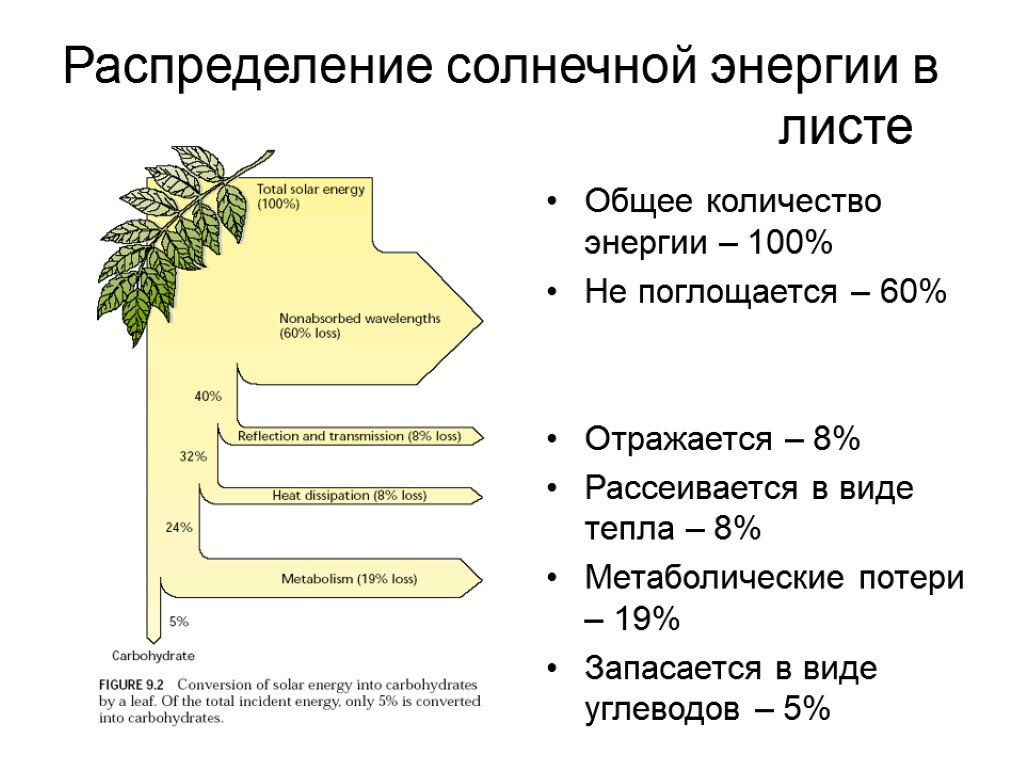
 Распределение солнечной энергии в листе Общее количество энергии – 100% Не поглощается – 60% Отражается – 8% Рассеивается в виде тепла – 8% Метаболические потери – 19% Запасается в виде углеводов – 5%
Распределение солнечной энергии в листе Общее количество энергии – 100% Не поглощается – 60% Отражается – 8% Рассеивается в виде тепла – 8% Метаболические потери – 19% Запасается в виде углеводов – 5%


