 Физика атома, атомного ядра и элементарных частиц 3. (0). Модель водородоподобного атома по теории Бора.
Физика атома, атомного ядра и элементарных частиц 3. (0). Модель водородоподобного атома по теории Бора.
 Водородоподобный атом Водородоподобным называется атом, имеющий один электрон в электронной оболочке. Это атом обычного (легкого) водорода, атом тяжелого водорода (дейтерия), сверхтяжелого водорода (трития), однократно ионизированный атом гелия, двухкратно ионизированный атом лития и т. д.
Водородоподобный атом Водородоподобным называется атом, имеющий один электрон в электронной оболочке. Это атом обычного (легкого) водорода, атом тяжелого водорода (дейтерия), сверхтяжелого водорода (трития), однократно ионизированный атом гелия, двухкратно ионизированный атом лития и т. д.
 Теория Бора Рассмотрим водородоподобный атом, т. е. систему из ядра с зарядом +Ze и одного электрона. При Z=1 это водород, при Z=2 – однократно ионизированный атом гелия, при Z=3 – двукратно ионизированный атом лития и т. д. ). Предположим, что электрон движется вокруг ядра по круговой орбите радиуса r со скоростью v. Приравнивая кулоновскую силу и центробежную силу, находим: (3. 1)
Теория Бора Рассмотрим водородоподобный атом, т. е. систему из ядра с зарядом +Ze и одного электрона. При Z=1 это водород, при Z=2 – однократно ионизированный атом гелия, при Z=3 – двукратно ионизированный атом лития и т. д. ). Предположим, что электрон движется вокруг ядра по круговой орбите радиуса r со скоростью v. Приравнивая кулоновскую силу и центробежную силу, находим: (3. 1)
 Второе соотношение, связывающее радиус орбиты электрона и его скорость дает правило квантования: (3. 2) Решая совместно уравнения (3. 1) и (3. 2), находим радиус орбиты электрона: (3. 3) Суммируя кинетическую и потенциальную энергию электрона, находим его полную энергию:
Второе соотношение, связывающее радиус орбиты электрона и его скорость дает правило квантования: (3. 2) Решая совместно уравнения (3. 1) и (3. 2), находим радиус орбиты электрона: (3. 3) Суммируя кинетическую и потенциальную энергию электрона, находим его полную энергию:
 Водородоподобный атом Итак, радиус n-ой стационарной орбиты и энергия электрона на этой орбите в водородоподобном атоме равны: Например, для водорода r 1 = 0. 53 Å, E 1 = - 13. 6 э. В. Постоянная Ридберга С учетом конечной массы ядра M постоянная Ридберга точно совпадает с экспериментальным значением 109677, 6 см-1
Водородоподобный атом Итак, радиус n-ой стационарной орбиты и энергия электрона на этой орбите в водородоподобном атоме равны: Например, для водорода r 1 = 0. 53 Å, E 1 = - 13. 6 э. В. Постоянная Ридберга С учетом конечной массы ядра M постоянная Ридберга точно совпадает с экспериментальным значением 109677, 6 см-1
 Таким образом, для водородоподобных атомов теория, основанная на постулатах Бора, дает результаты, с высокой точностью совпадающие с экспериментом. Более того, эта теория объясняет даже такой тонкий эффект, как изотопический сдвиг спектральных линий в спектре водородоподобных атомов. Однако попытки объяснить строение и свойства более сложных атомов (например, атома гелия с двумя электронами) приводят к неудаче.
Таким образом, для водородоподобных атомов теория, основанная на постулатах Бора, дает результаты, с высокой точностью совпадающие с экспериментом. Более того, эта теория объясняет даже такой тонкий эффект, как изотопический сдвиг спектральных линий в спектре водородоподобных атомов. Однако попытки объяснить строение и свойства более сложных атомов (например, атома гелия с двумя электронами) приводят к неудаче.
 Теория Бора - это приближенная полуклассическая теория, промежуточный этап в истории создания квантовой физики. Однако благодаря своей простоте эта теория до сих пор используется в тех случаях, когда надо наглядно объяснить какоелибо явление или эффект и получить оценку характерных параметров задачи по порядку величины.
Теория Бора - это приближенная полуклассическая теория, промежуточный этап в истории создания квантовой физики. Однако благодаря своей простоте эта теория до сих пор используется в тех случаях, когда надо наглядно объяснить какоелибо явление или эффект и получить оценку характерных параметров задачи по порядку величины.
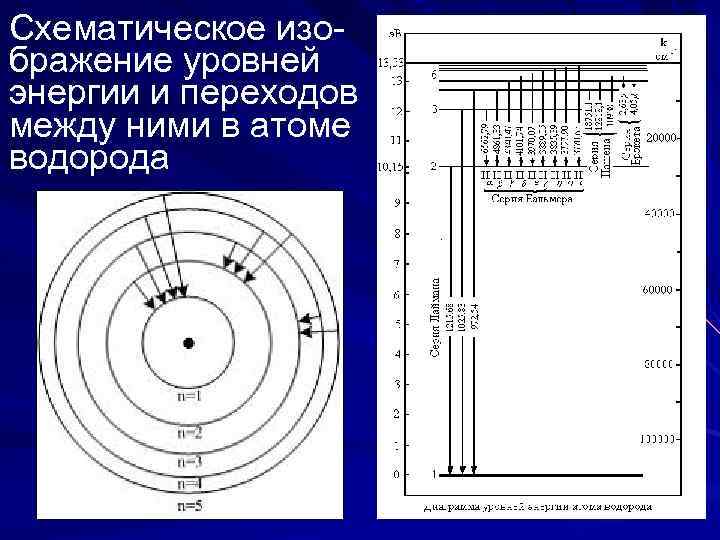 Схематическое изображение уровней энергии и переходов между ними в атоме водорода
Схематическое изображение уровней энергии и переходов между ними в атоме водорода
 Интернет-экзамен На рисунке изображены стационарные орбиты атома водорода согласно модели Бора, а также условно изображены переходы электрона с одной стационарной орбиты на другую, сопровождающиеся излучением кванта энергии. В ультрафиолетовой области спектра эти переходы дают серию Лаймана (Lyman T. ), в видимой – серию Бальмера Balmer J. ), в инфракрасной – серию Пашена (Paschen F. ). Наибольшей частоте кванта в серии Лаймана соответствует переход… ВАРИАНТЫ ОТВЕТОВ: 1) n=2 n=1 2) n=5 n=3 3) n=3 n=2 4) n=5 n=1 РЕШЕНИЕ: Серия Лаймана: переход на уровень n=1. чем больше изменение энергии, тем больше частота излученного кванта. ОТВЕТ: 4.
Интернет-экзамен На рисунке изображены стационарные орбиты атома водорода согласно модели Бора, а также условно изображены переходы электрона с одной стационарной орбиты на другую, сопровождающиеся излучением кванта энергии. В ультрафиолетовой области спектра эти переходы дают серию Лаймана (Lyman T. ), в видимой – серию Бальмера Balmer J. ), в инфракрасной – серию Пашена (Paschen F. ). Наибольшей частоте кванта в серии Лаймана соответствует переход… ВАРИАНТЫ ОТВЕТОВ: 1) n=2 n=1 2) n=5 n=3 3) n=3 n=2 4) n=5 n=1 РЕШЕНИЕ: Серия Лаймана: переход на уровень n=1. чем больше изменение энергии, тем больше частота излученного кванта. ОТВЕТ: 4.
 Интернет-экзамен
Интернет-экзамен
 Интернет-экзамен
Интернет-экзамен