ФІЗИЧНА ХІМІЯ МІЖФАЗНИХ ЯВИЩ Поверхневі явища у конденсованих


















9032-15_surface_phenomena.ppt
- Количество слайдов: 25
 ФІЗИЧНА ХІМІЯ МІЖФАЗНИХ ЯВИЩ Поверхневі явища у конденсованих фазах
ФІЗИЧНА ХІМІЯ МІЖФАЗНИХ ЯВИЩ Поверхневі явища у конденсованих фазах
 Збільшення площі поверхні кулі при збільшенні радіусу r до (r + dr) Збільшення об’єму кулі при збільшенні радіусу r до (r + dr) Загальна зміна поверхневої енергії Робота стиснення (розширення) системи
Збільшення площі поверхні кулі при збільшенні радіусу r до (r + dr) Збільшення об’єму кулі при збільшенні радіусу r до (r + dr) Загальна зміна поверхневої енергії Робота стиснення (розширення) системи
 Загальна зміна поверхневої енергії Робота стиснення (розширення) системи Рівняння Юнга-Лапласа:
Загальна зміна поверхневої енергії Робота стиснення (розширення) системи Рівняння Юнга-Лапласа:
 Рівняння Юнга-Лапласа: Для несферичних тіл: Для циліндру радіуса r: r1 = r, r2 = ∞:
Рівняння Юнга-Лапласа: Для несферичних тіл: Для циліндру радіуса r: r1 = r, r2 = ∞:
 Метод сталагмометрії При відриві краплини:
Метод сталагмометрії При відриві краплини:
 Капілярне підняття рідини (R – радіус капіляра, r – радіус кривизни, - кут змочування) Капілярне підняття (а) та опущення (б) При повному змочуванні = 0 та cos = 1 Для ртуті = 465·10-3 Дж/м2 при 450 атм: входження у пори ~ 15 нм
Капілярне підняття рідини (R – радіус капіляра, r – радіус кривизни, - кут змочування) Капілярне підняття (а) та опущення (б) При повному змочуванні = 0 та cos = 1 Для ртуті = 465·10-3 Дж/м2 при 450 атм: входження у пори ~ 15 нм
 Збільшення тиску насиченої пари над рідиною Додатковий тиск на поверхню рідини веде до збільшення тиску насиченої пари над рідиною: Vm - мольний об'єм конденсованої фази Для плоскої поверхні r1 = r2 = ∞ і P = 0 У випадку випуклого меніску за рахунок кривизни поверхні виникає так званий “тиск Лапласа” згідно до рівняння Юнга-Лапласа: Рівняння Томсона (Кельвіна): pn – тиск насиченої пари над випуклою поверхнею
Збільшення тиску насиченої пари над рідиною Додатковий тиск на поверхню рідини веде до збільшення тиску насиченої пари над рідиною: Vm - мольний об'єм конденсованої фази Для плоскої поверхні r1 = r2 = ∞ і P = 0 У випадку випуклого меніску за рахунок кривизни поверхні виникає так званий “тиск Лапласа” згідно до рівняння Юнга-Лапласа: Рівняння Томсона (Кельвіна): pn – тиск насиченої пари над випуклою поверхнею
 При r = 10-6 м pn/p0 = 1,001 Рівняння Томсона (Кельвіна): Підвищення тиску насиченої пари над малими краплинами призводить до агрегації рідини у великі краплі (атмосферні осади, перегонка) При r = 10-7 м pn/p0 = 1,011 При r = 10-8 м pn/p0 = 1,114 Для ввігнутих менісків рідин:
При r = 10-6 м pn/p0 = 1,001 Рівняння Томсона (Кельвіна): Підвищення тиску насиченої пари над малими краплинами призводить до агрегації рідини у великі краплі (атмосферні осади, перегонка) При r = 10-7 м pn/p0 = 1,011 При r = 10-8 м pn/p0 = 1,114 Для ввігнутих менісків рідин:
 Рівновага між поверхневим шаром та об'ємом для багатокомпонентної гомогенної конденсованої системи xi – мольна частка компонента в об'ємі; yi – мольна частка компонента в поверхневому шарі Хімічний потенціал у поверхневому шарі відрізняється від хімічного потенціалу в об'ємі на величину роботи утворення поверхні:
Рівновага між поверхневим шаром та об'ємом для багатокомпонентної гомогенної конденсованої системи xi – мольна частка компонента в об'ємі; yi – мольна частка компонента в поверхневому шарі Хімічний потенціал у поверхневому шарі відрізняється від хімічного потенціалу в об'ємі на величину роботи утворення поверхні:
 Рівновага між поверхневим шаром та об'ємом для багатокомпонентної гомогенної конденсованої системи xi – мольна частка компонента в об'ємі; yi – мольна частка компонента в поверхневому шарі Вираз для поверхневої енергії гомогенної конденсованої фази Міняємо знаки
Рівновага між поверхневим шаром та об'ємом для багатокомпонентної гомогенної конденсованої системи xi – мольна частка компонента в об'ємі; yi – мольна частка компонента в поверхневому шарі Вираз для поверхневої енергії гомогенної конденсованої фази Міняємо знаки
 Рівновага між поверхневим шаром та об'ємом для багатокомпонентної гомогенної конденсованої системи Двокомпонентна система з частинками, що не дуже відрізняються за розмірами (1 = 2 = та A1 = A2 = A)
Рівновага між поверхневим шаром та об'ємом для багатокомпонентної гомогенної конденсованої системи Двокомпонентна система з частинками, що не дуже відрізняються за розмірами (1 = 2 = та A1 = A2 = A)
 Рівновага між поверхневим шаром та об'ємом для багатокомпонентної гомогенної конденсованої системи
Рівновага між поверхневим шаром та об'ємом для багатокомпонентної гомогенної конденсованої системи
 Рівновага між поверхневим шаром та об'ємом для багатокомпонентної гомогенної конденсованої системи
Рівновага між поверхневим шаром та об'ємом для багатокомпонентної гомогенної конденсованої системи
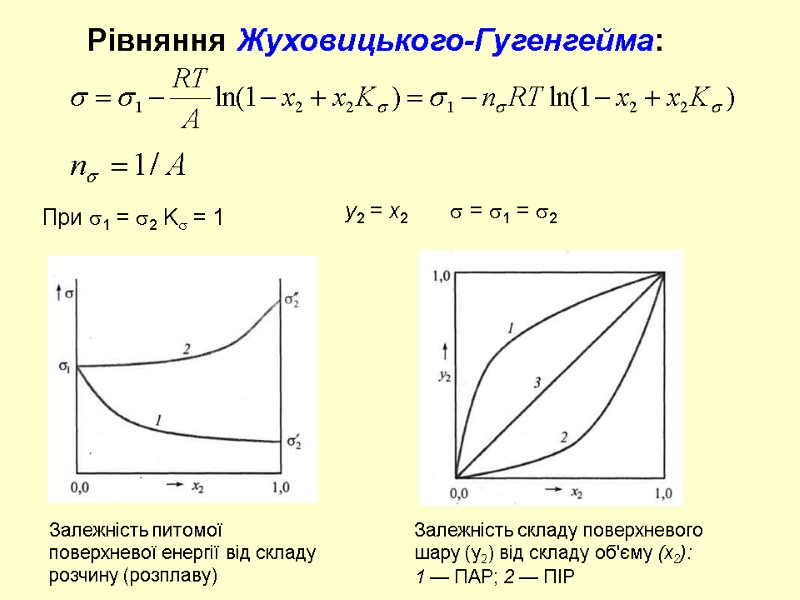
 Рівняння Жуховицького-Гугенгейма: При 1 = 2 K = 1 y2 = x2 = 1 = 2 Залежність питомої поверхневої енергії від складу розчину (розплаву) Залежність складу поверхневого шару (у2) від складу об'єму (х2): 1 — ПАР; 2 — ПІР
Рівняння Жуховицького-Гугенгейма: При 1 = 2 K = 1 y2 = x2 = 1 = 2 Залежність питомої поверхневої енергії від складу розчину (розплаву) Залежність складу поверхневого шару (у2) від складу об'єму (х2): 1 — ПАР; 2 — ПІР
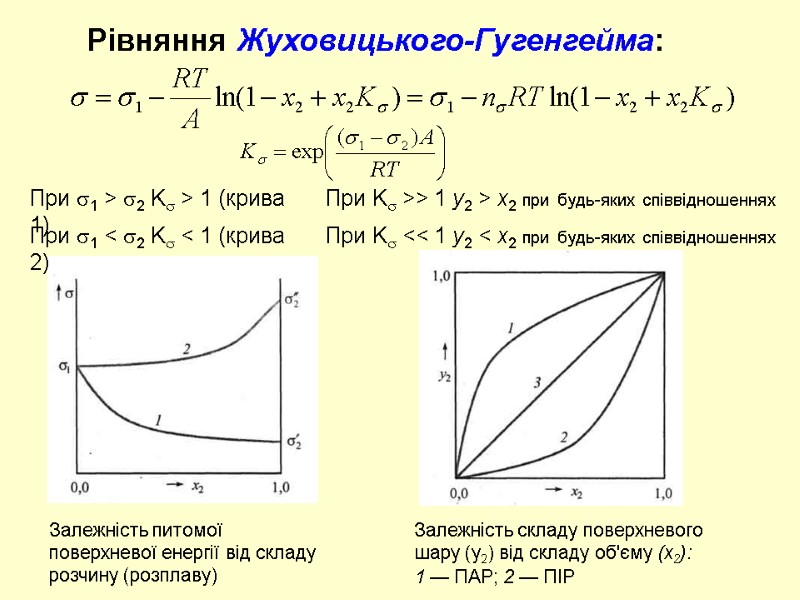
 Рівняння Жуховицького-Гугенгейма: При 1 > 2 K > 1 (крива 1) Залежність питомої поверхневої енергії від складу розчину (розплаву) Залежність складу поверхневого шару (у2) від складу об'єму (х2): 1 — ПАР; 2 — ПІР При K >> 1 y2 > x2 при будь-яких співвідношеннях При 1 < 2 K < 1 (крива 2) При K << 1 y2 < x2 при будь-яких співвідношеннях
Рівняння Жуховицького-Гугенгейма: При 1 > 2 K > 1 (крива 1) Залежність питомої поверхневої енергії від складу розчину (розплаву) Залежність складу поверхневого шару (у2) від складу об'єму (х2): 1 — ПАР; 2 — ПІР При K >> 1 y2 > x2 при будь-яких співвідношеннях При 1 < 2 K < 1 (крива 2) При K << 1 y2 < x2 при будь-яких співвідношеннях
 При K << 1 Рівняння Жуховицького-Гугенгейма: При малих x2 Критерій Жуховицького для ПАР
При K << 1 Рівняння Жуховицького-Гугенгейма: При малих x2 Критерій Жуховицького для ПАР
 Рівняння для ПАР у розведених розчинах Рівняння Ленгмюра для адсорбції: Рівняння Шишковського для поверхневого натягу:
Рівняння для ПАР у розведених розчинах Рівняння Ленгмюра для адсорбції: Рівняння Шишковського для поверхневого натягу:
 Поверхнева енергія твердих тіл Для монокристалів є анізотропною величиною Для кубічної гранецентрованої гратки: Для кубічної об’ємноцентрованої гратки:
Поверхнева енергія твердих тіл Для монокристалів є анізотропною величиною Для кубічної гранецентрованої гратки: Для кубічної об’ємноцентрованої гратки:
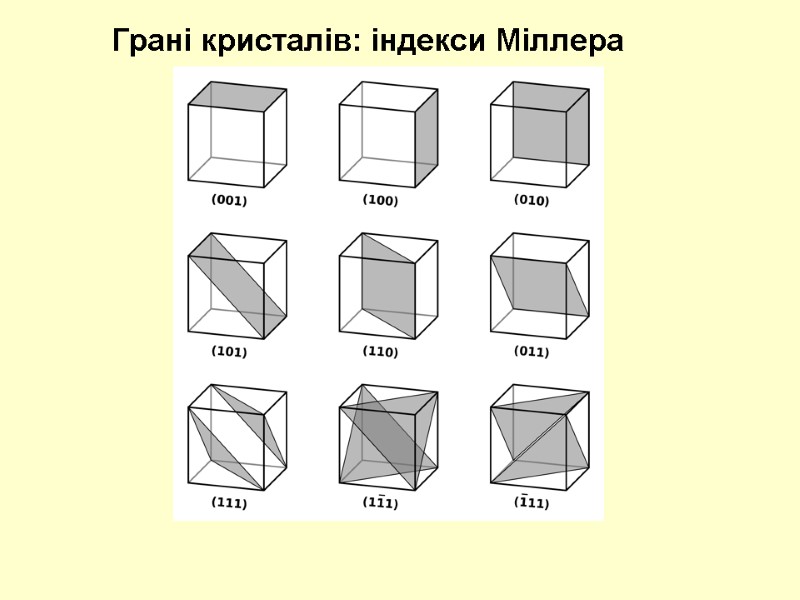
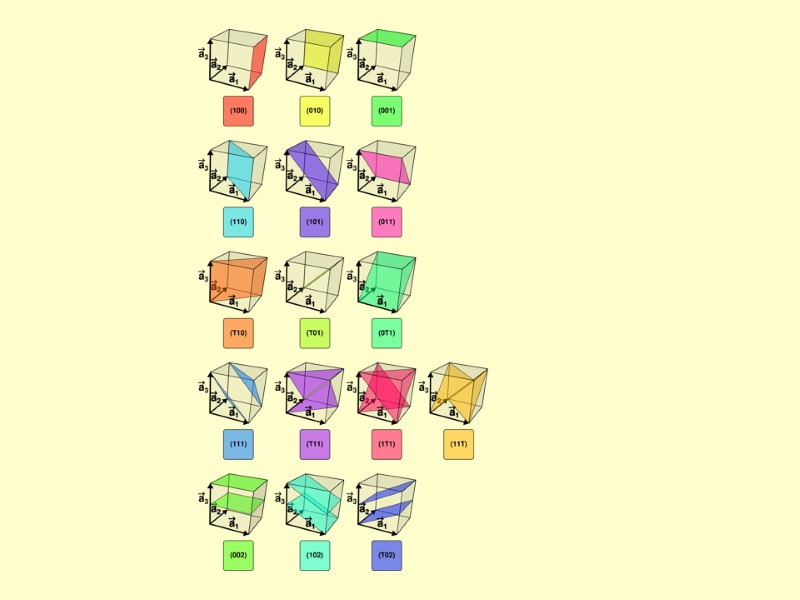
 Грані кристалів: індекси Міллера
Грані кристалів: індекси Міллера
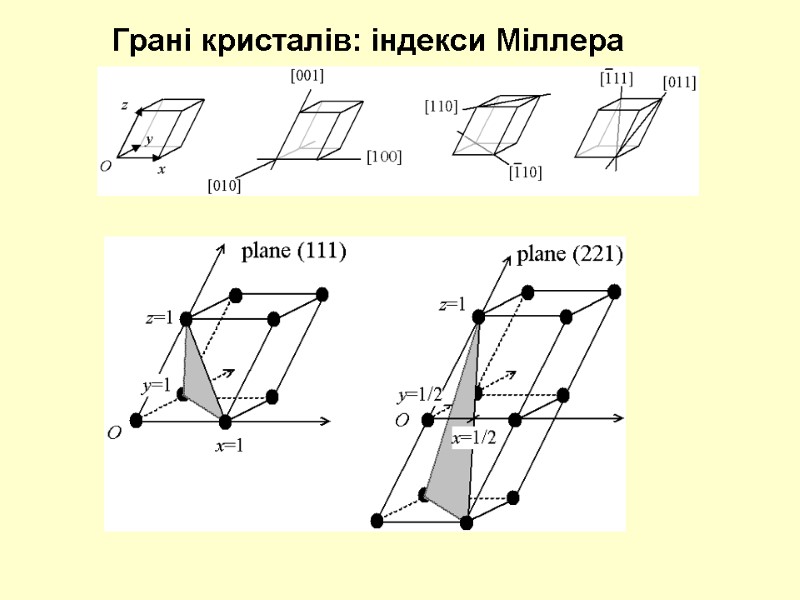
 Грані кристалів: індекси Міллера
Грані кристалів: індекси Міллера

 Принцип мінімуму вільної енергії Гіббса-Кюрі для монокристалів i - поверхнева енергія i-ї грані, Si – її площина при
Принцип мінімуму вільної енергії Гіббса-Кюрі для монокристалів i - поверхнева енергія i-ї грані, Si – її площина при
 Теорема Вульфа hi - висота перпендикуляру, що опущений з центру кристалізації на i-ту грань монокристала Грані з малими значеннями i розташовані у безпосередній близькості до центрів кристалізації і отримують максимальний розвиток.
Теорема Вульфа hi - висота перпендикуляру, що опущений з центру кристалізації на i-ту грань монокристала Грані з малими значеннями i розташовані у безпосередній близькості до центрів кристалізації і отримують максимальний розвиток.
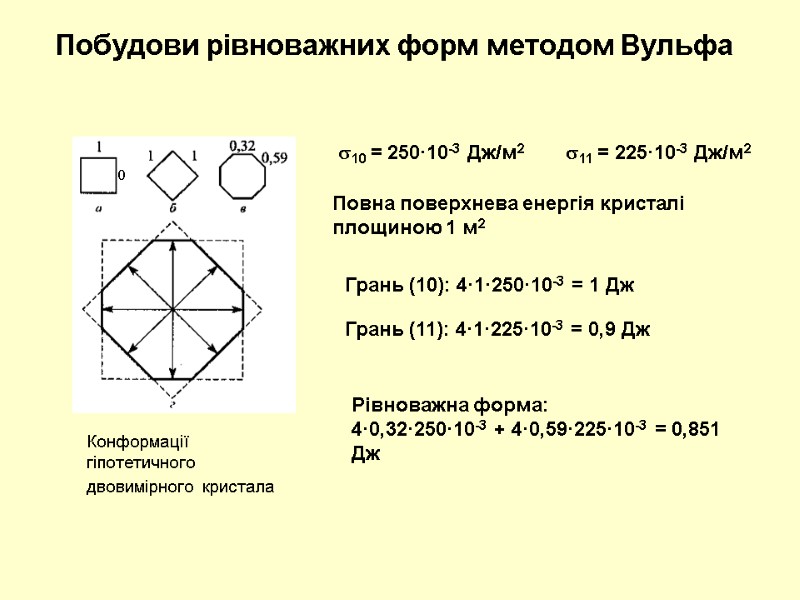
 Конформації гіпотетичного двовимірного кристала Побудови рівноважних форм методом Вульфа 10 = 250·10-3 Дж/м2 11 = 225·10-3 Дж/м2 Повна поверхнева енергія кристалі площиною 1 м2 Грань (10): 4·1·250·10-3 = 1 Дж 0 Грань (11): 4·1·225·10-3 = 0,9 Дж Рівноважна форма: 4·0,32·250·10-3 + 4·0,59·225·10-3 = 0,851 Дж
Конформації гіпотетичного двовимірного кристала Побудови рівноважних форм методом Вульфа 10 = 250·10-3 Дж/м2 11 = 225·10-3 Дж/м2 Повна поверхнева енергія кристалі площиною 1 м2 Грань (10): 4·1·250·10-3 = 1 Дж 0 Грань (11): 4·1·225·10-3 = 0,9 Дж Рівноважна форма: 4·0,32·250·10-3 + 4·0,59·225·10-3 = 0,851 Дж
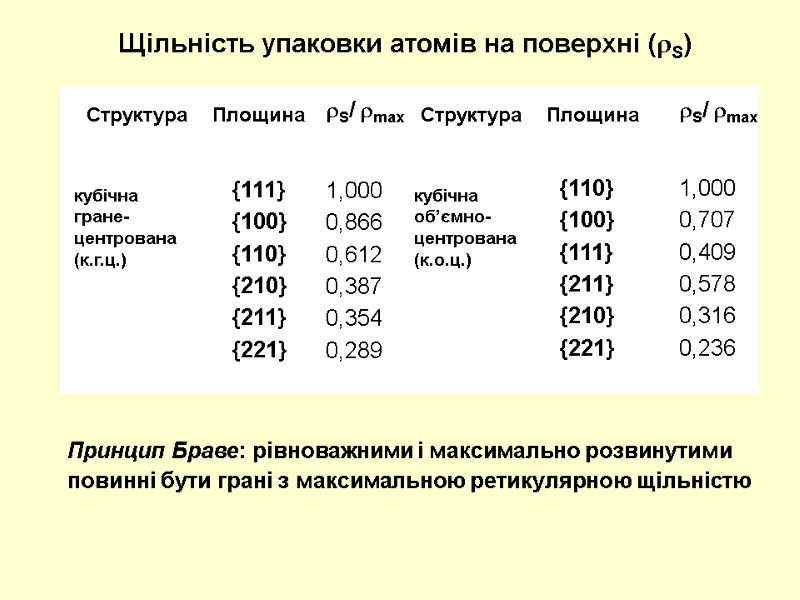
 Щільність упаковки атомів на поверхні (S) Структура Площина Структура Площина S/ max S/ max кубічна гране-центрована (к.г.ц.) кубічна об’ємно-центрована (к.о.ц.) {111} {100} {110} {210} {211} {221} {110} {100} {111} {211} {210} {221} 1,000 0,866 0,612 0,387 0,354 0,289 1,000 0,707 0,409 0,578 0,316 0,236 Принцип Браве: рівноважними і максимально розвинутими повинні бути грані з максимальною ретикулярною щільністю
Щільність упаковки атомів на поверхні (S) Структура Площина Структура Площина S/ max S/ max кубічна гране-центрована (к.г.ц.) кубічна об’ємно-центрована (к.о.ц.) {111} {100} {110} {210} {211} {221} {110} {100} {111} {211} {210} {221} 1,000 0,866 0,612 0,387 0,354 0,289 1,000 0,707 0,409 0,578 0,316 0,236 Принцип Браве: рівноважними і максимально розвинутими повинні бути грані з максимальною ретикулярною щільністю
