Фазовий стан речовини Агрегатний стан За звичайних умов


























27070-fazovy_stan_rechovini.ppt
- Количество слайдов: 30
 Фазовий стан речовини
Фазовий стан речовини
 Агрегатний стан За звичайних умов у більшості випадків атоми, молекули і іони існують у вигляді більш високої організації речовини, яка називається агрегатним станом. Залежно від відстані між частинками і енергії їх взаємодії речовини можуть існувати в газовому стані, рідкому або твердому стані. Твердий і рідкий стан об'єднують під загальною назвою – конденсований стан.
Агрегатний стан За звичайних умов у більшості випадків атоми, молекули і іони існують у вигляді більш високої організації речовини, яка називається агрегатним станом. Залежно від відстані між частинками і енергії їх взаємодії речовини можуть існувати в газовому стані, рідкому або твердому стані. Твердий і рідкий стан об'єднують під загальною назвою – конденсований стан.
 Газовий стан – характеризується тим, що відстані між частинками значно перевищують їх розміри, а їх середня кінетична енергія значно більша від середньої потенціальної енергії взаємного притягування (Екін>>Епот). Сили взаємодії частинок газу є недостатніми для утримання їх одна біля одної, тому всі гази, особливо за низького тиску та за підвищених температур поводять себе приблизно однаково, їх стан описується законами ідеальних газів, для яких нехтують силами міжмолекулярної взаємодії.
Газовий стан – характеризується тим, що відстані між частинками значно перевищують їх розміри, а їх середня кінетична енергія значно більша від середньої потенціальної енергії взаємного притягування (Екін>>Епот). Сили взаємодії частинок газу є недостатніми для утримання їх одна біля одної, тому всі гази, особливо за низького тиску та за підвищених температур поводять себе приблизно однаково, їх стан описується законами ідеальних газів, для яких нехтують силами міжмолекулярної взаємодії.
 Рідкий стан – утворюється при конденсації газів або при плавленні твердих речовин. Його можна характеризувати приблизною відповідністю середніх значень кінетичної і потенціальної енергії часток (Екін~Епот). Сили взаємодії частинок є достатніми, щоб перешкодити їх безладному рухові, але недостатні для припинення переміщення частинок одна відносно одної. Подібно до твердих речовин, рідкі мають певну структуру, яка поширюється лише на найближче оточення даної частинки, таким чином, структура рідини має ближній порядок.
Рідкий стан – утворюється при конденсації газів або при плавленні твердих речовин. Його можна характеризувати приблизною відповідністю середніх значень кінетичної і потенціальної енергії часток (Екін~Епот). Сили взаємодії частинок є достатніми, щоб перешкодити їх безладному рухові, але недостатні для припинення переміщення частинок одна відносно одної. Подібно до твердих речовин, рідкі мають певну структуру, яка поширюється лише на найближче оточення даної частинки, таким чином, структура рідини має ближній порядок.
 Часто рідини застосовуються як розчинники. Залежно від властивостей молекул рідини можуть бути полярними й неполярними розчинниками. Хорошими іонізуючими розчинниками є рідини, які складаються з полярних молекул (вода, рідкий аміак, деякі спирти). У рідинах, утворених неполярними молекулами краще розчиняються неполярні речовини.
Часто рідини застосовуються як розчинники. Залежно від властивостей молекул рідини можуть бути полярними й неполярними розчинниками. Хорошими іонізуючими розчинниками є рідини, які складаються з полярних молекул (вода, рідкий аміак, деякі спирти). У рідинах, утворених неполярними молекулами краще розчиняються неполярні речовини.
 Твердий стан –характеризується тим, що в ньому відстані між частинками близькі до розмірів самих частинок, а середня потенційна енергія притягання між ними значно більша за їх середню кінетичну енергію (Екін>>Епот). Сили, що діють між ними, утримують частинки у стані рівноваги, за рахунок чого тверді речовини мають певні форми. Тверді речовини можуть бути кристалічними або аморфними.
Твердий стан –характеризується тим, що в ньому відстані між частинками близькі до розмірів самих частинок, а середня потенційна енергія притягання між ними значно більша за їх середню кінетичну енергію (Екін>>Епот). Сили, що діють між ними, утримують частинки у стані рівноваги, за рахунок чого тверді речовини мають певні форми. Тверді речовини можуть бути кристалічними або аморфними.
 Кристалічний стан Кристалічні тверді речовини мають упорядковану просторову структуру, в якій складові частинки (атоми, молекули, іони) суворо чергуються в трьохмірному просторі, відзначаються дальнім порядком і певними геометричними формами. У кристалах розміщення частинок зображують у вигляді кристалічної гратки. Вона являє собою просторовий каркас, який утворюють уявні прямі, що перетинаються. Точки перетину – це вузли гратки в яких перебувають центри частинок що складають кристал.
Кристалічний стан Кристалічні тверді речовини мають упорядковану просторову структуру, в якій складові частинки (атоми, молекули, іони) суворо чергуються в трьохмірному просторі, відзначаються дальнім порядком і певними геометричними формами. У кристалах розміщення частинок зображують у вигляді кристалічної гратки. Вона являє собою просторовий каркас, який утворюють уявні прямі, що перетинаються. Точки перетину – це вузли гратки в яких перебувають центри частинок що складають кристал.
 Кількість частинок у найближчому оточенні відносно тієї частинки, що розглядається, називається координаційним числом. Найчастіше координаційні числа кристалів дорівнюють 4, 6, 8, 12. Координаційне число й стала гратки (відстані між вузлами гратки) є важливими характеристиками кристала. Наука про кристали називається кристалографією. Одним із найважливіших її законів є закон сталості двохгранних кутів: У всіх кристалах однієї й тієї самої речовини кути між відповідними гранями однакові.
Кількість частинок у найближчому оточенні відносно тієї частинки, що розглядається, називається координаційним числом. Найчастіше координаційні числа кристалів дорівнюють 4, 6, 8, 12. Координаційне число й стала гратки (відстані між вузлами гратки) є важливими характеристиками кристала. Наука про кристали називається кристалографією. Одним із найважливіших її законів є закон сталості двохгранних кутів: У всіх кристалах однієї й тієї самої речовини кути між відповідними гранями однакові.
 Класифікація кристалічних форм
Класифікація кристалічних форм
 Кристали класифікують за особливостями їх симетрії. Симетричні фігури мають один або кілька елементів симетрії – центр, осі, площини. Центр симетрії – це точка в середині кристала, яка поділяє навпіл усяку пряму, що через неї проходить і перетинає грані фігури. Площина симетрії поділяє фігуру кристала на дві половини, кожна з яких віддзеркалює одна одну. Вісь симетрії – це уявна пряма, при обертанні навколо якої кристала на 3600 фігура збігається сама з собою n разів. Число n називається порядком осі. Вісь першого порядку називається віссю інверсії, її має всяка фігура.
Кристали класифікують за особливостями їх симетрії. Симетричні фігури мають один або кілька елементів симетрії – центр, осі, площини. Центр симетрії – це точка в середині кристала, яка поділяє навпіл усяку пряму, що через неї проходить і перетинає грані фігури. Площина симетрії поділяє фігуру кристала на дві половини, кожна з яких віддзеркалює одна одну. Вісь симетрії – це уявна пряма, при обертанні навколо якої кристала на 3600 фігура збігається сама з собою n разів. Число n називається порядком осі. Вісь першого порядку називається віссю інверсії, її має всяка фігура.
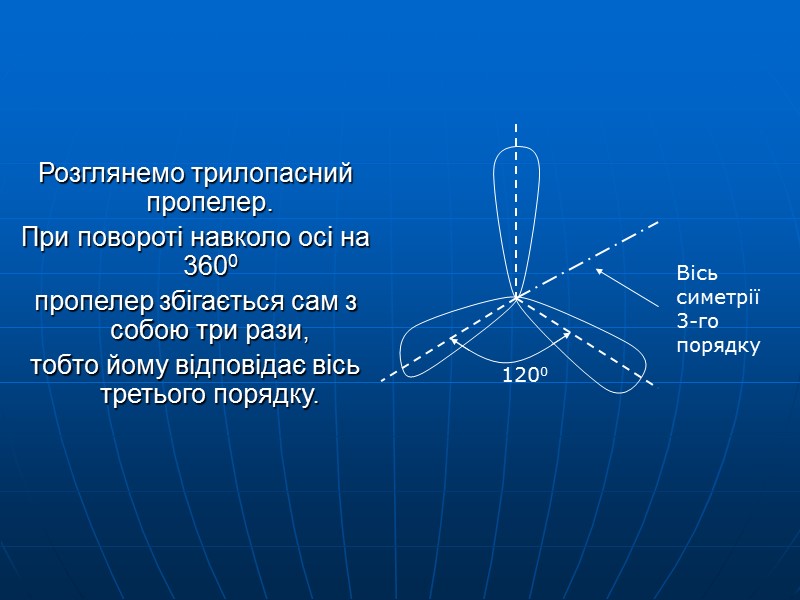
 Розглянемо трилопасний пропелер. При повороті навколо осі на 3600 пропелер збігається сам з собою три рази, тобто йому відповідає вісь третього порядку.
Розглянемо трилопасний пропелер. При повороті навколо осі на 3600 пропелер збігається сам з собою три рази, тобто йому відповідає вісь третього порядку.
 Одній і тій самій фігурі можуть відповідати осі різного порядку. Чим більше елементів симетрії має фігура тим вищою симетріею вона характерезується. Для кристалічних форм можливим є 32 види симетрії, яким відповідають 32 класи кристалів. Останні поділяють на шість кристалографічних систем, або сингоній. Причетність кристалів до певної кристалографічної системи пов`язують з кількістю і характером кристалографічних осей і кутів між ними.
Одній і тій самій фігурі можуть відповідати осі різного порядку. Чим більше елементів симетрії має фігура тим вищою симетріею вона характерезується. Для кристалічних форм можливим є 32 види симетрії, яким відповідають 32 класи кристалів. Останні поділяють на шість кристалографічних систем, або сингоній. Причетність кристалів до певної кристалографічної системи пов`язують з кількістю і характером кристалографічних осей і кутів між ними.





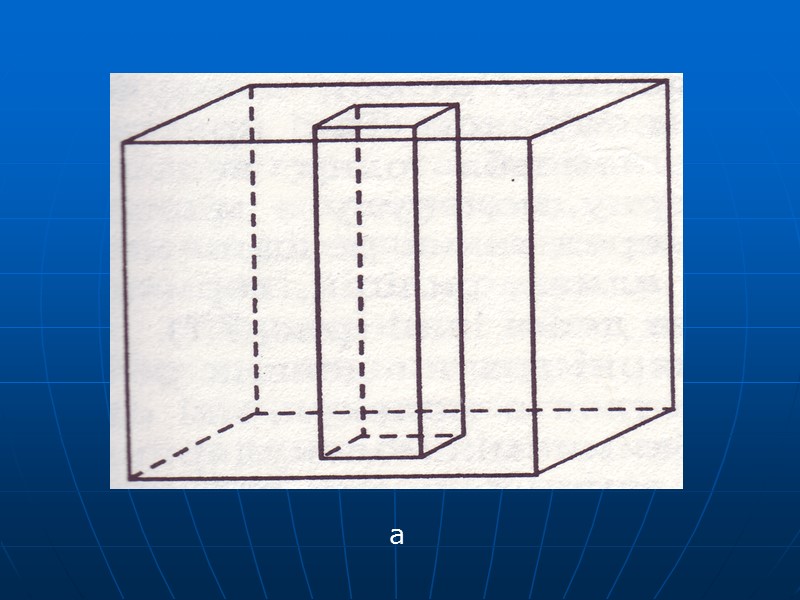
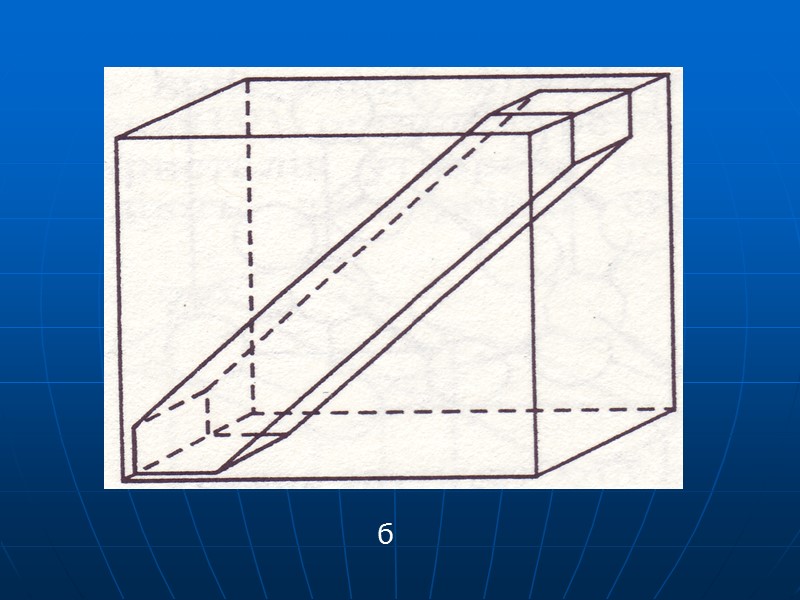
 Анізотропія кристалів Полягає в неоднаковості фізичних властивостей кристала – електро і теплопровідності, мехнічної міцності залежно від вибраного напряму для виміру. Наприклад, міцність до розиву бруска а, вирізаного з кристала NaCl, в 2,5 раза менша за міцність бруска б. Це явище називають ще векторальністю властивостей. Воно зумовлено тим, що анізотропія кристалів, як і форма, є наслідком особливостей внутрішньої будови.
Анізотропія кристалів Полягає в неоднаковості фізичних властивостей кристала – електро і теплопровідності, мехнічної міцності залежно від вибраного напряму для виміру. Наприклад, міцність до розиву бруска а, вирізаного з кристала NaCl, в 2,5 раза менша за міцність бруска б. Це явище називають ще векторальністю властивостей. Воно зумовлено тим, що анізотропія кристалів, як і форма, є наслідком особливостей внутрішньої будови.
 а
а
 б
б
 Типи хімічного з`язку в кристалах Залежно від природи частинок, що складають кристал, і характеру взаємодії між ними розрізняють атомні, молекулярні та іонні ґратки. У вузлах атомних кристалічних ґраток перебувають атоми, між якими існує ковалентний зв'язок (алмаз, германій, сіре олово). Молекулярні гратки складаються з молекул, які взаємопов'язані слабкими міжмолекулярними силами (тверді водень, кисень, галогени, інертні гази, CO2, вода, більшість кристалічних органічних речовин). Такі кристали мають малу міцність, низькі температури плавлення.
Типи хімічного з`язку в кристалах Залежно від природи частинок, що складають кристал, і характеру взаємодії між ними розрізняють атомні, молекулярні та іонні ґратки. У вузлах атомних кристалічних ґраток перебувають атоми, між якими існує ковалентний зв'язок (алмаз, германій, сіре олово). Молекулярні гратки складаються з молекул, які взаємопов'язані слабкими міжмолекулярними силами (тверді водень, кисень, галогени, інертні гази, CO2, вода, більшість кристалічних органічних речовин). Такі кристали мають малу міцність, низькі температури плавлення.
 Іонні кристалічні гратки складаються з протилежно заряджених іонів, які електростатично взаємодіють. Іони можуть бути як простими так і багатоатомними. Зв'язки між іонами досить міцні. Для багатьох характерна висока міцність і значні температури плавлення, наприклад, температура плавлення NaCl дорівнює 8010C. Кристалічні гратки, утворені металами, називаються металічними. Вони мають певні особливості.
Іонні кристалічні гратки складаються з протилежно заряджених іонів, які електростатично взаємодіють. Іони можуть бути як простими так і багатоатомними. Зв'язки між іонами досить міцні. Для багатьох характерна висока міцність і значні температури плавлення, наприклад, температура плавлення NaCl дорівнює 8010C. Кристалічні гратки, утворені металами, називаються металічними. Вони мають певні особливості.
 Поліморфізм Поліморфізм – це явище зумовлене здатністю однієї речовини існувати в кількох кристалічних формах. Поліморфізм спостерігається як серед простих так і складних речовин. Алотропія простих речовин найчастіше пов’язана з явищем поліморфізму: вуглецю – алмаз (кубічна система) і графіт (гексагональна), сірки – ромбічна і моноклінна. Карбонат кальцію – зустрічається у вигляді мінералів кальциту (гексагональна система) і арагоніту (ромбічна система).
Поліморфізм Поліморфізм – це явище зумовлене здатністю однієї речовини існувати в кількох кристалічних формах. Поліморфізм спостерігається як серед простих так і складних речовин. Алотропія простих речовин найчастіше пов’язана з явищем поліморфізму: вуглецю – алмаз (кубічна система) і графіт (гексагональна), сірки – ромбічна і моноклінна. Карбонат кальцію – зустрічається у вигляді мінералів кальциту (гексагональна система) і арагоніту (ромбічна система).
 Ізоморфізм Різні речовини можуть утворювати кристали однакової форми (ізоморфізм – рівноформність). Найяскравішим прикладом ізоморфізму є алюмокалієві KAl(SO4)2∙12H2O і хромокалієві KCr(SO4)2∙12H2O галуни, які мають подібний склад і однакову октаедричну форму кристалів.
Ізоморфізм Різні речовини можуть утворювати кристали однакової форми (ізоморфізм – рівноформність). Найяскравішим прикладом ізоморфізму є алюмокалієві KAl(SO4)2∙12H2O і хромокалієві KCr(SO4)2∙12H2O галуни, які мають подібний склад і однакову октаедричну форму кристалів.
 Аморфний стан Багато речовин при охолодженні їх розплавів кристалізуються. Але часто, перетворюючись у тверду фазу, особливо при швидкому охолодженні, не досягають високої міри упорядкованості, характерної для кристалічних ґраток. Такий твердий стан називається аморфним. Він характеризується відсутністю певної кристалічної будови речовини. Аморфні речовини є ізоморфними. При ударі вони розламуються безладно, а не вздовж певних площин, як кристали.
Аморфний стан Багато речовин при охолодженні їх розплавів кристалізуються. Але часто, перетворюючись у тверду фазу, особливо при швидкому охолодженні, не досягають високої міри упорядкованості, характерної для кристалічних ґраток. Такий твердий стан називається аморфним. Він характеризується відсутністю певної кристалічної будови речовини. Аморфні речовини є ізоморфними. При ударі вони розламуються безладно, а не вздовж певних площин, як кристали.
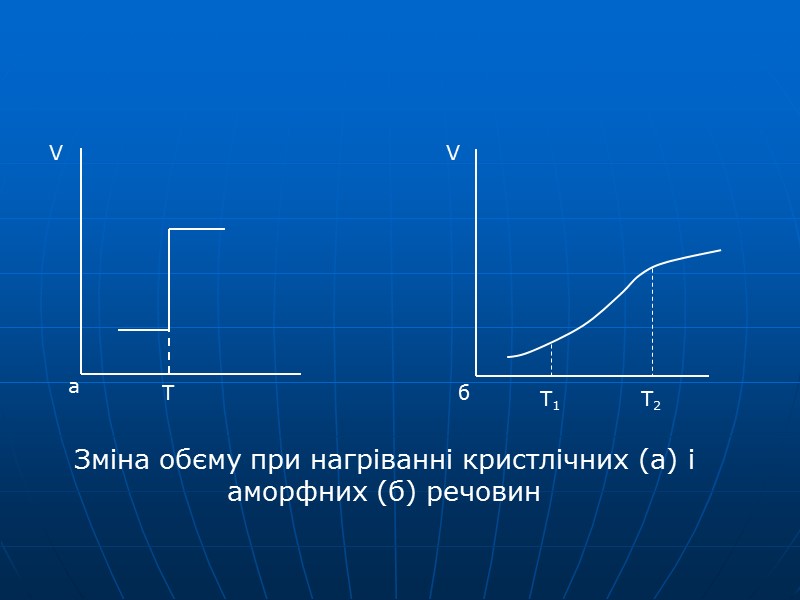
 На відміну від кристалічних, перехід аморфних речовин у рідкий стан не відбувається стрибкоподібно. Аморфні речовини не мають сталої температури плавлення. При нагріванні вони поступово розм'якшуються, розтікаються і, нарешті, перетворюються в густу рідину. Температурний інтервал розм'якшення залежить від речовини і може досягати десятків сотень градусів. Звичайне силікатне скло розм'якшується при температурі від 500 до 10000С. Це зумовлено зміною енергії між частинками в аморфному стані в широких межах.
На відміну від кристалічних, перехід аморфних речовин у рідкий стан не відбувається стрибкоподібно. Аморфні речовини не мають сталої температури плавлення. При нагріванні вони поступово розм'якшуються, розтікаються і, нарешті, перетворюються в густу рідину. Температурний інтервал розм'якшення залежить від речовини і може досягати десятків сотень градусів. Звичайне силікатне скло розм'якшується при температурі від 500 до 10000С. Це зумовлено зміною енергії між частинками в аморфному стані в широких межах.
 Зміна обєму при нагріванні кристлічних (а) і аморфних (б) речовин
Зміна обєму при нагріванні кристлічних (а) і аморфних (б) речовин
 Аморфний стан термоденамічно менш стійкий, ніж кристалічний. Для однакових речовин теплота утворення аморфного стану завжди дещо менша за теплоту кристалічного. Наприклад, теплоти, які виділяються при утворенні аморфного й кристалічного B2O3, відповідно становлять 1254 і 1273 кДж/моль, тому перехід з аморфного стану в кристалічний супроводжується виділенням теплоти. Такий перехід за звичайних умов може відбуватися дуже повільно, це пояснюється великою густиною аморфного стану. Необхідний для цього час може становити роки, що дозволяє вважати більшість аморфних сполук стійкими
Аморфний стан термоденамічно менш стійкий, ніж кристалічний. Для однакових речовин теплота утворення аморфного стану завжди дещо менша за теплоту кристалічного. Наприклад, теплоти, які виділяються при утворенні аморфного й кристалічного B2O3, відповідно становлять 1254 і 1273 кДж/моль, тому перехід з аморфного стану в кристалічний супроводжується виділенням теплоти. Такий перехід за звичайних умов може відбуватися дуже повільно, це пояснюється великою густиною аморфного стану. Необхідний для цього час може становити роки, що дозволяє вважати більшість аморфних сполук стійкими
 Аморфна й кристалічна форми можуть бути різними станами однієї й тієї самої речовини. Так, оксид кремнію SiO2 утворює кристалічний кварц і аморфний міерал кремінь. В аморфний стан можуть переходити такі речовини, молекули яких здатні полімеризуватися (сірка, селен, оксиди бору й кремнію, деякі сульфіди, силікати, борати, фосфати)
Аморфна й кристалічна форми можуть бути різними станами однієї й тієї самої речовини. Так, оксид кремнію SiO2 утворює кристалічний кварц і аморфний міерал кремінь. В аморфний стан можуть переходити такі речовини, молекули яких здатні полімеризуватися (сірка, селен, оксиди бору й кремнію, деякі сульфіди, силікати, борати, фосфати)
 Здатність перебувати в кристалічному й аморфному станах мають не всі речовини. Органічні полімери кристалічного стану не утворюють. Типовими аморфними речовинами є скло й тверді смоли. Рентгеноструктурними дослідженнями виявлено, що окремі атоми в склі утворюють такі самі групи, як і в кристалах, але в аморфних речовинах ці групи розміщуються невпорядковано. У кварцевому склі, як і в кристалі кварцу, існують тетраедричні групи, але вони розміщені безладно
Здатність перебувати в кристалічному й аморфному станах мають не всі речовини. Органічні полімери кристалічного стану не утворюють. Типовими аморфними речовинами є скло й тверді смоли. Рентгеноструктурними дослідженнями виявлено, що окремі атоми в склі утворюють такі самі групи, як і в кристалах, але в аморфних речовинах ці групи розміщуються невпорядковано. У кварцевому склі, як і в кристалі кварцу, існують тетраедричні групи, але вони розміщені безладно
