ЭХП Электрохимическая система (с одним электролитом)



















- Размер: 5.6 Mегабайта
- Количество слайдов: 28
Описание презентации ЭХП Электрохимическая система (с одним электролитом) по слайдам
 ЭХП
ЭХП

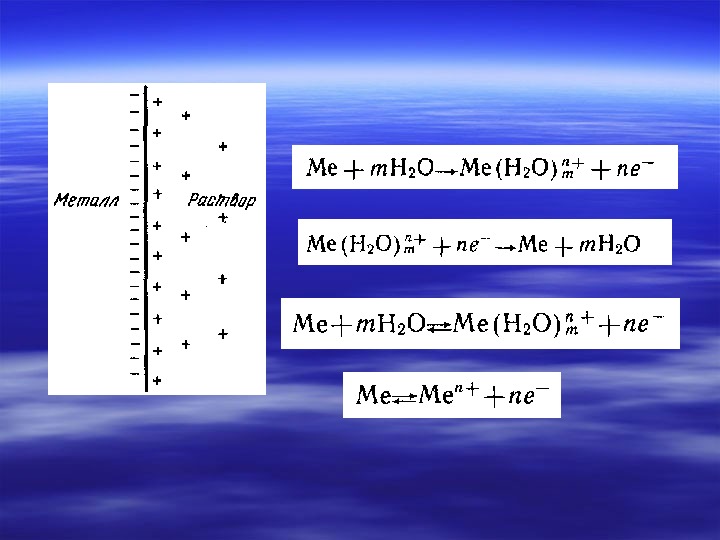
 Электрохимическая система (с одним электролитом)
Электрохимическая система (с одним электролитом)
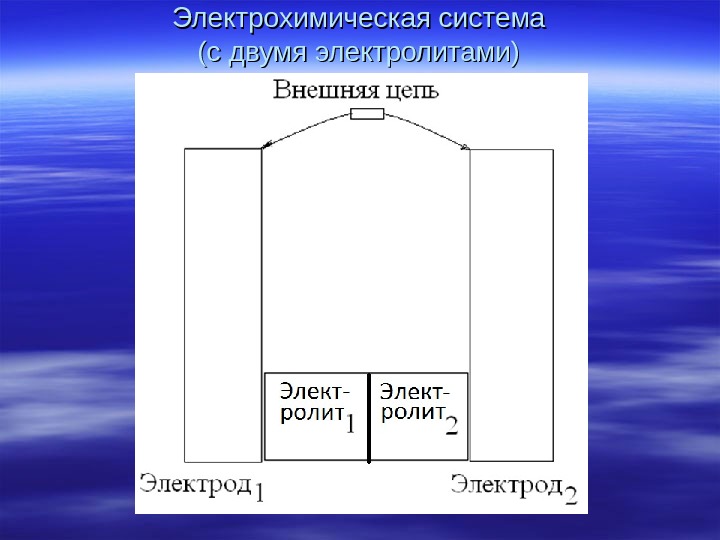
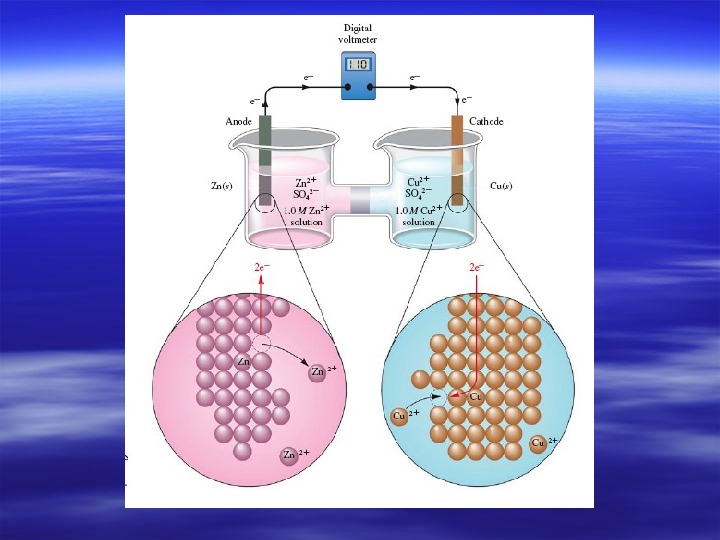
 Электрохимическая система (с двумя электролитами)
Электрохимическая система (с двумя электролитами)
 Электрохимическая схема Система с одним электролитом – Система с двумя электролитами – электрод 11 | | электролит | | электрод 22 электрод 11 | | электролит 11 ¦¦ ¦¦ электролит 22 | | электрод
Электрохимическая схема Система с одним электролитом – Система с двумя электролитами – электрод 11 | | электролит | | электрод 22 электрод 11 | | электролит 11 ¦¦ ¦¦ электролит 22 | | электрод
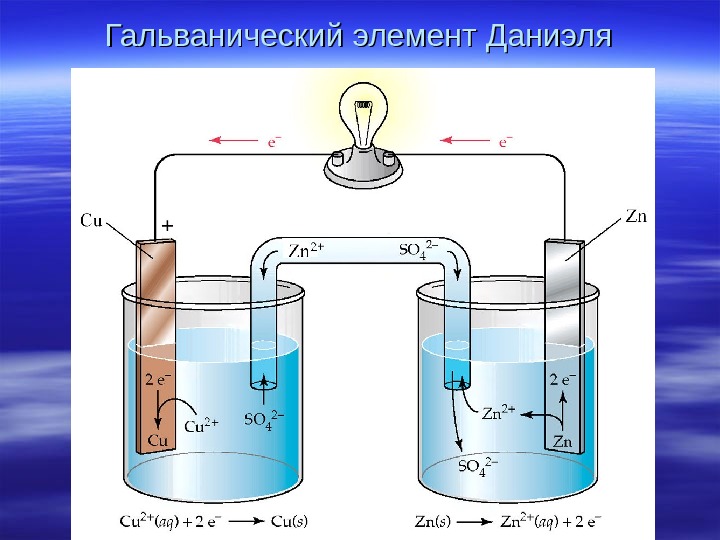
 Гальванический элемент Даниэля
Гальванический элемент Даниэля
 Электрохимические термины и процессы в гальваническом элементе Анод – электрод, на котором происходит окисление. Катод — электрод, на котором происходит восстановление. 1) Окисление восстановителя — анодная реакция : : Zn – 2 ē → Zn 2+2+ 2) Восстановление окислителя – – катодная реакция : : Cu. Cu 2+2+ + + 2 ē →→ Cu Cu 3) Движение ионов в растворе 4) Движение электронов во внешней цепи Токообразующая реакция (ТОР) — сумма катодной и анодной реакций Zn Zn + + Cu. Cu 2+2+ Zn Zn 2+2+ + + Cu. Cu
Электрохимические термины и процессы в гальваническом элементе Анод – электрод, на котором происходит окисление. Катод — электрод, на котором происходит восстановление. 1) Окисление восстановителя — анодная реакция : : Zn – 2 ē → Zn 2+2+ 2) Восстановление окислителя – – катодная реакция : : Cu. Cu 2+2+ + + 2 ē →→ Cu Cu 3) Движение ионов в растворе 4) Движение электронов во внешней цепи Токообразующая реакция (ТОР) — сумма катодной и анодной реакций Zn Zn + + Cu. Cu 2+2+ Zn Zn 2+2+ + + Cu. Cu
 Схема : : анод | | электролит11 ¦¦¦¦ электролит22 | | катод Полная : Zn | Zn. SO 44 ¦¦ Cu. SO 44 | Cu Краткая : : Zn| Zn 2+2+ ¦¦¦¦ Cu. Cu 2+2+ | Cu
Схема : : анод | | электролит11 ¦¦¦¦ электролит22 | | катод Полная : Zn | Zn. SO 44 ¦¦ Cu. SO 44 | Cu Краткая : : Zn| Zn 2+2+ ¦¦¦¦ Cu. Cu 2+2+ | Cu
 Электродвижущая сила (ЭДС) – разность потенциалов (напряжение) между электродами : : EE = = φφ22 — — φφ11. . EE связана с ΔΔ GG : : EE = — ΔΔ GG /n. F n – количество электронов в ТОР FF — число Фарадея = = 96500 Кл // моль
Электродвижущая сила (ЭДС) – разность потенциалов (напряжение) между электродами : : EE = = φφ22 — — φφ11. . EE связана с ΔΔ GG : : EE = — ΔΔ GG /n. F n – количество электронов в ТОР FF — число Фарадея = = 96500 Кл // моль
 Измерения электродных потенциалов EE = = φφкатода – – φφанода Принято : : электродный потенциал = = = EE = = φφ электрода – – φφэлектрода сравнения
Измерения электродных потенциалов EE = = φφкатода – – φφанода Принято : : электродный потенциал = = = EE = = φφ электрода – – φφэлектрода сравнения
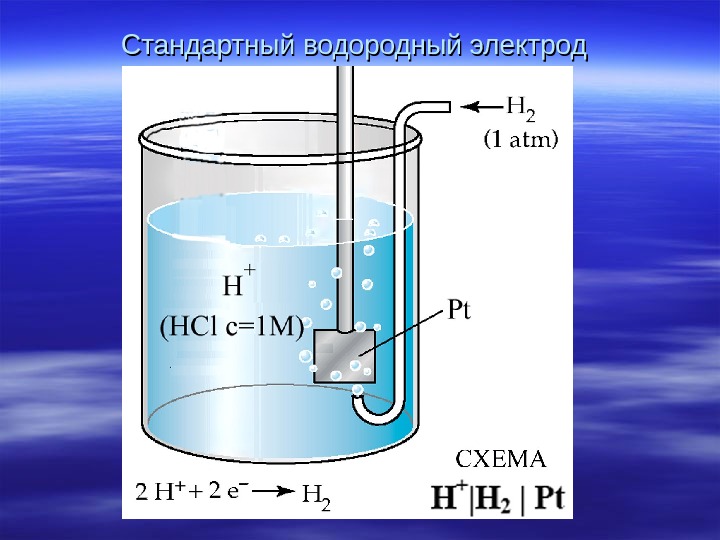
 Стандартный водородный электрод
Стандартный водородный электрод
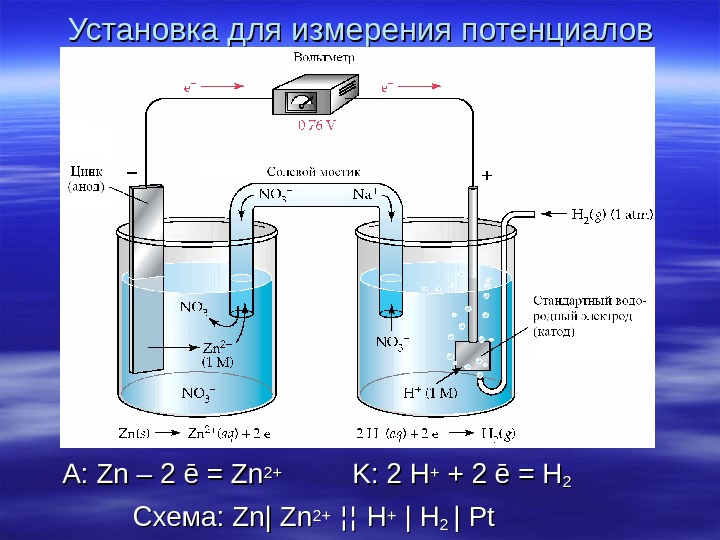
 Установка для измерения потенциалов A: Zn – 2 ē = Zn 2+2+ K: 2 H++ + 2 ē = H 22 Схема : Zn| Zn 2+2+ ¦¦¦¦ HH++ | H 22 || Pt. Pt
Установка для измерения потенциалов A: Zn – 2 ē = Zn 2+2+ K: 2 H++ + 2 ē = H 22 Схема : Zn| Zn 2+2+ ¦¦¦¦ HH++ | H 22 || Pt. Pt
 Стандартный электродный потенциал Измеряется ЕЕ = = φφэлектрод – – φφСВЭСВЭ = = = = ЕЕ Ox/Red = f( природы реагентов , , с, Т )) Стандартный электродный потенциал — ЕЕ 00 Ox/Red = = ЕЕOx/Red (( cc. Ox = = 1 1 моль // лл , , cc. Red = = 1 1 моль // лл )) Пример : : ЕЕ 00 Zn. Zn 2+2+/Zn/Zn Для Т Т = 25 00 С (298 К) ЕЕ 00 Ox/Red в таблицах
Стандартный электродный потенциал Измеряется ЕЕ = = φφэлектрод – – φφСВЭСВЭ = = = = ЕЕ Ox/Red = f( природы реагентов , , с, Т )) Стандартный электродный потенциал — ЕЕ 00 Ox/Red = = ЕЕOx/Red (( cc. Ox = = 1 1 моль // лл , , cc. Red = = 1 1 моль // лл )) Пример : : ЕЕ 00 Zn. Zn 2+2+/Zn/Zn Для Т Т = 25 00 С (298 К) ЕЕ 00 Ox/Red в таблицах

 Ряд напряжений металлов
Ряд напряжений металлов

 Металлический электрод первого рода Реакция : : Me. Men+n+ +n +n ee— = Me n – количество электронов Cu. Cu 2+2+ +2 +2 ee— = = Cu. Cu Схема : : Me. Me n+n+ | Me Cu. Cu 2+2+ | Cu
Металлический электрод первого рода Реакция : : Me. Men+n+ +n +n ee— = Me n – количество электронов Cu. Cu 2+2+ +2 +2 ee— = = Cu. Cu Схема : : Me. Me n+n+ | Me Cu. Cu 2+2+ | Cu
 Зависимость ЕЕ от от сс — — уравнение Нернста FF – число Фарадея FF = = 96500 Кл // моль При Т Т = 25 00 С (298 К) n Me 0 Me/n Melg 059. 0 c n EE n Me 0 Me/n Me ln F c n. RT EE 22 Cu 0 Cu/Cu ln F c n RT
Зависимость ЕЕ от от сс — — уравнение Нернста FF – число Фарадея FF = = 96500 Кл // моль При Т Т = 25 00 С (298 К) n Me 0 Me/n Melg 059. 0 c n EE n Me 0 Me/n Me ln F c n. RT EE 22 Cu 0 Cu/Cu ln F c n RT
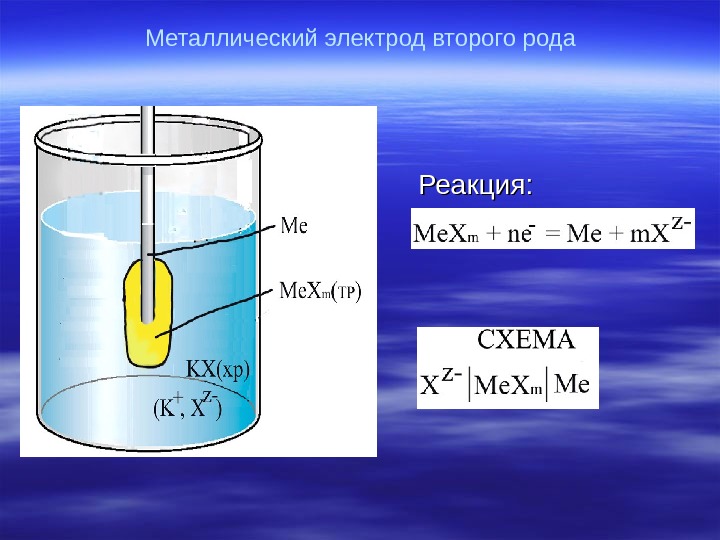
 Металлический электрод второго рода Реакция : :
Металлический электрод второго рода Реакция : :
 Уравнение потенциала : : m. Me. A/Men. Mez. A/Me, m. Me. A ln F ПР n. RT EE oo z. A/Me, m. Me. Az. A/Me, m. Me. A ln c Fz RT EE o
Уравнение потенциала : : m. Me. A/Men. Mez. A/Me, m. Me. A ln F ПР n. RT EE oo z. A/Me, m. Me. Az. A/Me, m. Me. A ln c Fz RT EE o
 хлорсеребряный электрод Ag Ag Ag. Cl Cl. Cl — Ag. Cl + ē = Ag. Ag + + Cl. Cl — Cl Cl. Ag. Cl/Ag, ln c FRT EE o кадмий-оксидный электрод Cd Cd Cd. O OHOH— Cd. O +H 22 O + 2 ē = Cd + 2 OH— OH OH Cd. OH/Cd, lnc F RT EE o
хлорсеребряный электрод Ag Ag Ag. Cl Cl. Cl — Ag. Cl + ē = Ag. Ag + + Cl. Cl — Cl Cl. Ag. Cl/Ag, ln c FRT EE o кадмий-оксидный электрод Cd Cd Cd. O OHOH— Cd. O +H 22 O + 2 ē = Cd + 2 OH— OH OH Cd. OH/Cd, lnc F RT EE o
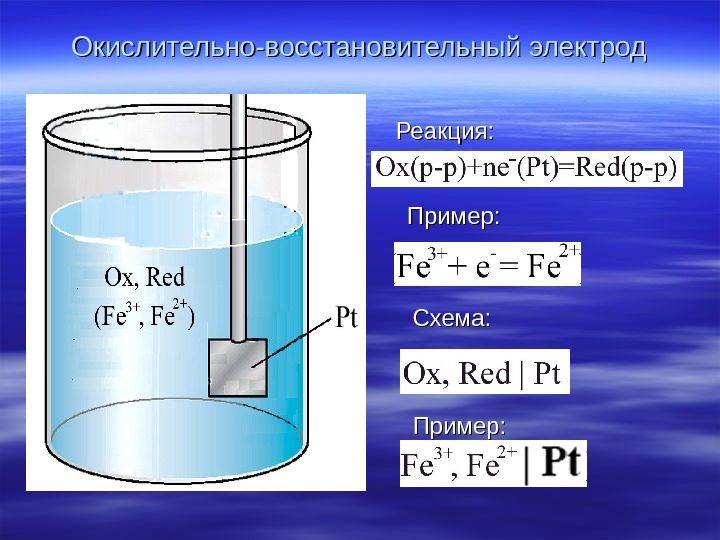
 Окислительно-восстановительный электрод Реакция : : Пример : : Схема : :
Окислительно-восстановительный электрод Реакция : : Пример : : Схема : :
 Уравнение потенциала Red Ox Ox/Red. C ln C F RT EE o 2 Fe 3 Fe 2 /Fe 3 Fe Cln C FRT EE o. Пример : :
Уравнение потенциала Red Ox Ox/Red. C ln C F RT EE o 2 Fe 3 Fe 2 /Fe 3 Fe Cln C FRT EE o. Пример : :
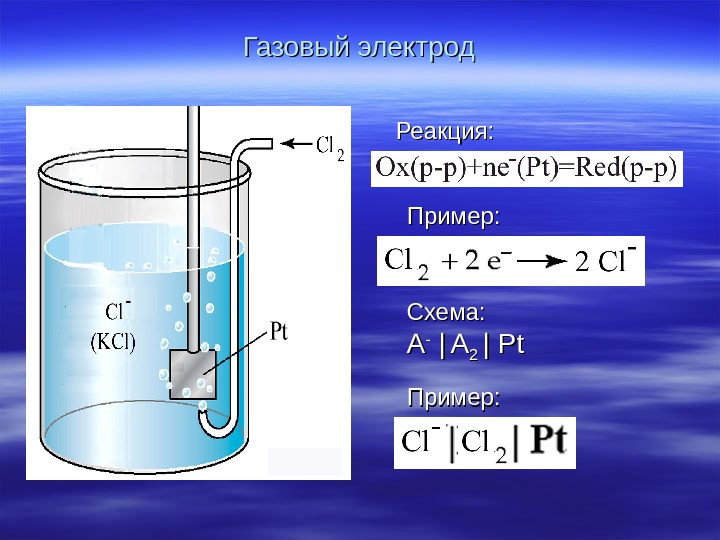
 Газовый электрод Реакция : : Пример : : Схема : : AA — | | AA 22 | Pt
Газовый электрод Реакция : : Пример : : Схема : : AA — | | AA 22 | Pt
 Уравнение потенциала — Cl 2 2 Cl — /Cl 2 Cl. C ln 2 P F RT EE o кислородный электрод Pt Pt | О| О 22 | | OHOH — OO 22 + 2 Н 22 OO + 4 ee — = 4 OHOH — — OH 4 2 O — /OH 2 O C ln 4 P F RT EE o
Уравнение потенциала — Cl 2 2 Cl — /Cl 2 Cl. C ln 2 P F RT EE o кислородный электрод Pt Pt | О| О 22 | | OHOH — OO 22 + 2 Н 22 OO + 4 ee — = 4 OHOH — — OH 4 2 O — /OH 2 O C ln 4 P F RT EE o


 каломельный электрод Hg Hg Hg. Hg 22 Cl. Cl 22 Cl. Cl — Hg. Hg 22 Cl. Cl 22 + 2 ē = 2 Н gg + 2 Cl. Cl —. .
каломельный электрод Hg Hg Hg. Hg 22 Cl. Cl 22 Cl. Cl — Hg. Hg 22 Cl. Cl 22 + 2 ē = 2 Н gg + 2 Cl. Cl —. .
