![> Элементы VIIА-группы (галогены) Группа самых электроотрицательных элементов Общая электронная формула: […] > Элементы VIIА-группы (галогены) Группа самых электроотрицательных элементов Общая электронная формула: […]](https://present5.com/presentation/3/190141580_444684637.pdf-img/190141580_444684637.pdf-1.jpg) Элементы VIIА-группы (галогены) Группа самых электроотрицательных элементов Общая электронная формула: […] ns 2 (n– 1)d 10 np 5 Ковалентность: F: I, II(д/а мех. ), (III-IV – д/а, редко) Cl, Br, I, At: I, III, V, VII (II-IV – д/а, ред. ) Hal стремятся образовать анион Hal– Степени окисления: F: – 1, 0 Cl, Br, I, At: – 1, 0, +1, +3, +5, +7 (+4 ред. )
Элементы VIIА-группы (галогены) Группа самых электроотрицательных элементов Общая электронная формула: […] ns 2 (n– 1)d 10 np 5 Ковалентность: F: I, II(д/а мех. ), (III-IV – д/а, редко) Cl, Br, I, At: I, III, V, VII (II-IV – д/а, ред. ) Hal стремятся образовать анион Hal– Степени окисления: F: – 1, 0 Cl, Br, I, At: – 1, 0, +1, +3, +5, +7 (+4 ред. )
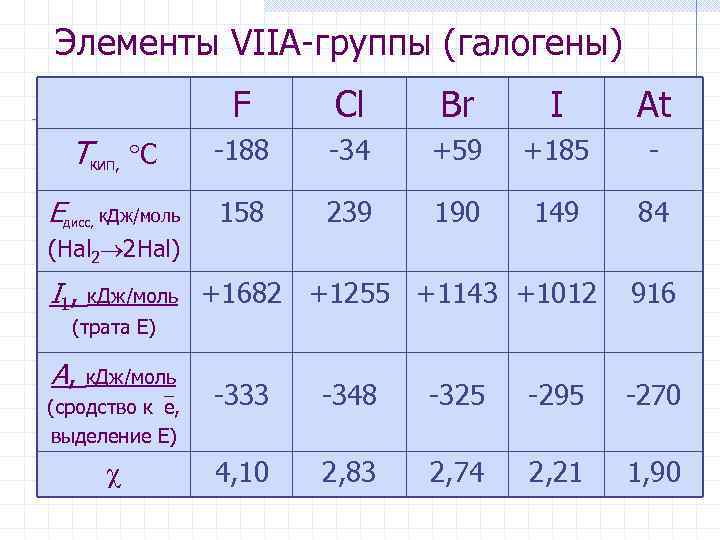 Элементы VIIА-группы (галогены) F Cl Br I At Tкип, С -188 -34 +59 +185 - Eдисс, к. Дж/моль 158 239 190 149 84 (Hal 2 2 Hal) I 1, к. Дж/моль +1682 +1255 +1143 +1012 916 (трата E) A, к. Дж/моль (сродство к e, -333 -348 -325 -295 -270 выделение E) 4, 10 2, 83 2, 74 2, 21 1, 90
Элементы VIIА-группы (галогены) F Cl Br I At Tкип, С -188 -34 +59 +185 - Eдисс, к. Дж/моль 158 239 190 149 84 (Hal 2 2 Hal) I 1, к. Дж/моль +1682 +1255 +1143 +1012 916 (трата E) A, к. Дж/моль (сродство к e, -333 -348 -325 -295 -270 выделение E) 4, 10 2, 83 2, 74 2, 21 1, 90
 Простые вещества: F 2, Cl 2, Br 2, I 2, At 2 Фтор Бром Иод Хлор
Простые вещества: F 2, Cl 2, Br 2, I 2, At 2 Фтор Бром Иод Хлор
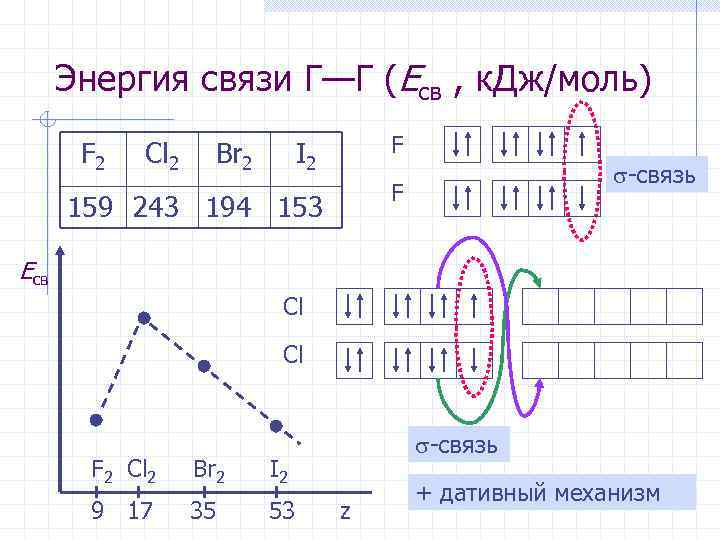 Энергия связи Г—Г (Eсв , к. Дж/моль) F 2 Cl 2 Br 2 I 2 F -связь F 159 243 194 153 Eсв Cl -связь F 2 Cl 2 Br 2 I 2 + дативный механизм 9 17 35 53 z
Энергия связи Г—Г (Eсв , к. Дж/моль) F 2 Cl 2 Br 2 I 2 F -связь F 159 243 194 153 Eсв Cl -связь F 2 Cl 2 Br 2 I 2 + дативный механизм 9 17 35 53 z
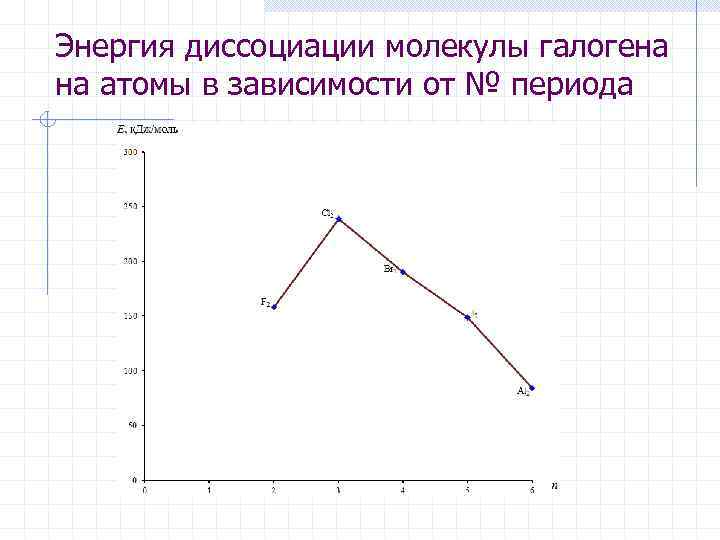 Энергия диссоциации молекулы галогена на атомы в зависимости от № периода
Энергия диссоциации молекулы галогена на атомы в зависимости от № периода
 Кристаллы флюорита
Кристаллы флюорита
 Фтор F 2 Получение: эл-лиз бифторидов: HF 2 - - e = ½F 2 + HF т. пл. – 220 °С, т. кип. – 183 °С Э + F 2 Э+ F –I ( - высокая, часто - высшая степень окисления; Э – все, кроме He, Ne, Ar, N 2, O 2) Au + 7/2 F 2 = Au. F 7 (=Au. F 5 F 2); Hg + 3/2 F 2 = Hg. F 3 NH 3 + 3 F 2 = NF 3 + 3 HF H 2 O + F 2 = 2 HF + [O] + F 2 = OF 2 On. F 2 (n = 1 8) 2 F 2 + 2 KOH (разб. ) = 2 KF + OF 2 + H 2 O Si. O 2 + 2 F 2 = Si. F 4 + O 2
Фтор F 2 Получение: эл-лиз бифторидов: HF 2 - - e = ½F 2 + HF т. пл. – 220 °С, т. кип. – 183 °С Э + F 2 Э+ F –I ( - высокая, часто - высшая степень окисления; Э – все, кроме He, Ne, Ar, N 2, O 2) Au + 7/2 F 2 = Au. F 7 (=Au. F 5 F 2); Hg + 3/2 F 2 = Hg. F 3 NH 3 + 3 F 2 = NF 3 + 3 HF H 2 O + F 2 = 2 HF + [O] + F 2 = OF 2 On. F 2 (n = 1 8) 2 F 2 + 2 KOH (разб. ) = 2 KF + OF 2 + H 2 O Si. O 2 + 2 F 2 = Si. F 4 + O 2
 Соединения фтора. Фтороводород HF : (HF)n т. кип. +19, 5 °С, неограниченно растворим в воде Автопротолиз: H 2 F 2 + HF 2 + H 2 F+, Ks = 2, 1 · 10– 11 Протонодонорные свойства: HF + HNO 3 F – + H 2 NO 3+ В водном р-ре – слабая кислота: HF + H 2 O F – + H 3 O+, KК = 6, 67. 10 4 (25 °C)
Соединения фтора. Фтороводород HF : (HF)n т. кип. +19, 5 °С, неограниченно растворим в воде Автопротолиз: H 2 F 2 + HF 2 + H 2 F+, Ks = 2, 1 · 10– 11 Протонодонорные свойства: HF + HNO 3 F – + H 2 NO 3+ В водном р-ре – слабая кислота: HF + H 2 O F – + H 3 O+, KК = 6, 67. 10 4 (25 °C)
 Фтороводород Si. O 2 + 4 HF газ = Si. F 4 + 2 H 2 O (травление стекла) Si. O 2 + 6 HF изб. = H 2[Si. F 6] + 2 H 2 O
Фтороводород Si. O 2 + 4 HF газ = Si. F 4 + 2 H 2 O (травление стекла) Si. O 2 + 6 HF изб. = H 2[Si. F 6] + 2 H 2 O
 Открытие фтора Фтор впервые получен в 1886 г. (А. Муассан, электролиз HF+KF ( KHF 2) Анри Муассан (1852 - 1907) Установки для получения фтора
Открытие фтора Фтор впервые получен в 1886 г. (А. Муассан, электролиз HF+KF ( KHF 2) Анри Муассан (1852 - 1907) Установки для получения фтора
 Получение фтора и фтороводорода В промышленности: электролиз расплава KHF 2 (т. пл. 239 °C) или KH 2 F 3 (т. пл. 70 °C) Катод (–) : 2 HF + 2 e– = H 2 + 2 F– Анод (+): 2 HF 2– – 2 e– = HF + F 2 В лаборатории: 2 Co. F 3 = 2 Co. F 2 + F 2 K 2[Ni. F 6] = 2 KF + Ni. F 2 + F 2 Получение HF: Ca. F 2 + H 2 SO 4(конц) = Ca. SO 4 + 2 HF (150 -300 С)
Получение фтора и фтороводорода В промышленности: электролиз расплава KHF 2 (т. пл. 239 °C) или KH 2 F 3 (т. пл. 70 °C) Катод (–) : 2 HF + 2 e– = H 2 + 2 F– Анод (+): 2 HF 2– – 2 e– = HF + F 2 В лаборатории: 2 Co. F 3 = 2 Co. F 2 + F 2 K 2[Ni. F 6] = 2 KF + Ni. F 2 + F 2 Получение HF: Ca. F 2 + H 2 SO 4(конц) = Ca. SO 4 + 2 HF (150 -300 С)
![>Фтороводородная (плавиковая) кислота [H 3 O]+F- >Фтороводородная (плавиковая) кислота [H 3 O]+F-](https://present5.com/presentation/3/190141580_444684637.pdf-img/190141580_444684637.pdf-12.jpg) Фтороводородная (плавиковая) кислота [H 3 O]+F- [H 3 O]+[HF 2]- [H 3 O]+[H 3 F 4]- Специфическая ионизация р-ров HF и специфический гидролиз водных р-ров фторидов: F- + HOH HF 2 - + OH-
Фтороводородная (плавиковая) кислота [H 3 O]+F- [H 3 O]+[HF 2]- [H 3 O]+[H 3 F 4]- Специфическая ионизация р-ров HF и специфический гидролиз водных р-ров фторидов: F- + HOH HF 2 - + OH-
 Применение Водоподготовка (обеззараживание воды фторированием) Фторуглеродные соединения (фреоны, фторкаучуки, фторопласты (тефлоны) и т. п. HF: получение синтетического криолита для производства алюминия, катализаторы, травление стекла и металлов, получение фторидов урана, олова и др.
Применение Водоподготовка (обеззараживание воды фторированием) Фторуглеродные соединения (фреоны, фторкаучуки, фторопласты (тефлоны) и т. п. HF: получение синтетического криолита для производства алюминия, катализаторы, травление стекла и металлов, получение фторидов урана, олова и др.
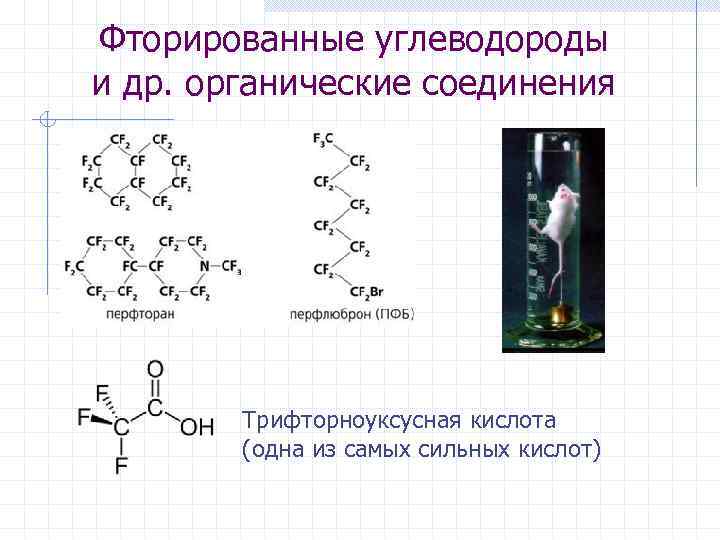 Фторированные углеводороды и др. органические соединения Трифторноуксусная кислота (одна из самых сильных кислот)
Фторированные углеводороды и др. органические соединения Трифторноуксусная кислота (одна из самых сильных кислот)
![Элементы VIIА-группы (галогены) Группа самых электроотрицательных элементов Общая электронная формула: […] Элементы VIIА-группы (галогены) Группа самых электроотрицательных элементов Общая электронная формула: […]](https://present5.com/presentation/3/190141580_444684637.pdf-img/190141580_444684637.pdf-1.jpg)










![Фтороводородная (плавиковая) кислота [H 3 O]+F- Фтороводородная (плавиковая) кислота [H 3 O]+F-](https://present5.com/presentation/3/190141580_444684637.pdf-img/190141580_444684637.pdf-12.jpg)


![Элементы VIIА-группы (галогены) Группа самых электроотрицательных элементов Общая электронная формула: […] Элементы VIIА-группы (галогены) Группа самых электроотрицательных элементов Общая электронная формула: […]](https://present5.com/presentation/3/190141580_444684637.pdf-img/190141580_444684637.pdf-1.jpg)










![Фтороводородная (плавиковая) кислота [H 3 O]+F- Фтороводородная (плавиковая) кислота [H 3 O]+F-](https://present5.com/presentation/3/190141580_444684637.pdf-img/190141580_444684637.pdf-12.jpg)

