Элементы VI А группы.ppt
- Количество слайдов: 21
 Элементы VI А группы Подготовила студентка ТК№ 24 19 гр Нежельской Ксении
Элементы VI А группы Подготовила студентка ТК№ 24 19 гр Нежельской Ксении
 Общая характеристика, краткие сведения об этом истории открытия и их распространенности в природе
Общая характеристика, краткие сведения об этом истории открытия и их распространенности в природе
 История открытия кислорода Официально считается, что кислород был открыт английским химиком Джозефом Пристли 1 августа 1774 года путём разложения оксида ртути в герметично закрытом сосуде (Пристли направлял на это соединение солнечные лучи с помощью мощной линзы). 2 Hg. O (t) → 2 Hg + O 2↑ Однако Пристли первоначально не понял, что открыл новое простое вещество, он считал, что выделил одну из составных частей воздуха (и назвал этот газ «дефлогистированным воздухом» ). О своём открытии Пристли сообщил выдающемуся французскому химику Антуану Лавуазье. В 1775 году А. Лавуазье установил, что кислород является составной частью воздуха, кислот и содержится во многих веществах. Несколькими годами ранее (в 1771 году) кислород получил шведский химик Карл Шееле. Он прокаливал селитру с серной кислотой и затем разлагал получившийся оксид азота. Шееле назвал этот газ «огненным воздухом» и описал своё открытие в изданной в 1777 году книге (именно потому, что книга опубликована позже, чем сообщил о своём открытии Пристли, последний и считается первооткрывателем кислорода). Шееле также сообщил о своём опыте Лавуазье. Важным этапом, который способствовал открытию кислорода, были работы французского химика Петра Байена, который опубликовал работы по окислению ртути и последующему разложению её оксида.
История открытия кислорода Официально считается, что кислород был открыт английским химиком Джозефом Пристли 1 августа 1774 года путём разложения оксида ртути в герметично закрытом сосуде (Пристли направлял на это соединение солнечные лучи с помощью мощной линзы). 2 Hg. O (t) → 2 Hg + O 2↑ Однако Пристли первоначально не понял, что открыл новое простое вещество, он считал, что выделил одну из составных частей воздуха (и назвал этот газ «дефлогистированным воздухом» ). О своём открытии Пристли сообщил выдающемуся французскому химику Антуану Лавуазье. В 1775 году А. Лавуазье установил, что кислород является составной частью воздуха, кислот и содержится во многих веществах. Несколькими годами ранее (в 1771 году) кислород получил шведский химик Карл Шееле. Он прокаливал селитру с серной кислотой и затем разлагал получившийся оксид азота. Шееле назвал этот газ «огненным воздухом» и описал своё открытие в изданной в 1777 году книге (именно потому, что книга опубликована позже, чем сообщил о своём открытии Пристли, последний и считается первооткрывателем кислорода). Шееле также сообщил о своём опыте Лавуазье. Важным этапом, который способствовал открытию кислорода, были работы французского химика Петра Байена, который опубликовал работы по окислению ртути и последующему разложению её оксида.
 Наконец, окончательно разобрался в природе полученного газа А. Лавуазье, воспользовавшийся информацией от Пристли и Шееле. Его работа имела громадное значение, потому что благодаря ей была ниспровергнута господствовавшая в то время и тормозившая развитие химии флогистонная теория. Лавуазье провёл опыт по сжиганию различных веществ и опроверг теорию флогистона, опубликовав результаты по весу сожженных элементов. Вес золы превышал первоначальный вес элемента, что дало Лавуазье право утверждать, что при горении происходит химическая реакция (окисление) вещества, в связи с этим масса исходного вещества увеличивается, что опровергает теорию флогистона. Таким образом, заслугу открытия кислорода фактически делят между собой Пристли, Шееле и Лавуазь
Наконец, окончательно разобрался в природе полученного газа А. Лавуазье, воспользовавшийся информацией от Пристли и Шееле. Его работа имела громадное значение, потому что благодаря ей была ниспровергнута господствовавшая в то время и тормозившая развитие химии флогистонная теория. Лавуазье провёл опыт по сжиганию различных веществ и опроверг теорию флогистона, опубликовав результаты по весу сожженных элементов. Вес золы превышал первоначальный вес элемента, что дало Лавуазье право утверждать, что при горении происходит химическая реакция (окисление) вещества, в связи с этим масса исходного вещества увеличивается, что опровергает теорию флогистона. Таким образом, заслугу открытия кислорода фактически делят между собой Пристли, Шееле и Лавуазь
 История открытия серы Сера (англ. Sulfur, франц. Sufre, нем. Schwefel) в самородном состоянии, а также в виде сернистых соединений известна с самых древнейших времен. С запахом горящей серы, удушающим действием сернистого газа и отвратительным запахом сероводорода человек познакомился, вероятно, еще в доисторические времена. Именно из-за этих свойств сера использовалась жрецами в составе священных курений при религиозных обрядах. Сера считалась произведением сверхчеловеческих существ из мира духов или подземных богов. Очень давно сера стала применяться в составе различных горючих смесей для военных целей. Уже у Гомера описаны "сернистые испарения", смертельное действие выделений горящей серы. Сера, вероятно, входила в состав "греческого огня", наводившего ужас на противников. Около VIII в. китайцы стали использовать ее в пиротехнических смесях, в частности, в смеси типа пороха. Горючесть серы, легкость, с которой она соединяется с металлами с образованием сульфидов (например, на поверхности кусков металла), объясняют то, что ее считали "принципом горючести" и обязательной составной частью металлических руд. Пресвитер Теофил (XI в. ) описывает способ окислительного обжига сульфидной медной руды, известный, вероятно, еще в древнем Египте. В период арабской алхимии возникла ртутно-серная теория состава металлов, согласно которой сера почиталась обязательной составной частью (отцом) всех металлов.
История открытия серы Сера (англ. Sulfur, франц. Sufre, нем. Schwefel) в самородном состоянии, а также в виде сернистых соединений известна с самых древнейших времен. С запахом горящей серы, удушающим действием сернистого газа и отвратительным запахом сероводорода человек познакомился, вероятно, еще в доисторические времена. Именно из-за этих свойств сера использовалась жрецами в составе священных курений при религиозных обрядах. Сера считалась произведением сверхчеловеческих существ из мира духов или подземных богов. Очень давно сера стала применяться в составе различных горючих смесей для военных целей. Уже у Гомера описаны "сернистые испарения", смертельное действие выделений горящей серы. Сера, вероятно, входила в состав "греческого огня", наводившего ужас на противников. Около VIII в. китайцы стали использовать ее в пиротехнических смесях, в частности, в смеси типа пороха. Горючесть серы, легкость, с которой она соединяется с металлами с образованием сульфидов (например, на поверхности кусков металла), объясняют то, что ее считали "принципом горючести" и обязательной составной частью металлических руд. Пресвитер Теофил (XI в. ) описывает способ окислительного обжига сульфидной медной руды, известный, вероятно, еще в древнем Египте. В период арабской алхимии возникла ртутно-серная теория состава металлов, согласно которой сера почиталась обязательной составной частью (отцом) всех металлов.
 В дальнейшем она стала одним из трех принципов алхимиков, а позднее "принцип горючести" явился основой теории флогистона. Элементарную природу серы установил Лавуазье в своих опытах по сжиганию. С введением пороха в Европе началось развитие добычи природной серы, а также разработка способа получения ее из пиритов; последний был распространен в древней Руси. Впервые в литературе он описан у Агриколы. Происхождение лат. Sulfur неясно. Полагают, что это название заимствовано от греков. В литературе алхимического периода сера часто фигурирует под различными тайными названиями. У Руланда можно найти, например, названия Zarnec (объяснение "яйца с огнем"), Thucios (живая сера), Terra foetida, spiritus foetens, Scorith, Pater и др. Древнерусское название "сера" употребляется уже очень давно. Под ним подразумевались разные горючие и дурно пахнущие вещества, смолы, физиологические выделения (сера в ушах и пр. ). По-видимому, это название происходит от санскритского сirа (светложелтый). С ним связано слово "серый", т. е. неопределенного цвета, что, в частности, относится к смолам. Второе древнерусское название серы жупел (сера горючая) - тоже содержит в себе понятие не только горючести, но и дурного запаха. Как объясняют филологи, нем. Schwefel имеет санскритский корень swep (спать, англо-саксонское sweblan - убивать), что, возможно, связано с ядовитыми свойствами сернистого газа
В дальнейшем она стала одним из трех принципов алхимиков, а позднее "принцип горючести" явился основой теории флогистона. Элементарную природу серы установил Лавуазье в своих опытах по сжиганию. С введением пороха в Европе началось развитие добычи природной серы, а также разработка способа получения ее из пиритов; последний был распространен в древней Руси. Впервые в литературе он описан у Агриколы. Происхождение лат. Sulfur неясно. Полагают, что это название заимствовано от греков. В литературе алхимического периода сера часто фигурирует под различными тайными названиями. У Руланда можно найти, например, названия Zarnec (объяснение "яйца с огнем"), Thucios (живая сера), Terra foetida, spiritus foetens, Scorith, Pater и др. Древнерусское название "сера" употребляется уже очень давно. Под ним подразумевались разные горючие и дурно пахнущие вещества, смолы, физиологические выделения (сера в ушах и пр. ). По-видимому, это название происходит от санскритского сirа (светложелтый). С ним связано слово "серый", т. е. неопределенного цвета, что, в частности, относится к смолам. Второе древнерусское название серы жупел (сера горючая) - тоже содержит в себе понятие не только горючести, но и дурного запаха. Как объясняют филологи, нем. Schwefel имеет санскритский корень swep (спать, англо-саксонское sweblan - убивать), что, возможно, связано с ядовитыми свойствами сернистого газа
 История открытия селена Название происходит от греч. σελήνη — Луна. Элемент назван так в связи с тем, что в природе он является спутником химически сходного с ним теллура (названного в честь Земли).
История открытия селена Название происходит от греч. σελήνη — Луна. Элемент назван так в связи с тем, что в природе он является спутником химически сходного с ним теллура (названного в честь Земли).
 История открытия теллура Впервые был найден в 1782 году в золотоносных рудах Трансильвании горным инспектором Францом Иозефом Мюллером (впоследствии барон фон Рейхенштейн), на территории Австро-Венгрии. В 1798 году Мартин Генрих Клапрот выделил теллур и определил важнейшие его свойства.
История открытия теллура Впервые был найден в 1782 году в золотоносных рудах Трансильвании горным инспектором Францом Иозефом Мюллером (впоследствии барон фон Рейхенштейн), на территории Австро-Венгрии. В 1798 году Мартин Генрих Клапрот выделил теллур и определил важнейшие его свойства.
 История открытия полония Элемент открыт в 1898 году супругами Пьером Кюри и Марией Склодовской-Кюри в смоляной обманке. Элемент был назван в честь родины Марии Склодовской. Кюри — Польши (лат. Polonia).
История открытия полония Элемент открыт в 1898 году супругами Пьером Кюри и Марией Склодовской-Кюри в смоляной обманке. Элемент был назван в честь родины Марии Склодовской. Кюри — Польши (лат. Polonia).
 Общая характеристика В подгруппу кислорода входит пять элементов: кислород, сера, селен, теллур и полоний (радиоактивный металл). Это р-элементы VI группы периодической системы Д. И. Менделеева. Они имеют групповое название – халькогены, что означает «образующие руды» . У атомов халькогенов одинаковое строение внешнего энергетического уровня — ns 2 nр4. Этим объясняется сходство их химических свойств. Все халькогены в соединениях с водородом и металлами проявляют степень окисления -2, а в соединениях с кислородом и другими активными неметаллами — обычно +4 и +6. Для кислорода, как и для фтора, не типична степень окисления, равная номеру группы. Он проявляет степень окисления обычно -2 и в соединении со фтором +2. Такие значения степеней окисления следуют из электронного строения халькогенов. У атома кислорода на 2 р-подуровне два неспаренных электрона. Его электроны не могут разъединяться, поскольку отсутствует d-подуровень на внешнем (втором) уровне, т. е. отсутствуют свободные орбитали. Поэтому валентность кислорода всегда равна двум, а степень окисления -2 и +2 (например, в Н 2 О и ОF 2). Таковы же валентность и степени окисления у атома серы в невозбужденном состоянии. При переходе в возбужденное состояние (что имеет место при подводе энергии, например при нагревании) у атома серы сначала разъединяются Зр-, а затем 3 sэлектроны (показано стрелками). Числонеспаренных электронов, а, следовательно, и валентность в первом случае равны четырем (например, в SO 2), а во втором — шести (например, в SO 3). Очевидно, четные валентности 2, 4, 6 свойственны аналогам серы — селену, теллуру и полонию, а их степени окисления могут быть равны -2, +4 и +6. Водородные соединения элементов подгруппы кислорода отвечают формуле Н 2 R (R - символ элемента): Н 2 О, Н 2 Sе, Н 2 Те. Они называются хальководородами. При растворении их в воде образуются кислоты. Сила этих кислот возрастает с ростом порядкового номера элемента, что объясняется уменьшением энергии связи в ряду соединений Н 2 R. Вода, диссоциирующая на ионы Н+ и ОН-, является амфотерным электролитом.
Общая характеристика В подгруппу кислорода входит пять элементов: кислород, сера, селен, теллур и полоний (радиоактивный металл). Это р-элементы VI группы периодической системы Д. И. Менделеева. Они имеют групповое название – халькогены, что означает «образующие руды» . У атомов халькогенов одинаковое строение внешнего энергетического уровня — ns 2 nр4. Этим объясняется сходство их химических свойств. Все халькогены в соединениях с водородом и металлами проявляют степень окисления -2, а в соединениях с кислородом и другими активными неметаллами — обычно +4 и +6. Для кислорода, как и для фтора, не типична степень окисления, равная номеру группы. Он проявляет степень окисления обычно -2 и в соединении со фтором +2. Такие значения степеней окисления следуют из электронного строения халькогенов. У атома кислорода на 2 р-подуровне два неспаренных электрона. Его электроны не могут разъединяться, поскольку отсутствует d-подуровень на внешнем (втором) уровне, т. е. отсутствуют свободные орбитали. Поэтому валентность кислорода всегда равна двум, а степень окисления -2 и +2 (например, в Н 2 О и ОF 2). Таковы же валентность и степени окисления у атома серы в невозбужденном состоянии. При переходе в возбужденное состояние (что имеет место при подводе энергии, например при нагревании) у атома серы сначала разъединяются Зр-, а затем 3 sэлектроны (показано стрелками). Числонеспаренных электронов, а, следовательно, и валентность в первом случае равны четырем (например, в SO 2), а во втором — шести (например, в SO 3). Очевидно, четные валентности 2, 4, 6 свойственны аналогам серы — селену, теллуру и полонию, а их степени окисления могут быть равны -2, +4 и +6. Водородные соединения элементов подгруппы кислорода отвечают формуле Н 2 R (R - символ элемента): Н 2 О, Н 2 Sе, Н 2 Те. Они называются хальководородами. При растворении их в воде образуются кислоты. Сила этих кислот возрастает с ростом порядкового номера элемента, что объясняется уменьшением энергии связи в ряду соединений Н 2 R. Вода, диссоциирующая на ионы Н+ и ОН-, является амфотерным электролитом.
 У атома кислорода на 2 р-подуровне два неспаренных электрона. Его электроны не могут разъединяться, поскольку отсутствует d -подуровень на внешнем (втором) уровне, т. е. отсутствуют свободные орбитали. Поэтому валентность кислорода всегда равна двум, а степень окисления -2 и +2 (например, в Н 2 О и ОF 2). Таковы же валентность и степени окисления у атома серы в невозбужденном состоянии. При переходе в возбужденное состояние (что имеет место при подводе энергии, например при нагревании) у атома серы сначала разъединяются Зр-, а затем 3 s-электроны (показано стрелками). Числонеспаренных электронов, а, следовательно, и валентность в первом случае равны четырем (например, в SO 2), а во втором — шести (например, в SO 3). Очевидно, четные валентности 2, 4, 6 свойственны аналогам серы — селену, теллуру и полонию, а их степени окисления могут быть равны -2, +4 и +6. Водородные соединения элементов подгруппы кислорода отвечают формуле Н 2 R (R - символ элемента): Н 2 О, Н 2 Sе, Н 2 Те. Они называются хальководородами. При растворении их в воде образуются кислоты. Сила этих кислот возрастает с ростом порядкового номера элемента, что объясняется уменьшением энергии связи в ряду соединений Н 2 R. Вода, диссоциирующая на ионы Н+ и ОН-, является амфотерным электролитом.
У атома кислорода на 2 р-подуровне два неспаренных электрона. Его электроны не могут разъединяться, поскольку отсутствует d -подуровень на внешнем (втором) уровне, т. е. отсутствуют свободные орбитали. Поэтому валентность кислорода всегда равна двум, а степень окисления -2 и +2 (например, в Н 2 О и ОF 2). Таковы же валентность и степени окисления у атома серы в невозбужденном состоянии. При переходе в возбужденное состояние (что имеет место при подводе энергии, например при нагревании) у атома серы сначала разъединяются Зр-, а затем 3 s-электроны (показано стрелками). Числонеспаренных электронов, а, следовательно, и валентность в первом случае равны четырем (например, в SO 2), а во втором — шести (например, в SO 3). Очевидно, четные валентности 2, 4, 6 свойственны аналогам серы — селену, теллуру и полонию, а их степени окисления могут быть равны -2, +4 и +6. Водородные соединения элементов подгруппы кислорода отвечают формуле Н 2 R (R - символ элемента): Н 2 О, Н 2 Sе, Н 2 Те. Они называются хальководородами. При растворении их в воде образуются кислоты. Сила этих кислот возрастает с ростом порядкового номера элемента, что объясняется уменьшением энергии связи в ряду соединений Н 2 R. Вода, диссоциирующая на ионы Н+ и ОН-, является амфотерным электролитом.
 Изменения в группе величины радиусов атомов и ионов, потенциала ионизации.
Изменения в группе величины радиусов атомов и ионов, потенциала ионизации.
 Сходство и различие свойств элементов VI группы, главной подгруппы с точки зрения строения атома. В подгруппе кислорода с возрастанием атомного номера увеличивается радиус атомов, уменьшается энергия ионизации, характеризующая металлические свойства элементов. Поэтому в ряду 0 --S--Se--Te--Ро свойства элементов изменяются от неметаллических к металлическим. В обычных условиях кислород - типичный неметалл (газ), а полоний — металл, похожий на свинец. С увеличением атомного, номера элементов значение электроотрицательности элементов в подгруппе уменьшается. Отрицательная степень окисления становится все менее характерной. Окислительная активность простых веществ в ряду 02 --S—Se--Те снижается. Так, если сера и значительно слабее, селен непосредственно взаимодействует с водородом, то теллур с ним в реакцию не вступает.
Сходство и различие свойств элементов VI группы, главной подгруппы с точки зрения строения атома. В подгруппе кислорода с возрастанием атомного номера увеличивается радиус атомов, уменьшается энергия ионизации, характеризующая металлические свойства элементов. Поэтому в ряду 0 --S--Se--Te--Ро свойства элементов изменяются от неметаллических к металлическим. В обычных условиях кислород - типичный неметалл (газ), а полоний — металл, похожий на свинец. С увеличением атомного, номера элементов значение электроотрицательности элементов в подгруппе уменьшается. Отрицательная степень окисления становится все менее характерной. Окислительная активность простых веществ в ряду 02 --S—Se--Те снижается. Так, если сера и значительно слабее, селен непосредственно взаимодействует с водородом, то теллур с ним в реакцию не вступает.
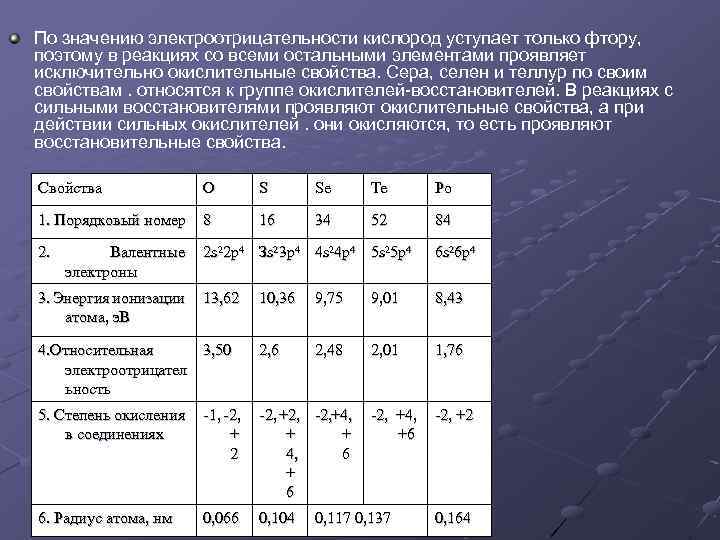 По значению электроотрицательности кислород уступает только фтору, поэтому в реакциях со всеми остальными элементами проявляет исключительно окислительные свойства. Сера, селен и теллур по своим свойствам. относятся к группе окислителей-восстановителей. В реакциях с сильными восстановителями проявляют окислительные свойства, а при действии сильных окислителей. они окисляются, то есть проявляют восстановительные свойства. Свойства O S Se Те Ро 1. Порядковый номер 8 16 34 52 84 2. 2 s 22 р4 Зs 23 р4 4 s 24 р4 5 s 25 p 4 6 s 26 p 4 13, 62 Валентные электроны 3. Энергия ионизации атома, э. В 10, 36 9, 75 9, 01 8, 43 4. Относительная 3, 50 электроотрицател ьность 2, 6 2, 48 2, 01 1, 76 5. Степень окисления в соединениях -1, -2, + 2 -2, +2, -2, +4, + + 4, 6 + 6 -2, +4, +6 -2, +2 6. Радиус атома, нм 0, 066 0, 104 0, 117 0, 137 0, 164
По значению электроотрицательности кислород уступает только фтору, поэтому в реакциях со всеми остальными элементами проявляет исключительно окислительные свойства. Сера, селен и теллур по своим свойствам. относятся к группе окислителей-восстановителей. В реакциях с сильными восстановителями проявляют окислительные свойства, а при действии сильных окислителей. они окисляются, то есть проявляют восстановительные свойства. Свойства O S Se Те Ро 1. Порядковый номер 8 16 34 52 84 2. 2 s 22 р4 Зs 23 р4 4 s 24 р4 5 s 25 p 4 6 s 26 p 4 13, 62 Валентные электроны 3. Энергия ионизации атома, э. В 10, 36 9, 75 9, 01 8, 43 4. Относительная 3, 50 электроотрицател ьность 2, 6 2, 48 2, 01 1, 76 5. Степень окисления в соединениях -1, -2, + 2 -2, +2, -2, +4, + + 4, 6 + 6 -2, +4, +6 -2, +2 6. Радиус атома, нм 0, 066 0, 104 0, 117 0, 137 0, 164
 . Сравнение свойств простых веществ. Свойства пероксидов и супероксидов Свойства кислорода S + О 2 = SO 2. С графитом кислород реагирует при 700 °С С + О 2 = СО 2. Взаимодействие кислорода с азотом начинается лишь при 1200°С или в электрическом разряде N 2 + О 2 2 NО - Q. Кислород реагирует и со многими сложными соединениями, например с оксидом азота (II)он реагирует уже при комнатной температуре: 2 NО + О 2 = 2 NО 2. Сероводород, реагируя с кислородом при нагревании, дает серу 2 Н 2 S + О 2 = 2 S + 2 Н 2 О или оксид серы (IV) 2 Н 2 S + ЗО 2 = 2 SО 2 + 2 Н 2 О в зависимости от соотношения между кислородом и сероводородом. В приведенных реакциях кислород является окислителем. В большинстве реакций окисления с участием кислорода выделяется тепло и свет - такие процессы называются горением.
. Сравнение свойств простых веществ. Свойства пероксидов и супероксидов Свойства кислорода S + О 2 = SO 2. С графитом кислород реагирует при 700 °С С + О 2 = СО 2. Взаимодействие кислорода с азотом начинается лишь при 1200°С или в электрическом разряде N 2 + О 2 2 NО - Q. Кислород реагирует и со многими сложными соединениями, например с оксидом азота (II)он реагирует уже при комнатной температуре: 2 NО + О 2 = 2 NО 2. Сероводород, реагируя с кислородом при нагревании, дает серу 2 Н 2 S + О 2 = 2 S + 2 Н 2 О или оксид серы (IV) 2 Н 2 S + ЗО 2 = 2 SО 2 + 2 Н 2 О в зависимости от соотношения между кислородом и сероводородом. В приведенных реакциях кислород является окислителем. В большинстве реакций окисления с участием кислорода выделяется тепло и свет - такие процессы называются горением.
 Еще более сильным окислителем, чем кислород О 2, является озон О 3. Он образуется в атмосфере при грозовых разрядах, объясняется специфический запах свежести после грозы. Обычноозон получают пропусканием разряда через кислород (реакция эндотермическая и сильно обратимая; выход озона около 5%): ЗО 2 2 О 3 - 284 к. Дж При взаимодействии озона с раствором иодида калия выделяется йод, тогда как с кислородом эта реакция не идет: 2 КI + О 3 + Н 2 О = I 2 + 2 КОН + О 2. Реакция часто используется как качественная для обнаружения ионов I- или озона. Для этого в раствор добавляют крахмал, который дает характерный синий комплекс с выделившимся иодом. Реакция качественная еще и потому, что озон не окисляет ионы Сl- и Br-. При пропускании газообразного озона через раствор какого-либо алкена в тетрахлорметане при температуре ниже 20°С образуется озонид соответствующего алкена: O / H 2 C = CH 2 + O 3 → H 2 C CH 2 / O озонид этилена O
Еще более сильным окислителем, чем кислород О 2, является озон О 3. Он образуется в атмосфере при грозовых разрядах, объясняется специфический запах свежести после грозы. Обычноозон получают пропусканием разряда через кислород (реакция эндотермическая и сильно обратимая; выход озона около 5%): ЗО 2 2 О 3 - 284 к. Дж При взаимодействии озона с раствором иодида калия выделяется йод, тогда как с кислородом эта реакция не идет: 2 КI + О 3 + Н 2 О = I 2 + 2 КОН + О 2. Реакция часто используется как качественная для обнаружения ионов I- или озона. Для этого в раствор добавляют крахмал, который дает характерный синий комплекс с выделившимся иодом. Реакция качественная еще и потому, что озон не окисляет ионы Сl- и Br-. При пропускании газообразного озона через раствор какого-либо алкена в тетрахлорметане при температуре ниже 20°С образуется озонид соответствующего алкена: O / H 2 C = CH 2 + O 3 → H 2 C CH 2 / O озонид этилена O
 Свойства серы Атом серы, имея незавершенный внешний энергетический уровень, может присоединять два электрона и проявлять степень окисления -2. Такую степень окисления сера проявляет в соединениях с металлами и водородом (например, Na 2 S и Н 2 S). При отдаче или оттягивании электронов к атому более электроотрицательного элемента степень окисления серы может быть +2, +4 и +6. Сера легко образует соединения со многими элементами. При сгорании ее на воздухе или в кислороде образуется оксид серы (IV) SО 2 и частично оксид серы (VI) SO 3: S + O 2 = SO 2 и 2 S + 3 O 2 = 2 SO 3 Это наиболее важные оксиды серы.
Свойства серы Атом серы, имея незавершенный внешний энергетический уровень, может присоединять два электрона и проявлять степень окисления -2. Такую степень окисления сера проявляет в соединениях с металлами и водородом (например, Na 2 S и Н 2 S). При отдаче или оттягивании электронов к атому более электроотрицательного элемента степень окисления серы может быть +2, +4 и +6. Сера легко образует соединения со многими элементами. При сгорании ее на воздухе или в кислороде образуется оксид серы (IV) SО 2 и частично оксид серы (VI) SO 3: S + O 2 = SO 2 и 2 S + 3 O 2 = 2 SO 3 Это наиболее важные оксиды серы.
 При нагревании сера непосредственно соединяется с водородом, галогенами (кроме йода), фосфором, углем, а также со всеми металлами, кроме золота, платины и иридия. Например: S + Н 2 = Н 2 S; 3 S + 2 Р = Р 2 S 3; S + Cl 2 = SСl 2; 2 S + С = СS 2; S + Fе = Fе. S Как следует из примеров, в реакциях с металлами и некоторыми неметаллами сера является окислителем, в реакциях же с более активными неметаллами, как например, с кислородом, хлором, - восстановителем.
При нагревании сера непосредственно соединяется с водородом, галогенами (кроме йода), фосфором, углем, а также со всеми металлами, кроме золота, платины и иридия. Например: S + Н 2 = Н 2 S; 3 S + 2 Р = Р 2 S 3; S + Cl 2 = SСl 2; 2 S + С = СS 2; S + Fе = Fе. S Как следует из примеров, в реакциях с металлами и некоторыми неметаллами сера является окислителем, в реакциях же с более активными неметаллами, как например, с кислородом, хлором, - восстановителем.
 Свойства селена Селен — аналог серы и проявляет степени окисления − 2 (H 2 Se), +4 (Se. O 2) и +6 (H 2 Se. O 4). Однако, в отличие от серы, соединения селена в степени окисления +6 — сильнейшие окислители, а соединения селена (-2) гораздо более сильные восстановители, чем соответствующие соединения серы. Простое вещество — селен гораздо менее активно химически, чем сера. Так, в отличие от серы, селен не способен гореть на воздухе самостоятельно]. Окислить селен удаётся только при дополнительном нагревании, при котором он медленного горит синим пламенем, превращаясь в двуокись Se. O 2. Со щелочными металлами селен реагирует (весьма бурно) только будучи расплавленным. В отличие от SO 2, Se. O 2 — не газ, а кристаллическое вещество, хорошо растворимое в воде. Получить селенистую кислоту (Se. O 2 + H 2 O → H 2 Se. O 3) ничуть не сложнее, чем сернистую. А действуя на неё сильным окислителем (например, HCl. O 3), получают селеновую кислоту H 2 Se. O 4, почти такую же сильную, как серная.
Свойства селена Селен — аналог серы и проявляет степени окисления − 2 (H 2 Se), +4 (Se. O 2) и +6 (H 2 Se. O 4). Однако, в отличие от серы, соединения селена в степени окисления +6 — сильнейшие окислители, а соединения селена (-2) гораздо более сильные восстановители, чем соответствующие соединения серы. Простое вещество — селен гораздо менее активно химически, чем сера. Так, в отличие от серы, селен не способен гореть на воздухе самостоятельно]. Окислить селен удаётся только при дополнительном нагревании, при котором он медленного горит синим пламенем, превращаясь в двуокись Se. O 2. Со щелочными металлами селен реагирует (весьма бурно) только будучи расплавленным. В отличие от SO 2, Se. O 2 — не газ, а кристаллическое вещество, хорошо растворимое в воде. Получить селенистую кислоту (Se. O 2 + H 2 O → H 2 Se. O 3) ничуть не сложнее, чем сернистую. А действуя на неё сильным окислителем (например, HCl. O 3), получают селеновую кислоту H 2 Se. O 4, почти такую же сильную, как серная.
 Свойства теллура Теллур — хрупкое серебристо-белое вещество с металлическим блеском. В тонких слоях на просвет краснокоричневый, в парах — золотисто-жёлтый. Химически теллур менее активен, чем сера. Он растворяется в щелочах, поддается действию азотной и серной кислот, но в разбавленной соляной кислоте растворяется слабо. С водой металлический теллур начинает реагировать при 100 °C, а в виде порошка он окисляется на воздухе даже при комнатной температуре, образуя оксид Te. O 2. При нагреве на воздухе теллур сгорает, образуя Te. O 2. Это прочное соединение обладает меньшей летучестью, чем сам теллур. Поэтому для очистки теллура от оксидов их восстанавливают проточным водородом при 500 — 600 °C. В расплавленном состоянии теллур довольно инертен, поэтому в качестве контейнерных материалов при его плавке применяют графит и кварц.
Свойства теллура Теллур — хрупкое серебристо-белое вещество с металлическим блеском. В тонких слоях на просвет краснокоричневый, в парах — золотисто-жёлтый. Химически теллур менее активен, чем сера. Он растворяется в щелочах, поддается действию азотной и серной кислот, но в разбавленной соляной кислоте растворяется слабо. С водой металлический теллур начинает реагировать при 100 °C, а в виде порошка он окисляется на воздухе даже при комнатной температуре, образуя оксид Te. O 2. При нагреве на воздухе теллур сгорает, образуя Te. O 2. Это прочное соединение обладает меньшей летучестью, чем сам теллур. Поэтому для очистки теллура от оксидов их восстанавливают проточным водородом при 500 — 600 °C. В расплавленном состоянии теллур довольно инертен, поэтому в качестве контейнерных материалов при его плавке применяют графит и кварц.
 Свойства полония В разбавленной соляной кислоте полоний медленно растворяется, образуя розовые растворы (цвет ионов Po 2+): Po + 2 HCl → Po. Cl 2 + Н 2, однако под действием собственной радиации дихлорид превращается в жёлтый тетрахлорид Po. Cl 4. Разбавленная азотная кислота пассивирует полоний, а концентрированная быстро его растворяет. С неметаллами VI группы полоний роднят реакция с водородом, при которой образуется летучий гидрид Po. Н 2 (т. пл. – 35°С, т. кип. +35°С, легко разлагается), реакция с металлами (при нагревании) с образованием твёрдых полонидов черного цвета (Na 2 Po, Ag 2 Po, Be. Po, Mg. Po, Ca. Po, Zn. Po, Hg. Po, Pb. Po, Ni. Po, Pt. Po) и реакция с расплавленными щелочами с образованием полонидов и солей полониевой кислоты: 3 Po + 6 Na. OH → 2 Na 2 Po + Na 2 Po. O 3 + Н 2 O. С хлором полоний реагирует при нагревании, образуя ярко-жёлтыекристаллы Po. Cl 4, с бромом получаются красные кристаллы Po. Br 4, с иодом уже при 40°С — чёрный летучий иодид Po. I 4. Известен и белый тетрафторид полония Po. F 4. При нагревании тетрагалогениды разлагаются с образованием более стабильных дигалогенидов — рубиново-красного Po. Cl 2 и фиолетово-коричневого Po. Br 2. Известны комплексные галогениды, например (NH 4)2 Po. Br 6. В растворах полоний существует в виде катионов Po 2+, Po 4+, анионов Po. O 32–, Po. O 42–, а также разнообразных комплексных ионов, например Po. Cl 62–.
Свойства полония В разбавленной соляной кислоте полоний медленно растворяется, образуя розовые растворы (цвет ионов Po 2+): Po + 2 HCl → Po. Cl 2 + Н 2, однако под действием собственной радиации дихлорид превращается в жёлтый тетрахлорид Po. Cl 4. Разбавленная азотная кислота пассивирует полоний, а концентрированная быстро его растворяет. С неметаллами VI группы полоний роднят реакция с водородом, при которой образуется летучий гидрид Po. Н 2 (т. пл. – 35°С, т. кип. +35°С, легко разлагается), реакция с металлами (при нагревании) с образованием твёрдых полонидов черного цвета (Na 2 Po, Ag 2 Po, Be. Po, Mg. Po, Ca. Po, Zn. Po, Hg. Po, Pb. Po, Ni. Po, Pt. Po) и реакция с расплавленными щелочами с образованием полонидов и солей полониевой кислоты: 3 Po + 6 Na. OH → 2 Na 2 Po + Na 2 Po. O 3 + Н 2 O. С хлором полоний реагирует при нагревании, образуя ярко-жёлтыекристаллы Po. Cl 4, с бромом получаются красные кристаллы Po. Br 4, с иодом уже при 40°С — чёрный летучий иодид Po. I 4. Известен и белый тетрафторид полония Po. F 4. При нагревании тетрагалогениды разлагаются с образованием более стабильных дигалогенидов — рубиново-красного Po. Cl 2 и фиолетово-коричневого Po. Br 2. Известны комплексные галогениды, например (NH 4)2 Po. Br 6. В растворах полоний существует в виде катионов Po 2+, Po 4+, анионов Po. O 32–, Po. O 42–, а также разнообразных комплексных ионов, например Po. Cl 62–.
