эл.хим.сист. 2011.pptx
- Количество слайдов: 55
 Электрохимические системы Гаальванические элементы Электролиз коррозия
Электрохимические системы Гаальванические элементы Электролиз коррозия
 Электрохимические процессы Любые процессы взаимного превращения химической и электрической форм энергии называются электрохимическими.
Электрохимические процессы Любые процессы взаимного превращения химической и электрической форм энергии называются электрохимическими.
 Основные способы осуществления ОВР § Химический способ – непосредственная передача электронов от восстановителя к окислителю. § Электрохимический способ – хаотический перенос электронов преобразуется в направленный процесс, т. е. от восстановителя через внешнюю цепь к окислителю. § В электрохимическом процессе полуреакции окисления и восстановления пространственно разделены
Основные способы осуществления ОВР § Химический способ – непосредственная передача электронов от восстановителя к окислителю. § Электрохимический способ – хаотический перенос электронов преобразуется в направленный процесс, т. е. от восстановителя через внешнюю цепь к окислителю. § В электрохимическом процессе полуреакции окисления и восстановления пространственно разделены
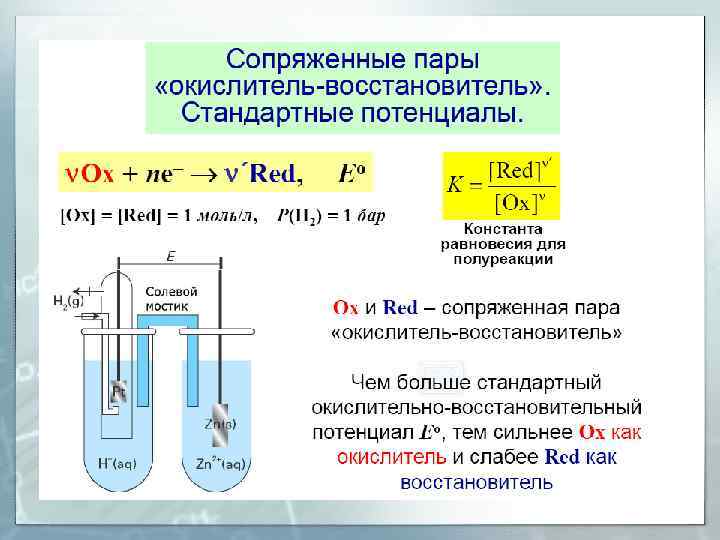
 Критерии самопроизвольного протекания ОВ реакций Эл. работа по переносу электронов Разность потенциалов между электродами Переносимый эл. заряд Число электронов, переходящих в элементарном акте ОВР
Критерии самопроизвольного протекания ОВ реакций Эл. работа по переносу электронов Разность потенциалов между электродами Переносимый эл. заряд Число электронов, переходящих в элементарном акте ОВР
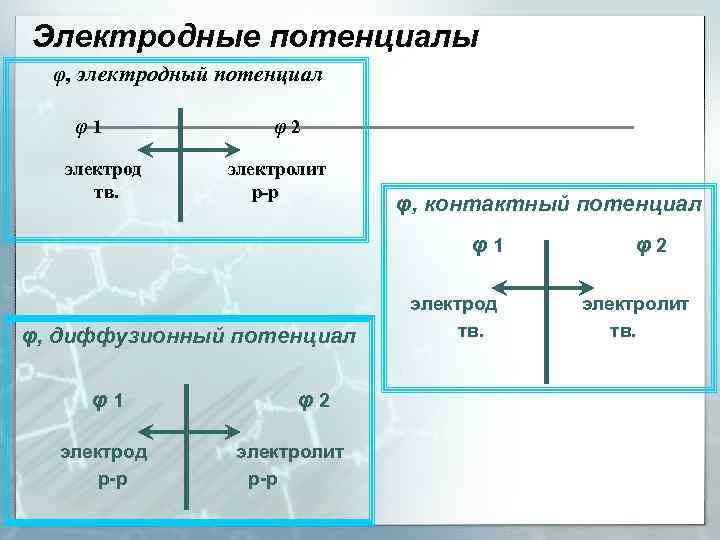 Электродные потенциалы φ, электродный потенциал φ1 электрод тв. φ2 электролит р-р φ, контактный потенциал φ1 φ, диффузионный потенциал φ1 электрод р-р φ2 электролит р-р электрод тв. φ2 электролит тв.
Электродные потенциалы φ, электродный потенциал φ1 электрод тв. φ2 электролит р-р φ, контактный потенциал φ1 φ, диффузионный потенциал φ1 электрод р-р φ2 электролит р-р электрод тв. φ2 электролит тв.
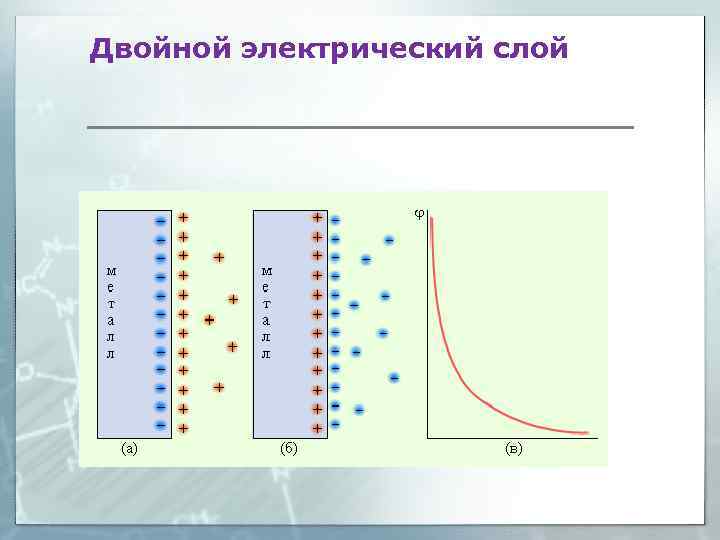
 Механизм образования двойного электрического слоя Электродный потенциал E – разность потенциалов между металлом и его катионами в растворе, возникающая при образовании двойного электрического слоя. Cu – 2 e = Cu 2+
Механизм образования двойного электрического слоя Электродный потенциал E – разность потенциалов между металлом и его катионами в растворе, возникающая при образовании двойного электрического слоя. Cu – 2 e = Cu 2+
 Двойной электрический слой
Двойной электрический слой
 Двойной электрический слой Pb 2++S 2 -→Pb. S ДЭС может образоваться в результате: 1. Обмена ионами между металлом и раствором 2. Адсорбции ионов на поверхности электрода 3. Выхода электронов из кристаллической решётки электрода Возникновение электронного потенциала на границе раздела фаз. Движущая сила этих процессов связана с неравноценностью энергетического состояния компонентов в контактирующих фазах.
Двойной электрический слой Pb 2++S 2 -→Pb. S ДЭС может образоваться в результате: 1. Обмена ионами между металлом и раствором 2. Адсорбции ионов на поверхности электрода 3. Выхода электронов из кристаллической решётки электрода Возникновение электронного потенциала на границе раздела фаз. Движущая сила этих процессов связана с неравноценностью энергетического состояния компонентов в контактирующих фазах.
 Электродный потенциал § Потенциал, который устанавливается на границе раздела фаз (электрод-электролит) в результате протекания равновесной электродной реакции Зависит от: • Химической природы электрода и электролита и вида электродной реакции • Концентрации веществ, участвующих в электродной реакции • Температуры
Электродный потенциал § Потенциал, который устанавливается на границе раздела фаз (электрод-электролит) в результате протекания равновесной электродной реакции Зависит от: • Химической природы электрода и электролита и вида электродной реакции • Концентрации веществ, участвующих в электродной реакции • Температуры
 Электродный потенциал уравнение нернста
Электродный потенциал уравнение нернста
 Cтандартный электродный потенциал Величина электродного потенциала определяется по водородной шкале. В качестве « 0» выбран стандартный водородный электрод. По сравнению с водородным электродом потенциал других элементов имеет положительное или отрицательное значение.
Cтандартный электродный потенциал Величина электродного потенциала определяется по водородной шкале. В качестве « 0» выбран стандартный водородный электрод. По сравнению с водородным электродом потенциал других элементов имеет положительное или отрицательное значение.


 Типы электродов § § § Электроды 1 -го рода Электроды 2 -го рода Окислительно-восстановительные электроды Ионоселективные электроды Газовые электроды
Типы электродов § § § Электроды 1 -го рода Электроды 2 -го рода Окислительно-восстановительные электроды Ионоселективные электроды Газовые электроды
 Электроды 1 -го рода Металл или неметалл погруженный в электролит, содержащий ионы этого металла или неметалла Электрод 1 -го рода обменивается с электролитом или только катионами или только анионами
Электроды 1 -го рода Металл или неметалл погруженный в электролит, содержащий ионы этого металла или неметалла Электрод 1 -го рода обменивается с электролитом или только катионами или только анионами
 Металлический электрод Схема электрода Ме Ме. А Электродная реакция Mеz+ + ze- ⇆ Mе 0 ОКИСЛЕННАЯ ВОССТАНОВЛЕННАЯ Уравнение Нернста для металлического электрода
Металлический электрод Схема электрода Ме Ме. А Электродная реакция Mеz+ + ze- ⇆ Mе 0 ОКИСЛЕННАЯ ВОССТАНОВЛЕННАЯ Уравнение Нернста для металлического электрода
 Неметаллический электрод Схема электрода Pt, A KА Электродная реакция A + ze- ⇆ Az- ОКИСЛЕННАЯ ВОССТАНОВЛЕННАЯ Pt в электродной реакции не участвует, с ее помощью передаются электроны Уравнение Нернста для неметаллического электрода
Неметаллический электрод Схема электрода Pt, A KА Электродная реакция A + ze- ⇆ Az- ОКИСЛЕННАЯ ВОССТАНОВЛЕННАЯ Pt в электродной реакции не участвует, с ее помощью передаются электроны Уравнение Нернста для неметаллического электрода



 Окислительно-восстановительный электрод Схема электрода Pt ок, вос Pt Fe 3+, Fe 2+ Электродная реакция ОК + ze- ⇆ ВОС Fe 3+ + e- ⇆ Fe 2+ Pt в электродной реакции не участвует, с ее помощью передаются электроны Уравнение Нернста для окислительно-восстановительного электрода
Окислительно-восстановительный электрод Схема электрода Pt ок, вос Pt Fe 3+, Fe 2+ Электродная реакция ОК + ze- ⇆ ВОС Fe 3+ + e- ⇆ Fe 2+ Pt в электродной реакции не участвует, с ее помощью передаются электроны Уравнение Нернста для окислительно-восстановительного электрода

 Стандартный водородный электрод Стандартные условия: ан+ = 1 моль/л, Р = 1 атм, Т= 298 К Схема электрода: Pt, H 2 H+ H 2 -2 e 2 H+ φH+/H 2˚ = 0 Зависимость электродного потенциала от р. Н a. H φH+/H 2˚=φ˚H+/H ˚+ ∙lg( )=0+0, 059∙lga. H PH р. Н = - lg a. H если ан+ ≠ 1 моль/л φH+/H 2˚ = -0, 059 р. Н + 2 2 + +
Стандартный водородный электрод Стандартные условия: ан+ = 1 моль/л, Р = 1 атм, Т= 298 К Схема электрода: Pt, H 2 H+ H 2 -2 e 2 H+ φH+/H 2˚ = 0 Зависимость электродного потенциала от р. Н a. H φH+/H 2˚=φ˚H+/H ˚+ ∙lg( )=0+0, 059∙lga. H PH р. Н = - lg a. H если ан+ ≠ 1 моль/л φH+/H 2˚ = -0, 059 р. Н + 2 2 + +
 Водородный электрод Схема электрода Pt, H 2 Ι HCl Электродная реакция 2 H+ + 2 e- ⇆ H 2 Pt в электродной реакции не участвует, с ее помощью передаются электроны Уравнение Нернста для водородного электрода
Водородный электрод Схема электрода Pt, H 2 Ι HCl Электродная реакция 2 H+ + 2 e- ⇆ H 2 Pt в электродной реакции не участвует, с ее помощью передаются электроны Уравнение Нернста для водородного электрода
 Кислородный электрод Схема электрода Pt, О 2 Ι КОН Электродная реакция O 2+4 e-+2 H 2 O ⇆ 4 OH- Pt в электродной реакции не участвует, с ее помощью передаются электроны Уравнение Нернста для кислородного электрода
Кислородный электрод Схема электрода Pt, О 2 Ι КОН Электродная реакция O 2+4 e-+2 H 2 O ⇆ 4 OH- Pt в электродной реакции не участвует, с ее помощью передаются электроны Уравнение Нернста для кислородного электрода

 Гальванические элементы Химические источники тока
Гальванические элементы Химические источники тока
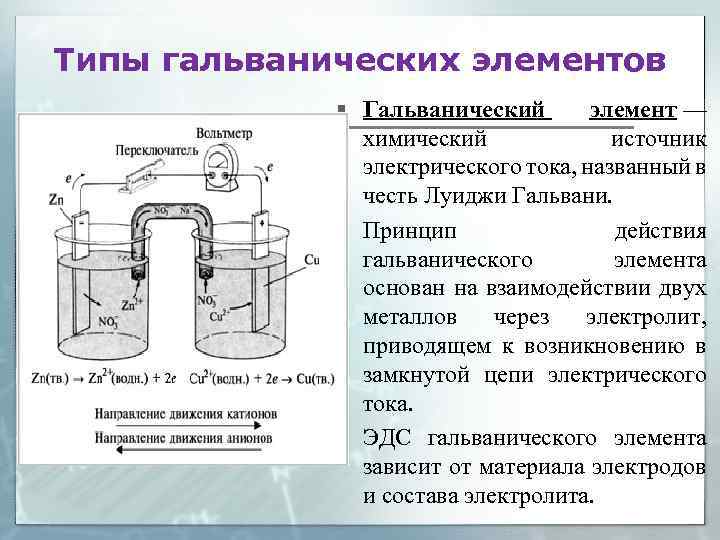 Типы гальванических элементов § Гальванический элемент — химический источник электрического тока, названный в честь Луиджи Гальвани. § Принцип действия гальванического элемента основан на взаимодействии двух металлов через электролит, приводящем к возникновению в замкнутой цепи электрического тока. § ЭДС гальванического элемента зависит от материала электродов и состава электролита.
Типы гальванических элементов § Гальванический элемент — химический источник электрического тока, названный в честь Луиджи Гальвани. § Принцип действия гальванического элемента основан на взаимодействии двух металлов через электролит, приводящем к возникновению в замкнутой цепи электрического тока. § ЭДС гальванического элемента зависит от материала электродов и состава электролита.
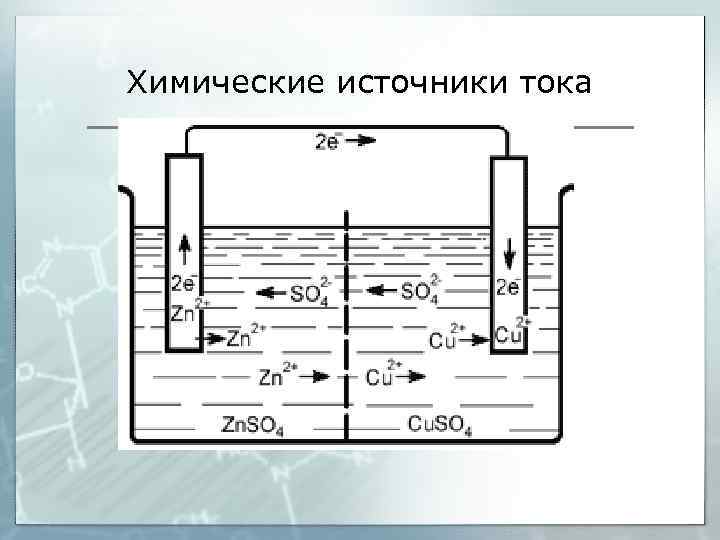 Химические источники тока -Zn I Zn. SO 4 II Cu. SO 4 I Cu +
Химические источники тока -Zn I Zn. SO 4 II Cu. SO 4 I Cu +
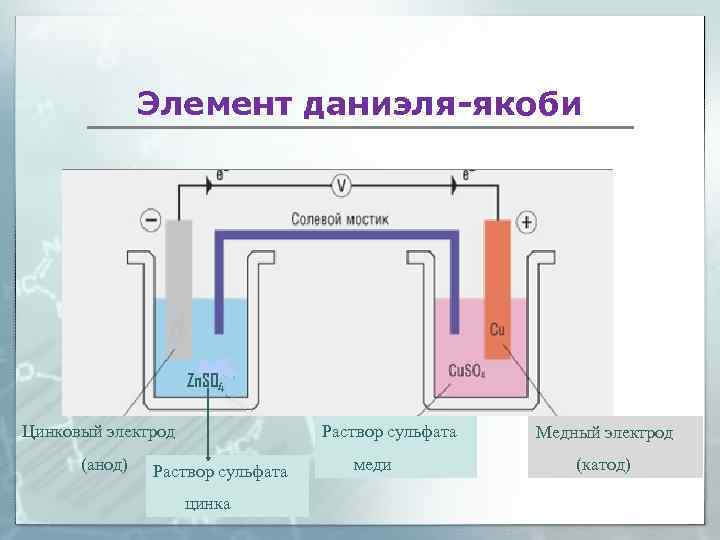 Элемент даниэля-якоби Zn. SO 4 Цинковый электрод Раствор сульфата Медный электрод (анод) меди (катод) Раствор сульфата цинка
Элемент даниэля-якоби Zn. SO 4 Цинковый электрод Раствор сульфата Медный электрод (анод) меди (катод) Раствор сульфата цинка
 Zn Zn. SO 4 Cu. SO 4 Cu Zn˚ - 2 e Zn+2 φ˚= -0, 76 В в-ль Cu+2 + 2 e Cu˚ φ˚= +0, 34 В ок-ль ЕОВР = φ˚ок - φ˚в-ля = 0, 34 – (-0, 76) > 0 ЭДС Токообразующая реакция: Σ Zn˚ + Cu+2 → Zn+2 + Cu˚ ∆G˚обр = -z. FE, где z – число электронов, участвующих в реакции
Zn Zn. SO 4 Cu. SO 4 Cu Zn˚ - 2 e Zn+2 φ˚= -0, 76 В в-ль Cu+2 + 2 e Cu˚ φ˚= +0, 34 В ок-ль ЕОВР = φ˚ок - φ˚в-ля = 0, 34 – (-0, 76) > 0 ЭДС Токообразующая реакция: Σ Zn˚ + Cu+2 → Zn+2 + Cu˚ ∆G˚обр = -z. FE, где z – число электронов, участвующих в реакции
 Типы гальванических элементов Обратимые гальванические элементы – гальванические элементы, в которых прямая (токообразующая реакция) и обратная (потребление электрической энергии) представляют собой одну и ту же взаимообратимую реакцию. Необратимые гальванические элементы – гальванические элементы, в которых прямая токообразующая реакция не соответствует обратной реакции потребления электрической энергии.
Типы гальванических элементов Обратимые гальванические элементы – гальванические элементы, в которых прямая (токообразующая реакция) и обратная (потребление электрической энергии) представляют собой одну и ту же взаимообратимую реакцию. Необратимые гальванические элементы – гальванические элементы, в которых прямая токообразующая реакция не соответствует обратной реакции потребления электрической энергии.
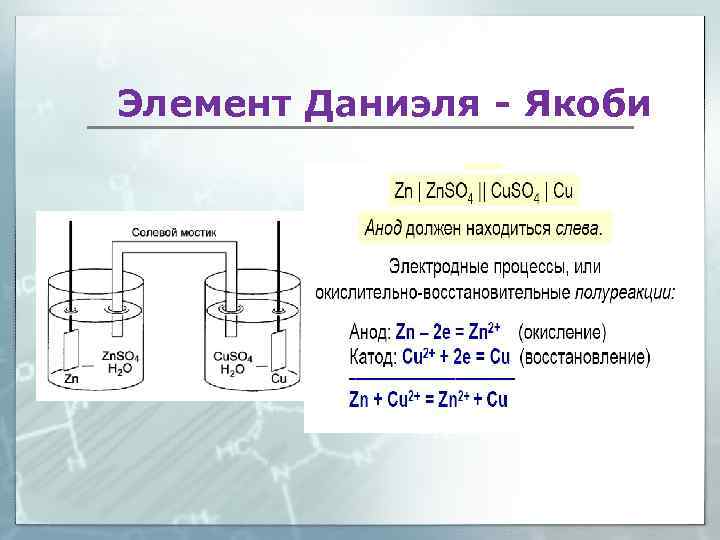 Элемент Даниэля - Якоби
Элемент Даниэля - Якоби
 Мерой работоспособности ГЭ элемента является ЭДС или разность потенциалов электродов:
Мерой работоспособности ГЭ элемента является ЭДС или разность потенциалов электродов:
 Необратимые гальванические элементы - гальванические элементы, в которых не может протекать взаимообратная реакция, то есть прямая токообразующая реакция не соответствует обратной реакции потребления химической энергии. § Прямой процесс -Zn|Cu. SO |Cu+ 4 4 0 -2 e→Zn 2+ Zn Cu 2++2 e→Cu 0 § Обратный процесс Cu 2++2 e→cu 0 Cu 0 -2 e→Cu 2+ § Потребление тока E 2 ≠ -E 1
Необратимые гальванические элементы - гальванические элементы, в которых не может протекать взаимообратная реакция, то есть прямая токообразующая реакция не соответствует обратной реакции потребления химической энергии. § Прямой процесс -Zn|Cu. SO |Cu+ 4 4 0 -2 e→Zn 2+ Zn Cu 2++2 e→Cu 0 § Обратный процесс Cu 2++2 e→cu 0 Cu 0 -2 e→Cu 2+ § Потребление тока E 2 ≠ -E 1
 Концентрационные гальванические элементы § Концентрационные гальванические элементы – это необратимые гальванические элементы, в которых источником энергии является работа выравнивания концентраций в системе
Концентрационные гальванические элементы § Концентрационные гальванические элементы – это необратимые гальванические элементы, в которых источником энергии является работа выравнивания концентраций в системе

 Необратимые гальванические элементы Cухие гальванические элементы Zn→Zn 2++2 e 2 NH 4++2 Mn. O 2+2 e→Mn 2 O 3+2 NH 3+H 2 O
Необратимые гальванические элементы Cухие гальванические элементы Zn→Zn 2++2 e 2 NH 4++2 Mn. O 2+2 e→Mn 2 O 3+2 NH 3+H 2 O
 Применение § Электрический аккумулятор — химический источник тока многоразового действия (в отличие от гальванического элемента, химические реакции, непосредственно превращаемые в электрическую энергию в них, многократно обратимы). Электрические аккумуляторы используются для накопления энергии и автономного питания различных устройств.
Применение § Электрический аккумулятор — химический источник тока многоразового действия (в отличие от гальванического элемента, химические реакции, непосредственно превращаемые в электрическую энергию в них, многократно обратимы). Электрические аккумуляторы используются для накопления энергии и автономного питания различных устройств.
 Свинцовый аккумулятор
Свинцовый аккумулятор
 Равновесные потенциалы выделения водорода и кислорода p. H Уравнения электродных реакций Электродный потенциал, В р. Н< 7 2 Н + + 2 е = Н 2 0 р. Н< 7 2 H 2 O - 4 е = O 2 + 4 Н + 1, 227 р. Н =7 2 Н 2 О + 2 е = Н 2 + 2 OН - -0, 413 р. Н= 7 2 Н 2 О - 4 е = O 2 + 4 Н + 0, 814 р. Н> 7 2 Н 2 О + 2 е = Н 2 + 2 OН - -0, 828 р. Н> 7 4 OН - - 4 е = О 2 + 2 Н 2 O 0, 401
Равновесные потенциалы выделения водорода и кислорода p. H Уравнения электродных реакций Электродный потенциал, В р. Н< 7 2 Н + + 2 е = Н 2 0 р. Н< 7 2 H 2 O - 4 е = O 2 + 4 Н + 1, 227 р. Н =7 2 Н 2 О + 2 е = Н 2 + 2 OН - -0, 413 р. Н= 7 2 Н 2 О - 4 е = O 2 + 4 Н + 0, 814 р. Н> 7 2 Н 2 О + 2 е = Н 2 + 2 OН - -0, 828 р. Н> 7 4 OН - - 4 е = О 2 + 2 Н 2 O 0, 401
 Коррозия
Коррозия
 Коррозия – разрушение любого материала под действием окружающей среды. Различают следующие виды коррозии: 1) Химическая 2) электрохимическая
Коррозия – разрушение любого материала под действием окружающей среды. Различают следующие виды коррозии: 1) Химическая 2) электрохимическая
 ХИМИЧЕСКАЯ КОРРОЗИЯ Химическая коррозия – разрушение металлов из-за взаимодействия с окислителями в средах, не обладающих ионной проводимостью (газовая, атмосферная в сухом газе, в сухом воздухе). 3 Fe + 2 O 2 Fe 3 O 4 Рыхлая плёнка 2 Al + 3 O 2 2 Al 2 O 3 Плотная плёнка Скорость химической реакции определяется свойствами металла окислителя и свойствами продукта, образовавшегося на поверхности. Скорость химической реакции прямо пропорциональна скорости диффузии окислителя через плёнку продукта к чистому металлу. Ti, Zr, Ni, Cr, V, Mo, W – коррозионностойкие металлы
ХИМИЧЕСКАЯ КОРРОЗИЯ Химическая коррозия – разрушение металлов из-за взаимодействия с окислителями в средах, не обладающих ионной проводимостью (газовая, атмосферная в сухом газе, в сухом воздухе). 3 Fe + 2 O 2 Fe 3 O 4 Рыхлая плёнка 2 Al + 3 O 2 2 Al 2 O 3 Плотная плёнка Скорость химической реакции определяется свойствами металла окислителя и свойствами продукта, образовавшегося на поверхности. Скорость химической реакции прямо пропорциональна скорости диффузии окислителя через плёнку продукта к чистому металлу. Ti, Zr, Ni, Cr, V, Mo, W – коррозионностойкие металлы
 ЭЛЕКТРОХИМИЧЕСКАЯ КОРРОЗИЯ Электрохимическая коррозия возникает в средах с ионной проводимостью из-за образования микрогальванических элементов. Среда: • Вода (морская, речная) • Грунтовые воды • Влажные почва • Влажный атмосферный воздух • Растворы электролитов
ЭЛЕКТРОХИМИЧЕСКАЯ КОРРОЗИЯ Электрохимическая коррозия возникает в средах с ионной проводимостью из-за образования микрогальванических элементов. Среда: • Вода (морская, речная) • Грунтовые воды • Влажные почва • Влажный атмосферный воздух • Растворы электролитов
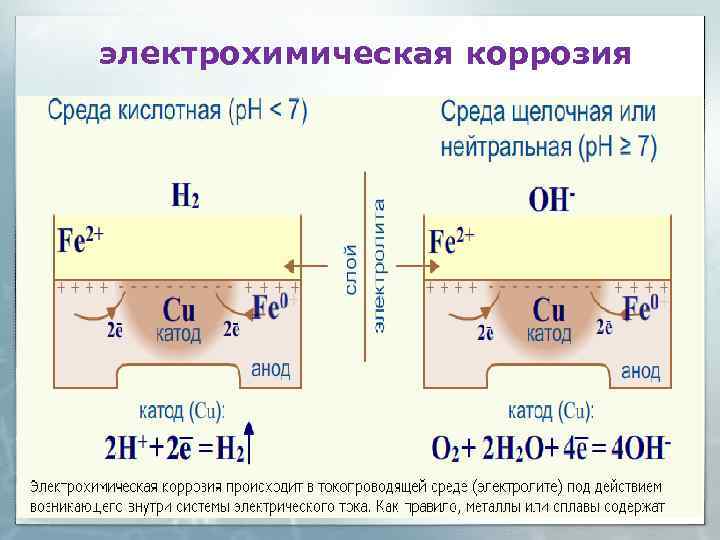 электрохимическая коррозия
электрохимическая коррозия
 Коррозия Fe с менее активным элементом Fe Sn коррозионная пара Н 2 О КОН EFe = -0, 44 В ЕSn = -0, 13 B анод Fe˚ - 2 e → Fe+2 катод О 2 + 4 е + 2 Н 2 О → 4 ОН_ +2+4 OH Σ 2 Fe˚+O 2 + 2 H 2 O → 2 Fe (2 Fe(OH)2↓) Fe Н 2 О, ОН _ О 2, Sn коррозия с кислородной деполяризацией
Коррозия Fe с менее активным элементом Fe Sn коррозионная пара Н 2 О КОН EFe = -0, 44 В ЕSn = -0, 13 B анод Fe˚ - 2 e → Fe+2 катод О 2 + 4 е + 2 Н 2 О → 4 ОН_ +2+4 OH Σ 2 Fe˚+O 2 + 2 H 2 O → 2 Fe (2 Fe(OH)2↓) Fe Н 2 О, ОН _ О 2, Sn коррозия с кислородной деполяризацией
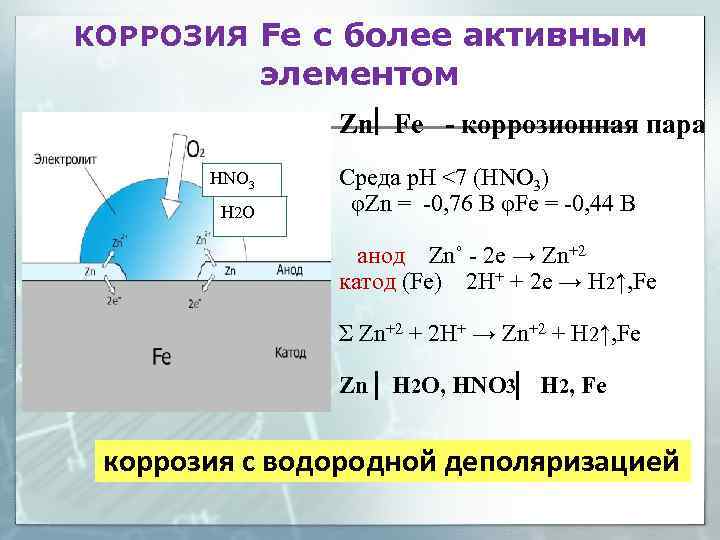 КОРРОЗИЯ Fe с более активным элементом Zn Fe - коррозионная пара НNO 3 H 2 O Среда р. Н <7 (НNO 3) φZn = -0, 76 В φFe = -0, 44 В анод Zn˚ - 2 e → Zn+2 катод (Fe) 2 Н+ + 2 е → Н 2↑, Fe Σ Zn+2 + 2 Н+ → Zn+2 + H 2↑, Fe Zn H 2 O, HNO 3 H 2, Fe коррозия с водородной деполяризацией
КОРРОЗИЯ Fe с более активным элементом Zn Fe - коррозионная пара НNO 3 H 2 O Среда р. Н <7 (НNO 3) φZn = -0, 76 В φFe = -0, 44 В анод Zn˚ - 2 e → Zn+2 катод (Fe) 2 Н+ + 2 е → Н 2↑, Fe Σ Zn+2 + 2 Н+ → Zn+2 + H 2↑, Fe Zn H 2 O, HNO 3 H 2, Fe коррозия с водородной деполяризацией
 Электрохимическая коррозия 1) Электрохимическая коррозия возникает в токопроводящих средах при наличии контакта разнородных металлов, за счет образования гальванических микроэлементов. 2) При коррозии происходит анодное растворение металла, за счет катодного восстановления окислителя среды, где в р. Н < 7 – окислитель – Н+, в р. Н =7 и р. Н > 7 – окислитель – О 2. 3) Скорость коррозии более активных металлов возрастает в случае электрохимической коррозии. 4) Процесс коррозии идет самопроизвольно, если φок-ля > φанодного р-ния Ме
Электрохимическая коррозия 1) Электрохимическая коррозия возникает в токопроводящих средах при наличии контакта разнородных металлов, за счет образования гальванических микроэлементов. 2) При коррозии происходит анодное растворение металла, за счет катодного восстановления окислителя среды, где в р. Н < 7 – окислитель – Н+, в р. Н =7 и р. Н > 7 – окислитель – О 2. 3) Скорость коррозии более активных металлов возрастает в случае электрохимической коррозии. 4) Процесс коррозии идет самопроизвольно, если φок-ля > φанодного р-ния Ме
 Выводы: 1) Электрохимическая коррозия возникает в средах с ионной проводимостью при наличии контакта двух разнородных металлов или металл и неметалл, неметалл выполняет роль катода. 2) При электрохимической коррозии идёт самопроизвольное разрушение более активного элемента (анода - с меньшим E 0) за счёт катодного восстановления окислителей среды. Окислители среды: p. H<7 : H+, Fe 3+, Cr 2 O 72 -. p. H ≥ 7: O 2 (растворённый) Катодная реакция: 2 Н+ + 2 е → Н 2↑ O 2 + 4 e + H 2 O ⇄ 4 OH 3)При электрохимической коррозии скорость окисления более активного металла увеличивается, а менее активного – уменьшается по сравнению с химической коррозией.
Выводы: 1) Электрохимическая коррозия возникает в средах с ионной проводимостью при наличии контакта двух разнородных металлов или металл и неметалл, неметалл выполняет роль катода. 2) При электрохимической коррозии идёт самопроизвольное разрушение более активного элемента (анода - с меньшим E 0) за счёт катодного восстановления окислителей среды. Окислители среды: p. H<7 : H+, Fe 3+, Cr 2 O 72 -. p. H ≥ 7: O 2 (растворённый) Катодная реакция: 2 Н+ + 2 е → Н 2↑ O 2 + 4 e + H 2 O ⇄ 4 OH 3)При электрохимической коррозии скорость окисления более активного металла увеличивается, а менее активного – уменьшается по сравнению с химической коррозией.
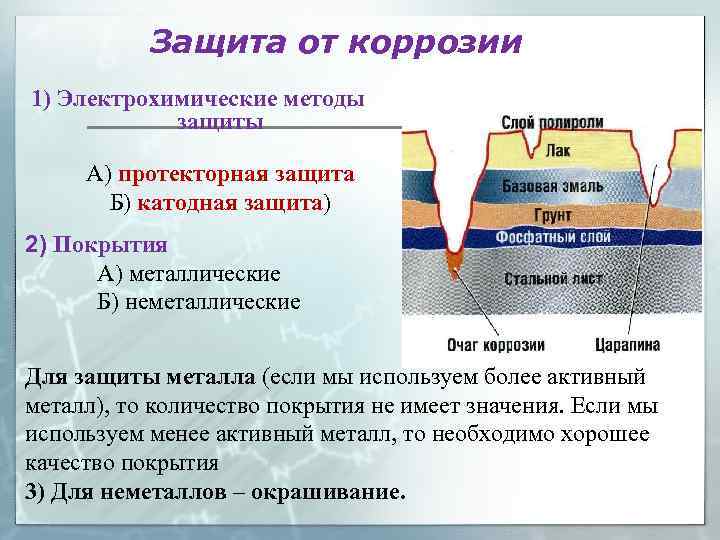 Защита от коррозии 1) Электрохимические методы защиты А) протекторная защита Б) катодная защита) 2) Покрытия А) металлические Б) неметаллические Для защиты металла (если мы используем более активный металл), то количество покрытия не имеет значения. Если мы используем менее активный металл, то необходимо хорошее качество покрытия 3) Для неметаллов – окрашивание.
Защита от коррозии 1) Электрохимические методы защиты А) протекторная защита Б) катодная защита) 2) Покрытия А) металлические Б) неметаллические Для защиты металла (если мы используем более активный металл), то количество покрытия не имеет значения. Если мы используем менее активный металл, то необходимо хорошее качество покрытия 3) Для неметаллов – окрашивание.
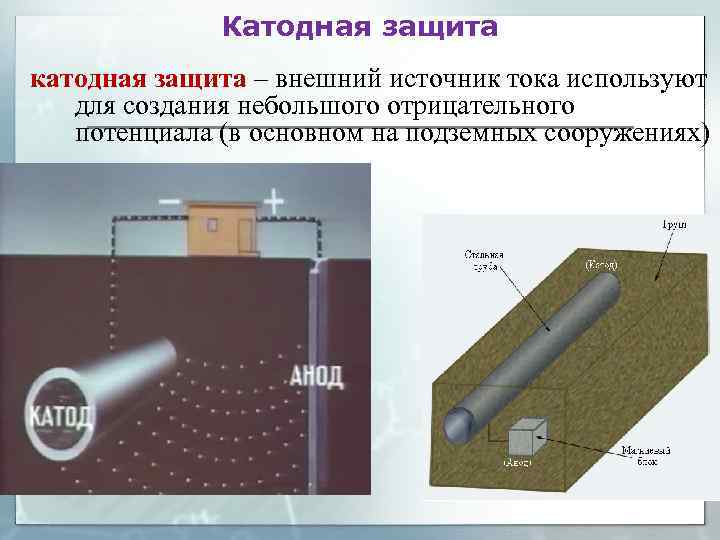 Катодная защита катодная защита – внешний источник тока используют для создания небольшого отрицательного потенциала (в основном на подземных сооружениях)
Катодная защита катодная защита – внешний источник тока используют для создания небольшого отрицательного потенциала (в основном на подземных сооружениях)
 Протекторная защита протекторная защита – основной металл приводят в контакт с более активным металлом. Более активный будет разрушаться, а менее активный – сохраняться.
Протекторная защита протекторная защита – основной металл приводят в контакт с более активным металлом. Более активный будет разрушаться, а менее активный – сохраняться.

