Электронное строение.pptx
- Количество слайдов: 31
 Электронное строение атома и периодический закон
Электронное строение атома и периодический закон
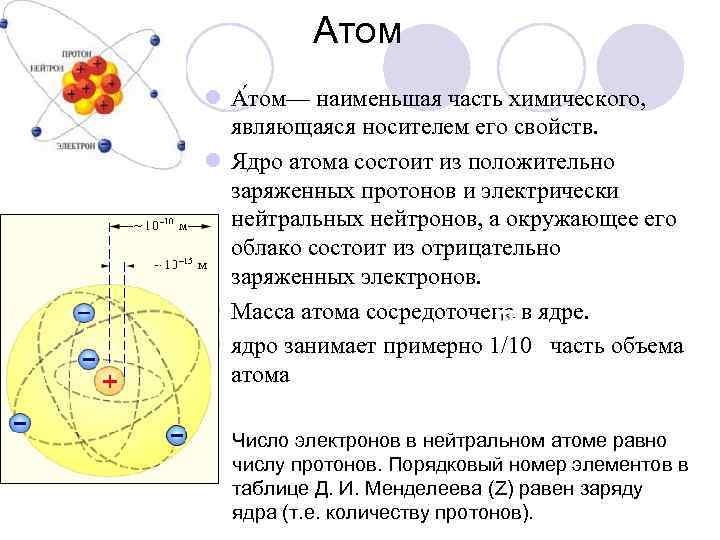 Атом l А том— наименьшая часть химического, являющаяся носителем его свойств. l Ядро атома состоит из положительно заряженных протонов и электрически нейтральных нейтронов, а окружающее его облако состоит из отрицательно заряженных электронов. l Масса атома сосредоточена в ядре. l ядро занимает примерно 1/10 часть объема атома Число электронов в нейтральном атоме равно числу протонов. Порядковый номер элементов в таблице Д. И. Менделеева (Z) равен заряду ядра (т. е. количеству протонов).
Атом l А том— наименьшая часть химического, являющаяся носителем его свойств. l Ядро атома состоит из положительно заряженных протонов и электрически нейтральных нейтронов, а окружающее его облако состоит из отрицательно заряженных электронов. l Масса атома сосредоточена в ядре. l ядро занимает примерно 1/10 часть объема атома Число электронов в нейтральном атоме равно числу протонов. Порядковый номер элементов в таблице Д. И. Менделеева (Z) равен заряду ядра (т. е. количеству протонов).
 Двойственный характер электрона Распределение по энергетическим уровням и количество электронов влияет на свойства атома. При этом положение электронов в атоме нельзя однозначно определить из-за двойственной природы электрона. Как было предложено в 1924 г. Луи де Бролем, что электрон характеризуется корпускулярно – волновым дуализмом, иными словами - одновременно проявляет свойства малой частицы и электромагнитной волны. Поэтому движение электрона в атоме может быть представлено в форме 3 -х мерного облака вокруг ядра. Электронное облако характеризуется вероятностью нахождения электрона в каждый момент времени в данном микрообъёме атома.
Двойственный характер электрона Распределение по энергетическим уровням и количество электронов влияет на свойства атома. При этом положение электронов в атоме нельзя однозначно определить из-за двойственной природы электрона. Как было предложено в 1924 г. Луи де Бролем, что электрон характеризуется корпускулярно – волновым дуализмом, иными словами - одновременно проявляет свойства малой частицы и электромагнитной волны. Поэтому движение электрона в атоме может быть представлено в форме 3 -х мерного облака вокруг ядра. Электронное облако характеризуется вероятностью нахождения электрона в каждый момент времени в данном микрообъёме атома.
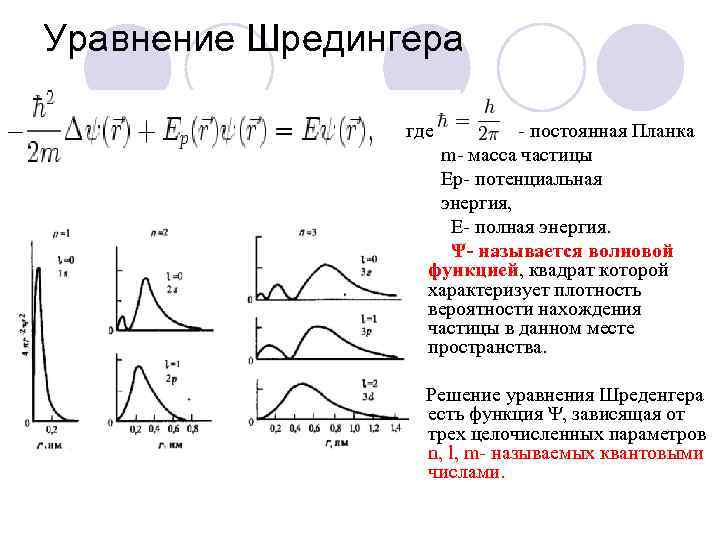 Уравнение Шредингера где - постоянная Планка m- масса частицы Ep- потенциальная энергия, Е- полная энергия. Ψ- называется волновой функцией, квадрат которой характеризует плотность вероятности нахождения частицы в данном месте пространства. Решение уравнения Шреденгера есть функция Ψ, зависящая от трех целочисленных параметров n, l, m- называемых квантовыми числами.
Уравнение Шредингера где - постоянная Планка m- масса частицы Ep- потенциальная энергия, Е- полная энергия. Ψ- называется волновой функцией, квадрат которой характеризует плотность вероятности нахождения частицы в данном месте пространства. Решение уравнения Шреденгера есть функция Ψ, зависящая от трех целочисленных параметров n, l, m- называемых квантовыми числами.
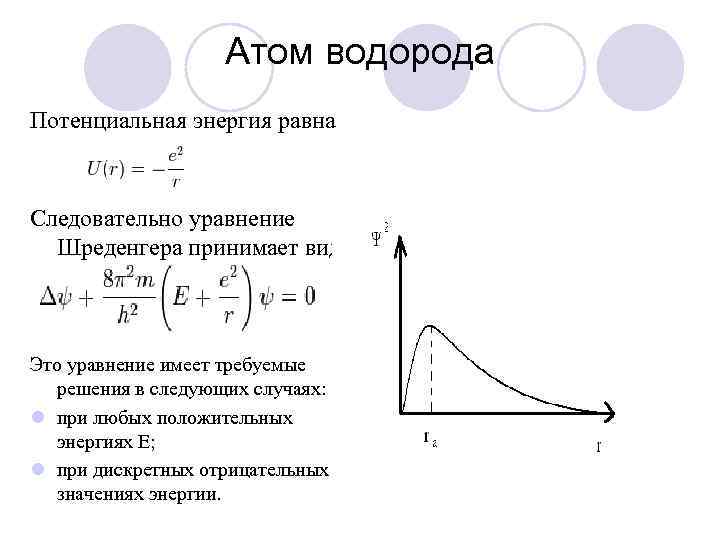 Атом водорода Потенциальная энергия равна Следовательно уравнение Шреденгера принимает вид: Это уравнение имеет требуемые решения в следующих случаях: l при любых положительных энергиях E; l при дискретных отрицательных значениях энергии.
Атом водорода Потенциальная энергия равна Следовательно уравнение Шреденгера принимает вид: Это уравнение имеет требуемые решения в следующих случаях: l при любых положительных энергиях E; l при дискретных отрицательных значениях энергии.
 Квантовые числа § Главное квантовое число n § Орбитальное квантовое число l § Магнитное квантовое число ml § Спиновое квантовое число s
Квантовые числа § Главное квантовое число n § Орбитальное квантовое число l § Магнитное квантовое число ml § Спиновое квантовое число s
 Главное квантовое число может принимать положительные целочисленные значения: n=1, 2, 3, . . 7. . , ∞ Главное квантовое число характеризует: * удаленность уровня от ядра *уровень энергии электрона в атоме *количество подуровней на данном уровне.
Главное квантовое число может принимать положительные целочисленные значения: n=1, 2, 3, . . 7. . , ∞ Главное квантовое число характеризует: * удаленность уровня от ядра *уровень энергии электрона в атоме *количество подуровней на данном уровне.
 Орбитальное квантовое число, принимает целочисленные значения l=0, 1…(n-1) Орбитальное квантовое число характеризует тип энергетического подуровня и форму атомной орбитали. l 0 1 2 3 Тип S подуровня p d f Форма атомной орбитали -
Орбитальное квантовое число, принимает целочисленные значения l=0, 1…(n-1) Орбитальное квантовое число характеризует тип энергетического подуровня и форму атомной орбитали. l 0 1 2 3 Тип S подуровня p d f Форма атомной орбитали -
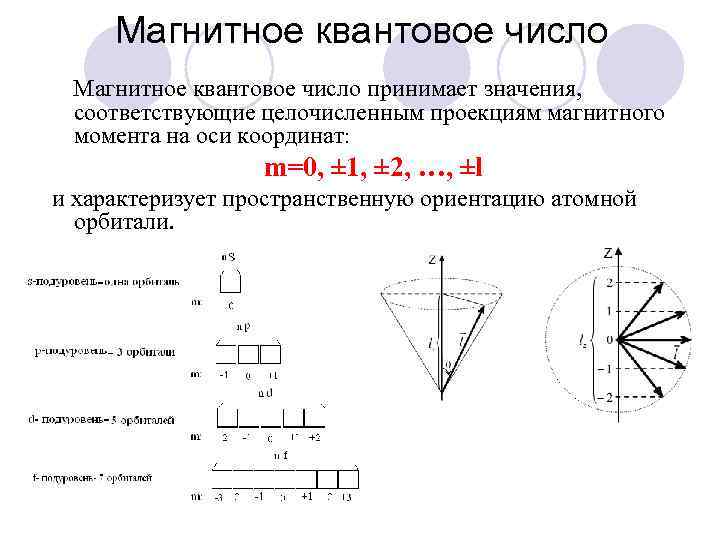 Магнитное квантовое число принимает значения, соответствующие целочисленным проекциям магнитного момента на оси координат: m=0, ± 1, ± 2, …, ±l и характеризует пространственную ориентацию атомной орбитали.
Магнитное квантовое число принимает значения, соответствующие целочисленным проекциям магнитного момента на оси координат: m=0, ± 1, ± 2, …, ±l и характеризует пространственную ориентацию атомной орбитали.
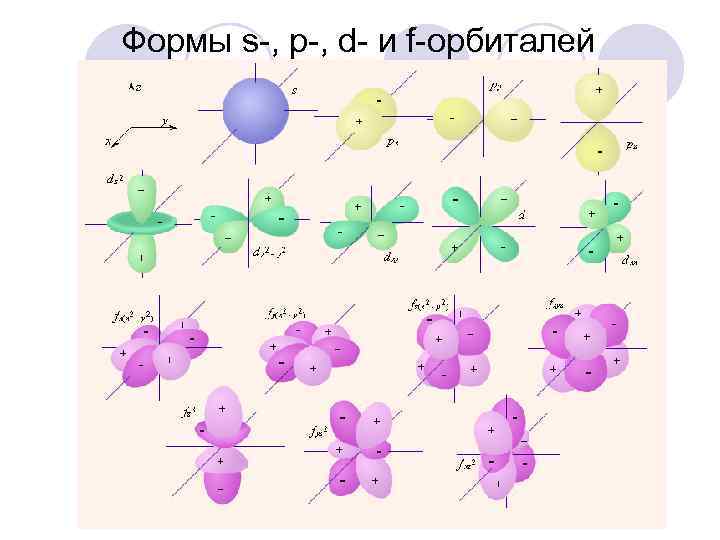 Формы s-, p-, d- и f-орбиталей
Формы s-, p-, d- и f-орбиталей
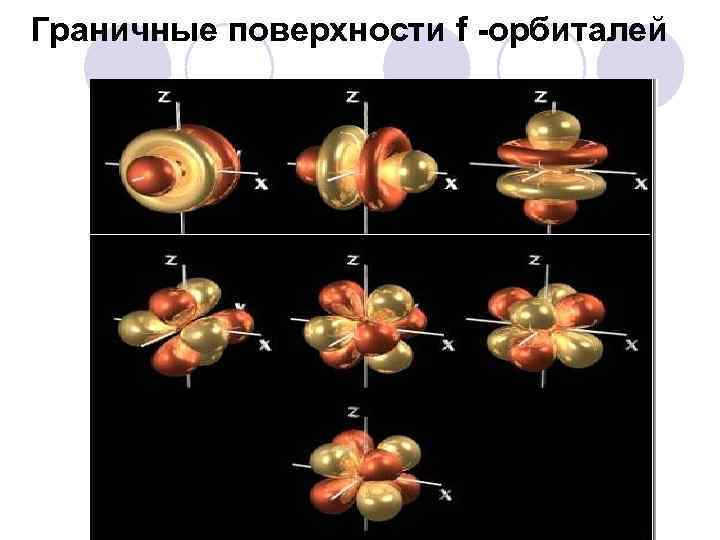 Граничные поверхности f -орбиталей
Граничные поверхности f -орбиталей
 Спиновое квантовое число определяется собственным моментом вращения электрона в двух противоположных направлениях. S= ± 1/2 обозначение Графическое обозначение Направление вращения +1/2 ↑ по часовой стрелке -1/2 ↓ против часовой стрелки
Спиновое квантовое число определяется собственным моментом вращения электрона в двух противоположных направлениях. S= ± 1/2 обозначение Графическое обозначение Направление вращения +1/2 ↑ по часовой стрелке -1/2 ↓ против часовой стрелки
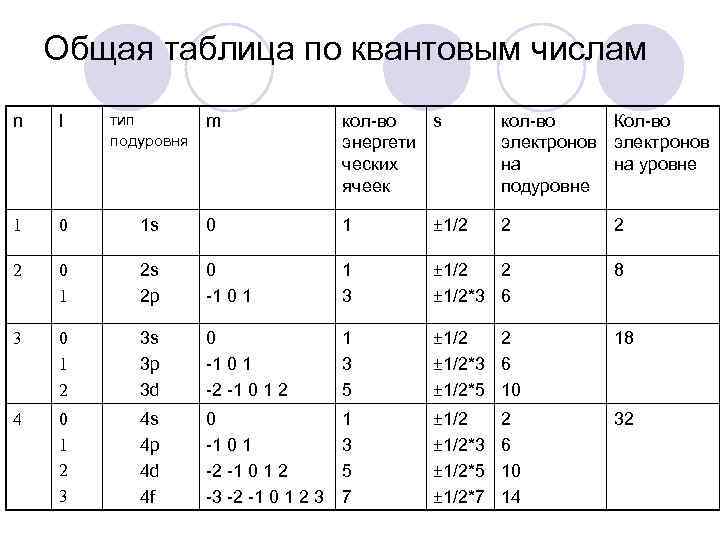 Общая таблица по квантовым числам n l тип m подуровня кол-во s энергети ческих ячеек кол-во Кол-во электронов на на уровне подуровне 1 0 1 s 0 1 ± 1/2 2 0 1 2 s 2 p 0 -1 0 1 1 3 ± 1/2 2 ± 1/2*3 6 8 3 0 1 2 3 s 3 p 3 d 0 -1 0 1 -2 -1 0 1 2 1 3 5 ± 1/2 2 ± 1/2*3 6 ± 1/2*5 10 18 4 0 1 2 3 4 s 4 p 4 d 4 f 0 -1 0 1 -2 -1 0 1 2 -3 -2 -1 0 1 2 3 1 3 5 7 ± 1/2*3 ± 1/2*5 ± 1/2*7 32 2 6 10 14
Общая таблица по квантовым числам n l тип m подуровня кол-во s энергети ческих ячеек кол-во Кол-во электронов на на уровне подуровне 1 0 1 s 0 1 ± 1/2 2 0 1 2 s 2 p 0 -1 0 1 1 3 ± 1/2 2 ± 1/2*3 6 8 3 0 1 2 3 s 3 p 3 d 0 -1 0 1 -2 -1 0 1 2 1 3 5 ± 1/2 2 ± 1/2*3 6 ± 1/2*5 10 18 4 0 1 2 3 4 s 4 p 4 d 4 f 0 -1 0 1 -2 -1 0 1 2 -3 -2 -1 0 1 2 3 1 3 5 7 ± 1/2*3 ± 1/2*5 ± 1/2*7 32 2 6 10 14
 Энергетический уровень Совокупность всех орбиталей с одинаковым значением главного квантового числа, т. е. орбиталей с близкими значениями энергий.
Энергетический уровень Совокупность всех орбиталей с одинаковым значением главного квантового числа, т. е. орбиталей с близкими значениями энергий.
 Последовательность заполнения электронных подуровней l 1. Принцип минимума энергии l Наиболее устойчивое состояние электрона в атоме соответствует наименьшему возможному значению его энергии. l В результате возрастание энергии по энергетическим подуровням происходит примерно в следующем порядке: l n. S < (n-1)d ≤ (n-2)f ≤ (n-3)g < np l 2. Правило Клечковского l Заполнение электронных оболочек в атомах элемента происходит в порядке возрастания суммы (n+l). При равенстве этой суммы вначале заполняется подуровень с меньшим значением n.
Последовательность заполнения электронных подуровней l 1. Принцип минимума энергии l Наиболее устойчивое состояние электрона в атоме соответствует наименьшему возможному значению его энергии. l В результате возрастание энергии по энергетическим подуровням происходит примерно в следующем порядке: l n. S < (n-1)d ≤ (n-2)f ≤ (n-3)g < np l 2. Правило Клечковского l Заполнение электронных оболочек в атомах элемента происходит в порядке возрастания суммы (n+l). При равенстве этой суммы вначале заполняется подуровень с меньшим значением n.
 1 s < 2 p < 3 s < 3 p < 4 s ≈ 3 d < 4 p < 5 s ≈ 4 d < 5 p < 6 s ≈ 4 f ≈ 5 d < 6 p < 7 s ≈ 5 f ≈ 6 d < 7 p.
1 s < 2 p < 3 s < 3 p < 4 s ≈ 3 d < 4 p < 5 s ≈ 4 d < 5 p < 6 s ≈ 4 f ≈ 5 d < 6 p < 7 s ≈ 5 f ≈ 6 d < 7 p.
 l 3. Запрет Паули l В атоме не может быть двух электронов с одинаковым набором всех четырех квантовых чисел. Из принципа Паули вытекает следствие: максимально возможное число электронов на каждом энергетическом уровне равно удвоенному значению квадрата главного квантового числа: х=2 п 2 4. Правило Хунда l Минимальной энергией обладает конфигурация с максимальным суммарным спином.
l 3. Запрет Паули l В атоме не может быть двух электронов с одинаковым набором всех четырех квантовых чисел. Из принципа Паули вытекает следствие: максимально возможное число электронов на каждом энергетическом уровне равно удвоенному значению квадрата главного квантового числа: х=2 п 2 4. Правило Хунда l Минимальной энергией обладает конфигурация с максимальным суммарным спином.
 Составление электронных формул l 1. полная электронная формула показывает распределение электронов атома по его уровням и подуровням. l Независимо от последовательности формирования подуровня в электронной формуле он записывается на своем энергетическом уровне. l 2. сокращенная электронная формула показывает распределение валентных электронов на формирующихся атомных орбиталях.
Составление электронных формул l 1. полная электронная формула показывает распределение электронов атома по его уровням и подуровням. l Независимо от последовательности формирования подуровня в электронной формуле он записывается на своем энергетическом уровне. l 2. сокращенная электронная формула показывает распределение валентных электронов на формирующихся атомных орбиталях.
 3. электронная формула в виде энергетических ячеек. l Составляется только для сокращенной электронной формулы. l Показывает распределение валентных электронов и позволяет прогнозировать возможные валентности атома. Нормальным (невозбужденным) состоянием атома называется структура, соответствующая квантовохимическим законам формирования атомных орбиталей. l Возбужденным состоянием атома называется структура, в которой электроны переходят на энергетические подуровни с более высокой энергией в пределах внешнего уровня.
3. электронная формула в виде энергетических ячеек. l Составляется только для сокращенной электронной формулы. l Показывает распределение валентных электронов и позволяет прогнозировать возможные валентности атома. Нормальным (невозбужденным) состоянием атома называется структура, соответствующая квантовохимическим законам формирования атомных орбиталей. l Возбужденным состоянием атома называется структура, в которой электроны переходят на энергетические подуровни с более высокой энергией в пределах внешнего уровня.
 Периодический закон l Свойства элементов и их соединений находятся в периодической зависимости от заряда ядра (порядковый номер). l Периодический закон был открыт Д. И. Менделеевым в марте 1869 года при сопоставлении свойств всех известных в то время элементов и величин их атомных масс (весов). l Периодические изменения свойств химических элементов обусловлены повторением электронной конфигурации внешнего энергетического уровня (валентных электронов) их атомов с увеличением заряда ядра. l Графическим изображением периодического закона является периодическая таблица. Она содержит 7 периодов и 8 групп.
Периодический закон l Свойства элементов и их соединений находятся в периодической зависимости от заряда ядра (порядковый номер). l Периодический закон был открыт Д. И. Менделеевым в марте 1869 года при сопоставлении свойств всех известных в то время элементов и величин их атомных масс (весов). l Периодические изменения свойств химических элементов обусловлены повторением электронной конфигурации внешнего энергетического уровня (валентных электронов) их атомов с увеличением заряда ядра. l Графическим изображением периодического закона является периодическая таблица. Она содержит 7 периодов и 8 групп.
 Атомный радиус l Орбитальный атомный радиус- это условная величина, которая равна расстоянию между ядром и самой дальней из стабильных орбиталей в в электронной оболочке этого атома. l В периоде с увеличением порядкового номера атомный радиус уменьшается за счёт более сильного взаимодействия между ядром и внешними электронами. l В группе с увеличением порядкового номера атомный радиус растет, так как увеличивается число уровней.
Атомный радиус l Орбитальный атомный радиус- это условная величина, которая равна расстоянию между ядром и самой дальней из стабильных орбиталей в в электронной оболочке этого атома. l В периоде с увеличением порядкового номера атомный радиус уменьшается за счёт более сильного взаимодействия между ядром и внешними электронами. l В группе с увеличением порядкового номера атомный радиус растет, так как увеличивается число уровней.
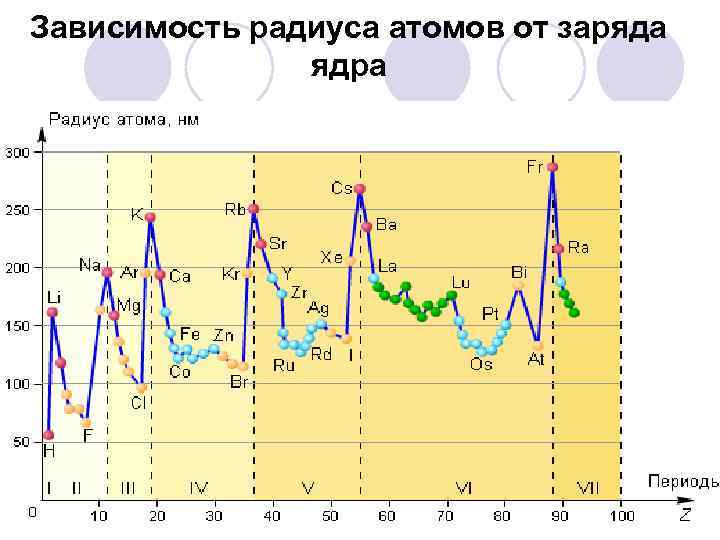 Зависимость радиуса атомов от заряда ядра
Зависимость радиуса атомов от заряда ядра
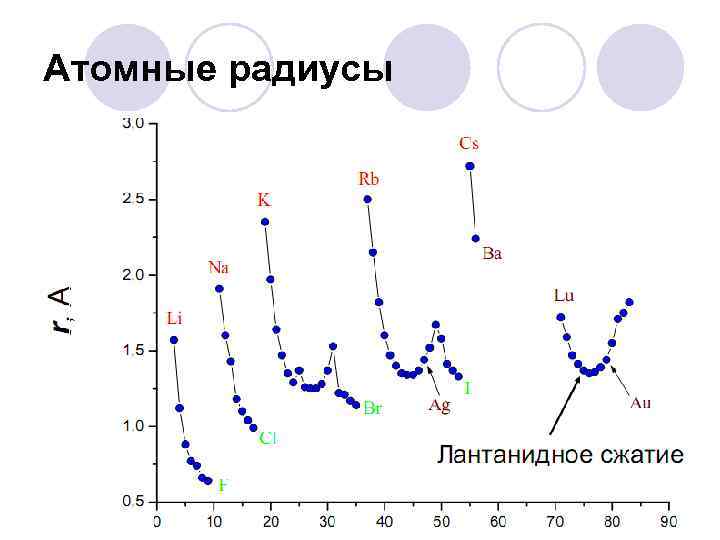 Атомные радиусы
Атомные радиусы
 Энергия ионизации l Энергия ионизации — это энергия, необходимая для отрыва наиболее слабо связанного электрона от атома. При отрыве электрона от атома образуется соответствующий катион. l Энергия, которая выделяется присоединении к атому одного электрона, называется энергией сродства к электрону Энергия ионизации для элементов одного периода возрастает слева направо с возрастанием заряда ядра. l В подгруппе она уменьшается сверху вниз вследствие увеличения расстояния электрона от ядра.
Энергия ионизации l Энергия ионизации — это энергия, необходимая для отрыва наиболее слабо связанного электрона от атома. При отрыве электрона от атома образуется соответствующий катион. l Энергия, которая выделяется присоединении к атому одного электрона, называется энергией сродства к электрону Энергия ионизации для элементов одного периода возрастает слева направо с возрастанием заряда ядра. l В подгруппе она уменьшается сверху вниз вследствие увеличения расстояния электрона от ядра.
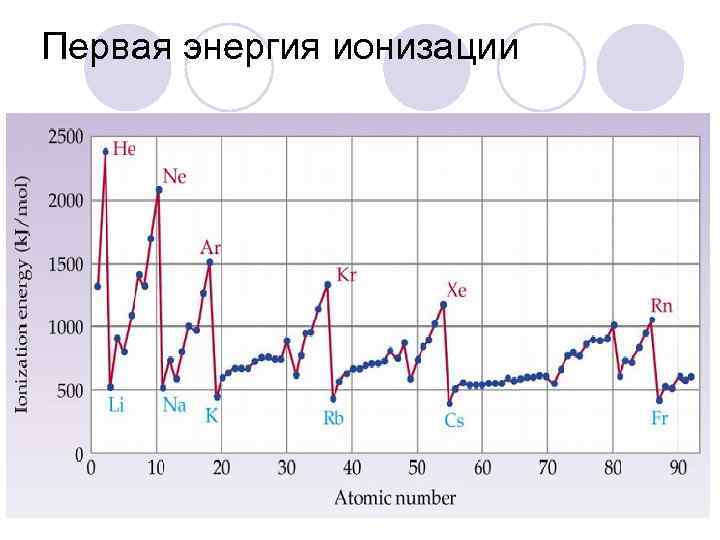 Первая энергия ионизации
Первая энергия ионизации
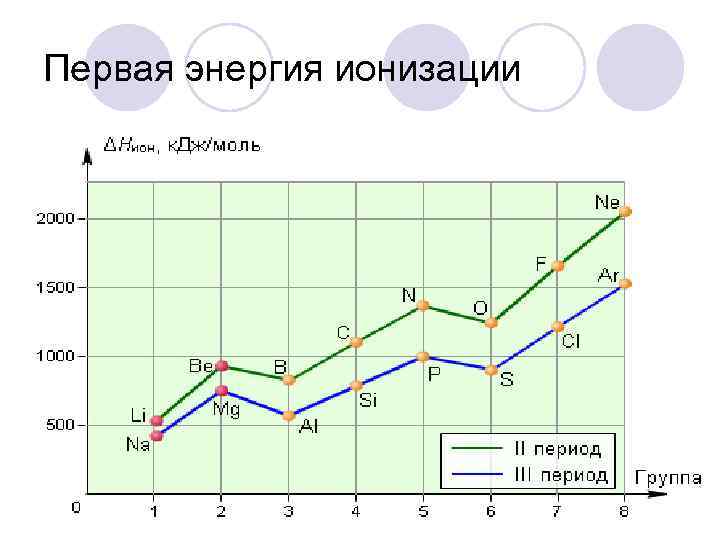 Первая энергия ионизации
Первая энергия ионизации
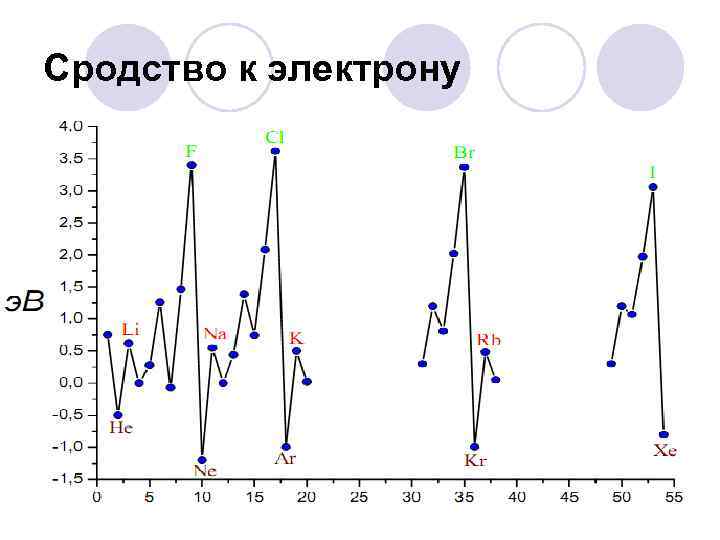 Сродство к электрону
Сродство к электрону
 Электроотрицательность l Электроотрицательность - способность атома в соединении притягивать к себе электроные пары. Может быть определена формуле: ЭО=1/2(ЭИ+СЭ), где ЭИ и СЭ –энергия ионизации и сродства. l На практике пользуются относительной электроотрицательностью. l с увеличением номера элемента электроотрицательность в периоде растет, а в группе — уменьшается. ЭО<2 Металлические свойства ЭО≈2 Переходные свойства ЭО>2 Неметаллические свойства
Электроотрицательность l Электроотрицательность - способность атома в соединении притягивать к себе электроные пары. Может быть определена формуле: ЭО=1/2(ЭИ+СЭ), где ЭИ и СЭ –энергия ионизации и сродства. l На практике пользуются относительной электроотрицательностью. l с увеличением номера элемента электроотрицательность в периоде растет, а в группе — уменьшается. ЭО<2 Металлические свойства ЭО≈2 Переходные свойства ЭО>2 Неметаллические свойства
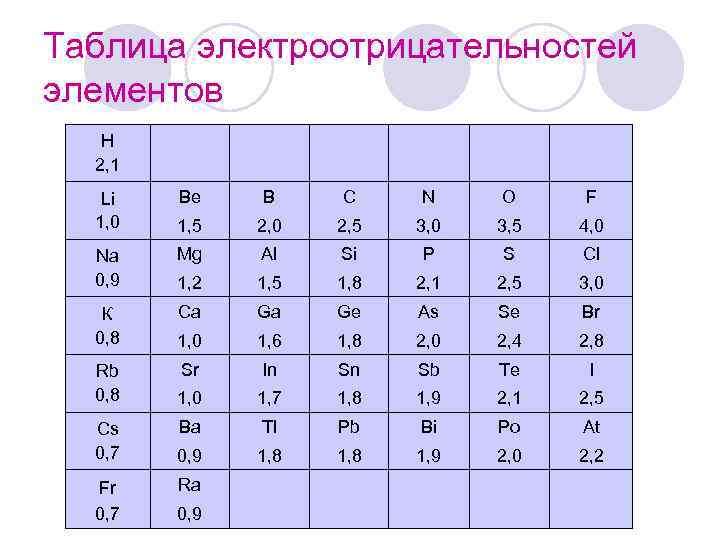 Таблица электроотрицательностей элементов H 2, 1 Li 1, 0 Na 0, 9 К 0, 8 Rb 0, 8 Cs 0, 7 Fr 0, 7 Be В С N О F 1, 5 2, 0 2, 5 3, 0 3, 5 4, 0 Mg Al Si P S Cl 1, 2 1, 5 1, 8 2, 1 2, 5 3, 0 Ca Ga Ge As Se Br 1, 0 1, 6 1, 8 2, 0 2, 4 2, 8 Sr In Sn Sb Те I 1, 0 1, 7 1, 8 1, 9 2, 1 2, 5 Ba Tl Pb Bi Po At 0, 9 1, 8 1, 9 2, 0 2, 2 Ra 0, 9
Таблица электроотрицательностей элементов H 2, 1 Li 1, 0 Na 0, 9 К 0, 8 Rb 0, 8 Cs 0, 7 Fr 0, 7 Be В С N О F 1, 5 2, 0 2, 5 3, 0 3, 5 4, 0 Mg Al Si P S Cl 1, 2 1, 5 1, 8 2, 1 2, 5 3, 0 Ca Ga Ge As Se Br 1, 0 1, 6 1, 8 2, 0 2, 4 2, 8 Sr In Sn Sb Те I 1, 0 1, 7 1, 8 1, 9 2, 1 2, 5 Ba Tl Pb Bi Po At 0, 9 1, 8 1, 9 2, 0 2, 2 Ra 0, 9
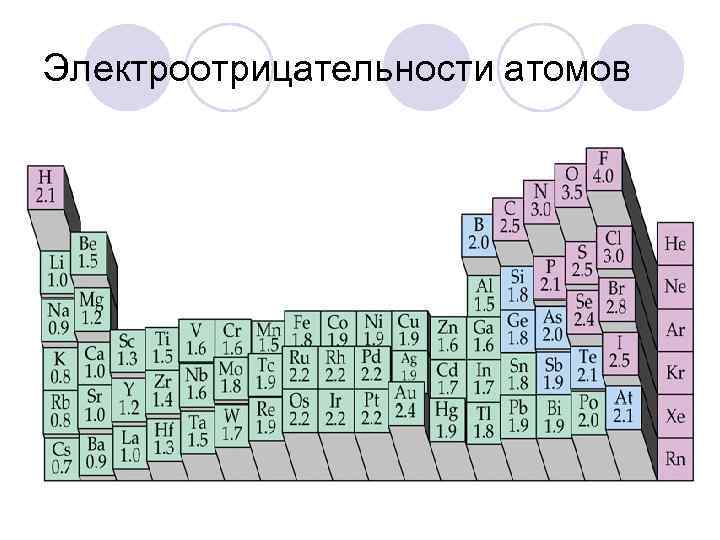 Электроотрицательности атомов
Электроотрицательности атомов

